宁亚维1,刘 茁1,范素芳2,马俊美2,李 强2,*,张 岩2,*
(1.河北科技大学生物科学与工程学院,河北 石家庄 050018;2.河北省食品检验研究院,河北 石家庄 050000)
摘 要:建立超高效液相色谱-串联质谱(ultra-high performance liquid chromatography-tandem mass spectrometry,UPLC-MS/MS)检测食品中鸡蛋过敏原卵白蛋白的方法。蛋清经胰蛋白酶酶解、超滤净化,经Easy-nLC 1000纳升液相色谱-四极杆-静电场轨道阱高分辨质谱以乙腈-0.1%甲酸溶液作为流动相进行分离,结合Uniprot数据库筛选出特异性好且灵敏度高的特征肽段GGLEPINFQTAADQAR(GR-16)作为外标,采用UPLC-MS/MS正离子源多反应监测模式对实际样品进行检测。结果表明,该方法在5~5 000 ng/mL范围内线性良好,定量限为0.1 μg/g,平均回收率在77.22%~98.55%之间,相对标准偏差不大于9.97%。此方法特异性高、灵敏度好、分析速度快,可为食品中鸡蛋过敏原的检测提供技术支持。
关键词:超高效液相色谱-串联质谱;过敏原;卵白蛋白;胰蛋白酶;特征肽段
食物过敏大多是食物中过敏原蛋白对机体细胞的选择性刺激,从而引起机体免疫系统异常和生理机能障碍[1-2],近年来已经成为国际关注的重大食品安全问题,其危害仅次于食源性微生物污染[3],被世界卫生组织认为是21世纪的流行病[4]。
在食物过敏中,90%以上是由含麸质的谷物、甲壳类、鱼类、蛋类、花生、大豆、乳和坚果及其制品8 种食物引起的[1],其中鸡蛋过敏的人群最为广泛,特别是3岁以下的儿童为鸡蛋过敏的易发人群[5]。目前,对于鸡蛋过敏尚无有效的治疗手段,过敏人群只能严格控制日常饮食不得含有过敏原,然而鸡蛋营养丰富,在众多食品中均有添加,过敏人群难免会受到伤害[2]。对此,国外已经出台了强制性标识食品过敏原的法规[6],而国内只有针对出口食品过敏源成分的标准,以实时荧光定量聚合酶链式反应(polymerase chain reaction,PCR)法和环介导等温扩增检测方法为主,需要开发制定高灵敏度的直接对常见致敏蛋白的定性定量方法,并制定相应的标识法规。
目前用于过敏原检测的手段主要有酶联免疫(enzyme-linked immuno sorbent assay,ELISA)法[7-11]、PCR法[12-15]和液相色谱-质谱联用技术[16-17]。ELISA法是基于蛋白质的检测技术,是现在最为成熟的方法,但是由于各种加工手段使蛋白质存在不同程度的变性,导致无法与抗体准确结合,而且ELISA法不可避免存在交叉反应且通量低,因此不适于对鸡蛋过敏原的准确定量[1,3]。PCR法是基于DNA水平的检测手段,而非直接对致敏蛋白进行定量,但鸡蛋含有极少量的DNA,并且鸡蛋和鸡肉中的DNA没有差异性[3,12]。近年来,液相色谱-串联质谱法广受关注,其基于特征肽段有效地解决了变性蛋白的定量检测问题,而且可以直接对蛋清致敏蛋白进行高灵敏度、特异性和准确度的检测。此方面,Tolin等[18-19]通过液相色谱-串联质谱法以卵白蛋白和溶菌酶作为主要致敏蛋白来表征葡萄酒中鸡蛋源澄清剂的存在,同时与酶联免疫点印迹化学发光法进行比较,检出限降低了10 倍,可以实际应用于商业葡萄酒中微量动物源澄清剂的残留检测;Heick等[20]采用液相色谱-串联三重四极杆质谱技术测定面包基质中的卵白蛋白,检出限为42 μg/g,且线性范围广;Planque等[21-22]建立了超高效液相色谱-串联质谱(ultra-high performance liquid chromatographytandem mass spectrometry,UPLC-MS/MS)法测定巧克力、冰淇淋、番茄酱和饼干中的卵白蛋白,检出限达到3.4 μg/g。
鉴于质谱检测方法具有高灵敏度与特异性的优势,本实验拟通过UPLC-MS/MS技术建立鸡蛋过敏原卵白蛋白的定量检测方法,并进行线性关系、检出限、加标回收等方法学验证,将所建方法应用于实际商品中卵白蛋白的定量检测,以期对食品中鸡蛋过敏原的准确定量提供技术支持。
鸡蛋,配料中分别含有鸡蛋和不含鸡蛋的饼干、挂面、蛋糕、面包 市售。
碳酸氢铵、二硫苏糖醇(dithiothreitol,DTT)、碘乙酰胺(iodoacetamide,IAA)、卵白蛋白标准品(纯度≥98%,来源于鸡蛋清)、甲酸(色谱纯)美国Sigma公司;乙腈、正己烷(均为色谱纯)美国Fisher Scientific公司;胰蛋白酶 美国AB SCIEX公司;Watsons蒸馏水(实验用水) 广州屈臣氏食品饮料有限公司;蛋清过敏源卵白蛋白3 条特征肽段LTEWTSSNVMEER(LR-13)、GGLEPINFQTAADQAR(GR-16)、ELINSWVESQTNGIIR(ER-16)(纯度均不小于95%)由上海强耀生物科技有限公司合成。
超滤离心管(0.5 mL,10 kDa)、Easy-nLC 1000纳升液相色谱-四极杆-静电场轨道阱高分辨质谱(配Nanospray Flex离子源) 美国Thermo Scientific公司;低蛋白吸附样品瓶 美国Waters公司;Triple Quad 6500+液相色谱-质谱联用仪(配电喷雾离子源及MultiQuant 3.0.1数据处理系统) 美国AB SCIEX公司;N-EVAPTM111氮吹仪 美国Organomation Associates公司;C18色谱柱(100 μm×4 cm,120 Å,5 μm)、C18毛细色谱柱(75 μm×15 cm,120 Å,5 μm) 北京乐润峰科技有限公司;Proteonavi色谱柱(2.0 mm×150 mm,5 μm) 日本Shiseido公司。
1.3.1 储备液的配制
分别精密称取LTEWTSSNVMEER(LR-13)、G G L E P I N F Q T A A D Q A R(G R-1 6)、ELINSWVESQTNGIIR(ER-16)各1 mg于10 mL容量瓶中,用水溶解并定容,配制成100 μg/mL的特征肽段混标储备液。精密称取20 mg卵白蛋白标准品(来源于鸡蛋清)于10 mL容量瓶中,用水溶解并定容,配制成2 mg/mL的卵白蛋白标准品储备液。
1.3.2 Easy-nLC 1000纳升液相色谱-四极杆-静电场轨道阱高分辨质谱测定条件
色谱条件:富集柱:C18色谱柱(100 μm×4 cm,1 2 0 Å,5 μ m);分析柱:C18毛细色谱柱(75 μm×15 cm,120 Å,5 μm);流速300 nL/min;进样体积2 μL;流动相A为0.1%甲酸溶液,流动相B为乙腈;洗脱程序:0~3 min,3%~7% B;3~38 min,7%~22% B;38~48 min, 22%~35% B;48~50 min,35%~90% B;50~60 min,90% B。
质谱条件:电喷雾离子源,正离子模式;扫描模式:Full MS/dd-MS2;Full MS分辨率70 000;AGC target为1×106;质量扫描范围m/z 350~1 800;dd-MS2分辨率17 500,AGC target为1×105;隔离窗口为m/z 2.0;Fixed fi rst mass为m/z 120.0;碰撞能为27 eV。
1.3.3 Triple Quad 6500+液相色谱-质谱联用仪测定条件
色谱条件:Proteonavi色谱柱(2.0 mm×150 mm,5 μm);柱温40 ℃;流速0.3 mL/min;进样体积1 μL;流动相A为0.1%甲酸溶液,流动相B为乙腈;洗脱程序:0~0.5 min,2% B;0.5~4.5 min,2%~50% B;4.5~7.5 min,50%~75% B;7.5~9 min,75% B;9~9.01 min;75%~2% B;9.01~11 min,2% B。
质谱条件:电喷雾离子源,正离子模式;扫描模式:多反应监测;离子化电压5 500 V;雾化器压力(GS1)50 psi;辅助气压力(GS2)55 psi;气帘气压力30 psi;离子源温度500 ℃。
1.3.4 样品预处理
食品基质分析前需要进行脱脂处理。称取1 g至15 mL离心管中,加入5 mL正己烷后振荡10 min后,9 500×g离心10 min弃去上清液;然后重复上述正己烷脱脂后,采用氮气吹干,以备后续处理。
1.3.5 蛋白酶水解
称取0.1 g脱脂样品,用超纯水稀释至10 mL,取50 μL样品稀释液加入690 μL水混匀,再向其中加入10 μL的DTT(100 mmol/L)于70 ℃水浴反应30 min,然后加入10 μL的IAA(300 mmol/L)于室温避光静置30 min。向上述混合液中加入200 μL NH4HCO3(500 mmol/L)和30 μL胰蛋白酶(1 mg/mL)混匀,于37 ℃水浴振荡酶解3 h,最后加入10 μL甲酸混匀以终止反应。酶解液13 000×g离心10 min,取500 μL上清液于10 kDa超滤离心管中,14 000×g离心20 min,去除杂蛋白,收集上清液待测。
1.3.6 基质效应
将配料不含鸡蛋的饼干、挂面、蛋糕、面包作为空白基质,精密移取一定量的特征肽段GGLEPINFQTAADQAR(GR-16)储备液,分别用水和空白基质提取液稀释配制成2、5、10、20、50、100、200、500、1 000、2 000、5 000 ng/mL标准曲线溶液。基质效应按下式计算:
式中:slopematrix为空白基质曲线的斜率;slopestandard为标准曲线的斜率。
1.3.7 加标回收率
向空白样品中添加卵白蛋白标准品储备液进行回收率测定,其中卵白蛋白的具体添加量按照特征肽段GGLEPINFQTAADQAR(GR-16)的2、10、20 倍定量限3 个水平计算得出(卵白蛋白与GGLEPINFQTAADQAR(GR-16)的物质的量比为1)。为排除基质对卵白蛋白定量产生的影响,所有标准曲线均采用每种样品对应的空白样品基质提取液进行配制。
鸡蛋中蛋白质丰富,蛋清中卵类黏蛋白、卵白蛋白、卵转铁蛋白和溶菌酶被公认为主要的致敏蛋白[23]。卵类黏蛋白热稳定性较高,对胰蛋白酶有抑制作用,不易达到肽段水平的分析检测;卵转铁蛋白和溶菌酶对热不稳定易变性,目前研究较少。而卵白蛋白在蛋清中含量最高,由386 个氨基酸组成,分子质量为44 287 Da,主要引起免疫球蛋白IgE介导型过敏反应,且不耐酶解,研究最为广泛[23-25]。因此,鸡蛋中卵白蛋白的定性定量分析成为鸡蛋过敏原检测的主要依据[18-22,26]。
特征肽段的筛选可为方法的建立提供定量依据,因此本研究首先筛选卵白蛋白中的特征肽段。将前处理后的样品直接注入Easy-nLC 1000纳升液相色谱-四极杆-静电场轨道阱高分辨质谱进行分离分析,将所得的肽段信息利用ProteinPilot软件和Uniprot数据库分析处理。与Uniprot数据库结果比对后,得到多条肽段。然后根据如下特征肽段的筛选原则进行特征肽段的筛选:以7~20 个氨基酸为宜;不含错切或漏切的酶切位点;最好不含甲硫氨酸;具有稳定的物理化学性质;进行定性定量分析时,具有较好的灵敏度和峰形[20,27-30]。最终筛选到3 段响应值较好、灵敏度较高的特征肽段,分别为LTEWTSSNVMEER(LR-13)、GGLEPINFQTAADQAR(GR-16)、ELINSWVESQTNGIIR(ER-16)。所选择的3 条肽段通过Uniprot数据库进行BLAST搜索,确定肽段的唯一性。参考Zhang Jingyun等[31]的方法,合成上述3条特征肽段的纯品作为标准样品,进行后续研究。
实验比较了乙腈-水,乙腈-0.1%甲酸溶液2 种流动相体系在相同的洗脱程序条件下特征肽段的响应和出峰情况。结果表明,使用乙腈-0.1%甲酸溶液作为流动相,特征肽段的响应和峰形都要优于前者,拖尾现象明显改善,稳定性也有所提高。在电喷雾离子源正离子模式下,加入甲酸有助于肽类物质离子化进而提高分离效率和质谱信号的强度,故选择乙腈-0.1%甲酸溶液作为流动相。
将3 段特征肽段标准品分别用水稀释至5 000 ng/mL,通过蠕动泵以5 μL/min的速率直接注入Triple Quad 6500+质谱仪中,以全扫描模式确定特征肽段的准确母离子质量数。3 条肽段均以[M+2H]2+作为母离子,分别再对3 个母离子进行二级扫描,确定各自的定性和定量离子。每个肽段选取3 个子离子,对子离子的破碎电压、碰撞能量等参数进行优化如表1、图1所示。
表1 过敏原卵白蛋白的合成特征肽段的多反应监测参数
Table 1 MRM parameters of synthetic characteristic peptides of allergen ovalbumin
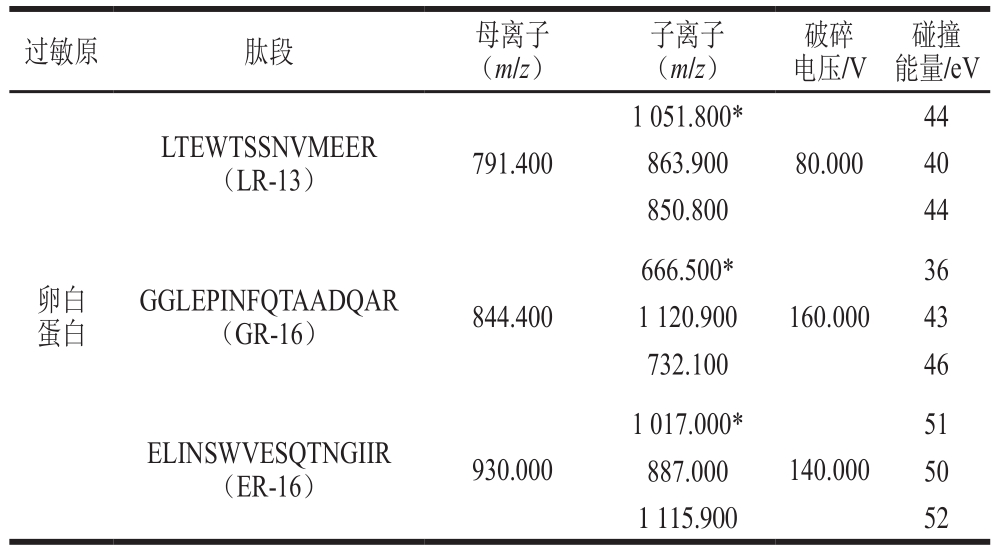
注:*.定量离子。
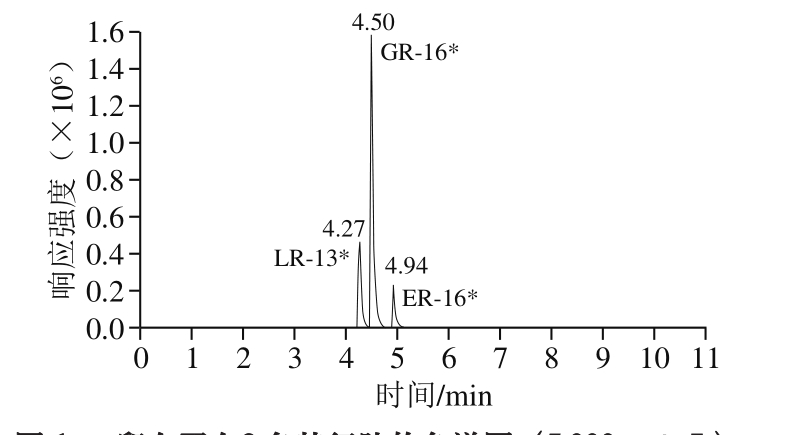
图1 卵白蛋白3 条特征肽的色谱图(5 000 ng/mL)
Fig. 1 Chromatogram of three characteristic peptides of ovalbumin (5 000 ng/mL)
分别精密移取混标储备液,用水稀释配制成1、2、5、10、20、50、100、200、500、1 000、2 000、5 000 ng/mL的标准溶液,分别以3 条特征肽段的色谱峰面积为纵坐标(Y),以各组分的质量浓度为横坐标(X)做线性回归方程,并计算该方法的线性范围。
在不含鸡蛋的空白基质中,添加混标储备液,获得每个肽段RSN为3时,作为该肽段的检出限(limit of detection,LOD);每个肽段RSN为10时,作为该肽段的定量限(limit of quantity,LOQ)。由表2可以看出,在所筛选的3 条特征肽段中GGLEPINFQTAADQAR(G R-1 6)的灵敏度最高且图1表明其响应值最好,故选取GGLEPINFQTAADQAR(GR-16)作为定量肽段,其余2 条肽段用以辅助定性分析。
表2 卵白蛋白中特征肽段的线性关系、LOD和LOQ(n=6)
Table 2 Linear relationships, LODs and LOQs of characteristic peptides of allergen ovalbumin (n= 6)

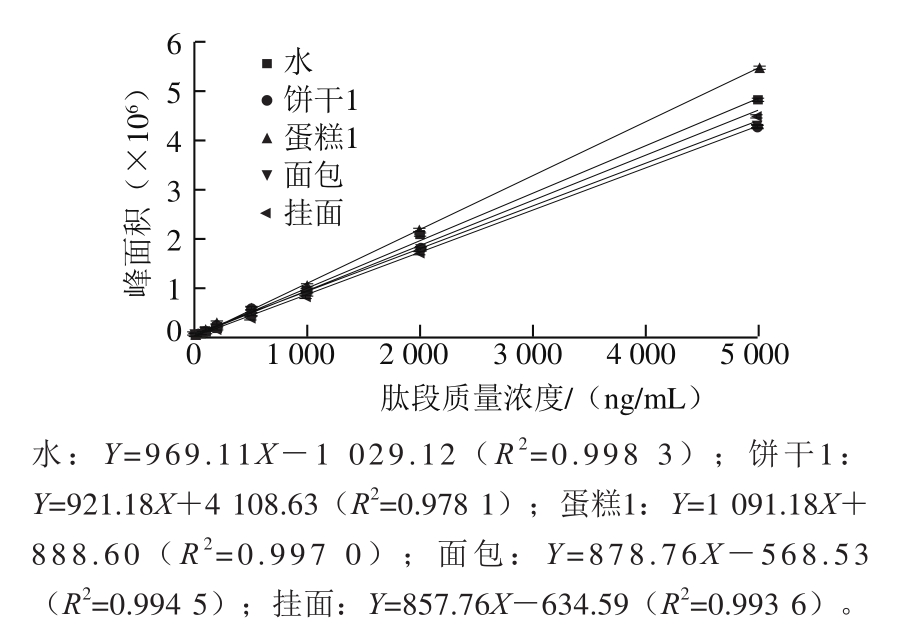
图2 溶剂与空白基质的标准曲线
Fig. 2 Standard curves with water and six blank solvents
检测6 种空白基质的基质效应,结果如图2所示。基质效应大于100%时,表明基质对目标物离子化有增益作用;基质效应小于100%时,表明基质对目标物离子化有抑制作用。结果表明,饼干(95.05%)、面包(90.68%)、挂面(88.53%)对特征肽段GGLEPINFQTAADQAR(GR-16)有不同程度的减弱作用,其中挂面的离子化抑制程度最大;而蛋糕基质(112.60%)对特征肽段GGLEPINFQTAADQAR(GR-16)有增益作用。因此,后续实验采用基质配标来定量以补偿基质效应。
表3 基质中卵白蛋白的加标回收率和RSD(n=6)
Table 3 Spiked recoveries and RSDs of ovalbumin in different matrices (n= 6)
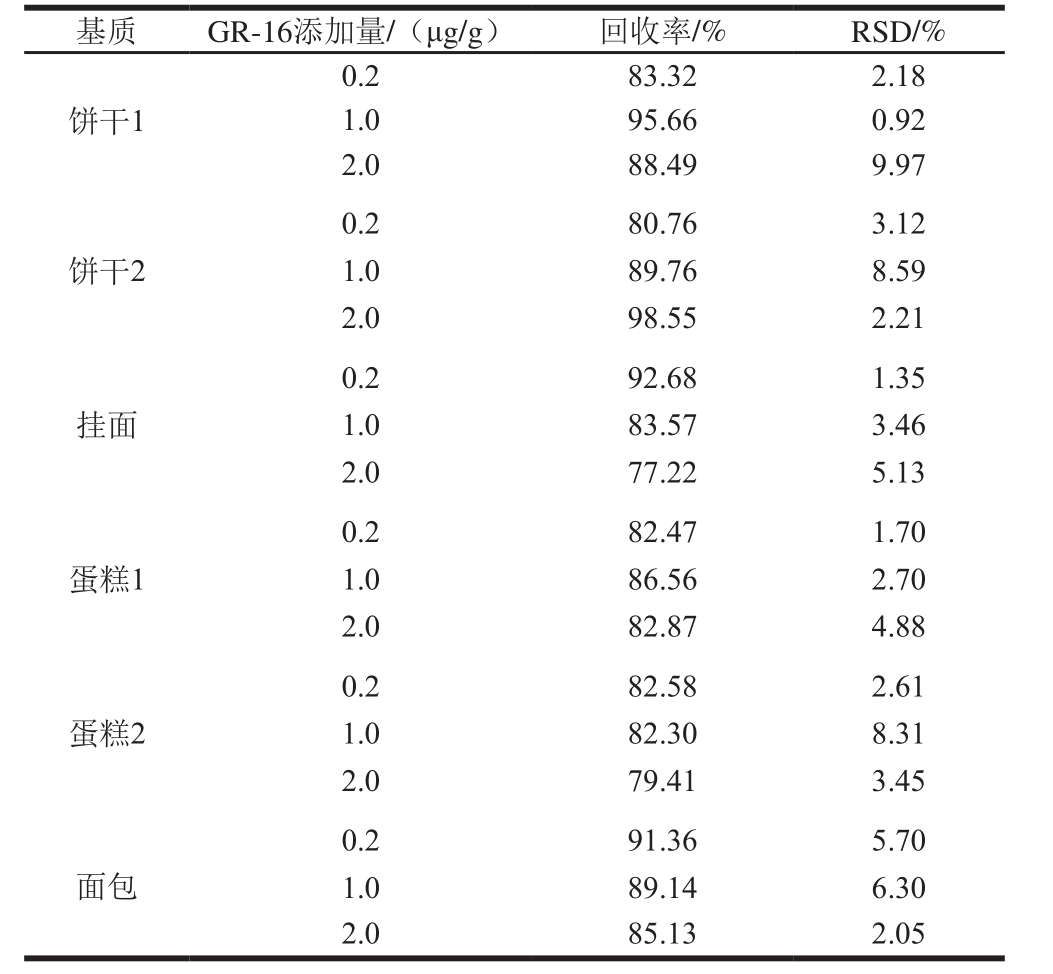
如表3所示,卵白蛋白中定量肽段GGLEPINFQTAADQAR(GR-16)在基质饼干1中回收率在83.32%~95.66%之间,相对标准偏差(relative standard deviation,RSD)不大于9.97%;在基质饼干2中回收率在80.76%~98.55%之间,RSD不大于8.59%;在基质挂面中回收率在77.22%~92.68%之间,RSD不大于5.13%;在基质蛋糕1中回收率在82.47%~86.56%之间,RSD不大于4.88%;在基质蛋糕2中回收率在79.41%~82.58%之间,RSD不大于8.31%;在基质面包中回收率在85.13%~91.36%之间,RSD不大于6.30%。
采用市售饼干、蛋糕、面包、挂面(配料表含鸡蛋)作为实际样品进行检测。分别采用4 种样品的空白基质配制标准曲线,结果见表4。
表4 UPLC-MS/MS检测市售食品中卵白蛋白含量(n=6)
Table 4 Determination of valbumin in commercial foods by UPLC-MS/MS (n= 6)

注:—.检测值低于定量限。
本实验建立UPLC-MS/MS法快速检测食品中鸡蛋过敏原卵白蛋白的方法。通过蛋白质组学方法成功筛选到高特异性卵白蛋白肽段,并采用电喷雾质谱多反应监测模式实现了高灵敏度、快速定量。该方法的建立为食品中鸡蛋过敏原的检测提供了技术支持,为推动我国食品过敏原标识的监督与立法提供理论支持。
参考文献:
[1] 吴慈, 陈溪, 刘健慧, 等. 基于高分辨质谱技术的婴幼儿食品中过敏原蛋白质的高灵敏检测[J]. 色谱, 2017, 35(10): 1037-1041.DOI:10.3724/SP.J.1123.2017.06013.
[2] TOSCA M A, SILVESTRI M, OLCESE R, et al. Allergen-specific Ig E to food molecular components and age: from early childhood to adulthood[J]. Allergol Immunopathol, 2017, 45(1): 87-92.DOI:10.1016/j.aller.2016.06.008.
[3] 古淑青, 赵超敏, 程甲, 等. 基于质谱技术的食品过敏原检测方法研究进展[J]. 色谱, 2016, 34(7): 639-646. DOI:10.3724/SP.J.1123.2016.03005.
[4] 李在玲. 儿童食物过敏[J]. 临床儿科杂志, 2014, 32(3): 299-300.DOI:10.3969/j.issn.1000-3606.2014.03.030.
[5] LIN Y T, WU C T, HUANG J L, et al. Correlation of ovalbumin of egg white components with allergic diseases in children[J]. Journal of Microbiology Immunology and Infection, 2016, 49(1): 112-118.DOI:10.1016/j.jmii.2014.01.002.
[6] 殷冉, 陈君义, 王毅谦. 食品过敏原标签要求及生产过程控制初探[J].食品安全质量检测学报, 2017, 8(4): 1127-1131.
[7] 邓小芳. 食品中四种重要过敏原酶联免疫检测方法的研究[D].无锡: 江南大学, 2012.
[8] 张世伟, 赖心田, 洪晓明, 等. 竞争酶联免疫法测定食品中鸡蛋过敏原[J]. 检验检疫学刊, 2012, 22(6): 41-43.
[9] 张世伟, 赖心田, 洪晓明, 等. 双抗夹心酶联免疫分析法检测食品中鸡蛋过敏原[J]. 安徽农业科学, 2012, 40(32): 15894-15895; 15897.DOI:10.13989/j.cnki.0517-6611.2012.32.026.
[10] GALAN-MALO P, LÓPEZ M, ORTIZ J C, et al. Detection of egg and milk residues on working surfaces by ELISA and lateral flow immunoassay tests[J]. Food Control, 2017, 74: 45-53. DOI:10.1016/j.foodcont.2016.11.027.
[11] AZARNIA S, BOYE J I, MONGEON V, et al. Detection of ovalbumin in egg white, whole egg and incurred pasta using LC-ESI-MS/MS and ELISA[J]. Food Research International, 2013, 52(2): 526-534.DOI:10.1016/j.foodres.2013.02.039.
[12] 丁亮, 付琳, 吴秀莲, 等. 基于蛋白质和DNA的食品过敏原检测技术的研究进展[J]. 中国酿造, 2017, 36(7): 157-160. DOI:10.11882/j.issn.0254-5071.2017.07.034.
[13] EISCHEIH A C, STADIG S R. A group-specific, quantitative realtime PCR assay for detection of crab, a crustacean shellfish allergen,in complex food matrices[J]. Food Chemistry, 2018, 244: 224-231.DOI:10.1016/j.foodchem.2017.10.045.
[14] ÁFRICA S, BALLESTEROS I, MARTIN A, et al. Detection of pistachio allergen coding sequences in food products: a comparison of two real time PCR approaches[J]. Food Control, 2017, 75: 262-270.DOI:10.1016/j.foodcont.2016.12.015.
[15] CASTA J, AMARAL J S, GRAZINA L, et al. Matrix-normalised realtime PCR approach to quantify soybean as a potential food allergen as affected by thermal processing[J]. Food Chemistry, 2017, 221: 1843-1850. DOI:10.1016/j.foodchem.2016.10.091.
[16] AHSAN N, RAO R S P, GRUPPUSO P A, et al. Targeted proteomics:current status and future perspectives for quantification of food allergens[J]. Journal of Proteomics, 2016, 143: 15-23. DOI:10.1016/j.jprot.2016.04.018.
[17] ANDJELKOVIC U, GAVROVIC-TANKULOVIC M, MARTINOVIC T,et al. Omics methods as a tool for investigation of food allergies[J].TrAC Trends in Analytical Chemistry, 2017, 96: 107-115.DOI:10.1016/j.trac.2017.07.011.
[18] TOLIN S, PASINI G, CURIONI A, et al. Mass spectrometry detection of egg proteins in red wines treated with egg white[J]. Food Control,2012, 23(1): 87-94. DOI:10.1016/j.foodcont.2011.06.016.
[19] TOLIN S, PASINI G, SIMONATO B, et al. Analysis of commercial wines by LC-MS/MS reveals the presence of residual milk and egg white allergens[J]. Food Control, 2012, 28(2): 321-326. DOI:10.1016/j.foodcont.2012.05.015.
[20] HEICK J, FISCHER M, POPPING B. First screening method for the simultaneous detection of seven allergens by liquid chromatography mass spectrometry[J]. Journal of Chromatography A, 2011, 1218: 938-943. DOI:10.1016/j.chroma.2010.12.067.
[21] PLANQUE M, AMOULD T, DIEU M, et al. Advances in ultrahigh performance liquid chromatography coupled to tandem mass spectrometry for sensitive detection of several food allergens in complex and processed foodstuffs[J]. Journal of Chromatography A,2016, 1464: 115-123. DOI:10.1016/j.chroma.2016.08.033.
[22] PLANQUE M, AMOULD T, DIEU M, et al. Liquid chromatography coupled to tandem mass spectrometry for detecting ten allergens in complex and incurred foodstuffs[J]. Journal of Chromatography A,2017, 1530: 138-151. DOI:10.1016/j.chroma.2017.11.039.
[23] 佟平, 高金燕, 陈红兵. 鸡蛋清中主要过敏原的研究进展[J]. 食品科学, 2007, 28(8): 565-568. DOI:10.3321/j.issn:1002-6630.2007.08.143.
[24] GOMAA A, BOYE J. Impact of irradiation and thermal processing on the immunochemical detection of milk and egg allergens in foods[J].Food Research International, 2015, 74: 275-283. DOI:10.1016/j.foodres.2015.05.023.
[25] 刘珂, 熊丽姬, 高金燕, 等. 加工对鸡蛋中四种主要过敏原结构的影响[J]. 食品科学, 2017, 38(23): 51-58. DOI:10.7506/spkx1002-6630-201723009.
[26] PILOLLI R, DE ANGELIE E, MONACI L. Streamlining the analytical workf l ow for multiplex MS/MS allergen detection in processed foods[J]. Food Chemistry, 2017, 221: 1747-1753. DOI:10.1016/j.foodchem.2016.10.110.
[27] MONACI L, LOSITO I, ANGELIS E D, et al. Multi-allergen quantification of fi ning-related egg and milk proteins in white wines by high-resolution mass spectrometry[J]. Rapid Commun Mass Spectrom,2013, 27: 2009-2018. DOI:10.1002/rcm.6662.
[28] 詹丽娜, 陈沁, 古淑青, 等. 超高效液相色谱-四极杆/静电场轨道阱高分辨质谱检测食品中的牛奶过敏原酪蛋白[J]. 色谱, 2017, 35(4):405-412. DOI:10.3724/SP.J.1123.2016.10034.
[29] 洪宇伟, 陈启, 张京顺, 等. 超高效液相色谱-电喷雾质谱法检测花生过敏原Arah2[J]. 食品安全质量检测学报, 2015, 6(5): 1895-1902.
[30] PILOLLI R, CHAUDHARI R, PALMISANO F, et al. Development of a mass spectrometry immunoassay for unambiguous detection of egg allergen traces in wines[J]. Analytical & Bioanalytical Chemistry,2017, 409: 1581-1589. DOI:10.1007/s00216-016-0099-3.
[31] ZHANG J Y, LAI S, CAI Z, et al. Determination of bovine lactoferrin in dairy products by ultra-high performance liquid chromatographytandem mass spectrometry based on tryptic signature peptides employing an isotope-labeled winged peptide as internal standard[J].Analytica Chimica Acta, 2014, 829: 33-39. DOI:10.1016/j.aca.2014.04.025.
Detection of Egg Allergen Ovalbumin in Food by Ultra-High Performance Liquid Chromatography-Tandem Mass Spectrometry
NING Yawei1, LIU Zhuo1, FAN Sufang2, MA Junmei2, LI Qiang2,*, ZHANG Yan2,*
(1. College of Bioscience and Bioengineering, Hebei University of Science and Technology, Shijiazhuang 050018, China;2. Hebei Food Inspection and Research Institute, Shijiazhuang 050000, China)
Abstract:An ultra-high performance liquid chromatography-tandem mass spectrometry (UPLC-MS/MS) method was developed for the detection of the egg allergen ovalbumin in food in this investigation. Egg white was trypsinized and the resulting hydrolysate was purified by ultrafiltration, and then separated by Easy-nLC 1000 nano liquid chromatographyquadrupole/orbitrap high resolution mass spectrometry with acetonitrile-0.1% (V/V) formic acid water as the mobile phase.By comparison with the Uniprot database, the characteristic peptide GGLEPINFQTAADQAR(GR-16) with good specificity and sensitivity was selected. Then, the UPLC-MS/MS analysis was performed using positive ion electrospray ionization (ESI+)in the multi-reaction monitoring (MRM) mode. The method showed a good linear relationship in the concentration range of 5–5 000 ng/mL with a limit of quantification (LOQ) of 0.1 μg/g. The average recoveries ranged from 77.22% to 98.55%with relative standard deviations (RSDs) lower than 9.97%. This method has high specificity and good sensitivity and is also time-saving, and thus it can provide technical support for the accurate determination of egg allergens in food product.
Keywords:ultra-high performance liquid chromatography-tandem mass spectrometry; allergen; ovalbumin; trypsin;characteristic peptides
NING Yawei, LIU Zhuo, FAN Sufang, et al. Detection of egg allergen ovalbumin in food by ultra-high performance liquid chromatography-tandem mass spectrometry[J]. Food Science, 2018, 39(20): 332-336. (in Chinese with English abstract)DOI:10.7506/spkx1002-6630-201820048. http://www.spkx.net.cn
引文格式:宁亚维, 刘茁, 范素芳, 等. 超高效液相色谱-串联质谱法检测食品中鸡蛋过敏原卵白蛋白[J]. 食品科学, 2018, 39(20):332-336. DOI:10.7506/spkx1002-6630-201820048. http://www.spkx.net.cn
文章编号:1002-6630(2018)20-0332-05
文献标志码:A
中图分类号:TS20
DOI:10.7506/spkx1002-6630-201820048
张岩(1979—),男,正高级工程师,博士,研究方向为食品安全。E-mail:snowwinglv@126.com
李强(1981—),男,正高级工程师,硕士,研究方向为食品安全。E-mail:sjzliq@163.com
*通信作者简介:
第一作者简介:宁亚维(1983—),女,副教授,博士,研究方向为食品生物技术与安全。E-mail:ningyawei@hebust.edu.cn
基金项目:国家重大科学仪器设备开发专项(2012YQ03011110);河北省自然科学基金资助项目 (C2015321005)
收稿日期:2018-03-01