膳食纤维具有降低餐后血糖、调节人体脂肪代谢、预防肥胖症等多种生理功能[1],同时膳食纤维良好的持油、持水等理化性质也可改善食品的风味及质构[2],在食品加工领域有着重要意义。膳食纤维根据溶解性分为可溶性膳食纤维和不溶性膳食纤维,可溶性膳食纤维中的亲水基团可吸附重金属离子或胆汁酸等小分子物质,并在水溶液中形成凝胶网络结构,使膳食纤维更好地在人体内发挥上述生理功能[3]。大豆膳食纤维作为一种常见的天然膳食纤维,来源广泛且价格低廉,但天然大豆膳食纤维多纯度较低、可溶性膳食纤维含量较少、口感粗糙、加工特性较差;因此通过改性(如物理法、化学法及酶法)提高膳食纤维品质成为膳食纤维生产过程中的重要环节。如Chen Ye等[4]发现挤压膨化可提高大豆膳食纤维中可溶性膳食纤维的含量,且膳食纤维的持水性、溶解性及膨胀性均有显著提高;李文佳等[5]通过对酸碱法提取的豆渣膳食纤维进行微晶化处理,所提取膳食纤维的纯度可达91.43%,且持油、持水性有所增强;单平阳等[6]发现发酵及挤压处理均可提高花生壳膳食纤维的重金属离子吸附能力;冯雁波等[7]采用超微粉碎制备改性松仁膳食纤维,经体外模拟实验证明较原纤维具有更好的降血脂功能。
生物解离(biological dissociation,BD)是一种新型的绿色提油工艺,在机械破碎的基础上,通过对植物油料进行酶解处理可实现油脂与蛋白的同步提取,具有十分广阔的应用前景[8]。生物解离残渣是生物解离工艺的主要副产物之一,据已有文献报道,每提取1 L大豆油将产生约4.4 kg残渣[9],对该组分的合理利用将关系到生物解离工艺的经济可行性。生物解离残渣中膳食纤维含量丰富,且由于在提取过程中对物料进行了挤压膨化及酸碱调节等改性处理,使其中膳食纤维的理化性质及功能特性得到一定改善。然而目前针对生物解离残渣的研究主要集中在固态发酵和营养成分的提取等方面[10-13],关于生物解离膳食纤维理化性质和功能特性的研究鲜有报道。因此,本实验通过对生物解离大豆膳食纤维的主要成分、持水性、持油性、膨胀性等理化性质,及重金属离子吸附能力、葡萄糖吸收能力、α-淀粉酶抑制能力、胆汁酸阻滞指数等功能特性进行测定,并与水提法提取的天然大豆膳食纤维,及化学法、发酵法、挤压膨化法提取的改性大豆膳食纤维进行比较,从而明晰生物解离对膳食纤维理化性质和功能特性的改性作用,为生物解离残渣中膳食纤维的增值利用提供新思路,并为开发新型大豆膳食纤维来源提供一定理论依据。
全脂大豆片 山东高唐蓝山集团;Alcalase 2.4 L碱性内切蛋白酶 杰能科(中国)生物工程有限公司;保加利亚乳杆菌、嗜热链球菌为实验室菌种库自备;α-淀粉酶(20 000 U/g) 北京索莱宝科技有限公司;牛磺胆酸钠 上海源叶生物科技有限公司;其他常用化学试剂均为分析纯。
TG16-WS台式高速离心机 湖南湘仪离心机仪器有限公司;FD5-3型冷冻干燥机 美国SIM公司;KC-701超微粉碎机 北京开创同和科技发展有限公司;KieltecAnalysister凯氏定氮仪 瑞典Foss公司;Lindberg/BlueM型马弗炉 美国AshevilleNC公司;SHA-B恒温水浴振荡器 常州国华电器有限公司;DHG-9146A型电热恒温鼓风干燥箱 上海精宏实验设备有限公司;高效液相色谱(high performance liquid chromatography,HPLC)仪 美国Agilent公司;UV1101紫外-可见分光光度计 上海天美科学仪器有限公司。
1.3.1 膳食纤维的制备
生物解离膳食纤维(BD-DF):参考李杨等[14]的方法,将大豆片粉碎后用挤压膨化机进行挤压膨化处理,所用大豆片水分质量分数12%,挤压膨化机套筒温度60 ℃,螺杆转速120 r/min,模孔孔径30 mm,挤压膨化后的大豆片以料液比1∶6(m/V)与水混合,调节pH值至9.0,加入质量分数为0.2%的Alcalase 2.4 L碱性内切蛋白酶,55 ℃酶解3 h,加热灭酶后反复离心至上层无游离油析出,收集下层残渣,调节水解液pH值至3.0,4 500 r/min离心分离,并对上层清液进行乙醇沉淀处理,再次离心后收集下层残渣,将两次收集的残渣混合后冻干,即获得生物解离膳食纤维。
水提法膳食纤维(W-DF):参考单平阳等[6]的方法,脱脂豆粉以料水比1∶6(m/V)与水混合,经耐高温α-淀粉酶处理3 h后4 500 r/min离心,下层物即为水提法膳食纤维。
化学法改性膳食纤维(C-DF):参考万婕等[15]的方法,脱脂豆粉水溶液pH值调节至10.0,50 ℃搅拌1 h后4 500 r/min离心,滤渣用清水洗涤3 次后烘干即获得化学法改性膳食纤维。
发酵法改性膳食纤维(F-DF):参考赵泰霞等[16]的方法,将脱脂豆粉水溶液灭菌后接种保加利亚乳杆菌和嗜热链球菌(1∶1,m/m)混合菌种,接种量5%,并加入3%脱脂奶粉及0.5%白砂糖,于41 ℃发酵30 h后获得发酵法改性膳食纤维。
挤压膨化法改性膳食纤维(E-DF):参考刘汉文等[17]的方法,对原料进行挤压膨化预处理后根据上述水提法提取膳食纤维。
不同方法提取得到的膳食纤维粉中水分、灰分、粗蛋白和粗脂肪质量分数的测定根据AOAC方法[18],可溶性膳食纤维及不溶性膳食纤维质量分数的测定根据AACC方法[19]。
1.3.2 膳食纤维理化性质的测定
膳食纤维理化性质的测定参照文献[20]。
持水性:准确称取1.0 g膳食纤维粉于100 mL烧杯中,加入70 mL蒸馏水,搅拌2 h后3 500 r/min离心30 min,去除上清液称质量,持水性按公式(1)计算。
持油性:准确称取1.0 g膳食纤维粉于100 mL烧杯中,加入70 mL植物油,搅拌2 h后3 500 r/min离心30 min,去除上清液称质量,持油性按公式(2)计算。
膨胀性:准确称取1.0 g膳食纤维粉于具塞试管中,读取干膳食纤维体积/mL,加入25 mL蒸馏水振荡摇匀后在室温静置24 h,读取膨胀后膳食纤维的体积,膨胀性按公式(3)计算。
溶解性:称取1.0 g膳食纤维粉于离心管中,料液比1∶10(m/V)加入蒸馏水,均匀混合后,室温下静置1 h,在3 000 r/min离心10 min,收集上清液和残渣,分别干燥称质量,溶解性按公式(4)计算。
1.3.3 膳食纤维重金属离子吸附能力的测定
参考单平阳等[6]的方法,测定了不同提取方法所得膳食纤维对Pb2+、As3+、Cu2+3 种重金属离子的吸附能力。分别向100 mL重金属溶液Pb(NO3)2、CuSO4、NaAsO2(10 μmol/mL)中加入1.0 g膳食纤维粉,为模拟胃及肠道环境,分别调整pH值至2.0和7.0,并于37 ℃条件下水浴振荡3 h(120 r/min),吸附反应结束后加入8 mL无水乙醇沉淀样品,于4 000 r/min离心10 min,采用原子吸收分光光度法[21]测定上清液中残留的重金属离子浓度,各膳食纤维对不同重金属离子吸附能力按公式(5)计算。
式中:c0为初始上清液中各重金属离子浓度/(μmol/mL);ct为吸附后上清液中各重金属离子浓度/(μmol/mL);V为溶液体积/mL;md为膳食纤维的质量/g。
1.3.4 膳食纤维葡萄糖吸收能力的测定
参照Chau等[22]的方法,分别向100 mL葡萄糖溶液(50、100、200 mmol/L)中加入1.0 g各膳食纤维样品,于37 ℃条件下水浴振荡6 h(120 r/min),4 500 r/min离心20 min后取上清液,根据还原糖法[2]测定上清液中剩余葡萄糖浓度,膳食纤维葡萄糖吸收能力按公式(6)计算。
式中:c0为初始溶液中的葡萄糖浓度/(mmol/L);cs为葡萄糖吸收达到饱和后上清液中的葡萄糖浓度/(mmol/L);V为离心后上清液的体积/mL;md为膳食纤维粉的质量/g。
1.3.5 膳食纤维α-淀粉酶活性抑制能力的测定
α-淀粉酶抑制能力的测定参照Ahmed等[23]的方法,40 g马铃薯淀粉溶于900 mL 0.05 mol/L磷酸盐缓冲液(pH 6.5)中,65 ℃条件下搅拌30 min后定容至1 000 mL,得到质量分数4%的马铃薯淀粉溶液。取1.0 g膳食纤维粉和4 mg α-淀粉酶加入到40 mL上述马铃薯淀粉溶液中,37 ℃水浴振荡1 h 120 r/min),4 500 r /min离心20 min,以不加膳食纤维粉为空白组,采用还原糖法[2]测定上清液中葡萄糖含量,膳食纤维对α-淀粉酶活性抑制能力按公式(7)计算。
式中:Ac为空白组的吸光度;As为实验组(添加膳食纤维粉)的吸光度。
1.3.6 胆汁酸阻滞指数的测定
胆汁酸阻滞指数的测定参照Adiotomre等[24]的方法,在截留分子质量为1.2~1.4 kDa的透析袋内加入25 mL 15 mmol/L牛磺胆酸钠溶液及0.2 g膳食纤维,将透析袋封口后放入100 mL 0.01mol/L的磷酸盐缓冲液(pH 7.0)中,37 ℃水浴振荡1 h和2 h(120 r/min),以不加膳食纤维粉为空白组;分别吸取2 mL透析袋内上清液,采用HPLC测定其中的胆汁酸浓度。测定条件如下:采用C18柱(250 mm×4.6 mm,5 μm),流动相为乙腈(流动相A)和pH 3.0的0.15%磷酸氢二钠溶液(流动相B)。流动相洗脱程序为:0~30min流动相A 22%~42%,30 min~35 min,流动相A 42%~35%,流动相流速为1.0 mL/min,采用紫外检测器测定203 nm波长处吸光度,胆汁酸阻滞指数按公式(8)计算。
式中:cd为样品上清液中的胆汁酸浓度/(mmol/L);cc为空白组上清液中的胆汁酸浓度/(mmol/L)
本实验数据均为3 个平行样的平均值±标准差,结果采用SPSS 22.0分析软件和Origin 8.0软件进行处理,采用ANOVA对数据进行差异显著性分析(P<0.05表示差异显著)。
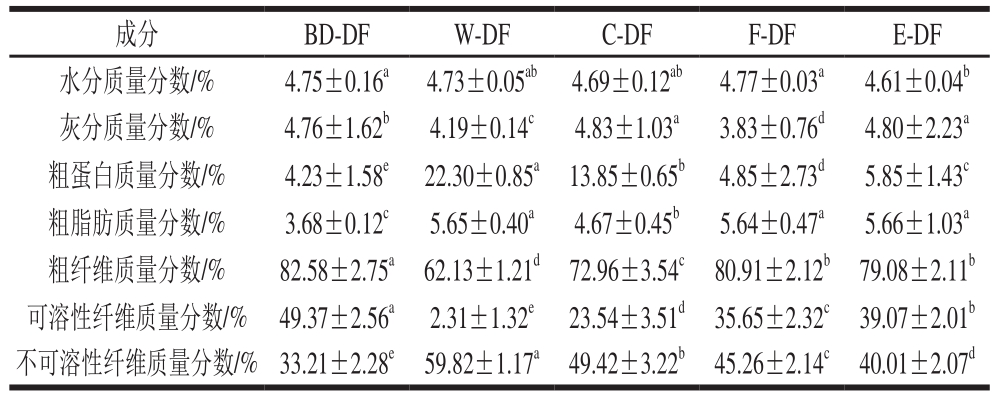
表1 不同提取方式膳食纤维的成分组成
Table1 Chemical compositions of dietary fibers from different extraction methods
注:同行肩标小写字母不同表示差异显著(P<0.05)。下同。
成分 BD-DF W-DF C-DF F-DF E-DF水分质量分数/% 4.75±0.16a4.73±0.05ab4.69±0.12ab4.77±0.03a4.61±0.04b灰分质量分数/% 4.76±1.62b4.19±0.14c4.83±1.03a3.83±0.76d4.80±2.23a粗蛋白质量分数/% 4.23±1.58e22.30±0.85a13.85±0.65b4.85±2.73d5.85±1.43c粗脂肪质量分数/% 3.68±0.12c5.65±0.40a4.67±0.45b5.64±0.47a5.66±1.03a粗纤维质量分数/% 82.58±2.75a62.13±1.21d72.96±3.54c80.91±2.12b79.08±2.11b可溶性纤维质量分数/% 49.37±2.56a2.31±1.32e23.54±3.51d35.65±2.32c39.07±2.01b不可溶性纤维质量分数/% 33.21±2.28e59.82±1.17a49.42±3.22b45.26±2.14c40.01±2.07d
表1为不同提取方式所得膳食纤维中水分、灰分、粗蛋白、粗脂肪、粗纤维、可溶纤维及不可溶性纤维的质量分数。由表1可知,生物解离膳食纤维的纯度最高,可达到82.52%,发酵法及挤压膨化法改性膳食纤维次之,分别为80.91%和79.08%,化学法改性膳食纤维纯度为72.96%,而水提法膳食纤维纯度最低,仅为62.13%。其中值得注意的是,生物解离膳食纤维中可溶性膳食纤维质量分数为49.37%,约达总膳食纤维质量分数的60%,而发酵法及挤压膨化法改性膳食纤维中,可溶性膳食纤维分别占总膳食纤维约44%和49%。Chen Ye等[4]测定天然大豆膳食纤维中可溶性膳食纤维含量仅为2.6%,通过爆破挤压技术改性处理使其可溶性膳食纤维含量提高至30.1 %。生物解离膳食纤维中可溶性膳食纤维含量的提高可能是由于提取过程中挤压膨化及酸碱处理的结合有效地破坏了物料组织,使其结构中的亲水活性位点暴露,可溶性膳食纤维含量增加[20],且在碱性条件下可溶性膳食纤维更易被提取。上述实验结果表明生物解离膳食纤维中可溶性膳食纤维含量明显高于其他改性方式提取的膳食纤维,属于优质膳食纤维,具有更好的营养价值。此外,通过对比不同提取方式膳食纤维中粗蛋白质量分数可知,生物解离膳食纤维中粗蛋白质量分数最低,仅为4.23%,而水提法膳食纤维蛋白含量为22.30%,明显高于其他膳食纤维,这是由于生物解离使用的蛋白酶能有效将大豆蛋白水解为小分子多肽,使其游离于水解液中[8]。酸碱调节、发酵及挤压膨化均对蛋白有一定破坏[25-26],而水提法并未对蛋白进行处理,因此水提法膳食纤维中蛋白残留率较高[27]。该结果表明生物解离能够更有效地水解大豆蛋白,从而得到纯度较高的膳食纤维。
通过对比不同提取方式膳食纤维中其余成分的质量分数发现,各膳食纤维中灰分及水分的质量分数相近(P>0.05),而生物解离膳食纤维中粗脂肪质量分数略低于其他方式提取的膳食纤维,约为3.68%。此外,生物解离提取过程中经过加热、酸度调节、反复离心等步骤,所得生物解离膳食纤维呈现乳白色,颗粒细腻,且无豆腥味,具有更好的感官品质。
表2 不同提取方式膳食纤维的理化性质
Table2 Physicochemical properties of dietary fibers from different extraction methods

指标 BD-DF W-DF C-DF F-DF E-DF持水性/(g/g) 6.87±0.34a3.63±0.14d4.84±0.74c5.28±0.41b5.98±0.56b持油性/(g/g) 5.48±0.45a2.32±0.43e3.07±0.21d4.17±0.47c5.04±0.21ab膨胀性/(mL/g) 8.22±0.76a4.73±0.37d5.85±0.47c6.23±0.56bc6.89±0.42b溶解性/% 5.07±0.51a2.07±0.02d3.74±0.09c4.72±0.07b4.91±0.12b
由表2可知,不同提取方式膳食纤维理化性质的优劣次序均为:生物解离膳食纤维>挤压膨化法改性膳食纤维>发酵法改性膳食纤维>化学法改性膳食纤维>水提法膳食纤维,其中生物解离膳食纤维的持水性、持油性、膨胀性和溶解性相比于挤压膨化法改性膳食纤维分别提高约15%、9%、19%及3%,相比于水提法膳食纤维分别提高约89%、136%、74%及145%。
膳食纤维的持水性可以调节食品体系中水分分布情况,对食品外观、风味及商品价值都有较大影响。通过对比不同提取方式膳食纤维的持水性可知,生物解离膳食纤维的持水性最为优越,为6.87 g/g,这可能与生物解离膳食纤维中可溶性膳食纤维质量分数较高有关。已有研究表明,膳食纤维的持水性与截留水的方式关系密切[28]。可溶性膳食纤维在水溶液中可形成凝胶,自身吸收水分的同时产生的胶状物也可防止水分流失[29],因此膳食纤维中可溶性膳食纤维含量越高,持水性越强。
膳食纤维持油性可有效改善食品的质构特性,赋予食品更好的感官品质。由表2可知,生物解离膳食纤维的持油性最高,为5.48 g/g,这可能与生物解离膳食纤维中的脂肪质量分数明显低于其余膳食纤维有关。Yalegama等[30]的研究发现,膳食纤维的持油性与其表面孔隙率及其对大分子物质的吸附能力有关,并与膳食纤维中的脂肪含量成反比。这是由于膳食纤维中脂肪含量越低,则说明油料细胞壁破坏越严重,膳食纤维孔隙率越大,对油脂的吸附能力就会越强。
通过对比不同方式提取的膳食纤维膨胀性及溶解性可以发现,生物解离膳食纤维的膨胀性较高,为8.22 mL/g,该数值与已有研究中的数据相接近,Goñi等[31]发现一些商业型膳食纤维的吸水膨胀性为6.2~9.9 mL/g。此外,生物解离膳食纤维溶解性也显著高于其他样品,为5.07%。生物解离膳食纤维膨胀性及溶解性增加的原因可能是由于在提取过程中膳食纤维中大分子组分的连接键在物理及化学共同作用下断裂转变为小分子组分,膳食纤维致密的网状结构转变得疏松,体积和比表面积有所增大,同时可溶物质含量增多[31],从而导致膳食纤维膨胀性及溶解性提高。以上结果表明,生物解离膳食纤维理化性质优于其他方式提取的膳食纤维,可在肉制品、烘焙食品、保健食品等多种食品中进行应用,提高食品的加工特性及品质。
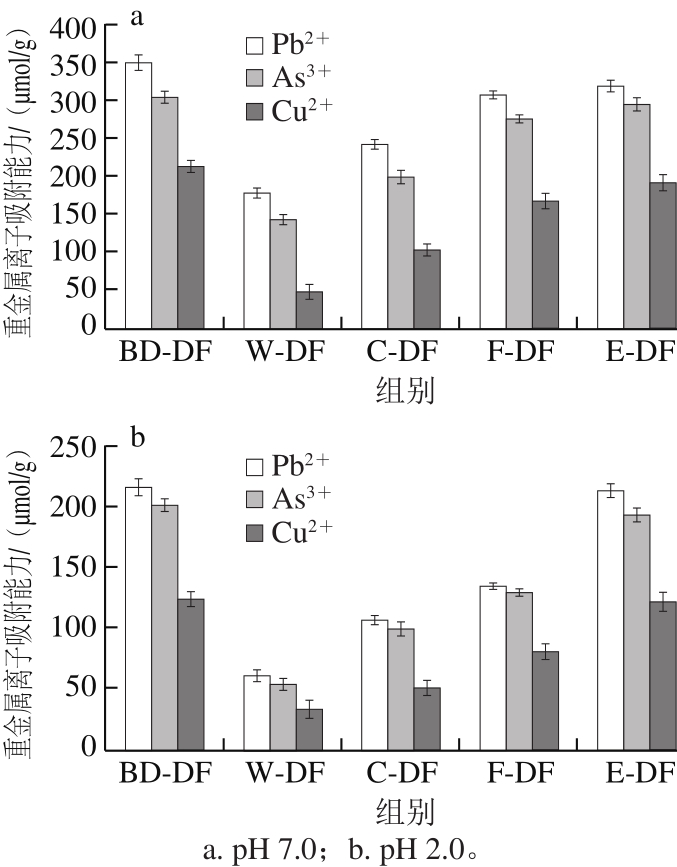
图1 不同提取方式膳食纤维重金属离子吸附能力
Fig.1 Adsorption capacity of dietary fibers from different extraction methods toward heavy metal ions
Pb、As和Cu等重金属元素易在生物体内富集,达到一定程度可导致中毒甚至癌症[32],膳食纤维侧链中的亲水性基团具有很强的离子交换能力,对重金属离子可产生一定吸附作用,然而这种离子交换能力易受pH值影响,故本实验选择pH 2.0及pH 7.0两个条件,模拟体外肠道和胃环境下不同提取方式的膳食纤维对上述3 种重金属离子的吸附能力。由图1a可知,在pH 7.0条件下,不同提取方式膳食纤维重金属吸附能力的强弱次序为:生物解离膳食纤维>挤压膨化法改性膳食纤维>发酵法改性膳食纤维>化学法改性膳食纤维>水提法膳食纤维,且吸附能力的强弱次序均为Pb2+>As3+>Cu2+。在pH 2.0条件下(图1b),生物解离膳食纤维对Pb2+、As3+、Cu2+3 种重金属离子吸附能力与挤压膨化法改性膳食纤维吸附能力相近(P>0.05),分别为215.2、200.1、123.2 μmol/g及212.4、192.1、121.3 μmol/g,明显高于水提法、化学法及发酵法膳食纤维(60.3、52.9、32.7 μmol/g,106.3、98.4、50.2 μmol/g及134.2、28.5、79.7 μmol/g),且膳食纤维在pH 7.0条件下对同种重金属离子的吸附效果要优于pH 2.0。这是由于在酸性条件下,纤维中糖醛酸的羟基和木质素的酚酸等亲水基团对重金属离子的吸附作用被溶液中电离的H3O+的排斥作用取缔[20],此时物理吸附成为膳食纤维吸附重金属离子的主要方式[33]。上述结果不仅说明小肠环境更适合膳食纤维对重金属离子的吸附,同时也证明生物解离膳食纤维具有更强的重金属吸附能力,可有效阻碍人体对重金属离子的吸收。
2.4.1 葡萄糖吸收能力分析
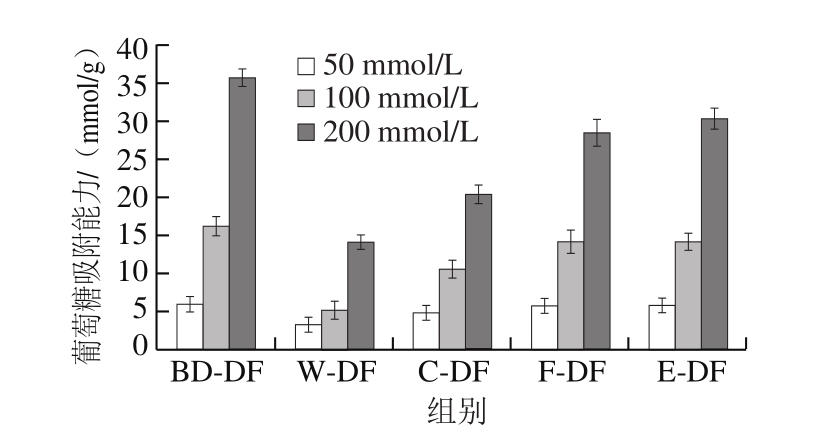
图2 不同提取方式膳食纤维的葡萄糖吸收能力
Fig.2 Glucose adsorption capacities of dietary fibers from different extraction methods
膳食纤维具有抑制葡萄糖扩散的功效,可降低血液中葡萄糖的含量,有效控制血糖指数[34]。图2所示为不同方式提取的膳食纤维对葡萄糖的吸收能力,各膳食纤维对葡萄糖吸收力的大小依次为:生物解离膳食纤维>挤压膨化法改性膳食纤维>发酵法改性膳食纤维>化学法改性膳食纤维>水提法膳食纤维,且不同提取方式膳食纤维的葡萄糖吸收能力均随葡萄糖浓度的增加而提高,当葡萄糖浓度为200 mmol/L时,生物解离膳食纤维葡萄糖吸收能力分别高于挤压膨化法、发酵法、化学法及水提法膳食纤维17.66%、25.41%、74.20%及151.79%。这一现象与Park等[35]的研究结果一致。已有研究表明,膳食纤维的葡萄糖吸收能力与其可溶性膳食纤维的含量及物理结构有关[21]。这是由于可溶性膳食纤维与水接触后产生的凝胶状物体可将葡萄糖分子包裹其中,且膳食纤维疏松的网状结构也会减缓葡萄糖分子在食品体系中的扩散速率。上述结果表明,生物解离膳食纤维对葡萄糖的吸收能力明显高于其他方式提取的膳食纤维,可起到较好的调节饮食结构、控制餐后血糖指数的作用,在各种食品、保健品和医药制品中具有一定的应用前景。
2.4.2 α-淀粉酶活性抑制能力分析
表3 不同提取方式膳食纤维的α-淀粉酶活性抑制能力
Table3 α-Amylase inhibitory activities of dietary fibers from different extraction methods
组别 BD-DF W-DF C-DF F-DF E-DF α-淀粉酶抑制能力/% 18.42±0.19a13.53±0.18e15.30±0.71d17.61±0.28c17.93±10.54b
膳食纤维对α-淀粉酶活性具有一定抑制的作用,可改善食品体系中淀粉类物质的消化特性[36]。表3所示为不同提取方式的膳食纤维对α-淀粉酶的抑制能力。其中,生物解离膳食纤维的α-淀粉酶抑制能力最高,为18.42%,较水提法膳食纤维、化学法改性膳食纤维、发酵法改性膳食纤维及挤压膨化法改性膳食纤维分别提高了约36%、20%、5%和3%。生物解离膳食纤维较高的α-淀粉酶抑制能力可能与其持水性和膨胀性较强有关。较高的膨胀性和持水率能降低体系流动性,减少酶与底物发生碰撞的机会,降低α-淀粉酶的酶解效果[37]。因此生物解离膳食纤维有较高的α-淀粉酶抑制能力,可作为一种慢消化食品添加剂应用在功能性食品中。
2.4.3 胆汁酸阻滞指数分析
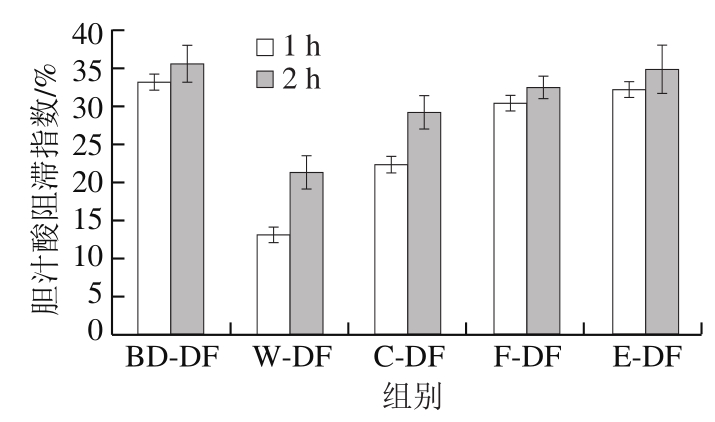
图3 不同提取方式膳食纤维胆汁酸阻滞指数
Fig.3 Bile acid retardation index of dietary fibers from different extraction methods
胆汁酸过多会损伤胃黏膜上皮细胞,膳食纤维具有延迟或抑制人体对胆汁酸吸收速率的功效,从而预防疾病[38]。根据图3不同提取方式膳食纤维的胆汁酸阻滞结果可知,生物解离膳食纤维的胆汁酸阻滞指数最大,为33.12%~35.52%,挤压膨化法及发酵法改性膳食纤维次之,分别为32.14%~34.76%和30.32%~32.34%,而水提法膳食纤维的胆汁酸阻滞指数最低,仅有13.13%~21.32%,不同提取方式膳食纤维的胆汁酸阻滞指数差异可能与其中可溶性膳食纤维含量有关,这是由于可溶性膳食纤维中的活性基团可以螯合吸附胆汁酸之类的有机分子[39]。综合以上不同提取方式对膳食纤维功能特性的分析结果可知,生物解离膳食纤维相比于其他膳食纤维具有更好的功能特性和营养价值,可作为一种功能性配料添加到普通食品或保健食品中,增加食品的降血糖、降血脂等生理功能,保证膳食结构平衡。
本实验对比了不同提取方式所得大豆膳食纤维的化学组成、理化性质及功能特性,结果发现,生物解离大豆膳食纤维纯度可高达82.58%,可溶性膳食纤维含量约占总膳食纤维含量的60%,并且相比于化学法、发酵法及挤压膨化提取的改性膳食纤维以及水提法提取的天然膳食纤维,生物解离膳食纤维具有较高的持水性、持油性、膨胀性和溶解性(6.87 g/g、5.48 g/g、8.22 mL/g、5.07%),可作为新型品质改良剂添加至食品行业中。与此同时,生物解离膳食纤维的重金属吸附能力(pH 7.0时Pb2+351.2 μmol/g、As+304.1 μmol/g、Cu2+214.1 μmol/g)、葡萄糖吸收能力(3.06~35.78 mmol/g)、α-淀粉酶活性抑制能力(18.42%)和胆汁酸阻滞指数(33.12%~35.52%)均明显高于其他方式提取的膳食纤维,在功能强化型食品及保健品方面的开发具有广阔前景。本研究可为生物解离副产物的综合利用提供一定理论依据。
[1] LIU C M, LIANG R H, DAI T T, et al. Effect of dynamic high pressure microfluidization modified insoluble dietary fiber on gelatinization and rheology of rice starch[J]. Food Hydrocolloids,2016, 57(1): 55-61. DOI:10.1016/j.foodhyd.2016.01.015.
[2] GRUNDY M M, EDWARDS C H, MACKIE A R, et al. Re-evaluation of the mechanisms of dietary fibre and implications for macronutrient bioaccessibility, digestion and postprandial metabolism[J]. British Journal of Nutrition, 2016, 116(5): 816-833.
[3] MATEOS-APARICIO I, MATEOS-PEINADO C, RUPÉREZ P. High hydrostatic pressure improves the functionality of dietary fibre in okara by-product from soybean[J]. Innovative Food Science & Emerging Technologies, 2010, 11(3): 445-450. DOI:10.1016/j.ifset.2010.02.003.
[4] CHEN Ye, YE Ran, YIN Luo, et al. Novel blasting extrusion processing improved the physicochemical properties of soluble dietary fiber from soybean residue and in vivo evaluation[J]. Journal of Food Engineering, 2014, 120(1): 1-8. DOI:10.1016/j.jfoodeng.2013.07.011.
[5] 李文佳, 林亲录, 苏小军. 从豆渣中制取大豆膳食纤维的研究[J].农产品加工(学刊), 2010(6): 51-53. DOI:10.3969/j.issn.1671-9646(X).2010.06.015.
[6] 单平阳, 王磊, 石可歆, 等. 花生壳可溶性膳食纤维物化及功能特性的研究[J]. 安徽农业科学, 2017, 45(13): 89-91; 98. DOI:10.3969/j.issn.0517-6611.2017.13.027.
[7] 冯雁波, 包怡红. 超微粉碎对松仁膳食纤维体外降血糖、降血脂功能的影响[J]. 食品工业科技, 2016, 37(23): 342-346; 350.DOI:10.13386/j.issn1002-0306.2016.23.056.
[8] JIANG L, HUA D, WANG Z, et al. Aqueous enzymatic extraction of peanut oil and protein hydrolysates[J]. Food and Bioproducts Processing, 2010, 88(2/3): 233-238. DOI:10.1016/j.fbp.2009.08.002.
[9] MAT Y M, GORDON, MICHAEL H N, et al. Aqueous enzyme assisted oil extraction from oilseeds and emulsion de-emulsifying methods: a review[J]. Trends in Food Science & Technology, 2015,41(1): 60-82. DOI:10.1016/j.tifs.2014.09.003.
[10] SEKHON J K, JUNG S, WANG T, et al. Effect of co-products of enzyme-assisted aqueous extraction of soybeans on ethanol production in dry-grind corn fermentation[J]. Bioresource Technology, 2015,192(2): 451-460. DOI:10.1016/j.biortech.2015.05.096.
[11] 徐渐, 江连洲, 穆莹, 等. 超声波酸水解法提取豆渣中异黄酮条件优化[J]. 食品工业科技, 2012, 33(13): 253-256.
[12] QI B K, JIANG L Z, LI Y, et al. Extract dietary fiber from the soy pods by chemistry-enzymatic methods[J]. Procedia Engineering, 2011,15(1): 4862-4873. DOI:10.1016/j.proeng.2011.08.907.
[13] 江连洲, 毛惠婷, 毕爽, 等. 超声波辅助提取生物解离豆渣中植酸的工艺优化[J]. 食品工业科技, 2016, 37(6): 255-259; 263.
[14] 李杨, 江连洲, 张兆国, 等. 大豆生物解离提取副产物-水溶性糖工艺优化及机理研究[J]. 中国粮油学报, 2010(6): 31-36.
[15] 万婕, 余海霞, 刘成梅, 等. 大豆膳食纤维及其各组分连续分离工艺研究[J]. 食品工业科技, 2012, 33(24): 282-285.
[16] 赵泰霞, 朱杏玲. 微生物发酵法提取大豆渣膳食纤维的研究[J]. 武夷学院学报, 2016, 35(3): 18-22. DOI:10.3969/j.issn.1674-2109.2016.03.005.
[17] 刘汉文, 黄良策, 陈洪兴, 等. 挤压膨化对豆渣可溶性膳食纤维的影响[J]. 食品科学, 2011, 32(8): 159-162.
[18] HORWITZ W, HELRICH K, HELRICH W. Official methods of analysis of the Association of Official Analytical Chemist[M]. America:Association of Official Analytical Chemists, Inc., 1975: 181-186.
[19] AACC. Approved methods of American Association of Cereal Chemists[S]. Applied Biochemistry and Biotechnology, 2000.
[20] ROBERTSON J A, FDDE M, DYSSELER P, et al. Hydration properties of dietary fibre and resistant starch: a European collaborative study[J]. LWT-Food Science and Technology, 2000, 33(2): 72-79.
[21] 阮传英. 动态高压微射流技术对豆渣膳食纤维吸附重金属能力的影响[D]. 南昌: 南昌大学, 2014: 17.
[22] CHAU C F, WEN Y L, WANG Y T. Improvement of the functionality of a potential fruit insoluble fibre by micron technology[J].International Journal of Food Science & Technology, 2006, 41(9):1054-1060.
[23] AHMED F, SAIRAM S, UROOJ A. In vitro hypoglycemic effects of selected dietary fiber sources[J]. Journal of Food Science &Technology, 2011, 48(3): 285-289.
[24] ADIOTOMRE J, EASTWOOD M A, EDWARDS C A, et al. Dietary fiber: in vitro methods that anticipate nutrition and metabolic activity in humans[J]. American Journal of Clinical Nutrition, 1990, 52(1):128-134.
[25] 马梦梅. 孜然膳食纤维改性及降血糖活性研究[D]. 北京: 中国农业科学院, 2016: 7.
[26] PÉREZ-LÓPEZ E, MATEOS-APARICIO I, RUPÉREZ P. Okara treated with high hydrostatic pressure assisted by Ultraf l o®L: effect on solubility of dietary fibre[J]. Innovative Food Science & Emerging Technologies, 2016, 33(2): 32-37. DOI:10.1016/j.ifset.2015.12.017.
[27] 张华, 段倩, 张可, 等. 化学法提取红枣渣中不溶性膳食纤维工艺研究[J]. 北方园艺, 2013, 6(14): 143-145.
[28] 李杨, 张雅娜, 王欢, 等. 生物解离提取大豆油与其他不同种大豆油品质差异研究[J]. 中国粮油学报, 2014, 29(6): 46-52.
[29] EVA G, ANTONIO J, PILAR R. Dietary fibre and physicochemical properties of several edible seaweeds from the northwestern Spanish coast[J]. Food Research International, 2010, 43(9): 2289-2294.
[30] YALEGAMA L L, NEDRA K D, SIVAKANESAN R, et al. Chemical and functional properties of fibre concentrates obtained from byproducts of coconut kernel[J]. Food Chemistry, 2013, 141(1): 124-130.
[31] GOÑI I, MARTIN-CARRÓN N. In vitro fermentation and hydration properties of commercial dietary fiber-rich supplements[J]. Nutrition Research, 1998, 18(6): 1077-1089.
[32] ANDERSON E T, BERRY B W. Identification of nonmeat ingredients for increasing fat holding capacity during heating of ground beef[J].Journal of Food Quality, 2001, 24(4): 291-299.
[33] BISWAS A K, KUMAR V, BHOSLE S, et al. Dietary fibers as functional ingredients in meat products and their role in human health[J].International Journal of Livestock Production, 2011, 2(4): 45-54.
[34] ZHANG N, HUANG C H, OU S Y. In vitro binding capacities of three dietary fibers and their mixture for four toxic elements, cholesterol, and bile acid[J]. Journal of Hazardous Materials, 2011, 186(1): 236-239.
[35] PARK K H, LEE K Y, LEE H G. Chemical composition and physicochemical properties of barley dietary fiber by chemical modification[J]. International Journal of Biological Macromolecules,2013, 60(6): 360-365.
[36] 阮传英, 涂宗财, 王辉, 等. 豆渣膳食纤维的体外吸附性能[J]. 食品科学, 2014, 35(15): 109-112. DOI:10.7506/spkx1002-6630-201415022.
[37] 涂宗财, 胡月明, 陈丽莉, 等. 豆渣膳食纤维吸附重金属的研究[J]. 食品与机械, 2013, 29(1): 85-87. DOI:10.3969/j.issn.1003-5788.2013.01.019.
[38] GALISTEO M, MORÓN R, RIVERA L, et al. Plantago ovata husks-supplemented diet ameliorates metabolic alterations in obese Zucker rats through activation of AMP-activated protein kinase.comparative study with other dietary fibers[J]. Clinical Nutrition,2010, 29(2): 261-267.
[39] LÓPEZ-VARGAS J H, FERNÁNDEZ-LÓPEZ J, PÉREZ-LVAREZ J A, et al. Chemical, physico-chemical, technological, antibacterial and antioxidant properties of dietary fiber powder obtained from yellow passion fruit (Passif l ora edulis var. f l avicarpa) co-products[J]. Food Research International, 2013, 51(2): 756-763.
Effect of Different Extraction Methods on Physicochemical and Functional Properties of Soybean Dietary Fiber