蛋清凝胶作为一种食品原料,在生产加工中具有重要的作用,不仅可以改善食品的质地和形态,还可以提高食品的保水性、增稠性、黏结性等[1]。但由于蛋清的水分含量较高,乳化性相对较低,蛋清蛋白极容易发生变性,在保藏和运输中蛋清的品质和功能特性会发生变化[2-3]。
为提高蛋清凝胶的稳定性和凝胶特性,胡瑞等[4]研究发现杂粮的种类与添加量可以影响鸡蛋凝胶的保水性及质构特性,其中杂粮粉添加量与鸡蛋凝胶的保水性、硬度、咀嚼性呈正相关,与弹性呈负相关性,结果显示添加适量杂粮粉可以改善鸡蛋凝胶的品质。曾虹艳等[5]研究不同磷酸盐对鸡蛋凝胶持水性的影响,结果表明,添加适量磷酸盐可提高鸡蛋凝胶的持水性。Handa等[6]研究不同pH值对热诱导条件下蛋清凝胶质构特性的影响,发现在碱性条件下,溶液的pH值越高,蛋清凝胶的质构特性越好,网络结构越有序。Croguennec等[7]研究发现金属离子的种类与pH值对蛋清的凝胶性能有显著影响。这些实验所用到的方法在一定程度上可以提高蛋清凝胶的保水性,增加凝胶强度,但也破坏了蛋清蛋白的结构,产生的副产物会影响其营养价值,且存在一定的安全性问题。因此,在不破坏蛋清蛋白的情况下研究一种改善蛋清凝胶性质的技术对于凝胶产品的合理加工及开发具有实际的指导意义。
近年来,超声作为一种改善蛋白质功能性质的绿色技术,在食品的破损检测、乳化、均质、肉质嫩化、灭菌、提取、过滤、干燥等方面发挥着重要作用[8-10]。并且经研究发现,经过超声处理后的蛋白质凝胶特性显著增强[11-16]。Hu Hao等[11-12]发现大豆分离蛋白钙离子热凝胶和葡萄糖酸内酯热凝胶经过高场强超声处理后凝胶强度和保水性都增强,并且超声处理后大豆蛋白的凝胶空间网络变得更加致密、均一。Madadlou等[13]研究发现,酪蛋白溶液经过超声处理后,形成凝胶的pH值降低,弹性和强度增强。超声辅助适度加热可以增强酸奶的凝胶结构和持水性,降低凝胶的收缩性[14]。Tang Chuanhe等[15]发现高场强超声能够提高商用大豆分离蛋白的溶解性和凝胶性。Zisu等[16]对牛奶蛋白质超声处理后,发现超声能够降低乳清蛋白和酪蛋白的黏性,并增强其凝胶性。
目前,对超声影响蛋白质凝胶特性的研究多集中在单一分离蛋白质理化性质的变化等方面,而蛋清是一种混合蛋白质,结构相对复杂,关于超声改善蛋清凝胶性质的研究鲜见报道。因此,本研究釆用超声波技术作为改性手段,对蛋清溶液进行超声处理,分析蛋清蛋白质超声处理前后的空间结构、分子分布和流变学性能的变化;然后,制作不同超声条件处理的蛋清凝胶,通过对蛋清凝胶的保水性、质构特性等进行分析,探索超声对蛋清溶液形成凝胶的影响。研究结果可为利用超声改善蛋清的凝胶性能提供参考,对鸡蛋清产业化利用具有一定的指导和应用价值。
鸡蛋购自于南昌市天虹商场。
考马斯亮蓝G250、牛血清白蛋白(均为分析纯)生工生物工程(上海)股份有限公司;5,5’-二硫双(2-硝基苯甲酸)(5,5’-dithiobis(2-nitrobenzoic acid),DTNB)、8-苯胺-1-萘磺酸(8-anilino-1-naphthalenesulfonic acid,ANS) 美国Sigma公司。
XO-1000D超声波细胞破碎仪 江苏南京先欧仪器制造有限公司;T18高速分散机 德国IKA公司;Lambda25紫外-可见分光光度计 美国Perkin Elmer公司;J-810圆二色光谱仪 日本分光公司;F-4600荧光分光光度计 日本日立公司;高速冷冻离心机 美国Thermo Scientific公司;BI-200SM动静态光散射仪美国布鲁克海文仪器公司;迷你型蛋白垂直电泳仪 美国Bio-Rad公司;DHR-2流变仪 美国TA公司;G:BOX凝胶成像系统 英国Syngene公司;TA.XT-Plus质构分析仪英国Stable Micro Systems公司。
1.3.1 超声处理
手工分离得到鲜鸡蛋的蛋清,用高速分散机搅拌(4 200 r/min、55 min),间歇开闭分散机开关,控制蛋清溶液在室温条件下,静置1 h后,采用冷冻离心机离心(8 000 r/min,30 min),取上清液进行超声处理。将超声波探头伸入蛋清溶液表面1~2 cm。超声前,先将盛有蛋清样品的50 mL离心管放在冰水混合物中静置20 min,以降低溶液温度,整个超声过程中,使蛋清样品处于冰浴环境下,以避免样品过热。设置超声频率功率为30 Hz,工作时间7 s,间歇时间3 s。超声功率分别为0、200、400、600 W,超声时间分别为0、10、20、30 min,正交处理蛋清溶液,得到超声处理前后的一系列样品。
1.3.2 粒径分析
将超声处理前后的蛋清稀释至1 mg/mL,经0.45 μm滤膜过滤,设置测量波长为633 nm,入射光路中的衰减轮为50%档,散射角为90°,小孔径片为200 μm,测试时间为5 min[17-18]。样品平行测量3 次。
1.3.3 流变学分析
整个过程根据Nyemb等[19]的研究有所调整,设置仪器应变为1%,振动频率在0.1~100 Hz范围内以对数增加,测量超声处理前后的蛋清的储能模量(G’)、耗能模量(G’’)和相位角(θ)与振动频率的关系。
1.3.4 结构分析
1.3.4.1 一级结构的测定
采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDSPAGE)对超声处理前后的蛋清的蛋白质条带进行分析,按照不连续SDS-PAGE配方配制分离胶和浓缩胶,待凝胶凝固后,取样品和上样缓冲液等体积混合,每孔上样量为10 μg。电泳后,在G:BOX凝胶成像系统上分析得到凝胶图。
1.3.4.2 二级结构的测定
将样品稀释成0.5 mg/mL,设定扫描范围为190~250 nm,扫描速率为100 nm/min,光径为0.1 cm,间隔0.1 nm,带宽0.1 nm,平行测2 次。通过在线圆二色谱分析网站(http://dichroweb.cryst.bbk.ac.uk/html/ho.shtml)对数据进行分析计算,结果以平均摩尔椭圆率[θ]表示,单位为(deg·cm2)/dmol。
1.3.4.3 内源性荧光光谱分析
将超声处理前后的蛋清稀释至0.1 mg/mL,设定荧光分光光度计的条件为:激发波长为350 nm,发射波长为300~400 nm,应答时间为4 s,狭缝宽度为5.0 nm,电压为400 V。对样品的荧光强度进行扫描。
1.3.4.4 紫外-可见分光光谱分析
将超声处理前后的蛋清稀释至0.1 mg/mL,设置扫描波长范围为250~350 nm,间隔为1.0 nm,扫描速率中等,带宽为2.0 nm,响应时间为0.2 s。
1.3.4.5 表面疏水性的测定
将超声处理前后的蛋清用磷酸盐缓冲液(50 mmol/L,pH 7.0)稀释至0.1 mg/mL,分别取5 mL加入30 μL ANS溶液(5 mmol/L)混合,室温下避光反应1 h后,测其荧光强度。设定荧光分光光度计的条件为:激发波长为390 nm,发射波长为400~700 nm,扫描速率为1 200 nm/min,光径为1 cm,狭缝宽度为5 nm,电压为700 V。
1.3.4.6 游离巯基含量的测定
采用Ellman法测定超声处理前后的蛋清的游离巯基含量[20-21]。将样品用三羟甲基氨基甲烷-甘氨酸(Tris-glycine)缓冲液稀释成4 mg/mL,将4 mg DTNB溶于1 mL Tris-glycine缓冲液配成Ellman试剂,分别取3 mL稀释后的样品溶液与30 μL Ellman试剂混合,室温下避光反应15 min后,在412 nm波长处测定吸光度,以Tris-glycine缓冲液作为空白对照,按照公式(1)计算游离巯基含量。
式中:75.53=106/(1.36×104),1.36×104表示摩尔消光系数(mol/(L•cm));ρ表示蛋白质样品的质量浓度/(mg/mL);D表示样品稀释倍数(7.5)。
1.3.5 凝胶性质的分析
将超声处理前后的蛋清90 ℃水浴加热30 min,制成蛋清凝胶[22],冷却,妥善保存,确保其完整性。
1.3.5.1 凝胶保水性的测定
用离心法测凝胶保水性[23],并做适当修改。取2 g蛋清凝胶用滤纸制成小包,置于10 mL EP管中。8 000 r/min离心20 min,倒去水分,并小心用滤纸转移残存的水分,称质量,实验重复3 次,凝胶保水性按式(2)进行计算。
式中:m1表示离心前凝胶和离心管的质量/g;m2表示离心后去除水分的凝胶和离心管的质量/g。
1.3.5.2 质构特性的测定
用质构仪测量蛋清凝胶的质构特性[24-25]。采用P/5探头对样品进行两次压缩。测定条件如下:测前速率:5.0 mm/s;探头以1.0 mm/s的速率穿刺;测后速率:5.0 mm/s;测定距离为15 mm;压缩比例为50%;触发力:5.0 g;触发类型:Auto;数据攫取速率:200 pps;停留时间:5 s。每个样品制3块凝胶,平行测量3 次。
所有数据利用Microsoft Excel 2010软件进行统计处理,采用Origin 9.0软件进行作图分析,用SPSS 17.0软件对数据进行方差分析,用S-N-K法进行多重比较(P<0.05表示差异显著)。
利用动静态光散射分析超声对蛋清溶液粒径大小及其分布的影响(图1),与未超声的样品相比,随着超声功率的增加和超声时间的延长,蛋清溶液粒径主峰不断左移,粒径分布范围变窄,说明超声使蛋白质的整体分子粒径分布变窄。与未超声样品相比,超声200 W、20 min和30 min的样品在20 nm以下的粒径分布消失,而在28~40 nm范围内出现了新的粒径次峰;超声400 W、10 min和30 min的样品的粒径分布分别在15 nm和20 nm以下消失,均在30~50 nm范围内出现了新的粒径次峰,说明在200 W和400 W的超声处理下,蛋清溶液的蛋白质发生了聚集,也有小部分发生了降解。与未超声样品相比,在超声600 W条件下,超声10、20、30 min的样品分别在55、45、42 nm以下没有粒径分布,且在65~90、55~85、55~82 nm范围内出现了新的粒径次峰,说明在600 W的超声处理下,蛋清溶液的蛋白质发生了部分的降解,也有小部分发生了聚集。

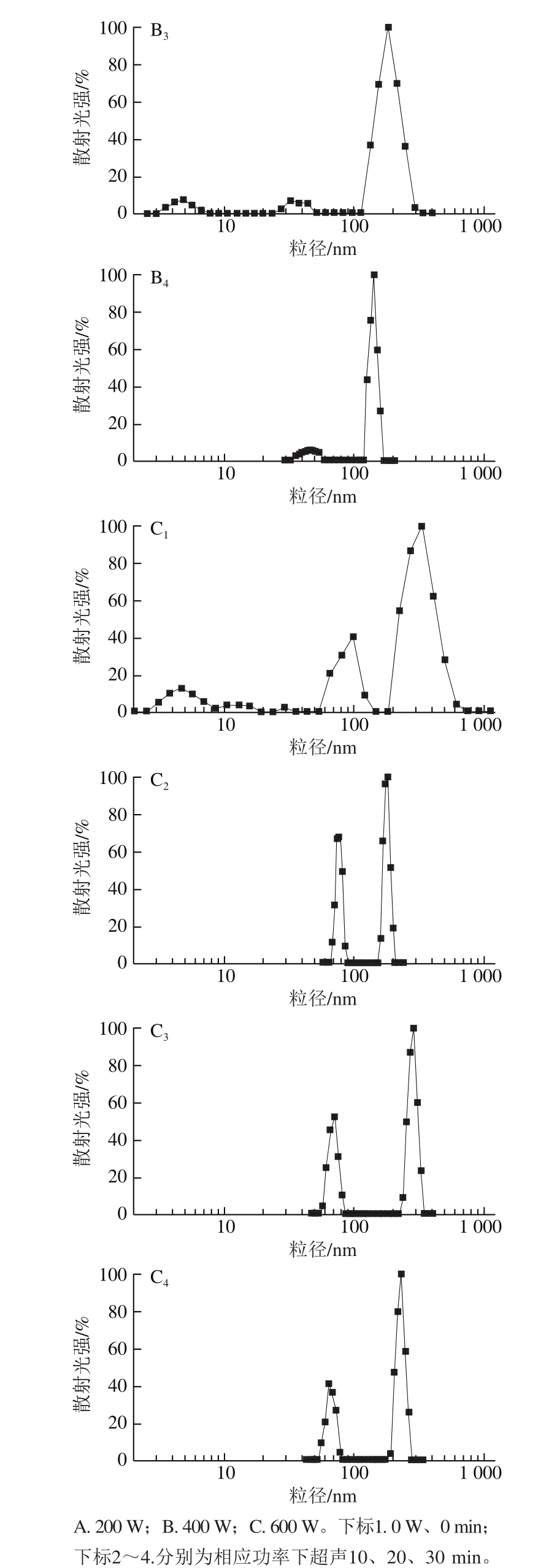
图1 超声处理的蛋清样品粒径分布图
Fig.1 Particle size distribution of egg white samples after ultrasonic treatment
G’表示样品在发生形变时,由于弹性形变(可逆)而储存的能量,大小与凝胶的弹性有关,G’’表示样品在发生形变时,由于黏性形变(不可逆)而损耗的能量,大小与液体的黏性有关[26]。G’和G’’的比值称为损耗角正切(tan θ),表示黏弹性的度量,tan θ越大,黏性越大,tan θ越小,弹性越大[27]。溶液在形成凝胶的过程中,G’和G’’一直在发生变化。形成凝胶之初,G’<G’’,溶液主要发生黏性形变,呈液态;随着交联反应的进行,分子基团逐步增大,G’显著上升,直到G’=G’’,此时称为胶凝点,溶液形成半固体的凝胶态;胶凝点之后,G’>G’’,半固体的样品发生弹性形变,呈固态[28]。
如图2C所示,与未超声样品相比,经过600 W、30 min的超声处理后,tan θ增大,黏性变大,说明蛋白溶液表现出更加偏向液体的流变性,黏性越来越大,形成的凝胶弹性较差;同时,与未超声样品相比,在同一振动频率下,600 W、30 min超声处理组样品的G’、G’’明显降低,可能是600 W、30 min处理组样品发生了一定的降解,蛋清溶液的粒度减小,此推测与动静态光散射结果符合,从而形成凝胶的交联程度降低,凝胶性能下降。
如图2A、C所示,随着振动频率增加,200 W、10 min超声处理组G’显著下降,tan θ增大,说明蛋白溶液形成的凝胶弹性降低,黏性增大,类似于600 W、30 min超声处理的样品,蛋白溶液也偏向液体的流变性,但由于超声的强度此时并不高,可能是由于蛋清溶液的蛋白质种类繁多且组成复杂,导致200 W、10 min的超声处理后蛋清液的部分蛋白质更偏向于溶液的黏性。说明蛋清作为混合蛋白源,蛋清中的蛋白质种类和组成在超声处理下发生的变化也会影响蛋清溶液的流变性。
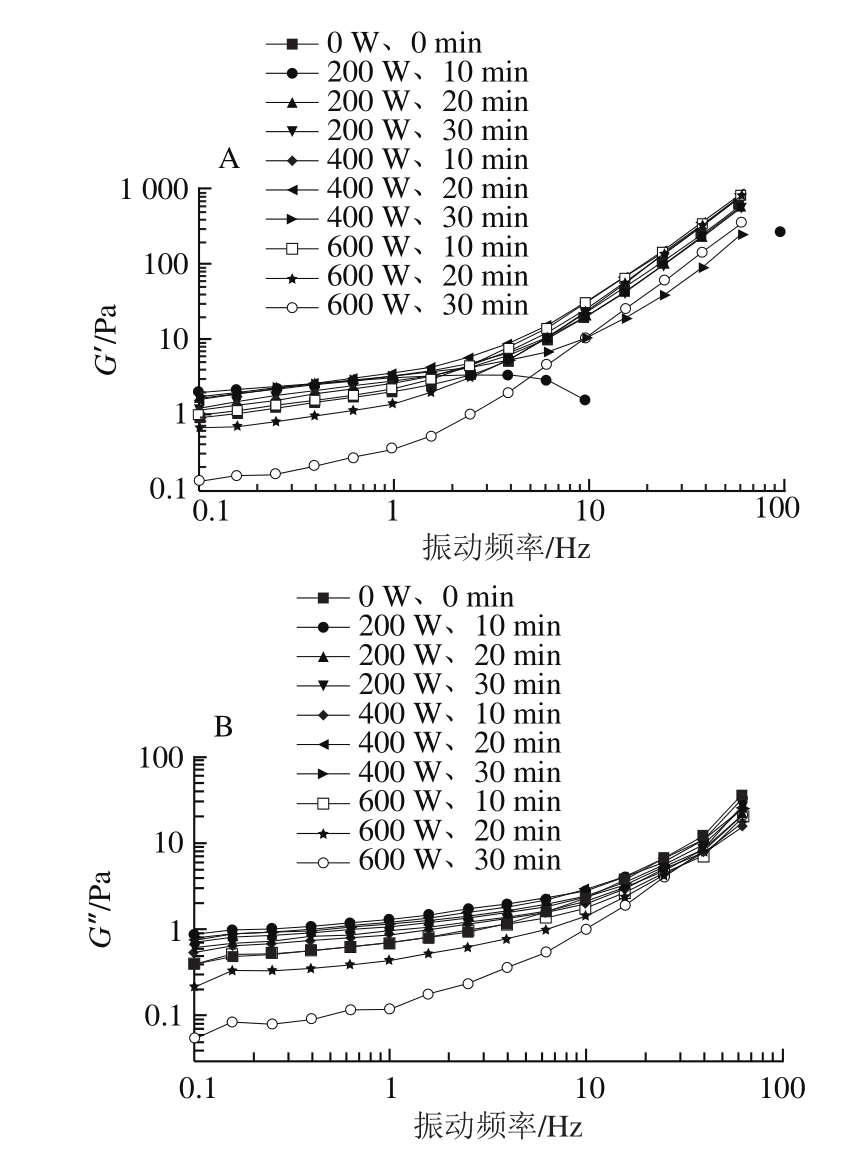
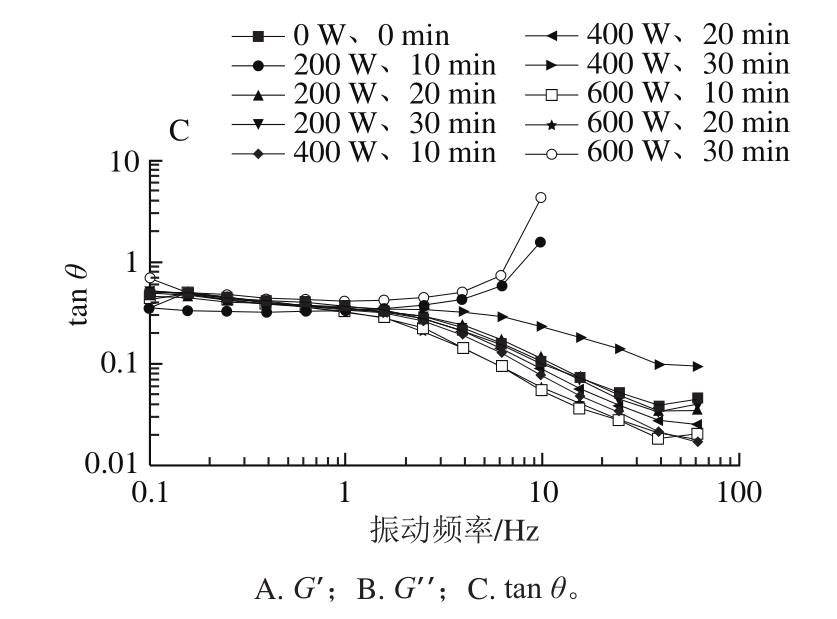
图2 超声处理的蛋清样品的流变性变化
Fig.2 Variation in rheological properties of egg white samples after ultrasonic treatment
通过SDS-PAGE分析超声对蛋清蛋白条带的影响(图3),发现蛋白样品经过超声处理之后,蛋白质条带没有明显的变化,说明超声对蛋白质的一级结构并不造成影响。
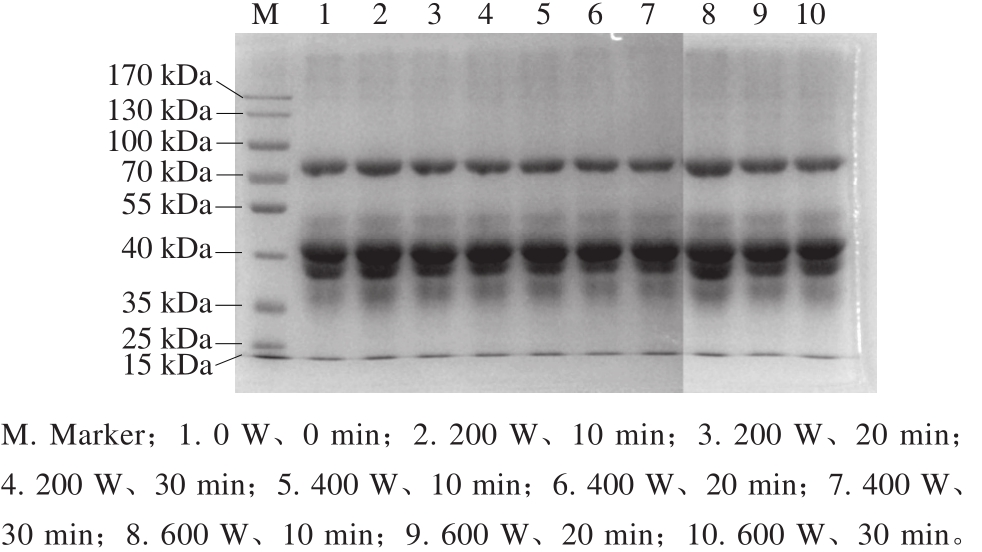
图3 超声处理的蛋清样品的SDS-PAGE图
Fig.3 SDS-PAGE patterns of egg white samples after ultrasonic treatment

图4 超声处理的蛋清样品圆二色光谱
Fig.4 Circular dichroism spectra of egg white samples after ultrasonic treatment
利用圆二色光谱分析超声对蛋清蛋白二级结构的影响,由图4可知,未超声样品在195 nm波长处有正峰,在219~221 nm波长处有负峰,说明未超声样品的二级结构以β-折叠为主。超声处理后,光谱曲线与X坐标轴的交点没有明显迁移,大部分在192 nm波长处有一个正峰,在208 nm和222 nm波长处有负峰,表明超声处理后,蛋清样品的二级结构主要以β-螺旋结构为主,但部分超声的蛋清溶液仍表现以β-折叠结构为主的特征峰。蛋清溶液的蛋白质分子主要是β-折叠结构,在超声处理下,随超声时间的延长,蛋清溶液的β-螺旋结构和β-折叠结构出现了无规则变化。说明超声处理下,部分蛋清溶液的蛋白质二级结构发生改变。
分析超声对蛋清蛋白三级结构的影响,如图5A~C所示,在200 W和400 W的超声处理下,蛋清溶液的荧光强度均降低(图5A),暴露在溶液中的芳香族氨基酸残基减少(图5C),而游离巯基含量在超声10 min和20 min显著减少(P<0.05)(图5D),超声30 min无显著性变化(P>0.05),疏水基团增加(图5B)。可能是由于超声的空穴作用导致蛋白质发生碰撞后相互作用,蛋白质发生卷曲、折叠,使部分生色基团被包裹在蛋白分子内部,导致荧光强度部分猝灭,蛋白质发生折叠时,蛋白质部分聚集,蛋白质分子间的芳香族氨基酸残基、疏水基团和游离巯基被部分掩埋,巯基形成了二硫键,因此暴露在溶液中的芳香族氨基酸残基和游离巯基含量下降;而疏水基团增加可能是由于蛋白质发生聚集时,分子间相互作用,暴露出分子内的疏水基团。
如图5A~C所示,在600 W的超声作用下,相对于未处理的蛋清样品,超声10 min的荧光强度明显降低,超声20 min和30 min的荧光强度(图5A)和暴露在溶液中的芳香族氨基酸残基(图5C)、疏水基团增加(图5B),游离巯基含量显著增加(P<0.05)(图5D),可能是蛋白质分子相互作用,暴露出不同的生色基团。相比于超声20 min和30 min的样品,超声10 min的样品的荧光强度反而低于未处理样品,可能是由于蛋清溶液是混合蛋白源,分子结构复杂、荧光生色基团分布不均、蛋白质分子伸展和折叠方式不同,在超声处理下都会引起蛋白荧光强度的差异[29],蛋白质部分展开时,蛋白质分子结构由紧密变得松散,暴露在溶液中的芳香族氨基酸残基越来越多,蛋白质的分子间疏水作用也被破坏,分子内部暴露出了更多的疏水基团,包埋在蛋白质内部的巯基暴露到分子表面,同时分子间或分子内的二硫键被打断,形成了新的巯基。

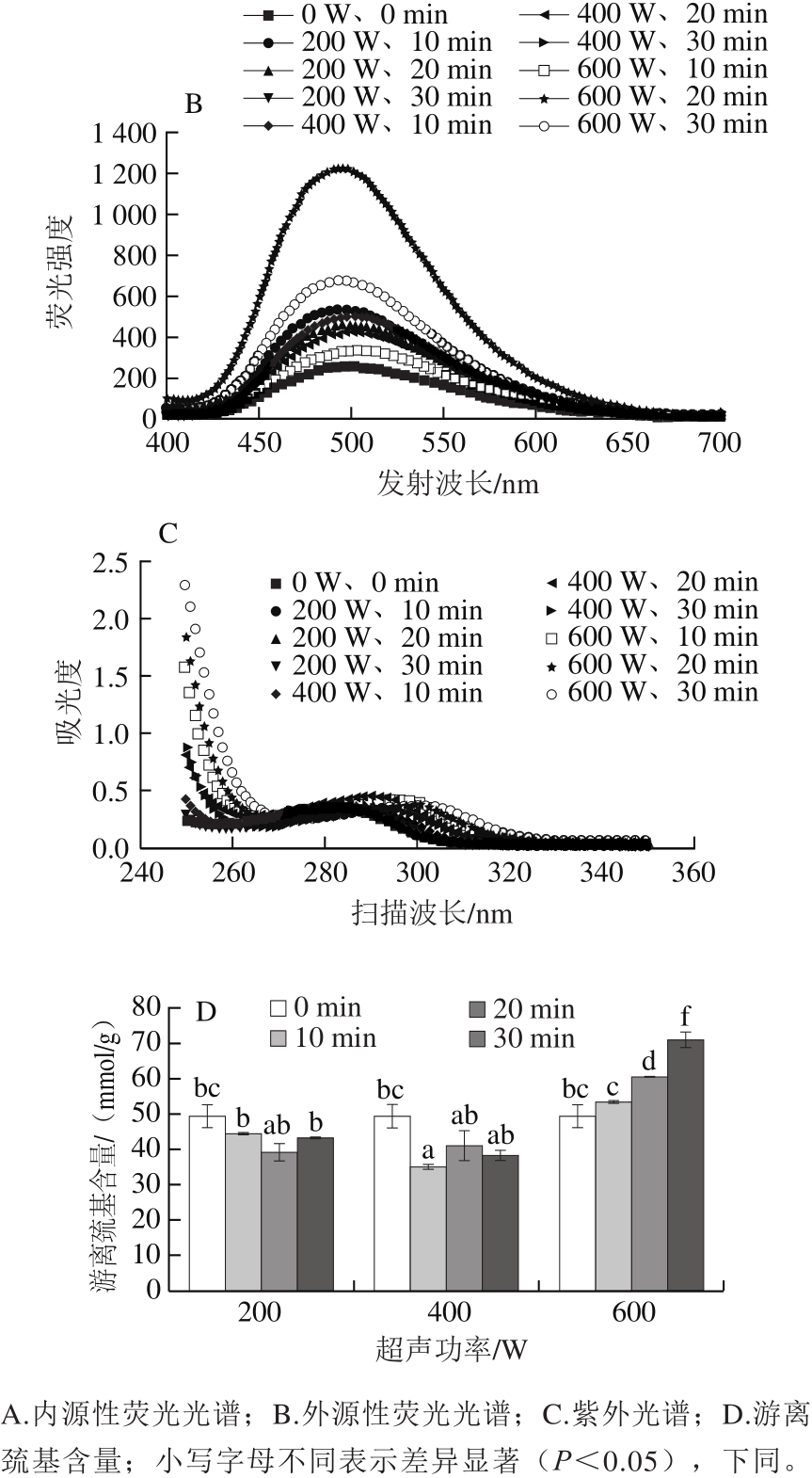
图5 超声处理的蛋清样品三级结构变化
Fig.5 Change in tertiary structure of egg white samples after ultrasonic treatment
由图6A可知,在超声200 W时,和超声0 min相比,超声处理使蛋清凝胶保水性显著增加(P<0.05),但超声10 min和20 min之间无显著性变化(P>0.05)。在超声400 W时,超声10 min保水性无显著性变化(P>0.05),超声20 min和30 min的凝胶保水性显著增强(P<0.05)。在超声600 W时,和超声0 min相比,超声10、20、30 min均使蛋清凝胶保水性显著增强(P<0.05),但超声10、20 min和30 min处理组之间蛋清凝胶保水性无显著性变化(P>0.05)。保水性增强可能是因为超声波的空穴效应使蛋清溶液的蛋白质发生了一定的折叠和聚集,从而蛋清凝胶形成的空间网络结构更加均一、稳定,对水分子的绑定更加坚固[30]。Zhang Ziye等[31]发现肌纤维蛋白凝胶在经过超声处理之后,保水性会增加,因为超声之后蛋白质溶液更加均一,空隙变小,更容易防止水分子逸出,和本研究结论一致。
由图6B可知,在200 W和400 W超声处理下,随着超声时间的延长,蛋清的凝胶强度显著增强(P<0.05),可能是由蛋白质分子间或分子内发生了一定的交联反应,蛋白质发生了一定的折叠和聚集,这能导致蛋白质聚集体的相对分子质量增大,而暴露在溶液中的游离巯基含量减少,二硫键增多,导致分子间或分子内发生交联的机会增多,因此蛋清溶液的凝胶强度增强。相反,在600 W、30 min的超声处理下,蛋清溶液的凝胶强度显著降低(P<0.05),可能是长时间的超声处理使蛋清溶液的蛋白质逐渐展开,并发生了一定的降解,使蛋白质分子间不容易发生交联反应。Zhang Peipei等[32]在转谷氨酰胺酶催化大豆分离蛋白的实验中发现,随着超声功率的增大,蛋白质的凝胶强度增加,说明超声有利于大豆分离蛋白的交联反应,并能增加氨基酸之间的非共价作用和增强蛋白质凝胶三维网络结构的稳定性。但本研究发现,与未处理样品相比,在超声600 W、30 min的条件下,蛋清蛋白的凝胶强度反而降低了。由此可见,蛋白种类不同,超声处理对蛋白凝胶结构的影响也不同。
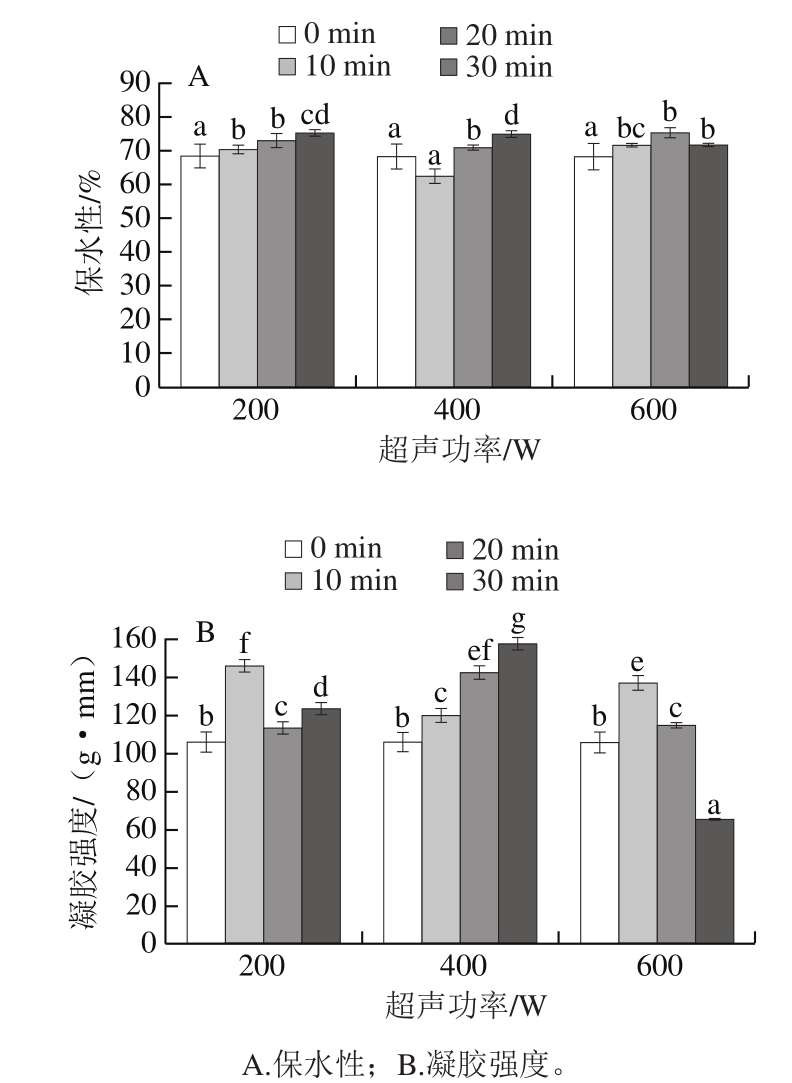
图6 超声处理对蛋清凝胶特性的影响
Fig.6 Effect of ultrasonic treatment on egg white gel properties
超声可以改变蛋清溶液的粒径分布,使部分蛋白质分子粒径变大,部分蛋白质分子粒径变小。200 W、10 min和600 W、30 min的超声处理下,蛋清溶液偏向于液体的流变性。在200 W和400 W的超声处理下,蛋清溶液的蛋白质发生了折叠和聚集,也有小部分发生了降解;在600 W的超声处理下,蛋清溶液的蛋白质发生了部分的降解,也有小部分发生了聚集。在200、400 W和600 W 3 种功率的超声处理下,与超声0 min相比,蛋清凝胶的保水性均增强。200 W和400 W的超声处理有利于增强蛋清的凝胶强度,使凝胶更加坚固和致密;600 W、30 min的超声处理会使蛋清的凝胶强度降低,从而使凝胶的稳定性降低。
本研究说明一定强度的超声处理可以改善蛋白质的凝胶特性,但需要限制超声处理的强度,高功率和长时间的作用下,蛋白质的凝胶特性可能会降低。前人研究超声对蛋白质凝胶特性的影响,主要致力于对单一蛋白影响的研究,如大豆7S蛋白、罗非鱼分离蛋白等,而在食品加工过程中,蛋白质发挥凝胶特性通常是在复杂的食物基质条件下;因此,研究超声对单一蛋白凝胶特性的影响具有一定的局限性。本研究以蛋清蛋白这一混合蛋白源为研究对象,对其在超声前后的理化性质、流变特性及功能特性进行了详细的探讨,研究结果可为进一步改善蛋清制品凝胶特性、充分开发利用我国蛋清资源提供参考。
[1] MATSUDOMI N, NAKANO K, SOMA A, et al. Improvement of gel properties of dried egg white by modification with galactomannan through the Maillard reaction[J]. Journal of Agricultural and Food Chemistry, 2002, 50(14): 4113-4118. DOI:10.1021/jf0114334.
[2] HAMMERSHØJ M, LARSEN L B, ANDERSEN A B, et al. Storage of shell eggs influences the albumen gelling properties[J]. LWTFood Science and Technology, 2002, 35(1): 62-69. DOI:10.1006/fstl.2001.0811.
[3] RELKIN P. Reversibility of heat-induced conformational changes and surface exposed hydrophobic clusters of beta-lactoglobulin: their role in heat-induced sol-gel state transition[J]. International Journal of Biological Macromolecules, 1998, 22(1): 59-66. DOI:10.1016/s0141-8130(97)00089-5.
[4] 胡瑞, 李纯, 周文倩, 等. 杂粮粉对鸡蛋凝胶特性的影响[J]. 食品科学, 2013, 34(23): 151-154. DOI:10.7506/spkx1002-6630-201323032.
[5] 曾虹艳, 刘福权, 赵志峰, 等. 磷酸盐对鸡蛋凝胶持水性的影响研究[J]. 食品研究与开发, 2016, 37(8): 216-220. DOI:10.3969/j.issn.1005-6521.2016.08.051.
[6] HANDA A, TAKAHASHI K, KURODA N, et al. Heat-induced egg white gels as affected by pH[J]. Journal of Food Science, 1998, 63(3):403-407. DOI:10.1111/j.1365-2621.1998.tb15752.x.
[7] CROGUENNEC T, NAU F, BRULE G. Influence of pH and salts on egg white gelation[J]. Journal of Food Science, 2002, 67(2): 608-614.DOI:10.1111/j.1365-2621.2002.tb10646.x.
[8] ZHENG L Y, SUN D W. Innovative applications of power ultrasound during food freezing processes: a review[J]. Trends in Food Science &Technology, 2006, 17(1): 16-23. DOI:10.1016/j.tifs.2005.08.010.
[9] CHEMAT F, HUMA Z E, KHAN M K. Applications of ultrasound in food technology: processing, preservation and extraction[J].Ultrasonics Sonochemistry, 2011, 18(4): 813-835. DOI:10.1016/j.ultsonch.2010.11.023.
[10] SORIA A C, VILLAMIEL M. Effect of ultrasound on the technological properties and bioactivity of food: a review[J]. Trends in Food Science & Technology, 2010, 21(7): 323-331. DOI:10.1016/j.tifs.2010.04.003.
[11] HU Hao, WU Jiahui, CHAN Li, et al. Effects of ultrasound on structural and physical properties of soy protein isolate (SPI)dispersions[J]. Food Hydrocolloids, 2013, 30(2): 647-655.DOI:10.1016/j.foodhyd.2012.08.001.
[12] HU Hao, CHAN Li, EUNICE C Y, et al. The effect of high intensity ultrasonic pre-treatment on the properties of soybean protein isolate gel induced by calcium sulfate[J]. Food Hydrocolloids, 2013, 32(2):303-311. DOI:10.1016/j.foodhyd.2013.01.016.
[13] MADADLOU A, EMAM-DJOMEH Z, MOUSAVI M E, et al.Acid-induced gelation behavior of sonicated casein solutions[J].Ultrasonics Sonochemistry, 2010, 17(1): 153-158. DOI:10.1016/j.ultsonch.2009.06.009.
[14] RIENER J, NOCI F, CRONIN D A, et al. A comparison of selected quality characteristics of yoghurts prepared from thermosonicated andconventionally heated milks[J]. Food Chemistry, 2010, 119(3):1108-1113. DOI:10.1016/j.foodchem.2009.08025.
[15] TANG Chuanhe, WANG Xiaoyan, YANG Xiaoquan, et al. Formation of soluble aggregates from insoluble commercial soy protein isolate by means of ultrasonic treatment and their gelling properties[J].Journal of Food Engineering, 2009, 92(4): 432-437. DOI:10.1016/j.jfoodeng.2008.12.017 .
[16] ZISU B, BHASKARACHARYA R, KENTISH S, et al.Ultrasonic processing of dairy systems in large scale reactors[J].Ultrasonics Sonochemistry, 2010, 17(6): 1075-1081. DOI:10.1016/j.ultsonch.2009.10.014.
[17] DJOULLAH A, KRECHICHE G, HUSSON F, et al. Size measuring techniques as tool to monitor pea proteins intramolecular crosslinking by transglutaminase treatment[J]. Food Chemistry, 2015, 190: 197-200. DOI:10.1016/j.foodchem.2015.05.091.
[18] 王鹏杰, 简澍瑜, 王辰元, 等. 不同前处理条件对动态光散射检测酪蛋白胶束粒径的影响[J]. 农业工程学报, 2015, 31(14): 298-302.DOI:10.11975/j.issn.1002-6819.2015.14.041.
[19] NYEMB K, GUÉRIN-DUBIARD C, PÉZENNEC S, et al. The structural properties of egg white gels impact the extent of in vitro protein digestion and the nature of peptides generated[J].Food Hydrocolloids, 2016, 54: 315-327. DOI:10.1016/j.foodhyd.2015.10.011.
[20] SHIMADA K, CHEFTEL J C. Determination of sulfhydryl-groups and disulfide bonds in heat-induced gels of soy protein isolate[J].Journal of Agricultural and Food Chemistry, 1988, 36(1): 147-153.DOI:10.1021/jf00079a038.
[21] 迟玉杰, 胥伟, 洪煜淼. 糖基化处理对蛋清粉凝胶性与物化特性的影响[J]. 食品科学, 2013, 34(7): 82-85. DOI:10.7506/spkx1002-6630-201307018.
[22] 周长旭. 鸡蛋热诱导凝胶形成及凝胶特性的研究[D]. 南京: 南京农业大学, 2012: 34-44. DOI:10.7666/d.Y2360716.
[23] PÉREZ-MATEOS M, MONTERO P. Contribution of hydrocolloids to gelling properties of blue whiting muscle[J]. European Food Research and Technology, 2000, 210(6): 383-390. DOI:10.1007/s002170050568.
[24] 姜松, 王海鸥. TPA质构分析及测试条件对苹果TPA质构分析的影响[J]. 食品科学, 2004, 25(12): 68-71. DOI:10.3321/j.issn:1002-6630.2004.12.011.
[25] 车永真. 高凝胶性蛋清粉的研究[D]. 无锡: 江南大学, 2008: 9-13.DOI:10.7666/d.y1398168.
[26] RAIKOS V, CAMPBELL L, EUSTON S R. Rheology and texture of hen’s egg protein heat-set gels as affected by pH and the addition of sugar and/or salt[J]. Food Hydrocolloids, 2007, 21(2): 237-244.DOI:10.1016/j.foodhyd.2006.03.015.
[27] MILLS E N C, HUANG L, NOEL T R, et al. Formation of thermally induced aggregates of the soya globulin beta-conglycinin[J]. Biochimica Et Biophysica Acta-Protein Structure and Molecular Enzymology, 2001,1547(2): 339-350. DOI:10.1016/s0167-4838(01) 00199-6.
[28] WINTER H H, CHAMBON F. Analysis of linear viscoelasticity of a cross-linking polymer at the gel point[J]. Journal of Rheology, 1986,30(2): 367-382. DOI:10.1122/1.549853.
[29] 刘斌, 马海乐, 李树君, 等. 超声波处理对脱脂麦胚分离蛋白结构的变化研究[J]. 光谱学与光谱分析, 2011, 31(8): 2220-2225.DOI:10.3964/j.issn.1000-0593(2011)08-2220-06.
[30] WU W, HUA Y F, LIN Q L, et al. Effects of oxidative modification on thermal aggregation and gel properties of soy protein by peroxylradicals[J]. International Journal of Food Science and Technology, 2011, 46(9): 1891-1897. DOI:10.1111/j.1365-2621.2011.02698.x.
[31] ZHANG Ziye, REGENSTEIN J M, ZHOU Peng, et al. Effects of high intensity ultrasound modification on physicochemical property and water in myofibrillar protein gel[J]. Ultrasonics Sonochemistry, 2017,34: 960-967. DOI:10.1016/j.ultsonch.2016.08.008.
[32] ZHANG Peipei, HU Tan, FENG Shaolong, et al. Effect of high intensity ultrasound on transglutaminase-catalyzed soy protein isolate cold set gel[J]. Ultrasonics-Sonochemistry, 2016, 29: 380-387.DOI:10.1016/j.ultsonch.2015.10.014.
Effect of Ultrasonic Processing on Protein Structure and Gel Properties of Egg White