
图1 超声辅助解冻装置示意图
Fig.1 Schematic diagram of the experimental setup for ultrasound-assisted thawing
中国对虾肉质鲜美、营养丰富,是广受欢迎的水产品之一;2016年的统计显示,中国对虾的养殖产量达到39 288 t,在水产品交易市场上占据了一定的份额[1],但由于其水分含量高、组织脆弱,极容易黑变、腐败,因而冷冻保藏十分重要。冻藏是目前中国对虾保鲜贮藏最常用的方式之一,其最终品质不仅受冷冻方法及冷冻速率的影响,也与解冻过程有直接的关系,不当的解冻方法会加速食品理化性质的变化以及微生物的生长,使冻结食品品质劣变,从而降低其营养价值和经济价值;因此寻求一种中国对虾的合理解冻方法十分重要[2-5]。
近年来,超声辅助解冻作为一种新型的解冻方式受到人们的关注[6-7]。Li Bin等[8]提出声波解冻能缩短解冻时间,减少汁液损失并提高产品质量;Gambuteanu等[9]比较了不同功率的超声辅助解冻和水解冻对猪肉理化性质的影响,结果表明超声强度为0.6 W/cm2时,相变区的解冻时间较静水解冻缩短了80%,同时超声辅助解冻后的猪肉品质与对照组无显著差异。目前针对解冻处理过程中解冻速率与温度分布的研究还较为缺乏,如果能精确掌握解冻食品内部的温度分布、变化趋势以及解冻时间,将对优化解冻工艺、加快生产效率、提高食品品质有重要的意义。计算机技术的飞速发展使得应用数值模拟法求解产品解冻过程的传热问题成为可能[10]。Birla等[11]用FEMLAB软件来模拟水果的射频解冻过程,其设计实验验证用结冷胶制作的水果模型解冻过程中的温度分布,结果证明模拟结果与实验结果十分吻合,该模型能成功预测解冻过程中的瞬时温度分布。
现阶段对解冻过程中的传热模拟已有很多研究,但大都集中在对射频解冻和微波解冻的模拟[11-13],而对超声辅助解冻的有限元模拟几乎没有相关研究。本实验以中国对虾为研究对象,探究超声辅助解冻对蛋白变性的影响,旨在为中国对虾科学合理的解冻方法提供参考;同时应用COMSOL Multiphysics 5.2a软件模拟超声辅助解冻中国对虾的过程,建立食品的热物理学性质随时间变化的超声-热传导双向耦合模型,并对模拟结果进行实验验证。
新鲜中国对虾购于杭州骆家庄农贸市场,其大小、形态一致,质量(11.0±0.5)g,鲜活无异味。
牛血清白蛋白 上海阿拉丁试剂有限公司;考马斯亮蓝 生工生物工程(上海)有限公司;宽分子质量蛋白标准 美国Thermo Scientific公司;十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfatepolyacrylamide gelelectrophoresis,SDS-PAGE)、凝胶配制试剂盒、上样缓冲液 上海碧云天生物科技有限公司;其他试剂均为分析纯或化学纯。
Data Trace MP III无线温度传感器及工作站 美国Mesa Labs公司;JY92-IIDN超声波细胞粉碎机 宁波新芝生物科技股份有限公司;FSH-2可调高速匀浆机 金坛市鸿科仪器厂;PowerPacTM基础电泳仪、电泳槽 美国Bio-Rad公司;MultiskanTM GO全波长酶标仪 美国赛默飞世尔科技公司;Cary Eclipse荧光分光光度计 美国安捷伦公司;HH-10数显恒温搅拌水浴锅 金坛市科杰仪器厂;UV 2550紫外-可见分光光度计 日本岛津公司;MDS1差示扫描量热(differential scanning calorimetry,DSC)仪 梅特勒-托利多国际贸易(上海)有限公司。
1.3.1 超声辅助解冻装置与对虾几何模型

图1 超声辅助解冻装置示意图
Fig.1 Schematic diagram of the experimental setup for ultrasound-assisted thawing
解冻装置如图1所示,超声辅助解冻槽是半径50 mm、高150 mm的圆柱形水槽,其中液面高度为120 mm,解冻介质为水。将待解冻的对虾放置在高度为25 mm的镂空金属网支架上进行解冻。在设计模型时,忽略对虾的头部和尾鳍(均不含肌肉组织),以含肌肉为主的虾腹为模拟对象。由于对虾不规则的形态,在建模过程中,通过测量形态、大小近似的对虾的尺寸,取其平均值,再依照其尺寸和形状建立对虾的3D几何模型(图2)。

图2 中国对虾的几何模型以及所划分的网格
Fig.2 Computational geometry of Chinese shrimp body and the obtained mesh
建立模型时,选用固体传热和压力声场两个物理场,根据实验装置建立几何模型,相关参数见表1所示,其中解冻介质水的基本参数由COMSOL Multiphysics软件提供。为了简化研究,建立模型时有几下几点假设[14-18]:1)对虾在解冻过程中与外界环境仅有热交换;2)对虾各组成部分均为各向同性的均匀体,忽略虾壳对传热造成的影响;3)对虾在解冻过程中,虾体内部热交换只考虑导热,不考虑对流传热;4)解冻初始,对虾温度和水分分布均匀且一致。
表1 相关参数
Table1 Relevant parameters

参数 水平频率(f0) 22 000 Hz超声在水中衰减系数 0.025 Np/m超声在对虾肉中衰减系数 0.5 Np/m[19-20]水的潜热(L) 333.6 kJ/kg[21]功率(PW) 200 W
1.3.2 超声辅助解冻的理论基础
超声辅助解冻是多物理场问题,其中传热控制方程见式(1)。
式中:T表示对虾的温度/℃;t表示解冻时间/s;ρ表示虾肉的密度/(kg/m3);Cp表示对虾的比热容/(J/(kg·K));k表示对虾的热导率/(W/(m·K));Q0表示单位体积物料所吸收的超声能量/(W/m3)。
Q0、声压(P)、声强(I)的计算分别见式(2)~(4)。

由式(3)、(4)得式(5)。
式中:ω表示超声的角频率/(rad/s);α表示超声在物料中的衰减系数/m-1;A表示超声探头的振幅/m;c表示声波在物料中的传播速率/(m/s)。
1.3.3 边界条件及初始条件
对虾底面在解冻过程中一直与镂空金属支撑网接触,但因其导热作用小,故忽略不计。对虾与解冻装置中的水发生对流换热,视为第三类边界条件[22],具体由式(6)表示。
式中:h是对流传热系数,超声辅助解冻时取350 W/(m2·K),水解冻时取200 W/(m2·K)[23];T是对虾的表面温度/℃;T水表示介质水的温度(15 ℃)。
冻结的对虾内部各项均匀,温度一致,因此对虾的初始条件方程由式(7)表示。
式中:T0是对虾的初始温度(-18 ℃)。
1.3.4 对虾热物性参数的确定
对虾在解冻过程中会发生相变,大部分冰晶融化成水,其热物性会发生较大变化。为准确模拟和预测冻结过程中的温度场及解冻时间,故采用分段多项式数学模型来反映对虾的热物性变化规律[18]。确定对虾的主要成分是合理计算对虾热物理参数的基础,经测定,其主要成分水分、蛋白质、灰分、脂肪的质量分数分别近似为78%、19%、2%、1%。各组分的热物理性质参考李云飞等[25]编著的《食品工程原理》。
由冯亦步[26]的研究可知,虾中冰的质量分数(ω冰)、已解冻的水的质量分数(ωw)计算分别见式(8)、(9)。
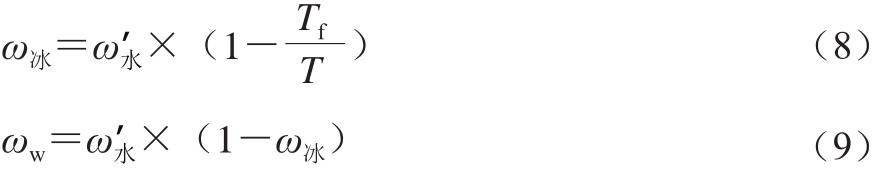
式中:Tf是初始冻结温度/℃;T是虾体温度/℃;ω’水是对虾中总的水分质量分数/%;根据冻结曲线可知,对虾的Tf为-2 ℃;ω冰是对虾中在解冻过程中冰的质量分数。
早期对食品解冻的模拟大多假设食品热物性参数在解冻过程中为常数,而实际上食品的热物性参数在解冻过程中有较大的变化,特别是含水量高的食品。食品解冻发生在一定的温度范围内而非某一特定温度,由于解冻涉及到食品中水的相变过程,需要吸收大量的相变潜热,同时食品的密度、比热容和热导率等热物理性质会随着解冻的进行不断发生变化。本实验模拟采用固定网格法中的显热容法对潜热释放进行处理,即把相变潜热看作是在相变区域内有一个很大的显热容,这样就能将分区描述的控制方程及界面能量守恒条件转化成在整个区域上适用的单一非线性导热方程。同时采用变热物性方程来反映中国对虾在解冻过程中热物性参数随温度变化而相应变化的值[21]。
对虾比热容(Cp/(J/(kg·K)))、热导率(k/(W/(m·K)))、密度(ρ/(kg/m3))的计算分别见式(10)~(12)[26-27]。

式中:ωi表示各组分的质量分数/%;Cpi表示各组分对应的比热容/(J/(kg·K));L表示水的潜热/(J/mol);ki表示各组分对应的热导率/(W/(m·K);ρi表示各组分对应的密度/(kg/m3)。
对虾的比热容、热导率以及密度随温度变化的趋势如图3所示。
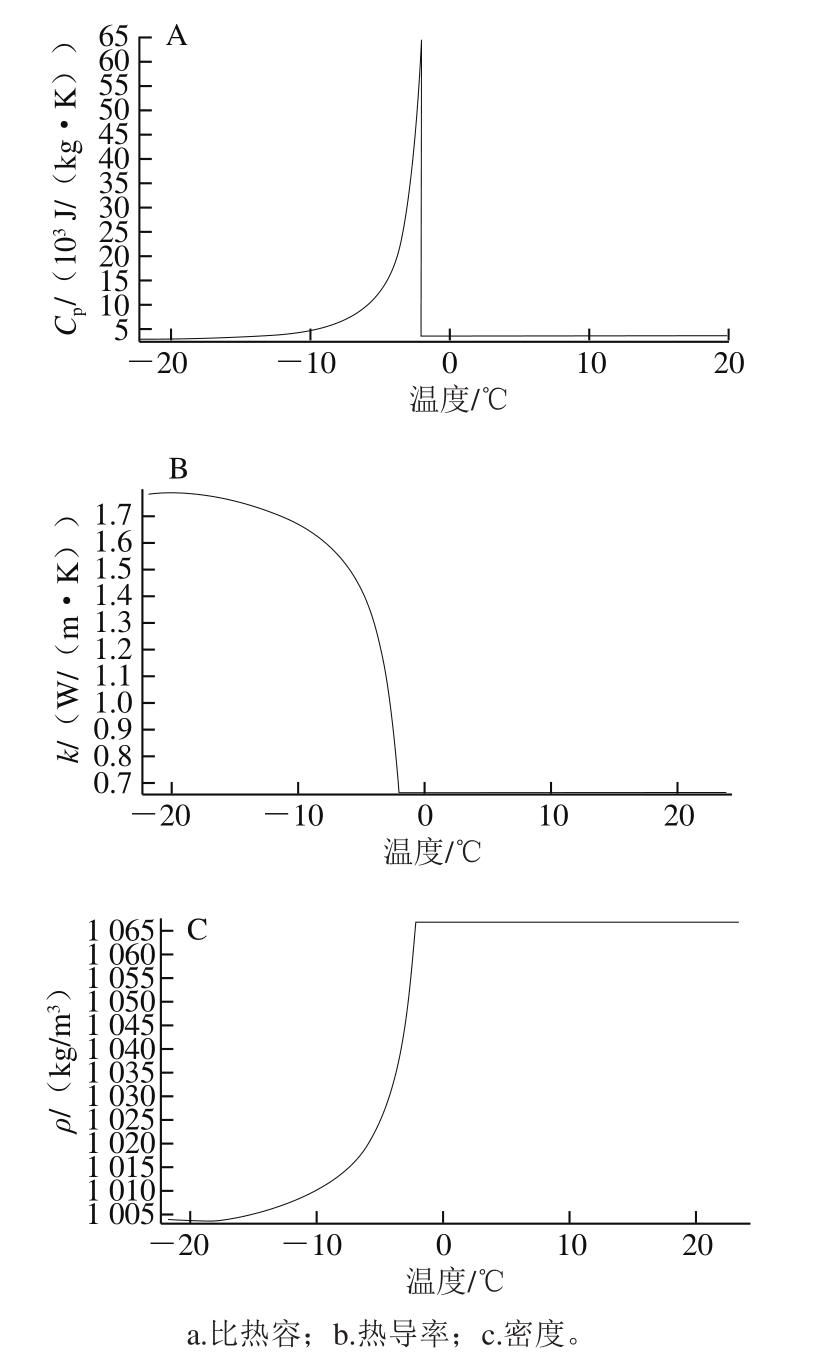
图3 对虾随温度变化的热物性参数
Fig.3 Thermal properties of Chinese shrimp as a function of temperature
1.3.5 模型的验证以及超声辅助解冻对中国对虾蛋白变性的影响
选用与模型大小、形态近似的新鲜对虾,冰水致死后,去头、尾鳍。将温度探头插入至对虾最大截面处的中心位置,即虾体几何中心部位视为对虾的温度最低点,用来记录对虾在解冻过程中中心温度的变化。对虾在-18 ℃下冻藏48 h后,取出并置于超声辅助解冻装置中进行超声辅助解冻,超声强度为0.2 W/mL。对照组是在相同条件下仅去掉超声作用的静水解冻。其中,解冻介质均恒温在15 ℃。
为了验证有限元模拟模型的精度,采用均方根误差(root mean square error,RMSE)(式(13))对模拟及实测结果间的差异进行统计检验。
式中:Tm表示模拟温度/℃;T表示对虾的实测中心温度/℃;i表示数据节点编号;n表示数据点总数。
为探究超声辅助解冻对中国对虾蛋白变性的影响,取解冻后的样品进行以下指标测定。
1.3.5.1 肌原纤维蛋白的提取
肌原纤维蛋白提取按照Lefevre等[28]的方法并进行适当修改。称取4.00 g样品,与缓冲液A(20 mmol/L磷酸盐缓冲液,含有100 mmol/L NaCl、1 mmol/L EDTA,pH 7.0)按1∶10(m/V)混合均匀,15 000 r/min匀浆60 s,6 000 r/min、4 ℃离心10 min,取沉淀。再加入5 倍体积缓冲液A,相同条件下离心取沉淀。重复以上操作2 次,最后沉淀中加入缓冲液B(25 mmol/L磷酸盐缓冲液,含有0.6 mol/L NaCl,pH 7.0),匀浆后冰浴溶解2 h,过滤去除不溶性部分,滤液即为肌原纤维蛋白溶液。以牛血清白蛋白作标准曲线,考马斯亮蓝法测定蛋白质量浓度,并用缓冲液B调节蛋白质量浓度。
1.3.5.2 肌原纤维蛋白的SDS-PAGE图谱
参照Laemmli[29]的方法,并加以调整。向一定质量浓度的肌原纤维蛋白样品中加入缓冲液B,使各蛋白样品的最终质量浓度一致,加1×上样缓冲液,沸水浴5 min。上样量为10 μL,选择恒压条件,4%浓缩胶恒压80 V条件下进行电泳,待样品进入12%分离胶后,调节电压至120 V,继续电泳,直到溴酚蓝跑至凝胶底部,关闭电源。将胶取出,加入适量的考马斯亮蓝染色液R250,染色30 min。染色完毕后,回收染色液,加入适量脱色液,置于摇床脱色过夜,直至凝胶上的背景色完全脱去。
1.3.5.3 解冻处理后蛋白的荧光光谱分析
将肌原纤维蛋白溶液稀释至0.1 mg/mL,运用荧光分光光度计在室温25 ℃环境下进行样品的荧光扫描测定,采用1 cm光径的四面透光的石英比色皿,出射和入射的狭缝宽度均为5 nm。样品在280 nm波长处被激发,290~500 nm发射波长下进行扫描测定;以磷酸盐缓冲溶液作为空白对照。
1.3.5.4 对虾肌肉蛋白热稳定性测定
对虾去头去壳后,取第二腹节处约15 mg左右的肌肉,平铺于DSC仪铝质样品盘中,用配套铝盖压盖密封处理,需称量记下虾肌肉样品的精确质量,以空白铝盘作为对照。DSC仪工作条件为:N2(99.99%纯度)流速40 mL/min;20 ℃平衡2 min。以5 ℃/min的升温速率从20 ℃升温至100 ℃,记录该升温范围内的吸热变性曲线。用与DSC仪连接的TA Universal分析软件来探究解冻处理对虾肉肌肉蛋白DSC图谱各峰的变性温度以及变性焓的影响。
每次测定至少设置3 次平行,测定结果以平均值±标准差表示。采用SPSS 20软件进行数据分析,采用ANOVA进行邓肯氏(Duncan)差异显著性分析,P<0.05表示差异显著。
2.1.1 对虾在解冻过程中最大截面处的温度分布
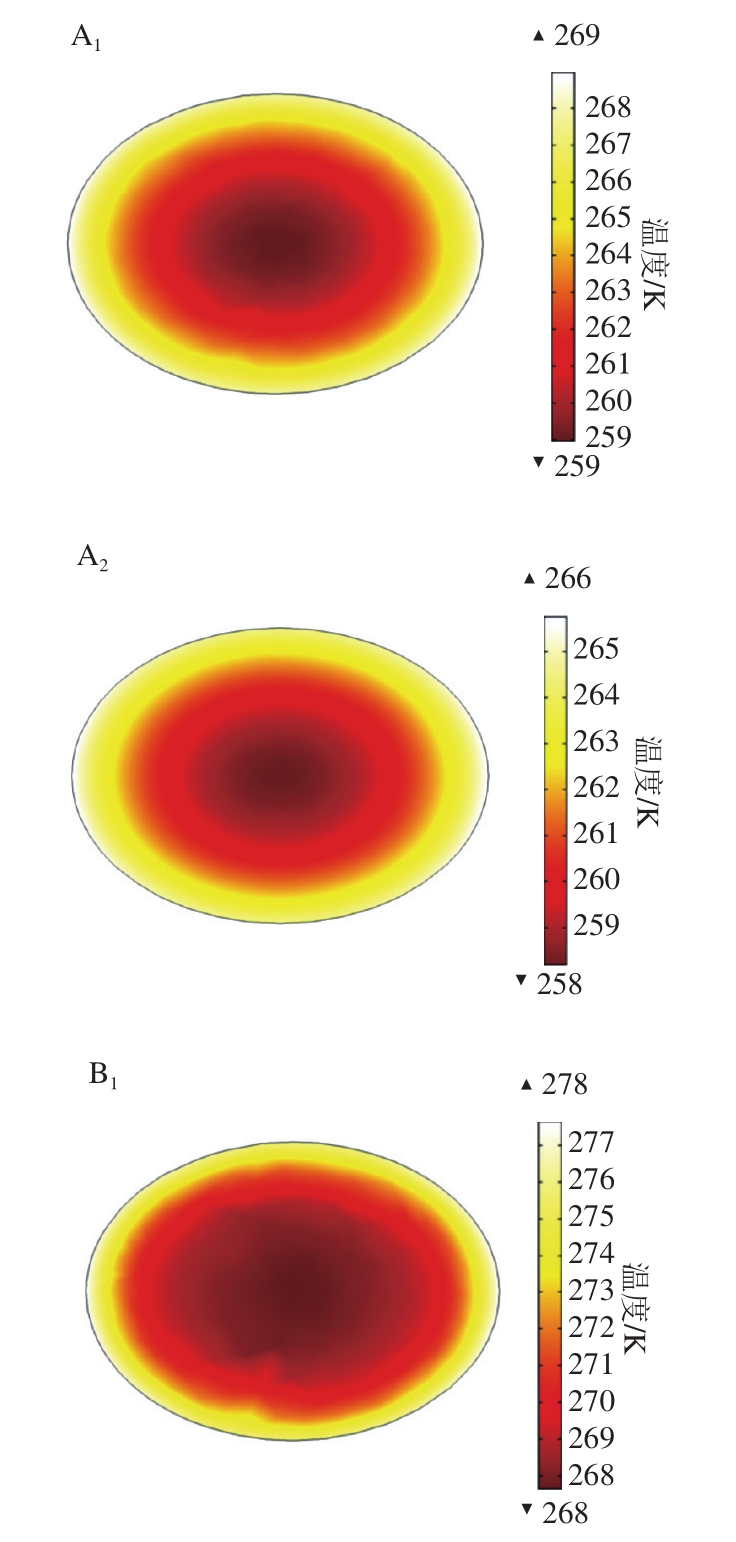
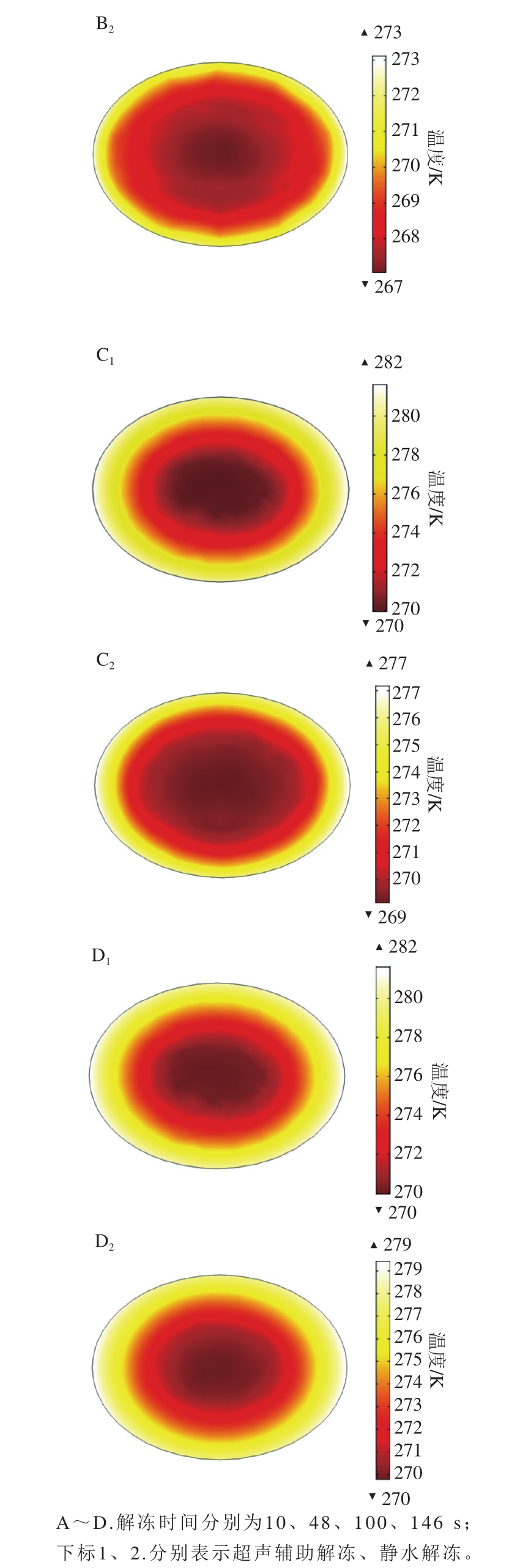
图4 不同解冻时间的切面温度场
Fig.4 Internal cross-sectional temperature fields at different thawing times
对虾解冻所需的热量以超声衰减产热和与介质的热交换为主,取解冻10、48、100、146 s时对虾最大截面处的温度分布来观察。超声辅助解冻和静水解冻时对虾温度分布如图4所示。由模拟结果可知,解冻到10 s时,对虾与介质水发生剧烈的热交换,其边缘部分迅速升温,而内部温度依旧较低;超声辅助解冻的对虾内部整体温度高于静水解冻组,且低温区的面积小于静水解冻组的低温面积。解冻到48 s时,对虾表面的温度依旧升高得较快,超声辅助解冻的对虾整体进入相变区,最低温度为-5 ℃,低温区在逐渐减少;静水解冻的对虾边缘升温迅速,但内部低温区的面积仍然较大,热量由外向里逐渐传导。当解冻到100 s时,超声辅助解冻的对虾仅一小片区域处于相变区;静水解冻的对虾解冻完成区域从边缘到中心逐渐增加,但中心的一大片区域仍处于相变阶段。解冻至146 s时,超声辅助解冻的对虾最低温度达到-1 ℃,解冻完成;而静水解冻的对虾中心部分仍处于相变区,根据计算结果可知,当解冻至208 s时,才完成解冻。由此可知,超声辅助解冻过程中,一方面对虾内部组织吸收超声衰减所产生的能量从而加速解冻进程;另一方面超声促进对虾与介质的热交换,因而解冻速率显著大于静水解冻组。
2.1.2 实验验证

图5 超声辅助解冻(A)和静水解冻(B)时中国对虾中心温度模拟值和实测值对比
Fig.5 Comparison of measured and simulated values of internal temperature of Chinese shrimp during ultrasound-assisted thawing (A)and water immersion thawing (B)
为了判断COMSOL软件模拟的准确性,本研究设计实验来进行验证。如图5A所示,超声辅助解冻时,COMSOL软件计算得到的中心温度达到-1 ℃所需时间为146 s,实验测得的时间为132 s,较为接近。在解冻的整个阶段,模拟值与实验值拟合较好,RMSE为0.943 3 ℃。图5B是对照组静水解冻中心温度实验值和模拟值的对比,计算得到的中心温度到达-1 ℃所需时间为208 s,实验测得的时间为206 s,较为接近,RMSE为0.907 7 ℃。结果表明,COMSOL软件模拟能较好地反映超声辅助解冻过程中温度分布和变化趋势,本模型具有一定的精确性。
同时可以看出,超声辅助解冻的解冻速率远远大于对照组,解冻时间缩短了35.9%;尤其在相变期,超声辅助解冻能快速通过此阶段,降低对冻藏食品品质的损害,是一种快速有效的解冻方式。
2.2.1 解冻处理对对虾肌原纤维蛋白SDS-PAGE的影响
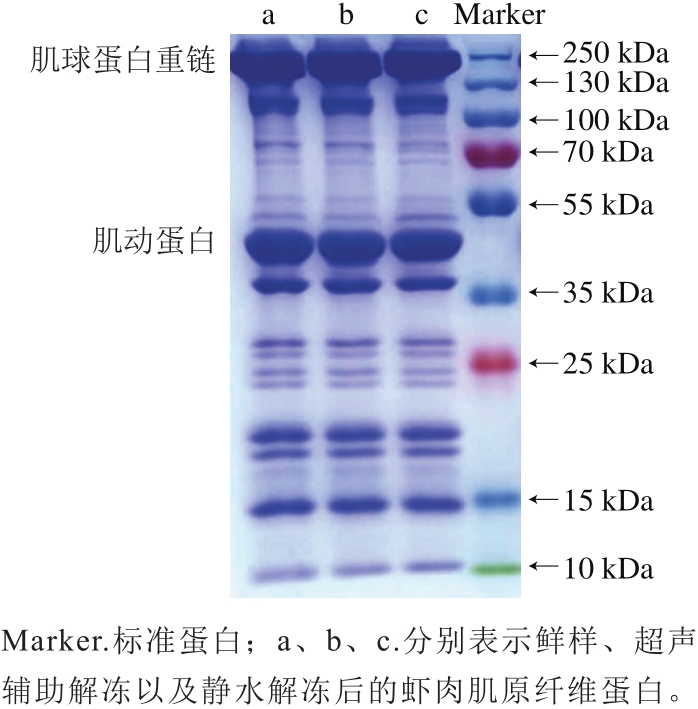
图6 中国对虾肌原纤维蛋白的SDS-PAGE图谱
Fig.6 SDS-PAGE patterns of Chinese shrimp myofibril proteins
SDS-PAGE图谱常用来表征蛋白质的聚集或裂解变性情况。电泳图谱的主要条带包括分子质量为220 kDa的肌球蛋白重链、43 kDa的肌动蛋白、36 kDa的原肌球蛋白[30]。如图6所示,解冻处理后肌球蛋白重链与肌动蛋白同鲜样对照组无显著性差异,表明在肌原纤维蛋白中,解冻处理对这几种主要蛋白没有明显的影响。与鲜样对照组相比,解冻后分子质量为70~100 kDa的蛋白条带颜色轻微地变浅或加深,表明蛋白发生一定程度的降解和交联;这主要是在冻结、解冻解冻过程中,蛋白质受自身蛋白酶和细菌蛋白酶的共同作用发生分解所引起的[31]。
2.2.2 解冻处理对对虾肌原纤维蛋白荧光色谱的影响

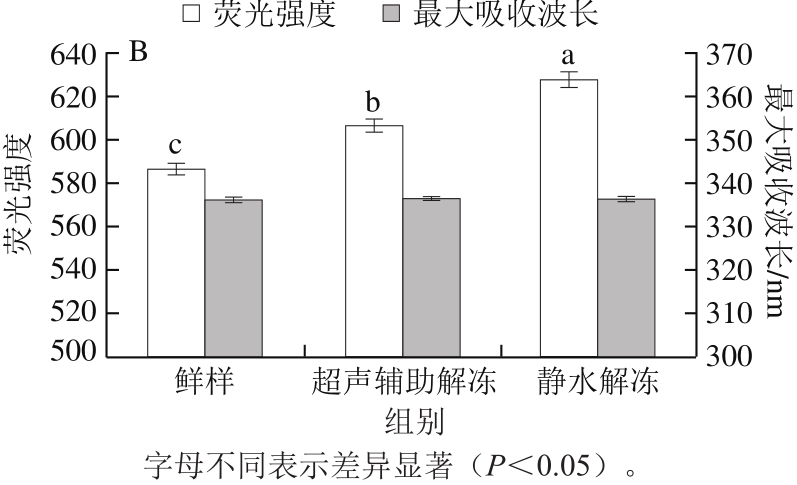
图7 解冻处理对对虾肌原纤维蛋白内源荧光的影响
Fig.7 Effect of thawing treatment on the intrinsic fluorescence intensity of shrimp myofibrillar protein
蛋白的内源荧光主要来自于色氨酸(Trp)和酪氨酸(Tyr)残基,常作为内源荧光探针来研究溶液状态下蛋白质的构象[32]。虾肉肌原纤维蛋白经解冻处理后其内源荧光强度的变化如图7所示,解冻处理对肌原纤维蛋白的最大吸收波长没有发生显著性改变,均为336 nm,未检测出肌原纤维蛋白荧光发射峰的红移或蓝移现象,说明Trp和Tyr残基微环境极性没有发生明显变化。但解冻后肌原纤维蛋白的荧光强度显著上升,荧光强度的增加主要由于蛋白质疏水残基的暴露,即肌原纤维蛋白的Trp部分展开[33]。这表明解冻处理对蛋白的高级结构有一定的影响,使得蛋白构象发生变化,让更多的发色基团暴露;尤其是静水解冻,对蛋白构象影响较大。
2.2.3 解冻过程对对虾肌肉蛋白热稳定性的影响
表2 解冻处理对中国对虾虾肉蛋白热稳定性的影响
Table2 Influence of thawing treatment on thermal stability of Chinese shrimp muscle

注:峰I.代表肌球蛋白质头部引起的热流变化;峰II.代表肌球蛋白尾部和肌浆蛋白引起的热流变化;峰III.代表肌动蛋白引起的热流变化[1]。同列肩标小写字母不同表示差异显著(P<0.05)。
解冻方式 峰I 峰II 峰III变性温度/℃ 变性焓/(J/g) 变性温度/℃ 变性焓/(J/g) 变性温度/℃ 变性焓/(J/g)鲜样 48.11±0.11 1.16±0.01 64.05±0.09c0.25±0.01 81.16±0.21 0.29±0.02a超声辅助解冻 47.72±0.99 1.05±0.16 65.84±0.24b0.23±0.05 80.82±0.51 0.25±0.05a静水解冻 48.43±0.67 1.01±0.07 66.86±0.33a0.25±0.04 80.73±0.76 0.17±0.02b
表2显示了解冻过程对虾肉峰I、峰II、峰III变性温度和变性焓值的影响。解冻后虾肉蛋白峰I的变性焓值有一定程度的下降,但没有显著性变化;峰II的变性温度均显著性上升,变性焓无显著性变化;峰III的变性焓值下降,尤其是静水解冻后的虾肉蛋白,变性焓显著性下降。因此可知,解冻处理对虾肌肉蛋白的热稳定性影响较小,超声辅助解冻由于具有较快且较为稳定的特点,解冻后的虾肉蛋白热稳定性接近鲜样,蛋白变性程度低,静水解冻后蛋白热稳定性降低。其中肌浆蛋白对解冻处理有较强的稳定性,由于其较稳定的结构特点,解冻不会导致其彻底变性,只会降低其变性温度;而肌动蛋白则较易受到影响,变性程度较大。
和传统解冻方式相比,超声辅助解冻展现出了较高的工业价值,能显著提高解冻速率的同时并较好地保持食品的品质。利用COMSOL软件对超声辅助解冻过程进行数值模拟,模拟值和实验值较为接近,其中超声辅助解冻的RMSE为0.943 3 ℃,对照组的RMSE为0.907 7 ℃,验证了模型的准确性;且超声辅助解冻的时间比对照组缩短了35.9%。
解冻处理后,对于蛋白的一级结构来说,占主要成分的肌球蛋白重链和肌动蛋白没有发生变化,但有一部分蛋白条带颜色变浅或加深,发生轻微的降解或聚集。从荧光光谱来看,最大吸收波长均无显著变化,但荧光强度均一定程度增加,尤其是静水解冻后,荧光强度增加幅度较大,造成肌原纤维蛋白的Trp残基较多暴露。超声辅助解冻后,对虾肌肉的热稳定性接近鲜样,而静水解冻后,其肌动蛋白的变性焓值显著下降,热稳定性变差。
综上所述,相较于静水解冻,超声辅助解冻对虾是一种高效的解冻方式,在快速解冻的同时能较好地保持中国对虾的品质,这种解冻方式值得更深一步的研究。
[1] 郭云峰,赵文武. 2007年中国渔业统计年鉴[M]. 北京: 中国农业出版社, 2017: 21-36.
[2] 李银, 孙红梅, 张春晖, 等. 牛肉解冻过程中蛋白质氧化效应分析[J]. 中国农业科学, 2013, 46(7): 1426-1433. DOI:10.3864/j.issn.0578-1752.2013.07.013.
[3] 张春晖, 李侠, 李银, 等. 低温高湿变温解冻提高羊肉的品质[J]. 农业工程学报, 2013, 29(6): 267-273.
[4] CHENG X F, ZHANG M, XU B G, et al. The principles of ultrasound and its application in freezing related processes of food materials:a review[J]. Ultrasonics-Sonochemistry, 2015, 27: 576-585.DOI:10.1016/j.ultsonch.2015.04.015.
[5] 迟海, 李学英, 杨宪时, 等. 解冻方式和条件对南极磷虾品质的影响[J]. 食品与机械, 2011, 27(1): 94-97. DOI:10.3969/j.issn.1003-5788.2011.01.027.
[6] ALARCON-ROJO A D, JANACUA H, RODRIGUEZ J C, et al.Power ultrasound in meat processing[J]. Meat Science, 2015, 107: 86-93. DOI:10.1016/j.meatsci.2015.04.015.
[7] WU X F, ZHANG M, ADHIKARI B, et al. Recent developments in novel freezing and thawing technologies applied to foods[J]. Critical Reviews in Food Science & Nutrition, 2015, 57(17): 3620-3631. DOI:10.1080/10408398.2015.1132670.
[8] LI Bin, SUN Dawen. Novel methods for rapid freezing and thawing of foods: a review[J]. Journal of Food Engineering, 2002, 54(3): 175-182.DOI:10.1016/S0260-8774(01)00209-6.
[9] GAMBUTEANU C, ALEXE P. Comparison of thawing assisted by low-intensity ultrasound on technological properties of pork longissimus dorsi muscle[J]. Journal of Food Science & Technology,2015, 52(4): 2130-2138. DOI:10.1007/s13197-013-1204-7.
[10] 黄智, 严荣军, 李瑞, 等. 采后热风与热水处理杀虫的水果温度场有限元模拟[J]. 农业工程学报, 2014, 30(2): 252-259.
[11] BIRLA S L, WANG S, TANG J. Computer simulation of radio frequency heating of model fruit immersed in water[J]. Journal of Food Engineering, 2008, 84(2): 270-280. DOI:10.1016/j.jfoodeng.2007.05.020.
[12] PITCHAI K, CHEN J J, BIRLA S, et al. Modeling microwave heating of frozen mashed potato in a domestic oven incorporating electromagnetic frequency spectrum[J]. Journal of Food Engineering,2016, 173: 124-131. DOI:10.1016/j.jfoodeng.2015.11.002.
[13] UYAR R, BEDANE T F, ERDOGDU F, et al. Radio-frequency thawing of food products: a computational study[J]. Journal of Food Engineering, 2015, 146: 163-171. DOI:10.1016/j.jfoodeng.2014.08.018.
[14] LUCAS T, FLICK D, CHOUROT J M, et al. Modeling and control of thawing phenomena in solute-impregnated frozen foods[J]. Journal of Food Engineering, 2000, 45(4): 209-218. DOI:10.1016/S0260-8774(00)00058-3.
[15] PURLIS E. Bread baking: technological considerations based on process modelling and simulation[J]. Journal of Food Engineering,2011, 103(1): 92-102. DOI:10.1016/j.jfoodeng.2010.10.003.
[16] GOÑI S M, PURLIS E. Geometric modelling of heterogeneous and complex foods[J]. Journal of Food Engineering, 2010, 97(4): 547-554.DOI:10.1016/j.jfoodeng.2009.11.017.
[17] 杨小梅. 对虾冷冻过程的温度分析及其数值模拟[D]. 杭州: 浙江大学, 2014: 30-37.
[18] 申志远, 刘斌, 杨瑞丽, 等. 西兰花速冻过程温度分布的数值模拟研究[J]. 食品科技, 2014, 39(5): 52-55. DOI:10.13684/j.cnki.spkj.2014.05.013.
[19] DUCK F A. Chapter 4: acoustic properties of tissue at ultrasonic frequencies[M]//DUCK F A. Physical properties of tissue.Massachusetts: Academic Press, 1990: 73-135. DOI:10.1016/B978-0-12-222800-1.50008-5.
[20] 宋健. 基于仿组织材料的超声衰减系数测量研究[D]. 北京: 北京化工大学, 2015: 20-30.
[21] DIMA J B, SANTOS M V, BARON P J, et al. Experimental study and numerical modeling of the freezing process of marine products[J].Food and Bioproducts Processing, 2014, 92(1): 54-66. DOI:10.1016/j.fbp.2013.07.012.
[22] 李杰, 谢晶. 鼓风冻结虾仁时间的数值模拟及实验验证[J]. 农业工程学报, 2009, 25(4): 248-252; 318.
[23] KIANI H, ZHANG Z H, SUN D W. Experimental analysis and modeling of ultrasound assisted freezing of potato spheres[J].Ultrasonics Sonochemistry, 2015, 26: 321-331. DOI:10.1016/j.ultsonch.2015.02.015.
[24] VOLLER V. An overview of numerical methods for solving phase change problems[J]. Advances in Numerical Heat Transfer, 1996, 1:341-375.
[25] 李云飞, 葛克山. 食品工程原理[M]. 北京: 中国农业大学出版社,2009: 205-210.
[26] 冯亦步. 冻结食品热物性的计算及应用[J]. 天津商业大学学报,1997(3): 1-7. DOI:10.15963/j.cnki.cn12-1401/f.1997.03.001.
[27] SANTOS M V, LESPINARD A R. Numerical simulation of mushrooms during freezing using the FEM and an enthalpy: Kirchhoff formulation[J]. Heat and Mass Transfer, 2011, 47(12): 1671-1683.
[28] LEFEVRE F, FAUCONNEAU B, THOMPSON J W, et al. Thermal denaturation and aggregation properties of Atlantic salmon myof i brils and myosin from white and red muscles[J]. Journal of Agricultural and Food Chemistry, 2007, 55(12): 4761-4770. DOI:10.1021/jf063045d.
[29] LAEMMLI U K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J]. Nature, 1970, 227: 680-685.
[30] 常海霞, 石燕, 王辉, 等. 超声波对草鱼肌肉肌原纤维蛋白溶液理化特性的影响[J]. 食品科学, 2015, 36(5): 56-60. DOI:10.7506/spkx1002-6630-201505011.
[31] 李姣, 李学鹏, 励建荣, 等. 冷藏条件下中国对虾肌肉蛋白质的生化特性[J]. 食品科学, 2011, 32(5): 16-21.
[32] 涂宗财, 马达, 王辉, 等. 超声波对鸡肉肌浆蛋白理化性质和结构的影响[J]. 食品科学, 2013, 34(19): 32-36. DOI:10.7506/spkx1002-6630-201319008.
[33] CHENG L N, SUN D W, ZHU Z W, et al. Effects of high pressure freezing (HPF) on denaturation of natural actomyosin extracted from prawn (Metapenaeus ensis)[J]. Food Chemistry, 2017, 229: 252-259.DOI:10.1016/j.foodchem.2017.02.048.
Numerical Simulation of Ultrasound-Assisted Thawing of Frozen Chinese Shrimp (Fenneropenaeus chinensis) and Its Impact on Protein Denaturation