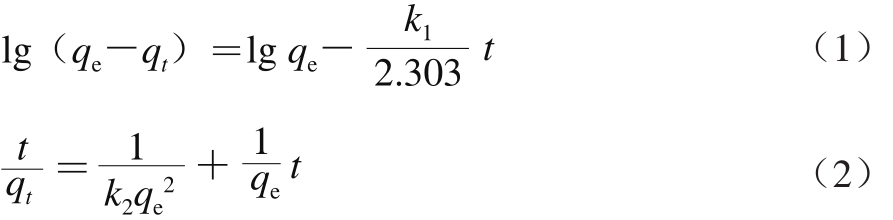
蓝莓果渣主要是在蓝莓果汁和果酒加工过程中产生的,目前这些果渣除了少量用作饲料和肥料外,大多数作为废物而废弃,造成极大的浪费和环境污染,亟待寻找有效的利用途径。蓝莓果渣中富含的花色苷,作为自然界中一类具有类黄酮结构的天然水溶性色素,具有抗动脉硬化[1]、抗衰老[2]和改善光诱导的视网膜病变[3]等功能。因此,选择一种恰当的花色苷提取分离方式具有重要意义。
生物吸附富集法利用某些细菌、真菌、藻类和生物质等生物吸附剂对水溶液中重金属离子、染料或酚类物质等进行吸附和富集,以达到某些目的[4-6]。它作为一种高效、绿色、经济的新兴方法,具有很大的研究价值。目前,从蓝莓渣中提取花色苷的方法主要有溶剂萃取法、超声波辅助提取法、酶解辅助提取法等,但这些非生物吸附富集方法均存在提取效率低、能耗大、溶剂残留量大等缺点[7];因此生物吸附剂在花色苷分离纯化方面的应用成为研究热点[8-11]。废啤酒酵母生物吸附剂是啤酒生产过程中的副产物,因其具有成本低廉和吸附特异性强等优点而在生物吸附领域具有广阔的应用前景。目前,废啤酒酵母较多地用于金属离子[12-13]和染料[14-15]吸附,但吸附富集花色苷的报道较少。Stafussa等[11]研究发现,在温度25 ℃、转速140 r/min和吸附时间2 h条件下,废啤酒酵母对葡萄渣提取物中花色苷的吸附量为1.335 mg/g,该结果表明废啤酒酵母对花色苷具有很好的吸附效果。
近年来,超声波技术被应用到生物吸附研究中,超声辅助吸附主要是利用超声波产生强烈的空化效应增强液相质点的运动,强化固-液两相的传质过程,从而提高吸附速率和吸附量[16-17]。Gupta等[16]利用改性西瓜皮吸附污水中的铜离子,发现振荡条件下达到吸附平衡时间为60 min,而90 W超声条件下仅为20 min,吸附速率显著提高;Djelloul等[17]采用水飞蓟籽粉吸附水溶液中的亚甲基蓝染料,结果表明,30 W和60 W超声条件下的吸附量分别比常规吸附高27.07%和82.17%。
关于描述吸附剂或生物吸附剂分离纯化花色苷过程的动力学模型主要有Lagergren一级动力学模型、二级动力学模型和粒子内扩散模型[11,18],等温吸附模型主要有Langmuir、Freundlich、Temkin和Dubinine-Radushkevich等[11,19]。Stafussa等[11]利用废啤酒酵母对葡萄渣提取物中的花色苷进行吸附,并研究了其吸附过程中的动力学和热力学特性,结果表明Lagergren二级动力学模型和Temkin等温吸附模型对其吸附过程具有更好的模拟效果。
因此,本研究选择啤酒厂的废啤酒酵母作为吸附剂,首先对静置、水浴振荡与超声波辅助废啤酒酵母吸附蓝莓渣中花色苷的效果进行了比较,然后考察了吸附时间、超声强度、吸附温度和蓝莓渣提取液中花色苷初始质量浓度对废啤酒酵母吸附蓝莓渣中花色苷的影响,在此基础上对吸附前后单体花色苷组分变化、吸附动力学、等温吸附模型和吸附机制进行了初步分析,旨在为超声波辅助废啤酒酵母吸附分离蓝莓渣中花色苷的工艺提供理论依据。
蓝莓(品种‘Garden blue’),由江苏省南京市溧水蓝莓种植基地提供,2016年7月采摘、洗净和榨汁后得到的果渣于-18 ℃贮藏备用;废啤酒酵母泥由青岛啤酒股份有限公司科研开发中心提供,于-18 ℃贮藏备用。
三氟乙酸和乙腈(色谱纯) 国药集团化学试剂有限公司;溴化钾(光谱纯) 上海源叶生物科技有限公司;飞燕草色素-3-葡萄糖苷、矢车菊素-3-葡萄糖苷、芍药色素-3-葡萄糖苷、锦葵色素-3-半乳糖苷、锦葵色素-3-葡萄糖苷、锦葵色素-3-阿拉伯苷(标准品)美国Sigma公司;其他试剂均为分析纯。
LSHZ-300冷冻水浴恒温振荡器 江苏太仓市实验设备厂;CKDC-1006程序控温低温恒温浴槽 南京凡帝朗信息科技有限公司;VCX130超声波细胞破碎仪美国Sonics公司;IR100傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)仪 美国Nicolet公司;1200高效液相色谱(high performance liquid chromatography,HPLC)仪 美国安捷伦公司。
1.3.1 废啤酒酵母冻干粉制备
参照Stafussa等[11]的方法并稍加修改。用蒸馏水将废啤酒酵母泥清洗3 遍后冷冻干燥,粉碎过100 目筛,得到的废啤酒酵母封装于铝箔袋内,置于干燥器中备用。
1.3.2 蓝莓渣花色苷的提取
参照Cui Chun等[20]的方法并稍加修改。蓝莓渣常温下避光解冻后,称取100 g蓝莓渣,以料液比1∶15(m/V)浸渍于pH 2、体积分数为50%的盐酸-乙醇溶液中,室温下浸提12 h后,5 000 r/min离心15 min,收集上清液,于-18 ℃贮藏备用。
1.3.3 静置、水浴振荡与超声波辅助废啤酒酵母吸附蓝莓渣提取液中花色苷
静置吸附:准确称取300 mg废啤酒酵母冻干粉于100 mL锥形瓶中,加入50 mL花色苷质量浓度为180 mg/L的蓝莓渣提取液(pH 2.0),在40 ℃条件下放置120 min。分别在0、5、10、20、30、45、60、90 min和120 min时吸取样液500 μL,10 000 r/min离心5 min,收集上清液测定总花色苷含量,并计算其吸附量。
水浴振荡辅助吸附:准确称取300 mg废啤酒酵母冻干粉于100 mL锥形瓶中,加入50 mL花色苷质量浓度为180 mg/L的蓝莓渣提取液(pH 2.0),在40 ℃、160 r/min条件下处理120 min,后续处理同静置吸附。
超声波辅助吸附:准确称取300 mg废啤酒酵母冻干粉于100 mL锥形瓶中,加入50 mL花色苷质量浓度为60~240 mg/L的蓝莓渣提取液(pH 2.0),在20~40 ℃温度和超声强度199~394 W/L条件下处理120 min,后续处理同静置吸附。
1.3.4 吸附模型
1.3.4.1 动力吸附模型
准确称取300 mg废啤酒酵母冻干粉于100 mL锥形瓶中,加入50 mL花色苷质量浓度为180 mg/L的蓝莓渣提取液,在394 W/L超声强度和20、30、40 ℃不同温度梯度下进行超声波辅助吸附120 min。分别在0、5、10、20、30、45、60、90 min和120 min时吸取样液500 μL,10 000 r/min离心5 min,收集上清液测定总花色苷含量,并计算其吸附量。本研究采用Lagergren一级动力学方程(式(1))和二级动力学方程(式(2))[11,18]对不同温度下的吸附数据进行拟合。
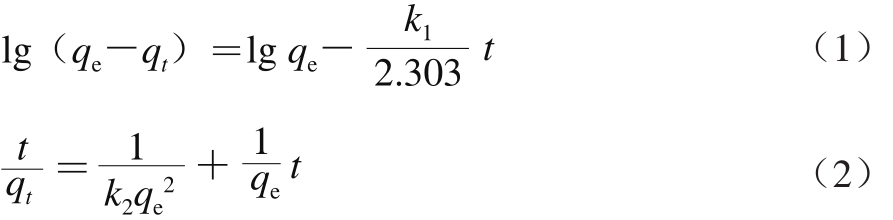
式中:qt为t时刻的花色苷吸附量/(mg/g);qe为平衡时的花色苷吸附量/(mg/g);t为吸附时间/min;k1为一级动力学速率常数/min-1;k2为二级动力学速率常数/(g/(mg·min))。
1.3.4.2 等温吸附模型
准确称取300 mg废啤酒酵母冻干粉于100 mL锥形瓶中,加入50 mL花色苷质量浓度为60~180 mg/L的蓝莓渣提取液,在超声强度为394 W/L、温度为40 ℃条件下进行超声波辅助吸附120 min。在120 min时吸取样液500 μL,10 000 r/min离心5 min,收集上清液测定总花色苷含量,并计算其吸附量。为了描述花色苷吸附过程中吸附平衡关系,本研究采用Freundlich等温吸附方程(式(3))和Temkin等温吸附方程(式(4))对得到的实验数据进行拟合[11,19]。

式中:KF/(L/g)、n为经验常数;ρe为平衡质量浓度/(mg/L);A为最大吸附量的平衡常数/(L/mg);bT为Temkin等温吸附常数/(kJ/mol);T为绝对温度/K;R为理想气体常数(8.314 J/(K·mol))。
1.3.5 分析与测试方法
1.3.5.1 花色苷含量和吸附量的测定
总花色苷含量用分光光度法测定[21]。将乙醇、水、盐酸三者按体积比69∶30∶1混合,配制成溶液,样品用此溶液稀释,于520 nm波长处测定吸光度(A520nm)。总花色苷质量浓度以每升蓝莓渣提取液中含有的锦葵色素-3-葡萄糖苷质量计。按公式(5)计算。
式中:d表示样品的稀释倍数。
花色苷吸附量计算见公式(6)[19]。
式中:qt为t时刻废啤酒酵母对花色苷的吸附量/(mg/g);ρ0为蓝莓渣花色苷提取液的初始质量浓度(mg/L);ρt为花色苷提取液t时刻的质量浓度/(mg/L);V为溶液总体积/mL;m为废啤酒酵母质量/mg。
1.3.5.2 吸附前后花色苷组分分析
参考Cui Chun等[20]的高效液相色谱法,并稍作修改。对吸附前的蓝莓渣花色苷提取液和在超声强度为394 W/L、温度为40 ℃条件下吸附后的蓝莓渣花色苷提取液进行HPLC分析,色谱柱为TC-C18。
1.3.5.3 吸附前后废啤酒酵母FTIR变化
参照Stafussa等[11]方法进行FTIR测定。将未吸附蓝莓渣花色苷的废啤酒酵母和在超声强度394 W/L、温度40 ℃条件下吸附蓝莓渣花色苷后的废啤酒酵母冷冻干燥,按照1∶100(m/m)的比例加入光谱纯溴化钾,充分研磨混合后,用压片机压成透明薄片,利用FTIR仪(400~4 000 cm-1波数范围内)分析吸附前后废啤酒酵母表面化学官能团的变化。
实验均重复均3 次,结果以平均值±标准差的形式表示,采用Excel 2007软件对数据进行拟合,采用SPSS 20.0最小显著性差异法(least-significant difference,LSD)进行差异显著性检验,P<0.05表示差异显著。
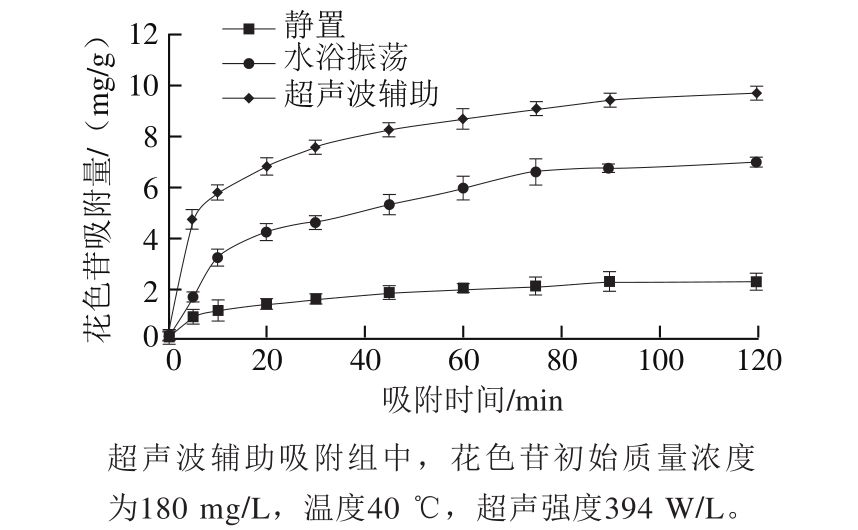
图1 不同方式下废啤酒酵母对蓝莓渣中的花色苷吸附量
Fig.1 Adsorption amounts of anthocyanins by waste beer yeast in different modes
由图1可知,静置、水浴振荡与超声波辅助废啤酒酵母吸附花色苷量均随吸附时间的延长呈现上升趋势,并且在前20 min内吸附速率较快,分别完成了吸附总量的60.64%、62.89%和70.11%。此后,吸附速率逐渐降低,直至120 min达到吸附平衡,随后花色苷吸附量增幅较为平缓。这可能是在吸附反应初期,啤酒酵母表面有大量活性吸附位点,溶液中的花色苷能够迅速与活性位点结合,因此吸附反应很容易进行;随着反应的继续,活性位点逐渐被占据,吸附开始变得缓慢,直至最后达到平衡[22]。
从图1还可看出,在20 min时,超声强度394 W/L下花色苷吸附效率达到70.11%,显著高于静置(60.64%)和水浴振荡条件下的吸附效率(62.89%)(P<0.05)。此后,超声条件下花色苷吸附效率和吸附量始终最高。在120 min达到吸附平衡时,超声条件下花色苷吸附量为9.69 mg/g,显著高于静置吸附的2.26 mg/g和振荡辅助吸附的7.03 mg/g(P<0.05)。因此,超声波辅助废啤酒酵母吸附花色苷的效果明显优于静置和振荡条件下的吸附效果。

图2 不同超声强度对废啤酒酵母吸附蓝莓渣花色苷的影响
Fig.2 Effect of ultrasonic power on biosorption of anthocyanins by waste beer yeast
由图2可知,在不同超声强度下,随着吸附时间的延长,废啤酒酵母对花色苷的吸附量均呈现上升的趋势,并且在前20 min内吸附速率较快,之后吸附变得缓慢,吸附速率显著降低(P<0.05),120 min时基本达到吸附平衡。吸附时间相同时,超声强度越强,吸附速率越大,吸附量越高,总体表现为不同超声强度对于花色苷吸附有显著性影响(P<0.05),199、279 W/L和394 W/L条件下的花色苷平衡吸附量分别为7.42、8.91、9.69 mg/g。这可能是超声产生强烈的空化效应,加快传质和传热速度,从而促进花色苷与啤酒酵母活性位点的结合,同时超声波产生的振荡作用加速了花色苷分子的扩散,可以极大地提高吸附效率和吸附量[16]。当然超声强度过高时,因超声空化作用产生的高温高压不仅会使酵母细胞壁破裂,同时花色苷也会发生降解,致使废啤酒酵母对花色苷的吸附能力下降[7,23]。

图3 不同超声处理温度对废啤酒酵母吸附蓝莓渣花色苷的影响
Fig.3 Effect of temperature on biosorption of anthocyanins by waste beer yeast
由图3可知,不同温度条件下,随着吸附时间的延长,废啤酒酵母对花色苷的吸附量均呈现上升趋势,且在前20 min内吸附速率较快,之后吸附速率逐渐降低,在120 min基本达到吸附平衡。在相同的时间间隔内,随着温度的升高,废啤酒酵母菌对花色苷的吸附量增加,但是变化并不显著(P>0.05),20、30 ℃和40 ℃条件下的花色苷平衡吸附量分别为9.15、9.37 mg/g和9.69 mg/g。这可能是在较高的温度条件下,酵母表面一些吸附位点被活化,并且花色苷分子运动速率加快,与酵母表面接触机会增多,从而促进花色苷与啤酒酵母活性位点的结合,使得吸附量变大[22]。从实际生产的耗能和经济方面考虑,废啤酒酵母菌对蓝莓渣花色苷的生物吸附在常温下进行更为合理。
由图4可知,废啤酒酵母菌对花色苷的平衡吸附量随着花色苷初始质量浓度的增大而增加。这可能是当初始花色苷质量浓度增大时,花色苷与酵母吸附剂之间的有效碰撞概率增大,从而使得平衡吸附量增加[17]。当花色苷初始质量浓度大于180 mg/L时,废啤酒酵母对花色苷的平衡吸附量增加缓慢,其吸附容量接近饱和,即废啤酒酵母对花色苷的最大吸附量达到9.69 mg/g左右。一方面可能是因为较高的花色苷质量浓度容易增加固-液之间的传质阻力,导致花色苷分子向啤酒酵母表面迁移的动力下降[22];另一方面,废啤酒酵母表面的吸附位点基本上与花色苷结合完全,几乎达到饱和状态,从而导致较高花色苷质量浓度条件下的平衡吸附量几乎不发生变化[24]。综合考虑吸附效率和吸附量,选取花色苷初始质量浓度为180 mg/L较为合适。

图4 蓝莓渣花色苷初始质量浓度对超声辅助废啤酒酵母吸附的影响
Fig.4 Effect of initial anthocyanin concentration on biosorption of anthocyanins by waste beer yeast
对温度20、30 ℃和40 ℃和超声强度394 W/L条件下得到的废啤酒酵母菌对花色苷的吸附动力学数据进行拟合,结果如表1所示。在不同温度下模拟得到的二级动力学方程比一级动力学方程能够更好地拟合实验结果,二级动力学方程的拟合结果的相关系数r均大于0.999,而一级动力学方程的相关系数r仅为0.97左右。另外,根据二级动力学方程计算得到的平衡吸附量qe比一级动力学方程计算出的平衡吸附量更接近实验得到的平衡吸附量(图3),并且随着温度的升高,其吸附速率常数k1和平衡吸附量理论值qe也增大,与之前不同温度梯度下的吸附实验结果相一致(图3)。这表明二级动力学模型能够很好地模拟废啤酒酵母对花色苷的吸附过程,也说明废啤酒酵母对花色苷的吸附是一个化学作用的过程[18]。Stafussa等[11]对废啤酒酵母对葡萄渣花色苷吸附数据进行动力学分析,证明二级动力学模型拟合效果最佳,相关系数r为0.989,qe为1.347 mg/g。Buran等[25]利用FPX66、XAD4和XAD7HP 3 种大孔树脂对蓝莓花色苷进行吸附特性研究,发现二级动力学模型比一级动力学模型拟合效果更好,相关系数r均大于0.99。
表1 一级和二级动力学模型基本参数及相关系数
Table1 Kinetic parameters of pseudo-first order and pseudo-second order models
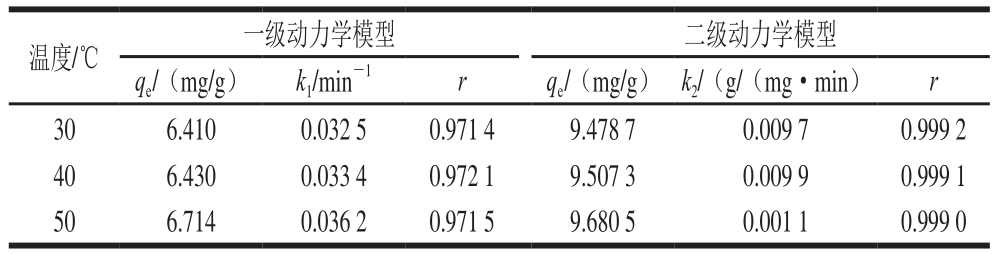
温度/℃ 一级动力学模型 二级动力学模型qe/(mg/g) k1/min-1r qe/(mg/g) k2/(g/(mg·min) r 30 6.410 0.032 5 0.971 4 9.478 7 0.009 7 0.999 2 40 6.430 0.033 4 0.972 1 9.507 3 0.009 9 0.999 1 50 6.714 0.036 2 0.971 5 9.680 5 0.001 1 0.999 0
为了描述超声波辅助啤酒酵母吸附花色苷过程中的吸附平衡关系,本研究选择Freundlich等温吸附方程和Temkin等温吸附方程对花色苷吸附过程进行分析。Freundlich等温吸附模型为经验模型,它假设吸附剂表面的吸附位点并非均匀分布,同时是在各种非理想条件下发生的多分子层吸附;Temkin等温吸附模型是一种单分子层吸附模型,它假定固体吸附剂表面是不均匀的,同时吸附过程的吸附自由能是其表面覆盖的作用,微分吸附热随表面覆盖度线性下降[11,19]。
表2 Freundlich和Temkin等温吸附模型拟合基本参数及相关系数
Table2 Parameters of Langmuir and Temkin isotherm models for biosorption of anthocyanins by waste beer yeast

温度/℃ 超声强度/(W/L)Freundlich等温吸附模型 Temkin等温吸附模型KF/(L/g) n r A/(L/mg) bT/(kJ/mol) r 40 394 0.055 1 1.030 5 0.978 1 0.041 4 0.482 2 0.995 3
由表2可知,采用Temkin等温吸附模型对花色苷吸附实验数据拟合时,线性相关性较好,相关系数r达到0.995 3,这表明Temkin等温吸附模型能较好地描述废啤酒酵母菌对蓝莓渣花色苷的吸附行为。Stafussa等[11]采用4 种等温吸附模型对废啤酒酵母菌吸附葡萄渣花色苷过程进行分析,结果发现,Temkin等温吸附模型拟合效果最好,相关系数r达到0.996 0,其他3 种模型拟合效果则较差。
实验数据用Freundlich等温吸附模型拟合时,也表现出了较好的线性关系,相关系数为0.978 1。本研究计算得到n=1.030 5,根据以前研究[11,26],当1<n<10时,表明吸附容易进行,且废啤酒酵母菌对蓝莓渣花色苷的吸附为优惠吸附;当1<1/n<2时,表明固体吸附剂的表面是不均匀的,即此吸附是在表面不均匀的体系下发生的。
参考Li Chunyang等[27]的研究结果,并结合前期HPLC-质谱(mass spectrometer,MS)结构鉴定结果可知,蓝莓渣中所含的主要单体花色苷为飞燕草色素-3-葡萄糖苷、矢车菊素-3-葡萄糖苷、芍药色素-3-葡萄糖苷、锦葵色素-3-半乳糖苷、锦葵色素-3-葡萄糖苷和锦葵色素-3-阿拉伯苷(图5A)。
采用HPLC分析吸附前后蓝莓渣中的单体花色苷成分,结果表明,废啤酒酵母对各种单体花色苷进行了不同程度的吸附,其中,对锦葵色素-3-葡萄糖苷的吸附率最高(31.48%),对芍药色素-3-葡萄糖苷的吸附率最低(20.97%)(表3),这与Mazzaracchio等[28]的研究结果相似。废啤酒酵母对各种花色苷吸附程度的差异可能与其化学结构相关,B环上羟基数量的增加和糖苷基团的减少可能会使花色苷吸附量升高。

图5 吸附前(A)和吸附后(B)蓝莓渣中花色苷HPLC图
Fig.5 HPLC chromatograms of blueberry pomace anthocyanins before (A) and after (B) biosorption
表3 吸附前后蓝莓渣中主要单体花色苷含量的变化
Table3 Changes in anthocyanin composition of blueberry pomace before and after biosorption
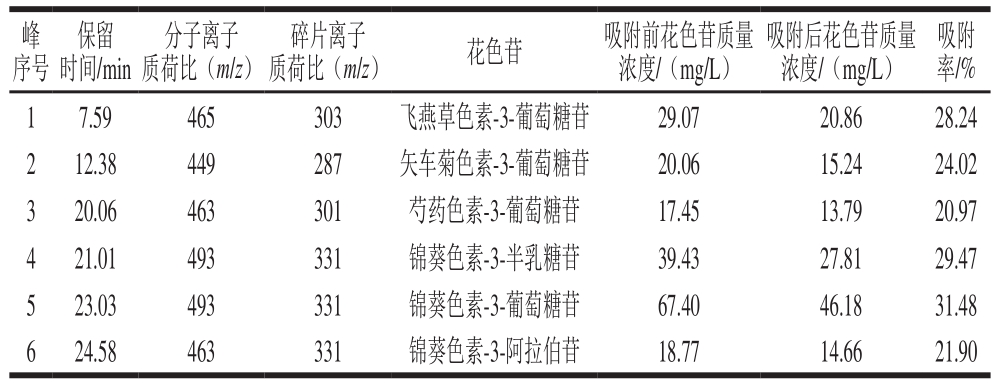
峰吸附率/%1 7.59 465 303 飞燕草色素-3-葡萄糖苷 29.07 20.86 28.24 2 12.38 449 287 矢车菊色素-3-葡萄糖苷 20.06 15.24 24.02 3 20.06 463 301 芍药色素-3-葡萄糖苷 17.45 13.79 20.97 4 21.01 493 331 锦葵色素-3-半乳糖苷 39.43 27.81 29.47 5 23.03 493 331 锦葵色素-3-葡萄糖苷 67.40 46.18 31.48 6 24.58 463 331 锦葵色素-3-阿拉伯苷 18.77 14.66 21.90序号保留时间/min分子离子质荷比(m/z)质荷比(m/z) 花色苷 吸附前花色苷质量浓度/(mg/L)碎片离子 吸附后花色苷质量浓度/(mg/L)
对吸附花色苷前后的废啤酒酵母官能团变化进行FTIR测定,采用OMNIC 8.0软件进行分析,结果如图6所示。通过查阅文献[11,16,18]可知,吸附前的废啤酒酵母主要在以下几处有吸收峰(图6A):3 289.86(—OH或—NH2)、2 925.43(—CH2)、1 638.31(酰胺基团Ⅰ带)、1 584.22(酰胺基团Ⅱ带)、1 453.92(C—OH)、1 245.46 cm-1(酰胺基团Ⅲ带)和1 042.13 cm-1(C—O—C或C—O)。在废啤酒酵母吸附花色苷后(图6B),3 289.86 cm-1处吸收峰移动到3 287.71 cm-1,可能是基于—OH或—NH2的伸缩振动作用;吸附后1 638.31 cm-1和1 245.41 cm-1处的吸收峰分别移动到1 627.94 cm-1和1 234.58 cm-1,1 584.22 cm-1处的吸收峰在吸附后消失,表明啤酒酵母表面的酰胺基团参与了花色苷的吸附作用;吸附后1 453.92 cm-1和1 042.13 cm-1处的吸收峰分别移动到1 451.00 cm-1和1 044.63 cm-1,表明啤酒酵母多糖所含的某些官能团在吸附过程中起到一定的作用。据报道,多酚类物质中的大量酚羟基与蛋白质主链的酰胺基(—C O N H),侧链上的羟基(—O H)、氨基(—NH2)以及羧基(—COOH)以氢键的形式多点结合,并且啤酒酵母细胞壁富含多聚糖,多聚糖中的大量羟基也可通过氢键的作用吸附花色苷[29-30]。由此可知,蛋白质和多糖物质中的氨基、羟基和酰胺基团在废啤酒酵母吸附花色苷的过程中起着关键作用。

图6 吸附前(A)和吸附后(B)废啤酒酵母傅里叶变换红外光谱图
Fig.6 FTIR spectra of waste beer yeast before (A) and after (B) biosorption
超声强度394 W/L下花色苷吸附量显著高于静置吸附量和振荡辅助吸附量(P<0.05);随着吸附时间的延长,废啤酒酵母对花色苷的吸附量增加,在120 min时基本达到吸附平衡;随着超声强度的增加和温度的升高,废啤酒酵母对花色苷的吸附量增加;在一定花色苷初始质量浓度范围内(60~180 mg/L),废啤酒酵母菌对花色苷的平衡吸附量随着花色苷初始质量浓度的增加而增加,当大于180 mg/L时,其平衡吸附量增加缓慢。
在温度30、40 ℃和50 ℃和超声强度394 W/L条件下的吸附动力学行为表明,废啤酒酵母对蓝莓渣中花色苷的吸附过程较好地符合二级动力学模型(相关系数r>0.999),3 个温度条件下花色苷平衡吸附量分别为9.15、9.37 mg/g和9.69 mg/g。
在温度40 ℃和超声强度394 W/L条件下的等温吸附研究表明,废啤酒酵母对蓝莓渣中花色苷的吸附过程可以用Freundlich和Temkin等温吸附模型拟合,但是Temkin方程的模拟效果更好(相关系数r>0.99)。
对吸附前后蓝莓渣中的花色苷成分进行HPLC分析可知,废啤酒酵母对各种单体花色苷进行了不同程度的吸附,锦葵色素-3-葡萄糖苷吸附率最高,芍药色素-3-葡萄糖苷吸附率最低;FTIR分析得知废啤酒酵母表面的氨基、羟基和酰胺基团在废啤酒酵母吸附花色苷的过程中起着关键作用。这些均表明废啤酒酵母对花色苷具有良好的吸附效果。
综上所述,废啤酒酵母对吸附蓝莓渣中花色苷而言是一种高效廉价的生物吸附剂,它在分离富集花色苷方面具有广阔的应用前景。
[1] ABDEL-MOEMIN A R. Switching to black rice diets modulates lowdensity lipoprotein oxidation and lipid measurements in rabbits[J]. The American Journal of the Medical Sciences, 2011, 341(4): 318-324.DOI:10.1097/MAJ.0b013e3182019f62.
[2] JOSEPH J A, DENISOVA N A, ARENDASH G, et al. Blueberry supplementation enhances signaling and prevents behavioral deficits in an Alzheimer disease model[J]. Nutritional Neuroscience, 2003, 6(3):153-162.
[3] TANAKA J, NAKANISHI T, OGAWA K, et al. Purple rice extract and anthocyanidins of the constituents protect against light-induced retinal damage in vitro and in vivo[J]. Journal of Agricultural and Food Chemistry, 2010, 59(2): 528-536. DOI:10.1016/j.lfs.2012.10.017.
[4] SOTO M L, MOURE A, DOMÍNGUEZ H, et al. Recovery,concentration and purification of phenolic compounds by adsorption:a review[J]. Journal of Food Engineering, 2011, 105: 1-27.DOI:10.1016/j.jfoodeng.2011.02.010.
[5] 李音, 单胜道, 杨瑞芹, 等. 低温水热法制备竹生物炭及其对有机物的吸附性能[J]. 农业工程学报, 2016, 32(24): 240-247.DOI:10.11975/j.issn.1002-6819.2016.24.032.
[6] AYANGBENRO A S, BABALOLA O O. A new strategy for heavy metal polluted environments: a review of microbial biosorbents[J].International Journal of Environmental Research and Public Health,2017, 14(1): 1-16. DOI:10.3390/ijerph14010094.
[7] DA FONSECA MACHADO A P, PEREIRA A L D, BARBERO G F, et al. Recovery of anthocyanins from residues of Rubus fruticosus,Vaccinium myrtillus and Eugenia brasiliensis by ultrasound assisted extraction, pressurized liquid extraction and their combination[J]. Food Chemistry, 2017, 231: 1-10. DOI:10.1016/j.foodchem.2017.03.060.
[8] JING P, RUAN S Y, DONG Y, et al. Optimization of purification conditions of radish (Raphanus sativus L.) anthocyanin-rich extracts using chitosan[J]. LWT-Food Science and Technology, 2011, 44:2097-2103. DOI:10.1016/j.lwt.2011.06.003.
[9] MAZZARACCHIO P, KINDT M, PIFFERI P G, et al. Adsorption behaviour of some anthocyanins by wheat gluten and its fractions in acidic conditions[J]. International Journal of Food Science and Technology, 2012, 47(2): 390-398. DOI:10.1111/j.1365-2621.2011.02852.x.
[10] GAO R C, JING P, RUAN S Y, et al. Removal of off-flavours from radish (Raphanus sativus L.) anthocyanin-rich pigments using chitosan and its mechanism(s)[J]. Food Chemistry, 2014, 146: 423-428.DOI:10.1016/j.jpcs.2013.08.007.
[11] STAFUSSA A P, MACIEL G M, DA SILVA ANTHERO A G, et al.Biosorption of anthocyanins from grape pomace extracts by waste yeast: kinetic and isotherm studies[J]. Journal of Food Engineering,2016, 169: 53-60. DOI:10.1016/j.jfoodeng.2015.08.016.
[12] WANG J L, CHEN C. Biosorption of heavy metals by Saccharomyces cerevisiae: a review[J]. Biotechnology Advances, 2006, 24(5):427-451. DOI:10.1016/j.biotechadv.2006.03.001.
[13] TONK S, NAGY B, TÖRÖK A, et al. Cd(II), Zn(II) and Cu(II)bioadsorption on chemically treated waste brewery yeast biomass: the role of functional groups[J]. Acta Chimica Slovenica, 2015, 62(3):736-746.
[14] KUMARI K, ABRAHAM T E. Biosorption of anionic textile dyes by nonviable biomass of fungi and yeast[J]. Bioresource Technology,2007, 98(9): 1704-1710. DOI:10.1016/j.biortech.2006.07.030.
[15] KIM T Y, LEE J W, CHO S Y. Application of residual brewery yeast for adsorption removal of reactive orange 16 from aqueous solution[J].Advanced Powder Technology, 2015, 26(1): 267-274. DOI:10.1016/j.apt.2014.10.006.
[16] GUPTA H, GOGATE P R. Intensified removal of copper from waste water using activated watermelon based biosorbent in the presence of ultrasound[J]. Ultrasonics Sonochemistry, 2016, 30, 113-122.DOI:10.1016/j.ultsonch.2015.11.016.
[17] DJELLOUL C, HASSEINE A. Ultrasound-assisted removal of methylene blue from aqueous solution by milk thistle seed[J].Desalination and Water Treatment, 2013, 51(28/29/30): 5805-5812.DOI:10.1080/19443994.2012.760113.
[18] WEI W, WANG Q L, LI A, et al. Biosorption of Pb(II) from aqueous solution by extracellular polymeric substances extracted from Klebsiella sp. J1: adsorption behavior and mechanism assessment[J].Scientific Reports, 2016, 6: 1-10. DOI:10.1038/srep31575.
[19] 袁亚宏, 蔡露阳, 岳田利, 等. 磁性壳聚糖微球吸附苹果渣多酚的动力学及热力学分析[J]. 农业工程学报, 2012, 28(16): 264-269.DOI:10.3969/j.issn.1002-6819.2012.16.041.
[20] CUI Chun, ZHANG Shaomin, YOU Lijun, et al. Antioxidant capacity of anthocyanins from Rhodomyrtus tomentosa (Ait.) and identification of the major anthocyanins[J]. Food Chemistry, 2013, 139(1/2/3/4): 1-8.DOI:10.1016/j.foodchem.2013.01.107.
[21] IVANOVA V, DÖRNYEI Á, MÁRK L, et al. Polyphenolic content of Vranec wines produced by different vinification conditions[J]. Food Chemistry, 2011, 124(1): 316-325. DOI:10.1016/j.foodchem.2010.06.039.
[22] 胡晓婧, 藏婷婷, 顾海东, 等. 平菇菌糠对废水中铜离子的生物吸附性能[J]. 环境科学, 2014, 35(2): 669-677.
[23] WU T, YU X, HUA A T, et al. Ultrasonic disruption of yeast cells:underlying mechanism and effects of processing parameters[J].Innovative Food Science and Emerging Technologies, 2015, 28: 59-65. DOI:10.1016/j.ifset.2015.01.005.
[24] 杜杰, 郭彩霞. 废啤酒酵母菌对苹果汁中展青霉素的吸附作用[J].食品科学, 2016, 37(5): 56-61. DOI:10.7506/spkx1002-6630-201605011.
[25] BURAN T J, SANDHU A K, LI Z, et al. Adsorption/desorption characteristics and separation of anthocyanins and polyphenols from blueberries using macroporous adsorbent resins[J]. Journal of Food Engineering, 2014, 128: 167-173. DOI:10.1016/j.jfoodeng.2013.12.029.
[26] 王静, 雷宏杰, 岳珍珍, 等. 大孔树脂对红枣汁中棒曲霉素的吸附动力学[J]. 农业工程学报, 2015, 31(2/3): 285-291. DOI:10.11975/j.issn.1002-6819.2015.23.038.
[27] LI Chunyang, FENG JIN, HUANG Wuyang, et al. Composition of polyphenols and antioxidant activity of rabbiteye blueberry (Vaccinium ashei) in Nanjing[J]. Journal of Agricultural and Food Chemistry,2013, 61: 523-531. DOI:10.1021/jf3046158.
[28] MAZZARACCHIO P, KINDT M, PIFFERI P G, et al. Adsorption behaviour of some anthocyanins by wheat gluten and its fractions in acidic conditions[J]. International Journal of Food Science and Technology, 2012, 47(2): 390-398. DOI:10.1111/j.1365-2621.2011.02852.x.
[29] 黄惠华, 王志, 陈建新. 多酚-蛋白质络合反应的影响因素研究[J]. 食品科学, 2003, 24(2): 22-25. DOI:10.3321/j.issn:1002-6630.2003.02.002.
[30] 刘寅, 王淼. 预处理方式对酵母细胞吸附茶多酚性能的影响[J]. 食品科学, 2011, 32(6): 38-44.
Ultrasound-Assisted Biosorption of Anthocyanins from Blueberry Pomace Extracts by Waste Beer Yeast