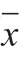 ±s表示,采用统计软件SPSS 18.0的单因素ANOVA方法分析不同组别之间差异的显著性。以P<0.05定义为具有统计学显著性差异判断标准。
±s表示,采用统计软件SPSS 18.0的单因素ANOVA方法分析不同组别之间差异的显著性。以P<0.05定义为具有统计学显著性差异判断标准。植物雌激素是一大类植物源性的天然化合物,广泛存在于人类的日常食材当中[1]。由于它们的结构与哺乳动物体内的雌激素结构类似,在人体内可激活相应的受体以发挥雌激素类生物学效应[2]。目前研究表明,植物雌激素从本质上是一种内分泌干扰物,其不当摄入极有可能打破原有的生殖内分泌平衡状态,从而引发相关的负面效应[3]。研究其对于人群健康的影响,尤其是对于内源性雌激素水平较低且肝脏生物转化能力较弱的未成年个体的影响,具有非常重要的现实意义。
槲皮素属于植物雌激素中的黄酮类物质,以多种β-糖苷的形式存在于许多日常食用蔬菜及水果中,其人群摄入平均水平较高(每日摄入量为10~20 mg)[4]。因此,日常膳食所引发的槲皮素摄入对于人体健康的影响日益为人们所关注。
乳腺组织作为典型的雌激素敏感性组织,其发育过程自然极可能会受到激素样物质不当摄入的负面影响[3,5]。本研究中,以21 日龄雌性小鼠为模型,考察长期膳食水平槲皮素摄入对于其乳腺组织发育的影响,期望能从整体动物水平客观评价槲皮素长期摄入对于围青春期乳腺发育过程的潜在影响,为相关食品安全预警提供实验依据。
清洁级2 1 日龄雌性昆明小鼠3 6 只(体质量10~13 g;许可证号:SCXK(湘)2016-0002),购自湖南斯莱克景达实验动物有限公司。
小鼠饲料(不含植物雌激素) 北京实验动物饲料公司;槲皮素(纯度>99%)、异鼠李素(纯度>99%);葡聚糖凝胶、胰脂肪酶、葡萄糖醛酸酶、硫酸酯酶 美国Sigma-Aldrich公司;雌激素受体(estrogen receptor,ER)α及ERβ一抗、孕激素受体(progesterone receptor,PR)一抗、增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)一抗 美国Abcam公司;山羊抗兔过氧化物酶标记染色试剂盒、辣根过氧化物酶(diaminobenzidine,DAB)显色试剂盒、苏木精北京中杉金桥生物技术有限公司;甲醇、乙腈、甲酸、二甲基亚砜、乙酸铵、乙酸乙酯、正己烷、氯仿 上海振兴化工一厂。
高效液相色谱四极杆飞行时间串联质谱(high performance liquid chromatography-quadrupole-time of flight/mass spectrometry,HPLC-Q-TOF/MS) 美国Agilent公司;超纯水仪 美国Milipore公司;冷冻干燥机 德国Christ公司;电子天平 梅特勒-托利多(上海)公司;离心机上海安亭离心机厂;氮吹仪 北京成萌伟业科技有限公司;组织匀浆器 上海标本磨具厂;数显双列四孔恒温水浴锅 金坛市岸头良友实验仪器厂;脱水机、半自动切片机 德国Leica公司;病理组织包埋冷冻台、病理组织漂烘仪 常州市中威电子仪器有限公司;超低温冰箱 青岛海尔股份有限公司;显微镜 日本Olympus公司。
1.3.1 动物实验分组与处理
室温(20±1)℃,12 h/12 h明暗交替,自由饮食。为了避免常规小鼠饲料当中豆源性原料对于实验的干扰,全过程采用不含植物雌激素的特殊饲料进行喂养。将刚断奶的21 日龄雌性小鼠随机分为4 组(9 只/组):槲皮素高、中、低剂量组(暴露剂量分别为45、25、5 mg/(kg·d))以及空白对照组(二甲基亚砜0.1 mL/d)。对小鼠进行灌胃,每日1 次。直至小鼠性成熟并出现3 次以上具有规律性的生殖周期,共连续灌胃50 d。待小鼠阴道口开张即性成熟后,以阴道涂片形式观测其生殖周期变化。择发情期于末次灌胃4 h后脱臼处死小鼠。收集血浆样本以及乳腺组织,以HPLC-Q-TOF/MS分析槲皮素相关代谢物分布状况,以免疫组织化学方法检测小鼠乳腺上皮细胞相关指标(ERα、ERβ、PR、PCNA)表达水平。
1.3.2 组织样本检测前处理
取300 μL血浆或乳腺组织生理盐水匀浆液,先后加入10 μL香叶木素溶液(10 μg/mL)、2 mL乙酸乙酯,漩涡混匀后3 000 r/min离心5 min,反复萃取4 次,合并上清液,氮气吹干。将吹干样品以50 μL甲醇+300 μL正己烷-氯仿(体积比1∶1)复溶,上葡聚糖凝胶柱。以6 mL正己烷-氯仿(体积比1∶1)洗脱即为脂溶相,再用5 mL甲醇洗脱即为水溶相,将两相样本以氮气挥干,分别进行处理。
正己烷相:以200 μL甲醇复溶,加入1 g/100 mL脂肪酶溶液150 μL,37 ℃水浴酶解4 h,2 mL乙酸乙酯漩涡混匀,3 000 r/min离心5 min,萃取4 次,合并上清液,氮气吹干。以200 μL甲醇复溶过滤膜,进样检测。
甲醇相:以200 μL甲醇复溶,调节pH值至4.9,漩涡混匀,加入5 μL β-葡萄糖醛酸酶和5 μL硫酸酯酶,漩涡混匀,在37 ℃水浴密闭酶解过夜。加入2 mL乙酸乙酯漩涡混匀,3 000 r/min离心5 min,萃取4 次,合并上清液,氮气吹干。以200 μL甲醇复溶过滤膜,进样检测。
1.3.3 槲皮素以及其代谢产物异鼠李素的组织分布状况检测
参考文献[6]的方法采用HPLC-Q-TOF/MS法检测槲皮素及其代谢产物异鼠李素的组织分布状况。色谱条件:C18色谱柱(50 mm×2.1 mm,1.8 μm),流动相为体积分数0.1%甲酸溶液(A)-乙腈(B);梯度洗脱:0~1 min,10%~35% B;1~3 min,35% B;3~6 min,35%~80% B;6~8 min,80% B;8~9 min,80%~10% B;9~10 min,10% B;检测波长360、260 nm;柱温30 ℃;流速0.35 mL/min;进样量5 μL。
质谱条件:使用电喷雾离子源(electron spray ionization,ESI),在负离子模式下分别采集数据,数据采集范围m/z 50~2 000;ESI参数:气化室温度350 ℃,离子源温度100 ℃,脱溶剂气(N2)体积流量10 L/min,裂解电压180 V;定性离子:m/z 301、315。
1.3.4 乳腺上皮细胞内ER、PR以及PCNA表达水平检测
取乳腺组织以中性福尔马林固定12 h,常规梯度乙醇溶液脱水至组织呈透明,石蜡包埋并切片(厚度5 μm)。按照经典的SP法免疫组化方法进行操作,严格按照相关试剂说明书进行染色。石蜡切片常规脱蜡入水,置于柠檬酸钠缓冲液中以高压锅加热加压修复抗原;以体积分数3% H2O2浸泡封闭内源性过氧化物并以正常山羊血清工作液(体积分数7.5%)封闭,直接分别滴加一抗工作液ERα(1∶75)、ERβ(1∶75)、PR(1∶200)或PCNA(1∶250),4 ℃冷藏孵育过夜,磷酸盐缓冲液清洗后滴加生物素偶联山羊抗兔二抗工作液(1∶1 000)孵育25 min(37 ℃),辣根酶标记链霉卵白素工作液,孵育25 min(37 ℃),DAB显色,苏木精复染,脱水-透明-中性树胶封片。显微镜下观察,选取每个样本3 张切片,每张切片取5 个400 倍镜视野统计结果,其中DAB显色呈褐色为阳性,而阴性染色细胞核因经过苏木精复染而呈现出蓝色。结果评判标准:参照Remmele等[6]的免疫化学评分体系(immunohistochemical response score,IRS),采用染色强度(staining intensity,SI)和阳性细胞百分比(percentage of positively stained glands,PP)的乘积,即IRS=SI×PP。SI分为4级:0级为未见阳性细胞即阴性,1级弱阳性,2级中等阳性,3级强阳性。PP分为5级:0级为阴性,1级≤25%,2级25%~50%,3级50%~75%;4级≥75%。
各组数据以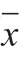 ±s表示,采用统计软件SPSS 18.0的单因素ANOVA方法分析不同组别之间差异的显著性。以P<0.05定义为具有统计学显著性差异判断标准。
±s表示,采用统计软件SPSS 18.0的单因素ANOVA方法分析不同组别之间差异的显著性。以P<0.05定义为具有统计学显著性差异判断标准。
本团队前期已建立并报道了生物样本中槲皮素相关代谢产物的检测方法,在信噪比为3时检出限可低至1 ng/mL且重复性佳[7]。以槲皮素标准品进样质量浓度(X)对峰面积积分值(Y)进行线性回归,在脂溶相以及水溶相中槲皮素标准品进样在0.002~2 000 μg/mL范围内均与峰面积积分值呈良好线性关系(表1)。
表1 各组织洗脱相中的槲皮素含量标准曲线回归方程和相关系数
Table1 Linear regression equations with coefficients of correlation for quercetin and isohamnetin dissolved in various phases

组织类型 基质 线性回归方程 相关系数血浆 脂溶相 Y=2 368 599X+125 0.998 9水溶相 Y=2 525 541X+267 0.999 1乳腺 脂溶相 Y=2 356 962X+324 0.999 4水溶相 Y=2 193 035X+321 0.998 8
血浆以及乳腺组织局部的槲皮素相关代谢物含量与动物模型的槲皮素摄入量存在典型的剂量依赖性关系。不论是脂肪酸酯类产物还是结合型硫酸酯或葡萄糖醛酸酯类代谢产物在乳腺组织当中的含量均明显大于血浆组织,体现出了显著的组织富集效应(表2)。尤其是水溶性结合型代谢产物,乳腺组织局部浓度均值可达到血浆浓度的30 倍以上。提示乳腺组织对于槲皮素的暴露较为敏感。此外,在灌胃4 h后血浆中以槲皮素脂肪酸酯为主,而在乳腺组织内以水溶性结合型槲皮素代谢产物为主。
表2 各组织中槲皮素各类代谢产物分布
Table2 Distribution of quercetin metabolites
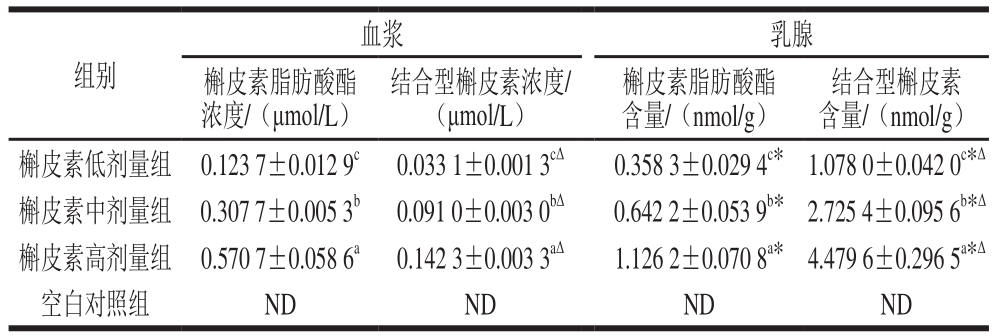
注:同列肩标小写字母不同表示组间差异显著(P<0.05);*.同组内、不同组织的同一指标间差异显著(P<0.05);Δ.同组内、同组织不同指标间差异显著(P<0.05)。ND.未检出。
血浆 乳腺槲皮素脂肪酸酯浓度/(μmol/L)组别 结合型槲皮素浓度/(μmol/L)槲皮素脂肪酸酯含量/(nmol/g)结合型槲皮素含量/(nmol/g)槲皮素低剂量组 0.123 7±0.012 9c0.033 1±0.001 3cΔ0.358 3±0.029 4c* 1.078 0±0.042 0c*Δ槲皮素中剂量组 0.307 7±0.005 3b0.091 0±0.003 0bΔ0.642 2±0.053 9b* 2.725 4±0.095 6b*Δ槲皮素高剂量组 0.570 7±0.058 6a0.142 3±0.003 3aΔ1.126 2±0.070 8a* 4.479 6±0.296 5a*Δ空白对照组 ND ND ND ND
PCNA是描述组织细胞增殖水平的经典指标,以其为靶点可较为客观地评价乳腺上皮细胞增殖的状况。IRS评分结果显示围青春期的槲皮素长期摄入并没有直接改变雌性小鼠成年后乳腺上皮的增殖状况,与组织分析结果相一致(图1)。
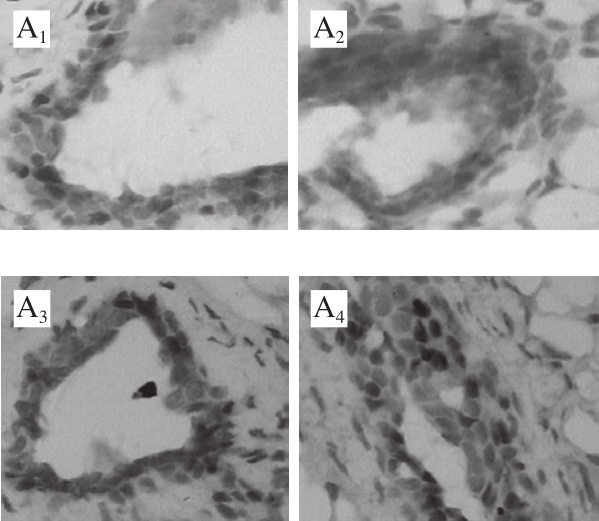
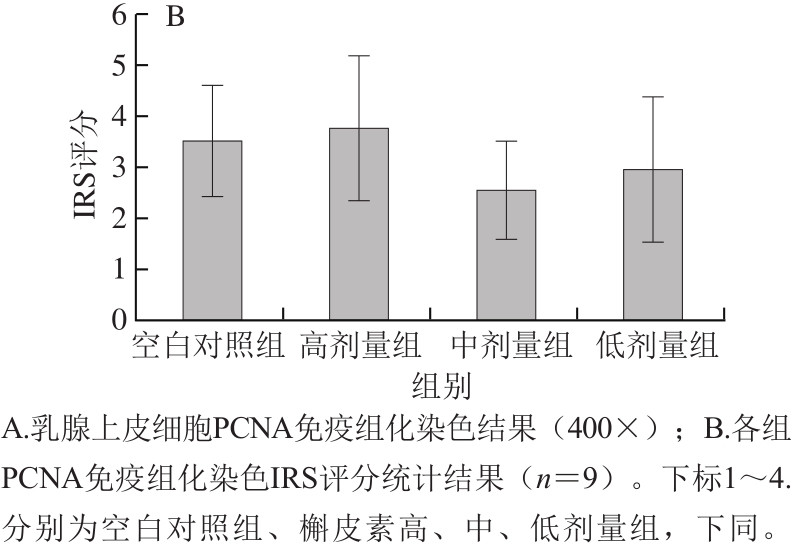
图1 乳腺上皮细胞内PCNA免疫组织化学染色结果
Fig.1 IHC staining of PCNA
为考察槲皮素是否影响小鼠成年后乳腺上皮细胞对于生殖内分泌相关激素的敏感性,进一步分析了乳腺上皮细胞内ER的表达状态。
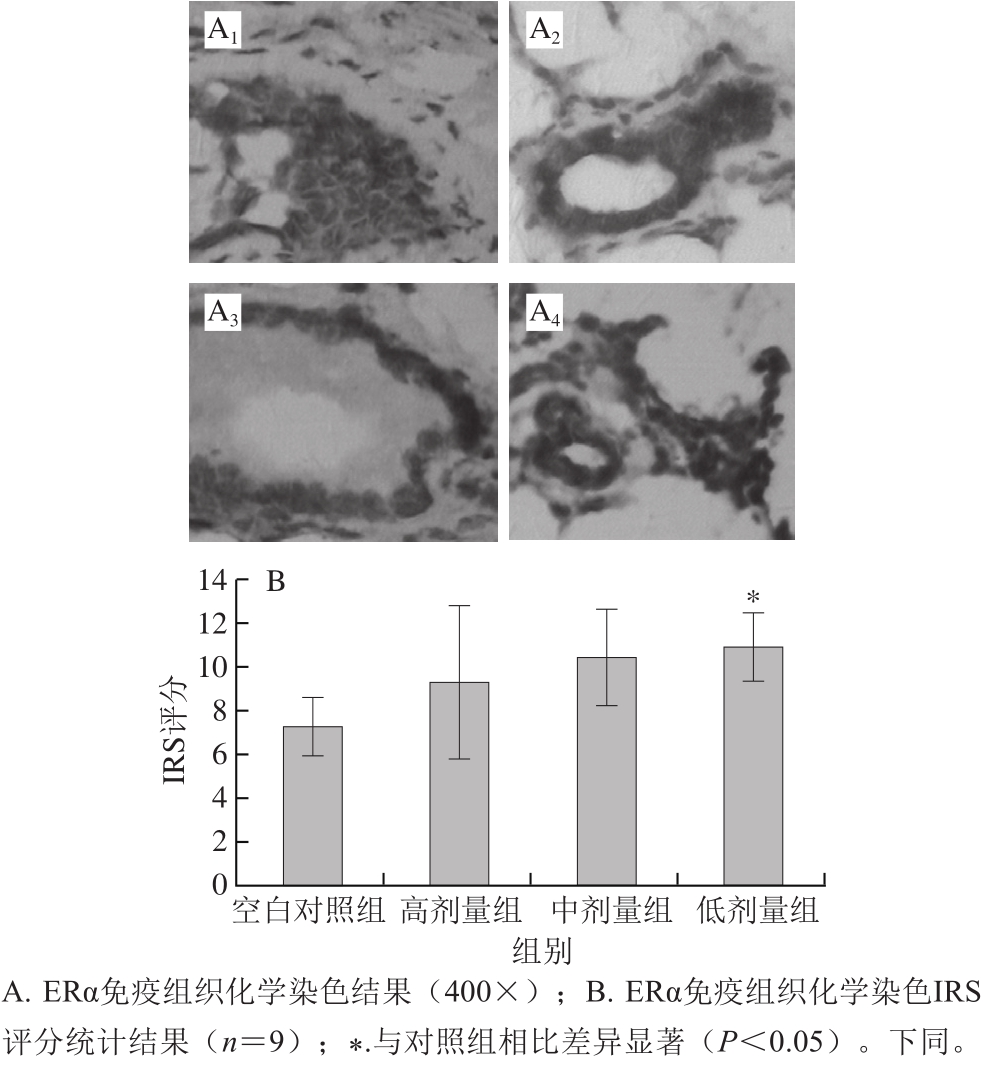
图2 ERα免疫组织化学染色结果
Fig.2 IHC staining of ERα
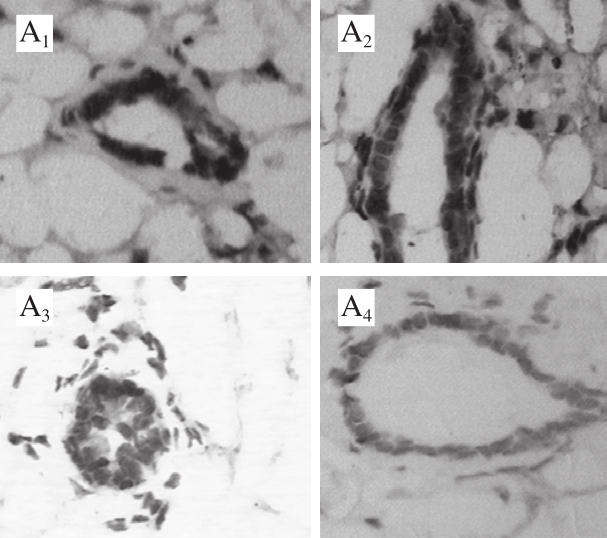

图3 ERβ免疫组织化学染色结果
Fig.3 IHC staining of ERβ
局部组织ERα以及ERβ的表达水平和表达比例直接影响组织对于相关激素和激素类似物的反应性。经免疫组织化学染色分析,低剂量组槲皮素长期暴露后明显可诱导乳腺上皮细胞内ERα表达(图2),而与ERα相反,乳腺上皮细胞ERβ的表达受到抑制(图3)。由此乳腺组织上皮细胞内ERα与ERβ表达水平的比值被显著上调。需要说明的是,这些效应在中、高剂量组中并没有显示出统计学差异。
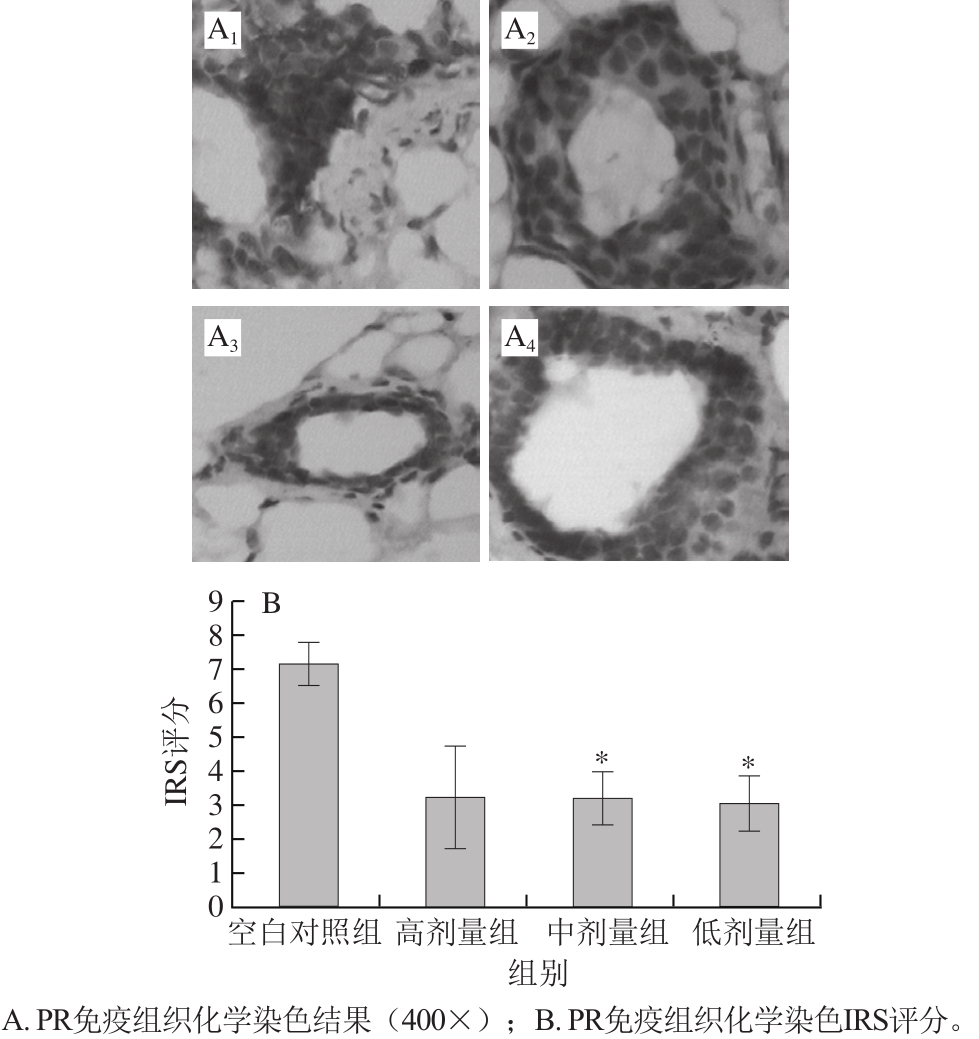
图4 PR免疫组织化学染色结果
Fig.4 IHC staining of PR
PR是ER通路下游的重要分子指标,在乳腺组织的生长发育以及分化过程中起到非常重要的作用[8]。免疫组织化学染色分析显示,PR的表达明显受到了槲皮素长期暴露的阻遏,在中、低剂量组乳腺上皮细胞内PR表达量显著低于空白对照组(图4)。
近年来,乳腺癌以及乳腺相关疾病的发病率逐年上升,已成为危害女性健康的重要因素之一[9]。有研究报道表明,在幼年期内分泌干扰物的不当摄入会影响乳腺等激素敏感性组织的发育,并可能提高个体成年后罹患相关疾病的风险[3]。
槲皮素是正常膳食中广泛存在的黄酮类活性物质[10]。由于许多研究报道表明其具有一定的抗氧化、抗肿瘤等生物学活性,因此富含槲皮素成分的膳食一直为人们所推崇[11-12]。然而需要指出的是槲皮素同时也可以在哺乳动物体内激活ER相关通路从而表现出类雌激素样活性,属于植物雌激素的范畴[13]。幼儿阶段的个体,由于乳腺等雌激素敏感性组织处于发育阶段且个体本底生殖内分泌激素水平较低,对于外源性雌激素样内分泌干扰物的摄入尤其敏感[14]。为客观评价膳食源性槲皮素对于人体健康的影响,在本研究中,以前期槲皮素膳食摄入水平评估原始数据为基础,选择相对较低的膳食暴露剂量,客观评价在围青春期这一生长发育敏感阶段槲皮素的长期膳食摄入对于乳腺发育的影响。
研究结果提示:尽管在本研究考察剂量范围(5~45 mg/(kg·d))内,围青春期槲皮素的长期暴露并没有明显影响到成年雌性个体乳腺组织结构以及乳腺上皮细胞的增殖状况,但是乳腺上皮细胞内ER的表达谱已发生了显著性的改变,ERα表达上调而ERβ表达下调,ERα与ERβ表达水平比值明显上升,且PR的表达也受到阻遏。这一现象与其他研究团队关于染料木素等其他植物雌激素影响ER表达谱的报道相似[15-16]。
值得一提的是,槲皮素的生物学效应特点与染料木素等其他植物雌激素相类似,呈现出双向“U”型效应,即在高剂量水平与低剂量水平下可表现出截然不同的甚至相反的生物学活性[17]。从本研究的数据中不难看出:槲皮素在中低剂量组中显示出了更为显著的生物学效应,而不是高剂量组,这并不符合常规的效量关系,这一现象与其他植物雌激素类物质的生物学活性研究结果相一致[17]。
部分细胞实验研究报道槲皮素能诱导乳腺癌细胞凋亡,可作为预防或治疗乳腺癌的有效化合物[18-19],但其效果的产生往往需要较高的作用浓度(20~60 μmol/L)。需要说明的是,这一浓度水平通过正常的膳食摄入几乎是不可能达到的。而Singh等[20]的动物实验研究结果表明槲皮素可能会加剧雌性ACI大鼠中雌二醇(E2)诱导的乳腺肿瘤风险,因此槲皮素可能提高了乳腺组织对于E2促增殖效应的敏感性,与本研究中槲皮素暴露会上调小鼠成年后乳腺组织内ERα/β表达比结果相符。
众所周知,ER、PR是相关生殖内分泌激素作用的主要靶分子,其在局部组织的表达水平可明显影响相应组织对于相关激素以及激素样活性物质的反应性,也极可能会影响到个体对于相关疾病致病因素的敏感性[21]。ER主要分为结构类似但生物功能相对独立又彼此紧密联系的ERα以及ERβ两大亚型[22]。相关研究报道提示,ERβ可负向调控ERα介导的相关敏感性组织/细胞增殖的生物学过程,在组织分化以及乳腺肿瘤发生发展的过程中起到了非常重要的作用[23]。此外,PR的表达也可从一定程度上抑制乳腺发育过程中组织增殖并促进分化[24]。在本研究中,槲皮素在围青春期的不当暴露提高了个体成年后乳腺上皮细胞内ERα/β表达比值,抑制了促进乳腺组织发育分化的PR表达,极可能提高乳腺组织对于促进其增殖、诱发其异常增生等各因素的敏感性,从而升高相应个人罹患相关疾病的风险。
需要说明的是:槲皮素不仅通过直接作用于激素敏感性组织本身,而且可能通过影响机体内整体的生殖内分泌平衡,来引发一系列的负面效应[25-26]。由此,槲皮素膳食摄入所可能引发的潜在危害,尤其是针对处于生长发育阶段的婴幼儿及青少年,应该给予重视。
此外,本团队前期建立的化学分析方法可以在相关标准品缺乏的情况下,通过相应酶类的生物水解,精确分析槲皮素生物转化产生的相应代谢物[7]。数据显示,槲皮素在动物体内不仅可转化为水溶性的硫酸酯以及葡萄糖醛酸酯类结合产物,还可以转化为脂溶性的脂肪酸酯类产物。各类槲皮素代谢产物的组织内局部分布均呈现出剂量依赖性关系。需要特别关注的是,在乳腺组织中槲皮素相应代谢产物的含量均明显高于血浆组织,体现出显著的乳腺组织局部富集作用,因此,相对而言乳腺组织对于槲皮素的摄入更为敏感。由此也表明,单纯以血浆当中相应代谢产物浓度为关注剂量,在细胞水平上讨论槲皮素对于个体各组织器官的影响具有一定的局限性。
本研究以围青春期雌性小鼠为模型从整体动物水平证实:乳腺对于槲皮素暴露具有较高的敏感性,槲皮素的长期暴露引发其相应代谢产物在乳腺组织当中进行局部富集;小鼠成年后乳腺上皮细胞内各生殖内分泌激素受体表达谱可被槲皮素暴露所干扰。在5 mg/(kg·d)剂量水平下,槲皮素可显著上调乳腺上皮细胞内ERα与ERβ表达水平比值并且明显抑制PR表达,改变乳腺组织对于生殖内分泌激素以及其外源类似物的敏感性,从而影响相应个体成年后罹患乳腺相关疾病的可能性。
[1] HU X J, SONG W R, GAO L Y, et al. Assessment of dietary phytoestrogen intake via plant-derived foods in China[J]. Food Additives and Contaminants Part A-Chemistry Analysis Control Exposure & Risk Assessment, 2014, 31(8): 1325-1335. DOI:10.1080/1 9440049.2014.930562.
[2] 谢明勇, 胡晓鹃, 聂少平. 植物雌激素早期摄入对个体生殖发育的影响[J]. 中国食品学报, 2012, 12(7): 1-8. DOI:10.3969/j.issn.1009-7848.2012.07.001.
[3] GOMEZ A L, AYELEN L, ALTAMIRANO G A, et al. Perinatal exposure to bisphenol A or diethylstilbestrol increases the susceptibility to develop mammary gland lesions after estrogen replacement therapy in middle-aged rats[J]. Hormones & Cancer, 2017, 8(2): 1-12.DOI:10.1007/s12672-016-0282-1.
[4] EGERT S, WISKER E. Quercetin part 1: chemical structure, content in foods, daily intake and bioavailability[J]. Ernahrungs Umschau, 2011,58(8): 416-422.
[5] GUERRERO-BOSAGNA C M, SKINNER M K. Environmental epigenetics and phytoestrogen/phytochemical exposures[J]. Journal of Steroid Biochemistry and Molecular Biology, 2014, 139: 270-276.DOI:10.1016/j.jsbmb.2012.12.011.
[6] REMMELE W, STEGNER H E. A Proposal for the standardization of the immunoreactive score (IRS) for the immunohistochemical demonstration of estrogen-receptors (ER-ICA) in breast-cancer[J].Pathologe, 1987, 8(3): 138-140.
[7] 许春莲, 胡晓鹃, 邱奇琦, 等. 小鼠血浆中槲皮素脂溶性及水溶性代谢产物的分离与测定[J]. 食品科学, 2012, 33(6): 132-136.
[8] GRIMM S L, HARTIG S M, EDWARDS D P. Progesterone receptor signaling mechanisms[J]. Journal of Molecular Biology, 2016,428(19): 3831-3849. DOI:10.1016/j.jmb.2016.06.020.
[9] ARNOLD M, LEITZMANN M, FREISLING H, et al. Obesity and cancer: an update of the global impact[J]. Cancer Epidemiology, 2016,41: 8-15. DOI:10.1016/j.canep.2016.01.003.
[10] SHAHZAD H, GIRIBABU N, SEKARAN M, et al. Quercetin induces dose-dependent differential morphological and proliferative changes in rat uteri in the presence and in the absence of estrogen[J].Journal of Medicinal Food, 2015, 18(12): 1307-1316. DOI:10.1089/jmf.2014.3293.
[11] MEN K, DUAN X, WEI X W, et al. Nanoparticle-delivered quercetin for cancer therapy[J]. Anti-cancer Agents in Medicinal Chemistry,2014, 14(6): 826-832. DOI:10.2174/1871520614666140521122932.
[12] 周小理, 王青, 杨延利, 等. 苦荞萌发物中生物活性黄酮对人乳腺癌细胞增殖的抑制作用[J]. 食品科学, 2011, 32(1): 225-228.
[13] LI X S, JIAN Z N, JI F W. Effects of quercetin and psoralen on expression of ER alpha, ER beta protein levels in T47D cells[J].Chinese Pharmacological Bulletin, 2009, 25(4): 461-464.
[14] OSBORNE G, RUDEL R, SCHWARZMAN M. Evaluating chemical effects on mammary gland development: a critical need in disease prevention[J]. Reproductive Toxicology, 2015, 54: 148-155.DOI:10.1016/j.reprotox.2014.07.077.
[15] GABRIEL PONS D, NADAL-SERRANO M, TORRENS-MAS M,et al. The phytoestrogen genistein affects breast cancer cells treatment depending on the ER alpha/ER beta ratio[J]. Journal of Cellular Biochemistry, 2016, 117(1): 218-229. DOI:10.1002/jcb.25268.
[16] MOLZBERGER A F, VOLLMER G, HERTRAMPF T, et al. In utero and postnatal exposure to isof l avones results in a reduced responsivity of the mammary gland towards estradiol[J]. Molecular Nutrition &Food Research, 2012, 56(3): 399-409. DOI:10.1002/mnfr.201100371.
[17] EVA R K, MONICA S R, IMON R. A review on endocrine disruptors and their possible impacts on human health[J]. Environmental Toxicology and Pharmacology, 2015, 40(1): 241-258. DOI:10.1016/j.etap.2015.06.009.
[18] SEO H, KU J M, CHOI H, et al. Quercetin induces caspase-dependent extrinsic apoptosis through inhibition of signal transducer and activator of transcription 3 signaling in HER2-overexpressing BT-474 breast cancer cells[J]. Oncology Reports, 2016, 36(1): 31-42. DOI:10.3892/or.2016.4786.
[19] PHAM A, BORTOLAZZO A, WHITE J B. Rapid dimerization of quercetin through an oxidative mechanism in the presence of serum albumin decreases its ability to induce cytotoxicity in MDA-MB-231 cells[J]. Biochemical and Biophysical Research Communications,2012, 427(2): 415-420. DOI:10.1016/j.bbrc.2012.09.080.
[20] SINGH B, MENSE S M, BHAT N K, et al. Dietary quercetin exacerbates the development of estrogen-induced breast tumors in female ACI rats[J]. Toxicology and Applied Pharmacology, 2010,247(2): 83-90. DOI:10.1016/j.taap.2010.06.011.
[21] MADEIRA M, MATTAR A, LOGULLO A F, et al. Estrogen receptor alpha/beta ratio and estrogen receptor beta as predictors of endocrine therapy responsiveness: a randomized neoadjuvant trial comparison between anastrozole and tamoxifen for the treatment of postmenopausal breast cancer[J]. BMC Cancer, 2013, 13:425:1-12.DOI:10.1186/1471-2407-13-425.
[22] NIKOV G N, HOPKINS N E, BOUE S, et al. Interactions of dietary estrogens with human estrogen receptors and the effect on estrogen receptor-estrogen response element complex formation[J].Environmental Health Perspectives, 2000, 108(9): 867-872.DOI:10.1289/ehp.00108867.
[23] FOX E M, DAVIS R J, SHUPNIK M A. ER beta in breast canceronlooker, passive player, or active protector?[J]. Steroids, 2008,73(11): 1039-1051. DOI:10.1016/j.steroids.2008.04.006.
[24] KNUTSON T P, LANGE C A. Tracking progesterone receptormediated actions in breast cancer[J]. Pharmacology & Therapeutics,2014, 142(1): 114-125. DOI:10.1016/j.pharmthera.2013.11.010.
[25] 舒翔, 胡晓鹃, 周圣煜, 等. 槲皮素对幼鼠卵巢发育以及血液中激素水平的影响[J]. 药学学报, 2011, 46(9): 1051-1057.
[26] 李娜, 邢萌萌, 李文娟, 等. 早期给予膳食槲皮素对大鼠母代生殖及其子代生长发育的影响[J]. 食品科学, 2012, 33(23): 297-300.
Impact of Long-Term Dietary Quercetin Exposure on Breast Development in Mice