饼干模型对小麦及花生过敏原消化稳定性和免疫活性的影响
饶 欢1,2,田 阳1,2,李 玺1,2,薛文通1,2,*
(1.中国农业大学,北京食品营养与人类健康高精尖中心,北京 100083;2.中国农业大学食品科学与营养工程学院,北京 100083)
摘 要:食品加工或食物基质可以不同程度地影响过敏原消化稳定性和免疫原性。然而,对食品加工和食物基质对食物模型中过敏原的影响却知之甚少。本实验通过体外模拟胃肠消化的方式,包括模拟口腔咀嚼、胃部消化和十二指肠消化,采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳和免疫印迹的方法,分析焙烤模型饼干中小麦过敏原和花生过敏原的消化特性和免疫原性。结果显示:小麦和花生蛋白均可被胃蛋白酶迅速水解,醇溶蛋白、谷蛋白等致敏原被降解成低分子质量多肽;可溶性蛋白中花生过敏原Ara h 1和Ara h 3基本消失,Ara h 2/6耐受胃肠消化;酶联免疫吸附测定结果显示,消化后饼干中过敏原的致敏性降低。综合以上结果表明,饼干模型的消化性质基本不受焙烤加工和其他基质的影响,免疫原性因致敏原被消化而降低。
关键词:焙烤饼干模型;过敏原;消化稳定性;免疫原性
食物过敏是过敏性疾病中的一种,如今已成为全球关注的食品公共安全问题。在欧洲,大约2%的成年人和4%~5%的儿童承受着食物过敏带来的伤害[1],美国受食物过敏影响的人口是20 年前的2 倍[2],亚洲的发病率也呈明显上升趋势[3]。然而截至当前,依然没有行之有效的治疗方法。因此,深入探究致敏机制,寻找治疗突破点;降低过敏原致敏性,研发脱敏或低致敏食物;完善致敏评价体系等成为科学领域亟待解决的问题。
食物加工过程中的各种加工工序以及食物成分间发生的物理化学变化,均可不同程度地影响食物过敏原的含量和结构,从而增加或降低过敏原致敏性。而过敏原的改变也会影响其消化时的分解方式以及吸收时穿过肠黏膜屏障和呈递给免疫系统的形式[4-6]。虽然当前食物致敏途径机制仍不十分明晰,但可以肯定大部分食物过敏原是经过人体消化系统消化后而引发过敏反应的。通常认为,经过食品加工和消化系统处理(蛋白酶水解、低酸、胆盐等)后,依然保持足够完整又具有免疫原性的蛋白才具有潜在致敏的可能[7]。
目前,有关过敏原消化稳定性和致敏机制的研究众多,大部分是以纯化后的过敏原或以单一食物组分作为研究对象[8-11],虽然可以为后期研究提供科学数据和理论参考,但与生活中摄入的复杂食品相差较大,很难反映多重加工、复杂食物基质以及食物消化对过敏原的综合影响。因此,本研究以复杂的焙烤食物模型为对象,综合考察加工、食物组分及消化对小麦和花生过敏原的影响。
1 材料与方法
1.1 材料与试剂
NuPAGETMBis-Tris(4%~12%)凝胶、NuPAGETM十二烷基硫酸锂(lithium lauryl sulfate,LDS)缓冲液(4×,pH 8.4)、Simply-BlueTMsafe-stain、Mark 12TM和SeeBlueTM预染色蛋白Marker 美国Invitrogen公司;模拟唾液(simulated saliva fluid,SSF)、模拟胃液(simulated gastric fluid,SGF)、胰液混合液(pancreatic mix solution,PMS)、肝混合液(hepatic mix solution,HMS)、改良的Krebs-Ringer(modified Krebs-Ringer,MKR)缓冲液、磷酸二氢钠、氯化钾、氯化镁、卵磷脂 美国Thermo Fisher公司;人唾液淀粉酶(5 000 U/mL)、胃蛋白酶(4 293 U/mg)、胰蛋白酶(1 685 U/mg)、胰凝乳蛋白酶(40 U/mg)、胰淀粉酶(44.9 U/mg)和脂肪酶(25 200 U/mg) 美国Sigma公司。抗体均由英国曼彻斯特大学提供。人过敏血清由河北省第四医院提供。
1.2 仪器与设备
Typhoon Trio多功能激光扫描成像仪 美国GE公司;GeneGnome XRQ成像系统 英国Syngene公司;Multiskan FC酶标仪 赛默飞(上海)公司。
1.3 方法
1.3.1 焙烤食物模型制备
普通饼干和花生饼干是本实验采用的2种配方的饼干模型,普通饼干中的主要致敏原是小麦,花生饼干由于添加了脱脂花生粉,其主要致敏原为花生和小麦。成分质量分数见表1。所有成分经混合后,160 ℃烘焙20 min,冷藏备用。
表1 2 种饼干主要成分的质量分数
Table1 Ingredients of two types of model biscuits%
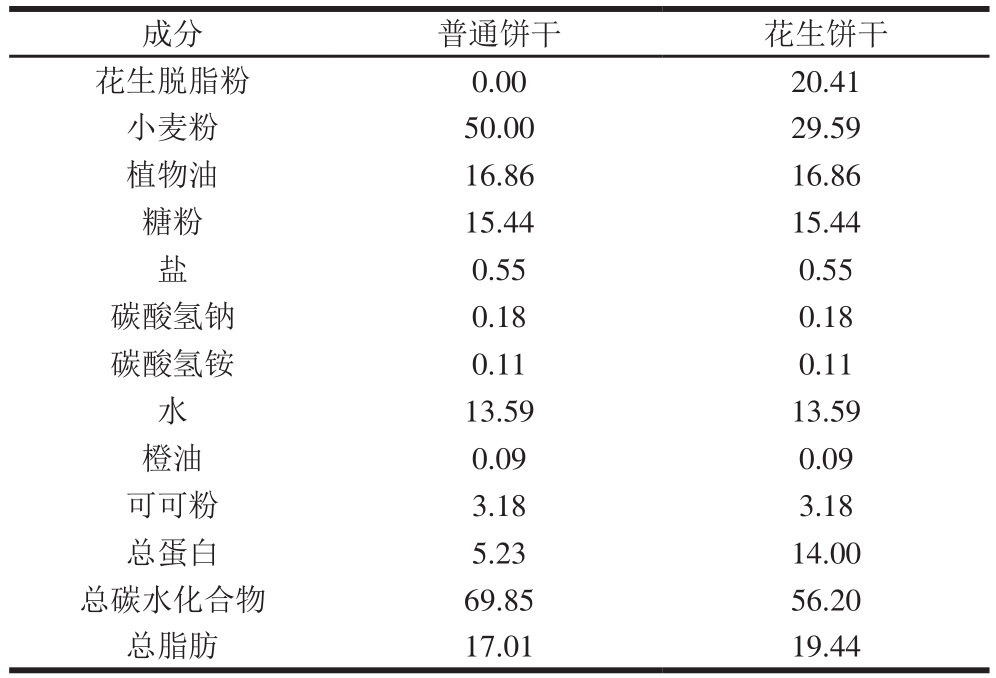
成分 普通饼干 花生饼干花生脱脂粉 0.00 20.41小麦粉 50.00 29.59植物油 16.86 16.86糖粉 15.44 15.44盐0.55 0.55碳酸氢钠 0.18 0.18碳酸氢铵 0.11 0.11水13.59 13.59橙油 0.09 0.09可可粉 3.18 3.18总蛋白 5.23 14.00总碳水化合物 69.85 56.20总脂肪 17.01 19.44
1.3.2 体外消化模型
体外消化模型的建立参照Smith等[12]的方法,包括模拟口腔咀嚼、肠胃酶系、离子环境、温度及pH值,以再现人体消化环境。体系中模拟体液的用量及消化酶加入量均根据食物材料中的蛋白质、碳水化合物及脂肪含量确定,可以更准确反映人体实际消化环境。
模拟口腔咀嚼:将含有人唾液淀粉酶和溶菌酶的0.38 mL SSF,以及1.2 mL水,加入0.65 g饼干(m(食物)∶m(SSF)∶V(水)=1.00∶0.59∶1.86)中,37 ℃水浴搅拌1 min。将此咀嚼样品放在冰上冷却待蛋白质分析。
模拟胃部消化:向2.24 g咀嚼样品中加入含有胃蛋白酶的1.05 mL SGF(m(咀嚼样品)∶V(SGF)=1.00∶0.46,用1 mol/L HCl溶液将pH值调节至2.5,以模拟胃部酸性环境。留一个咀嚼样品加入不含有胃蛋白酶的SGF,作为溶剂对照,记为Gu。将所有样品置于37 ℃、170 r/min水浴振荡器中,分别消化0.3、2、4、11、22、33、44、55、66、77 min和120 min。加入0.5 mol/L NaHCO3将pH值升高至7.5,以停止消化,并将消化后样品置于冰上冷却待蛋白质分析。
模拟十二指肠消化:取11 min胃消化物用于随后的十二指肠模拟消化。胃消化产物平均分入7支试管中(其中一支试管中的食糜只加入试剂和不含蛋白酶的消化液,作为溶剂对照,记为Du),加入1 mol/L HCl溶液将消化物pH值降至2.5,再加入0.07 mL HMS和含有胰蛋白酶、胰凝乳蛋白酶、胰淀粉酶和脂肪酶的PMS,并用MKR缓冲液将pH值调至6.5。将所有样品置于37 ℃,170 r/min振荡水浴中温育0.3、5、15、30、60 min和120 min。加入250 μL 0.1 mol/L蛋白酶抑制剂以终止蛋白水解消化反应。
1.3.3 SDS-PAGE检测消化稳定性
所有消化后的饼干样品,包括胃消化各个时间点和肠消化各个时间点样品,经13 000×g离心20 min后,分离上清液和沉淀,制备十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)样品。50 μL上清液中加入25 μL 200 mmol/L二硫苏糖醇和25 μL NuPAGE LDS缓冲液,90 ℃加热5 min,冷却后上样。取10 mg沉淀和10 mg未经消化的原饼干样品,加入500 μL蛋白提取液(7 mol/L尿素、2 mol/L硫脲、2 g/100 mL CHAPS、50 mmol/L二硫苏糖醇,pH 8.8),60 ℃水浴超声处理15 min,之后16 000×g离心30 min,取75 μL上清液加入25 μL NuPAGE LDS缓冲液,90 ℃加热5 min,冷却后上样。
将7 μL各个样品与蛋白Marker分别上样到4%~12%NuPAGE Bis-Tris预制凝胶中,200 V恒压电泳35 min。凝胶在固定液(体积分数50%甲醇溶液、体积分数10%醋酸溶液)中孵育2 h后,用蒸馏水洗胶3 次,每次5 min。Simply-BlueTMsafe-stain染色2 h后,脱色过夜,Typhoon Trio扫描仪成像。
1.3.4 Western-blot测定免疫活性
经胃部消化的所有样品经SDS-PAGE分离后,将进行免疫印迹实验。将SDS-PAGE凝胶和硝酸纤维素膜浸泡在转膜液(125 mmol/L甘氨酸、体积分数20%甲醇、25 mmol/L Tris-HCl,pH 8.3)中10 min,15 V半干转膜20 min。将膜在TBS-T(Tween 20体积分数0.05%)洗涤缓冲液中洗涤10 min,然后在5 g/100 mL脱脂奶粉(封闭缓冲液)中封闭2 h。封闭完成后,洗膜3 次,每次5 min,4 ℃孵育一抗过夜(鼠抗G12、0610和R5,1∶1 000封闭液稀释;兔抗Ara h 1、Ara h 3和Ara h 2/6,1∶5 000封闭液稀释)。洗膜3 次,每次15 min,二抗(辣根过氧化物酶(horseradish peroxidase,HRP)标记的羊-抗鼠或羊-抗兔,1∶10 000封闭液稀释)室温孵育1 h,洗涤4 次,每次15 min。使用增强型化学发光检测印迹,并通过化学发光仪GeneGnome XRQ成像系统成像。
1.3.5 ELISA评价致敏性
实验采用酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)的方法对消化前后样品致敏性进行评价。分别收集花生和小麦过敏人群的血清各3 个,分别混合建立花生过敏血清池和小麦过敏血清池。待测蛋白样品用包被液(0.015 mol/L Na2CO3,0.035 mol/L NaHCO3,pH 9.6)稀释至1 μg/mL,加入100 µL/孔至酶标板中,4 ℃静置过夜。取出后用TBS-T(Tween 20体积分数0.05%)洗涤4 次,除去残留液体和气泡。每孔加入200 µL 0.5%牛血清白蛋白封闭液,37 ℃孵育2 h后,TBS-T洗涤4 次,拍干。加入1∶10封闭液稀释的血清,每孔100 µL,37 ℃孵育2 h,取出后TBS-T洗涤4 次,拍干。随后每孔加入100 µL 1∶10 000封闭液稀释的羊抗人HRP-免疫球蛋白E(immunoglobulin E,IgE)二抗,37 ℃孵育1 h,洗涤4 次,拍干。3,3’,5,5’-四甲基联苯胺(3,3’,5,5’-tetramethylbenzidine,TMB)显色液50 µL/孔加入酶标板,37 ℃避光孵育15 min。每孔迅速加入50 µL 2 mol/L硫酸终止液,终止显色反应。450 nm波长处测定各孔OD值。
1.4 数据统计分析
每个实验均重复3 次,采用SPSS软件的ANOVA对结果进行差异显著性分析,并用SigmaPlot 12.5软件绘图。
2 结果与分析
2.1 体外消化对饼干中蛋白消化稳定性的影响
2.1.1 口腔-胃消化对饼干中蛋白消化稳定性的影响
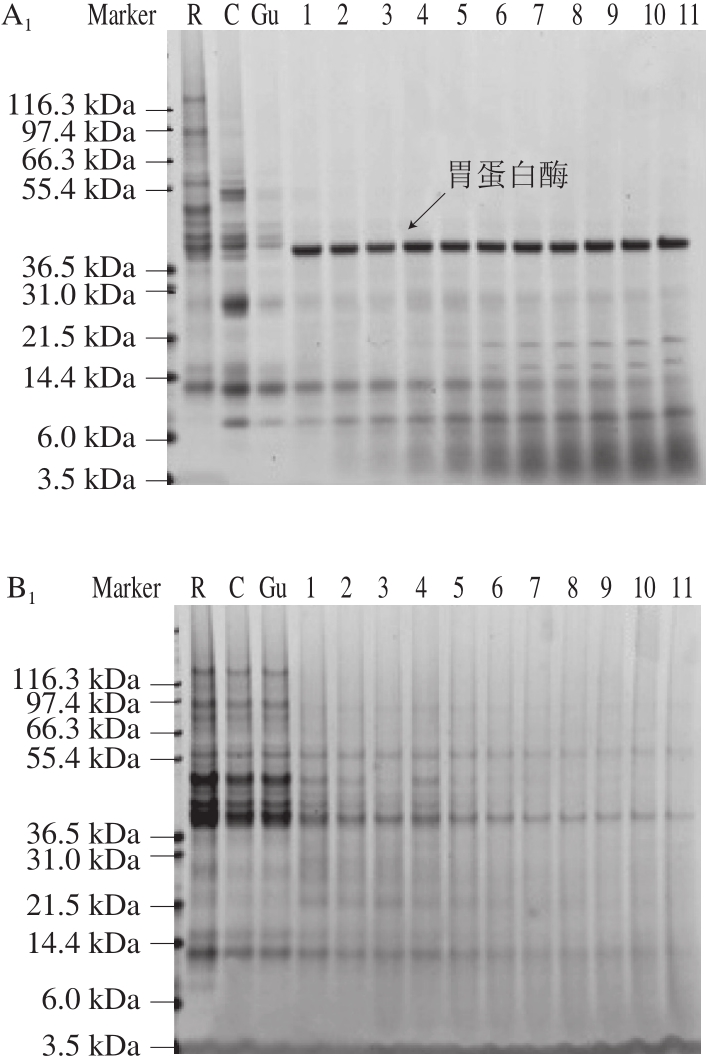
在普通饼干的可溶性组分即上清液蛋白(图1A1)中可观察到,未被消化的样品R中,蛋白分子质量分布广泛,且主要集中于45 kDa左右,还有部分分子质量大于100 kDa的蛋白。样品经口腔咀嚼和淀粉酶作用后,大分子蛋白变成相对较小的蛋白,可能是淀粉酶破坏了饼干中的淀粉网状结构,使本来聚合的蛋白解离成独立个体。当咀嚼物进入胃相,胃蛋白酶迅速分解小麦蛋白,随着消化时间的延长,越来越多的小分子质量多肽出现,蛋白分子质量分布范围约为3~20 kDa。在不可溶组分(图1B1)中,小麦蛋白依然保持着完整的结构状态,但其含量也随消化时间延长而减少,可能是被消化成可溶蛋白,转移到上清液中。
为探究另一组分的加入是否会影响蛋白消化速率,实验同时检测了花生饼干的消化特性。从图1A2中可见,大多数蛋白质被迅速消化成较稳定的蛋白降解片段(<8 kDa),说明小麦蛋白或花生蛋白的消化速率并未互相影响。对比未被消化的食糜(图1B1、B2),图1B2中可观察到更多的残留蛋白,如分子质量40 kDa的条带(如图1B2箭头所示),可在图1B1、B2中同时观察到,且图1B2中条带颜色更深,但无法通过SDS-PAGE方法判断这些条带属于小麦蛋白或是花生蛋白。
英国学者用同样的消化模型,对比研究了总醇溶蛋白、小麦粉和面包的消化模式,结果显示,总醇溶蛋白或小麦粉可以迅速被胃蛋白酶消化,但面包中的小麦蛋白几乎未被消化,而是在十二指肠中进一步消化成小肽[12]。本实验中,饼干的消化模式更接近于总醇溶蛋白或小麦粉,蛋白在胃部基本被消化。
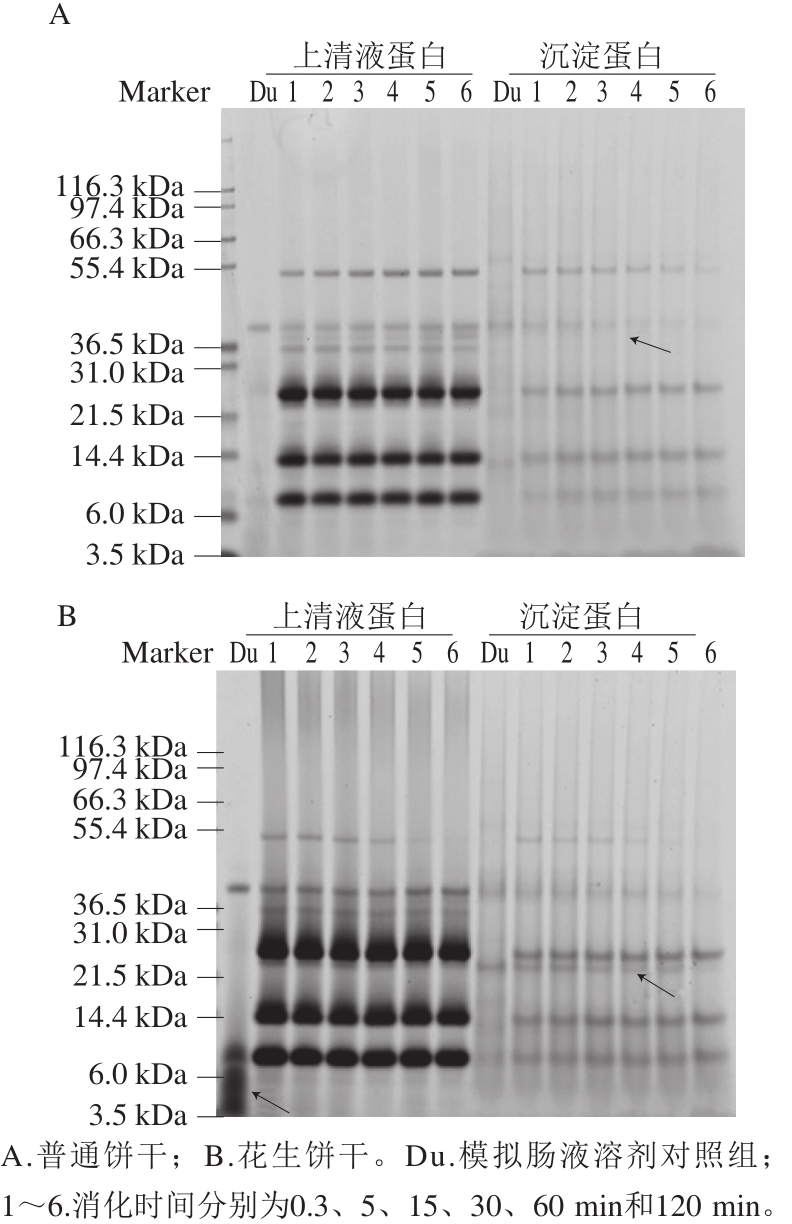
2.1.2 口腔-胃-肠消化对饼干中蛋白消化率的影响
由图2可知,饼干中大部分蛋白已被胃蛋白酶消化,部分残存于上清液和沉淀中蛋白会继续被肠液中的胰蛋白酶、糜蛋白酶、脂肪酶等进一步消化分解。对十二指肠消化后的可溶性蛋白样本进行的SDS-PAGE分析结果显示,蛋白凝胶中清晰可见的条带分别属于不同的蛋白酶,难以确定是否还有未被消化的小麦或者花生蛋白。在不可溶组分中,两种饼干在40 kDa左右有蛋白条带(如图2A箭头所示),且随消化进行而变少。与普通饼干中沉淀蛋白相比,在花生饼干中出现20 kDa左右的蛋白条带(如图2B箭头所示),并且呈降低趋势,说明花生中有部分蛋白在这一阶段被消化分解。
2.2 体外消化对饼干中致敏蛋白免疫原性的影响
2.2.1 体外消化对小麦过敏原免疫原性的影响
小麦中的α/β-、γ-、ω-醇溶蛋白,低分子质量麦谷蛋白亚基和高分子质量麦谷蛋白亚基都可引起IgE介导的食物过敏[13-15]。通过不同的抗体来检测不同类型过敏原可观察到不同过敏原在消化过程中的变化。0610抗体可检测醇溶蛋白和低分子质量麦谷蛋白,可特定识别QPFP抗原表位[16];G12抗体可识别最具免疫毒性的片段coeliactoxic 33-mer[17];R5抗体可检测一系列醇溶蛋白,可特异性识别QXPFP、QQQFP和LQPFP抗原决定簇[18]。
由图3可知,小麦过敏原被迅速水解成小分子片段,但仍然可以被抗体识别,G12、0610和R5抗体可以分别检测到20~30、30~65 kDa和25~35 kDa的抗酶解多肽(如图3箭头所示)。在消化的开始阶段仍有许多“完整”小麦致敏蛋白存在于不溶组分中,但随着酶解时间延长,它们被降解或溶解于上清液体系中被消化,50 min后基本无清晰条带检出。
2.2.2 体外消化对花生过敏原免疫原性的影响
Ara h 1、Ara h 2/6 和Ara h 3是花生中的主要致敏蛋白,能被大多数花生过敏患者识别[19-22],其中Ara h 1是花生中含量最多的致敏蛋白[23],Ara h 2/6是致敏性最强的致敏蛋白,能被95%的花生过敏患者识别,在欧美一些国家作为花生过敏检测的指标之一[24]。
在消化后的可溶性组分中发现,未消化的花生饼干R和咀嚼样品C中可检测出Ara h 1和Ara h 3,当与胃蛋白酶接触后迅速被消化(图4A1、A2、A3)。消化0.3 min后已无Ara h 1检出,但38 kDa左右的蛋白仍可以在消化120 min后被Ara h 3抗体检出(图4A2)。Ara h 2/6在消化过程中几乎无降解,说明其对胃蛋白酶具有较强的抵抗力。在不溶性组分中(图4B1、B2、B3),即使在消化120 min后,也可以检测到Ara h 1和Ara h 3,但无法检测到任何Ara h 2/6。Ara h 2/6是亲水蛋白,在消化过程中被完全释放到水溶液中。
2.2.3 体外消化对饼干致敏性的影响
实验采用过敏人群的血清更能说明样品致敏性的强弱。从图5中可以看出,对照组对小麦及花生过敏患者的致敏性均最强。当饼干经胃部消化11 min后,其致敏性显著下降。当消化120 min后,致敏性极显著下降,说明随着消化时间延长,致敏蛋白含量下降或其致敏能力下降,致使饼干的致敏性减弱。
3 讨 论
蛋白质消化稳定性是评价其潜在致敏性的重要参考依据,体外消化模型常被应用于过敏原等对人体有潜在危害的肽类物质的检测中。但蛋白质消化稳定性和食物过敏的关系与食物致敏原类别、食物基质及食物加工等多因素有关。一些过敏原在单独存在的环境下容易被蛋白酶降解,但若是经过加工或与其他成分互相作用后,过敏原的消化稳定性和致敏性也将会改变。Martinez等[25]对体外单独消化乳球蛋白和混合消化乳球蛋白和糖基化肠肽进行了对比实验,发现混合消化后抗原表位消失,IgE结合能力下降,说明二者会相互作用改变消化产物,从而降低乳球蛋白的潜在致敏性。还有研究表明,杏仁中的过敏原在巧克力慕斯和蛋糕中较难被蛋白酶水解,这可能是受食物黏度干扰,或是蛋白与食物基质(例如:脂肪、巧克力中的类黄酮、糖等)相互作用的结果[26]。
饼干和面包都是以小麦为原料的食品,但由于两种食品的加工方式不同,其在胃肠道内的消化方式也不同。Simonato等[27]的研究表明,烘焙过程增加了小麦过敏原对蛋白质水解的抵抗力,使它们能够到达胃肠道,从而引起免疫反应。Smith等[12]在分析面包中过敏原难以被消化的原因中也指出,焙烤是重要因素之一。另有研究表明,热加工产生的美拉德反应导致过敏原消化稳定性提高[28]。但本实验结果显示,虽同为焙烤加工后的食品,饼干中的小麦蛋白和花生蛋白依然容易被胃蛋白酶水解。虽然被降解后的小麦过敏原仍具有可识别的抗原决定簇,但大部分过敏原已失去了完整的蛋白结构。花生蛋白中的主要过敏原,特别是含量最多的Ara h 1基本消失,Ara h 3含量也明显减少,只有Ara h 2/6可耐受胃蛋白酶水解。有学者对单一的花生过敏原进行体外消化实验,研究结果与本实验结果一致,均表明Ara h 1易被酶解而Ara h 2/6耐受酶解[29]。从ELISA的实验结果可以看出,消化后的饼干仍具有致敏性,可能是因为仍有致敏蛋白未被消化,如Ara h 2,或是被水解的致敏原片段仍具有致敏表位[30],但总体来说其致敏能力显著下降。
综上可知,饼干模型相较于面包模型,过敏原更容易被分解,“完整”过敏原含量更少,理论分析及实验结果表明其对机体的危害更小。分析两种模型结果不同的主要原因可能是:1)面团经发酵、揉搓以后,面筋蛋白及淀粉形成复杂的网状结构,蛋白酶较难接触到包裹于内部的小麦蛋白。本实验所用饼干,仅仅是各个原料的混合,分子间缔合程度低,蛋白较容易暴露。2)面包中水分含量较高,水分子通过氢键与蛋白质相互作用,影响蛋白质结构和生物学功能。而饼干中水分含量低,油脂含量多,分子间不容易形成致密的网状结构,蛋白酶较容易与表位或者其他官能团结合。接下来的研究,也将从这两方面进一步验证分析。
参考文献:
[1] NWARU B I, HICKSTEIN L, PANESAR S S, et al. The epidemiology of food allergy in Europe: a systematic review and meta-analysis[J].Allergy, 2014, 69(1): 62-75. DOI:10.1111/all.12305.
[2] SICHERER S H, SAMPSON H A. Food allergy: epidemiology,pathogenesis, diagnosis, and treatment[J]. Journal of Allergy and Clinical Immunology, 2014, 133(2): 291-307. DOI:10.1016/j.jaci.2013.11.020.
[3] LEUNG T F, KO F W S, WONG G W. Roles of pollution in the prevalence and exacerbations of allergic diseases in Asia[J]. Journal of Allergy and Clinical Immunology, 2012, 129(1): 42-47. DOI:10.1016/j.jaci.2011.11.031.
[4] PASCHKE A. Aspects of food processing and its effect on allergen structure[J]. Molecular Nutrition & Food Research, 2009, 53(8): 959-962. DOI:10.1002/mnfr.200800187.
[5] MASTHOFF L J, HOFF R, VERHOECKX K C M, et al. A systematic review of the effect of thermal processing on the allergenicity of tree nuts[J]. Allergy, 2013, 68(8): 983-993. DOI:10.1111/all.12185.
[6] LEPSKI S, BROCKMEYER J. Impact of dietary factors and food processing on food allergy[J]. Molecular Nutrition & Food Research,2013, 57(1): 145-152. DOI:10.1002/mnfr.201200472.
[7] UNTERSMAYR E, JENSEN-JAROLIM E. The effect of gastric digestion on food allergy[J]. Current Opinion in Allergy and Clinical Immunology, 2006, 6(3): 214-219. DOI:10.1097/01.all.0000225163.06016.93.
[8] MORENO F J, MELLON F A, WICKHAM M S J, et al. Stability of the major allergen Brazil nut 2S albumin (Ber e 1) to physiologically relevant in vitro gastrointestinal digestion[J]. Febs Journal, 2005,272(2): 341-352. DOI:10.1111/j.1742-4658.2004.04472.x
[9] DÍAZ-PERALES A, BLANCO C, SÁNCHEZ-MONGE R, et al.Analysis of avocado allergen (Prs a 1) IgE-binding peptides generated by simulated gastric fluid digestion[J]. Journal of Allergy and Clinical Immunology, 2003, 112(5): 1002-1007. DOI:10.1016/j.jaci.2003.07.006.
[10] PIERSMA S R, GASPARI M, HEFLE S L, et al. Proteolytic processing of the peanut allergen Ara h 3[J]. Molecular Nutrition &Food Research, 2005, 49(8): 744-755. DOI:10.1002/mnfr.200500020.
[11] SUHR M, WICKLEIN D, LEPP U, et al. Isolation and characterization of natural Ara h 6: evidence for a further peanut allergen with putative clinical relevance based on resistance to pepsin digestion and heat[J]. Molecular Nutrition & Food Research, 2004, 48(5): 390-399.DOI:10.1002/mnfr.200400028.
[12] SMITH F, PAN X, BELLIDO V, et al. Digestibility of gluten proteins is reduced by baking and enhanced by starch digestion[J]. Molecular Nutrition & Food Research, 2015, 59(10): 2034-2043. DOI:10.1002/mnfr.201500262.
[13] WIESER S, BAAR A, SRINIVASAN B, et al. Molecular and immunological characterization of gamma gliadins as major allergens in wheat food allergy[J]. Journal of Allergy and Clinical Immunology,2016, 137(2): AB269. DOI:10.1016/j.jaci.2015.12.1018.
[14] VENTER C, MASLIN K, ARSHAD S H, et al. Very low prevalence of IgE mediated wheat allergy and high levels of cross-sensitisation between grass and wheat in a UK birth cohort[J]. Clinical and Translational Allergy, 2016, 6(1): 1-7. DOI:10.1186/s13601-016-0111-1.
[15] NILSSON N, SJÖLANDER S, BAAR A, et al. Wheat allergy in children evaluated with challenge and IgE antibodies to wheat components[J]. Pediatric Allergy and Immunology, 2015, 26(2): 119-125. DOI:10.1111/pai.12334.
[16] TOSI P, GRITSCH C S, HE J, et al. Distribution of gluten proteins in bread wheat (Triticum aestivum) grain[J]. Annals of Botany, 2011,108(1): 23-35. DOI:10.1093/aob/mcr098.
[17] HALBMAYR-JECH E, HAMMER E, FIELDER R, et al.Characterization of G12 sandwich ELISA, a next-generation immunoassay for gluten toxicity[J]. Journal of AOAC International,2012, 95(2): 372-376. DOI:10.5740/jaoacint.SGE_Halbmayr-Jech.
[18] KOEHLER P, SCHWALB T, IMMER U, et al. AACCI approved methods technical committee report: collaborative study on the immunochemical determination of partially hydrolyzed gluten using an R5 competitive ELISA[J]. Cereal Foods World, 2014, 59(4): 171-178. DOI:10.1094/CFW-58-3-0402.
[19] KLEMANS R J B, BROEKMAN H C H P, KNOL E F, et al. Ara h 2 is the best predictor for peanut allergy in adults[J]. The Journal of Allergy and Clinical Immunology: In Practice, 2013, 1(6): 632-638.DOI:10.1016/j.jaip.2013.07.014.
[20] BUBLIN M, KOSTADINOVA M, RADAUER C, et al. IgE crossreactivity between the major peanut allergen Ara h 2 and the nonhomologous allergens Ara h 1 and Ara h 3[J]. Journal of Allergy and Clinical Immunology, 2013, 132(1): 118-124. DOI:10.1016/j.jaci.2013.01.022.
[21] VISSERS Y M, IWAN M, ADEL-PATIENT K, et al. Effect of roasting on the allergenicity of major peanut allergens Ara h 1 and Ara h 2/6: the necessity of degranulation assays[J]. Clinical &Experimental Allergy, 2011, 41(11): 1631-1642. DOI:10.1111/j.1365-2222.2011.03830.x.
[22] FLINTERMAN A E, VAN HOFFEN E, DEN HARTOG JAGER C F, et al. Children with peanut allergy recognize predominantly Ara h2 and Ara h6, which remains stable over time[J]. Clinical &Experimental Allergy, 2007, 37(8): 1221-1228. DOI:10.1111/j.1365-2222.2007.02764.x.
[23] YUSNAWAN E, MARQUIS C P, LEE N A. Purification and characterization of Ara h1 and Ara h3 from four peanut market types revealed higher order oligomeric structures[J]. Journal of Agricultural and Food Chemistry, 2012, 60(41): 10352-10358. DOI:10.1021/jf302800e.
[24] VALCOUR A, JONES J E, BORRES M, et al. Sensitization profiles to peanut allergen components across the United States of America[J].Journal of Allergy and Clinical Immunology, 2017, 139(2): AB128.DOI:10.1016/j.jaci.2016.12.416.
[25] MARTINEZ M J, MARTOS G, MOLINA E, et al. Reduced β-lactoglobulin IgE binding upon in vitro digestion as a result of the interaction of the protein with casein glycomacropeptide[J].Food Chemistry, 2016, 192: 943-949. DOI:10.1016/j.foodchem.2015.07.097.
[26] MANDALARI G, RIGBY N M, BISIGNANO C, et al. Effect of food matrix and processing on release of almond protein during simulated digestion[J]. LWT-Food Science and Technology, 2014, 59(1): 439-447. DOI:10.1016/j.lwt.2014.05.005.
[27] SIMONATO B, PASINI G, GIANNATTASIO M, et al. Food allergy to wheat products: the effect of bread baking and in vitro digestion on wheat allergenic proteins. a study with bread dough, crumb, and crust[J]. Journal of Agricultural and Food Chemistry, 2001, 49(11):5668-5673. DOI:10.1021/jf0104984.
[28] NAKAMURA A, SASAKI F, WATANABE K, et al. Changes in allergenicity and digestibility of squid tropomyosin during the Maillard reaction with ribose[J]. Journal of Agricultural and Food Chemistry,2006, 54(25): 9529-9534. DOI:10.1021/jf061070d.
[29] KOPPELMAN S J, HEFLE S L, TAYLOR S L, et al. Digestion of peanut allergens Ara h 1, Ara h 2, Ara h 3, and Ara h 6: a comparative in vitro study and partial characterization of digestion-resistant peptides[J]. Molecular Nutrition & Food Research, 2010, 54(12):1711-1721. DOI:10.1002/mnfr.201000011.
[30] DI STASIO L, PICARIELLO G, MONGIELLO M, et al. Peanut digestome: identification of digestion resistant IgE binding peptides[J].Food and Chemical Toxicology, 2017, 107: 88-98. DOI:10.1016/j.fct.2017.06.029.
Effect of Model Biscuits on Digestive Stability and Immunoreactivity of Wheat and Peanut Allergens
RAO Huan1,2, TIAN Yang1,2, LI Xi1,2, XUE Wentong1,2,*
(1. Beijing Advanced Innovation Center for Food Nutrition and Human Health, China Agricultural University, Beijing 100083, China;2. College of Food Science and Nutritional Engineering, China Agricultural University, Beijing 100083, China)
Abstract:Food processing and interactions between different food components affect the bioavailability and immunoreactivity of allergens. However, the impacts of food processing and food matrices on protein digestibility and the immunoreactivity of allergens are poorly understood. The digestibility and immunogenicity of wheat and peanut allergens in wheat-based model biscuits were assessed in an in vitro digestion system including simulated mastication and gastroduodenal digestion using sodium dodecyl sulfate-polyacrylamide gel electrophoresis (SDS-PAGE) and Western blot analysis.Our results demonstrated that peanut and wheat allergens were rapidly digested after exposure to pepsin. The wheat allergens were degraded into low-molecular-mass polypeptides. The peanut allergens Ara h 1 and Ara h 3 almost disappeared, and Ara h 2/6 was resistant to gastrointestinal digestion. The results of enzyme-linked immunosorbent assay (ELISA) showed decreased allergenicity of the allergens after digestion. Taken together, these findings showed that the digestive stability of the model biscuits was not affected by the baking process and other ingredients and the immunoreactivity was reduced due to the digestion of allergens.
Keywords:model biscuits; allergens; digestive stability; immunoreactivity
RAO Huan, TIAN Yang, LI Xi, et al. Effect of model biscuits on digestive stability and immunoreactivity of wheat and peanut allergens[J]. Food Science, 2018, 39(21): 122-128. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201821018. http://www.spkx.net.cn
引文格式:饶欢, 田阳, 李玺, 等. 饼干模型对小麦及花生过敏原消化稳定性和免疫活性的影响[J]. 食品科学, 2018, 39(21):122-128. DOI:10.7506/spkx1002-6630-201821018. http://www.spkx.net.cn
文章编号:1002-6630(2018)21-0122-07
文献标志码:A
中图分类号:Q51;R151.2
DOI:10.7506/spkx1002-6630-201821018
*通信作者简介:薛文通(1962—),男,教授,博士,研究方向为粮食、油脂及植物蛋白工程。E-mail:xwt@cau.edu.cn
第一作者简介:饶欢(1988—),女,博士研究生,研究方向为粮食、油脂及植物蛋白工程。E-mail:raohuan881210@163.com
基金项目:国家自然科学基金面上项目(31471614)
收稿日期:2017-05-27