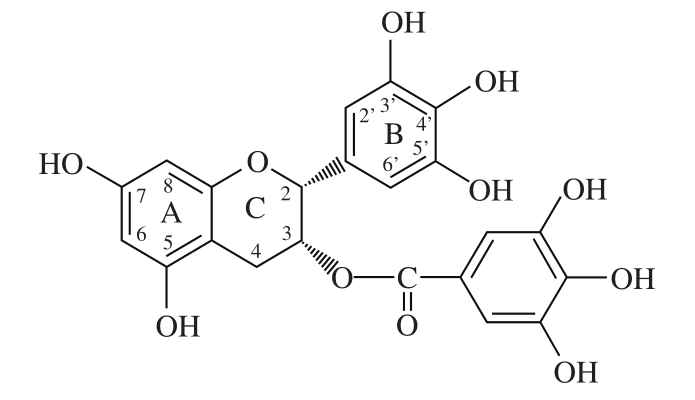
图1 EGCG的化学结构式
Fig.1 Structure of EGCG
大米作为世界范围内的主要粮食,我国2/3人口的主食,由于水体和土壤污染的加剧使其较其他粮食作物更易受到重金属污染。就重金属镉(Cd)污染而言,19世纪80年代日本因食用Cd污染稻米引发的骨痛病事件曾引起全世界的广泛关注,直到现在日本仍然存在严重的大米Cd污染问题[1-2]。而目前在我国大米重金属Cd污染的形势较为严峻[3]。Cd是迄今已知的最易在体内蓄积的重金属之一,其在人肾脏、肝脏等组织中的半衰期可达10~30 年[1]。人体的Cd暴露途径主要是通过膳食,消化后Cd通过与人体消化道肠上皮细胞的特异性金属转运蛋白如DMT-1和MTP1结合,运输到血液,然后与各组织器官中的金属硫蛋白结合,开始长时间的蓄积[4]。Cd的肠吸收量被认为与其在膳食中污染浓度成正比,然而膳食中其他因素也会影响Cd的生物有效性[5]。除Fe、Zn、Ca等金属元素对Cd的生物有效性有较大影响外[6-8],茶多酚可促进机体内Cd排除、降低Cd毒性[9-10]。表没食子儿茶素没食子酸酯((-)-epigallocatechin-3-gallate,EGCG)是茶多酚中生物活性显著的儿茶素类单体,含量占儿茶素的80%[11],其结构如图1[12]所示。EGCG的C环上的没食子基使其成为过渡金属元素(如铁和铜)螯合剂[13]。

图1 EGCG的化学结构式
Fig.1 Structure of EGCG
人体消化吸收过程复杂,体内实验模型较难建立。因此,可基于体内消化环境模拟建立体外消化模型。RIVM(Rijksinstituut voor volksgezondheid en milieu)法是由Oomen等[14-15]创建的口腔-胃-小肠三步模拟法,可用于对有机污染物和土壤中金属离子生物可给性的研究。机体对物质的吸收一般在小肠中进行Caco-2细胞来源于人结肠癌细胞系,其多种特性与小肠细胞类似,在食品科学领域中活性物质吸收代谢方面有广泛的应用[16]。但Caco-2作为模型的重要不足是Caco-2细胞间紧密联接程度比正常小肠细胞高,且缺乏分泌小肠黏液的能力[17]。因此,为了更好地模拟机体肠吸收功能,细胞共培养技术越来越受到关注。研究发现,HT-29细胞是可产生黏液的杯状细胞,能补充Caco-2细胞缺乏的分泌黏液的能力,形成与小肠上皮细胞类似的黏液层[18],其与Caco-2细胞共培养可更加精确地模拟人体小肠上皮细胞吸收过程。Stuknytė等[19]首次在体外模拟胃肠消化实验中证实了面包和面食样品中释放了小麦面筋蛋白外啡肽A5和C5,并且采用Caco-2/HT-29细胞共培养肠吸收模型验证了A5和C5通过人肠黏膜转运的可能性,表明食物经体外胃肠消化后与Caco-2/HT-29细胞共培养肠吸收模型联用,可模拟食物的消化和吸收的全过程。
因此,本研究结合体外口腔-胃肠消化,采用已建立并验证的Caco-2/HT-29细胞共培养模型,分析主食米饭中Cd在胃肠消化阶段的生物可给性,以及EGCG对Cd肠吸收阶段的吸收转运率影响,初步探究其影响机理,为利用EGCG降低大米主食中Cd的吸收转运提供理论参考。
Cd污染大米(Cd含量为(0.720±0.006)mg/kg)产自湖南某矿区;Caco-2和HT-29细胞株 武汉大学细胞保藏中心(中国典型培养物保藏中心);6 孔Transwell细胞转运小室 美国Corning公司;TC20细胞计数仪美国Bio-Rad公司。
EGCG标准品(纯度≥95%)、淀粉酶、尿酸、胰酶美国Sigma-Aldrich公司;Cd、Ca、Fe、Zn、Cu、Mg、Mn元素标准液 国家标准物质中心;高糖细胞培养基(Dulbecco’s modified Eagle medium,DMEM)、0.25%胰蛋白酶、胎牛血清、青链霉素 美国Gibco公司;Hank’s平衡盐溶液(Hank’s balanced salt solution,HBSS)、不含Ca、Mg的磷酸盐缓冲液(phosphate buffered saline,PBS)、非必需氨基酸、L-谷氨酰胺美国Hyclone公司;黏蛋白、牛胆粉、脂肪酶 上海源叶生物科技有限公司;D-葡萄糖醛酸、牛血清白蛋白长沙市迈科为生物科技有限公司;胃蛋白酶 北京索莱宝科技有限公司;正丁酸、盐酸(含量36%~38%)、氯化钾、硫氰酸钾、一水合磷酸二氢钠、无水硫酸钠、氯化钠、碳酸氢钠、尿素、无水氯化钙、氯化铵、无水葡萄糖、磷酸二氢钾、六水合氯化镁、氢氧化钠、盐酸葡萄糖胺 国药集团化学试剂有限公司。
ME204/02电子天平 梅特勒托利多仪器上海有限公司;四两装万能粉碎机 浙江屹立工贸有限公司;DSI2-300A水浴恒温振荡器 太仓市实验设备厂;HHD-2型电热恒温水浴锅 上海比朗仪器有限公司;WK2102T电磁炉 美的集团;0.22 µm滤膜 美国Life Sciences公司;SORVALL LYNX6000高速冷冻离心机、3111系列二氧化碳培养箱 德国Thermo Scientific公司;SW-CJ超净工作台 苏州安泰空气技术有限公司;XDS-10倒置生物显微镜 上海团结仪器制造有限公司;DK-98电热恒温水浴锅 天津市泰斯特仪器有限公司;5418R低温台式离心机 德国Eppendorf公司;Mars5型微波消解仪 美国CEM公司;7700x型电感耦合等离子体质谱(inductively coupled plasma-mass spectrometry,ICP-MS)仪 美国安捷伦公司。
1.3.1 样品制备
将大米样品挑拣去除杂质,称取100 g放入粉碎机进行粉碎,然后过80 目筛,装袋密封,即为生大米粉样品,用于大米原料中Cd及其他金属元素含量测定。
准确称取10.00 g未淘洗去杂大米样品(随机平行挑选9 组),将其置于干净且质量恒定的铝盒(直径7 cm)中,于分析天平上准确加入15.00 g超纯水,盖上铝盒盖子于电磁炉上蒸20 min,取出,待冷却至室温,即为米饭样品。准确称量9 组平行样的质量(精确到小数点后4 位),计算1 g大米蒸煮后所得米饭质量。
1.3.2 体外模拟口腔-胃肠消化
参照Oomen等[15]的方法建立体外模拟胃肠消化模型,模拟消化液的配制见表1。
表1 模拟消化液的配制
Table1 Preparation of simulated digestive juices
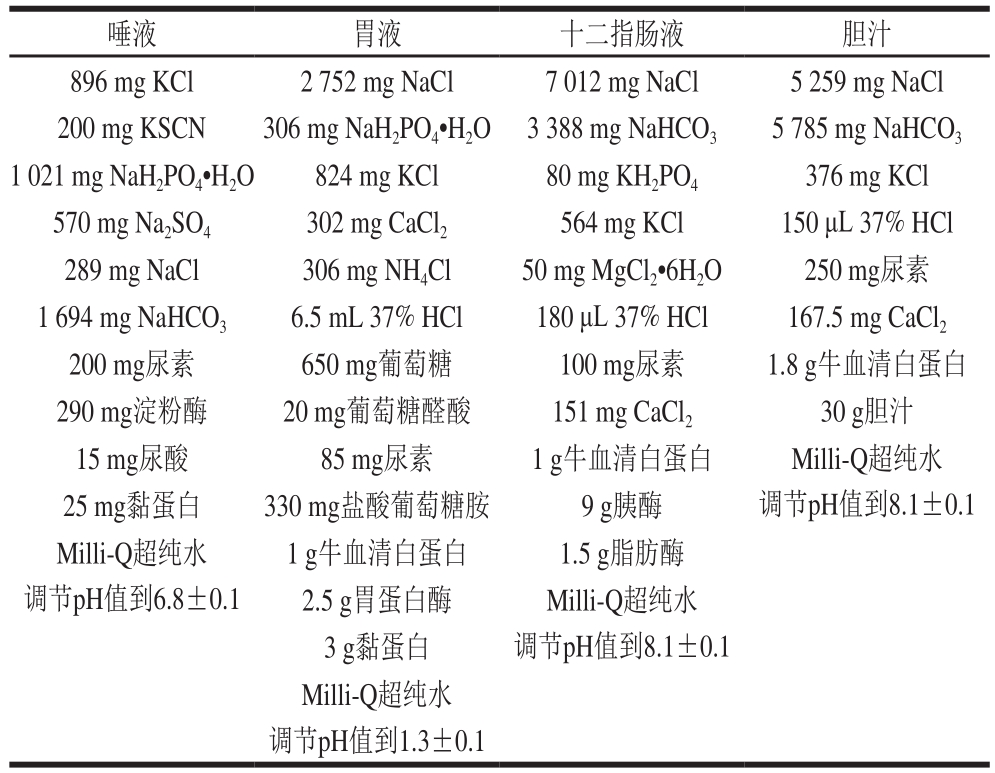
唾液 胃液 十二指肠液 胆汁896 mg KCl 2 752 mg NaCl 7 012 mg NaCl 5 259 mg NaCl 200 mg KSCN 306 mg NaH2PO4•H2O 3 388 mg NaHCO35 785 mg NaHCO31 021 mg NaH2PO4•H2O 824 mg KCl 80 mg KH2PO4376 mg KCl 570 mg Na2SO4302 mg CaCl2564 mg KCl 150 μL 37% HCl 289 mg NaCl 306 mg NH4Cl 50 mg MgCl2•6H2O 250 mg尿素1 694 mg NaHCO36.5 mL 37% HCl 180 μL 37% HCl 167.5 mg CaCl2200 mg尿素 650 mg葡萄糖 100 mg尿素 1.8 g牛血清白蛋白290 mg淀粉酶 20 mg葡萄糖醛酸 151 mg CaCl230 g胆汁15 mg尿酸 85 mg尿素 1 g牛血清白蛋白 Milli-Q超纯水25 mg黏蛋白 330 mg盐酸葡萄糖胺 9 g胰酶 调节pH值到8.1±0.1 Milli-Q超纯水 1 g牛血清白蛋白 1.5 g脂肪酶调节pH值到6.8±0.1 2.5 g胃蛋白酶 Milli-Q超纯水3 g黏蛋白 调节pH值到8.1±0.1 Milli-Q超纯水调节pH值到1.3±0.1
口腔消化:将制备好的米饭样品全部取出,用研钵均匀捣碎,准确称量到150 mL具塞三角瓶中,加入10 mL唾液,在37 ℃下,以55 r/min的转速振荡孵育5 min。
胃消化:向上述口腔消化食糜中加入20 mL胃液,添加体积分数10% HCl溶液或1 mmol/L NaOH溶液调整pH值到2.5±0.5,在37 ℃下,以55 r/min的转速振荡孵育2 h,取出3 个平行样品放入-20 ℃冰箱中保存1 h后转移至0 ℃,作为胃消化阶段待测样品,备用。其余样品进行后续实验。
肠消化:向上述胃消化食糜中加入30 mL十二指肠液、10 mL胆汁,添加体积分数10% HCl溶液或1 mmol/L NaOH溶液调整pH(6.5±0.5),在37 ℃下,以55 r/min的转速振荡孵育3 h和5 h,各取出3 个平行样放入-20 ℃保存后1 h转移至0 ℃,作为肠消化阶段不同消化时间的待测样品,备用。
消化过程结束时,将0 ℃保存的样品,在95 ℃恒温水浴锅中灭酶10 min,全部转移到高速离心管中,于高速冷冻离心机10 000 r/min离心30 min,取上清液过0.22 µm滤膜后,滤液放置4 ℃冰箱冷藏保存,用于后续的ICP-MS测定及吸收实验。
1.3.3 体外模拟肠吸收
1.3.3.1 建立Caco-2/HT-29细胞共培养肠吸收模型
将Caco-2和HT-29细胞按照7∶3的比例,接种到6 孔Transwell小室AP侧的聚酯薄膜上,并且调整最终总细胞浓度约为5×104个/mL,AP侧加入完全培养基1.5 mL,BL侧加入完全培养基2.5 mL,放置于5%的CO2细胞培养箱中37 ℃培养,待细胞贴壁且几乎长满时(2~3 d),更换添加1 mol/L丁酸的完全培养基,每2 d更换培养基,培养11 d,每组3 个平行。以上Caco-2/HT-29细胞共培养模型经前期实验验证,可应用于后续的吸收实验。
1.3.3.2 模拟肠吸收转运实验
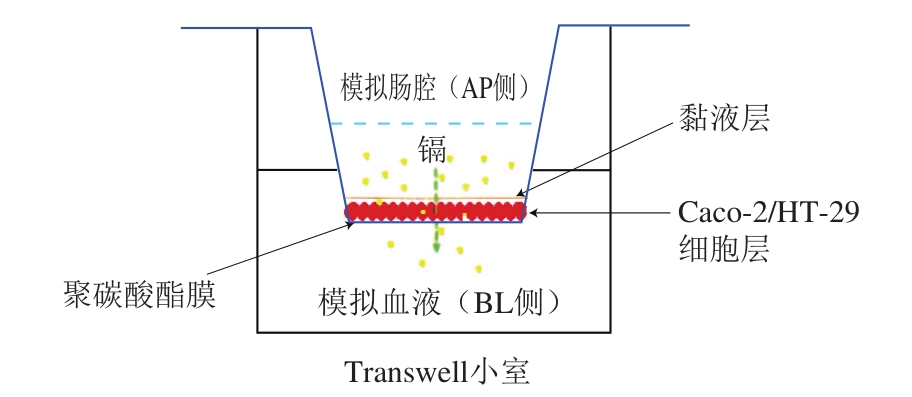
图2 肠吸收转运Caco-2/HT-29细胞共培养模型示意图
Fig.2 Schematic diagram for the co-culture of Caco-2/HT-29 cells in small intestine
肠吸收转运实验在建立好的Caco-2/HT-29细胞共培养肠吸收模型中进行(图2)。将模型从细胞培养箱中取出,小心吸取Transwell小室AP侧和BL侧的培养基,用37 ℃预热的PBS(无Ca、Mg)轻轻洗2 次。分别将37 ℃预热的米饭胃、肠消化液滤液1.5 mL加入到AP侧,BL侧加入2.5 mL HBSS(无Ca、Mg),将Transwell小室放置细胞培养箱中,2 h后转运实验结束,收集AP侧溶液约1.5 mL,用于ICP-MS测定。
1.3.4 EGCG对吸收转运率的影响
将50 mg EGCG标准品溶于50 mL的棕色容量瓶中,配制成2 182 µmol/L的标准储备液。用大米样品消化液滤液将EGCG标准储备液稀释成21.82 µmol/L和43.64 µmol/L的工作液,37 ℃预热。将建立好的Caco-2/HT-29(细胞浓度比7∶3)细胞共培养肠吸收模型从细胞培养箱中取出,小心吸取Transwell小室AP侧和BL侧的培养基,用预热的PBS(无Ca、Mg)清洗2 次。分别将1.5 mL消化液和含两种浓度EGCG的消化液滤液加入到AP侧,BL侧加入2.5 mL HBSS(无Ca、Mg),将Transwell小室放置细胞培养箱中,2 h后转运实验结束,收集AP侧溶液约1.5 mL,用于ICP-MS测定。
1.3.5 ICP-MS测定元素含量
分别测定大米、米饭、米饭消化液、EGCG添加前后米饭消化液经肠吸收转运后Cd及其他主要金属元素的含量。
分别准确称取0.5 g制备好的生大米粉及米饭样品,1.0 g消化液滤液以及吸收过程Transwell小室AP侧收集得到的溶液。将上述样品置于聚四氟乙烯微波消解罐中,加HNO35~7 mL且加盖密封,浸泡过夜。将消解罐对称放入微波消解仪中,120 ℃消解3 min,180 ℃消解10 min,爬升时间分别为5 min和10 min。消解结束后,取出消解罐冷却,将样液转移到25 mL烧杯,180 ℃加热赶酸。消解液剩余约1 mL后取下烧杯,冷却后转移到25 mL容量瓶中,用少量超纯水多次洗涤消化罐,合并洗涤液,用超纯水定容后混匀,同时做试剂空白。采用ICP-MS测定元素的含量,每组样品平行测定3 次[20]。
1.3.6 生物可给性的测定
生物可给性是指污染物在胃肠环境中可以溶出的比例,表示基质中污染物可被人体吸收的相对量[21]。
米饭中Cd及其他主要金属元素的生物可给性由式(1)计算。
式中:ρIV为消化液中可溶性元素质量浓度/(mg/L);VIV为消化反应液的体积/L;TC为米饭样品中该金属元素含量/(mg/kg);mC为模拟消化中加入米饭质量/kg。
1.3.7 吸收转运率的测定
采用Caco-2/HT-29细胞共培养模型来模拟机体小肠上皮细胞吸收转运的过程,米饭消化液中Cd及其他主要金属元素的转运吸收率由式(2)计算。
式中:ρ为Transwell小室AP侧元素的质量浓度/(mg/L);V为AP侧溶液的体积/mL;ρD为AP侧加入胃肠消化液中元素的质量浓度/(mg/L);VD为AP侧加入胃肠消化液的体积/mL。
所有实验平行测定3 次,结果以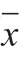 ±s表示。实验数据采用SPSS 17.0 Duncan’s新复极差分析数据的差异性(P<0.05)。
±s表示。实验数据采用SPSS 17.0 Duncan’s新复极差分析数据的差异性(P<0.05)。
表2 生大米及其蒸煮米饭中Cd及其他金属元素含量
Table2 Contents of cadmium and other metal elements in raw and cooked rice
mg/kg md

注:同列肩标小写字母不同表示差异显著(P<0.05)。
样品 Cd Fe Ca Cu Zn Mg Mn大米 0.724±0.006a7.576±0.353a74.608±2.517a2.328±0.006a8.602±0.018b437.717±3.032a14.855±0.063a米饭 0.712±0.004a4.481±0.221b57.792±2.990b2.043±0.018a8.776±0.016a351.687±1.488b14.054±0.127b
由表2可知,大米经蒸煮后Cd的含量无显著性差异。除Cu含量无显著性差异和Zn有略微升高外,Fe、Ca、Mg、Mn这4 种元素含量均存在不同程度的降低,推测其降低的原因可能与蒸煮过程中有小部分金属元素溶解有关,该部分金属元素通常会与蛋白质结合,热处理促使蛋白质降解,从而使部分金属元素作为自由态盐离子或者与可溶态的氨基酸、蛋白质结合,溶解于蒸煮米水中,随水分被挥发并残留在铝盒盖子上凝结的水中。
表3 Cd污染米饭胃肠消化阶段Cd及其他金属元素生物可给性
Table3 Bioavailability of cadmium and other metal elements in rice samples after gastric and gastrointestinal digestion%
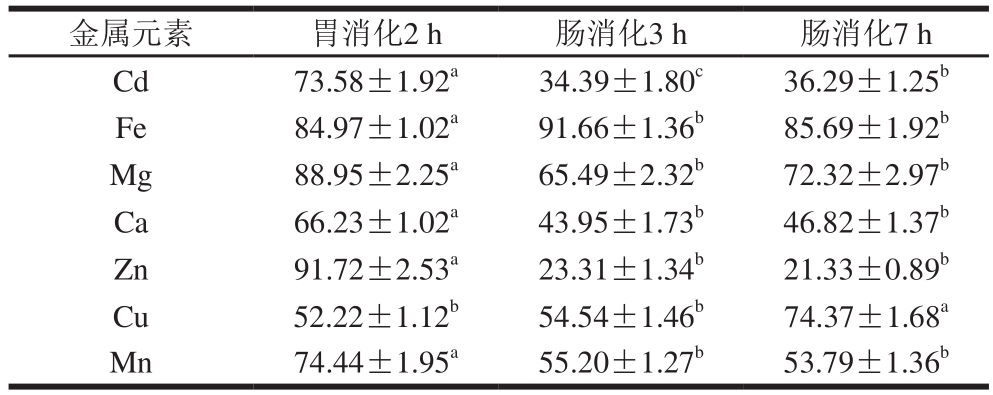
注:同行肩标小写字母不同表示差异显著(P<0.05)。
金属元素 胃消化2 h 肠消化3 h 肠消化7 h Cd 73.58±1.92a34.39±1.80c36.29±1.25bFe 84.97±1.02a91.66±1.36b85.69±1.92bMg 88.95±2.25a65.49±2.32b72.32±2.97bCa 66.23±1.02a43.95±1.73b46.82±1.37bZn 91.72±2.53a23.31±1.34b21.33±0.89bCu 52.22±1.12b54.54±1.46b74.37±1.68aMn 74.44±1.95a55.20±1.27b53.79±1.36b
生物可给性可描述摄入的食物中污染物经消化释放进入消化液中物质的相对百分率。如表3所示,米饭样品分别在胃和小肠消化阶段的Cd及其他主要金属元素的生物可给性。其中Cd经胃消化2 h的生物可给性为(73.58±1.92)%,肠消化7 h的生物可给性为(36.29±1.25)%。该研究结果与Zhuang Ping等[22]得出的蒸煮大米在胃消化阶段的生物可给性为70%~74%,在肠消化阶段为41%~46%的结果相近。Cd胃消化阶段的生物可给性大于肠消化阶段,这可能是因为大米胚乳中的Cd集中于蛋白质中[23],而胃消化阶段的主要消化酶是胃蛋白酶,大米经蒸煮后淀粉熟化、蛋白质变性,胃液中酸性条件下(pH 2.5左右)大米中绝大多数蛋白质失活变性、肽键断裂[24],原本被淀粉包裹的蛋白质暴露出来,被胃蛋白酶水解,与蛋白质结合的Cd大量释放进入消化液。胃消化后已经没有完整的米饭粒存在,进入小肠后,从强酸性升到pH 6.5左右,重金属与蛋白质分解产生的Met、Cys等含硫氨基酸以及谷胱甘肽等结合,这些络合物高度疏水,在弱酸的环境中形成不溶性沉淀,并且吸附在食糜上,随着消化过程的继续,消化液中已释放的Cd又被重新吸附[25]。研究发现,pH值是影响金属离子在溶液中生物吸附的重要因素,直接影响金属离子在溶液中的溶解度,也影响着金属离子对吸附剂吸附位点的竞争[26]。除了Cd以外,从表3还可看出,Ca、Mg、Zn和Mn等元素的生物可给性在小肠消化阶段均显著小于胃消化阶段,而Fe和Cu元素相反,分析可能的原因是Fe和Cu在整个消化阶段的吸附和释放过程中,释放的量要大于吸附量。
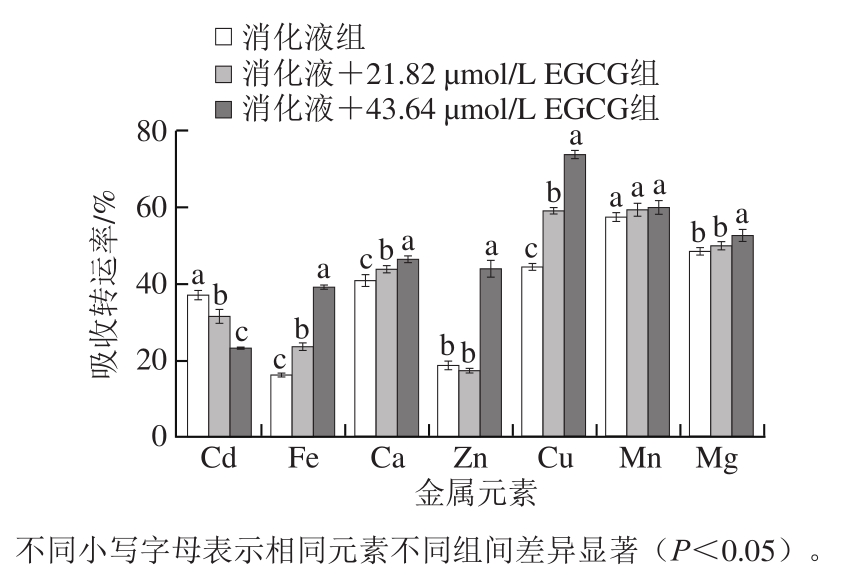
图3 EGCG对消化液中Cd及其他主要金属元素吸收转运率的影响
Fig.3 Effect of EGCG on absorption and transport rates of cadmium and other major metal elements in digestive fluid
膳食中污染物Cd消化后主要是在机体内的小肠部位吸收。本实验采用细胞共培养模型模拟肠吸收过程,通过ICP-MS测定计算出Cd及其他主要金属元素的吸收转运率。由图3可知,与对照样组相比,添加EGCG可降低Cd的转运吸收率,且随着EGCG浓度的增加显著降低,21.82 µmol/L和43.64 µmol/L EGCG使Cd的转运吸收率较对照组分别降低了5.56%和13.89%;而除Mn外,43.64 µmol/L EGCG使其他5 种金属元素Fe、Ca、Zn、Cu和Mg的吸收转运率均显著增大。
EGCG能降低米饭消化液中Cd的转运吸收,可能是由于,一方面,EGCG的多—OH结构能够将游离的金属离子固定,消减金属离子被机体的吸收,而且EGCG对金属离子的螯合顺序也可能存在差异,这就会产生EGCG和金属离子间的螯合反应对机体内金属离子含量动态平衡的影响[27]。另一方面,Cd是机体的非必需元素,因此,机体内没有专门负责Cd吸收转运的特定通路及载体,Cd只能通过竞争必需金属离子的转运载体进入机体细胞。研究发现,可转运Cd的载体主要包括铁转运载体DMT1、Ca2+通道(电压门控钙通道)和钙库调控的钙通道以及锌铁调控蛋白ZIP家族中的ZIP8和ZIP14等[28]。在小肠中DMT1仅表达于小肠绒毛的肠上皮细胞[29],其表达受到许多因素影响,进而会影响机体对Cd的吸收,而机体Fe水平与DMT1的表达之间存在负调节关系[30]。由于Ca2+和Cd2+具有相似的离子半径,Cd2+也能利用Ca2+通道,而Cd导致机体细胞损伤的主要原因就是破坏细胞内的钙稳态平衡[31]。研究发现,TRPV5和TRPV6通道不仅对Ca2+表现出高度的选择性,而且在Ca2+缺乏的小鼠小肠细胞内,当其他Cd转运载体表达减少的情况下,二者的mRNA仍高度表达,同时小肠的Cd吸收增加,说明TRPV5和TRPV6也存在转运Ca2+的可能[32]。非特异性锌转运体ZIP,除吸收转运锌以外,其中ZIP8和ZIP14具有吸收转运Cd的作用[33-34]。Girijashanker等[35]研究发现,ZIP14在大鼠十二指肠、肝脏、脑部和睾丸高度表达,尤其对Cd2+有较高的亲和力,但易受到Zn2+、Cu2+和Mn2+的抑制。
从图3中可知,随着EGCG浓度的增大,Fe、Ca、Zn、Cu和Mg元素的吸收转运率均显著提高,推测Cd转运吸收率的降低也可能是由于EGCG直接或间接上调了这5 种金属元素的吸收转运,这些金属离子吸收转运率的增加竞争性抑制Cd2+的吸收载体和通道,从而降低细胞对Cd2+的吸收转运。Yu Haining等[36]研究发现,EGCG能使PC-3细胞减少对Cd2+的吸收,而增加对Zn2+的吸收,这种影响取决于EGCG和Cd2+的浓度及添加顺序,分析其原因可能是Cd2+影响了EGCG的构象。
本实验利用已建立的体外口腔-胃-肠消化模型和Caco-2/HT-29细胞共培养肠吸收模型,揭示出EGCG能够有效降低米饭消化液中污染物Cd的吸收转运。EGCG具有多种对人体有益的功效,并且其具有食用安全、成本相对低以及生物利用率高等优点,因此有望成为降低Cd暴露人群健康危害的一项膳食干预方法。在后续研究中,拟采用动物实验,进一步研究EGCG对大米中污染物Cd吸收转运的影响机理。
[1] DUCPHUC H, KIDO T, DUNG M H, et al. A 28-year observational study of urinary cadmium and β2-microglobulin concentrations in inhabitants in cadmium-polluted areas in Japan[J]. Journal of Applied Toxicology, 2016, 36(12): 1622-1628. DOI:10.1002/jat.3327.
[2] KUBO K, NOGAWA K, KIDO T, et al. Estimation of benchmark dose of lifetime cadmium intake for adverse renal effects using hybrid approach in inhabitants of an environmentally exposed river basin in Japan[J]. Society of Risk Analysis, 2017, 37(1): 20-26. DOI:10.1111/risa.12750.
[3] HU Y A, CHENG H F, TAO S. The challenges and solutions for cadmium-contaminated rice in China: a critical review[J].Environment International, 2016, 92/93: 515-532. DOI:10.1016/j.envint.2016.04.042.
[4] RYU DY, LEE S J, PARK D W, et al. Dietary iron regulates intestinal cadmium absorption through iron transporters in rats[J]. Toxicology Letters, 2004, 152(1): 19-25. DOI:10.1016/j.toxlet.2004.03.015.
[5] REEVES P G, CHANEY R L. Bioavailability as an issue in risk assessment and management of food cadmium: a review[J]. Science of the Total Environment, 2008, 398(1/2/3): 13-19. DOI:10.1016/j.scitotenv.2008.03.009.
[6] YU H Y, LIU C, ZHU J, et al. Cadmium availability in rice paddy fields from a mining area: the effects of soil properties highlighting iron fractions and pH value[J]. Environmental Pollution, 2016, 209(1):38-45. DOI:10.1016/j.envpol.2015.11.021.
[7] RENTSCHLER G, KIPPLER M, AXMON A, et al. Cadmium concentrations in human blood and urine are associated with polymorphisms in zinc transporter genes[J]. Metallomics Integrated Biometal Science, 2014, 6(4): 885-891. DOI:10.1039/c3mt00365e.
[8] YANG Y, CHRN R, FU G, et al. Phosphate deprivation decreases cadmium (Cd) uptake but enhances sensitivity to Cd by increasing iron (Fe) uptake and inhibiting phytochelatins synthesis in rice(Oryza sativa)[J]. ActaPhysiologiaePlantarum, 2016, 38(1): 1-13.DOI:10.1007/s11738-015-2055-9.
[9] 陈慧中. 茶多酚、维生素-C对急性镉毒性影响的实验研究[D].沈阳: 中国医科大学, 2003: 13-22.
[10] 王文祥, 廖惠珍, 曹建平. 茶多酚拮抗镉致雄性大鼠生殖毒性的初步研究[J]. 毒理学杂志, 2005, 19(增刊3): 271-271. DOI:10.16421/j.cnki.1002-3127.2005.s1.205.
[11] YANG C S, LAMBERT J D, HOU Z, et al. Molecular targets for the cancer preventive activity of tea polyphenols[J]. Molecular Carcinogenesis, 2006, 45(6): 431-435. DOI:10.1002/mc.20228.
[12] DEVIKA P T, STANELY M P P. (-)Epigallocatechin-gallate (EGCG)prevents mitochondrial damage in isoproterenol-induced cardiac toxicity in albino Wistar rats: a transmission electron microscopic and in vitro study[J]. Pharmacological Research, 2008, 57(5): 351-357.DOI:10.1016/j.phrs.2008.03.008.
[13] HIGDON J V, FREI B. Tea catechins and polyphenols: health effects, metabolism, and antioxidant functions[J]. Critical Reviews in Food Science and Nutrition, 2003, 43(1): 89-143.DOI:10.1080/10408690390826464.
[14] OOMEN A G, HACK A, MINEKUS M, et al. Comparison of five in vitro digestion models to study the bioaccessibility of soil contaminants[J]. Environmental Science & Technology, 2002, 36(15):3326-3334. DOI:10.1021/es010204v.
[15] OOMEN A G, ROMPELBERG C J M, BRUIL M A, et al.Development of an in vitro digestion model for estimating the bioaccessibility of soil contaminants[J]. Archives of Environmental Contamination Toxicology, 2003, 44(3): 281-287. DOI:10.1007/s00244-002-1278-0.
[16] 黄海智, 陈健乐, 程焕, 等. Caco-2细胞模型预测活性物质吸收代谢的研究进展[J]. 中国食品学报, 2015, 15(1): 164-172. DOI:10.16429/j.1009-7848.2015.01.025.
[17] MAHLER G J, SHULER M L, GLAHN R P. Characterization of Caco-2 and HT29-MTX cocultures in an in vitro digestion/cell culture model used to predict iron bioavailability[J]. Journal of Nutritional Biochemistry, 2009, 20(7): 494-502. DOI:10.1016/j.jnutbio.2008.05.006.
[18] 王振洲, 崔岩山, 张震南, 等. Caco-2细胞模型评估金属人体生物有效性的研究进展[J]. 生态毒理学报, 2014, 9(6): 1027-1034.DOI:10.7524/AJE.1673-5897-20131224001.
[19] STUKNYTĖ M, MAGGIONI M, CATTANEO S, et al. Release of wheat gluten exorphins A5 and C5 during in vitro gastrointestinal digestion of bread and pasta and their absorption through an in vitro model of intestinal epithelium[J]. Food Research International, 2015,72: 208-214. DOI:10.1016/j.foodres.2015.04.002.
[20] 张高强, 袁建, 贾继荣, 等. 电感耦合等离子体质谱法(ICP-MS)测定大米中27 种元素的含量[J]. 粮食与饲料工业, 2016, 12(11): 14-17;24. DOI:10.7633/j.isn.1003-6202.2016.11.004.
[21] 徐笠, 陆安祥, 王纪华, 等. 食物中重金属的生物可给性和生物有效性的研究方法和应用进展[J]. 生态毒理学报, 2017, 12(1): 89-97.DOI:10.7524/AJE.1673-5897.20160707001.
[22] ZHUANG Ping, ZHANG Chaosheng, LI Yingwen, et al. Assessment of influences of cooking on cadmium and arsenic bioaccessibility in rice, using an in vitro, physiologically-based extraction test[J]. Food Chemistry, 2016, 213: 206-214. DOI:10.1016/j.foodchem.2016.06.066.
[23] 方勇, 夏季, 李红梅, 等. 基于体外模拟消化/Caco-2细胞模型测定大米中铅的生物有效性[J]. 食品科学, 2016, 37(16): 199-204.DOI:10.7506/spkx1002-6630-201616032.
[24] GOODMAN B E. Insights into digestion and absorption of major nutrients in humans[J]. Advances in Physiology Education, 2010,34(2): 44-53. DOI:10.1152/advan.00094.2009.
[25] AZIZ R, RAFIQ M T, LI T Q, et al. Uptake of cadmium by rice grown on contaminated soils and its bioavailability/toxicity in human cell line(Caco-2/HL-7702)[J]. Journal of Agricultural and Food Chemistry,2015, 63: 3599-3608. DOI:10.1021/jf505557g.
[26] NOMANBHAY S M, PALANISAMY K. Removal of heavy metals from industrial wastewater usingchitosan coated oil palm shell charcoal[J]. Electronic Journal of Biotechnology, 2005, 8(1): 43-53.DOI:10.2225/vol8-issue1-fulltext-7.
[27] 安珍. EGCG拮抗Cd2+诱导的细胞凋亡机理及SiO2-NPs的细胞毒性研究[D]. 兰州: 兰州大学, 2015: 25-30.
[28] 于振, 朱毅, 罗云波. 机体细胞镉摄入离子转运通道研究进展[J].生态毒理学报, 2016, 11(4): 10-17. DOI:10.7524/AJE.1673-5897.20151007001.
[29] GUNSHIN H, MACKENZIE B, BERGER U V, et al.Cloning and characterization of a mammalian proton-coupled metaliontransporter[J]. Nature, 1997, 388: 482-491.
[30] GIORGI G, ROQUE M E. Iron overload induces changes of pancreatic and duodenal divalent metal transporter 1 and prohepcidin expression in mice[J]. Acta Histochemica, 2014, 116(2): 354-362. DOI:10.1016/j.acthis.2013.08.013.
[31] ZOU H, LIU X, HAN T, et al. Alpha-lipoic acid protects against cadmium-induced hepatotoxicity via calcium signalling and gap junctional intercellular communication in rat hepatocytes[J]. Journal of Toxicological Sciences, 2015, 40(4): 469-477. DOI:10.2131/jts.40.469.
[32] MIN K S, UEDA H, TANAKA K. Involvement of intestinal calcium transporter 1 and metallothionein in cadmium accumulation in the liver and kidney of mice fed a low-calcium diet[J]. Toxicology Letters,2008, 176(1): 85-92. DOI:10.1016/j.toxlet.2007.10.011.
[33] AIBA I, HOSSAIN A, KUO M T. Elevated GSH level increases cadmium resistance through down-regulation of Sp1-dependent expression of the cadmium transporter ZIP8[J]. Molecular Pharmacology, 2008, 74(3): 823-833. DOI:10.1124/mol.108.046862.
[34] MENDICINO G. ZIP14 and ZIP8 zinc/bicarbonate symporters in Xenopus oocytes: characterization of metal uptake and inhibition[J].Metallomics Integrated Biometal Science, 2012, 4(11): 1218-1225.DOI:10.1039/c2mt20177a.
[35] GIRIJASHANKER K, HE L, SOLEIMANI M, et al. Slc39a14 gene encodes ZIP14, a metal/bicarbonate symporter: similarities to the ZIP8 transporter[J]. Molecular Pharmacology, 2008, 73(5): 1413-1423.DOI:10.1124/mol.107.043588.
[36] YU Haining, SHEN Shengrong, YIN Junjie. Effects of interactions of EGCG and Cd2+on the growth of PC-3 cells and their mechanisms[J].Food & Chemical Toxicology, 2007, 45(2): 244-249. DOI:10.1016/j.fct.2006.08.015.
Effects of (-)-Epigallocatechin-3-gallate on Intestinal Absorption and Transport of the Pollutant Cadmium in Cooked Rice