众所周知,自由基与各种细胞信号转导之间存在密切的联系。体内代谢和外源性的自由基可通过细胞转导的途径调控细胞的状态,甚至介导疾病的发生与发展[1]。自由基具有很强的氧化作用,能够导致细胞内脂质、核酸和氨基酸的过氧化损伤,破坏细胞结构并引起细胞功能紊乱,从而致使细胞衰老、癌变甚至死亡[2-4]。细胞内的活性氧(reactive oxidative species,ROS)作为新陈代谢的产物在各类细胞中不断产生和清除,其种类包括O2-•、H2O2及HO2•、•OH等。一定浓度的ROS通过细胞氧化应激反应能够诱导细胞凋亡甚至导致其坏死,因此H2O2与细胞衰老、凋亡有着密切的联系。抗氧化体系是机体用来减缓和预防氧化的第一道防线,包括抗氧化酶类和非酶类物质,体内的大多数过氧化物都能够被此体系捕捉并清除。其中酶促系统主要包括过氧化氢酶(catalase,CAT)和超氧化物歧化酶(superoxide dismutase,SOD)等,是细胞内清除ROS的主要酶[5];非酶类主要是一些低分子物质,例如VC、VE[6]及谷胱甘肽(glutathione,GSH)等[7-8]。丙二醛(malondialdehyde,MDA)以及谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)是衡量机体抗氧化能力大小的重要因素[9-10]。黄酮在自然界的植物和浆果中广泛存在,它的功效是多方面的,包括较好的抗氧化性、改善心脑血管疾病、抗炎、抗癌和抗衰老等[11]。
牡丹属于毛莨科芍药属植物,具有“国色天香”之称。其根皮可以入药,其中含有牡丹酚和植物甾醇等生物活性成分[12]。花瓣中的抗氧化物质(总酚和类黄酮)的含量也很高,其水提液能够清除多种自由基[13]。牡丹籽则可以作为一种油料资源,其中含有多种药理成分,具有很高的营养价值[14]。但是关于牡丹花蕊的研究却较少。随着牡丹的综合利用及开发越来越多,近年来对牡丹花蕊中黄酮类化合物的研究也有了初步的进展。傅茂润等[15]的研究显示牡丹花蕊能够清除1,1-二苯基-2-三硝基苯肼自由基,具有很强的抗氧化性。李朝苹等[16]的研究表明牡丹花蕊的水提液中含有生物活性物质黄酮和总酚酸,其在体内外的抗氧化功效中发挥重要作用。目前大部分研究还集中于牡丹花蕊黄酮的提取、鉴定以及初步的体外抗氧化阶段,而关于牡丹花蕊黄酮对细胞及机体影响的研究很少。本实验通过创建RAW264.7巨噬细胞损伤模型,测定细胞和细胞培养液中各种抗氧化酶类(CAT和SOD等)以及小分子非酶物质(GSH)的水平,来研究牡丹花蕊黄酮对H2O2诱导的细胞损伤的抗氧化和抗炎能力,为开发牡丹花蕊黄酮的功能性食品及药物提供科学依据。
牡丹花蕊于2016年5月在洛阳牡丹园采得。
小鼠单核巨噬细胞RAW264.7 南京科佰生物科技有限公司;RPMI-1640培养基 美国Hyclone公司;噻唑蓝(methyl thiazoly1 tetrazolium,MTT) 美国Sigma公司;双抗(青霉素-链霉素)、胎牛血清、胰酶 美国Gibco公司;SOD、CAT、总抗氧化能力(total antioxidant capacity,T-AOC)、GSH-Px、GSH、MDA以及乳酸脱氢酶(lactate dehydrogenase,LDH)测定试剂盒 南京建成生物工程研究所;其余试剂均为分析纯。
SCIENTZ-10N冷冻干燥机 宁波新芝生物科技股份有限公司;CKX41倒置显微镜 日本OLYMPUS公司;SW-CJ-2FD型双人单面净化工作台 苏州净化设备有限公司;LDZX-50KB立式压力蒸汽灭菌器 上海申安医疗器械厂;E191IR型CO2细胞培养箱 美国金西盟公司;680全自动酶标仪 美国Bio-Rad公司;微型漩涡混合仪上海沪西分析仪器厂有限公司;HL-2D型恒流泵 上海圣科仪器设备有限公司;UV2400紫外-可见分光光度计上海舜宇恒平科学仪器有限公司;KQ-500DE型数控超声波清洗器 昆山市超声仪器有限公司。
1.3.1 牡丹花蕊黄酮的提取
称取过筛的牡丹花蕊粉末50 g,用体积分数为60%的乙醇溶液按料液比1∶30的比例混合,在提取温度60 ℃、功率300 W的条件下超声提取40 min,抽滤,50 ℃下减压浓缩至无乙醇味,真空冷冻干燥成粉备用。
1.3.2 牡丹花蕊黄酮的纯化
预处理D-101树脂,将1.3.1节中所得的牡丹花蕊黄酮粉末配制成质量浓度为2.0 mg/mL的上样液,以1.50 mL/min的上样流速对树脂进行纯化,先用3.0 BV蒸馏水以1.5 mL/min的流速洗脱除杂,再用体积分数为95%的乙醇溶液以3.0 mL/min的流速洗脱,收集乙醇洗脱液,旋转蒸发,真空冷冻干燥后置于4 ℃冰箱中保存,备用。采用分光光度法测定其含量,牡丹花蕊黄酮的质量分数大于70%。
1.3.3 RAW264.7巨噬细胞培养
先配制含质量分数1%双抗和质量分数10%的胎牛血清RPMI-1640培养基,再将细胞接种于装有适量培养基的细胞培养瓶中,置于37 ℃、5% CO2的细胞培养箱中培养[17]。细胞培养瓶中的细胞覆盖率达到70%~80%时进行传代,根据细胞的生长速率定时更换培养液。
1.3.4 RAW264.7巨噬细胞氧化损伤模型的建立
取对数生长期的RAW264.7巨噬细胞,按每孔200 μL的量接种于96 孔板中,调整细胞密度为2.0×105个/mL。在37 ℃、5% CO2条件下培养24 h,当细胞达到贴壁状态时,弃去上清液,加入由RPMI-1640培养基配制成的不同浓度梯度的H2O2溶液,每个梯度6 个平行。再培养24 h后,弃去上清液,用缓冲液洗涤2 次后,每孔分别加入200 μL的培养基及10 μL质量浓度为5 mg/mL的MTT,放入CO2培养箱中培养4 h后,弃去上清液,每孔加入150 μL二甲基亚砜,室温放置10 min,放入酶标仪于490 nm波长处测定吸光度,根据公式(1)计算细胞存活率。
式中:A0为空白组的平均吸光度;A1为不同浓度H2O2组的平均吸光度。
1.3.5 牡丹花蕊黄酮质量浓度的筛选
细胞培养过程同1.3.4节,仅将1.3.4节中所加入的RPMI-1640培养基配制的H2O2溶液换成同种培养基配制的不同质量浓度的牡丹花蕊黄酮溶液,并通过公式(1)计算细胞存活率。
1.3.6 细胞及细胞培养液中SOD、CAT、T-AOC、GSH-Px、GSH、MDA以及LDH水平的测定
将细胞密度为2.0×105个/mL的RAW264.7巨噬细胞接种于6 孔板中,每孔2.0 mL,放在37 ℃、5% CO2培养箱中培养。24 h后,细胞完全贴壁,吸弃细胞培养液,空白组和H2O2损伤组加入2.0 mL培养基;牡丹花蕊剂量组分别加入2.0 mL不同质量浓度的牡丹花蕊黄酮培养液;VC对照组加入2.0 mL质量浓度为250 μg/mL的VC培养液,置于培养箱中培养。24 h后,吸弃上清液,每孔加入800 μmol/L H2O2溶液2.0 mL,置于培养箱中培养4 h后将细胞和细胞培养液分离。细胞培养液离心(4 ℃、1 500 r/min、5 min)后取上清液待测;细胞用磷酸盐缓冲液清洗2 次后,采用吹打的方式收集细胞,离心(4 ℃、1 000 r/min、10 min)保留细胞团块,加入0.5 mL磷酸盐缓冲液,冰水浴条件下超声破碎(400 W,3~5 s/次,间隔30 s,重复3 次),待测。参照相应试剂盒方法测定细胞及细胞培养液中SOD、CAT、T-AOC、GSH-Px、GSH、MDA以及LDH水平。
利用DPS 7.5软件进行统计分析,测定数据以平均值±标准差表示。采用单因素方差分析并用LSD法进行多重比较, P<0.05表示差异显著。
由图1可知,各梯度的H2O2溶液对RAW264.7巨噬细胞的生长均有一定抑制作用,且细胞存活率随H2O2浓度的升高呈下降趋势。与空白组相比,不同浓度的H2O2抑制RAW264.7巨噬细胞生长的效果十分明显,当H2O2浓度为800 μmol/L时,RAW264.7巨噬细胞存活率为51.88%,则以此浓度作为RAW264.7巨噬细胞的半致死浓度。H2O2浓度过低时,不能有效抑制细胞的增殖,而H2O2浓度过高则会引起细胞死亡过量,因此建立细胞模型时,采用H2O2的浓度为800 μmol/L。
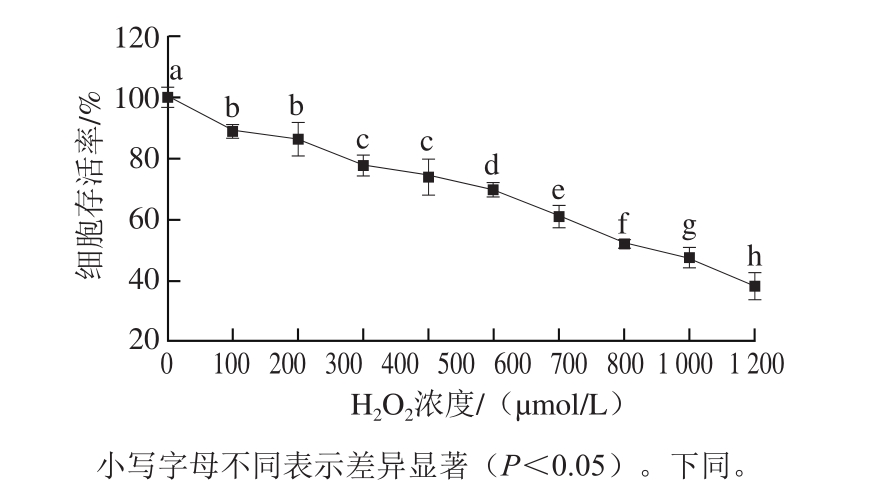
图1 不同浓度H2O2对RAW264.7巨噬细胞增殖作用的影响
Fig.1 Dose-dependent effects of hydrogen peroxide on the viability of RAW264.7 cells

图2 不同质量浓度牡丹花蕊黄酮对RAW264.7巨噬细胞增殖作用的影响
Fig.2 Dose-dependent effects of flavonoids from peony stamens on the viability of RAW264.7 cells
图2 表明,相较空白组,质量浓度在0~30 μg/mL范围内的牡丹花蕊黄酮均可以促进RAW264.7巨噬细胞的生长。当牡丹花蕊黄酮质量浓度低于10 μg/mL时,对RAW264.7巨噬细胞的促生长作用不明显;当其质量浓度为10、20、30 μg/mL时,促增殖作用显著(P<0.05)。当牡丹花蕊黄酮质量浓度大于30 μg/mL时,显著抑制增殖(P<0.05),因此,选择后续实验的牡丹花蕊黄酮质量浓度为10、20、30 μg/mL。
抗氧化物质的作用主要是维持内环境ROS的动态平衡,清除过多的ROS,使机体处于相对稳定的状态[18]。

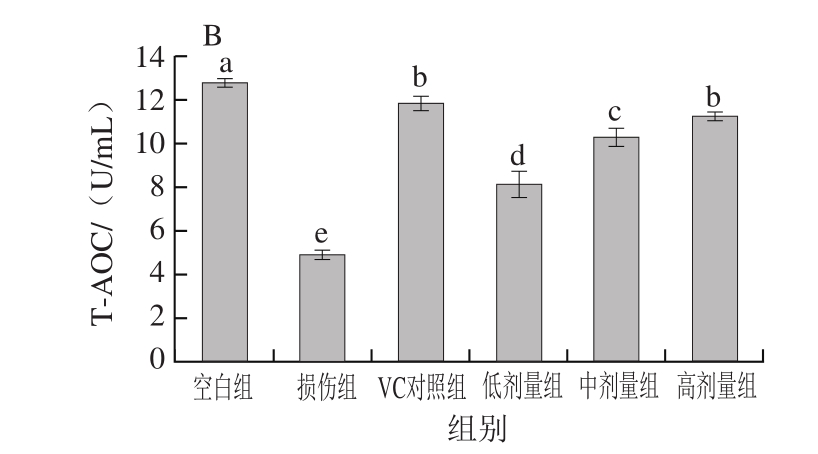
图3 RAW264.7巨噬细胞(A)及细胞培养液(B)的T-AOC
Fig.3 T-AOC activities in cultured RAW264.7 cells (A) and culture medium (B)
如图3所示,与空白组相比,H2O2损伤组的细胞及其培养液的T-AOC均明显降低(P<0.05);同时与H2O2损伤组相比,牡丹花蕊黄酮提高细胞及细胞培养液的T-AOC(P<0.05),且呈剂量依赖性。牡丹花蕊黄酮高剂量组在细胞及细胞培养液的T-AOC与VC对照组相比无显著差异(P>0.05),低、中剂量组在细胞及细胞培养液的T-AOC均低于VC对照组,且差异显著(P<0.05)。
SOD是一种重要的抗氧化剂,存在于各种生物细胞中,它能够将超氧化物转化为H2O2,H2O2再被CAT和过氧化物酶转化为无害的水,从而达到清除胞内自由基和保护细胞的作用[19]。
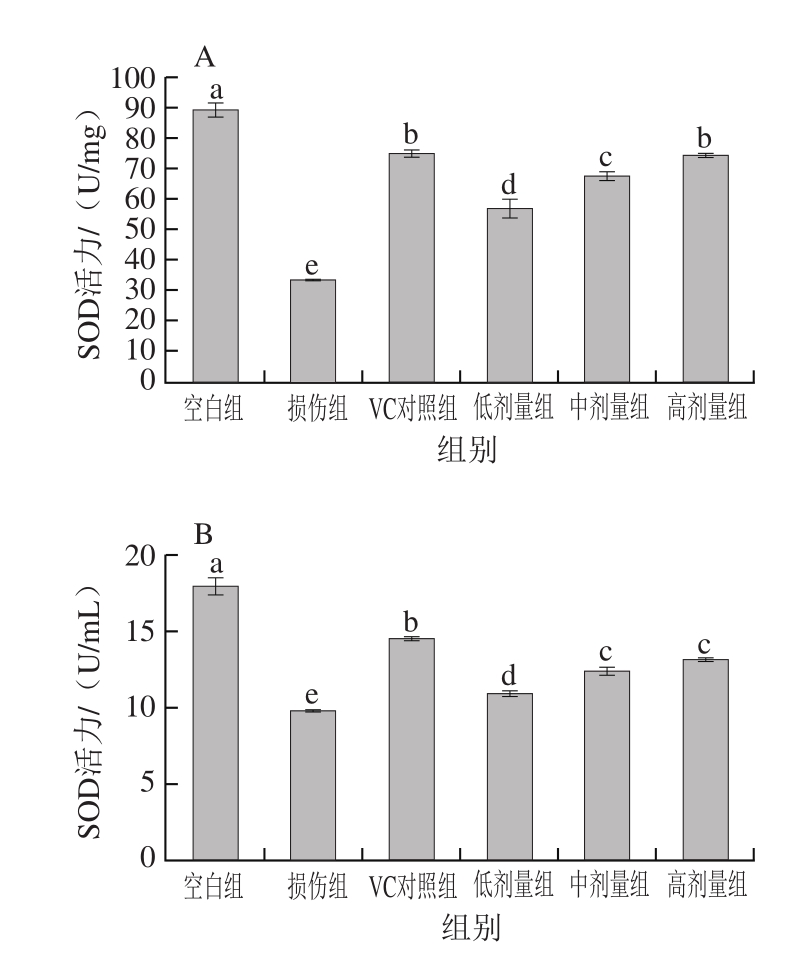
图4 RAW264.7巨噬细胞(A)及细胞培养液(B)中SOD活力
Fig.4 SOD activities in cultured RAW264.7 cells (A) and culture medium (B)
如图4所示,与空白组相比,H2O2损伤组细胞及细胞培养液中的SOD活力显著降低(P<0.05);与H2O2损伤组相比,牡丹花蕊黄酮能有效提高细胞中SOD活力,并呈剂量依赖性(P<0.05)。除牡丹花蕊黄酮高剂量组在细胞中的SOD活力接近VC对照组外(P>0.05),其他剂量组在细胞及细胞培养液中的SOD活力均低于VC对照组,差异显著(P<0.05)。
GSH是一种低分子清除剂,它可清除超氧自由基和H2O2,能够稳定含硫基的酶和抑制血红蛋白及其他辅因子的氧化损伤[20]。

图5 RAW264.7巨噬细胞(A)及细胞培养液(B)中GSH水平
Fig.5 GSH contents in cultured RAW264.7 cells (A) and culture medium (B)
如图5所示,与空白组相比,H2O2损伤组细胞和细胞培养液中的GSH水平显著降低(P<0.05);而与H2O2损伤组相比,牡丹花蕊黄酮各剂量组抑制了细胞及细胞培养液中GSH水平的下降。除牡丹花蕊黄酮高剂量组在细胞及细胞液中的GSH水平接近VC对照组外(P>0.05),其他剂量组在细胞及细胞培养液中的GSH水平均显著低于VC对照组(P<0.05)。VC对照组与空白组无显著差异(P>0.05)。
GSH-Px是一种过氧化物分解酶,它可以促进H2O2与GSH反应生成水及氧化型GSH,可以起到维持细胞膜结构和功能完整的作用[21]。

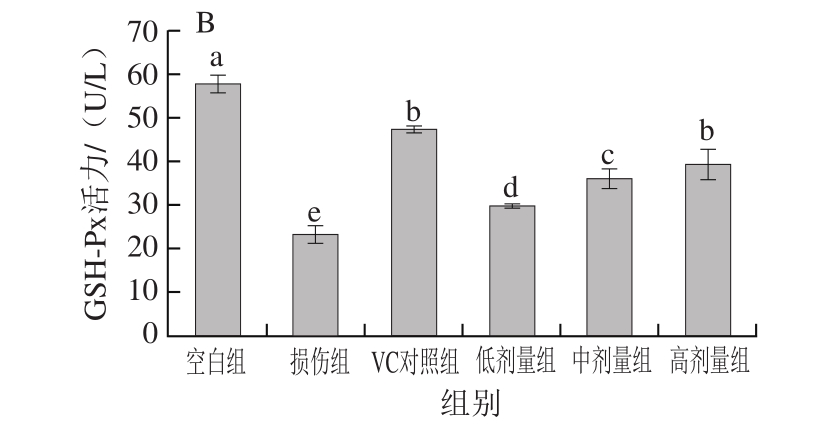
图6 RAW264.7巨噬细胞(A)及细胞培养液(B)的GSH-Px活力
Fig.6 GSH-Px activities in cultured RAW264.7 cells (A) and culture medium (B)
如图6所示,与空白组相比,H2O2损伤组细胞和细胞培养液中的GSH-Px活力显著降低(P<0.05),与H2O2损伤组相比,牡丹花蕊黄酮各剂量组显著提高细胞及细胞培养液中GSH-Px活力(P<0.05)。牡丹花蕊黄酮低、中、高剂量组之间存在明显的剂量依懒性(P<0.05)。VC对照组在细胞及细胞培养液中的GSH-Px活力显著高于牡丹花蕊黄酮各剂量组,且具有显著差异(P<0.05)。
细胞内的ROS能使生物膜中的多不饱和脂肪酸发生脂质化反应。一部分的脂质过氧化物能引起细胞代谢及功能障碍,甚至死亡。MDA水平能体现机体内脂过氧化物的水平,从而反映细胞损伤的程度[22]。

图7 RAW264.7巨噬细胞(A)及细胞培养液(B)中MDA水平
Fig.7 MDA contents in cultured RAW264.7 cells (A) and culture medium (B)
如图7所示,与空白组相比,H2O2损伤组细胞和细胞培养液中的MDA水平均显著升高(P<0.05)。与H2O2损伤组相比,牡丹花蕊黄酮低、中、高剂量组均显著抑制了H2O2引起的细胞和细胞培养液中MDA水平的增加,并呈剂量依赖性。牡丹花蕊黄酮高剂量组MDA水平显著低于VC对照组(P<0.05)。
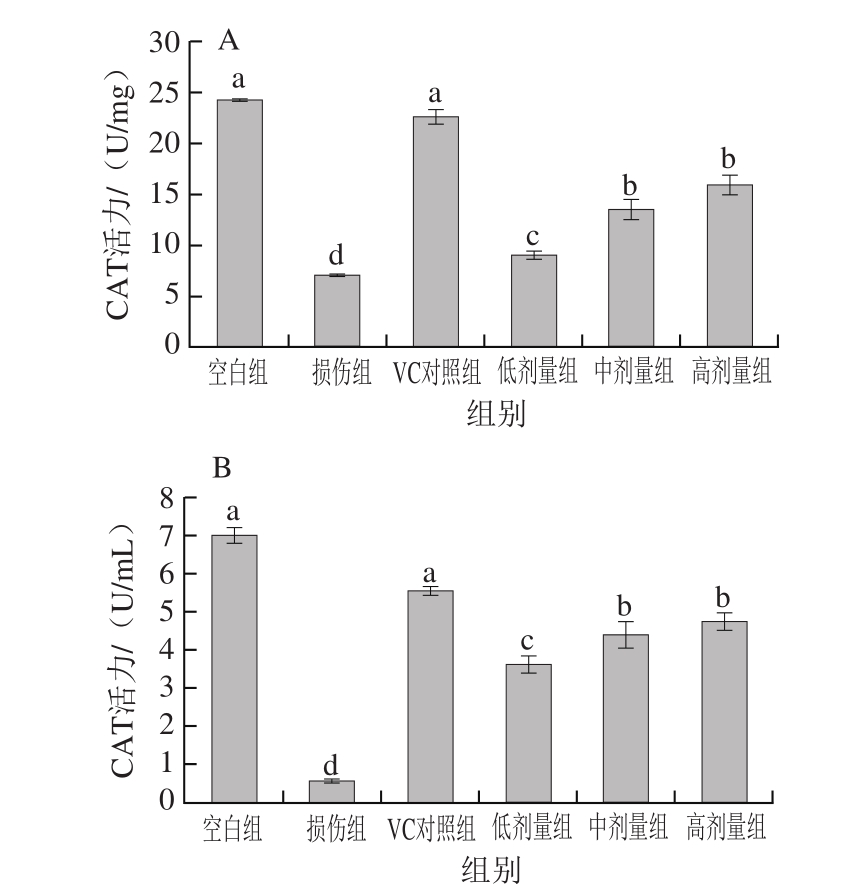
图8 RAW264.7巨噬细胞(A)及细胞培养液(B)的CAT活力
Fig.8 CAT activities in cultured RAW264.7 cells (A) and culture medium (B)
CAT是机体抗氧化体系的关键酶之一,能够将H2O2转化成氧和水,从而减轻细胞损伤[23]。如图8所示,与空白组相比,H2O2损伤组细胞和细胞培养液中的CAT活力显著降低(P<0.05),与H2O2损伤组相比,牡丹花蕊黄酮低、中、高剂量组显著提高了细胞及细胞培养液中CAT活力,并呈剂量依赖性(P<0.05)。VC对照组的细胞及细胞液中的CAT活力显著高于牡丹花蕊黄酮的各剂量组(P<0.05)。

图9 RAW264.7巨噬细胞(A)及细胞培养液(B)中LDH活力
Fig.9 LDH activities in cultured RAW264.7 cells (A) and culture medium (B)
LDH能够催化丙酮酸生成乳酸,几乎存在于所有组织中。当细胞受损时LDH将大量向细胞外释放,导致其细胞外LDH的水平显著升高,因此LDH活力可以反映细胞受氧化损伤程度[24]。如图9所示,细胞中,H2O2损伤组的LDH活力显著低于空白组(P<0.05),而细胞培养液中的LDH活力显著升高(P<0.05),表明H2O2使细胞膜受损导致LDH向外扩散。与H2O2损伤组相比,牡丹花蕊黄酮各剂量组显著提高了细胞中LDH活力,且降低了细胞培养液中LDH活力(P<0.05),并呈剂量依赖性,表明牡丹花蕊黄酮可以预防或减缓细胞膜受损程度,阻止细胞内LDH向细胞外扩散。在细胞中,牡丹花蕊黄酮高剂量组的LDH活力接近VC对照组,无显著差异(P>0.05)。在细胞液中,牡丹花蕊黄酮高剂量组的LDH活力显著低于VC对照组(P<0.05)。
本实验通过H2O2诱导RAW264.7巨噬细胞损伤来建立氧化应激损伤模型,以此探究牡丹花蕊黄酮的抗氧化活性。研究结果表明,H2O2浓度为800 μmol/L时,能够对RAW264.7巨噬细胞造成有效的损伤,且细胞存活率在50%左右。牡丹花蕊黄酮具有促进RAW264.7巨噬细胞增殖的作用,其中质量浓度在10~30 μg/mL范围内时,促增殖效果显著。巨噬细胞作为机体免疫的重要参与者,可通过分泌细胞因子和抗原提呈作用等影响免疫炎症反应的进程[25-28]。通过实验可看出牡丹花蕊黄酮能够显著促进RAW264.7巨噬细胞的繁殖,可以侧面反映出牡丹花蕊黄酮具有一定的抗炎效果。
本实验通过测定细胞和细胞培养液中各种抗氧化酶类(CAT和SOD等)以及小分子非酶类物质(GSH)的水平来反映牡丹花蕊黄酮对H2O2诱导损伤的RAW264.7巨噬细胞的保护程度。实验表明H2O2诱导损伤RAW264.7巨噬细胞后,细胞与细胞培养液中的有害物质MDA水平显著升高,T-AOC以及各种抗氧化酶(SOD、GSH-Px、CAT和LDH)活力显著降低,表明H2O2能够损害RAW264.7巨噬细胞的抗氧化机能,破坏细胞膜结构,导致细胞内各种抗氧化酶活力下降。而用不同剂量牡丹花蕊黄酮与H2O2联合作用于RAW264.7巨噬细胞时,各剂量组抗氧化指标与H2O2损伤组相比,抗氧化能力显著增强,且存在一定程度上的剂量-效应关系。牡丹花蕊黄酮不仅能够提高细胞和细胞培养液中各种抗氧化指标的活性,清除有毒有害物质和自由基[25],降低机体ROS的含量;而且还可以降低MDA水平,抑制脂质过氧化物的产生,减缓细胞损伤,增强机体的抗氧化能力[26-27],维持细胞膜的完整与细胞的稳定,减轻LDH向细胞外扩散。VC具有极强的抗氧化性,在MDA、GSH水平和T-AOC、SOD活力的测定中,牡丹花蕊黄酮高剂量组和VC对照组的水平没有显著差异,则说明牡丹花蕊黄酮在一定质量浓度下是可以达到VC的抗氧化水平的。
综上所述,牡丹花蕊黄酮可以显著减缓RAW264.7巨噬细胞因H2O2诱导的抗氧化活性下降,并呈剂量-效应关系,还能够增强细胞内抗氧化酶活力,降低机体内氧活性及有害物质的含量,维持细胞的稳定性。
[1] 廖日滔, 郭静科, 李冰洁, 等. 自由基相关细胞信号传导的研究进展[J].中国细胞生物学学报, 2014, 36(11): 1573-1583. DOI:10.11844/cjcb.2014.11.0175.
[2] WANG Fulong, WANG Zhenzhen, CHEN Yan. Advances in the research of the mechanism and intervention of aging[J]. Chinese Journal of Cell Biology, 2012, 34(8): 739-748.
[3] TRACHOOTHAM D, ZHANG H, ZHANG W, et al. Effective elimination of fludarabine-resistant CLL cells by PEITC through a redox-mediated mechanism[J]. Blood, 2008, 112(5): 1912-1922.DOI:10.1182/blood-2008-04-149815.
[4] WEST A P, BRODSKY I E, RAHNER C, et al. TLR signalling augments macrophage bactericidal activity through mitochondrial ROS[J]. Nature, 2011, 472: 476-480. DOI:10.1038/nature09973.
[5] 卞梦瑶, 方勇, 裴斐, 等. 生姜油树脂对H2O2引起RAW264.7巨噬细胞损伤的保护作用[J]. 食品科学, 2014, 35(1): 244-249.DOI:10.7506/spkx1002-6630-201323048.
[6] 崔志文, 黄琴, 黄怡, 等. 鼠李糖乳酸杆菌对Caco-2细胞抗氧化功能的影响[J]. 中国农业科学, 2011, 44(23): 4926-4932. DOI:10.3864/j.issn.0578-1752.2011.23.020.
[7] PLAZA L, CRESPO I, DE PASCUAL-TERESA S, et al. Impact of minimal processing on orange bioactive compounds during refrigerated storage[J]. Food Chemistry, 2011, 124(2): 646-651. DOI:10.1016/j.foodchem.2010.06.089.
[8] HUANG Renhua, XIA Renxue, HU Liming, et al. Antioxidant activity and oxygen-scavenging system in orange pulp during fruit ripening and maturation[J]. Scientia Horticuvlturae, 2007, 113(2): 166-172.DOI:10.1016/j.scienta.2007.03.010.
[9] JO S H, SON M K, KOH H J, et al. Control of mitochondrial redox balance and cellular defense against oxidative damage bymitochondrial NADP(+)-dependent isocitrate dehydrogenase[J]. The Journal of Biological Chemistry, 2001, 276(19): 16168-16176. DOI:10.1074/jbc.M010120200.
[10] LIAO H, BANBURY L K. Antioxidant activity of 45 Chinese herbs and the relationship with their TCM characteristics[J]. Evidencebased Complementary and Alternative Medicine, 2008, 5(4): 429-434.DOI:10.1093/ecam/nem054.
[11] 杨楠, 贾晓斌, 张振海, 等. 黄酮类化合物抗肿瘤活性及机制研究进展[J]. 中国中药杂志, 2015, 40(3): 373-381. DOI:10.4268/cjcmm20140302.
[12] 陈娟, 张明华, 章丽, 等. 牡丹皮苷/酚组分对糖尿病肾病大鼠肾损伤的保护作用及其机制研究[J]. 中国中药杂志, 2016, 41(11): 1990-1998. DOI:10.4268/cjcmm20161104.
[13] 赵伟, 耿岩玲, 崔莉, 等. 牡丹花黄酮类化学成分研究[J].中国现代中药, 2016, 18(3): 303-306. DOI:10.13313/j.issn.1673-4890.2016.3.010.
[14] 王顺利, 任秀霞, 薛璟祺, 等. 牡丹籽油成分、功效及加工工艺的研究进展[J]. 中国粮油学报, 2016, 31(3): 139-146. DOI:10.3969/j.issn.1003-0174.2016.03.027.
[15] 傅茂润, 刘峰, 赵海军, 等. 牡丹雄蕊的营养成分和抗氧化能力研究[J]. 中国食物与营养, 2011, 11(5): 71-74. DOI:10.3969/j.issn.1006-9577.2011.05.017.
[16] 李朝苹, 陈立勇, 阴英超, 等. 牡丹花蕊水提取液抗氧化功能研究[J]. 山东大学学报(医学版), 2015, 53(11): 32-36. DOI:10.6040/j.issn.1671-7554.0.2015.252.
[17] 代艳文, 袁丁, 万静枝, 等. 竹节参总皂苷通过NF-κB通路对LPS致RAW264.7巨噬细胞炎症的保护作用研究[J]. 中国中药杂志, 2014,39(11): 2076-2080. DOI:10.4268/cjcmm20141126.
[18] 邓洋, 许秀举, 于海平. 啤酒对大鼠血清的LDH和T-AOC的影响[J].食品科技, 2009, 34(5): 120-122. DOI:10.13684/j.cnki.spkj.2009.05.066.
[19] 董亮, 何永志, 王远亮, 等. 超氧化物歧化酶(SOD)的应用研究进展[J]. 中国农业科技导报, 2013, 15(5): 53-58. DOI:10.3969/j.issn.1008-0864.2013.05.08.
[20] WANG L Y, DING L, YU Z P, et al. Intracellular ROS scavenging and antioxidant enzyme regulating capacities of corn gluten meal-derived antioxidant peptides in HepG2 cells[J]. Food Research International,2016, 90(1): 33-41. DOI:10.1016/j.foodres.2016.10.023.
[21] PODKOPAEVA D A, GRABOVICH M Y, DUBININA G A. Oxidative stress and antioxidant cell protection systems in the microaerophilic bacterium Spirillum winogradskii[J]. Microbiologiya, 2003, 72(5):534-542. DOI:10.1023/A:1026082914661.
[22] BEDOYA-RAMÍREZ D, CILLA A, CONTRERAS-CALDERÓN J,et al. Evaluation of the antioxidant capacity, furan compounds and cytoprotective-cytotoxic effects upon Caco-2 cells of commercial Colombian coffee[J]. Food Chemistry, 2017, 219(1): 364-372.DOI:10.1016/j.foodchem.2016.09.159.
[23] 王文君, 蔡教英, 蒋艳, 等. 芦荟黄酮体内抗氧化活性及对CAT mRNA表达的影响[J]. 中国食品学报, 2013, 13(10): 13-18.DOI:10.16429/j.1009-7848.2013.10.003.
[24] 苗明三, 陈元朋, 吴巍. 姜黄素对大鼠血瘀性脑缺血模型血液流变学及脑匀浆LD、LDH和TchE水平的影响[J]. 中药药理与临床,2010, 26(1): 29-31. DOI:10.13412/j.cnki.zyyl.2010.01.009.
[25] 白健, 师伟, 秦鸿雁. 巨噬细胞功能、活化和起源异质性在肝纤维化中作用的研究进展[J]. 细胞与分子免疫学杂志, 2017, 33(1): 114-118. DOI:10.13423/j.cnki.cjcmi.008057.
[26] 刘思思, 李琦, 孙立东, 等. 参莲提取物对LPS诱导的巨噬细胞炎症反应的影响[J]. 中国实验方剂学杂志, 2017, 23(10): 85-91.DOI:10.13422/j.cnki.syfjx.2017100085.
[27] 宮甜甜, 黄少刚, 张玥, 等. 巨噬细胞的极化及功能调控[J].解剖学报, 2 0 1 7, 4 8(1): 1 0 6-11 0. D O I:1 0.1 6 0 9 8/j.issn.0529-1356.2017.01.019.
[28] 袁芳. 山楂叶总黄酮对H2O2诱导乳鼠心肌细胞氧化应激和细胞凋亡的影响[J]. 现代中西医结合杂志, 2016, 25(4): 368-371; 405.DOI:10.3969/j.issn.1008-8849.2016.04.008.
[29] 刘栩岑, 李玉洁, 王娅杰, 等. 参莲提取物对PM2.5染毒RAW264.7巨噬细胞损伤的保护作用[J]. 中国中药杂志, 2015, 40(10): 1977-1983.DOI:10.4268/cjcmm20151025.
[30] 曹柏营, 姜秀娟, 戚颖欣, 等. 藤本豆豆荚总黄酮对小鼠免疫功能的影响[J]. 食品与机械, 2017, 33(1): 158-162. DOI:10.13652/j.issn.1003-5788.2017.01.036.
Protective Effect of Flavonoids from Peony Stamens on Hydrogen Peroxide-Induced Toxicity in RAW264.7 Cells