中国野生菰米对大鼠血脂及炎性因子表达的影响
王 菁,刘 洋,张 红,王少康*,孙桂菊
(东南大学公共卫生学院营养与食品卫生系,江苏 南京 210009)
摘 要:目的:研究中国野生菰米对高脂膳食诱导的胰岛素抵抗大鼠血脂浓度以及炎性因子水平的影响。方法:50 只雄性SD大鼠随机分成阴性对照组,胰岛素抵抗模型组,高、低剂量菰米组和米面组。连续喂养8 周,实验前、后测定各组大鼠的体质量及总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)和高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)浓度,同时测定高敏C反应蛋白(hypersensitive C-reactive protein,hs-CRP)、肿瘤坏死因子-α(tumor necrosis factor,TNF-α)、白介素-6(interleukin-6,IL-6)含量,用SPSS 18.0软件对数据进行统计分析。结果:高剂量菰米组大鼠与米面组及胰岛素抵抗模型组大鼠相比,HDL-C浓度显著上升(P<0.05),体质量和TC、TG、LDL-C浓度均显著下降(P<0.05)。与胰岛素抵抗模型组相比,高剂量菰米组的TNF-α及IL-6含量显著下降(P<0.05)。与阴性对照组相比,低、高剂量菰米组IL-6含量均显著升高(P<0.05)。结论:中国野生菰米具有改善高脂膳食诱导的大鼠胰岛素抵抗作用,该作用的机制可能是通过降低血脂浓度,调节炎性因子的表达,从而改善胰岛素抵抗。
关键词:野生菰米;胰岛素抵抗;血脂;炎性因子
胰岛素抵抗(insulin resistance,IR)是指一系列的病理和临床表现,是由于机体的靶器官及靶组织对内源性和/或外源性胰岛素的敏感性和反应性降低或丧失而产生的[1]。IR是导致2型糖尿病发生的初始原因,同时也是多种慢性代谢性疾病发病的基础[2],因此,防治慢性代谢性疾病的关键之一是改善IR的状态[3-4]。同时,IR的发生往往还会升高炎性因子水平[5]。有研究表明,发生IR的诱导因素是炎症,炎性因子的聚集可能会干扰胰岛素信号的转导途径[5-7],但是如何通过干预炎性因子改善IR的作用和机制仍需进一步研究。本研究以总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)[8-9]浓度及肿瘤坏死因子-α(tumor necrosis factor,TNF-α)、高敏C反应蛋白(hypersensitive C-reactive protein,hs-CRP)以及白介素-6(interleukin-6,IL-6)含量为评价指标,采用中国野生菰米对高脂膳食诱导的IR模型大鼠进行干预,探究其对血脂浓度及炎性因子水平的影响,探讨我国野生菰米通过降低炎性因子水平从而改善高脂膳食诱导产生的IR作用及相关机制。
1 材料与方法
1.1 动物、材料与试剂
5 0 只近交系雄性S P F级S D大鼠,体质量180~220 g,购自上海西普尔-必凯实验动物有限公司,动物生产许可证号为SCXK(沪)2008-0016。在SPF级实验室内对动物进行单笼饲养,自由摄食和饮水,将室内温度控制在18~25 ℃,保持相对湿度为50%~70%及干燥、安静的通风环境,光照周期设定为12 h。
中国野生菰米(Zizania latifolia)采自江苏省宿迁市骆马湖,菰米经日光晒干,手工搓去外壳,粉碎过60 目筛制成菰米粉。对照样品为市售大米和面粉。TC、TG、HDL-C、hs-CRP、IL-6、TNF-α、空腹血糖(fasting blood glucose,FBG)、空腹胰岛素(fasting insulin,FINS)试剂盒 上海基尔顿生物科技有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
酶标仪 芬兰Labsystems公司;WF130万能粉碎机上海魔速科学器材有限公司;80-2型离心机 上海医疗器械厂有限公司;可调节移液器 大龙医疗设备仪器有限公司。
1.3 方法
1.3.1 饲料配方
使用完全配方饲料。以美国营养学会推荐的AIN-76M实验动物合成饲料为阴性对照组饲料,在此基础上对蛋白质和蔗糖的比例进行适当调整,增加胆固醇和饱和脂肪酸质量,制备成IR模型组饲料(高脂饲料)[10];同时用面粉、粳米粉替代高脂饲料中的淀粉和蔗糖,配制成米面组饲料;使用菰米替代高脂饲料中淀粉和蔗糖,配制成高剂量菰米组饲料;使用50%菰米和50%精米、面替代高脂饲料的淀粉和蔗糖,配制成低剂量菰米组饲料[11]。具体配方见表1。
表1 5 组实验动物饲料配方的构成
Table1 Formulation and composition of five experimental diet

成分及指标 高剂量菰米组低剂量菰米组IR模型组阴性对照组 米面组蔗糖质量/g 0 0 265 310 0酪蛋白质量/g 215 215 215 230 215面粉(标准粉)质量/g 0 130.75 0 0 261.50玉米淀粉质量/g 0 0 258 295 0纤维素质量/g 50 50 50 50 50豆油质量/g 0 0 0 70 0猪油质量/g 100 100 100 0 100蛋黄粉质量/g 50 50 50 0 50胆盐质量/g 2 2 2 0 2胆固醇质量/g 15 15 15 0 15混合矿物盐质量/g 30 30 30 30 30混合维生素质量/g 10 10 10 10 10氯化胆碱质量/g 2 2 2 2 2 DL-蛋氨酸质量/g 3 3 3 3 3菰米质量/g 523.0 261.5 0 0 0粳米质量/g 0 130.75 0 0 261.50合计/g 1 000 1 000 1 000 1 000 1 000总脂肪质量/g 133.10 133.35 127.80 70.30 133.60总碳水化合物质量/g 433.0 440.5 537.0 611.0 448.0总蛋白质质量/g 298.70 289.45 233.90 233.50 280.20 TC质量/g 17.5 17.5 17.5 0 17.5总膳食纤维质量/g 66.0 61.0 50.3 50.3 56.0总能量/(kJ/g) 16.30 16.25 16.80 15.90 16.20脂肪供能比例/% 30.4 30.7 28.7 16.2 31.0碳水化合物供能比例/% 47.1 46.7 48.4 58.0 46.3
1.3.2 动物分组
适应性喂养1 周后,将受试大鼠按照HOMA稳态模型IR指数(homeostasis model assessment insulin resistance index,HOMA-IR)(按式(1)计算)进行随机分组,分别为阴性对照组、高剂量菰米组、低剂量菰米组、米面组及IR模型组,10 只为1 组,分别饲喂与其相对应的饲料,实验周期为8 周。在实验初期所给予的饲料量低于适应性喂养时10%~20%,每天按时喂养,单笼饲养。每周称量并记录大鼠的体质量以及饲料的消耗量。实验结束时将动物禁食不禁水12 h之后处死,麻醉后采用股动脉取血,将血清分离(3 000 r/min离心10 min),保存在-20 ℃冰箱内,在-80 ℃冰箱中贮存大鼠的小肠及肝脏组织以备用。FBG浓度采用葡萄糖氧化酶法,在2 h内测定;FINS水平采用胰岛素放射免疫沉淀法,根据试剂盒说明书进行操作。
1.3.3 检测指标
血脂浓度(TC、TG及HDL-C浓度)的测定:采用Enzymatic-trinder法测定TC浓度(c(TC));甘油磷酸氧化酶法测定TG浓度(c(TG));胆固醇氧化酶法测定HDL-C浓度(c(HDL-C)),根据试剂盒说明书进行操作。LDL-C浓度(c(LDL-C))用Friedewald公式(式(2))[12]计算。
hs-CRP含量的测定采用双抗夹心酶联免疫吸附测定法;TNF-α含量的测定采用放射免疫分析方法;IL-6含量的测定采用放射免疫分析方法,根据试剂盒说明书进行操作。
1.4 数据统计与分析
结果用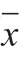 ±s表示,使用SPSS 18.0软件进行数据分析,采用重复测量方差分析和One-way ANOVA法进行显著性检验,应用SNK法比较组间差异性,以P<0.05表示差异显著。
±s表示,使用SPSS 18.0软件进行数据分析,采用重复测量方差分析和One-way ANOVA法进行显著性检验,应用SNK法比较组间差异性,以P<0.05表示差异显著。
2 结果与分析
2.1 中国野生菰米对大鼠生理情况的影响
实验过程中,各组动物毛色、精神状况良好,摄食、摄水状况正常。每只大鼠控制摄食量为20 g/d。在实验初期,各组大鼠间体质量并没有显著差异(P>0.05)。随着实验时间的延长,各组大鼠的体质量均慢慢增长,在实验结束时:阴性对照组大鼠的体质量显著低于IR模型组(P<0.05);米面组和IR模型组大鼠的体质量显著高于高剂量菰米组和低剂量菰米组(P<0.05);高剂量菰米组大鼠体质量与阴性对照组无显著性差异(P>0.05);低剂量菰米组大鼠体质量高于阴性对照组和高剂量菰米组,但无显著性差异(P>0.05);米面组大鼠体质量与IR模型组相比较为接近(表2)。
表2 不同饲料饲养对各组大鼠体质量的影响
Table2 Effect of different feeds on body mass of rats

注:a.与阴性对照组相比差异显著(P<0.05);b.与IR模型组相比差异显著(P<0.05);c.与高剂量菰米组相比差异显著(P<0.05);d.与低剂量菰米组相比差异显著(P<0.05)。下同。
时间 体质量/g IR模型组 米面组 低剂量菰米组 高剂量菰米组 阴性对照组第0周 251.32±11.48 248.40±10.84 245.20±8.92 247.11±7.78 246.09±5.93第2周 309.30±6.56 307.24±7.37 305.28±5.75 304.11±5.53 302.71±6.01第4周 380.57±4.80a377.12±3.20a362.16±4.40 360.75±2.76 358.75±4.57b第6周 423.83±11.45a416.06±10.69a404.48±7.02ab401.53±8.21ab396.70±7.23b第8周 457.15±7.79acd450.44±11.82acd429.70±4.17b426.45±6.88b422.84±6.14b
2.2 中国野生菰米对大鼠血糖水平和IR的影响
根据中国野生菰米对高脂膳食诱导大鼠IR机制的相关研究可以发现:在第2周时,FBG浓度、FINS水平和HOMA-IR均没有差异,在第4周时可能产生差异[11];因此本实验从第4周时开始检测大鼠血糖水平。实验开始时,各组大鼠FINS水平以及血清FBG浓度无明显差异。实验末期,IR模型组血清FBG浓度、FINS水平及HOMA-IR显著高于阴性对照组(P<0.05);与IR模型组和米面组比,低、高剂量菰米组血清FBG浓度和FINS水平、HOMA-IR显著降低(P<0.05);低剂量菰米组血清FBG浓度和FINS水平、HOMA-IR高于高剂量菰米组,但无显著性差异(P>0.05);米面组血清FBG浓度和FINS水平与模型组比无显著性差异(P>0.05)(表3~5)。
表3 不同饲料饲养对各组大鼠血清FBG浓度的影响
Table3 Effect of different feeds on FBG levels in rats

组别 FBG浓度/(mmol/L)IR模型组 米面组 低剂量菰米组 高剂量菰米组 阴性对照组第0周 5.23±0.90 5.42±0.75 5.12±0.41 5.37±0.32 5.14±0.51第4周 8.10±0.59 7.84±0.28 7.19±0.45 7.14±0.37 7.10±0.35第6周 7.67±0.28acd7.55±0.06acd6.87±0.16b6.81±0.18b6.72±0.22b第8周 7.42±0.13acd7.35±0.19acd6.77±0.26b6.59±0.14b6.53±0.12b
表4 不同饲料饲养对各组大鼠FINS水平的影响
Table4 Effect of different feeds on FINS levels in rats

组别 FINS水平/(μU/mL)IR模型组 米面组 低剂量菰米组 高剂量菰米组 阴性对照组第0周 7.12±0.68 7.14±0.95 7.13±0.71 7.11±0.72 6.95±0.66第4周 9.69±0.78 9.29±0.64 7.92±0.36 7.38±0.61 7.27±0.82第6周 11.94±2.11acd11.46±1.30acd9.43±0.80b8.50±0.77b8.26±0.21b第8周 14.62±0.98acd14.27±1.04acd10.87±0.71b10.34±1.49b9.67±0.76b
表5 不同饲料饲养对各组大鼠HOMA-IR的影响
Table5 Effect of different feeds on HOMA-IR in rats

组别 IR模型组 米面组 低剂量菰米组 高剂量菰米组 阴性对照组第0周 1.65±0.27 1.72±0.37 1.62±0.24 1.70±0.20 1.59±0.07第4周 3.46±0.33 3.23±0.33 2.53±0.21 2.34±0.27 2.31±0.33第6周 4.10±0.66acd3.84±0.43acd2.88±0.24b2.57±0.20b2.47±0.20b第8周 4.82±0.33acd4.66±0.34acd3.27±0.26b3.03±0.43b2.81±0.23b
2.3 中国野生菰米对大鼠血脂浓度的影响
表6 不同饲料饲养对各组大鼠血脂浓度的影响
Table6 Effects of different feeds on blood lipid levels in rats
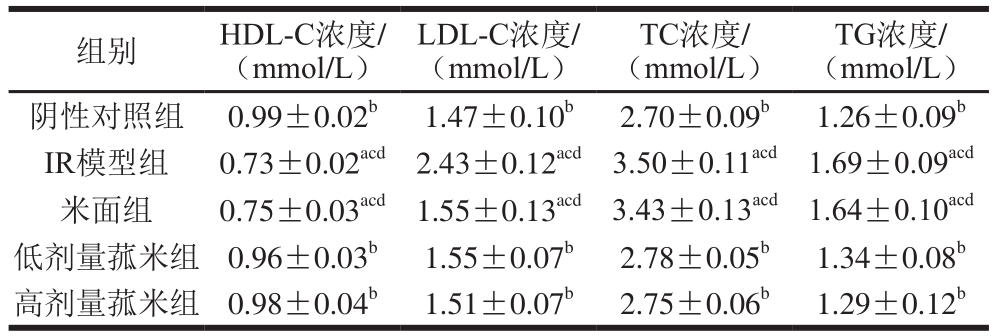
TG浓度/(mmol/L)阴性对照组 0.99±0.02b1.47±0.10b2.70±0.09b1.26±0.09bIR模型组 0.73±0.02acd2.43±0.12acd3.50±0.11acd1.69±0.09acd米面组 0.75±0.03acd1.55±0.13acd3.43±0.13acd1.64±0.10acd低剂量菰米组 0.96±0.03b1.55±0.07b2.78±0.05b1.34±0.08b高剂量菰米组 0.98±0.04b1.51±0.07b2.75±0.06b1.29±0.12b组别 HDL-C浓度/(mmol/L)LDL-C浓度/(mmol/L)TC浓度/(mmol/L)
由表6可知,IR模型组大鼠TG、TC、LDL-C浓度与阴性对照组相比显著升高,HDL-C浓度显著降低(P<0.05);高、低剂量菰米组TG、TC、LDL-C浓度与IR模型组和米面组相比显著降低,HDL-C浓度显著升高(P<0.05),且与阴性对照组差异不显著(P>0.05);低剂量菰米组TG、TC、LDL-C浓度高于高剂量菰米组,HDL-C浓度低于高剂量菰米组,但是差异不显著(P>0.05);米面组与IR模型组相比血脂浓度接近(P>0.05)。
2.4 中国野生菰米对大鼠小肠、肝脏组织匀浆炎性因子水平的影响
表7 不同饲料饲养对各组大鼠小肠组织匀浆炎性因子水平的影响Table7 Effect of different feeds on inflammatory factor levels in small intestinal tissue homogenate of IR rats

IL-6含量/(μg/g pro)阴性对照组 1.59±0.07b66.81±9.07b29.06±2.26bcdIR模型组 2.56±0.12a134.42±4.03ac63.75±3.74acd米面组 2.41±0.08a127.75±6.79ab57.47±3.32ac低剂量菰米组 2.02±0.08b112.75±5.34b51.47±1.56ab高剂量菰米组 1.85±0.10b98.23±4.96b43.54±1.93ab组别 hs-CRP含量/(μg/g pro)TNF-α含量/(μg/g pro)
表8 不同饲料饲养对各组大鼠肝脏组织匀浆炎性因子水平的影响Table8 Effect of different feeds on inflammatory factor levels in liver tissue homogenate of IR rats

IL-6含量/(μg/g pro)阴性对照组 3.60±1.03b213.98±125.05b72.79±31.16bcdIR模型组 8.97±1.71a413.87±55.52ac191.68±51.62acd米面组 6.47±1.12a397.14±93.62ab178.42±45.75ac低剂量菰米组 5.97±1.12b355.92±73.57 156.01±21.52ab高剂量菰米组 5.86±1.38b336.42±68.39b149.38±26.60ab组别 hs-CRP含量/(μg/g pro)TNF-α含量/(μg/g pro)
从表7、8中可知,与阴性对照组相比,IR模型组和米面组hs-CRP、TNF-α含量显著升高(P<0.05),低、高剂量菰米组hs-CRP含量也有所升高,但不显著(P>0.05);与米面组相比,低、高剂量菰米组的hs-CRP、TNF-α含量未见明显下降,其中高剂量菰米组较低剂量菰米组hs-CRP含量较低,但差异无显著性(P>0.05);与IR模型组相比,高剂量菰米组的TNF-α含量显著下降(P<0.05)。与阴性对照组相比,低、高剂量菰米组、IR模型组和米面组IL-6含量显著升高(P<0.05);与IR模型组相比,低、高剂量菰米组的IL-6含量显著下降(P<0.05);与米面组相比,高剂量菰米组IL-6含量显著下降(P<0.05),低剂量菰米组IL-6含量有所下降,但不显著(P>0.05)。
3 讨 论
3.1 高脂膳食诱导IR动物模型的建立
本研究在AIN-76M动物合成饲料配方的基础上对蛋白质和蔗糖的比例进行了适当调整,增加饱和脂肪酸和胆固醇的含量,制成诱导大鼠IR的高脂饲料[13]。在第4周时,与阴性对照组相比,IR模型组大鼠的血清FBG浓度、FINS水平及HOMA-IR均显著偏高,这与Efendić等[14]使用雄性Wistar大鼠建立IR模型的结果一致。表明IR大鼠模型可以通过高脂膳食的诱导建立。
3.2 中国野生菰米对大鼠血脂浓度的影响
经过8 周的造模和膳食干预,IR模型组大鼠血清TC、TG和LDL-C浓度均显著高于阴性对照组,HDL-C浓度显著低于阴性对照组;米面组大鼠血清FBG浓度和血脂浓度与IR模型组接近;与IR模型组和米面组相比,高剂量菰米组大鼠的血清TC、TG和LDL-C浓度均显著降低,HDL-C浓度显著升高,且和阴性对照组相当;低剂量菰米组大鼠血清TC、TG和LDL-C浓度略高于高剂量菰米组和阴性对照组。
本研究表明,中国野生菰米可以明显改善高脂膳食诱导的IR大鼠的血糖以及血脂代谢紊乱情况,使得大鼠的血糖浓度和血脂浓度维持在正常的范围内,增强SD大鼠的胰岛素敏感性,改善其IR状态,但是精米、面并没有起到预防、改善的作用。高剂量菰米组效果要略好于低剂量菰米组,但差异无显著性。说明用菰米替代50%的精米、面就能改善高脂膳食诱导的大鼠糖、脂代谢异常。
菰米改善糖、脂代谢的原因可能和菰米富含生物活性成分有关。在中国野生菰米中含有大量的生物活性物质,例如抗性淀粉、黄酮、酚类、花色苷、皂苷、植物甾醇、多不饱和脂肪酸、生育酚等[15-17],通过这些生物活性物质之间的协同或相加作用对高脂膳食诱导的IR大鼠胰岛素敏感性以及糖、脂代谢水平有所改善[18-19],在菰米中存在的抗性淀粉的含量比精制的米、面高,平均每100 g菰米中含有11.73 g抗性淀粉,有研究显示抗性淀粉能够降低胰岛素反应及餐后血糖浓度,也能够改善机体胰岛素敏感性[20]。菰米中的膳食纤维含量是普通米、面的2.4 倍,100 g菰米中总膳食纤维质量为7.24 g[20-21],这对血脂浓度的降低也有一定作用[22]。此外,菰米中的色素质量分数为5%,属于花色苷类化合物,此类物质能够调节血脂代谢,提高机体的抗氧化能力,从而可能改善脂代谢紊乱的情况。这些都体现出我国野生菰米具有重要的营养保健价值,但其具体的生物活性物质以及相关的机制仍然需要进一步研究。
3.3 中国野生菰米对大鼠炎性因子的影响
近些年来,有相关研究及流行病学资料证实,IR与炎症之间应该存在着相关性,由此可以推断出炎症可能是使得IR发生的一个重要因素[23],而炎性因子干扰胰岛素受体底物的信号转导通路则是导致IR发生的主要分子机制[5-6]。有研究证实,肥胖、IR以及代谢紊乱都是一种低度炎症的状态;“系统性炎症”或者是“慢性低水平的炎症”就是指代谢性疾病的炎症状态,其被认为是由于营养过剩而诱发的一种长期的炎性反应。目前的研究显示,代谢综合征人群血浆中炎性因子水平明显升高,例如在高血脂、高血压、2型糖尿病、动脉粥样硬化及肥胖患者的血浆中,IL-6和TNF-α水平都有明显的升高[23-24],TNF-α表达水平在肥胖模型动物的血浆里也有明显的升高[25],这些结果都说明炎性因子参与了IR的形成[26]。已有大量证据证明TNF-α参与了IR的形成,在IR的发病机制中起重要作用[27]。由肝脏分泌产生的重要防御分子hs-CRP,同时也是全身炎症反应的敏感性标志物[28]。hs-CRP通过介导促炎因子IL-1、IL-6的产生从而引起IR;其也可通过促进TNF-α的释放从而抑制胰岛素信号转导,导致IR的形成[26]。
本研究中,IR模型组大鼠小肠TNF-α、hs-CRP和IL-6含量均显著高于阴性对照组,说明在IR状态下,小肠存在炎性状态,将进一步诱导小肠产生IR;米面组虽然略低于IR模型组,但没有显著性差异(P>0.05),说明米、面不能改善IR状态下小肠低度炎性水平。菰米对降低这些炎性因子水平有一定的作用,其可以使脂肪组织所分泌产生的炎性因子TNF-α含量减少,使hs-CRP的合成受到抑制,从而使小肠低度的炎症状态得到缓解。菰米可以通过减少脂肪的蓄积降低体质量,从而减少炎性因子的分泌,同时还可能通过升高HDL-C浓度以及降低TG、TC、LDL-C浓度使内皮损伤减轻,从而进一步使慢性炎症的状态得到减轻。因此,炎症机制可能成为IR发生机制中的一个重要的研究方向,但如何有效地对炎性因子进行干预从而改善IR仍有待研究。
综上,中国野生菰米可以通过降低血糖浓度、调节血脂代谢紊乱情况,从而使高脂膳食诱导的大鼠IR作用得到改善。同时,其可以通过调节炎性因子的表达、缓解机体的炎症状态,从而改善高脂膳食诱导大鼠的IR作用。
参考文献:
[1] 杨永霞, 王琳琳, 郑凌云, 等. 基于核磁共振氢谱代谢组学研究黄连解毒汤对胰岛素抵抗大鼠棕色脂肪组织代谢组的影响[J]. 高等学校化学学报, 2014, 35(9): 1883-1888. DOI:10.7503/cjcu20140308.
[2] 朱小花. 香蕉粉对II型糖尿病胰岛素抵抗的改善作用及其机制研究[D]. 广州: 华南农业大学, 2016: 1-3.
[3] JARRETT R J. The metabolic syndrome[J]. Lancet, 2005, 366: 1922.DOI:10.1016/s0140-6736(05)67779-3.
[4] 刘晓梅, 谭春梅, 梁庆华, 等. 中老年人慢性代谢性疾病相关代谢指标的研究[J]. 中国医药导报, 2016, 13(30): 20-22; 28.
[5] 阮丹杰, 王伟. 炎性因子与胰岛素抵抗的研究进展[J]. 医学综述,2009, 15(4): 508-511. DOI:10.3969/j.issn.1006-2084.2009.04.010.
[6] 王晓芳, 丁维俊. 肥胖引起阿尔茨海默病的机制探讨[J].中国老年保健医学, 2015, 13(2): 102-104. DOI:10.3969/j.issn.1672-4860.2015.02.045.
[7] 任毅, 左之才, 万涛梅. 抵抗素在胰岛素抵抗中的作用机制及其受体信号通路研究进展[J]. 生理学报, 2016, 68(1): 65-74.DOI:10.13294/j.aps.2016.0011.
[8] 乔春晖. 血脂测定结果的临床可接受性分析[J]. 基层医学论坛,2017, 21(19): 2542-2543. DOI:10.19435/j.1672-1721.2017.19.061.
[9] 饶小娇, 于曼丽, 朱晓波, 等. TLR4与胰岛素抵抗小鼠主动脉炎性细胞因子表达[J]. 中国公共卫生, 2016, 32(11): 1480-1484.DOI:10.11847/zgggws2016.32.11.08.
[10] 周思宇, 翟成凯, 姜明霞, 等. 复合全谷豆粗杂粮对脂代谢紊乱大鼠体内外抗氧化作用的影响[J]. 卫生研究, 2013, 42(1): 1-5; 9.
[11] 张红, 刘洋, 赵军红, 等. 菰米血糖生成指数的测定及其改善大鼠胰岛素抵抗的作用[J]. 卫生研究, 2015, 44(2): 173-178; 184.
[12] FRIEDEWALD W T, LEVY R I, FREDRICKSON D S. Estimation of the concentration of low-density lipoprotein cholesterol in plasma,without use of the preparative ultracentrifuge[J]. Clinical Chemistry,1972, 18(6): 499-502.
[13] 张红, 韩淑芬, 曹佩, 等. 菰米对高脂诱导脂代谢紊乱大鼠肝脏脂毒性的作用[J]. 卫生研究, 2013, 42(2): 190-195.
[14] EFENDIĆ S, WAJNGOT A, VRANIĆ M. Increased activity of the glucose cycle in the liver: early characteristic of type 2 diabetes[J].Proceedings of the National Academy of Sciences, 1985, 82(9): 2965-2969. DOI:10.1073/pnas.82.9.2965.
[15] 赵军红. 我国野生菰米的血糖生成指数及其调控脂毒性改善大鼠胰岛素抵抗的作用[D]. 扬州: 扬州大学, 2013: 20-25.
[16] QIU Y, LIU Q, BETA T. Antioxidant properties of commercial wild rice and analysis of soluble and insoluble phenolic acids[J]. Food Chemistry, 2010, 121(1): 140-147. DOI:10.1016/j.foodchem.2009.12.021.
[17] PRZYBYLSKI R, KLENSPORFPAWLIK D, ANWAR F, et al. Lipid components of North American wild rice (Zizania palustris)[J].Journal of the American Oil Chemists Society, 2009, 86(6): 553-559.DOI:10.1007/s11746-009-1383-6.
[18] FUENTES-ZARAGOZA E, RIQUELME-NAVARRETE J M,SÁNCHEZ-ZAPATA E, et al. Resistant starch as functional ingredient:a review[J]. Food Research International, 2010, 43(4): 931-942.DOI:10.1016/j.foodres.2010.02.004.
[19] 靖丽. 柑橘精油的代谢图谱及其主要成分D-柠檬烯对糖脂代谢紊乱的防治作用研究[D]. 重庆: 西南大学, 2014: 25-30.
[20] 金增辉. 菰米的营养化学与开发利用[J]. 粮食加工, 2016, 41(1): 58-61.
[21] 翟成凯, 张小强, 孙桂菊, 等. 中国菰米的营养成分及其蛋白质特性的研究[J]. 卫生研究, 2000, 29(6): 375-378. DOI:10.3969/j.issn.1000-8020.2000.06.020.
[22] LINKO A M, JUNTUNEN K S, MYKKANEN H M, et al. Wholegrain rye bread consumption by women correlates with plasma alkylresorcinols and increases their concentration compared with lowfiber wheat bread[J]. Journal of Nutrition, 2005, 135(3): 580-583.DOI:10.1093/jn/135.3.580.
[23] GOLDSTEIN B J, SCALIA R. Adiponectin: a novel adipokine linking adipocytes and vascular function[J]. The Journal of Clinical Endocrinology and Metabolism, 2004, 89(6): 2563-2568.DOI:10.1210/jc.2004-0518.
[24] 张红, 曹佩, 翟成凯, 等. 我国菰米对高脂膳食大鼠血脂及炎性因子的影响[J]. 营养学报, 2009, 31(3): 222-225. DOI:10.3321/j.issn:0512-7955.2009.03.004.
[25] SAVAGE D B, PETERSEN K F, SHULMAN G I. Mechanisms of insulin resistance in humans and possible links with inf l ammation[J].Hypertension, 2005, 45(5): 828-833. DOI:10.1161/01.hyp.0000163475.04421.e4.
[26] 许光远. 辅助降糖颗粒与二甲双胍联合用药对ZDF大鼠胰岛素抵抗的作用及机制研究[D]. 北京: 北京中医药大学, 2017: 58-66.
[27] LAZAR M A. How obesity causes diabetes: not a tall tale[J]. Science,2005, 307: 373-375. DOI:10.1126/science.1104342.
[28] 王强, 程勇, 汪兵. 神经外科危重患者血糖波动和血清炎症因子水平与患者预后的关系[J]. 微循环学杂志, 2012, 22(3): 37-38; 41; 6.DOI:10.3969/j.issn.1005-1740.2012.03.013.
Effect of Wild Rice Seeds (Zizania latifolia) on Lipid Metabolism and Inflammatory Factor Expression in Rats
WANG Jing, LIU Yang, ZHANG Hong, WANG Shaokang*, SUN Guiju
(Department of Nutrition and Food Hygiene, School of Public Health, Southeast University, Nanjing 210009, China)
Abstract:Objective: To evaluate the effect of dietary supplementation of wild rice seeds (Zizania latifolia) on blood lipids and inf l ammatory factor levels in some tissues of high-fat fed rats with insulin resistance. Methods: Totally 50 SD rats were randomly divided into 5 groups: negative control, insulin resistance model, high-dose wild rice, low-dose wild rice and rice fl our groups. Before and after these animals were fed for 8 weeks, body mass and total cholesterol (TC), triglyceride (TG),high-density lipoprotein cholesterol (HDL-C), low density lipoprotein cholesterol (LDL-C), hypersensitive C-reactive protein(hs-CRP), tumor necrosis factor (TNF-α), and interleukin-6 (IL-6) levels were measured. The SPSS 18.0 software was used to analyze the experimental data. Results: Compared with the insulin resistance model and rice fl our groups, body mass and the levels of TC, TG and LDL-C in rats administered with wild rice at both doses declined signif i cantly (P < 0.05), and the level of HDL-C increased signif i cantly (P < 0.05). Compared with the insulin resistance model group, the level of TNF-α and IL-6 in the high-dose wild rice group signif i cantly decreased (P < 0.05). Both the low-dose and high-dose groups showed a signif i cantly increased level of IL-6 in comparison with the negative control group (P < 0.05). Conclusion: Wild rice seeds have the potential to improve insulin resistance in high-fat diet fed rats, likely by reducing blood lipids and regulating the expression of inf l ammatory cytokines.
Keywords:wild rice seeds; insulin resistance; blood lipids; inflammatory cytokines
WANG Jing, LIU Yang, ZHANG Hong, et al. Effect of wild rice seeds (Zizania latifolia) on lipid metabolism and inflammatory factor expression in rats[J]. Food Science, 2018, 39(21): 166-170. (in Chinese with English abstract)DOI:10.7506/spkx1002-6630-201821025. http://www.spkx.net.cn
引文格式:王菁, 刘洋, 张红, 等. 中国野生菰米对大鼠血脂及炎性因子表达的影响[J]. 食品科学, 2018, 39(21): 166-170.DOI:10.7506/spkx1002-6630-201821025. http://www.spkx.net.cn
文章编号:1002-6630(2018)21-0166-05
文献标志码:A
中图分类号:TQ467.32;TS218
DOI:10.7506/spkx1002-6630-201821025
*通信作者简介:王少康(1975—),男,副教授,博士,研究方向为营养与肿瘤。E-mail:shaokangwang@seu.edu.cn
第一作者简介:王菁(1994—),女,硕士研究生,研究方向为全谷物与营养。E-mail:220163003@seu.edu.cn
基金项目:国家自然科学基金面上项目(81673162);国家自然科学基金青年科学基金项目(81202195)
收稿日期:2018-03-12

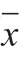 ±s表示,使用SPSS 18.0软件进行数据分析,采用重复测量方差分析和One-way ANOVA法进行显著性检验,应用SNK法比较组间差异性,以P<0.05表示差异显著。
±s表示,使用SPSS 18.0软件进行数据分析,采用重复测量方差分析和One-way ANOVA法进行显著性检验,应用SNK法比较组间差异性,以P<0.05表示差异显著。





