 。DPPH自由基清除率按式(1)计算。
。DPPH自由基清除率按式(1)计算。阳光中的紫外线辐射是造成皮肤损伤的主要原因[1]。由于平流层臭氧层的破坏增加了地球大气中的紫外线辐射,过度暴露于紫外线辐射对人体健康有许多不利影响,如导致皮肤癌、免疫抑制、太阳红斑和皮肤过早老化等。中波紫外线(ultraviolet B,UVB)(280~320 nm)是引起人永生化表皮角质形成细胞(HaCaT)辐射损伤的最重要因素,且UVB辐射可增加皮肤组织中的活性氧(reactive oxygen species,ROS)水平和自由基的生成量,引起一系列的氧化损伤。UVB也是造成皮肤光老化的主要原因之一,其可以穿透表皮到达真皮(主要由成纤维细胞和细胞外基质组成)上部,激活人类皮肤中基质金属蛋白(matrix metalloproteinases,MMPs)调节的信号通路[2],诱导皮肤光老化。皮肤光老化特征为产生皱纹、不规则色素沉着和缺乏弹性[3]。此外,肿瘤坏死因子(tumor necrosis factor,TNF)-α和白介素(interleukin,IL)-6是与UVB辐射有关的炎症细胞因子,辐射后,这些因子大量分泌,造成角质细胞内的炎症反应并加速细胞损伤[4]。
目前,保护人类皮肤免受太阳紫外线诱导的氧化损伤的主要方式是避免过度暴露在阳光下或使用防晒霜。植物化学物质的补充也可以起到保护作用,最近的一些研究表明天然的化学组分也能起到一定的抗氧化保护作用,例如葡萄种子提取物、盐肤木提取物、枸杞多糖、雪莲多糖等[5-9]。山楂属于蔷薇科(Rosaceae)梨亚科(Pyrinae)山楂属(Crataegus)植物,果胶含量丰富,约占果实质量的2%~4%。果胶是一类结构复杂的酸性杂多糖,其主要成分为半乳糖醛酸,具有良好的乳化、增稠、稳定和胶凝作用。研究表明,由果胶水解得到的果胶低聚半乳糖醛酸具有降血脂、降血糖、防龋齿、抑菌等多种生物活性[10-12]。
目前还鲜有关于山楂半乳糖醛酸提取物对UVB辐射HaCaT细胞氧化损伤及光老化保护作用的研究。本实验以山楂为原料提取山楂果胶,采用酶法降解,对酶解物半乳糖醛酸进行分离制备,研究山楂果胶低聚半乳糖醛酸的基质金属蛋白酶-1(matrix metalloproteinase 1,MMP-1)抑制活性,并对UVB辐射造成的氧化损伤的保护作用进行研究,对山楂功能食品和山楂皮肤保护产品的进一步开发具有重要意义。
果胶酶(食品级) 法国Lallemand公司;Dowex50W×8-200阳离子交换树脂、DMEM培养基美国Gibco公司;胎牛血清 美国Hyclone公司;磷酸盐缓冲液(phosphate buffered saline,PBS) 武汉双螺旋生物科技有限公司;Dowex1×4-400阴离子交换树脂、胰酶、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)、噻唑蓝(3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide tetrazolium,MTT)、二甲基亚砜(dimethylsulfoxide,DMSO) 美国Sigma公司;BCA蛋白质量浓度测定试剂盒、丙二醛(malondialdehyde,MDA)试剂盒、ROS试剂盒、超氧化物歧化酶(superoxide dismulase,SOD)试剂盒沈阳万类生物科技有限公司;谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、过氧化氢酶(catalase,CAT)、乳酸脱氢酶(lactate dehydrogenase,LDH)、羟脯氨酸(hydroxyproline,Hyp)试剂盒南京建成生物工程研究所;M M P-1试剂盒中国博士德生物公司;HaCaT细胞 南京华奥生物有限公司;TNF-α、IL-6细胞因子酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)试剂盒 美国R&D公司;RNA测定试剂盒 北京百泰克生物技术公司。
FDU-1200冷冻干燥机 日本Eyela东京理化株式会社;DHA-A电脑恒流泵 上海嘉鹏科技有限公司;100-LCD电脑自动部分收集器 上海琪特分析仪器有限公司;NW10LVF型超纯水系统 香港Heal Force公司;H-2050R型超速冷冻离心机 湖南湘仪有限公司;HF-90型CO2培养箱 上海力申有限公司;AE31倒置相差显微镜 麦克奥迪实业集团有限公司;SW-CJ-2FD型超净工作台 苏州净化仪器设备公司;ELX-800型酶标仪 美国Biotek公司;UV2910紫外-可见分光光度计日本日立公司;HH-4数显恒温水浴锅 金坛市杰瑞尔有限公司;DH36001B电热恒温培养箱 天津泰斯特公司;SUV-100日光紫外线模拟器、UVB辐射度监示器上海西格玛高技术有限公司;实时荧光定量聚合酶链式反应(real-time polymerase chain reaction,qPCR)仪BIONEER(上海)公司。
1.3.1 样品制备
1.3.1.1 果胶提取
将山楂清洗、去皮、去核、打浆,用0.81 mol/mL盐酸溶液以料液比1∶20在80 ℃条件下提取90 min。提取液经离心弃去残渣,4 倍体积乙醇沉淀,经冷冻干燥制得果胶[13]。
1.3.1.2 果胶酸制备
称取3 g山楂果胶溶于300 mL含40 g/L NaOH的体积分数50%乙醇溶液中,冰浴搅拌反应5 h,于冰箱中冷藏10 h,过滤,弃上清液。沉淀加入体积分数50%乙醇溶液100 mL,用3 mol/L盐酸溶液调节pH值至1.5±0.1。室温下搅拌30 min,抽滤,沉淀中加入50%酸化(体积分数1%盐酸溶液)乙醇溶液,搅拌30 min,过滤,用体积分数50%乙醇溶液洗涤3 次,冷冻干燥得果胶酸。1 g果胶酸溶于100 mL pH 4.5醋酸钠缓冲液(0.9 g醋酸钠与0.5 mL冰醋酸定容至50 mL,溶剂为蒸馏水)制成果胶酸样品,备用。
1.3.1.3 果胶酸酶解
用0.1 mol/L PBS(pH 4.5)配制质量浓度为10 mg/mL的果胶酸待解液,用质量浓度为0.000、0.005、0.010、0.015、0.020 mg/mL酶解液对其进行酶解[14]。分别于30、45、60、75、90 min时取样2 mL,沸水浴5~10 min灭活后进行1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)抗氧化能力测定,筛选抗氧化能力强的酶解物,确定果胶酸最佳酶解条件,并将酶解液冷冻干燥。
1.3.1.4 山楂果胶低聚半乳糖醛酸提取物的分离
准确称取果胶酸500 mg溶于PBS(pH 4.5)中,质量浓度为10 mg/mL,酶解后沸水浴5~10 min灭活,4 000 r/min离心10 min,取上清液冷藏备用。用“碱-酸-碱”方式处理Dowex1×4-400阴离子交换树脂,用“酸-碱-酸”方式处理Dowex50W×8-200阳离子交换树脂,使其活化。选用40 cm×1.5 cm玻璃柱,用1 mol/L甲酸溶液冲洗树脂,使pH值至1.5左右,树脂转化为HCOO-型,水洗至中性备用。取山楂果胶低聚半乳糖醛酸混合物,调节pH值至6.0,用0.6 mol/L甲酸铵溶液梯度洗脱,以1 mL/min流速分部收集,每管7 mL[15]。将DPPH自由基清除能力最强的样品冷冻干燥,-20 ℃保存。
1.3.2 DPPH自由基清除能力测定
称取DPPH 0.078 8 g,用体积分数60%乙醇溶液定容至1 L,得到0.2 mmol/L DPPH试剂,避光保存,备用。取树脂分离后的各管待测样品2 mL,加入0.2 mmol/L DPPH-乙醇溶液2.0 mL,混匀,静置30 min,于517 nm波长处测定吸光度A1。以待测样品与体积分数60%乙醇溶液的混合液为对照,测定吸光度A2;以DPPH溶液与体积分数60%乙醇溶液的混合液为空白,测定吸光度 。DPPH自由基清除率按式(1)计算。
。DPPH自由基清除率按式(1)计算。
1.3.3 山楂果胶低聚半乳糖醛酸含量的测定
将分离所得低聚半乳糖醛酸混合物经阳离子交换树脂除盐后进行质谱分析。样品通过2 μL定量环进样,喷雾电压4 kV;鞘气3 MPa;辅助气0.5 MPa;离子源温度为275 ℃;电压150 V[15,17]。山楂果胶酸性半乳糖醛酸含量的测定采用间羟基联苯法[18]。
1.3.4 细胞培养
HaCaT细胞用含10%胎牛血清的DMEM培养基于37 ℃、5% CO2的培养箱内培养至90%融合后,按分组进行UVB照射及山楂果胶低聚半乳糖醛酸提取物处理。
1.3.5 实验分组及UVB辐射
按照参考文献[19]的方法,并略有改动,采用SUV-100日光紫外线模拟器及UVB辐射度监示器进行实验。实验分为对照组:HaCaT细胞不照射UVB,不给予山楂果胶低聚半乳糖醛酸提取物处理。UVB组:HaCaT细胞进行30 mJ/cm2UVB辐射处理40 s,距离15 cm,后更换新鲜培养基培养24 h。低、高剂量山楂果胶低聚半乳糖醛酸提取物处理+UVB照射实验组:每2 mL培养基中加入质量浓度为5 μg/mL(低剂量)或10 μg/mL(高剂量)山楂果胶低聚半乳糖醛酸提取物处理1 h后,进行30 mJ/cm2UVB辐射处理,之后更换含5 μg/mL或10 μg/mL山楂果胶低聚半乳糖醛酸提取物的培养基培养24 h。收集各组细胞进行相关指标检测。
1.3.6 MTT法测定细胞存活率
1.3.6.1 山楂半乳糖醛酸对细胞增殖的影响
培养HaCaT细胞至细胞密度为90%左右,用PBS清洗1 次,加入质量分数0.25%胰酶消化细胞,并加入完全培养基终止反应。88×g离心3 min。将不同组别的细胞接种于96 孔板中,每孔4×103个,每组设置5 个复孔,待细胞贴壁后进行加药处理。样品组每200 μL培养基中分别加入质量浓度0、5、10、20、40、80、150、200 μg/mL山楂果胶低聚半乳糖醛酸提取物,将96 孔板置于37 ℃、5% CO2的条件下培养48 h后采用MTT法检测。96 孔板内每孔加入100 μL DMEM完全培养基与10 μL 5 mg/mL MTT混合液,置于37 ℃、5% CO2培养箱中孵育4 h。4 h后小心吸去上清液,加入150 μL DMSO,避光静置10 min后在酶标仪上测定其在570 nm波长处OD值,OD值越大表明存活率越高。
1.3.6.2 UVB辐射后山楂半乳糖醛酸提取物对细胞增殖的影响
将分组后的细胞按1.3.6.1节方法进行实验,分别用UVB和山楂半乳糖醛酸提取物处理细胞24 h后,用MTT法测定细胞存活率(式(2))。
式中:OD样品组、OD对照组分别为样品组、对照组在570 nm波长处OD值。
1.3.7 细胞内脂质过氧化物(MDA)含量和Hyp质量浓度的测定
将分组的细胞培养24 h后,用新鲜裂解缓冲液重悬至密度为107个/mL。按照试剂盒说明书进行操作,测定MDA含量和Hyp质量浓度。
1.3.8 细胞内ROS水平测定
细胞内的ROS水平测定按照Silván等[19]的方法,加入10 μmol/L 2’,7’-二氯荧光黄双乙酸盐于各组培养基,分组方法参见1.3.5节。37 ℃孵育细胞30 min。收集细胞,1 000×g离心10 min,去上清液,用200 μL PBS重悬细胞。使用荧光酶标仪检测,激发光波长为485 nm,发射光波长为530 nm。测定结果以相对荧光强度表示。
1.3.9 细胞内酶活力的测定
细胞内SOD、GSH-Px、CAT和LDH活力采用试剂盒检测,细胞培养及样品处理方法见1.3.5节,按照试剂盒操作说明对4 种酶活力进行检测。
1.3.10 ELISA法检测MMP-1含量、TNF-α及IL-6质量浓度
蛋白质提取和定量测定按照试剂盒说明书方法操作。细胞培养及样品处理方法见1.3.5节,依照ELISA试剂盒说明书测定各实验组MMP-1含量、TNF-α及IL-6质量浓度。
1.3.11 qPCR检测
将HaCaT细胞培养于含10% PBS的DMEM培养基中,置于5% CO2、37 ℃培养箱中。将分组后的细胞接种于96 孔板中,每孔细胞数为4×103个,每组设置5 个复孔,培养24 h后测定相关基因(MMP-1、T N F-α和I L-6)的表达量。采用试剂盒提取总RNA。将20 μL反转录RNA获得的相应cDNA置于-20 ℃,采用PCR仪测定。mRNA核苷酸序列内参采用β-actin,引物由上海生工生物工程(上海)有限公司合成。引物序列为:MMP-1上游引物:5’-CGACTCTAGAAACACAAGAGCAAGA-3’,下游引物:5’-A A G G T T A G C T T A C T G T C A C A C G C T T-3’; T N F-α上 游 引 物 :5’-CCAGACCCTCACACTCAGAT-3’,下游引物:5’-AACACCCATTCCCTTCACAG-3’;IL-6上游引物:5’-GCTATGAAGTTCCTCTCTGC-3’,下游引物:5’-CTAGGTTTGCCGAGTAGATC-3’。结果以2-ΔΔCt方法计算。
实验数据至少3 次重复,结果以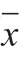 ±s表示。采用DPS软件进行单因素方差分析(One-way ANOVA),P<0.05表示差异显著,P<0.01表示差异极显著。
±s表示。采用DPS软件进行单因素方差分析(One-way ANOVA),P<0.05表示差异显著,P<0.01表示差异极显著。
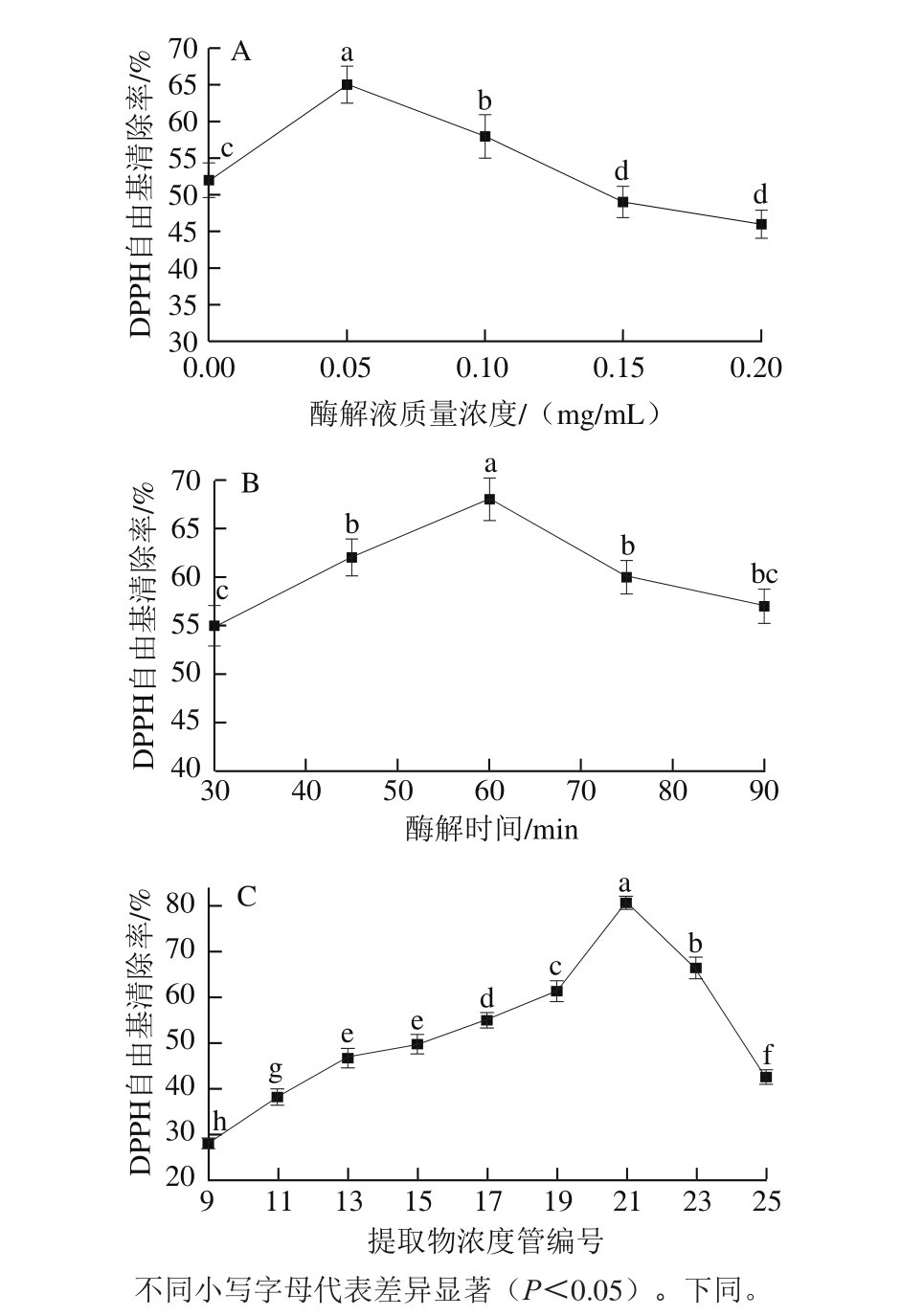
图1 酶解液质量浓度(A)、酶解时间(B)及山楂果胶低聚半乳糖醛酸提取物(C)对DPPH自由基清除率的影响
Fig.1 Effect of enzyme concentration (A), hydrolysis time (B) and hawthorn pectin oligogalacturonides (C) on DPPH radical scavenging rate of hydrolysates
由图1可知,在相同酶解液质量浓度下,随着酶解时间的延长,酶解物的DPPH自由基清除率呈现先增加后降低的趋势,在60 min、酶解液质量浓度0.05 mg/mL时,DPPH自由基清除率最高。这可能是因为酶解时间较短时果胶多糖降解不充分,酶解液中多为大分子聚半乳糖醛酸,其抗氧化能力弱;而随着酶解时间延长,果胶多糖过度降解为单糖,使得酶解液抗氧化能力逐渐降低。相同酶解时间下,随着酶解液质量浓度的增加,酶解液DPPH自由基清除率逐渐降低,这是因为酶解液质量浓度越大,相同酶解时间内果胶多糖酶解越彻底,半乳糖醛酸聚合度降低,故其抗氧化能力逐渐降低。
隔管测定阴离子交换树脂分离液,自第9号提取物浓度管开始收集,山楂果胶低聚半乳糖醛酸提取物的DPPH抗氧化能力呈现先增加后降低的趋势,在第21号提取物浓度管获得DPPH抗氧化能力最强样品,其DPPH自由基清除率达80.6%。
利用质谱对分离后的山楂低聚半乳糖醛酸进行聚合度分析,得到5 种不同聚合度的醛酸。在正离子模式下,由于洗脱过程中NH4+离子的引入,图谱中同时存在[M+Na]+、[M+NH4]+离子峰,其中m/z为745、921、1 273、1 525分别是半乳糖醛酸聚合度为4、5、7、9的[M+Na]+峰。m/z为1 109是聚合度为3的低聚半乳糖醛酸的[2M+NH4]+峰[20]。通过间羟基联苯法对分离纯化后山楂果胶酸酶解液中酸性半乳糖醛酸含量的测定结果为87%。
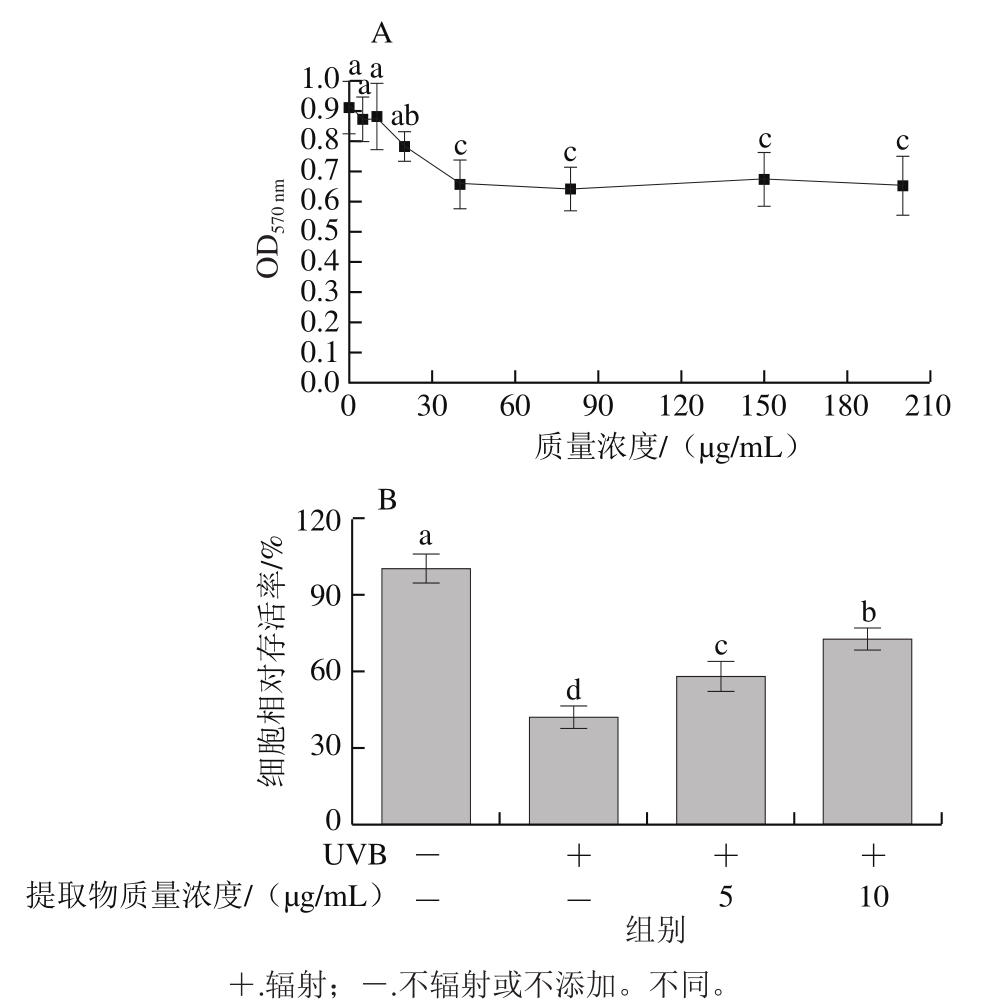
图2 山楂果胶低聚半乳糖醛酸提取物对HaCaT细胞(A)及经UVB辐射后HaCaT细胞(B)的增殖作用
Fig.2 Cytotoxic effects of hawthorn pectin oligogalacturonide on HaCaT cells (A) and protective effect against UVB irradiation (B)
由图2A可知,5、10 μg/mL的山楂果胶低聚半乳糖醛酸提取物对细胞没有显著影响(P>0.05),当质量浓度在20~200 μg/mL时,细胞存活率随质量浓度增大呈减小趋势,表明山楂果胶低聚半乳糖醛酸提取物对细胞的损伤有一定限度。经UVB照射后,5、10 μg/mL的山楂果胶低聚半乳糖醛酸提取物对细胞有一定保护作用(图2B)。5、10 μg/mL山楂果胶低聚半乳糖醛酸提取物使细胞相对存活率分别显著提升37.7%和72.4%(P<0.05),且两剂量组间有显著差异(P<0.05)。
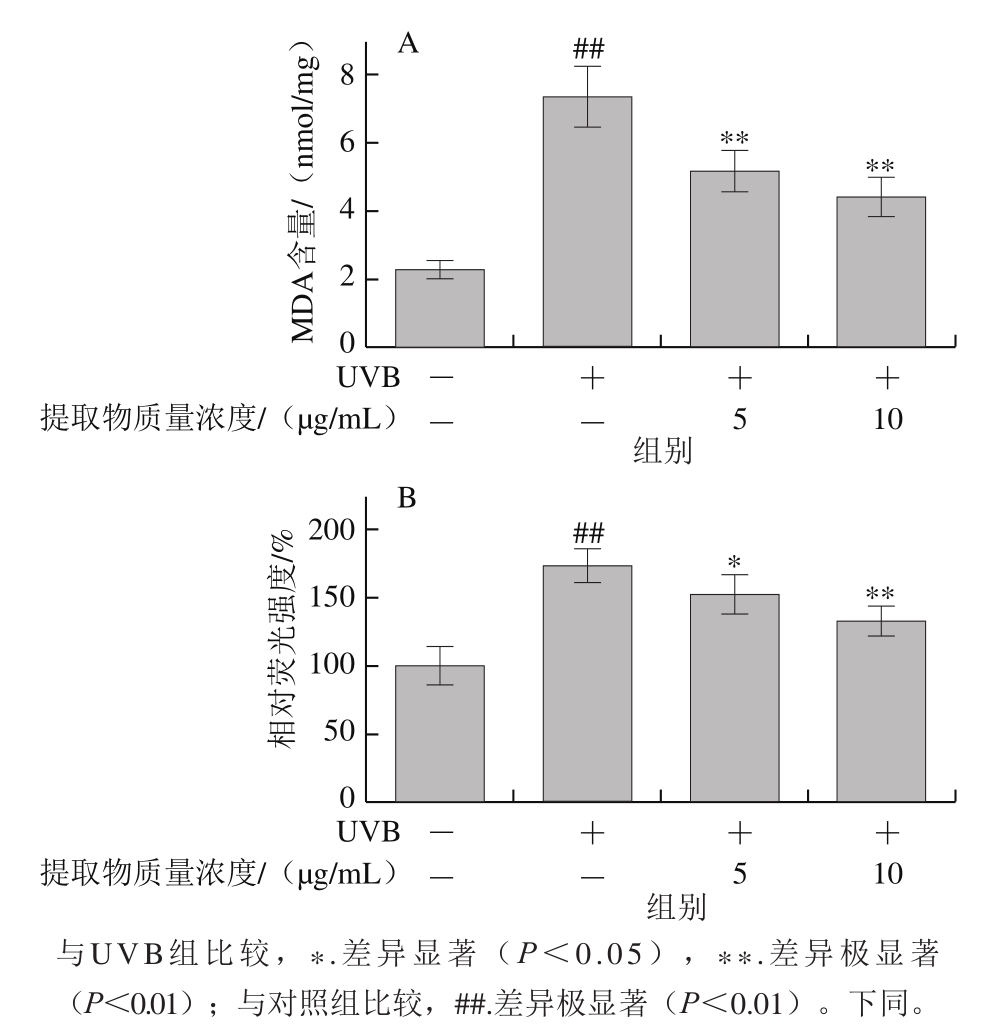
图3 山楂果胶低聚半乳糖醛酸提取物对HaCaT细胞UVB辐射后MDA含量(A)和ROS水平(B)的影响
Fig.3 Effects of hawthorn pectin oligogalacturonide on MDA (A) and ROS levels (B) of HaCaT cells after UVB irradiation
如图3所示,经UVB辐射后,细胞产生大量MDA和ROS,与对照组相比有极显著差异(P<0.01)。山楂果胶低聚半乳糖醛酸提取物可有效降低细胞内MDA含量和ROS水平,保护细胞,减轻氧化损伤。与UVB组比较,5、10 μg/mL山楂果胶低聚半乳糖醛酸提取物使MDA含量分别降低30.1%和39.8%(P<0.01),使ROS水平分别降低12.0%和23.9%(P<0.05,P<0.01)。
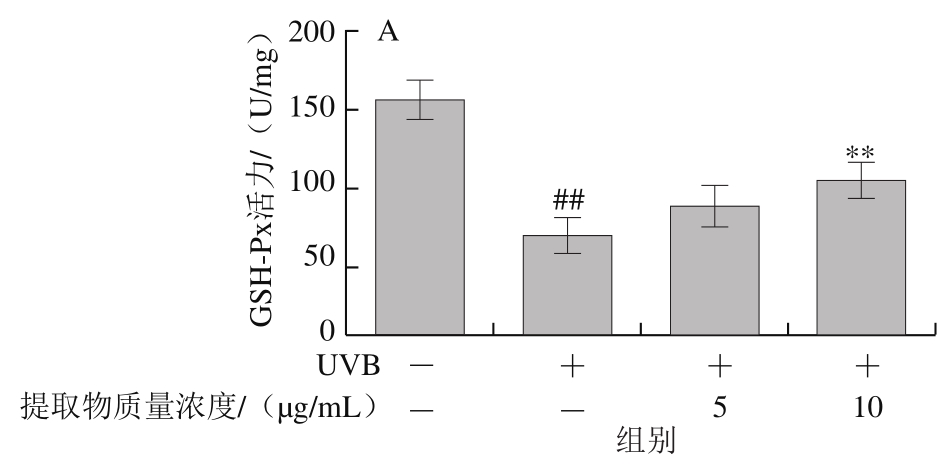
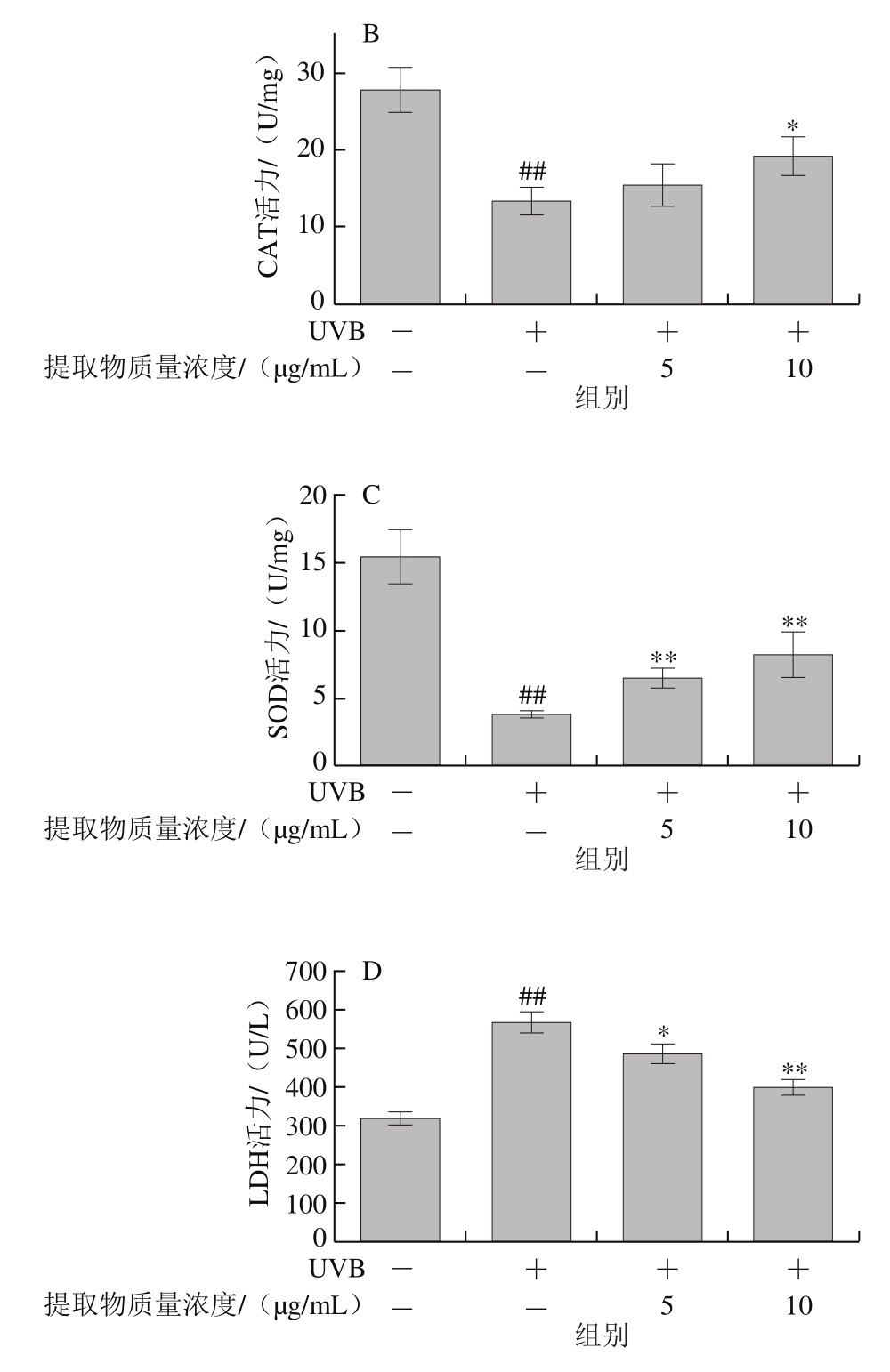
图4 山楂果胶低聚半乳糖醛酸提取物对HaCaT细胞UVB辐射后抗氧化酶(A~C)和LDH活力(D)的影响
Fig.4 Effects of hawthorn pectin oligogalacturonide on antioxidase (A-C)and LDH (D) levels of HaCaT cells after UVB irradiation
山楂果胶低聚半乳糖醛酸提取物有效提升经UVB辐射后HaCaT细胞内抗氧化酶活力(图4A~C)。UVB辐射使细胞内抗氧化酶活力极显著降低(P<0.01)。5 μg/mL山楂果胶低聚半乳糖醛酸提取物对细胞GSH-Px和CAT活力无显著增加作用(P>0.05),但可极显著提升SOD活力(P<0.01)。而10 μg/mL山楂果胶低聚半乳糖醛酸提取物对3 种抗氧化酶活力有显著或极显著提升作用(P<0.05,P<0.01),使3 种抗氧化酶活力分别增加54.5%、44.0%和119.3%。5、10 μg/mL山楂果胶低聚半乳糖醛酸提取物分别使LDH活力降低14.2%和29.9%(P<0.05,P<0.01)。
山楂果胶低聚半乳糖醛酸提取物有效抑制经UVB辐射后HaCaT细胞内MMP-1含量增加和TNF-α、IL-6质量浓度升高(图5A~C)。经UVB辐射后,MMP-1含量极显著增加(P<0.01),激活了MMPs信号通路,使细胞光老化加速。与UVB组相比,5、10 μg/mL山楂果胶低聚半乳糖醛酸提取物使细胞内MMP-1含量降低了31.8%和40.7%(P<0.05,P<0.01),显著或极显著降低由UVB诱导的TNF-α、IL-6质量浓度升高(P<0.05,P<0.01),并使Hyp质量浓度分别显著增加了38.3%和67.2%(图5D)。
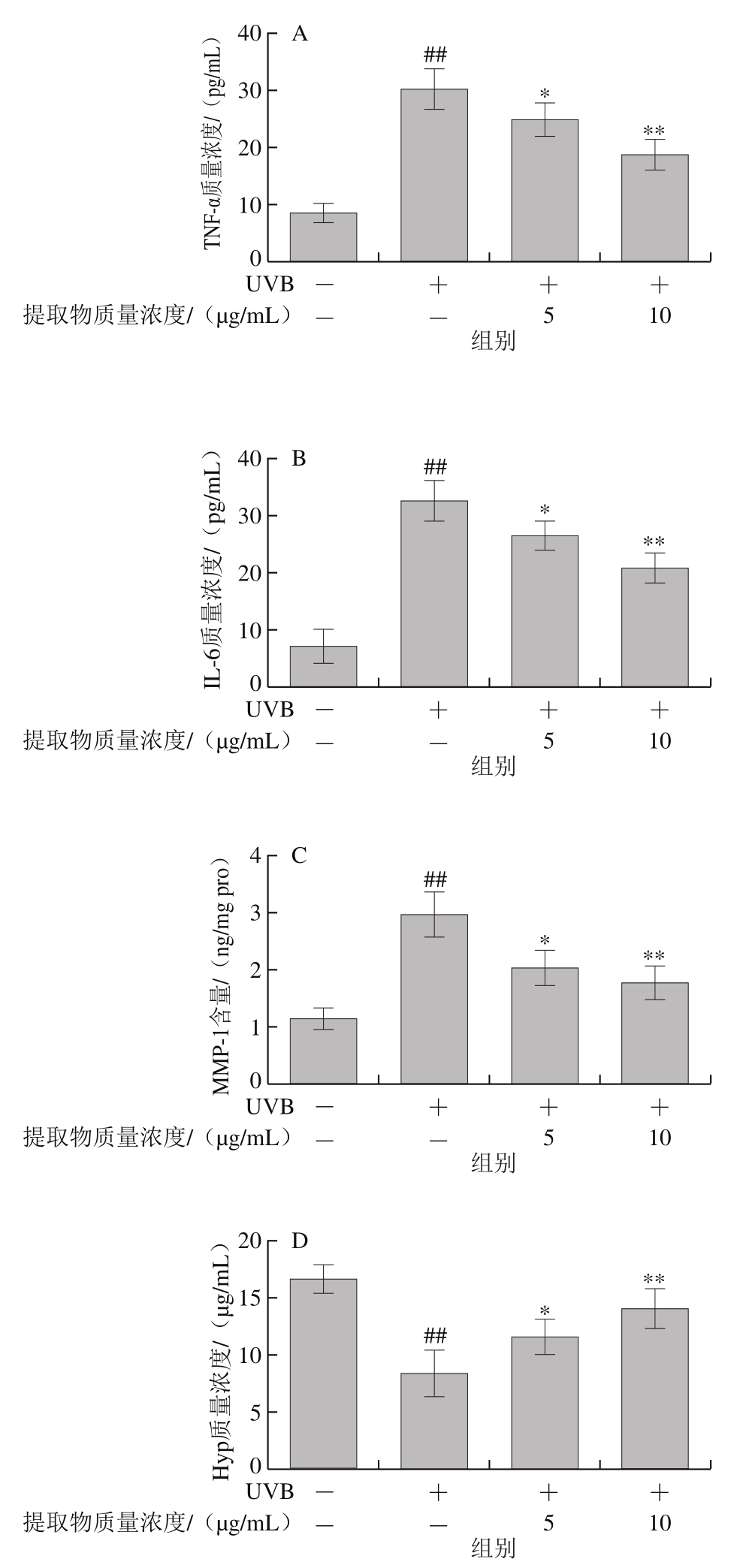
图5 山楂果胶低聚半乳糖醛酸提取物对HaCaT细胞UVB辐射后TNF-α(A)、IL-6(B)、MMP-1(C)、Hyp(D)水平的影响
Fig.5 Effects of hawthorn pectin oligogalacturonide on TNF-α (A),IL-6 (B), MMP-1 (C) and Hyp (D) levels in HaCaT cells after UVB irradiation
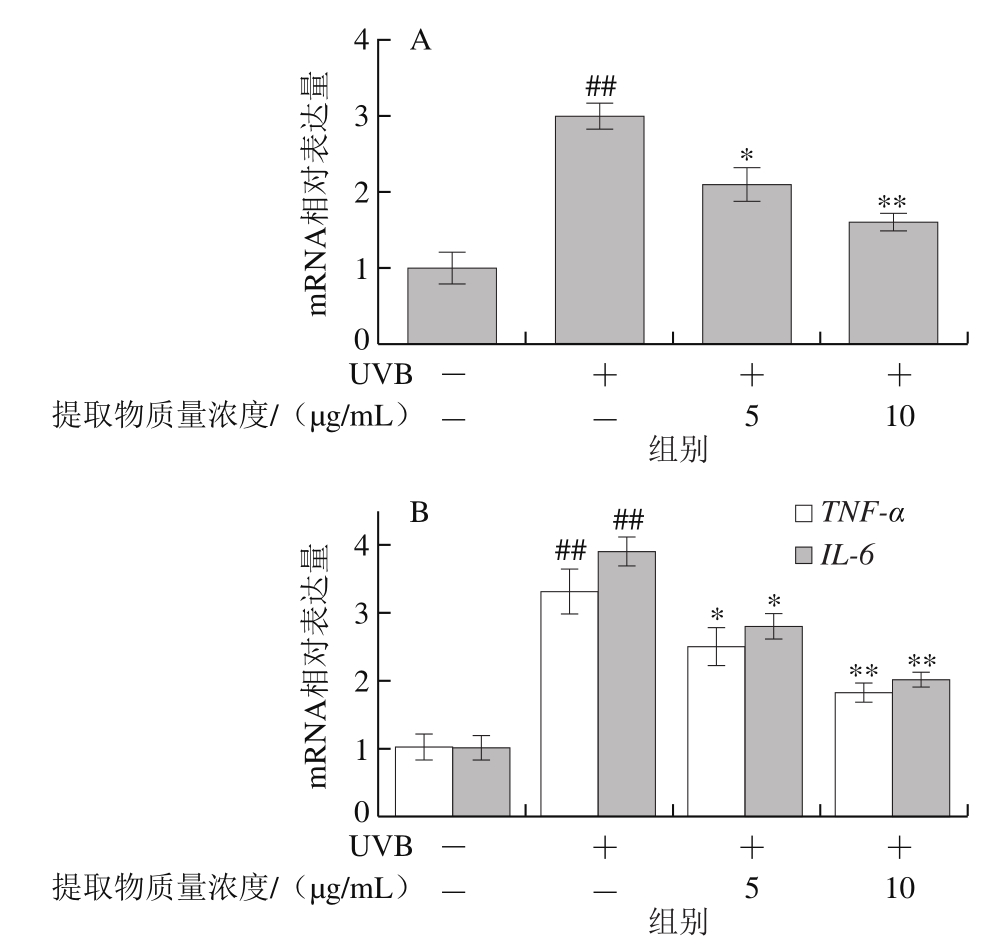
图6 山楂果胶低聚半乳糖醛酸提取物对HaCaT细胞UVB辐射后MMP-1(A)、TNF-α及IL-6(B)mRNA水平的影响
Fig.6 Effects of hawthorn pectin oligogalacturonide on mRNA expression levels of MMP-1 (A), TNF-α and IL-6 (B) in HaCaT cells after UVB irradiation
山楂果胶低聚半乳糖醛酸提取物可有效抑制经UVB辐射后HaCaT细胞内MMP-1、TNF-α及IL-6 mRNA水平升高(图6)。经UVB辐射后,MMP-1 mRNA水平极显著升高(P<0.01)。5、10 μg/mL山楂果胶低聚半乳糖醛酸提取物显著或极显著降低细胞内MMP-1、TNF-α及IL-6 mRNA相对表达量(P<0.05,P<0.01)。mRNA表达水平检测结果与含量或质量浓度检测结果一致。
果胶低聚糖的抗氧化能力与果胶的来源、品种、浓度、制备方式以及聚合度密切相关。柑橘果胶聚合度与DPPH自由基清除能力关系的研究中发现,酸性寡糖聚合度在一定范围内与DPPH自由基清除率呈现正相关性;但高聚合度的糖分子结合紧密,分子间有较强的相互作用力,削弱了酸性寡糖分子中羧基、羟基等基团的活性,因此其活性的强弱与果胶低聚糖的分子大小即聚合度有关[21-22]。本实验中,随着分离的进行,收集到的低聚半乳糖醛酸样品存在着聚合度和质量浓度的差异,因此选用DPPH自由基清除率较优的分离液进行后续实验。
阳光中的紫外线在生命周期中累积,造成细胞损伤,导致细胞死亡。由紫外线引起的氧化应激在皮肤细胞中引起细胞内ROS的生成,导致细胞损伤,最终使细胞凋亡。山楂果胶水解后的低聚半乳糖醛酸具有较高的抗氧化活性,能够调节脂质代谢[11-12]。但对UVB诱导的皮肤细胞损伤的保护作用还有待研究。因此,对山楂果胶低聚半乳糖醛酸提取物对UVB诱导HaCaT细胞产生的氧化损伤和光老化保护作用进行了研究。经UVB辐射后,HaCaT细胞会产生大量ROS,使皮肤抗氧化酶活力降低[23],产生大量的自由基并攻击细胞,导致氧化产物MDA含量增加,导致细胞损伤。另外,UVB辐射会损伤细胞膜的脂层结构,使细胞膜通透性变大、细胞内容物外流,并使LDH外泄[24]。因此,LDH漏出率可作为细胞膜损伤的重要指标。本研究发现,山楂果胶低聚半乳糖醛酸提取物能够有效降低经UVB辐射后的HaCaT细胞内的MDA含量和ROS水平,降低LDH活力,阻止细胞膜通透性变大,从而保护细胞膜,并显著提升受损细胞的存活率。茶叶中表没食子儿茶素没食子酸酯能够降低细胞内的MDA含量并降低LDH活力[24],与本研究结果一致。
皮肤衰老是一个复杂的生物机制,主要原因是由于产生过多的自由基和ROS。紫外线引起的皮肤老化称为光老化。UVB辐射能够产生更多的ROS,造成氧化损伤,加速皮肤的衰老。前人研究结果显示,多酚清除自由基的途径是依赖抑制紫外线诱导的氧化应激[25]。一些化合物能够捕获自由基,并具有抗氧化的作用,可以减轻光老化。葡萄多酚具有清除自由基的能力,从而使细胞内ROS水平显著降低[25]。这与本研究结果一致,山楂果胶低聚半乳糖醛酸提取物显著减少HaCaT细胞内ROS的生成,从而保护细胞,减少氧化损伤。在皮肤光老化过程中,MDA含量、ROS水平、Hpy质量浓度和SOD、GSH-Px、CAT活力变化都对皮肤老化产生重要影响。
皮肤老化引起真皮纤维的变化主要包括胶原纤维厚度、弹性、褶皱的变化。影响ROS水平的主要抗氧化酶包括GSH-Px、SOD和CAT,这些酶能够通过多种内源性细胞防御系统消除ROS,并对细胞氧化损伤有一定的保护作用。UVB辐射加速细胞脂质过氧化物的生成,使GSH-Px、SOD、CAT活力和Hyp质量浓度降低[26]。Hyp主要存在于胶原蛋白中,与胶原蛋白的合成有直接关系,其含量的多少成为评价皮肤光老化程度的重要指标[27]。在本研究中,山楂果胶低聚半乳糖醛酸提取物能够显著提升GSH-Px、SOD、CAT活力和Hyp质量浓度,因此能够有效减缓皮肤光老化,促进胶原蛋白的合成。有研究表明,蔓越莓果汁可使UVB照射的细胞中LDH活力降低,并使Hyp含量提高[28],与本研究结果一致。
光老化的皮肤中可见一系列细胞因子如IL、MMPs、活化蛋白以及DNA损伤的增加。MMPs可降解绝大部分细胞外基质,是皮肤光老化的直接诱因。MMP-1是MMPs的特异性内源性抑制物,能够抑制MMPs的活化与表达,从而阻止光老化的发生。UVB依赖诱导MMP-1和MMP-3调节细胞内脂质过氧化和羟自由基水平[29]。紫外线照射能够上调MMPs路径,这些路径与皮肤损伤中的胶原蛋白降解密切相关[30]。本研究表明,细胞暴露在30 mJ/cm2UVB辐射下40 s,MMP-1 mRNA水平极显著提升,山楂果胶低聚半乳糖醛酸提取物能够极显著降低MMP-1 mRNA水平,有效抑制MMP-1分泌。据报道,海洋胶原蛋白水解物通过抑制MMP-1的表达可以抑制胶原蛋白的降解[31],在鳕鱼皮明胶蛋白酶解物中也有同样的发现[32],与本研究结果一致。
另外,TNF-α和IL-6是与UVB辐射有关的炎症细胞因子。据报道,紫外线照射可引起HaCaT细胞的TNF-α和IL-6大量分泌[4]。TNF-α可促进IL-1β、IL-6和IL-8等其他炎症因子的分泌。IL-6在角质形成细胞-成纤维细胞相互作用环路中也起着重要的作用,这些炎性因子过量分泌,进一步加剧皮肤细胞的损伤[33]。本实验研究结果显示,经过山楂果胶低聚半乳糖醛酸提取物处理后,HaCaT细胞培养上清液中的TNF-α和IL-6质量浓度明显下降,提示山楂果胶低聚半乳糖醛酸提取物可以通过抑制TNF-α和IL-6的分泌,改善细胞环境,减轻UVB辐射所造成的细胞损伤。
综上,山楂果胶低聚半乳糖醛酸提取物对UVB辐射HaCaT细胞的氧化损伤及光老化具有保护作用,其作用机制可能与增强细胞抗氧化酶活力、降低ROS水平、抑制MMP-1分泌以及促进胶原蛋白合成有关。本研究为山楂果胶低聚半乳糖醛酸提取物作为保健食品对抑制UVB辐射造成的光氧化损伤及光老化的保护作用提供了一定的理论依据,但其抑制光氧化损伤和光老化保护作用的分子机制以及动物体内实验还有待进一步研究。
[1] JENKINS G. Molecular mechanisms of skin ageing[J]. Mechanisms of Ageing & Development, 2002, 123(7): 801-810. DOI:10.1016/S0047-6374(01)00425-0.
[2] HELENIUS M, MÄKELÄINEN L, SALMINEN A. Attenuation of NF-κB signaling response to UVB light during cellular senescence[J].Experimental Cell Research, 1999, 248(1): 194-202. DOI:10.1006/excr.1999.4393.
[3] ICHIHASHI M, UEDA M, BUDIYANTO A, et al. UV-induced skin damage[J]. Toxicology, 2003, 189(1): 21-39. DOI:10.1016/S0300-483X(03)00150-1.
[4] AMBOTHI K, PRASAD N R, BALUPILLAI A. Ferulic acid inhibits UVB-radiation induced photocarcinogenesis through modulating inflammatory and apoptotic signaling in Swiss albino mice[J].Food and Chemical Toxicology, 2015, 82: 72-78. DOI:10.1016/j.fct.2015.04.031.
[5] FILIP G A, POSTESCU I D, BOLFA P, et al. Inhibition of UVB-induced skin phototoxicity by a grape seed extract as modulator of nitrosative stress, ERK/NF-κB signaling pathway and apoptosis, in SKH-1 mice[J]. Food and Chemical Toxicology, 2013, 57(6): 296-306. DOI:10.1016/j.fct.2013.03.031.
[6] HA S J, LEE J, KIM H, et al. Preventive effect of Rhus javanica extract on UVB-induced skin inflammation and photoaging[J].Journal of Functional Foods, 2016, 27: 589-599. DOI:10.1016/j.jff.2016.10.011.
[7] 李红光. 枸杞多糖在UVB辐射人角质形成细胞氧化损伤中的保护作用[D]. 太原: 山西医科大学, 2014: 1-31.
[8] 加杨娥, 任立汆, 燕华玲. 柴达木枸杞多糖对UVB诱导人HaCaT细胞氧化损伤及凋亡相关蛋白的影响[J]. 中国皮肤性病学杂志, 2017,31(8): 825-829. DOI:10.13735/j.cjdv.1001-7089.201703087.
[9] 郭砚, 孙娟, 王丽雯. 藏雪莲多糖对UVB辐射HaCaT细胞氧化损伤的保护作用[J]. 药物分析杂志, 2015, 35(6): 1016-1021.DOI:10.16155/j.0254-1793.2015.2015.06.13.
[10] LI S H, LI T P, JIA Y F, et al. Fractionation and structural characterization of haw pectin oligosaccharides[J]. European Food Research and Technology, 2011, 233(5): 731-734. DOI:10.1007/s00217-011-1568-8.
[11] LI T P, LI S H, DU L J, et al. Effects of haw pectic oligosaccharide on lipid metabolism and oxidative stress in experimental hyperlipidemia mice induced by high-fat diet[J]. Food Chemistry, 2010, 121(4): 1010-1013. DOI:10.1016/j.foodchem.2010.01.039.
[12] LI T P, LI S H, DONG Y P, et al. Antioxidant activity of pentaoligogalacturonide, isolated from haw pectin, suppresses triglyceride synthesis in mice fed with a high-fat diet[J]. Food Chemistry, 2014,145(4): 335-341. DOI:10.1016/j.foodchem.2013.08.036.
[13] 张秀芳, 王克冰, 闫晓霖, 等. 微波辅助酸法提取柚皮果胶的工艺优化[J]. 南方农业学报, 2014, 45(11): 2041-2045. DOI:10.3969/j:issn.2095-1191.2014.11.2041.
[14] NIKOLIC M V, MOJOVIC L. Hydrolysis of apple pectin by the coordinated activity of pectic enzymes[J]. Food Chemistry, 2007,101(1): 1-9. DOI:10.1016/j.foodchem.2005.12.053.
[15] 徐溪. 苹果果胶寡糖的分离制备及其活性研究[D]. 西安: 西北大学,2010: 1-61.
[16] LIU S W, XU Q, LI X Y, et al. Effects of high hydrostatic pressure on physicochemical properties,enzymes activity, and antioxidant capacities of anthocyanins extracts of wild Lonicera caerulea berry[J].Innovative Food Science and Emerging Technologies, 2016, 36: 48-58. DOI:10.1016/j.ifset.2016.06.001.
[17] LIU Y, URGAONKAR S, VERKADE J G, et al. Separation and characterization of underivatized oligosaccharides using liquid chromatography and liquid chromatography-electrospray ionization mass spectrometry[J]. Journal of Chromatography A, 2005, 1079(1/2):146-152. DOI:10.1016/j.chroma.2005.03.011.
[18] 许会生, 张铁军, 赵广荣, 等. 一种测定酸性多糖中糖醛酸和中性糖含量的改良方法[J]. 食品工业科技, 2007, 58(7): 197-199.DOI:10.3969/j.issn.1002-0306.2007.07.062.
[19] SILVÁN J M, REGUERO M, PASCUAL-TERESA S. A protective effect of anthocyanins and xanthophylls on UVB-induced damage in retinal pigment epithelial cells[J]. Food & Function, 2016, 7(2): 1067-1076. DOI:10.1039/c5fo01368b.
[20] 徐溪, 李潇, 黄琳娟, 等. 苹果果胶活性寡聚半乳糖醛酸的分离制备及其ESI-MS分析研究[J]. 化学学报, 2010, 68(15): 1525-1531.
[21] KIM K W, THOMAS R L. Antioxidative activity of chitosans with varying molecular weights[J]. Food Chemistry, 2007, 101(1): 308-313.DOI:10.1016/j.foodchem.2006.01.038.
[22] SUN T, ZHOU D X, XIE J L, et al. Preparation of chitosan oligomers and their antioxidant activity[J]. European Food Research &Technolology, 2007, 225(3/4): 451-456. DOI:10.1007/s00217-006-0439-1.
[23] BERTON T R, PAVONE A, FISCHER S M. Ultraviolet-B irradiation alters the cell cycle machinery in murine epidermis in vivo[J]. Journal of Investigative Dermatology, 2001, 117(5): 1171-1178. DOI:10.1046/j.0022-202x.2001.01536.x.
[24] 林勇, 刘仲华, 马蕊. 茶叶中表没食子儿茶素没食子酸酯抑制中波紫外线诱导HaCaT细胞氧化损伤研究[J]. 食品安全质量检测学报,2015, 6(4): 1224-1228.
[25] MATITO C, AGELL N, SANCHEZ-TENA S, et al. Protective effect of structurally diverse grape procyanidin fractions against UV-induced cell damage and death[J]. Journal of Agricultural and Food Chemistry,2011, 59(9): 4489-4495. DOI:10.1021/jf103692a.
[26] WU Y, TIAN Q, LI L, et al. Inhibitory effect of antioxidant peptides derived from Pinctada fucata protein on ultr aviolet-indu ced photoaging in mice[J]. Journal of Functional Foods, 2013, 5(2): 527-538. DOI:10.1016 /j.jff.2013.01.016.
[27] 曾满红, 黄清松. 茶多酚延缓皮肤光老化的药效学实验研究[J].宜春学院学报, 2011, 33(12): 91-92. DOI:10.3969/j.issn.1671-380X.2011.12.035.
[28] 刘硕, 邝梦婷, 朱华伟, 等. 蔓越莓抑制UVB诱导HaCaT细胞氧化损伤和凋亡的研究[J]. 食品研究与开发, 2015, 36(22): 5-10.DOI:10.3969/j.issn.1005-6521.2015.22.002.
[29] CHIANG H M, LIN T J, CHIU C Y, et al. Coffea arabica extract and its constituents prevent photoaging bysuppressing MMPs expression and MAP kinase pathway[J]. Food and Chemical Toxicology, 2011,49(1): 309-318. DOI:10.1016/j.fct.2010.10.034.
[30] YU R J, KIM D H, KIM S R, et al. Anti-wrinkle effect of magnesium lithospermate B from Salvia miltiorrhiza BUNGE: inhibition of MMPs via NF-κB signaling[J]. PLoS ONE, 2014, 9(8): e102689.DOI:10.1371/journal.pone.0102689.
[31] LIANG J, PEI X, ZHANG Z, et al. The protective effects of longterm oral administration of marine collagen hydrolysate from chum salmon on collagen matrix homeostasis in the chronological aged skin of Sprague-Dawley male rats[J]. Journal of Food Science, 2010, 75(8):230-238. DOI:10.1111/j.1750-3841.2010.01782.x.
[32] LU J H, HOU H, FAN Y, et al. Identification of MMP-1 inhibitory peptides from cod skin gelatin hydrolysates and the inhibition mechanism by MAPK signaling pathway[J]. Journal of Functional Foods, 2017, 33: 251-260. DOI:10.1016/j.jff.2017.03.049.
[33] 高扬, 易若琨, 宋家乐. 竹叶总黄酮对UVB诱导HaCaT细胞氧化损伤的保护作用[J]. 南京中医药大学学报, 2015, 31(2): 165-169.DOI:10.14148/j.issn.1672-0482.2015.0165.
Protective Effect of Hawthorn Pectin Oligogalacturonide Extract against Ultraviolet B-Induced Oxidative Damage and Photoaging in HaCaT Cells