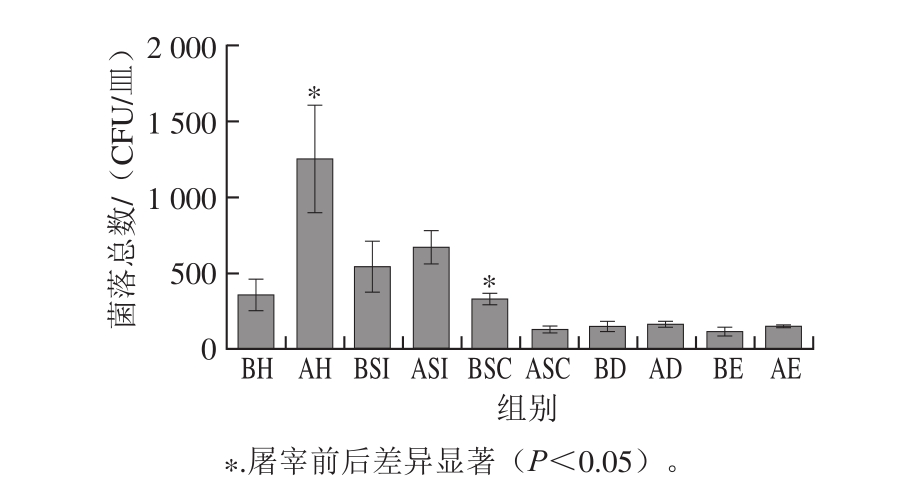
图1 家禽屠宰场空气菌落总数
Fig.1 Total airborne bacterial counts in different areas of the poultry slaughterhouse
鸡肉在世界消费市场上是增长速度最快的优质肉类,其肉质细嫩、滋味鲜美,因其具有高蛋白质、低脂肪、低热量、低胆固醇等营养特点,且供应充足、物美价廉,现已经成为世界上最受欢迎的主要肉类食品[1]。随着社会经济的发展和生活水平的提高,人们的消费观念也发生变化,开始越来越注重饮食的卫生。为了保障公共卫生安全,我国已经相继在各个城市的主城区全面限制活禽交易,主张家禽“集中屠宰,冷鲜上市”[2]。但有些屠宰场条件差,空气不流通,屠宰环境中可能存在不同种类微生物;而鸡肉食品营养丰富,是微生物生长的良好载体,其在屠宰和加工过程中的污染很难避免,如果控制不好将导致产品变质,影响产品货架期,甚至引起食源性疾病的发生[3-4]。目前对鸡肉加工和运输销售过程中微生物污染的研究较多,如屠宰加工过程中产生的交叉污染[5]。朱国良等[6]2014年调查了宁波市场生鸡肉微生物污染情况,发现有沙门氏菌、金黄色葡萄球菌和单增李斯特菌等污染。这些研究主要集中于屠宰各环节和销售中鸡肉微生物和特定食源性致病菌,对于屠宰场各屠宰区域中空气微生物研究较少;然而空气中的沉降微生物对鸡肉表面污染和屠宰场工作人员的健康有重要影响,因此对家禽定点屠宰场的空气微生物结构特征进行研究具有重要意义,可以为鸡肉食用安全提供有利依据。传统的基于分子生物学研究微生物的方法主要有荧光定量聚合酶链式反应(polymerase chain reaction,PCR)、荧光原位杂交、变性梯度凝胶电泳、克隆文库分析等[7-8],这些方法只能检测到部分微生物或者特定病原微生物,在种类和数量上有很大的局限性[9]。而近年来,随着高通量测序技术的迅速发展,其在分析微生物群落结构时,有着独特的优势,已成为微生物群落研究中非常重要的工具[10]。
平板计数琼脂(plate count agar,PCA)培养基杭州微生物试剂有限公司。
恒温培养箱 上海一恒科学仪器有限公司;离心机生工生物工程(上海)股份有限公司;PCR扩增仪 德国Biometra公司;HiSeq测序仪 美国Illumina公司。
1.3.1 样品采集
在浙江某家禽定点屠宰场不同的屠宰区域,包括挂禽间、宰杀沥血间、浸烫间、脱毛间、净膛间(包括净膛和清洗),分别收集屠宰前和连续屠宰5 h后空气微生物,具体方法为:把PCA平板均匀放在各区域四角和中间位置共5 个点,置于距地面1 m的高度,在同一时刻将5 个点的平板打开暴露5 min,随即加盖,置于37 ℃恒温箱中培养48 h,取出计数取平均值。屠宰前平板编号为挂禽间(BH)、宰杀沥血间(BSI)、浸烫间(BSC)、脱毛间(BD)、净膛间(BE);屠宰后平板编号为挂禽间(AH)、宰杀沥血间(ASI)、浸烫间(ASC)、脱毛间(AD)、净膛间(AE)。
1.3.2 DNA提取及扩增
采用ZR Fungal/Bacterial DNA MiniPrep™试剂盒进行空气平板微生物DNA提取。具体为:在无菌条件下,将500 μL无菌生理盐水加入各PCA平板中,刮取平板中所有菌苔置于灭菌离心管中,各区域的5 块平板样品混合后离心,去除上清液,将沉淀重悬在200 μL无菌生理盐水中,加入ZR BashingBead Lysis Tube,后续按照试剂盒说明书提取DNA,琼脂糖凝胶电泳进一步检测。
以提取的D N A为模板,引物为3 3 8 F(5’-ACTCCTACGGGAGGCAGCA-3’)和806R(5’-GGACTACHVGGGTWTCTAAT-3’),对屠宰场环境的细菌16S rRNA基因V3~V4区进行PCR扩增。
1.3.3 测序和质量控制
应用Illumina HiSeq测序仪高通量技术对屠宰场空气的细菌16S rRNA基因的V3~V4区进行测序。
1.3.4 生物信息学分析
采用高通量技术对家禽屠宰场空气中的细菌16S rRNA基因的V3~V4区进行测序,QIIME 1.7.0软件(http://qiime.org/scripts/split_libraries_fastq.html)对获得的序列进行筛选,得到高质量的DNA序列[11-12]。根据测序及计算的结果和聚类分析,得到一系列样品序列概况值(序列数量、物种数量、Shannon指数、Simpson指数、丰度指数和覆盖度指数),并绘制稀释性曲线、菌群结构柱状图、菌群丰度热点图、菌群结构的主坐标分析图等,从而反映屠宰场在屠宰前和屠宰后各个屠宰区域空气微生物的多样性及其丰富度。
将屠宰场各个屠宰区域在屠宰前后空气沉降的菌落总数的平均值转化为CFU/皿,用SPSS统计软件进行单因素方差分析(ANOVA)来比较不同屠宰区域屠宰前后细菌数量或相对丰度的差异,对有显著性差异的处理进行t检验。

图1 家禽屠宰场空气菌落总数
Fig.1 Total airborne bacterial counts in different areas of the poultry slaughterhouse
如图1所示,屠宰前和屠宰后不同屠宰区域的空气沉降微生物数量有一定的差异,特别是在挂禽间屠宰后空气沉降菌落总数比屠宰前高出71%,可能是因为屠宰中,挂禽间活鸡多、密度大,通风换气差;还有粪便干燥后随着鸡跳动会飘到空气中,破坏了环境,也利于一些病原菌的生长;另外病原菌易于附着在鸡咳嗽、鸣叫喷出来的小液滴上而进一步扩散传染[13]。各个区域屠宰后菌落数都增加,只有浸烫间屠宰后菌落总数反而比屠宰前减少了60%,可能是因为浸烫间温度高,烫毛水造成的水雾使空气不流通,空气中的微生物不易沉降。刘秀萍等[14]调查生猪屠宰前后的环境微生物,也检测出一定数量的菌落。赵慧等[15]分析了屠宰场车间空气微生物,认为这是肉制品污染的原因之一。
通过对家禽定点屠宰场在屠宰前和屠宰后空气微生物提取的DNA质控、筛选等处理,最终获得159 658 条有效序列,屠宰前5 个屠宰区域采集样品平均获得19 075 条,屠宰后平均是12 856 条,两组有显著性差异(P=0.035)。根据聚类分析,所得测序结果如表1所示,各样品最终获得152~190 个操作分类单元(operational taxonomic units,OTU),在屠宰前后样品分别平均获得178 个和174 个OTU,两组无显著差异(P=0.968),各样品的覆盖度指数均为1,稀释曲线均趋于平缓(图2),说明测序的结果合理,几乎覆盖了屠宰场空气中的所有物种,能够反映样品真实多样性组成。进一步根据得到的OTU信息,用ChaoI指数、ACE指数、Shannon指数及Simpson指数来评估样品微生物物种的丰富度和多样性(表1)。
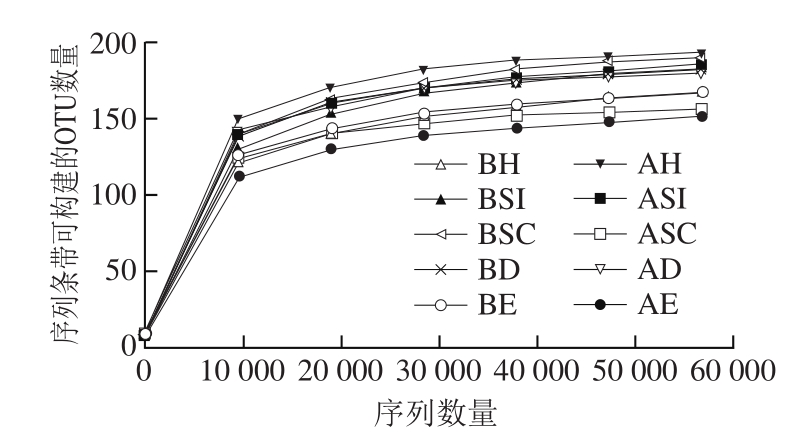
图2 各样品稀释曲线
Fig.2 Rarefaction curves showing bacterial community diversity
表1 样品测序概况
Table1 Summary of sequencing results for all samples
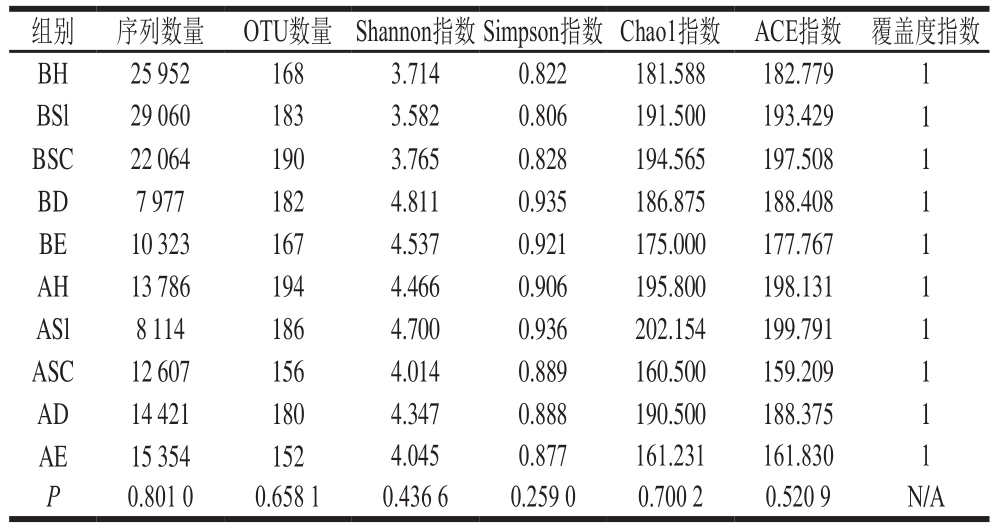
注:N/A.不适用。
组别 序列数量 OTU数量 Shannon指数Simpson指数 Chao1指数 ACE指数 覆盖度指数BH 25 952 168 3.714 0.822 181.588 182.779 1 BSl 29 060 183 3.582 0.806 191.500 193.429 1 BSC 22 064 190 3.765 0.828 194.565 197.508 1 BD 7 977 182 4.811 0.935 186.875 188.408 1 BE 10 323 167 4.537 0.921 175.000 177.767 1 AH 13 786 194 4.466 0.906 195.800 198.131 1 ASl 8 114 186 4.700 0.936 202.154 199.791 1 ASC 12 607 156 4.014 0.889 160.500 159.209 1 AD 14 421 180 4.347 0.888 190.500 188.375 1 AE 15 354 152 4.045 0.877 161.231 161.830 1 P 0.801 0 0.658 1 0.436 6 0.259 0 0.700 2 0.520 9 N/A
从微生物分类门的水平可知(图3A),从家禽定点屠宰场5 个区域在屠宰前和屠宰后各收集的沉降空气微生物中,主要包含厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)、绿弯菌门(Chloroflexi)等。其中厚壁菌门、变形菌门和放线菌门是屠宰场空气微生物的优势菌门,分别共占每个屠宰区域每次采样空气微生物的84%以上,其平均相对丰度分别为45.41%(22.01%~63.28%)、34.82%(11.39%~48.84%)、12.19%(3.91%~29.60%),Kim等[16]研究屠宰过程中鸡肉胴体微生物时,也检出这3 种为优势菌门。Kristiansen等[17]在研究猪舍空气微生物时发现厚壁菌门、变形菌门和拟杆菌门为主要的微生物。屠宰前和屠宰后沉降菌种类大致相似,但屠宰区域之间或每个区域屠宰前后空气微生物的相对丰度有差异,其中挂禽间和宰杀沥血间的厚壁菌门在屠宰前的相对丰度都较高,而屠宰后分别减少了21.55%和33.80%。
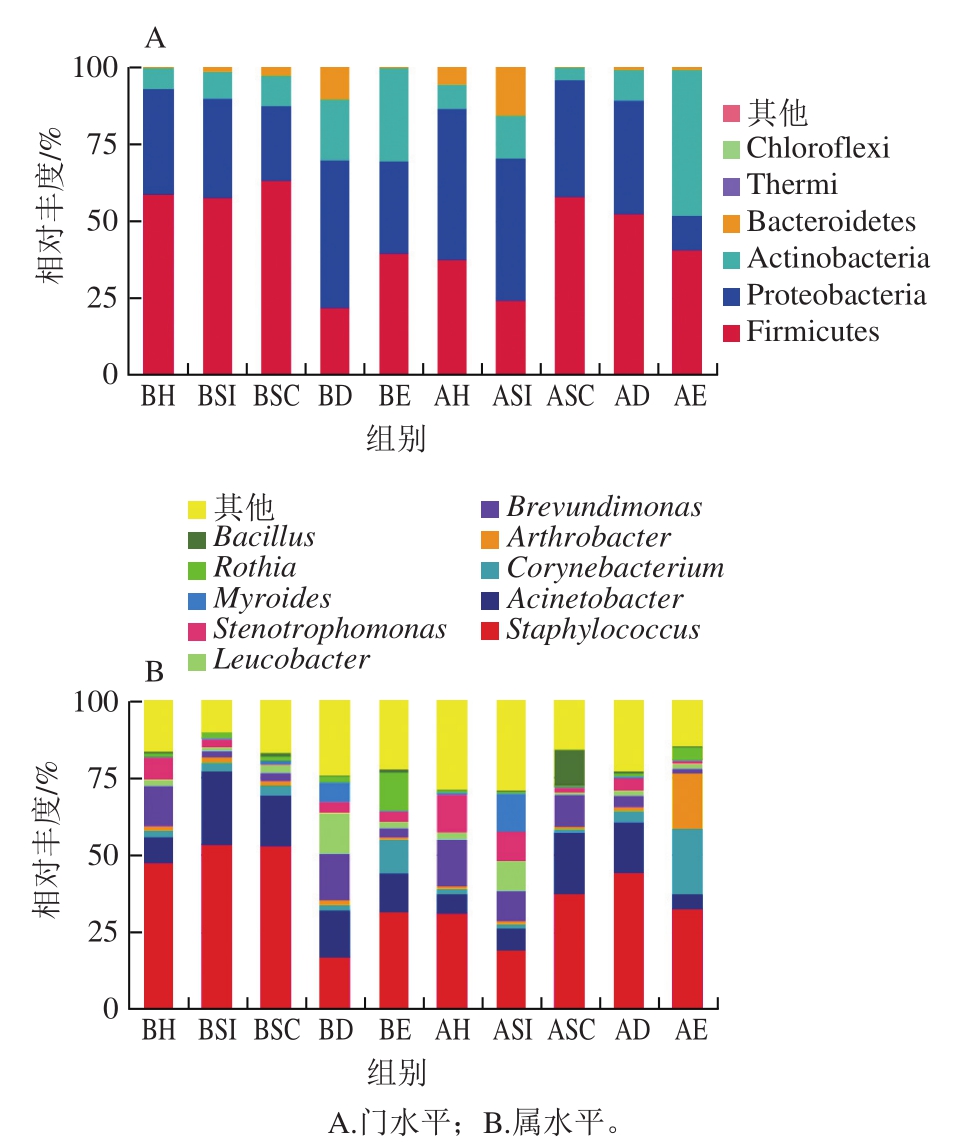
图3 家禽屠宰场不同区域空气菌群结构
Fig.3 Structure of airborne bacterial communities from different areas of the poultry slaughterhouse
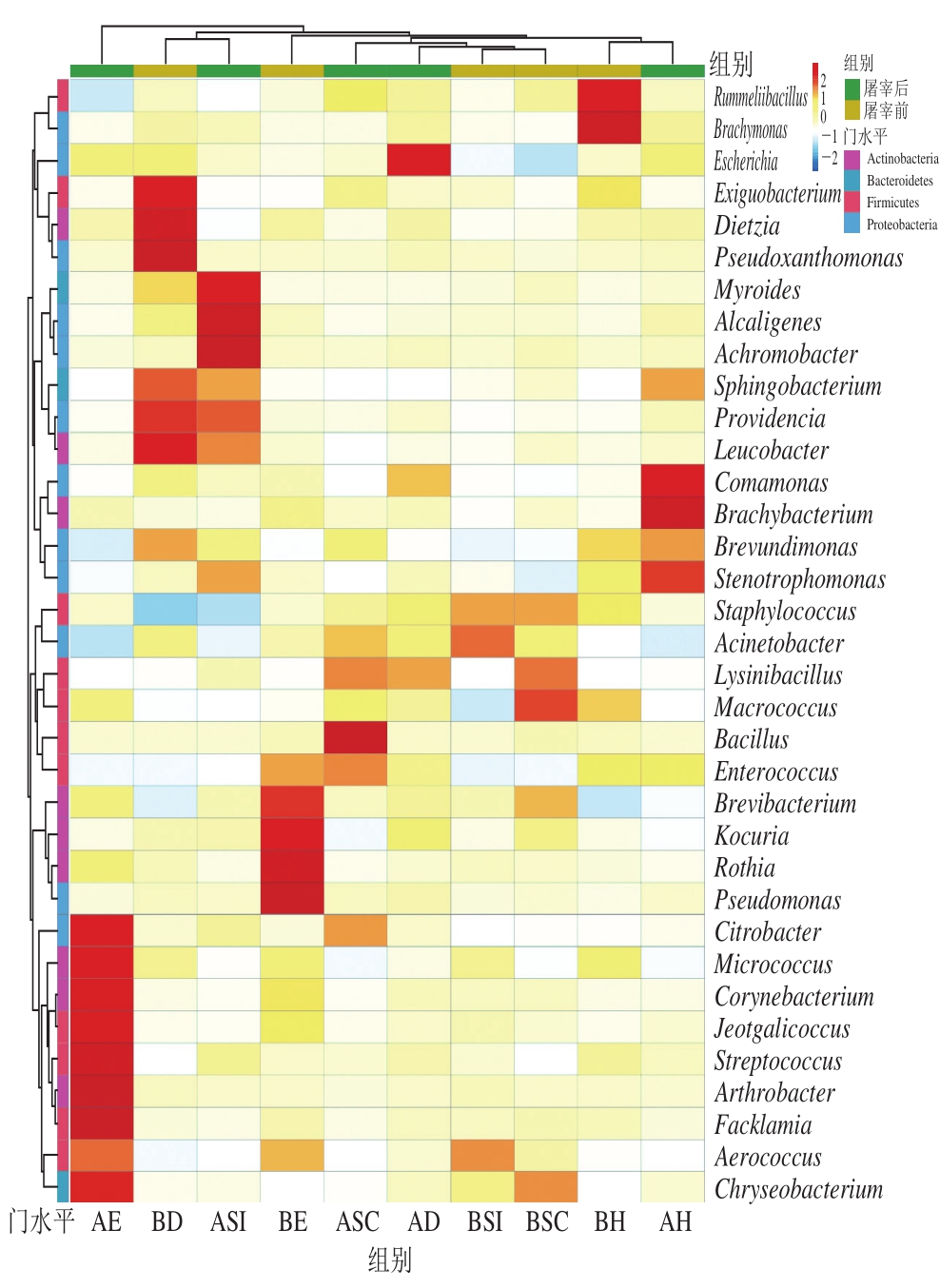
图4 家禽屠宰场不同区域菌群丰度热点图(属水平)
Fig.4 Abundance of bacteria in different areas of the poultry slaughterhouse at the genus level
从属的水平上分析(图3B),屠宰场空气微生物种类较丰富,微生物的相对丰度几乎都在70%以上。优势菌属主要为葡萄球菌属(Staphylococcus)和不动杆菌属(Acinetobacter),其相对丰度分别为36.90%(19.46%~53.46%)和13%(4.68%~23.41%),有研究表明,肉鸡在进入屠宰链时,它的羽毛、皮肤和粪便等都携带有大量的天然微生物,这些微生物会扩散到空气中,在后续的屠宰过程中可能会以不同的方式导致肉鸡的污染[18]。
表2 家禽屠宰场不同区域条件致病菌相对丰度
Table2 Relative abundance of conditional pathogens in different areas of the poultry slaughterhouse
%

组别 葡萄球菌属 不动杆菌属 寡养单胞菌属 埃希菌属BH 47.74 8.47 7.43 0.68 BSI 53.46 23.41 2.53 0.28 BSC 53.11 16.53 0.62 0.07 BD 16.81 15.51 3.67 1.24 BE 31.95 12.45 3.42 0.57 AH 31.56 5.88 12.38 1.23 ASI 19.46 6.80 9.63 0.68 ASC 37.64 20.04 1.65 0.65 AD 44.58 16.22 3.94 2.41 AE 32.72 4.68 1.26 1.21
从微生物分类属的水平上进一步分析,菌群丰度热点图(图4)展示出,不管是在屠宰前还是屠宰后,各个屠宰区域空气中的葡萄球菌属(Staphylococcus)污染较严重,相对丰度均超过16%(表2),葡萄球菌属是常见的革兰氏阳性菌,广泛存在于自然界,也是人体皮肤、黏膜的寄殖菌,可引起人和动物局部的化脓性感染,也可引发脓毒血症、心内膜炎、脑膜炎等严重感染[19]。还检测出屠宰场空气中有不动杆菌属(Acinetobacter)、寡养单胞菌属(Stenotrophomonas)和埃希菌属(Escherichia),均具有一定的致病性,属于条件致病菌。其中不动杆菌属细菌平均相对丰度为13%(4.68%~23.41%)(表2),其主要分布于外部潮湿的环境中,营养要求低,易生长,黏附力极强,在临床上发生率大于70%[20],并且院内感染发病率依旧不断升高。寡养单胞菌属相对丰度变化范围为0.62%~12.38%,它是革兰氏阴性菌,是院内感染的重要菌种[21],该菌主要引起肺部呼吸道感染[22],是癌症患者体内重要的病原体,特别是那些有阻塞性肺癌的[23],据研究统计被此菌感染后患有菌血症的病人死亡率为14%~69%[24-25]。大多数埃希菌属是人和动物肠道中的正常菌群,但逐渐也发现自然界中存在一些致病性的埃希菌属,主要由正常菌群条件致病,以泌尿系统感染常见[26],也易引起呼吸道感染[27]。尤其是在屠宰场的脱毛间空气微生物存在以上4 种条件致病菌较多,可能是因为脱毛间空气潮湿,利于病原菌增殖,或者是由于脱毛机扬起的羽毛、灰尘等使得空中微生物增多。
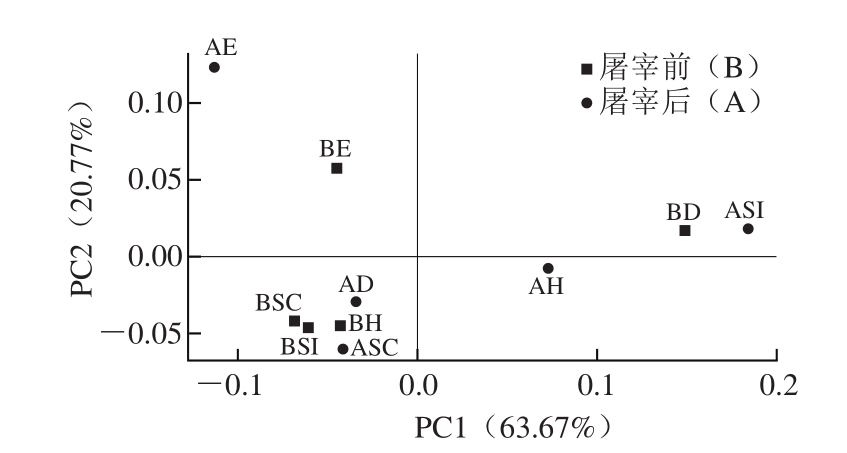
图5 各样品细菌菌落结构的主坐标分析
Fig.5 Principal coordinate analysis (PCoA) of the dissimilarity between airborne bacterial samples
根据各个样品OTU计算样品间的加权UniFrac距离,再对10 个样品进行主坐标分析。如图5所示,可以看出PCo1和PCo2分别解释63.67%和20.77%差异性。各处理样可以分为3 个集合,其中BH、BSI、BSC、ASC和AD聚集在一起,BD、ASI和AH相聚较近,BE和AE属同一屠宰区域(净膛间),空气微生物种类及丰富度相近。
空气中的微生物逐渐成为禽类肉制品的污染源[28],但对家禽屠宰场空气微生物结构研究还鲜有报道,实验发现家禽屠宰场的不同屠宰区域沉降菌数量存在一定的差异,并且屠宰生产后比屠宰前微生物数量有所增加,尤其是在屠宰后挂禽间菌落总数比屠宰前高出71%。采用高通量测序技术分析家禽定点屠宰场不同屠宰区域空气的微生物结构发现,厚壁菌门、变形菌门和放线菌门为空气沉降微生物的优势菌门,葡萄球菌属和不动细菌属为优势菌属,同时也发现存在一定量的葡萄球菌属、寡养单胞菌属和埃希菌属,这些属的细菌均为条件性致病菌。在后续鸡肉的屠宰与加工过程中,鸡肉存在安全隐患,由此说明有关食品安全部门应制定有效的干预措施,对家禽在加工过程中确保微生物安全是很重要的[29-30],本实验对家禽屠宰场空气微生物的检查,为鸡肉微生物污染的溯源和营造一个规范的屠宰环境提供了科学依据。
[1] 章薇, 吴娟, 熊国远. 鸡肉加工过程中微生物控制的探讨[J]. 畜牧与饲料科学, 2010, 31(5): 93-94.
[2] 华绪川, 徐威, 朱丽洁. 公共卫生安全视角下的家禽交易管理[J]. 中国家禽, 2016, 38(17): 1-5.
[3] LI Y, ZHUANG S, MUSTAPHA A. Application of a multiplex PCR for the simultaneous detection of Escherichia coli O157: H7,Salmonella and Shigella in raw and ready-to-eat meat products[J]. Meat Science, 2005, 71(2): 402-406. DOI:10.1016/j.meatsci.2005.04.013.
[4] MATARAGAS M, SKANDAMIS P, NYCHAS G J E, et al. Modeling and predicting spoilage of cooked, cured meat products by multivariate analysis[J]. Meat Science, 2007, 77(3): 348-356. DOI:10.1016/j.meatsci.2007.03.023.
[5] 朱恒文, 方艳红, 王元兰, 等. 肉鸡屠宰加工生产链中沙门氏菌的污染情况调查及ERIC-PCR溯源[J]. 食品科学, 2012, 33(17): 48-53.
[6] 朱国良, 徐景野, 章丹阳, 等. 宁波地区食品中食源性病原菌检测与分析[J]. 中国公共卫生管理, 2014, 30(6): 907-909.
[7] MASCLAUX F G, SAKWINSKA O, CHARRIERE N, et al.Concentration of airborne Staphylococcus aureus (MRSA and MSSA),total bacteria, and endotoxins in pig farms[J]. Annals of Occupational Hygiene, 2013, 57(5): 550-557. DOI:10.1093/annhyq/mes098.
[8] NEHME B, GILBERT Y, LETOURNEAU V, et al. Cultureindependent characterization of archaeal biodiversity in swine confinement building bioaerosols[J]. Applied and Environmental Microbiology, 2009, 75(17): 5445-5450. DOI:10.1128/AEM00726-09.
[9] 李红梅, 白林, 姜冬梅, 等. 基于16S rDNA高通量测序方法检测猪舍空气微生物多样性[J]. 中国畜牧杂志, 2015, 51(3): 81-84.
[10] SEGATA N, BOERNIGEN D, TICKLE T L, et al. Computational meta’omics for microbial community studies[J]. Molecular Systems Biology, 2013, 9(1): 1-15. DOI:10.1038/msb.2013.22.
[11] CAPORASO J G, KUCZYNSKI J, STOMBAUGH J, et al. QIIME allows analysis of high-throughput community sequencing data[J].Nature Methods, 2010, 7(5): 335-336. DOI:10.1038/nmeth.f.303.
[12] BOKULICH N A, SUBRAMANIAN S, FAITH J J, et al. Qualityfi ltering vastly improves diversity estimates from Illumina amplicon sequencing[J]. Nature Methods, 2013, 10(1): 57-59. DOI:10.1038/nmeth.2276.
[13] 吕坚成, 陈立. 畜禽舍空气中灰尘和微生物的危害及防控[J]. 现代农村科技, 2017(1): 45.
[14] 刘秀萍, 唐雨顺, 刘永华, 等. 生猪屠宰加工过程中微生物污染因素及关键控制点分析[J]. 中国兽医杂志, 2014, 50(9): 72-74.
[15] 赵慧, 甄少波, 任发政, 等. 生猪屠宰环节微生物状况调查及建议[J]农产品加工(学刊), 2012(5): 5-6; 13.
[16] KIM S A, PARK S H, LEE S I, et al. Assessment of chicken carcass microbiome responses during processing in the presence of commercial antimicrobials using a next generation sequencing approach[J]. Scientific Reports, 2017, 2(23): 1-14. DOI:10.1038/srep43354.
[17] KRISTIANSEN A, PEDERSEN K H, NIELSEN P H, et al. Bacterial community structure of a full-scale biof i lter treating pig house exhaust air[J]. Systematic & Applied Microbiology, 2011, 34(5): 344-352.DOI:10.1016/j.syapm.2010.11.022.
[18] KOTULA K L, PANDYA Y. Bacterial contamination of broiler chickens before scalding[J]. Journal of Food Protection, 1995, 58(12):1326-1329. DOI:10.4315/0362-028X-58.12.1326.
[19] 李宗良, 赖春颜, 梁敏锋, 等. 葡萄球菌属的临床分布与耐药性分析[J].中华医院感染学杂志, 2015, 25(12): 2684-2686.
[20] ARNOLD H M, SAWYER A M, KOLLEF M H. Use of adjunctive aerosolized antimicrobial therapy in the treatment of Pseudomonas aeruginosa and Acinetobacter baumannii ventilator-associated pneumonia[J]. Respiratory Care, 2012, 57(8): 1226-1233.
[21] DENTON M, KERR K G. Microbiological and clinical aspects of infection associated with Stenotrophomonas maltophilia infection[J].Clinical Microbiology Reviews, 1998, 11(1): 57-80.
[22] WAKINO S, IMAI E, YOSHIOKA K, et al. Clinical importance of Stenotrophomonas maltophilia nosocomial pneumonia due to its high mortality in hemodialysis patients[J]. Therapeutic Apheresis & Dialysis, 2009, 13(3): 193-198. DOI:10.1111/j.1744-9987.2009.00693.
[23] BROOKE J S. Stenotrophomonas maltophilia: an emerging global opportunistic pathogen[J]. Clinical Microbiology Reviews, 2012, 25(1): 2-41.
[24] JANG T N, WANG F D, WANG L S, et al. Xanthomonas maltophilia bacteremia: an analysis of 32 cases[J]. Journal of the Formosan Medical Association, 1992, 91(12): 1170-1176.
[25] VICTOR M A, ARPI M, BRUUN B, et al. Xanthomonas maltophilia bacteremia in immunocompromised hematological patients[J].Scandinavian Journal of Infectious Diseases, 1994, 26(2): 163-170.
[26] 陈之航. 要重视肠道致病性大肠埃希菌的检测[J]. 福州总医院学报,2007(3): 148-150.
[27] 谢朝云, 孙静, 熊芸, 等. 泌尿道与呼吸道感染大肠埃希菌的耐药性分析[J]. 中华医院感染学杂志, 2014, 24(16): 3933-3935.
[28] 李虹敏, 冯宪超, 徐幸莲, 等. 肉鸡屠宰加工及冷藏中的微生物污染来源及菌相分析[J]. 肉类工业, 2008(6): 33-37.
[29] BAUERMEISTER L J, BOWERS J W, TOWNSEND J C, et al.Validating the efficacy of peracetic acid mixture as an antimicrobial in poultry chillers[J]. Journal of Food Protection, 2008, 71(6): 1119-1122. DOI:10.4315/0362-028X-71.6.1119.
[30] SCOTT B R, YANG X, GEORNARAS I, et al. Antimicrobial efficacy of a sulfuric acid and sodium sulfate blend, peroxyacetic acid, and cetylpyridinium chloride against Salmonella on inoculated chicken wings[J]. Journal of Food Protection, 2015, 78(11): 1967-1972.DOI:10.4315/0362-028X.JFP-15-170.
Structure of Airborne Microbial Communities in Different Slaughter Areas of Poultry Slaughterhouse