草莓(Fragaria×ananassa Duch.)属蔷薇科草莓属多年生草本植物,因其色泽鲜艳、口感酸甜深受消费者的喜爱,又因为其含有丰富的营养物质,被称为“水果皇后”。由于草莓是浆果类水果,皮薄多汁,在采收、包装、运输等过程中,极易受到碰伤、挤压、振动等物理性因素的损害,从而造成病原真菌侵染,引起果实腐烂[1-2]。由灰霉菌引起的灰霉病是草莓采后主要真菌性病害,对草莓品质影响极大,缩短了其销售寿命[3]。
随着人们对食品安全和环境保护问题关注程度的增加,寻求安全、高效、环境友好的生物防治方法已成为趋势。目前用于防治果蔬采后病害的生物防治手段主要有植物、微生物及其代谢物。微生物可以产生大量种类丰富、功能多样的挥发性物质,能产生挥发性物质的微生物种类主要有细菌、酵母、放线菌、霉菌等[4-6]。目前,已经有600 种微生物所释放的1 300 种挥发性物质被登记[7]。李其利[8]的研究表明链霉菌JK-1产生的挥发物能够抑制灰霉菌及柑橘青霉菌菌丝生长、孢子萌发及孢子形成等,并通过气相色谱-质谱联用(gas chromatography-mass spectrometer,GC-MS)仪鉴定出41 种挥发性化合物,包括烃类、酯类、醇类、醚类及有机酸等。陈利军等[9]发现产香真菌GS-1产生的挥发物对番茄灰霉病菌、水稻胡麻斑病菌、小麦赤霉病菌、白菜黑斑病菌以及莴苣菌核病菌均有抑制作用,其中对灰霉菌抑制效果最好。Xie Shanshan等[10]通过透射电子显微镜发现芽孢杆菌菌株D13产生的挥发物气体能改变水稻白叶枯病菌菌丝形态及胞内内容物,并从转录水平发现病原菌毒力表达基因下降。黄蓉[11]从发病草莓上分离出7 株酵母,其中间型假丝酵母C410、近玫色锁掷孢酵母YCXT3、汉逊德巴利酵母W4682、出芽短梗霉YW1均能产生挥发物,且对灰葡萄菌的菌丝生长及孢子萌发均有抑制作用,并通过GC-MS分析了C410和YCXT3中的部分抗菌成分如2-壬酮、异己酸乙酯、1,3,5,7-环辛四烯、反式2-己烯基己酸等。周海莲[12]、Qin Xiaojie[13]等的研究表明葡萄汁有孢汉逊酵母的挥发物抑制灰霉菌丝生长,影响病原菌孢子萌发及生长,并通过GC-MS分析出葡萄汁有孢汉逊酵母挥发物的主要抑菌成分有丙酸乙酯、3-羟基己酸乙酯、己酸、肉桂醛等。
目前虽然有很多关于微生物产生具有抑菌作用挥发性物质的报道,但由于挥发性物质成分复杂,防治果蔬采后病害机制仍然未明了;因此研究挥发物单体对病原菌及果蔬的防治作用,能对进一步阐明其作用机理和未来的商业化应用提供基础[14]。本实验通过分析葡萄汁有孢汉逊酵母挥发性代谢物中的21 种单体(相对色谱峰面积大于0.1%)对灰葡萄孢的菌丝生长及孢子萌发等的影响,并从中筛选出4 种单体研究对草莓灰霉病的防治效果,从而进一步揭示葡萄汁有孢汉逊酵母挥发物防治草莓灰霉病的机理。
草莓果实(Fragaria×ananassa Duch),品种为‘红颜’,采摘于南京市锁石生态园。选用八成熟、无病虫害、无机械损伤、无腐烂、大小一致的果实进行实验。
灰葡萄孢霉(Botrytis cinerea)从草莓果实上分离纯化得到,保藏在4 ℃ PDA斜面培养基上。使用前从斜面培养基将病原菌接种到PDA平板上,25 ℃恒温培养7 d活化。
实验所用试剂均为分析纯,购自阿拉丁(上海)试剂有限公司。
102光学显微镜 日本尼康公司;HZQ-F160全温振荡培养箱 太仓市实验设备厂;TGL20M台式高速冷冻离心机 湘仪仪器有限公司;恒温恒湿培养箱 宁波海曙赛富实验仪器厂;XB-K-25血球计数板 国营上海医用光学仪器厂;HVE-50自动蒸汽灭菌锅 日本Hirayama有限公司;HP-2136便携式色差仪 上海谱熙光电科技有限公司;WYT-4型手持糖量仪 绍兴市亿纳仪器制造有限公司;TMS-PRO食品物性分析仪 美国FTC公司;BSA124S-CW电子天平 上海精科仪器厂。
1.3.1 供试菌株菌悬液制备
B. cinerea菌悬液制备:将少量无菌水倒入培养好的灰葡萄孢霉PDA平板上,用接种环轻轻刮下孢子,充分振荡,用4 层无菌纱布过滤。取其滤液,用无菌水配制成1×106spore/mL的孢子悬浮液。
1.3.2 挥发物单体对B. cinerea菌丝生长抑制效果的测定
根据周海莲[12]、Qin Xiaojie[13]等的实验结果,筛选出葡萄汁有孢汉逊酵母产生的21 种挥发物单体物质。将其中的固体单体配制成溶液,取4 g用无水乙醇定容至50 mL,再取100 μL溶液,假定培养皿体积为0.08 L,此时整个培养皿中挥发物气体质量浓度为100 mg/L。将挥发物气体依次梯度稀释成50.0、10.0、5.0、2.5 mg/L。采用平板倒扣法并略作改进:用无菌打孔器取培养了5 d的病原菌菌饼(直径0.8 cm),接于一PDA平板正中央,在培养皿盖上放置已灭菌的直径约为1 cm的滤纸片,用移液枪移取挥发物单体(液体单体:直接取100.0、50.0、10.0、5.0、2.5 μL,对应剂量分别为31.25、62.5、125、625、1 250 μL/L)于滤纸片上,液体单体组以滤纸片不添加挥发物单体为对照、固体单体组以滤纸片添加100 μL无水乙醇为空白对照,迅速扣好皿盖,用封口膜封住培养皿边缘。置于(25±1)℃、相对湿度90%~95%的恒温恒湿条件下倒扣培养3 d后,采用十字交叉法测量处理组和空白对照组菌落直径。每个处理3 个平板。整个实验重复2 次。按照公式(1)计算挥发物单体对B. cinerea菌丝生长的抑制率。
式中:d1为对照组菌丝直径/cm;d2为处理组菌丝直径/cm;d3为菌饼直径(0.8 cm)。
1.3.3 挥发物单体对B. cinerea孢子萌发影响的测定
取0.1 mL孢子悬浮液涂布平板,在培养皿皿盖上放置灭菌过的直径约为1 cm的滤纸片,用移液枪移取挥发物单体(液体单体分别为100.0、50.0、10.0、5.0、2.5 μL;固体单体溶液为100 μL)于滤纸片上,以滤纸片不添加挥发物单体为空白对照(CK),迅速扣好皿盖,用封口膜封住培养皿边缘。置于(25±1)℃、相对湿度90%~95%的恒温恒湿条件下培养,12 h后观察孢子的萌发率。每处理3 个平行,实验重复2 次。
1.3.4 4 种单体对草莓果实灰霉病防治效果的测定
按照1.3.2节和1.3.3节的结果以及剔除文献中已发表过的单体,筛选出4 种单体进行下一步实验。
取15 个小干燥器(直径150 mm),每个干燥器上层放10 颗八成熟草莓,用6 mm×6 mm×6 mm的一次性打孔器在草莓腰部打孔,注入20 μL灰葡萄孢子悬浮液,晾干后待用。对照组(CK组):滤纸片上不添加任何物质;处理组:滤纸片上分别添加3-羟基己酸乙酯、癸酸乙酯、肉桂醛、辛酸乙酯250 μL。将滤纸片置于干燥器底部,干燥器密封,于(25±1)℃、相对湿度90%~95%的恒温恒湿条件下放置5 d后进行外观观察并测定指标。发病率按照式(2)进行计算。
色差采用HP-2136便携式色差仪测定;可溶性固形物(total soluble solids,TSS)质量分数采用WYT-4型手持糖量仪测定;可滴定酸质量分数根据GB/T 12456《食品中总酸的测定》[15]测定;质构特性采用TMS-PRO食品物性分析仪测定,设置参数为:下压速率60 mm/s,形变量40%,高度40 mm,两次压缩中间的停顿时间为5 s,触发力为4.0 N。
所得结果为各处理组平均值,数据分析采用SPSS 20软件的Duncan方差分析,图表绘制采用Orign 2018软件。
21 种挥发物单体中,酯类、醇类、酸类、醛类、酮类和酚类分别为10、5、3、1、1 种和1 种。由表1可以看出,除月桂酸,其余20 种单体均对B.cinerea菌丝生长有抑制作用。其中酯类中,辛酸乙酯的抑制效果最好,完全抑制剂量为125 μL/L;醇类中,苯甲醇抑制效果最好,完全抑制剂量为125 μL/L;酸类中,正己酸的效果最好,完全抑制剂量为625 μL/L。在20 种单体中,2-壬酮和桂皮醛的抑制效果最好,完全抑制菌丝生长剂量为62.5 μL/L,其次是辛酸乙酯、苯甲醇,剂量为125 μL/L,正己醇、丙酸乙酯、正己酸、2-甲基丁酸乙酯、2-苯乙醇完全抑制菌丝生长的剂量为625 μL/L,3-苯丙醇、3-羟基己酸乙酯、3-羟基丁酸乙酯、癸酸乙酯、乙酸乙酯完全抑制菌丝生长的剂量均大于1 250 μL/L,4-乙基苯酚及正癸酸完全抑制菌丝生长的剂量均大于100 mg/L。由表2可知,21 种单体均对B. cinerea孢子萌发有抑制作用,抑制效果与剂量呈正相关。桂皮醛抑制效果最好,在625 μL/L时完全抑制孢子萌发;其次是2-壬酮和正己醇、乙酸异丁酯,在1 250 μL/L时完全抑制孢子萌发,其他挥发物单体均不能完全抑制孢子萌发。
表1 21 种单体对灰葡萄孢霉菌丝生长的影响
Table1 Effects of 21 volatile monomers on mycelium growth of B. cinerea

注:*.该物质为固体;同行肩标小写字母不同表示差异显著(P<0.05)。下同。
抑菌率/%31.25 μL/L或2.5 mg/L挥发物单体种类62.5 μL/L或5 mg/L 125 μL/L或10 mg/L 625 μL/L或50 mg/L 1 250 μL/L或100 mg/L酯类乙酸异丁酯 9.8±1.4a13.5±1.6b27.8±1.7c100.0±0.0d100.0±0.0d辛酸乙酯 58.4±1.2a89.6±0.5b100.0±0.0c100.0±0.0c100.0±0.0c丙酸乙酯 47.1±1.5a72.0±0.9b86.6±1.1c100.0±0.0d100.0±0.0d乙酸异戊酯 9.0±1.3a20.7±1.1b56.5±1.0c100.0±0.0d100.0±0.0d肉桂酸乙酯 3.2±0.3a26.8±2.1b33.3±2.8c46.5±1.8d100.0±0.0e3-羟基己酸乙酯 7.7±0.6a10.9±1.6a37.5±2.0b85.8±1.5c95.0±2.2d2-甲基丁酸乙酯 22.5±2.0a36.7±1.2b89.8±2.4c100.0±0.0d100.0±0.0d3-羟基丁酸乙酯 2.7±0.7a4.6±0.3a14.70±1.1b13.8±1.8b21.7±1.3c癸酸乙酯 8.8±1.1a9.0±1.6a9.8±0.5a21.5±1.4b34.2±1.4c乙酸乙酯 14.7±0.6a23.3±1.3b60.8±0.8c91.8±1.4d98.5±2.1e醇类异戊醇 2.0±0.5a3.8±0.6a23.3±2.0b95.7±3.3c100.0±0.0d正己醇 11.4±1.5a17.4±0.6b72.2±1.6c100.0±0.0d100.0±0.0d苯甲醇 35.7±1.7a66.2±3.2b100.0±0.0c100.0±0.0c100.0±0.0c2-苯乙醇 22.3±1.5a36.2±0.6b93.7±1.8c100.0±0.0d100.0±0.0d3-苯丙醇 24.9±1.6a32.2±1.8b44.4±0.7c67.1±1.1d75.1±2.3e正己酸 44.7±3.0a73.8±1.2b94.0±1.0c100.0±0.0d100.0±0.0d正癸酸* 2.2±0.8a11.8±1.3b14.2±1.2c20.9±1.1d22.8±0.6d月桂酸* -10.0±1.1ab-5.0±3.1b-5.7±0.8b-11.1±2.0b-6.1±3.0ab醛类 桂皮醛 54.7±1.6a100.0±0.0b100.0±0.0b100.0±0.0b100.0±0.0b酮类 2-壬酮 49.4±0.7a100.0±0.0b100.0±0.0b100.0±0.0b100.0±0.0b酚类 4-乙基苯酚* 12.9±1.5a25.4±1.7b47.2±2.2c89.5±2.1d89.2±1.6d酸类
表2 21 种单体对灰葡萄孢霉孢子萌发的影响
Table2 Effects of 21 volatile monomers on conidial germination of B. cinerea

孢子萌发率/%0 μL/L或0 mg/L挥发物单体种类31.25 μL/L或2.5 mg/L 62.5 μL/L或5 mg/L 125 μL/L或10 mg/L 625 μL/L或50 mg/L 1 250 μL/L或100 mg/L酯类乙酸异丁酯 84.5±1.8a80.7±1.2a74.7±1.7b65.7±2.5c0.3±0.5d0.0±0.0d辛酸乙酯 84.5±1.8a71.3±1.2b53.0±2.9c49.7±0.5c39.7±2.1d7.7±1.7e丙酸乙酯 84.5±1.8a77.7±1.2b70.3±2.6c64.3±2.1d4.3±1.2e0.7±0.5f乙酸异戊酯 84.5±1.8a72.0±2.9b65.0±1.4c33.3±4.2d6.7±0.9e1.0±0.8f肉桂酸乙酯 84.7±1.2a67.7±2.5b58.7±2.6c58.7±2.4c47.7±2.1d22.0±2.9e3-羟基己酸乙酯 87.3±2.5a81.3±2.1b76.3±1.7c74.0±0.8c69.0±1.4d54.7±2.1e2-甲基丁酸乙酯 85.7±1.8a79.3±3.7b72.0±1.4c58.0±2.9d2.0±1.4e0.3±0.2e3-羟基丁酸乙酯 85.7±1.8a82.7±1.8ab79.7±2.4bc75.3±2.1cd68.3±2.5e72.7±2.5de癸酸乙酯 85.7±1.8a78.7±3.9b72.7±1.9c72.3±2.5c71.0±2.9c64.3±1.7d乙酸乙酯 84.5±1.8a72.8±2.3b68.8±1.9c67.0±0.8c66.7±1.2c50.0±2.2d醇类异戊醇 85.7±1.8a81.0±2.4b75.3±3.7bc71.0±3.7c8.3±2.1d3.7±0.5d正己醇 84.5±1.8a77.7±1.9b71.0±2.2c53.3±4.5d3.7±1.2e0.0±0.0e苯甲醇 84.7±1.2a78.3±1.7b66.3±1.7c60.0±1.6d54.0±2.9e53.7±2.6e2-苯乙醇 84.5±1.8a77.7±1.2b71.3±1.9c66.3±1.2d63.7±1.2d58.0±2.2e3-苯丙醇 84.7±1.2a80.3±1.2a70.0±2.9b63.7±2.5c52.0±2.4d45.7±2.6e正己酸 84.7±1.2a34±2.9b13.7±0.9c11.3±1.2c6.7±0.5d4.3±0.9d正癸酸* 79.0±2.9a73.3±1.9b72.3±2.1b71.7±1.7b65.7±1.7c58.7±0.7d月桂酸* 79.0±2.9a76.3±1.2ab70.7±2.5bc73.3±2.1c70.7±1.7c65.7±2.1d醛类 桂皮醛 85.7±1.8a12.3±3.9b2.3±0.9c0.7±0.5c0.0±0.0c0.0±0.0c酮类 2-壬酮 85.7±1.8a63.0±2.9b14.0±3.7c1.0±0.8d0.3±0.2d0.0±0.0d酚类 4-乙基苯酚* 79.0±2.9a77.0±1.4ab74.0±2.2ab73.0±2.9c11.0±2.9d4.0±0.8e酸类
2.2.1 外观与发病率

图1 4 种挥发物单体对草莓灰霉病外观的影响
Fig.1 Effects of 4 volatile monomers on strawberry appearance
草莓的外观和发病情况是草莓贮藏效果最直观的反映。由图1可以看出,与刚采摘的草莓相比,CK组草莓有很明显的发病,草莓上长满了菌丝,处理组均无明显发病迹象。图2显示CK组发病率超过70%,3-羟基己酸乙酯、癸酸乙酯、桂皮醛和辛酸乙酯均可以不同程度地防治草莓灰霉病,发病率在20%以下,其中3-羟基己酸乙酯和桂皮醛防治效果最好,发病率为0%。
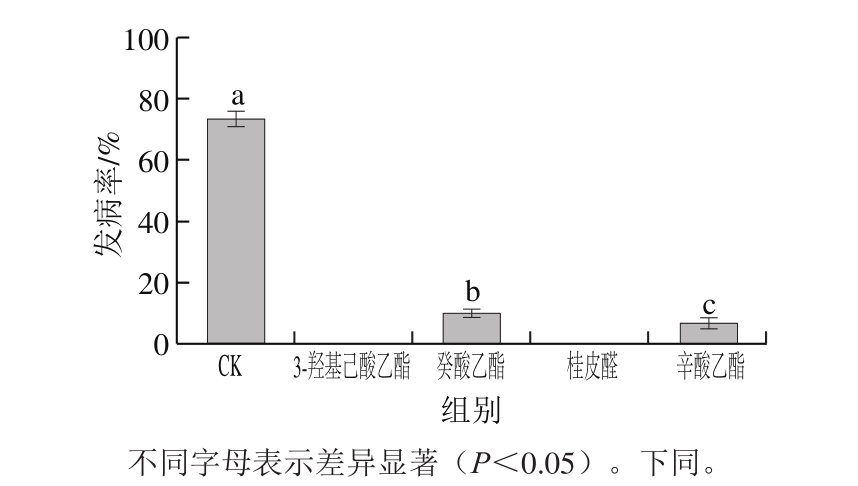
图2 4 种挥发物单体对草莓灰霉病发病率的影响
Fig.2 Effects of 4 volatile monomers on gray mold incidence in strawberry
2.2.2 色差
色差可以判定果实的成熟度和外观。色差Lab中L值表亮度,值越大表明果实亮度越好,a值为正值时表示红度,为负值时表示绿度。由图3A、B可以看出,贮藏期间草莓的L值降低,亮度下降,a值上升,红度上升,说明贮藏后草莓果实光泽度降低而红度增加。除了桂皮醛处理组的草莓a值显著低于CK组外(P<0.05),其他处理组的L值和a值与CK组差异均不显著(P>0.05)。说明桂皮醛能够维持草莓在贮藏期间的色泽。

图3 4 种挥发物单体处理对草莓L值(A)、a值(B)的影响
Fig.3 Effects of 4 volatile monomers on L value (A) and a value (B)of strawberry
2.2.3 TSS质量分数
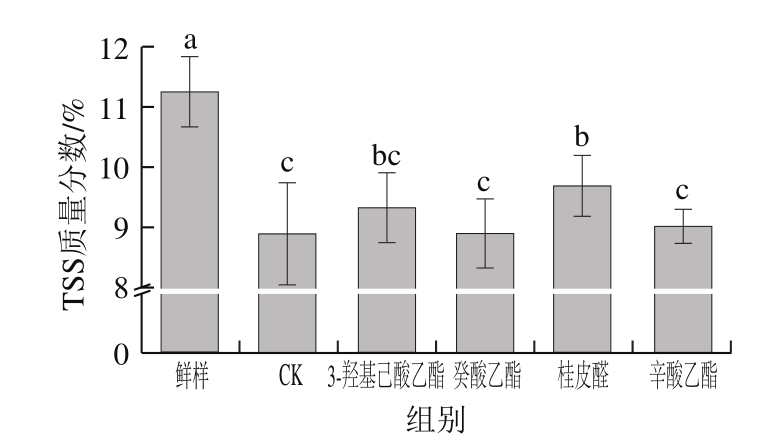
图4 4 种挥发物单体处理对草莓TSS质量分数的影响
Fig.4 Effects of 4 volatile monomers on total soluble solid content of strawberry
果蔬中TSS质量分数能直接反映成熟度和品质,其高低是判断耐贮藏性的重要指标之一。由图4可以看出,草莓在贮藏期间其TSS质量分数下降,其中CK组约下降到8.9%左右,癸酸乙酯和辛酸乙酯处理后的草莓TSS质量分数分别为8.92%和9.03%,与CK组差异不明显,桂皮醛处理后的草莓TSS质量分数变化最小,为9.7%。挥发物单体处理在一定程度上可以延缓草莓在贮藏期间TSS质量分数的下降,其中桂皮醛处理效果最好。
2.2.4 可滴定酸质量分数
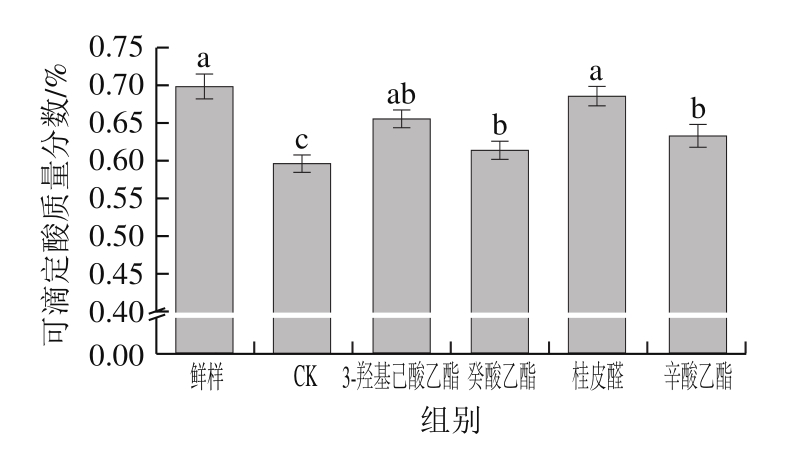
图5 4 种挥发物单体处理对草莓可滴定酸质量分数的影响
Fig.5 Effects of 4 volatile monomers on titratable acid content of strawberry
果实的酸含量是影响草莓风味和贮藏性的重要因素,有机酸是其主要影响因子。草莓中的有机酸主要是柠檬酸和苹果酸,其中柠檬酸约占80%~90%。由图5可以看出,草莓在贮藏期间可滴定酸质量分数下降,挥发物单体处理后草莓的可滴定酸质量分数均高于CK组,其中桂皮醛处理后的草莓可滴定酸质量分数与鲜样没有显著差异(P>0.05),说明桂皮醛处理能够延缓草莓在贮藏期间可滴定酸质量分数的下降。
2.2.5 质构特性
质构特性是评价果蔬品质的重要指标之一,果实的许多感官指标如硬度、脆性、弹性、咀嚼性等都与草莓质构特性有关。硬度在一定程度上反映果实对外力的抵抗性,与其组织结构和成熟程度有关;弹性一般指果实受到外力发生形变后恢复原有形态的能力,一般取决于细胞壁的完整性;胶黏性则用来表明果实的完整性,其值越高,代表果实的品质越完好;咀嚼性可以间接反映果实硬度。


图6 4 种挥发物单体处理对草莓硬度(A)、弹性(B)、胶黏性(C)、咀嚼性(D)的影响
Fig.6 Effect of 4 volatile monomers on hardness (A), springiness (B),gumminess (C) and chewiness (D) of strawberry
从图6A~D可以看出,在贮藏期间,草莓果实的硬度、弹性、胶黏性、咀嚼性均下降,挥发物单体处理后草莓果实的硬度、弹性、胶黏性与CK组相比无显著差异(P>0.05),但变化值小于CK组,咀嚼性则是挥发物单体处理组与CK组有显著差异(P<0.05),但4 个挥发物单体处理组间没有显著差异。相对来说,桂皮醛处理后的草莓果实其硬度、弹性、胶黏性、咀嚼性的变化值均小于其他组,说明桂皮醛能在一定程度上维持草莓在贮藏期间的硬度、弹性、胶黏性和咀嚼性。
利用微生物防治果蔬采后病害已成为研究热点。除了利用自身的抑菌特性,微生物还可以产生大量种类丰富、功能多样的挥发性物质,这些挥发性物质也具有抑菌特性[16]。陈利军等[17]研究表明产香真菌ZY-2的挥发物对草莓灰霉病菌、水稻胡麻斑病菌、小麦赤霉病菌、白菜黑斑病菌和莴苣菌核病菌具有很好的抑制作用,并通过GC-MS分析出其主要的抑菌成分是2-苯乙醇。Zhang Xiaoyun等[18]研究发现萎缩芽孢杆菌CAB-1的挥发物可以延缓灰葡萄孢霉孢子萌发和抑制菌丝生长,并利用GC-MS分析出26 种典型物质,如丙酰胺、邻茴香醛、L-氨基丙醇等,其中邻茴香醛的抑制效果最好。陈奕鹏等[19]发现内生真菌HND5的挥发物也具有抑菌作用,并通过GC-MS分析出14 种单体化合物,其中石竹烯和4-乙烯基-1,2-二甲氧基苯对尖孢镰刀菌、胶胞炭疽菌和多主棒孢菌具良好的抑制作用。Toffano等[20]研究发现酿酒酵母产生的挥发物能抑制柑橘叶点霉病,并且从分析出的7 种物质中发现,3-甲基-1-丁醇、2-甲基-1-丁醇可以抑制柑橘叶点霉菌丝生长和孢子萌发以及附着胞的形成。Gao Haiyan等[21]研究发现枯草芽孢杆菌CF-3的24 h发酵液产生的挥发物可以抑制灰葡萄孢菌和炭疽病菌等,并从这些挥发物中鉴定出77 种成分,其中2,4-二叔丁基苯酚在体外表现出较强的抑制作用。本实验发现,在所研究的21 种挥发物单体中,2-壬酮、桂皮醛等20 种挥发物单体均对灰霉的菌丝生长和孢子萌发有很好的抑制作用,而月桂酸对孢子萌发是抑制作用而对灰葡萄孢菌丝生长表现出促进作用。富饶等[22]研究表明月桂酸可以抑制番茄叶霉菌的菌丝生长,表现出“低抑高促”的现象,最佳浓度为0.01 mmol/L,本实验中月桂酸最小抑制的质量浓度为2.5 mg/L,即0.012 5 mmol/L,所以月桂酸可能表现出促进菌丝生长。对于孢子萌发,月桂酸则表现出抑制作用,具体原因有待进一步研究。
20 种单体对灰葡萄孢菌丝生长和孢子萌发均有抑制作用,其中效果最好的是2-壬酮和桂皮醛。Huang Rong等[23]研究发现Candida intermedia可以产生49 种挥发物物质,其中2-壬酮对灰霉的抑制效果最好,对菌丝生长和孢子萌发的半抑制浓度为10 μL/L。Abarca等[24]研究发现采用含2-壬酮的包装材料在20 ℃下可以抑制灰霉菌丝生长,降低番茄灰霉病的发生,低温可以加强防治效果。吴克刚等[25]通过抑菌圈法研究肉桂醛、百里香酚、香芹酚、丁香酚、茴香脑和柠檬醛对几种常见有害微生物的抑菌敏感性,结果表明肉桂醛对真菌抑菌能力更强,对黄曲霉的抑菌效果最好。孙琦[26]的研究表明肉桂醛具有抑制黄曲霉菌生长和黄曲霉毒素B1代谢的双重效应,当浓度达到0.8 mmol/L时可以完全抑制菌丝生长和产毒能力。3-羟基己酸乙酯、癸酸乙酯、桂皮醛以及辛酸乙酯均可以防治草莓灰霉病,其中防治效果最好的是桂皮醛。桂皮醛又名肉桂醛,主要存在于肉桂、月桂等香料中,具有很好的抑菌作用[27-28]。张娜娜等[29]的研究表明肉桂醛可以抑制灰葡萄孢菌的菌丝生长和孢子萌发,对菌丝生长的半最大效应浓度为95.6 μg/mL,质量浓度为60 μg/mL时对孢子的萌发抑制率为100%;在活体条件下,4 000 μg/mL的肉桂醛可以降低番茄果实质量损失率,维持番茄的贮藏品质,降低番茄灰霉病的发生。段小芳[30]的研究结果表明,肉桂醛对柑橘酸腐菌和指状青霉都具有较好的抑制作用,且随着抑菌剂质量浓度的升高抑菌效果增强,其最小抑菌浓度、最小杀菌浓度均为0.5 mg/mL;在活体条件下,果蜡+肉桂醛的复合处理可以有效降低柑橘果实腐烂率和失水率,保持果实品质,延长货架期。Wang Yuan等[31]研究表明,肉桂醛处理可以显著减少猕猴桃在贮藏期间微生物数量,同时可以保持猕猴桃品质,延缓衰老,增强其抗氧化能力。本实验结果也表明,相对于其他挥发物单体,桂皮醛能显著降低草莓果实贮藏期间的发病率,保持草莓色泽,抑制草莓TSS、可滴定酸质量分数及质构特性的下降,保持草莓贮藏品质。
本实验结果表明葡萄汁有孢汉逊酵母挥发性代谢物中的桂皮醛、2-壬酮等20 种单体均对灰葡萄孢菌丝生长和孢子萌发有不同程度的抑制作用,在活体条件下,桂皮醛处理能更好地维持草莓果实品质,降低发病率。下一步将对桂皮醛等20 种单体的抑菌机理以及其他单体对草莓灰霉病的防治效果进行深入研究,从而为揭示葡萄汁有孢汉逊酵母防治草莓灰霉病提供更多参考。
[1] GIAMPIERI F, TULIPANI S, ALVAREZ-SUAREZ J M, et al.The strawberry: composition, nutritional quality, and impact on human health[J]. Nutrition, 2012, 28(1): 9-19. DOI:10.1016/j.nut.2011.08.009.
[2] GIAMPIERI F, ALVAREZ-SUAREZ J M, BATTINO M. Strawberry and human health: effects beyond antioxidant activity[J]. Journal of Agricultural and Food Chemistry, 2014, 62(18): 3867-3876.DOI:10.1021/jf405455n.
[3] WILLIAMSON B, TUDZYNSKI B, TUDZYNSKI P, et al. Botrytis cinerea: the cause of grey mould disease[J]. Molecular Plant Pathology,2007, 8(5): 561-580. DOI:10.1111/j.1364-3703.2007.00417.x.
[4] SPADARO D, DROBY S. Development of biocontrol products for postharvest diseases of fruit: the importance of elucidating the mechanisms of action of yeast antagonists[J]. Trends in Food Science &Technology, 2016, 47: 39-49. DOI:10.1016/j.tifs.2015.11.003.
[5] SCHMIDT R, CORDOVEZ V, DE BOER W, et al. Volatile affairs in microbial interactions[J]. ISME Journal, 2015, 9(11): 2329-2335.DOI:10.1038/ismej.2015.42.
[6] SCHALCHLI H, TORTELLA G R, RUBILAR O, et al. Fungal volatiles: an environmentally friendly tool to control pathogenic microorganisms in plants[J]. Critical Reviews in Biotechnology, 2016,36(1): 144-152. DOI:10.3109/07388551.2014.946466.
[7] LEMFACK M C, NICKEL J, DUNKEL M, et al. mVOC: a database of microbial volatiles[J]. Nucleic Acids Research, 2013, 42(D1):D744-D748. DOI:10.1093/nar/gkx1016.
[8] 李其利. 链霉菌JK-1的鉴定及其防病潜能和防病机制的研究[D]. 武汉: 华中农业大学, 2011: 109-130.
[9] 陈利军, 郭世保, 田雪亮, 等. 产香真菌GS-1菌株鉴定及其挥发性物质对番茄灰霉病的生防效果[J]. 植物保护学报, 2016, 43(4): 608-613.
[10] XIE Shanshan, ZANG Haoyu, WU Huijun, et al. Antibacterial effects of volatiles produced by Bacillus strain D13 against Xanthomonas oryzae pv. oryzae[J]. Molecular Plant Pathology, 2018, 19(1): 49-58.DOI:10.1111/mpp.12494.
[11] 黄蓉. 防治草莓灰霉病酵母菌株筛选及防病机制研究[D]. 武汉: 华中农业大学, 2011: 68-128.
[12] 周海莲. 葡萄有孢汉逊酵母(Hanseniaspora uvarum)对灰霉病抑制机理的探讨[D]. 南京: 南京农业大学, 2012: 22-53.
[13] QIN Xiaojie, XIAO Hongmei, CHENG Xu, et al. Hanseniaspora uvarum prolongs shelf life of strawberry via volatile production[J].Food Microbiology, 2017, 63: 205-212. DOI:10.1016/j.fm.2016.11.005.
[14] PIECHULLA B, LEMFACK M C, KAI M. Effects of discrete bioactive microbial volatiles on plants and fungi[J]. Plant, Cell &Environment, 2017, 40(10): 2042-2067. DOI:10.1111/pce.13011.
[15] 国家质量监督检验检疫总局, 中国国家标准化管理委员会国家技术监督局. GB/T 12456—2008: 食品中总酸的测定[S]. 北京: 中国标准出版社, 2008: 1-4.
[16] KANCHISWAMY C N, MALONY M, MAFFEI M E. Chemical diversity of microbial volatiles and their potential for plant growth and productivity[J]. Frontiers in Plant Science, 2015, 6: 1-24.DOI:10.3389/fpls.2015.00151.
[17] 陈利军, 王国君, 田雪亮, 等. 产香真菌ZY-2菌株鉴定及其挥发性物质抑菌活性测定与组分分析[J]. 南方农业学报, 2013, 44(11): 1818-1822.
[18] ZHANG Xiaoyun, LI Baoqing, WANG Ye, et al. Lipopeptides, a novel protein, and volatile compounds contribute to the antifungal activity of the biocontrol agent Bacillus atrophaeus CAB-1[J].Applied Microbiology and Biotechnology, 2013, 97(21): 9525-9534.DOI:10.1007/s00253-013-5198-x.
[19] 陈奕鹏, 杨扬, 时涛, 等. 内生真菌HND5挥发性物质组分分析及其抑菌作用测定[J]. 热带作物学报, 2017, 38(4): 689-694.
[20] TOFFANO L, FIALHO M B, PASCHOLATI S F. Potential of fumigation of orange fruits with volatile organic compounds produced by Saccharomyces cerevisiae to control citrus black spot disease at postharvest[J]. Biological Control, 2017, 108: 77-82. DOI:10.1016/j.biocontrol.2017.02.009.
[21] GAO Haiyan, LI Peizhong, XU Xinxing, et al. Research on volatile organic compounds from Bacillus subtilis CF-3: biocontrol effects on fruit fungal pathogens and dynamic changes during fermentation[J].Frontiers in Microbiology, 2018, 9: 1-15. DOI:10.3389/fmicb.2018.00456.
[22] 富饶, 陈志霞, 周宝利, 等. 月桂酸对番茄叶霉病及番茄抗性生理指标的影响[J]. 沈阳农业大学学报, 2013, 44(4): 418-422.
[23] HUANG Rong, LI Guoqing, ZHANG Jing, et al. Control of postharvest Botrytis fruit rot of strawberry by volatile organic compounds of Candida intermedia[J]. Phytopathology, 2011, 101(7):859-869. DOI:10.1094/PHYTO-09-10-0255.
[24] ABARCA R L, RODRÍGUEZ F J, GUARDA A, et al. Application of β-cyclodextrin/2-nonanone inclusion complex as active agent to design of antimicrobial packaging films for control of Botrytis cinerea[J]. Food and Bioprocess Technology, 2017, 10(9): 1585-1594.DOI:10.1007/s11947-017-1926-z.
[25] 吴克刚, 马海杰, 魏浩, 等. 肉桂醛及其复配单离香料对食品有害微生物的抑制作用研究[J]. 现代食品科技, 2017, 33(7): 72-78; 179.
[26] 孙琦. 肉桂醛对黄曲霉菌生长和产毒的影响机制研究[D]. 北京: 中国农业科学院, 2016: 32-76.
[27] VASCONCELOS N G, CRODA J, SIMIONATTO S. Antibacterial mechanisms of cinnamon and its constituents: a review[J].Microbial Pathogenesis, 2018, 120: 198-203. DOI:10.1016/j.micpath.2018.04.036.
[28] SHREAZ S, WANI W A, BEHBEHANI J M, et al. Cinnamaldehyde and its derivatives, a novel class of antifungal agents[J]. Fitoterapia,2016, 112: 116-131. DOI:10.1016/j.fitote.2016.05.016.
[29] 张娜娜, 张辉, 马丽, 等. 肉桂醛对番茄采后灰霉病的抑制作用及其对品质的影响[J]. 食品科学, 2014, 35(14): 251-255.
[30] 段小芳. 肉桂醛和脱氢乙酸钠对柑橘采后酸腐病和绿霉病的防治[D].长沙: 湘潭大学, 2016: 5-46.
[31] WANG Yuan, SHAN Tingting, YUAN Yahong, et al. Overall quality properties of kiwifruit treated by cinnamaldehyde and citral microbial,antioxidant capacity during cold storage[J]. Journal of Food Science,2016, 81(12): 3043-3051. DOI:10.1111/1750-3841.13536.
Effect of Volatile Monomers from Hanseniaspora uvarum on Controlling Postharvest Gray Mold of Strawberry