
图1 大菱鲆的部位划分
Fig.1 Four parts of Scophthalmus maximus
大菱鲆属硬骨鱼纲,鲽形目,鲆科,菱属。大菱鲆是底栖型海洋鱼类,原产于东北大西洋至北极圈范围内的欧洲海域,是欧洲海域养殖良种。1992年,中国水产科学研究院黄海水产研究所将其引入我国,主要养殖区域集中于山东、辽宁、河北等沿海地区。在我国,大菱鲆又被称为“多宝鱼”,是目前非常畅销的一种低温经济鱼类[1]。大菱鲆是高蛋白、低脂肪[2-3]、富含维生素和矿物质的海鱼,且氨基酸的种类齐全、含量丰富,能够满足人体对必需氨基酸的需要。
我国大菱鲆仍以鲜销为主,相对于鲜销的产量和产值,加工的品种相对单一,主要集中于冷冻食品。市场上现有大菱鲆加工品多为冷冻整鱼或经“三去”之后制成的单冻鱼片。虽然冷冻运输环节的温度控制较为严格,但由于销售或管理的不完善,冷链存在较大的温度波动和反复冻融问题[4]。冷藏或冻藏是保存鱼类的重要方法,但是鱼的冻藏或冻融会引起鱼肉质量的降低,主要是其肌原纤维蛋白变性导致了一系列的变化,例如汁液流失、保水性下降、脂肪氧化、风味物质和蛋白质损伤等[5]。李婷婷等[6]研究大菱鲆微冻贮藏过程中的品质变化规律,发现大菱鲆在-2 ℃贮藏时其货架期可达到20 d,随着微冻贮藏时间的延长,菌落总数逐渐增加,大菱鲆肉质失去弹性和致密性,出现松软和口感变差的现象。众多研究表明,水产品不同部位间营养成分和质构特性存在差异。肖桂华等[7]研究发现鲍鱼腹足胶原蛋白含量相对较高,其硬度也高于其他部位。林婉玲等[8]研究发现罗非鱼尾部水分含量最高,背部蛋白质含量和氨基酸评分较高,腹部的脂肪含量、硬度、咀嚼性、弹性高于其他部位。姜启兴等[9]研究发现鳙鱼背部肌肉中水分和蛋白质含量高于腹部,腹部肌肉脂肪含量高于背部,两部位氨基酸组成没有差异。王垚等[10]研究发现大菱鲆上背部水分含量最高,组织结构紧密,剪切力高于其他部位;下腹部水分含量最低,蛋白质含量最高;腹部肌肉肌束间隙较大,失水率和质量损失率高于背部。目前,大菱鲆的研究大多集中在饲料[11-12]、养殖[13-17]、疾病等方面,仅有少数学者研究其贮藏特性[6],且国内的有关冷藏和冷冻的研究主要集中在冷藏和冷冻对鸡[18-19]、鱼[5]、虾[20]、蟹[21]等的影响;而冻融对大菱鲆质地及理化性质的影响鲜见报道。本实验的目的是研究反复冻融对大菱鲆不同部位肌肉品质的影响,为大菱鲆贮藏及精加工提供参考。
大菱鲆(Scophthalmus maximus)购于山东东方海洋集团有限公司,平均体质量(1.0±0.1)kg。
TU-1810SP紫外-可见分光光度计 北京普析通用仪器有限公司;TGL-16M台式高速冷冻离心机 长沙湘仪仪器有限公司; CT3质构仪 美国Brookfield公司;pH计梅特勒-托利多仪器(上海)有限公司;HH-4数显恒温水浴锅 金坛市科析仪器有限公司;KQ-600B型超声波清洗器 昆山市超声仪器有限公司;XHF-DY高速分散器 宁波新芝生物科技股份有限公司;PQ001-20-025V低场核磁共振(low-f i eld nuclear magnetic resonance,LF-NMR)仪 上海纽迈电子科技有限公司。
1.3.1 原料处理
活大菱鲆用手术刀直插心脏致死,去血、内脏和鱼皮。将去皮后大菱鲆分为上背、下背、上腹和下腹4 部分,分别用自封袋包装放置于4 ℃至尸僵。然后放入-18 ℃冷库中冷冻,7 d后取出,在4 ℃冰箱中冷藏解冻24 h,完成1 次冻融循环过程,依次完成2、3、5 次冻融循环后备用。大菱鲆不同部位划分见图1。

图1 大菱鲆的部位划分
Fig.1 Four parts of Scophthalmus maximus
1.3.2 pH值的测定
称取约10.0 g绞碎肉样于均质袋中,加100 mL蒸馏水,置于高速分散器中60 s后单层滤纸过滤取滤液备用。将校准后的pH计电极浸没在肉浸液中,记录样液25 ℃时的读数。每检测点平行测定3 次。
1.3.3 解冻质量损失率的测定
解冻质量损失率的计算见式(1)。
1.3.4 蒸制质量损失率的测定
精确称量新鲜和解冻后的鱼肉试样,然后放入沸水中蒸制12 min,室温下冷却,称质量,蒸制质量损失率的计算见式(2)。
1.3.5 粗蛋白损失量的测定
分别收集冻融后的汁液和蒸制后的汁液进行离心(7 000 r/min、20 min),采用双缩脲法测定上清液中粗蛋白质含量,并分别计算每100 g大菱鲆肌肉冻融和蒸制后粗蛋白的损失量,具体计算见公式(3)。
1.3.6 粗多糖损失量的测定
分别收集冻融后的汁液和蒸制后的汁液进行离心(7 000 r/min、20 min),采用苯酚-硫酸法测定上清液中粗多糖含量,并分别计算每100 g大菱鲆肌肉冻融和蒸制后粗多糖的损失量,具体计算公见式(4)
1.3.7 质构特性的测定
1.3.7.1 TPA的测定
新鲜肉样和所有解冻后的肉样切成1.5 cm×1.5 cm×1.0 cm的肉块,沸水中蒸制12 min,室温下冷却后置于平台上,用CT3质构仪圆柱形探头进行测定,测试前速率2 mm/s,测试后速率1 mm/s,测试速率1 mm/s,试样压缩形变量50%,触发值5 g。所有试样测定6 次。
1.3.7.2 剪切力的测定
新鲜肉样和所有解冻后的肉样切成1.5 cm×1.5 cm×1.0 cm的肉块,然后将待测样置于测定平台上,用CT3质构仪W型刀进行剪切力的测定。测试速率10 mm/s,进刀距离为25 cm。所有试样测定6 次。
1.3.8 LF-NMR分析
LF-NMR弛豫测量在LF-NMR仪上进行。测试条件为:质子共振频率为18 MHz,测试温度(25±3)℃。准确称取3.0 g样品放入直径15 mm的核磁管,而后放入分析仪中。自旋-自旋弛豫时间T2用GPMG序列进行测量。所使用的参数为:90°脉冲时间为5.8 μs,180°脉冲时间为11.4 μs,谱宽为100 kHz,采样点为7 498 2,重复时间为2 500 ms,模拟增益为20,数字增益为3,回波间隔时间为0.3 ms,回波取点为2 500。使用迭代寻优的方法将采集到的T2衰减曲线代入弛豫模型![]() 中拟合并反演可以得到样品的T2弛豫信息。
中拟合并反演可以得到样品的T2弛豫信息。
实验数据用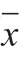 ±s表示,采用SPSS 17.0软件进行标准差和差异显著性分析处理,不同数据间的差异显著性基于单因素方差分析中的最小显著差数法进行判断,利用Excel 2007软件作图。
±s表示,采用SPSS 17.0软件进行标准差和差异显著性分析处理,不同数据间的差异显著性基于单因素方差分析中的最小显著差数法进行判断,利用Excel 2007软件作图。
由图2可以看出,新鲜大菱鲆不同部位的pH值不同,背部pH值显著高于腹部(P<0.05)。在冻融循环过程中,大菱鲆不同部位pH值呈现先上升后下降趋势,第1次冻融循环后pH值最高,这与郭园园等[5]的结果一致。分析原因可能是在冻融过程中,含氮化合物的分解产生挥发性碱性含氮物质使pH值上升。冻融循环1 次后,大菱鲆不同部位pH值显著高于鲜样。之后随着冻融循环次数的增加,大菱鲆不同部位肌肉pH值逐渐下降,一方面是在解冻过程中,水溶性蛋白质的析出与微生物代谢产物的变化对肉品pH值产生影响[22];另一方面是在无氧条件下,肌糖原分解产生的乳酸或者是三磷酸腺苷分解产生的代谢产物等,也会导致pH值的降低;另外,冻融循环次数对肌肉离子成分的影响也会导致pH值的变化[23]。在相同的冻融循环次数下,下背部的pH值显著高于其他部位(P<0.05)。

图2 冻融循环次数对大菱鲆肌肉pH值的影响
Fig.2 Effect of freeze-thawing cycles on pH of Scophthalmus maximus muscle
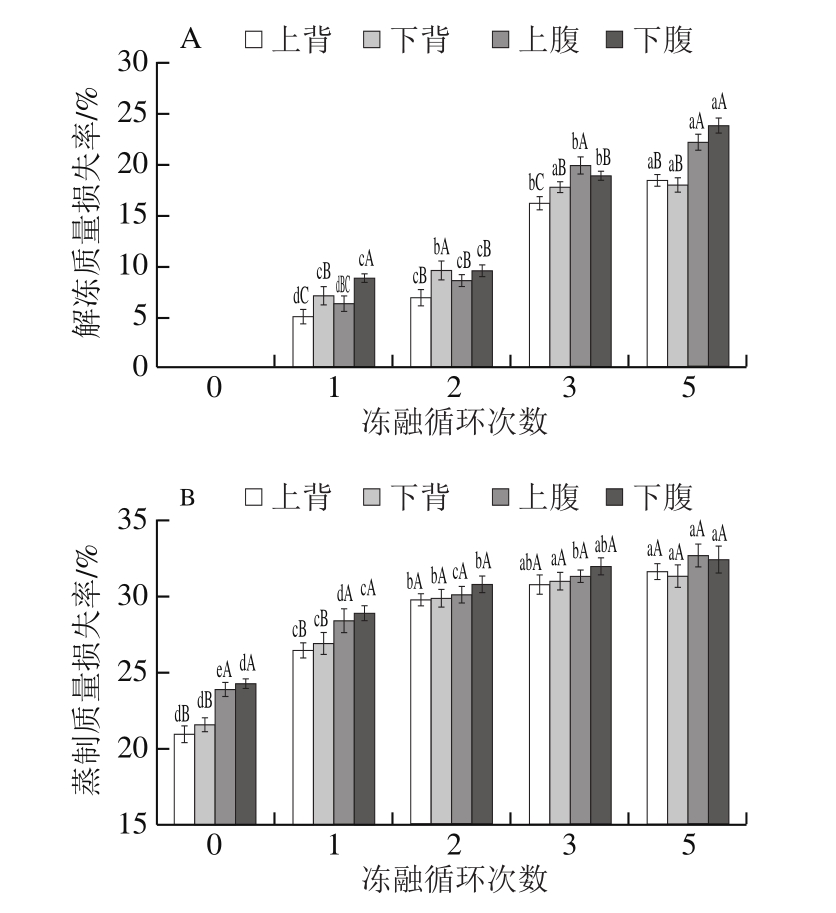
图3 冻融循环次数对大菱鲆肌肉解冻质量损失率(A)和蒸制质量损失率(B)的影响
Fig.3 Effect of freeze-thawing cycles on thawing (A) and cooking (B)loss of Scophthalmus maximus muscle
肉的保水性对肉的品质有很大影响,是肉质评定时的重要指标之一,保水性的高低可直接影响肉的风味、颜色、质地、嫩度和凝结性等[24]。解冻损失和蒸制损失可以作为评价肌肉保水性能强弱的指标。由图3A可以看出,随着冻融循环次数的增加,大菱鲆不同部位肌肉的解冻质量损失率增加,水分含量降低;这表明大菱鲆肌肉的保水性下降,这是由于冻融循环过程中温度的波动易造成重结晶现象,重结晶能严重破坏肌肉细胞结构,增大汁液损失。与冻融循环1 次相比,冻融循环2 次时大菱鲆不同部位肌肉的解冻质量损失率变化较小,而后随着循环次数的增加,解冻质量损失率增加显著(P<0.05);这是由于在初期的解冻过程中,由于肌纤维结构还能维持完整,能吸收一部分解冻后的水分,随着冻融循环次数的增加,这种破坏作用加剧,表现为肌纤维不能再吸收这部分水分,导致了解冻质量损失的不断增加[5]。从图3A还可看出,在相同的循环次数下,大菱鲆不同部位肌肉的解冻质量损失率不同,背部肌肉的解冻质量损失率低于腹部肌肉,这可能与背部肌肉的肌原纤维蛋白结构以及结缔组织中胶原蛋白的含量有关[25]。
从图3B可以看出,新鲜大菱鲆蒸制质量损失较小,随着冻融循环次数的增加,大菱鲆不同部位肌肉的蒸制质量损失率逐渐增加。在前2 次冻融过程中,同一冻融循环次数下大菱鲆背部的蒸制损失率显著低于腹部肌肉,而后随着冻融循环次数的增加,背部和腹部的蒸制质量损失率没有显著差异(P>0.05)。经过5 次冻融循环后,上背、下背、上腹、下腹的蒸制质量损失率分别由冻融0 次时20.95%、21.53%、23.88%、24.24%增加到31.60%、31.32%、32.66%、32.42%,这是由于在解冻过程中,肌肉蛋白结构发生改变,破坏了肌肉组织细胞,在蒸制过程中更易发生聚合,降低肌肉持水力,导致蒸制质量损失率上升[26]。
由图4A、B可以看出,冻融过程中大菱鲆不同部位的粗蛋白和粗多糖损失量不同,随着冻融循环次数的增加,不同部位的粗蛋白和粗多糖损失量都逐渐增加。冻融循环1 次时,上背部的粗蛋白和粗多糖损失量最小,下腹部损失量最大。经过1 次冻融循环,下腹部的粗蛋白损失最大,之后在同一冻融循环次数下,上背部粗蛋白损失最大,下背部最小。由图5A、B可以看出,蒸制后的粗蛋白和粗多糖的损失量随着冻融循环次数的增加而增加。下背部的粗蛋白损失量最大,下腹部的最小(冻融循环超过1 次),而上背部的粗多糖损失最小。在同一冻融循环次数下,解冻粗蛋白损失量明显大于蒸制损失量。
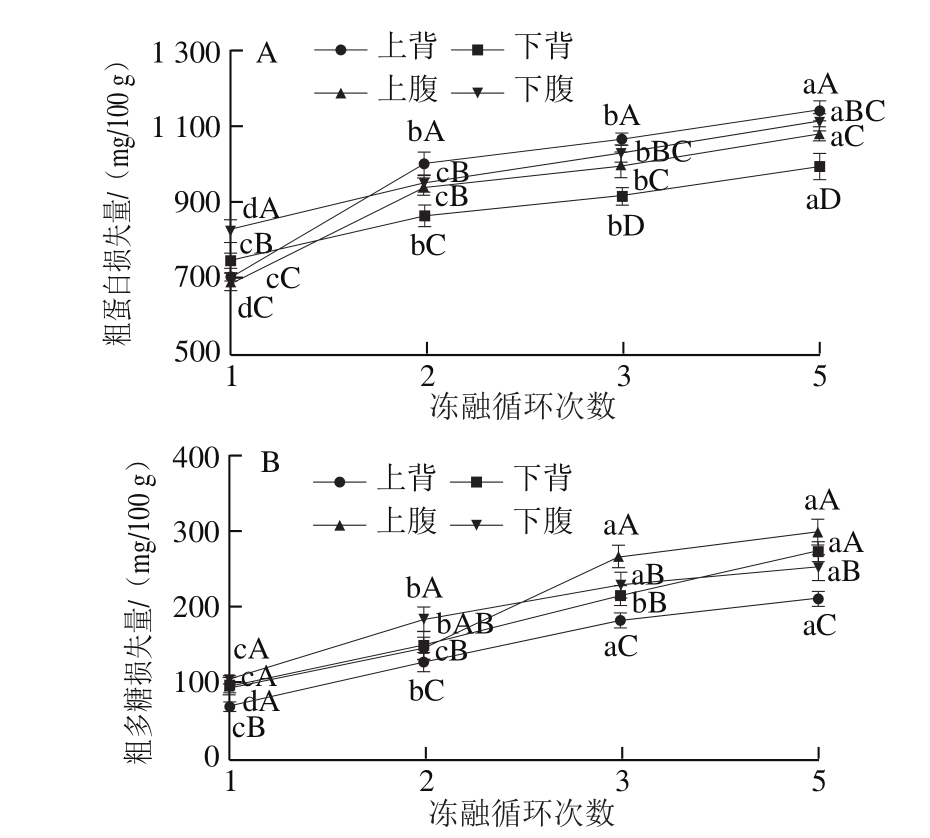
图4 冻融循环次数对大菱鲆解冻后粗蛋白(A)和粗多糖(B)损失量的影响
Fig.4 Effect of freeze-thawing cycles on crude protein (A) and polysaccharide (B) loss during thawing of Scophthalmus maximus muscle
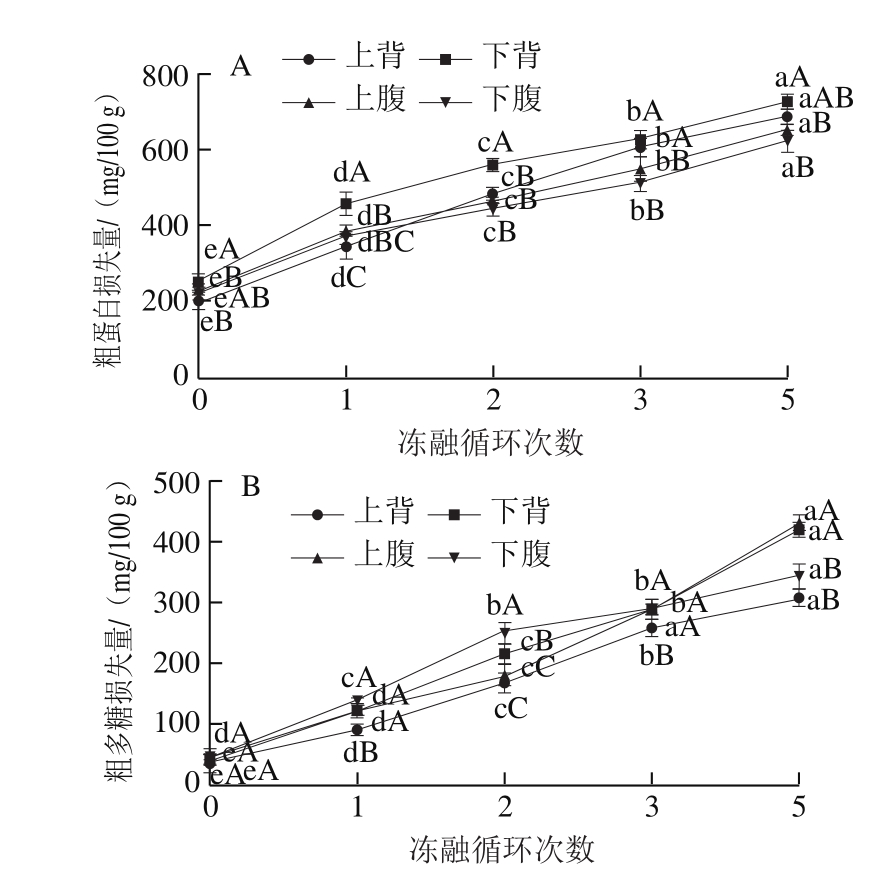
图5 冻融循环次数对大菱鲆蒸制后粗蛋白质(A)和粗多糖(B)损失量的影响
Fig.5 Effect of freeze-thawing cycles on crude protein (A) and polysaccharide (B) loss during cooking of Scophthalmus maximus muscle
2.4.1 TPA特性
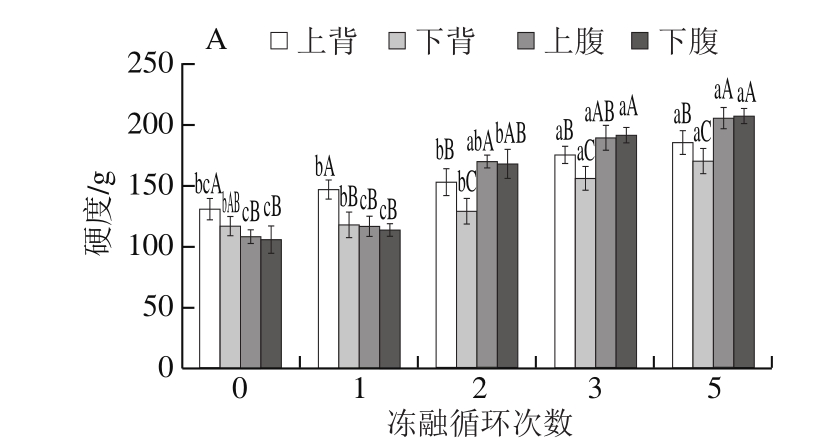
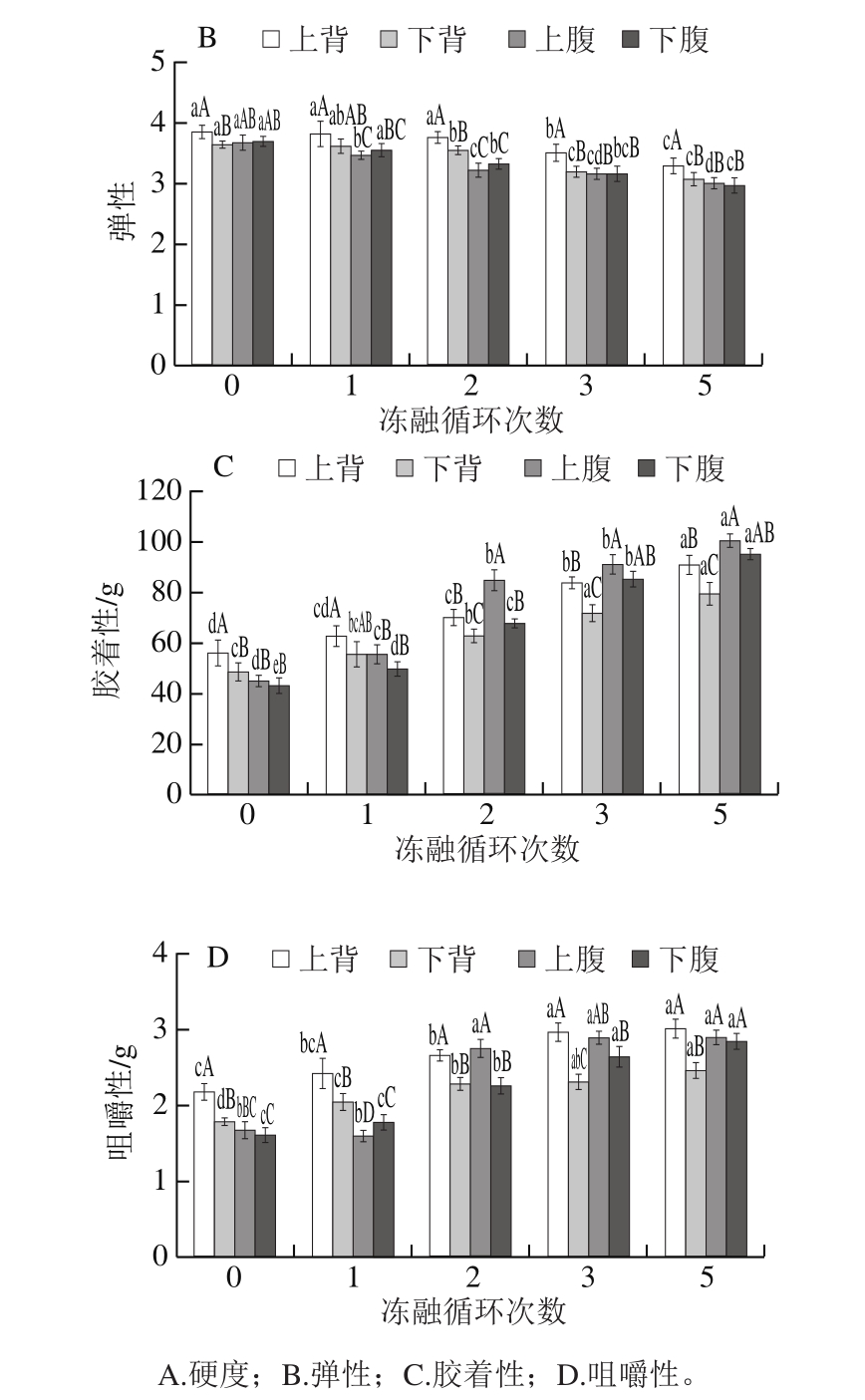
图6 冻融循环次数对大菱鲆蒸制后质构特性的影响
Fig.6 Effect of freeze-thawing cycles on texture properties of Scophthalmus maximus muscle
由图6A~D可以看出,新鲜大菱鲆肌肉的硬度、胶着性和咀嚼性小,弹性好,而上背的硬度、胶着性和咀嚼性显著大于下背和腹部。在硬度方面(图6A),经过冻融循环后,大菱鲆不同部位肌肉硬度有所增加,且随着冻融循环次数的增加,硬度逐渐增加,分析原因是由于熟化后大菱鲆肌肉的硬度可能与水分含量有着密切的关系,水分含量越低则硬度越大[27],经过冻融循环后,大菱鲆不同部位肌肉水分大量流失,造成肌肉的硬度增加。冻融循环1 次后,大菱鲆不同部位肌肉的硬度顺序为:上背>下背>上腹>下腹,且下背、上腹和下腹肌肉硬度没有显著差异。经过2 次冻融循环后,上腹和下腹肌肉的硬度显著增加,结合解冻损失和蒸煮损失分析是由于冻融循环后期,大菱鲆上腹和下腹肌肉的解冻损失和蒸制损失显著增加,导致上腹和下腹的水分含量减少,硬度增加。在同一冻融循环次数下,上腹和下腹的硬度没有显著差异,而上背和下背的硬度有显著差异(P<0.05)。在冻融过程中,腹部硬度增加的幅度显著大于背部。在弹性方面(图6B),随着冻融循环次数的增加,弹性逐渐下降。在同一冻融循环次数下,上腹和下腹的弹性没有显著差异(P>0.05)。在胶着性和咀嚼性方面(图6C、D),随着冻融循环次数的增加,胶着性和咀嚼性逐渐增加,即将肌肉破裂和咀嚼成吞咽时的稳定状态所需要的能量增加,不易咀嚼。在冻融过程中,腹部胶着性和咀嚼性增加的幅度显著大于背部,各部位肌肉的胶着性和咀嚼性与硬度有相同的趋势。
2.4.2 剪切力肌肉剪切力是评价肉类嫩度高低的指标,它所反映的是肌肉中结缔组织的含量与性质及肌原纤维蛋白的化学结构状态[28]。由表1可知,大菱鲆不同部位肌肉剪切力不同,背部大于腹部,且整体上背部最大,下腹部最小,这是由于不同部位肌肉中所含成分不同(特别是胶原蛋白),表现出不同的剪切力[29]。在本实验条件下,随着冻融循环次数的增加,大菱鲆不同部位剪切力显著下降,这与Shanks[30]、Smith[31]、郭园园[5]等的研究结果一致;主要原因是冰晶的再形成和再溶解破坏了细胞膜、细胞器以及肌肉组织结构。随着冻融循环次数的增加,肌纤维断裂越显著,结缔组织膜破坏越严重,剪切力就越小。
表1 冻融循环次数对大菱鲆不同部位肌肉剪切力的影响
Table1 Effect of freeze-thawing cycles on shear force of Scophthalmus maximus muscle

注:同列肩标大写字母不同表示差异显著(P<0.05);同行肩标小写字母不同表示差异显著(P<0.05)。
部位 冻融循环次数0 1 2 3 5上背 268.7±5.8aA200.5±7.9bA165.6±15.6cA129.5±7.4dA100.8±10.5eA下背 250.6±10.4aBC196.7±13.6bA168.5±8.4cA120.1±9.7dA101.5±5.8eA上腹 244.8±9.5aC193.8±9.1bA155.3±10.9cA119.0±8.2dA97.6±4.4eA下腹 202.0±10.9aD159.7±14.0bB119.7±6.9cB89.0±6.1dB70.0±6.8eB
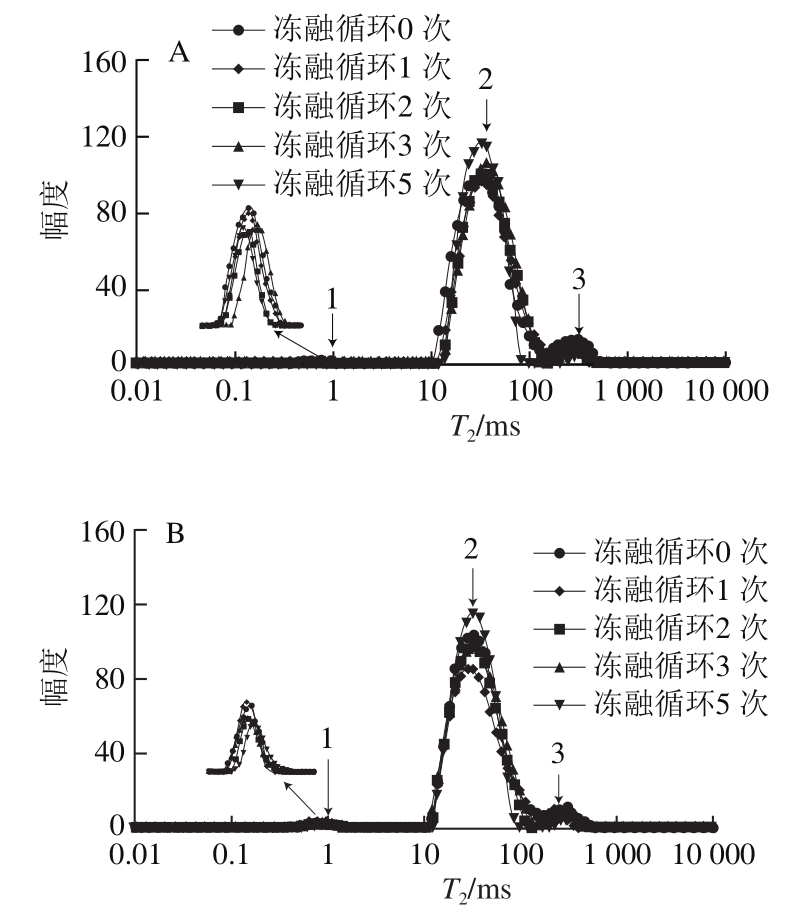
表2 不同冻融循环次数大菱鲆弛豫时间T2变化
Table2 Changes in relaxation time T2of Scophthalmus maximusafter different freeze-thaw cycles
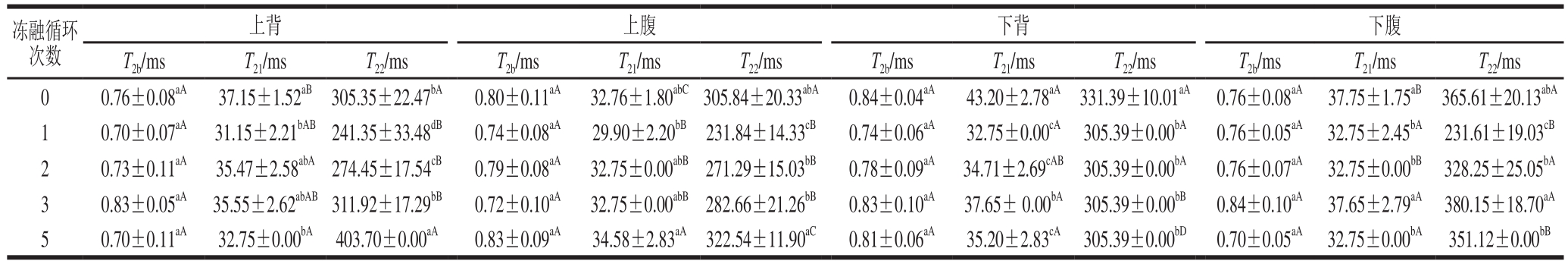
注:同列肩标小写字母不同表示差异显著(P<0.05);对于不同部位的同一指标,同行肩标大写字母不同表示差异显著(P<0.05)。下同。
上背 上腹 下背 下腹T2b/ms T21/ms T22/ms T2b/ms T21/ms T22/ms T2b/ms T21/ms T22/ms T2b/ms T21/ms T22/ms 0 0.76±0.08aA37.15±1.52aB305.35±22.47bA0.80±0.11aA32.76±1.80abC305.84±20.33abA0.84±0.04aA43.20±2.78aA331.39±10.01aA0.76±0.08aA37.75±1.75aB365.61±20.13abA1 0.70±0.07aA31.15±2.21bAB241.35±33.48dB0.74±0.08aA29.90±2.20bB231.84±14.33cB0.74±0.06aA32.75±0.00cA305.39±0.00bA0.76±0.05aA32.75±2.45bA231.61±19.03cB2 0.73±0.11aA35.47±2.58abA274.45±17.54cB0.79±0.08aA32.75±0.00abB271.29±15.03bB0.78±0.09aA34.71±2.69cAB305.39±0.00bA0.76±0.07aA32.75±0.00bB328.25±25.05bA3 0.83±0.05aA35.55±2.62abAB311.92±17.29bB0.72±0.10aA32.75±0.00abB282.66±21.26bB0.83±0.10aA37.65± 0.00bA305.39±0.00bB0.84±0.10aA37.65±2.79aA380.15±18.70aA5 0.70±0.11aA32.75±0.00bA403.70±0.00aA0.83±0.09aA34.58±2.83aA322.54±11.90aC0.81±0.06aA35.20±2.83cA305.39±0.00bD0.70±0.05aA32.75±0.00bA351.12±0.00bB冻融循环次数
表3 不同冻融循环次数大菱鲆肌肉组织弛豫T2峰面积变化
Table3 Changes in T2peak area of water from Scophthalmus maximusafter different freeze-thaw cycles

冻融循环次数下腹A总A2bA21A22A总A2bA21A22A总A2bA21A22A总A2bA21A220 1 061.54±4.52aC14.75±0.32aB1 000.19±8.22aB45.43±1.32aA1 070.03±5.12aC14.56±0.58aB1 009.95±12.1aB45.52±1.32aA1 086.09±3.42aB17.14±0.74aA1 021.89±9.20abB48.06±1.03aA1 104.33±5.93aA15.23±0.75aB1 041.37±4.23aA47.73±1.16aA1 1 042.98±5.87bC14.39±0.47aB980.82±7.32bC42.55±0.78bB1 044.23±3.68bC14.21±0.65aB990.01±20.3aC40.01±1.17bC1 072.00±2.98bB16.85±0.57aA1 008.68±1.89bB46.47±1.43aA1 085.76±5.16bA15.42±0.94aAB1 026.69±3.58bA43.65±1.38bAB2 1 037.28±3.86bB14.31±0.68aB985.42±5.24abB35.68±0.91cC1 037.97±4.32bcB14.00±0.32aB989.91±13.6aB34.06±0.94cC1 068.75±4.12bA16.56±0.78aA1 011.70±4.35abA40.49±1.23bA1 075.07±5.70bcA14.83±0.39aB1 022.40±7.82bcA37.84±0.00cB3 1 030.60±2.15cD14.50±0.58aB990.00±9.45aC26.10±1.32dB1 036.84±2.64cC14.70±0.431aB995.42±15.3aC26.72±1.00dA1 059.50±6.10cB16.18±0.90aA1 010.99±3.48abB32.37±0.90cA1 071.73±4.18cA15.47±0.10aA1 025.11±6.12bcA31.15±0.00dA5 1 029.41±3.43cC14.49±0.31aA995.11±8.42aA19.36±0.98eC1 035.43±5.43cB14.80±0.56aA1 000.75±8.56aA19.88±0.75eB1 050.94±3.78cA15.74±0.95aA1 011.39±5.16aA23.81±1.09dB1 059.51±6.32dA14.67±0.86aA1 014.97±7.54cA29.87±1.05eA上背 上腹 下背
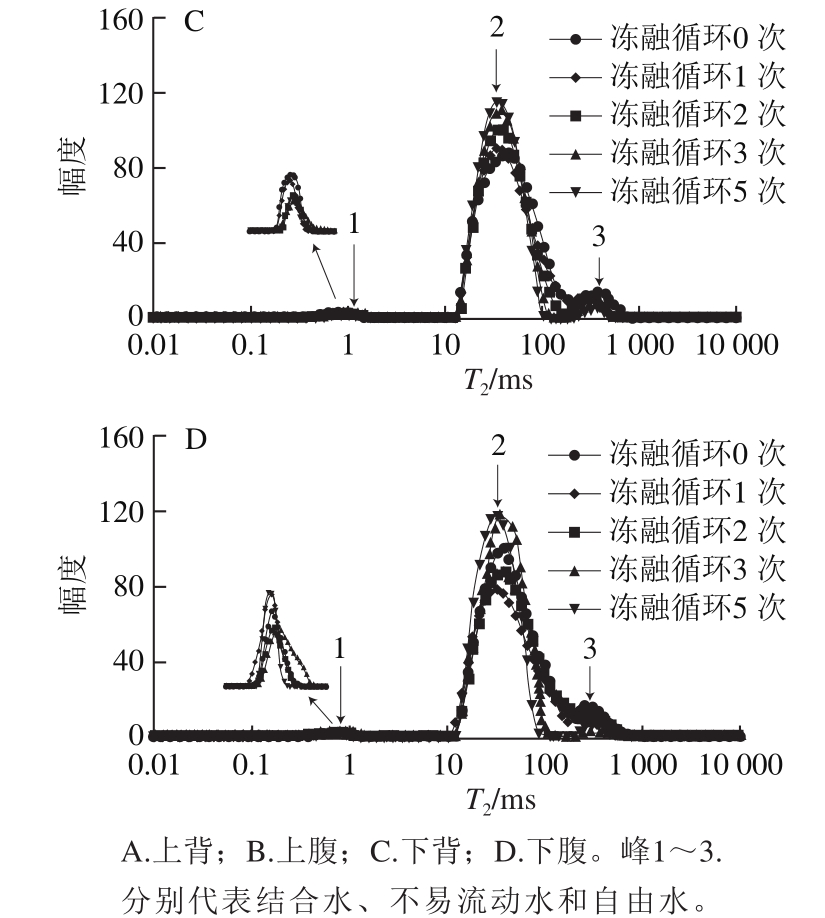
图7 冻融循环后大菱鲆T2弛豫时间分布
Fig.7 Distribution of transverse relaxation time T2in Scophthalmus maximus after freeze-thawing cycles
由图7可以看出,大菱鲆不同部位的T2弛豫时间分布图显示有3 个峰,峰1代表结合水,是与肌肉中大分子物质表面的极性基团紧密结合的水分子层,用T2b表示;峰2代表不易流动水,是存在于肌肉纤维之间的不易流动的水分子,用T21表示;峰3代表自由水,是存在于大菱鲆组织细胞间隙之间的能自由流动的水分子,用T22表示。由图7和表2可知,与冻融循环0 次相比,随着冻融循环次数增加,冻融后的大菱鲆肌肉弛豫时间T2呈延长趋势。随着冻融循环次数的增加,T2b没有显著性变化,分析原因是由于T2b反映的这部分水与大分子紧密结合,冻融很难对其造成显著影响。随着冻融循环次数的增加,大菱鲆不同部位T21呈延长趋势,但没有显著差异,而T22呈显著延长趋势,表明冻融可以使大菱鲆肌肉中自由水的自由度增加;与戚军等[32]在解冻前5 次的结果一致,但与李玫等[19]的结果相反,可能是原料不同,冻融过程对组织结构造成的影响不同,具体原因还需要进一步探讨研究。冻融过程T2的延长会增强水的移动性,可能会造成大菱鲆组织的稳定性下降,引起加工过程中汁液的流失。在同一冻融循环次数下,不同部位之间T2b没有显著差异,而上腹和下腹之间T22有明显差异。
A2b、A21、A22分别对应T2b、T21、T22的信号量,可以用于表示大菱鲆肌肉中结合水、不易流动水、自由水的量。由表3可知,大菱鲆肌肉中结合水的量最少,其次是自由水,不易流动水的量最多,且下背和下腹水分含量要高于上背和上腹。随着冻融循环次数的增加,大菱鲆不同部位含水量逐渐减少,上背水分含量减少最小,而下腹水分含量减少最大,结果与解冻损失结果一致。在冻融过程中,大菱鲆不同部位的A2b变化不显著,其表征的结合水的量变化不显著(P>0.05),是因为结合水是与大分子物质紧密结合的水分子,不易受蛋白质结构以及电荷变化的影响。随着冻融循环次数的增加,不易流动水的量呈先减少后增加趋势,与朱学伸等[18]在肌肉冻融实验中得到的结果一致。与冻融循环0 次的相比,冻融后自由水的量减少,且随着冻融循环次数的增加,自由水的量呈显著减少趋势(P<0.05),其中,上背部的自由水信号量变化最大,由原来的45.43下降到19.36,自由水存在于肌细胞外间隙中,靠毛细血管力作用存在于肌肉中。冻融过程中冰晶对肌细胞的物理性破坏,导致自由水以解冻汁液的形式流失,含量下降。
大菱鲆不同部位肌肉表现出不同的品质特性,随着冻融循环次数的增加,不同部位的pH值呈现先上升后下降趋势,第一次冻融循环后pH值最高。随着冻融循环次数的增加,解冻、蒸制质量损失率和解冻液、蒸制液中粗蛋白和粗多糖损失量明显增加,腹部的解冻和蒸制质量损失大于背部。前2 次冻融循环后,解冻损失变化不显著。随着冻融循环次数的增加,剪切力降低,而硬度、胶着性和咀嚼性增加,弹性下降,且在冻融过程中,腹部的硬度、胶着性和咀嚼性增加的幅度显著大于背部;因此在精加工过程中可根据需要进行分割处理。与新鲜大菱鲆相比,冻融后的弛豫时间T2呈现延长趋势,但随着冻融循环次数增加,T2b和T21没有显著性变化,在冻融循环过程中T22显著增大,表明结合水的量没有显著变化,而自由水的量呈显著下降。所以在运输、贮藏过程中应健全冷藏链技术,防止温度波动引起肌肉的反复冻融,冻融循环次数应控制在1 次以内,以减少冻融过程对肌肉品质的影响。
[1] 刘堃. 中国大菱鲆产业发展历程及对策研究[J]. 中国渔业经济,2011, 29(2): 12-17. DOI:10.3969/j.issn.1009-590X.2011.02.002.
[2] 马爱军, 陈四清, 雷霁霖, 等. 大菱鲆鱼体生化组成及营养价值的初步探讨[J]. 海洋水产研究, 2003, 24(1): 11-14. DOI:10.3969/j.issn.1000-7075.2003.01.003.
[3] 梁萌青, 雷霁霖, 吴新颖, 等. 3 种主养鲆鲽类的营养成分分析及品质比较研究[J]. 渔业科学进展, 2010, 31(4): 113-119. DOI:10.3969/j.issn.1000-7075.2010.04.016.
[4] 李苗云, 樊静, 赵改名, 等. 冻融变化对速冻肉馅品质的影响[C]//第八届中国肉类科技大会论文集, 昆明: 中国畜产品加工研究会, 2010: 183-187.
[5] 郭园园, 孔保华, 夏秀芳, 等. 冷冻-解冻循环对鲤鱼肉物理化学特性的影响[J]. 食品科学, 2011, 32(13): 125-130.
[6] 李婷婷, 刘剑侠, 徐永霞, 等. 大菱鲆微冻贮藏过程中的品质变化规律[J]. 中国食品学报, 2014, 14(7): 95-102.
[7] 肖桂华, 朱蓓薇, 董秀萍, 等. 鲍鱼腹足不同部位的质构特性及组织结构研究[J]. 食品科技, 2010, 35(11): 155-159. DOI:10.13684/j.cnki.spkj.2010.11.061.
[8] 林婉玲, 关熔, 曾庆孝, 等. 彩鲷和普通罗非鱼不同部位营养及质构特性的研究[J]. 现代食品科技, 2011, 27(1): 16-21; 49. DOI:10.3969/j.issn.1673-9078.2011.01.004.
[9] 姜启兴, 吴佳芮, 许艳顺, 等. 鳙鱼不同部位的成分分析及营养评价[J]. 食品科学, 2014, 35(5): 183-187. DOI:10.7506/spkx1002-6630-201405036.
[10] 王垚, 傅新鑫, 潘锦锋, 等. 大菱鲆背腹部肌肉基本组成、质构及加工特性[J]. 食品科学, 2015, 36(23): 64-69. DOI:10.7506/spkx1002-6630-201523013.
[11] LEKNES E, IMSLAND A K, GUSTAVSSON A, et al. Optimum feed formulation for turbot, Scophthalmus maximus (Rafinesque,1810) in the grow-out phase[J]. Aquaculture, 2012, 344-349: 114-119.DOI:10.1016/j.aquaculture.2012.03.011.
[12] 王庆超. 饲料调控大菱鲆(Scophthalmus maximus L.)幼鱼生长、营养素感知与代谢及相关信号通路的初步探究[D]. 青岛: 中国海洋大学, 2015: 25-73.
[13] 彭墨, 徐玮, 麦康森, 等. 亚麻籽油替代鱼油对大菱鲆幼鱼生长、脂肪酸组成及脂肪沉积的影响[J]. 水产学报, 2014, 38(8): 1131-1139.DOI:10.3724/SP.J.1231.2014.49251.
[14] 刘兴旺, 艾庆辉, 麦康森, 等. 大豆浓缩蛋白替代鱼粉对大菱鲆摄食、生长及体组成的影响[J]. 水产学报, 2014, 38(1): 91-98.DOI:10.3724/SP.J.1231.2014.48852.
[15] 刘宝锁, 张天时, 孔杰, 等. 大菱鲆生长和耐高温性状的遗传参数估计[J].水产学报, 2011, 35(11): 1601-1606. DOI:10.3724/SP.J.1231.2011.17591.
[16] REGOST C, ARZEL J, ROBIN J, et al. Total replacement of fish oil by soybean or linseed oil with a return to fish oil in turbot(Psetta maxima): 1. growth performance, flesh fatty acid profile,and lipid metabolism[J]. Aquaculture, 2003, 217(1/2/3/4): 465-482.DOI:10.1016/S0044-8486(02)00259-4.
[17] BELL J G, TOCHER D R, FARNDALE B M, et al. Effects of essential fatty acid-deficient diets on growth, mortality, tissue histopathology and fatty acid compositions in juvenile turbot(Scophthalmus maximus)[J]. Fish Physiology and Biochemistry, 1999,20(3): 263-277. DOI:10.1023/A:1007743532618.
[18] 朱学伸, 黄雪方, 鲁小讯, 等. 结合低场核磁共振分析反复冻融处理对肉鸡不同部位肌肉品质的影响[J]. 食品科学, 2016, 37(9): 23-28.DOI:10.7506/spkx1002-6630-201609005.
[19] 李玫, 李苗云, 赵改名, 等. 冻融循环下鸡肉品质变化的低场核磁共振研究[J]. 食品科学, 2013, 34(11): 58-61. DOI:10.7506/spkx1002-6630-201311014.
[20] 李学英, 迟海, 杨宪时, 等. 南极磷虾冷藏过程中的品质变化[J]. 食品科学, 2010, 31(20): 464-468.
[21] 何定芬. 三疣梭子蟹活蟹肉的冷冻加工技术[J]. 齐鲁渔业, 2002,19(7): 44-45; 4.
[22] 阿依木古丽, 蔡勇, 陈士恩, 等. 冻融对早胜牛肉品质及微细结构的影响[J]. 畜牧兽医学报, 2011, 42(3): 375-380.
[23] 阿依木古丽, 蔡勇, 陈士恩, 等. 反复冷冻-解冻对牛肉品质及组织结构的影响[J]. 食品科学, 2011, 32(7): 109-112.
[24] HUFF-LONERGAN E, LONERGAN S M. Mechanisms of waterholding capacity of meat: the role of postmortem biochemical and structural changes[J]. Meat Science, 2005, 71(1): 194-204.
[25] 张英华. 肉的品质及其相关质量指标[J]. 食品研究与开发, 2005,26(1): 39-42. DOI:10.1016/j.meatsci.2005.04.022.
[26] 余力, 贺稚非, ENKHMAA B, 等. 不同解冻方式对伊拉兔肉品质特性的影响[J]. 食品科学, 2015, 36(14): 258-264. DOI:10.7506/spkx1002-6630-201514049.
[27] 吴琼, 李德阳, 潘锦锋, 等. 熟化方式对大菱鲆肌肉加工特性的影响[J]. 中国食品学报, 2016, 16(19): 129-135. DOI:10.16429/j.1009-7848.2016.09.018.
[28] SRINIVASAN S, XIONG Youling L., BLANCHARD S P. Effects of freezing and thawing methods and storage time on thermal properties of freshwater prawns (Macrobrachium rosenbergii)[J]. Journal of the Science of Food and Agriculture, 1997, 75(1): 37-44. DOI:10.1016/S0001-2092(07)69000-0.
[29] SRIKET P, BENJAKUL S, VISESSANGUAN W, et al.Comparative studies on the effect of the freeze-thawing process on the physicochemical properties and microstructures of black tiger shrimp (Penaeus monodon) and white shrimp (Penaeus vannamei)muscle[J]. Food Chemistry, 2007, 104(1): 113-121. DOI:10.1016/j.foodchem.2006.11.004.
[30] SHANKS B C, WULF D M, MADDOCK R J. Technical note: the effect of freezing on Warner-Bratzler shear force values of beef longissimus steaks across several post-mortem aging periods[J].Journal of Animal Science, 2002, 80(8): 2122-2125.
[31] SMITH G C, SPAETH C W, CARPENTER Z L, et al. The effects of freezing, frozen storage conditions, and degree of doneness on lamb palatability characteristics[J]. Food Science, 1968, 33(1): 19-24.DOI:10.1111/j.1365-2621.1968.tb00876.x.
[32] 戚军, 高菲菲, 李春保, 等. 低场NMR研究冻融过程中羊肉持水力的变化[J]. 江苏农业学报, 2010, 26(3): 617-622. DOI:10.3969/j.issn.1000-4440.2010.03.033.
Effect of Freeze-Thaw Cycles on the Quality of Muscles from Different Parts of Scophthalmus maximus