鲜食糯玉米的食用品质主要表现为糯性、甜味和柔嫩性,其中柔嫩度是鲜食糯玉米品质育种与采后贮藏的关键指标[1-3]。鲜食糯玉米采后贮藏期间极易出现柔嫩度下降、食用品质劣化现象[4-5],其主要是由于贮藏过程中的微生物侵染导致抗性诱导作用增强,使抵御微生物侵染的次生代谢反应苯丙烷代谢增强,增加木质素等植保素的积累[6-7]。很多化学、物理、生物因子被用来抑制微生物侵染,降低抗性诱导效应,延缓木质素积累[7-11]。鲜食糯玉米采后抑菌研究还不多见,Pitak等[12]制备了香蕉粉/壳聚糖膜以保鲜幼嫩玉米,增强果穗的抑菌能力,但相关研究仍需要加强。
ClO2是一种安全、无毒的绿色消毒剂,作为高效的果蔬保鲜剂近年来受到普遍关注[11,13-14]。Yang Huqing等[11]发现采用28 mg/L的ClO2浸泡处理竹笋,可以抑制病原菌侵染,降低竹笋质量损失,延缓木质素积累。壳寡糖(chitosan oligosaccharide,COS)现已被广泛用于诱导植物的防卫反应,如可促进活性氧迸发、植保素形成和病程相关蛋白积累等[15]。Wang Fengde等[16]发现COS作为激发子可以诱导对多种病原菌的抗性,诱导苯丙氨酸解氨酶(phenylalanine ammonia lyase,PAL)mRNA积累,激发过氧化物酶(peroxidase,POD)活力,促进多酚合成;Ma Lin等[17]发现5 mg/mL COS处理能够延缓杏李质地下降,减少乙烯释放,降低果实腐败率等。COS多与其他多糖或杀菌剂联合应用,可增强其抗性诱导作用[11,16]。因此,本实验在前人研究结果基础上,采用ClO2杀菌复合COS涂膜的方法处理鲜食糯玉米果穗,并进行低温气调贮藏,以降低果穗的微生物侵染情况;实验分析了贮藏不同时期木质素、多酚含量,以及PAL、POD活力变化,以探讨鲜食糯玉米采后抵御病原菌侵染、保持柔嫩质地的方法及可能机制。
糯玉米(Zea mays L.)品种为‘京科糯2000’,山东省农业科学院作物研究所实验场种植。授粉后第24天采收,为保证所取果穗的一致性,采收时选择生长发育一致的植株。
UV2550紫外-可见分光光度计 日本岛津公司;DK-2000恒温水浴振荡器 天津市泰斯特仪器公司;SW-CJ-2FD净化工作台 江苏苏州净化设备公司;160HL恒温恒湿培养箱 江苏金怡仪器科技公司;LDZX-50FBS立式蒸汽压力灭菌器 上海申安医疗器械厂;Scientz-192动植物组织研磨器 浙江宁波新芝生物科技股份公司。
1.3.1 实验设计
每处理取30 个果穗,采用不同处理方式后,装入规格为60 cm×60 cm的气调贮藏袋中,每袋30 个果穗,整齐排列好,贮藏于(4±1)℃、相对湿度85%条件的恒温库中,贮藏期间每7 d定时取5 个果穗的中部籽粒混匀,分为两部分,一部分直接测定多酚、木质素含量,另一部分用液氮速冻,—40 ℃保存,用于进行酶活力分析。
鲜食糯玉米果穗去除苞叶后,采用去离子水清洗去除表面花丝等杂质,实验分为4 组,每组取30 个果穗,经不同处理后自然晾干、装入气调包装袋中。对照组:去离子水清洗;ClO2杀菌处理组:置于200 mg/L ClO2溶液中浸泡10 min;COS涂膜处理组:于15 mg/mL COS溶液中浸泡5 min;ClO2-COS处理组:于200 mg/L ClO2溶液中浸泡10 min,自然晾干后于15 mg/mL COS溶液中浸泡5 min。实验设2 次重复,结果取2 次重复的平均值。
1.3.2 微生物菌落计数方法
参考GB 4789.15—2016《食品安全国家标准 食品微生物学检验 霉菌和酵母计数》[18]测定霉菌和酵母菌总数。
1.3.3 木质素含量的测定
按照Gong Kuijie等[5]的方法测定木质素含量,结果以鲜质量计。木质素积累速率按式(1)计算。
其中:wn为第n天取样时的木质素含量/(mg/g);wn+7为第n+7天取样时的木质素含量/(mg/g)。
1.3.4 多酚含量的测定
多酚含量的测定参照Ti Huihui等[19]的方法略加修改。准确称取0.6 g鲜玉米籽粒,加入液氮脆化,在液氮挥发的同时捣碎成粉末状。按固液比1∶15(m/V)加入体积分数80%乙醇溶液溶解后,置于水温为40 ℃的超声清洗器中,在200 W功率下超声45 min,4 000 r/min离心10 min,取上清液3 mL,稀释两倍。准确吸取样品溶液2 mL于10 mL容量瓶中,分别加入蒸馏水5 mL、Folin-Ciocalteu试剂0.5 mL和75 g/L的Na2CO3溶液1.5 mL,加水稀释至刻度,混匀,75 ℃水浴10 min,冷却至室温,在760 nm波长处测定吸光度。称取50 mg的没食子酸标准品,按照样品测定方法制作标准曲线。按照标准曲线计算吸光度平均值对应的质量浓度。鲜食糯玉米中多酚含量按公式(2)计算,结果以鲜质量计。
式中:ρ为按照标准曲线计算的质量浓度/(μg/mL);V为提取液的总体积/mL;m为样品质量/g。
1.3.5 酶液提取及PAL、POD活力测定
按照Gong Kuijie等[5]的方法进行酶液提取并测定PAL、POD活力,每分钟吸光度变化0.01为一个酶活力,结果以鲜质量计。
每个处理组设3 次平行,结果以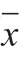 ±s表示。采用SAS 9.2软件进行统计分析,Origin 9.0和Excel软件进行数据分析并作图,取其平均值,运用Duncan检验进行差异显著性分析(P<0.05)。
±s表示。采用SAS 9.2软件进行统计分析,Origin 9.0和Excel软件进行数据分析并作图,取其平均值,运用Duncan检验进行差异显著性分析(P<0.05)。
表1 不同处理对鲜食糯玉米贮藏过程中霉菌和酵母菌总数的影响Table1 Effects of different treatments on total mold and yeast count of fresh waxy corn during storage

注:同列肩标小写字母不同表示差异显著(P<0.05);同行肩标大写字母不同表示差异显著(P<0.05)。
霉菌和酵母菌总数(lg(CFU/g))0 d 7 d 14 d 21 d 28 d 35 d对照 1.00±0.07bE2.27±0.10aD3.00±0.09aC3.52±0.16aB3.75±0.03aB4.30±0.21aAClO2杀菌 1.30±0.05aE2.30±0.08aD2.78±0.13aC3.18±0.10bB3.51±0.14aA3.78±0.16bACOS涂膜 1.00±0.11bE2.27±0.12aD2.80±0.11aD3.20±0.08bC3.71±0.18aB4.18±0.09aAClO2-COS处理 1.47±0.15aC1.78±0.08bBC1.85±0.06bAB1.95±0.11cAB2.11±0.06bA2.30±0.12cA处理方式
鲜食糯玉米采后贮藏过程中,微生物侵染是导致其货架期缩短的重要因素[20]。从表1中可以看出,随贮藏时间延长,病原菌侵染明显加重,其中对照组在贮藏末期时霉菌和酵母菌总数大幅度上升,达(4.30±0.21)(lg(CFU/g)),显著高于单纯ClO2杀菌处理组和ClO2-COS处理组,但与COS涂膜处理组不存在显著差异。ClO2-COS处理组表现出了良好的抑菌能力,贮藏35 d时霉菌和酵母菌菌落总数为(2.30±0.12)(lg(CFU/g)),显著低于ClO2杀菌处理组((3.78±0.16)(lg(CFU/g)))和COS涂膜处理组((4.18±0.09)(lg(CFU/g)))(P<0.05)。从图1中也可以看出,ClO2-COS处理组无肉眼可见菌斑,而对照组和COS涂膜处理组菌斑最为明显,ClO2杀菌处理组也有少量菌斑出现。ClO2杀菌处理组和COS涂膜处理组都表现了一定的抑菌能力,但可能由于取样间隔较长,7、14 d时与对照组的霉菌和酵母菌总数不存在显著性差异(P>0.05),仅在21 d时出现显著性差异(P<0.05)。

图1 不同处理组鲜食糯玉米贮藏末期果穗染菌情况
Fig.1 Microbial infection of fresh waxy corn at the end of storage in different treatment groups
植物在不同逆境环境生存进化中获得了一系列防卫反应系统,病原菌侵染后的木质素积累就是植物细胞应对外界的一个重要防御措施[7,21]。但是,木质素积累同时又会造成果实硬度增大,大多数研究认为果实质地劣化主要原因在于采收伤害、微生物侵染造成了木质化[9,21-22]。因此,如何恰当地调控抗病防御与质地劣化之间的关系成为保鲜贮藏技术的重点。

图2 不同处理对鲜食糯玉米采后贮藏期间木质素含量的影响
Fig.2 Effects of different treatments on lignin contents of fresh waxy corn during storage
从图2中可以看出,不同采后处理的鲜食糯玉米贮藏期间木质素含量总体上随贮藏时间延长而增加,表明采后衰老和微生物侵染会造成鲜食糯玉米籽粒中的木质素积累。对照组的木质素含量在贮藏期间持续升高,从采收初期的(27.69±1.21)mg/g上升至贮藏末期的(33.49±0.87)mg/g,并且始终高于其他处理组,表明不采用保鲜措施会快速启动防御机制,同时采后衰老也未得到有效抑制[11],造成木质素大量生成,这也造成了质地的快速劣化。对表1和图1、2中对照组各指标分析可以发现,木质素大量积累并不会增加鲜食糯玉米果穗的抗病原菌侵染能力。
与对照组相反,单纯ClO2或COS处理的果穗木质素含量则一直处于较低水平,二者木质素含量无显著差异(P>0.05),表明COS或ClO2处理均能适当降低木质素积累。结合表1和图1、2可以发现,在木质素积累较少的情况下,两个处理均表现了高于对照的抑菌能力。分析ClO2和COS处理组的木质素积累速率(图3)可以看出,二者表现出了相近的木质素积累能力。

图3 不同处理对鲜食糯玉米采后贮藏期间木质素积累速率的影响
Fig.3 Effects of different treatments on lignin accumulation rate of fresh waxy corn during storage
ClO2-COS处理组的木质素含量在3 个处理组中最低,在21 d后基本保持稳定(图2),而其良好的抑菌能力(图1、表1)进一步表明木质素积累并不能保证抗病原菌侵染能力的提升。分析木质素积累速率的规律也可以发现,ClO2-COS处理组的木质素积累速率随贮藏时间延长而下降,而对照组积累速率除7~14 d下降外,14~35 d都呈上升趋势(图3);表明ClO2-COS处理在有效抑制微生物侵染的同时,能够延缓木质素快速积累,从而保持品质稳定。

图4 不同处理对鲜食糯玉米采后贮藏期间多酚含量的影响
Fig.4 Effects of different treatments on polyphenol contents of fresh waxy corn during storage
多酚是苯丙烷代谢木质素合成途径的底物,通常被认为是木质素合成的前体物质[23-24]。多酚含量的变化在一定程度上可以表征木质素合成的变化。从图4可以看出,ClO2杀菌、COS涂膜以及二者复合处理均显著降低了贮藏期间多酚含量(P<0.05)。3 个处理组在35 d贮藏期内,多酚含量均先逐渐下降,28 d后开始上升。0~7 d贮藏期内,ClO2杀菌处理组多酚含量降低幅度最大,由初期的(329.36±0.77)μg/g降低至(262.39±0.39)μg/g;COS处理组多酚含量降低幅度最小,7 d时多酚含量为(327.66±8.97)μg/g,与采收0 d时无显著差异(P>0.05);ClO2-COS处理组多酚含量则处于二者之间,为(294.50±18.28)μg/g。而对照组的多酚含量除前7 d下降外,贮藏期间持续上升,且均高于3 个处理组。结合木质素含量变化可以看出,对照组在贮藏期间一直处于旺盛的多酚-木质素合成代谢状态,而3 种处理方式则保持了较低的多酚-木质素合成代谢,因而多酚含量变化较为缓慢。旺盛的多酚-木质素合成是以苯丙烷途径代谢底物苯丙氨酸的消耗为代价的[25],由此也会导致鲜食糯玉米品质的下降。对比ClO2杀菌、COS涂膜和复合处理的抑菌作用、木质素含量变化和多酚含量变化可以发现,鲜食糯玉米果穗的多酚-木质素合成状态并不是越低越好,合理地调控木质素合成速率更为重要。
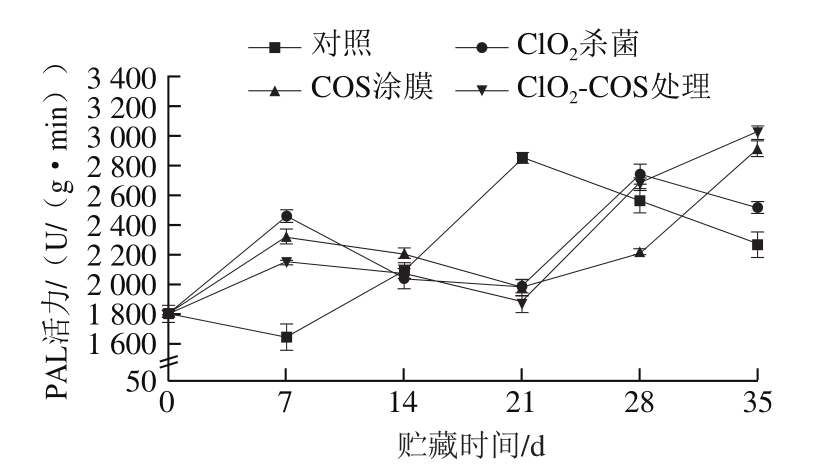
图5 不同处理对鲜食糯玉米采后贮藏期间PAL活力的影响
Fig.5 Effects of different treatments on PAL activity of fresh waxy corn during storage
PAL催化苯丙氨酸转化为肉桂酸,是导致植物细胞壁木质素沉积的第一关键酶[23,26]。鲜食糯玉米采后木质化过程中,PAL活力的变化将会直接影响多酚合成进程。从图5可以发现,贮藏期间,鲜食糯玉米处理组的PAL活力基本呈先上升后下降再上升的趋势,对照组的PAL活力明显比3 个处理组表现出更快、更显著的变化特征。对照组的PAL活力在0~7 d内下降,之后快速上升,21 d时达到最高,之后快速下降;而3 个处理组的PAL活力先在第7天达到峰值,之后开始下降,均在21 d时达到最低,之后开始上升。相对来讲,ClO2杀菌处理对PAL活力的变化趋势影响更为显著,而COS涂膜处理和ClO2-COS处理对PAL活力的变化趋势影响相对要小。
鲜食糯玉米采后由植株向果穗的物质转运终止,代谢底物来自于采收前积累产物,采收所造成的愈伤作用会导致苯丙烷代谢增强,因此出现PAL活力增强现象[21,27];随着果穗对于贮藏环境的适应,冷藏环境降低了呼吸消耗,采取保鲜处理措施的果穗都具有一定的抵御微生物侵染的能力,因此PAL活力出现下降;而随着贮藏时间的延长,微生物侵染增强,苯丙烷代谢随之被诱导,PAL活力开始增强;而在微生物侵染过度状态下,PAL代谢底物被大量消耗,因而其活力开始下降。
对照组的PAL活力在短暂降低后,快速上升趋势较为明显,表明只采用去离子水清洗处理的鲜食糯玉米苯丙烷代谢途径较为旺盛,由于微生物侵染加剧,植物体的抗病响应强烈。对照组贮藏21 d后PAL活力持续下降,也表明代谢底物快速消耗,抗病能力已经基本丧失。与对照组相比,3 个处理组的PAL活力变化均相对平缓,结合3 种处理的抑菌效果可以发现,3 种处理均能适度降低苯丙烷代谢水平,不会造成强烈的抗性诱导响应。与ClO2杀菌处理组的PAL活力在28 d后开始下降对比,COS涂膜处理组和ClO2-COS处理组的PAL活力在28 d后仍在升高,表明COS诱导抗性更有利于延迟代谢底物消耗,抑制病原菌侵染。

图6 不同处理对鲜食糯玉米采后贮藏期间POD活力的影响
Fig.6 Effects of different treatments on POD activity of fresh waxy corn during storage
POD在苯丙烷代谢中催化肉桂醇形成木质素的最后一步反应过程,使木质素单体聚合反应合成木质素[26,28]。由图6可知,鲜食糯玉米采收初期POD活力高于采后贮藏过程任一阶段,这可能是由于鲜食糯玉米采前处于旺盛的木质素合成阶段,已经积累了大量的木质素单体[28-29],因此离体采收后,POD仍然保持较高活力,但随着木质素单体消耗的增加,同时多酚合成不足以抵消木质素单体消耗,导致代谢底物含量下降,POD活力降低;随着微生物侵染加剧,抗性诱导PAL活力增加,多酚含量适度增加[7,30],POD活力升高,但由于多酚含量增加幅度较小,不足以带来采收初期大量木质素单体积累的效果,因而POD活力升高幅度也较小,其活力仍远低于采收初期。
从图6可以发现,对照组和COS涂膜处理组的POD活力都遵循了先下降后略有上升的变化趋势。相对地,ClO2杀菌处理组的POD活力在贮藏期间一直呈下降趋势,而ClO2-COS处理组的POD活力则表现出了先下降再上升后略有下降的趋势,但ClO2杀菌处理组和ClO2-COS处理组贮藏末期的POD活力差异都未达显著水平(P>0.05)。之前的研究发现,鲜食糯玉米采后木质素积累与POD活力存在显著相关性[5],在对竹笋、甜瓜等的研究中也发现了相同的结果[9,25-26,31]。COS涂膜处理组和ClO2-COS处理组的POD活力在贮藏期间基本低于ClO2杀菌处理组和对照组,这与其木质素积累速率(图3)的趋势相一致,这表明贮藏期间保持较低的POD活力有利于延缓木质素积累。ClO2-COS处理有效抑制了微生物侵染,且抑制了POD活力,使得木质素的积累下降。
鲜食糯玉米采后贮藏期间微生物侵染会造成木质素积累,使产品柔嫩度下降、质地劣化。ClO2杀菌处理可以降低微生物侵染基础,COS涂膜处理则可以产生诱导抗性。二者单独应用均具有一定的抑菌效果,而采用先杀菌后涂膜的ClO2-COS复合处理表现出了良好的抑菌能力,能够有效地抑制微生物侵染,降低抗性诱导效应。ClO2-COS处理能够降低木质素积累速率,降低多酚含量并使其基本保持较低水平,延缓木质素快速积累。ClO2-COS处理可以抑制PAL活力过快上升,降低苯丙烷代谢水平,还能降低POD活力,使其在贮藏期间一直保持较低水平,使木质素积累趋势平缓,从而保持糯玉米的柔嫩质地。
[1] 宋雪皎, 马兴林, 关义新, 等. 影响糯玉米鲜食品质因素的研究[J]. 玉米科学, 2005, 13(1): 115-118. DOI:10.3969/j.issn.1005-0906.2005.01.035.
[2] GONG K, CHEN L. Characterization of carbohydrates and their metabolizing enzymes related to the eating quality of postharvest fresh waxy corn[J]. Journal of Food Biochemistry, 2013, 37(5): 619-627.DOI:10.1111/jfbc.12015.
[3] 陈冰洁, 吕莹莹, 张恩盈, 等. 鲜食型糯玉米新品种主要农艺性状的相关和主成分分析[J]. 山东农业科学, 2017, 49(7): 16-20.DOI:10.14083/j.issn.1001-4942.2017.07.004.
[4] 龚魁杰, 陈利容, 朱立贵, 等. 鲜食糯玉米采后与食用品质相关的糖代谢变化[J]. 食品科技, 2011, 36(12): 170-173. DOI:10.13684/j.cnki.spkj.2011.12.013.
[5] GONG Kuijie, CHEN Lirong, LI Xiaoyue, et al. Lignin accumulation and biosynthetic enzyme activities in relation to postharvest firmness of fresh waxy corn[J]. Journal of Food Processing and Preservation,2017, 42(1): e13333. DOI:10.1111/jfpp.13333.
[6] YUAN L, BI Y, GE Y, et al. Postharvest hot water dipping reduces decay by inducing disease resistance and maintaining firmness in muskmelon (Cucumis melo L.) fruit[J]. Scientia horticulturae, 2013,161: 101-110. DOI:10.1016/j.scienta.2013.06.041.
[7] WANG Q G, CAO Y, ZHOU L L, et al. Effects of postharvest curing treatment on flesh colour and phenolic metabolism in fresh-cut potato products[J]. Food Chemistry, 2015, 169: 246-254. DOI:10.1016/j.foodchem.2014.08.011.
[8] LUO Z S, XU X L, CAI Z, et al. Effects of ethylene and 1-methylcyclopropene (1-MCP) on lignification of postharvest bamboo shoot[J]. Food Chemistry, 2007, 105(2): 521-527. DOI:10.1016/j.foodchem.2007.04.007.
[9] LUO Z S, FENG S M, PANG J, et al. Effect of heat treatment on lignification of postharvest bamboo shoots (Phyllostachys praecox f.prevernalis.)[J]. Food Chemistry, 2012, 135(4): 2182-2187.DOI:10.1016/j.foodchem.2012.07.087.
[10] BONGHI C, RIZZINI F M, GAMBUTI A, et al. Phenol compound metabolism and gene expression in the skin of wine grape (Vitis vinifera L.) berries subjected to partial postharvest dehydration[J].Postharvest Biology and Technology, 2012, 67: 102-109.DOI:10.1016/j.postharvbio.2012.01.002.
[11] YANG Huqing, ZHENG Jiaying, HUANG Chengqian, et al. Effects of combined aqueous chlorine dioxide and chitosan coatings on microbial growth and quality maintenance of fresh-cut bamboo shoots(Phyllostachys praecox f. prevernalis.) during storage[J]. Food and Bioprocess Technology, 2015, 8(5): 1011-1019. DOI:10.1007/s11947-014-1463-y.
[12] PITAK N, RAKSHIT S K. Physical and antimicrobial properties of banana flour/chitosan biodegradable and self sealing films used for preserving fresh-cut vegetables[J]. LWT-Food Science and Technology,2011, 44(10): 2310-2315. DOI:10.1016/j.lwt.2011.05.024.
[13] 李石磊, 肖生苓, 罗瑜莹. pH值对保鲜纸中亚氯酸钠留存率和二氧化氯释放规律的影响[J]. 食品科学, 2018, 39(5): 272-277.DOI:10.7506/spkx1002-6630-201805041.
[14] 韩强, 郜海燕, 陈杭君, 等. ClO2处理和包装方法对鲜核桃仁贮藏品质的影响[J]. 中国食品学报, 2017, 17(5): 130-137. DOI:10.16429/j.1009-7848.2017.05.017.
[15] SHIBUYA N, MINAMI E. Oligosaccharide signalling for defence responses in plant[J]. Physiological and Molecular Plant Pathology,2001, 59(5): 223-233. DOI:10.1006/pmpp.2001.0364.
[16] WANG Fengde, FENG Guihua, CHEN Kaoshan. Defense responses of harvested tomato fruit to burdock fructooligosaccharide, a novel potential elicitor[J]. Postharvest Biology and Technology, 2009, 52(1):110-116. DOI:10.1016/j.postharvbio.2008.09.002.
[17] MA Lin, CAO Jiankang, XU Limin, et al. Effects of 1-methylcyclopropene in combination with chitosan oligosaccharides on post-harvest quality of aprium fruits[J]. Scientia Horticulturae,2014, 179: 301-305. DOI:10.1016/j.scienta.2014.09.052.
[18] 国家卫生和计划生育委员会. 食品安全国家标准 食品微生物学检验 霉菌和酵母计数: GB/T 4789.15—2016[S]. 北京: 中国标准出版社, 2016: 1- 3.
[19] TI Huihui, ZHANG Ruifen, ZHANG Mingwei, et al. Dynamic changes in the free and bound phenolic compounds and antioxidant activity of brown rice at different germination stages[J]. Food Chemistry, 2014,161: 337-344. DOI:10.1016/j.foodchem.2014.04.024.
[20] 陈利容, 龚魁杰, 李香勇, 等. 鲜食糯玉米采后多糖降解代谢变化[J]. 食品科技, 2015, 40(11): 342-346. DOI:10.13684/j.cnki.spkj.2015.11.068.
[21] ZENG F F, LUO Z S, XIE J W, et al. Gamma radiation control quality and lignification of bamboo shoots (Phyllostachys praecox f. prevernalis.) stored at low temperature[J]. Postharvest Biology and Technology, 2015, 102: 17-24. DOI:10.1016/j.postharvbio.2015.02.004.
[22] LIU M Y, QIAN B J, ZHANG H, et al. Sanitizer treatments alleviate lignification of sliced few-flower wildrice (Zizania latifolia Turcz.)[J].Food Research International, 2010, 43(10): 2363-2368. DOI:10.1016/j.foodres.2010.09.004.
[23] CHEYNIER V, COMTE G, DAVIES K M, et al. Plant phenolics:recent advances on their biosynthesis, genetics, and ecophysiology[J].Plant Physiology and Biochemistry, 2013, 72: 1-20. DOI:10.1016/j.plaphy.2013.05.009.
[24] SIMLA S, BOONTANG S, HARAKOTR B. Anthocyanin content,total phenolic content, and antiradical capacity in different ear components of purple waxy corn at two maturation stages[J].Australian Journal of Crop Science, 2016, 10(5): 675-682.DOI:10.21475/ajcs.2016.10.05.p7389.
[25] LIU Y Y, GE Y H, BI Y, et al. Effect of postharvest acibenzolar-S-methyl dipping on phenylpropanoid pathway metabolism in muskmelon (Cucumis melo L.) fruits[J]. Scientia Horticulturae, 2014,168: 113-119. DOI:10.1016/j.scienta.2014.01.030.
[26] CAI C, XU C J, LI X, et al. Accumulation of lignin in relation to change in activities of lignification enzymes in loquat fruit flesh after harvest[J]. Postharvest Biology and Technology, 2006, 40(2): 163-169. DOI:10.1016/j.postharvbio.2005.12.009.
[27] CHEN Y H, LIN H T, SHI J, et al. Effects of a feasible 1-methylcyclopropene postharvest treatment on senescence and quality maintenance of harvested Huanghua pears during storage at ambient temperature[J]. LWT-Food Science and Technology, 2015, 64(1):6-13. DOI:10.1016/j.lwt.2015.05.021.
[28] WANG Y, CHANTREAU M, SIBOUT R, et al. Plant cell wall lignification and monolignol metabolism[J]. Frontiers in Plant Science,2013, 4: 1-14. DOI:10.3389/fpls.2013.00220.
[29] HUYSKENS-KEIL S, HERPPICH W B. High CO2effects on postharvest biochemical and textural properties of white asparagus(Asparagus officinalis L.) spears[J]. Postharvest Biology and Technology, 2013, 75: 45-53. DOI:10.1016/j.postharvbio.2012.06.017.
[30] ARAJI S, GRAMMER T A, GERTZEN R, et al. Novel roles for the polyphenol oxidase enzyme in secondary metabolism and the regulation of cell death in walnut[J]. Plant Physiology, 2014, 164(3):1191-1203. DOI:10.1104/pp.113.228593.
[31] WANG J J, BI Y, WANG Y, et al. Multiple preharvest treatments with harpin reduce postharvest disease and maintain quality in muskmelon fruit (cv. Huanghemi)[J]. Phytoparasitica, 2014, 42(2): 155-163.DOI:10.1007/s12600-013-0351-8.
Effect of ClO2Sterilization Combined with Chitosan Oligosaccharide Coating on Maintaining the Quality of Waxy Corn