
图1 多层乳液形成流程[8]
Fig.1 Schematic of the formation of multilayer emulsion[8]
食品中功能因子、风味物质等活性成分易受光、热、pH值变化等多种外界环境因素的影响而被破坏,无法达到预期的效果,因此需要选择合适的传递系统对其进行保护。传递系统一般可以对功能成分起到保护、传递以及控释等作用。乳液作为传递系统中的一个大类,在食品领域中有着广泛的应用。根据结构、相分布的不同,乳液可分为多种类型,包括传统乳液、Pickering乳液、多重乳液、多层乳液以及基于乳液的固体脂质颗粒和水凝胶填充颗粒等[1]。本文以双层乳液为主要研究对象,综述了其研究进展以及应用。
双层乳液属于多层乳液的一种,其乳液液滴具有两层界面层。多层乳液的液滴有着复杂的相间界面,其多层界面膜是由液滴所带电荷以及乳化条件所决定的[2]。以一种生物聚合物为乳化剂制备初级乳液(单层乳液),该乳化剂会在乳液液滴表面形成第1层界面层,稳定乳液结构。绝大部分的初级乳液都具有一定数量的表面电荷,当具有与液滴表面所带电位相反电荷的聚电解质与第1层界面膜接触时,它们相互作用并在第1层界面层外形成第2层界面层,即形成双层乳液,此时乳液液滴所带电荷的正负性发生反转,这种方法被称为层-层(layerby-layer,LBL)静电沉积法[3-4]。柳艳梅[5]以中链甘油三酯(medium chain triglycerides,MCT)油溶解β-胡萝卜素作为油相,辛烯基琥珀酸淀粉钠为乳化剂,经高速剪切与高压均质制得单层乳液,之后将所得单层乳液与一定浓度的壳聚糖溶液混匀,再经高速剪切与高压均质制得双层乳液。重复此过程可以形成更多界面层,从而得到多层乳液[6],如图1所示。通过这种LBL方式制备的双层乳液与传统乳液相比,增强了乳液在高离子强度、pH值变化、热加工、老化、脂肪氧化以及冻融循环条件下的理化稳定性[7]。

图1 多层乳液形成流程[8]
Fig.1 Schematic of the formation of multilayer emulsion[8]
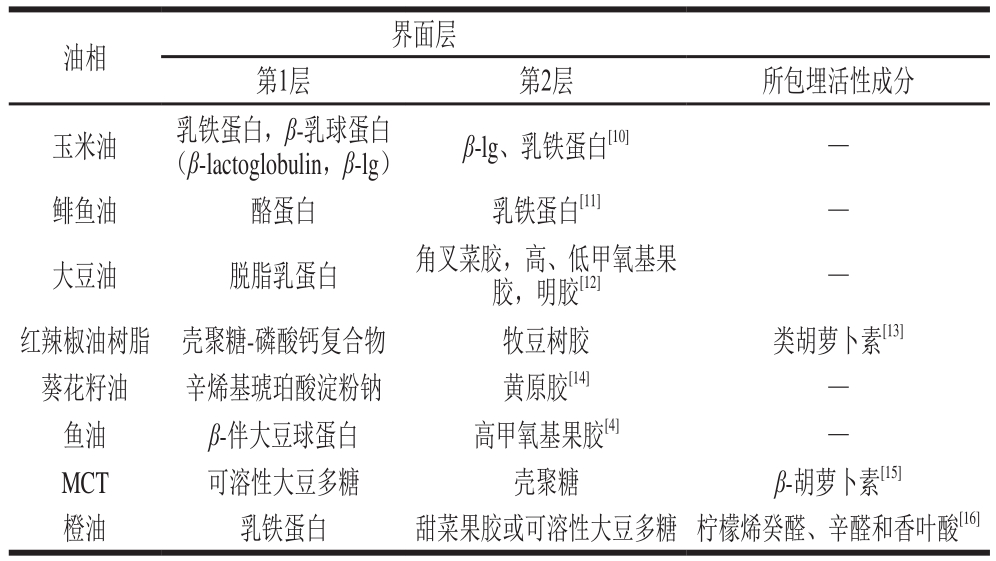
表1 近年来部分双层乳液的研究
Table1 Selected recent studies on bilayer emulsion
注:—.无相关内容,下同。
油相 界面层第1层 第2层 所包埋活性成分玉米油 乳铁蛋白,β-乳球蛋白(β-lactoglobulin,β-lg) β-lg、乳铁蛋白[10]—鲱鱼油 酪蛋白 乳铁蛋白[11]—大豆油 脱脂乳蛋白 角叉菜胶,高、低甲氧基果胶,明胶[12]—红辣椒油树脂 壳聚糖-磷酸钙复合物 牧豆树胶 类胡萝卜素[13]葵花籽油 辛烯基琥珀酸淀粉钠 黄原胶[14]—鱼油 β-伴大豆球蛋白 高甲氧基果胶[4]—MCT 可溶性大豆多糖 壳聚糖 β-胡萝卜素[15]橙油 乳铁蛋白 甜菜果胶或可溶性大豆多糖 柠檬烯癸醛、辛醛和香叶酸[16]
近年来有许多研究人员对不同组成的双层乳液的乳化性、稳定性等性质以及界面层材料的选择与开发进行研究,如表1所示。乳液作为一种传递系统可以保护所包埋的生物活性物质等成分,而双层乳液通过添加以蛋白质、多糖或小分子表面活性剂等成分组成的界面层增强了乳液的理化稳定性,可以对所包埋成分形成更好的保护[9]。
研究表明,两种不同的蛋白质可用于制备双层乳液。有研究人员尝试使用等电点分别为8.5与5.0的乳铁蛋白与β-lg制备双层乳液,Schmelz等[10]的研究发现乳铁蛋白与β-lg所形成的界面层在pH 3.0~7.0的范围内稳定,此外其所制备的双层乳液经热处理(21~90 ℃、20 min)以及在离子强度为0~500 mmol/L NaCl、0~60 mmol/L CaCl2的条件下均能保持稳定。Mao Yingyi等[17]的研究发现,乳铁蛋白与β-lg所制备的双层乳液与以这两种蛋白质的混合物为乳化剂所制得的乳液相比,在90 ℃条件下具有更好的热稳定性。
双层乳液作为一种传递系统,对敏感的亲脂性活性成分具有较好的保护作用。Lesmes等[11]以酪蛋白酸钠与乳铁蛋白包埋ω-3脂肪酸制备的双层乳液具有良好的物理稳定性,并且与仅用酪蛋白酸钠所制备的初级乳液相比氧化稳定性有显著提高。Taherian等[18]使用鱼胶与乳清分离蛋白(whey protein isolate,WPI)为乳化剂,以鱼油为油相,采用LBL沉积法制备水包油双层乳液,增强鱼油的氧化稳定性,并将其应用于牛奶、柑橘饮料等食品的加工中。蛋白质具有良好的乳化性,可以很好地包埋功能性成分等活性物质,蛋白质-蛋白质形式的双层乳液界面层因其食品级的原料来源以及易于消化的特性,十分适用于人类食品的加工与新型食品的开发。但是由于双层界面层均为蛋白质,相对于界面层为非蛋白质成分(如多糖)的双层乳液,较易因外界环境导致蛋白变性,从而影响到乳液的结构稳定性。
天然多糖种类繁多,且具有不同的结构和性质,以两种多糖组合制备双层乳液可以增强其理化稳定性[19]。García-Márquez等[13]采用LBL静电吸附法,以带阳离子的磷酸钙-壳聚糖复合材料为内层,带阴离子的甜荚豆胶为外层制备双层乳液,对类胡萝卜素进行包埋。结果表明,当磷酸钙-壳聚糖复合物与甜荚豆胶的质量比为1∶10时,乳液以及所包埋类胡萝卜素的理化稳定性有明显提高。Krstonošić等[14]研究了用质量分数10%辛烯基琥珀酸淀粉钠制备的初级乳液与黄原胶的相互作用,结果表明,乳液稳定性的增强与界面层的厚度和乳液黏度的增加有关。Choi等[20]采用自组装的方法制备藻酸盐-壳聚糖双层纳米乳液包埋辣椒精油以增强其稳定性,所制得的纳米乳液粒径小于20 nm,具有较好的理化稳定性。Hou Zhanqun等[15]以可溶性大豆多糖为界面层内层,壳聚糖为外层,制备双层乳液包埋β-胡萝卜素,发现壳聚糖溶液质量分数对乳液结构的稳定性有重要影响,当壳聚糖质量分数低于0.33%时,乳液液滴粒径随着壳聚糖质量分数的增加而显著升高;当壳聚糖质量分数高于0.33%时,粒径随壳聚糖质量分数的升高而降低,且在壳聚糖质量分数为0.50%时达到最小值,此时乳液稳定性最好,β-胡萝卜素的降解率最低。此外,壳聚糖的分子质量对β-胡萝卜素乳液的稳定性也有影响[21]。以多糖为乳化剂制备的双层乳液对环境应力的抵抗较强,但是多糖乳化性能相对蛋白质较差,要制备出液滴粒径较小且自身结构较为稳定的乳液往往需要较高浓度的多糖[22],此外,部分多糖的甜味会对食品的风味造成一定的影响。
蛋白质和多糖都属于功能性生物聚合物,具有良好的乳化性[23]。蛋白质稳定的乳液液滴粒径较小且分布均匀,但易受环境影响;多糖稳定的乳液可以在较宽的pH值范围内以及高离子强度下保持稳定[7,24-26],可以较好地抵抗环境应力对乳液稳定性造成的影响,但其乳化性相对弱于蛋白质。以蛋白质与多糖结合制备双层乳液可以更好地发挥两种物质的优势,同时避免不利的影响[27]。
蛋白质-多糖双层乳液的结构更为稳定。Gharsallaoui等[25]采用LBL静电沉积法,向豌豆分离蛋白稳定的乳液中添加果胶制备双层乳液,当pH值较低或是果胶含量较少时会发生桥接絮凝,其余条件下乳液稳定。增大果胶浓度,可提高果胶在单层乳液液滴表面的覆盖度,同时增加乳液的黏度,有效抑制桥接絮凝的发生,提升其物理稳定性[28]。以蛋白质-多糖结合制备双层乳液具有更好的控释性,更加适用于食品领域功能性成分的传递。Lim等[7]的研究发现,以WPI和阿拉伯胶包埋葵花籽油制备的双层乳液在胃环境下(pH值约为0.9~1.8)絮凝,包埋在油相中的活性成分被很好地保护起来,并在pH值相对较高(约5.0~7.0)的小肠中发生解絮凝,从而促进了功能性成分的释放和吸收。Qiu Chaoying等[29]进行了以小麦醇溶蛋白/黄原胶、小麦醇溶蛋白/果胶稳定的双层乳液与单一成分稳定的单层乳液的胃和小肠的消化实验,结果表明,双层乳液在胃与小肠中有着更高的油脂消化率,这是因为双层界面层有效抑制了乳液液滴的聚集,增大了油脂液滴与胃肠道分泌物接触的比表面积。Pinheiro等[30]使用乳铁蛋白/藻酸盐制备姜黄素双层纳米乳液进行动态胃肠道模型消化实验,并与单一乳铁蛋白稳定的单层乳液进行对比,发现双层乳液包埋的姜黄素具有更高的生物利用度。蛋白质-多糖双层乳液有着良好的氧化稳定性以及对所包埋活性成分的保护能力。研究表明,油滴表面形成的带有正电荷且具有一定厚度的界面层可对促氧化剂以及脂质过氧化物起到阻隔作用[31-32]。Zhao Jingjing等[16]利用乳铁蛋白制备单层乳液包埋橙油,再分别以可溶性大豆多糖和甜菜果胶制备双层乳液,并对比研究单层乳液以及两种双层乳液橙油的氧化稳定性,结果表明乳铁蛋白/甜菜果胶双层乳液对所包埋物的保护作用最强。此外,Xiang Jun等[26]还发现了乳铁蛋白/甜菜果胶双层乳液在25 ℃贮存条件下的氧化稳定性有明显增强。
由于蛋白质的表面活性较强,更易于在油-水界面形成稳定的界面层,因此,通常将蛋白质作为内层;而多糖对环境条件(pH值、离子强度、温度等)的耐受力较强,并且能够通过改善分散相的流变学特性来防止絮凝和聚沉,因此第2层通常采用带相反电荷的多糖[33]。蛋白质-多糖双层乳液特点突出,可根据实际条件选择合适的材料组合。
近年来,将蛋白质或多糖与小分子乳化剂如吐温、司盘、卵磷脂等结合制备双层乳液应用于食品领域的研究较多,具有较大的发展潜力。这类小分子乳化剂具有良好的乳化性能以及扩散、稳定、增溶等作用,在食品工业的乳液型食品、饮料产品以及功能性食品研发等领域中具有广阔的发展前景[34-35]。Jiménez-Martín等[36]分别以卵磷脂和卵磷脂/壳聚糖为乳化剂制备包埋鱼油的单层和双层乳液,结果表明,双层乳液的稳定性高于单层乳液,且用卵磷脂/壳聚糖双层乳液制备的微胶囊对鱼油有很好的保护能力。Li Yan等[37]研究了吐温20作为一种辅助表面活性剂对以β-lg为乳化剂的单层乳液以及以藻酸盐/壳聚糖为乳化剂的双层乳液的影响,结果表明,添加吐温20能够减小乳液液滴粒径、提高乳液的稳定性以及促进油脂的消化。小分子乳化剂的添加降低了乳化剂的总体用量,提升了乳化效果,但一些小分子乳化剂作为食品添加剂使用时应严格按照国标要求适量添加,注意食品安全。
蛋白质、多糖可以通过共价交联制备共价复合物,该共价复合物可以作用于乳液液滴表面形成双层结构以提高乳液的理化稳定性以及控释能力等。表2所示为近年来研究人员对蛋白质-多糖共价复合物制备双层乳液进行的研究。蛋白质与多糖的共价复合可通过美拉德反应或酶诱导来实现[38]。
蛋白质-多糖共价复合物通过多糖的羰基与蛋白质的氨基之间发生美拉德反应得到,如图2所示。Xu Duoxia等[47]分别以卵白蛋白与高甲氧基果胶的共价复合物以及普通物理混合物制备乳液,发现使用共价复合物稳定的双层乳液具有更高的稳定性以及黏度[49]。此外,蛋白质-多糖共价复合物可以提高所包埋的功能活性物质如β-胡萝卜素等的氧化稳定性并增加其水溶性。Xu Duoxia等[47]采用WPI-甜菜果胶的美拉德共价复合物作为乳化剂制备双层乳液包埋β-胡萝卜素,并将之与单独使用WPI和WPI/甜菜果胶混合物作为乳化剂所得的β-胡萝卜素乳液进行对比,结果发现,由共价复合物制备的乳液具有较好的物理稳定性,该共价复合物形成了更厚、更致密的界面层,且具有阻氧作用,可以更好地保护β-胡萝卜素不受各种环境因素的影响,减少了β-胡萝卜素的降解。蛋白质与多糖美拉德反应的共价复合可通过湿热法、干热法以及分子聚集法进行诱导,所制得的共价复合物双层乳液具有良好的稳定性。此外,其制备过程可与食品加工生产过程中的美拉德反应结合,一方面可以降低生产工艺对食品成分的破坏;另一方面也可以将包埋工艺融入现有生产流程[50]。
表2 蛋白质-多糖共价复合物制备双层乳液
Table2 Double layer emulsions stabilized by protein-polysaccharide conjugates

油相 共价复合双层 对比乳化剂 包埋功能因子蛋白质 多糖大豆油 水解大豆蛋白 葡聚糖、麦芽糊精 大豆多肽[39]—橙油 β-lg、WPI 玉米纤维胶(corn fiber glue,CFG) WPI、β-lg、CFG[40]—菜籽油 豌豆分离蛋白 果胶 果胶[41]—番茄油树脂 大豆分离蛋白(soy protein isolate,SPI) 阿拉伯胶 阿拉伯胶/SPI混合物 番茄红素[42]菜籽油 大豆乳清分离蛋白 香豆胶 大豆乳清分离蛋白/香豆胶混合物、香豆胶[43]—大豆油 燕麦分离蛋白(oat protein isolate,OPI) 葡聚糖 天然OPI、加热OPI[44]—大豆油 酪蛋白酸钠 麦芽糊精 酪蛋白酸钠、酪蛋白酸钠/麦芽糊精混合物[45]—菜籽油 脱酰胺小麦蛋白 葡聚糖[46]— —MCT WPI 甜菜果胶 WPI/甜菜果胶混合物 β-胡萝卜素[47]大豆油白蛋白 牛血清白蛋白(bovine serum albumin,BSA) CFG BSA[38]—玉米油 β-伴大豆球蛋白 葡聚糖 β-伴大豆球蛋白、酶水解β-伴大豆球蛋白-葡聚糖复合物[48]—
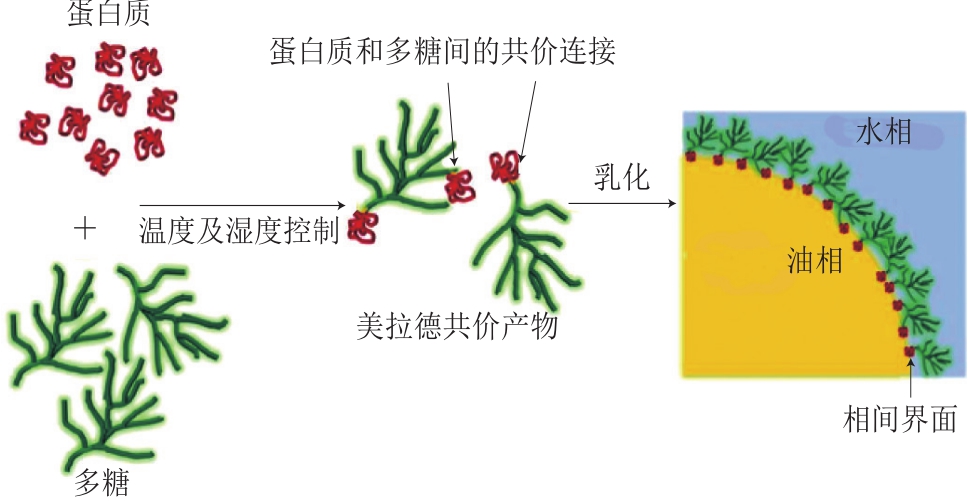
图2 蛋白质-多糖美拉德反应及其产物在乳液中的应用[8]
Fig.2 Schematic representation of Maillard reaction of protein and carbohydrate and application in emulsion[8]
蛋白质-多糖共价复合物也可通过酶诱导制备,相比于美拉德反应,酶诱导需要的反应物更少,反应速度更快[38]。Liu Yan等[38]利用辣根过氧化物酶交联BSA和CFG,制得BSA-CFG共价复合物,所得复合物具有比BSA和CFG更好的乳化性,且在大范围的pH值、冻融循环以及高离子强度条件下具有良好的稳定性。Zeeb等[51]以明胶和甜菜果胶制备双层乳液,并以漆酶交联明胶和甜菜果胶,研究其所包埋的脂质在人体胃肠道内的消化特性,发现通过改变乳液油滴表面结构可以改变油脂的消化率,控制液滴在人体消化系统中定点释放所包埋的活性成分,这对于功能性食品的开发具有重要意义。
溶液的pH值决定了乳液液滴表面基团的电离,从而决定了其表面的电荷密度[52],进而影响界面层的性质。通过控制溶液的pH值可以控制聚合物在液滴表面的覆盖程度。例如在pH 7时,由于多糖和乳液液滴之间的静电斥力较大,阴离子果胶无法吸附于由酪蛋白酸钠包裹的液滴表面;而在pH 3时,多糖和液滴表面具有相反的电荷,果胶可以吸附于酪蛋白酸钠包裹的液滴表面,形成双层乳液[53]。此外,乳液界面层的性质可以通过调整pH值来改变。乳液pH值的变化能够改变液滴表面和吸附的界面层、界面层之间以及界面层和未吸附的聚电解质之间的相互作用,由此而改变界面层的厚度及完整性。
溶液的离子强度决定了分子内和分子间静电相互作用的强度和范围,因此决定了多层乳液多层界面层的形成过程、结构以及厚度。随着溶液离子强度的增加,聚电解质和乳液液滴之间的静电相互作用的强度和范围会减小,这是因为液滴表面周围反离子的积累,这种现象被称为静电屏蔽。当溶液中反离子的浓度和原子价升高时,静电屏蔽效果随之增强[54]。Mao Like等[55]使用WPI和果胶以LBL静电吸附制备双层乳液,并研究了离子强度对乳液的影响,发现在pH 5条件下,当NaCl浓度大于150 mmol/L时,由于静电屏蔽现象,双层乳液结构开始被破坏。Zeeb等[56]采用LBL静电吸附,以明胶和果胶制备双层乳液,并研究了NaCl对乳液的影响,对比了添加和不添加NaCl以及添加不同浓度NaCl溶液的乳液粒径,结果表明,添加NaCl溶液降低了乳液界面层的厚度,随着NaCl浓度的增加乳液界面层厚度降低。
溶剂质量是双层乳液形成过程中的一个重要参数,改变溶剂的介电常数,会导致静电相互作用的强度以及各种疏水相互作用的相互影响发生变化[57]。有研究人员研究了溶剂质量对聚电解质多层膜厚度和结构的影响,并通过石英晶体微天平和表面等离子体共振技术证实,随着溶剂质量的降低,膜厚度和包埋量增加。溶剂是除pH值和离子强度外对膜的厚度、孔隙以及渗透率等参数外的另一影响因素,溶剂质量的改变可独立作用,也可与pH值和离子强度结合作用,以达到精确制备界面层的目的[58-59]。但是目前有关溶剂质量对多层乳液界面层影响的研究相对较少,因此需要进一步探索其对多层食品乳液的形成与性质的影响。
双层乳液中第1层界面层的电学性质由乳化剂决定,因此可以通过选择不同类型的乳化剂来进行控制。在食品工业中可以使用多种不同的乳化剂,包括表面活性剂(如吐温、司盘等)、磷脂、蛋白质和多糖等。不同的乳化剂具有不同的电特性,能够影响双层界面的形成和相关特性。通常情况下,由非离子表面活性剂形成的乳液液滴带有不同正负性的电荷,在高pH值条件下为负,低pH值条件下为正。
许多不同的食品级阴离子表面活性剂如卵磷脂、脂肪酸盐、二乙酰酒石酸单甘脂以及硬脂酰乳酸酯等可用来制备具有带负电荷液滴的初级乳液,而食品级阳离子表面活性剂较少,表面活性剂包覆的乳液液滴所带电荷可以通过具有不同电特性的表面活性剂来调节,如添加蛋白质作为乳化剂[54]。蛋白质可通过改变溶液的pH值而改变其电荷的正负性,通常,当溶液的pH值在等电点以下时带正电,在等电点以上时带负电。不同的蛋白质具有不同的等电点;因此,可以通过选择在所需溶液pH值条件下具有所需电学性质的蛋白质来改变单层乳液中液滴的电特性。多糖乳化剂(如阿拉伯胶和淀粉)一般形成较厚的阴离子界面层。
4.1.1 极端pH值条件下的稳定性
在实际食品乳液中,水相的pH值可以是酸性(如一些软饮料的pH值为2.5~4.0),也可以是弱碱性(如一些乳制品的pH值为7.0~7.4),此外,在产品的生产、存储、运销以及食用期间,其pH值都有可能发生变化。pH值的改变会影响到乳液结构的稳定性,从而影响产品的质量。双层界面层可以提高乳液在不同pH值环境下的稳定性。Lim等[7]使用WPI和阿拉伯胶包埋葵花籽油制备双层乳液,发现其在胃中的酸性环境(pH 0.9~1.8)下能够保持包埋结构稳定。
4.1.2 热力学稳定性
乳液为热力学不稳定系统,但是食品乳液在应用过程中经常需要经过热加工,如巴氏杀菌、灭菌或烹饪,这就要求提高乳液的热稳定性。而双层乳液可以显著提高乳液的热稳定性。有研究显示,以阴离子表面活性剂和阳离子聚电解质包埋于乳液液滴之上的双层乳液在30~90 ℃条件下能够保持稳定,例如十二烷基硫酸钠/壳聚糖[60]、卵磷脂/壳聚糖[61]以及十二烷基硫酸钠/明胶[62]等,这些双层乳液的热稳定性显著高于其初级乳液。此外,以果胶和β-lg制备的双层乳液的热稳定性与β-lg乳液相比有明显提高[47]。
4.1.3 冻融稳定性
冷藏是食品运销与保藏的主要方法之一,冷藏可以通过抑制微生物的生长与不良反应(如脂质氧化)的发生从而保护产品的品质。在乳制品、甜点、冰淇淋等食品中应用的乳液通常需要良好的冻融稳定性,然而许多水包油乳液在冷藏或冷冻过程中并不稳定,且在再加热后结构被破坏。而双层乳液可以显著提高乳液的冻融稳定性。Zhang Zeyu等[63]用SPI和葡聚糖的美拉德反应共价复合物制备双层乳液,并研究了该双层乳液与SPI乳液、SPI/葡聚糖混合物乳液的冻融稳定性,发现双层乳液的冻融稳定性较另外两种乳液有显著提高。
4.1.4 氧化稳定性
乳液作为一种传递系统,在包埋含有多不饱和脂肪酸等易于氧化的功能性成分时,需要其对所包埋的成分提供一定的抗氧化保护。双层乳液包埋可以很好地提高功能性成分的氧化稳定性,使其在传递过程中减少因氧化造成的损失。白藜芦醇作为一种具有多种生理保健功能的天然酚类化合物,是近年来研究的热点,然而较差的水溶性和化学不稳定性限制了其开发与应用。Acevedo-Fani等[64]以乳铁蛋白/藻酸盐制备白藜芦醇双层乳液,并将之与未被包埋的白藜芦醇进行对比,发现未被包埋的白藜芦醇的抗氧化活性随着贮存时间的延长(检测时间为0~4 周)而降低,而被双层乳液包埋的白藜芦醇的抗氧化活性随着贮存时间的延长基本没有变化,这说明双层乳液对易于氧化的功能性成分有较好的保护效果。
4.1.5 控释能力
双层乳液复杂的双界面层结构可对外界环境因素的改变作出响应以达到控释的目的。Benjamin等[65]以β-lg和果胶包埋易挥发性活性成分制备双层乳液,并进行了模拟消化实验,发现初级乳液在模拟口腔中受唾液影响而将活性物质快速释放,而双层乳液在口腔中基本保持稳定,在胃肠道中将包埋物质释放。与此类似的研究还有Xu Duoxia等[66]使用WPI和果胶制备β-胡萝卜素双层乳液,并进行模拟消化实验,结果表明,双层乳液包埋的油相和β-胡萝卜素被缓慢释放,且较厚的双层界面层抑制了脂肪酶的渗透,因此延缓了脂质的消化[67-68]。双层乳液可通过设计而能够耐受极端的pH值与高离子强度,并且可以抑制或避免包埋物质在胃中释放,以提高功能性成分的生物利用率。
双层乳液具有良好的理化稳定性以及对包埋成分的保护性,一方面可以稳定食品基质结构,防止因环境应力如pH值、离子强度、热加工、冷冻等对产品品质的破坏;另一方面可以包埋易受环境因素影响而破坏或降解的富含多不饱和脂肪酸的油脂和具有生理保健功能的生物活性物质,开发与制备功能性食品。Jiménez-Martín等[36]进行了双层乳液包埋ω-3脂肪酸并通过喷雾干燥法制备微胶囊的研究,发现包埋提高了ω-3脂肪酸的理化稳定性以及溶解性,据此,可以将双层乳液应用于包埋鱼油等,为功能性油脂的加工、保藏以及新型含油脂功能食品的开发提供新的方向。结合Semyonov等[69]的喷雾冷冻干燥制备益生菌微胶囊的研究以及Zhang Zeyu等[63]双层乳液可提高冻融稳定性的研究,可使用双层乳液包埋益生菌并制备微胶囊,从而进行功能性冰淇淋、奶酪等新型食品的开发与生产。近年来,研究人员以双层乳液对多种生物活性成分如β-胡萝卜素[6,70-71]、白藜芦醇[64]、番茄红素[42]、叶黄素[72]等进行包埋并评价其理化稳定性,发现双层乳液对这些功能性成分具有良好的保护、传递以及控释效果。因此,双重乳液可应用于保健品、功能食品甚至药品的开发和生产。
多种蛋白质、多糖以及食品小分子乳化剂之间相互组合,通过静电吸附或共价复合作用,可以制备双层乳液。双层乳液在绝大部分条件下拥有比一般乳液更好的理化稳定性与适用性,可以应用于食品的研发、生产加工、贮运、销售甚至人体消化过程中,在食品领域具有广阔的发展前景。例如其对所包埋成分良好的保护能力可以降低生产和贮运成本,也能延长相应食品的保质期;其良好的控释性可以提高一些功能性食品的效果、提升产品利润等。双层乳液及多层乳液的研究对食品工业生产以及新型功能性食品的开发具有重要意义。然而双层乳液的材料、技术及其在更加复杂的食品体系中的应用等方面还需进一步的研究,如开发出适用于双层乳液制备的新型低成本材料;进一步研究各种乳化剂在复杂的食品体系中与各种食品材料间有利与不利的反应;产学结合,将研究成果更好地应用于实际产品的开发与生产;跨领域发展,与制药、材料等领域结合,研发新型药品或环保包装材料;在双层乳液的基础上对3 层乳液甚至4 层乳液等多层乳液的开发与应用进行研究。
[1] MCCLEMENTS D, DECKER E, WEISS J. Emulsion-based delivery systems for lipophilic bioactive components[J]. Journal of Food Science,2007, 72(8): 109-124. DOI:10.1111/j.1750-3841.2007.00507.x.
[2] ĐORĐEVIĆ V, BALANČ B, BELŠČAK-CVITANOVIĆ A, et al.Trends in encapsulation technologies for delivery of food bioactive compounds[J]. Food Engineering Reviews, 2015, 7(4): 452-490.DOI:10.1007/s12393-014-9106-7.
[3] LIU Fuguo, WANG Di, SUN Cuixia, et al. Utilization of interfacial engineering to improve physicochemical stability of β-carotene emulsions: multilayer coatings formed using protein and proteinpolyphenol conjugates[J]. Food Chemistry, 2016, 205: 129-139.DOI:10.1016/j.foodchem.2016. 02.155.
[4] XIANG Ning, LYU Yuan, NARSIMHAN G. Characterization of fish oil in water emulsion produced by layer by layer deposition of soy β-conglycinin and high methoxyl pectin[J]. Food Hydrocolloids, 2016,52: 678-689.
[5] 柳艳梅. 基于OSA变性淀粉: 壳聚糖双层乳液制备及在β-胡萝卜素微胶囊中应用[D]. 杭州: 浙江工商大学, 2017: 14-31.
[6] WEI Zihao, GAO Yanxiang. Physicochemical properties of β-carotene bilayer emulsions coated by milk proteins and chitosan: EGCG conjugates[J]. Food Hydrocolloids, 2016, 52: 590-599. DOI:10.1016/j.foodhyd.2015.08.002.
[7] LIM A S L, ROOS Y H. Stability of flocculated particles in concentrated and high hydrophilic solid layer-by-layer (LBL)emulsions formed using whey proteins and gum Arabic[J].Food Research International, 2015, 74: 160-167. DOI:10.1016/j.foodres.2015.04.043.
[8] SIVAPRATHA S, SARKAR P. Multiple layers and conjugate materials for food emulsion stabilization[J]. Critical Reviews in Food Science and Nutrition, 2018, 58(6): 877-892. DOI:10.1080/10408398.2016.1227765.
[9] DIMA Ş, DIMA C, IORDĂCHESCU G. Encapsulation of functional lipophilic food and drug biocomponents[J]. Food Engineering Reviews, 2015, 7(4): 417-438. DOI:10.1007/s12393-015-9115-1.
[10] SCHMELZ T, LESMES U, WEISS J, et al. Modulation of physicochemical properties of lipid droplets using β-lactoglobulin and/or lactoferrin interfacial coatings[J]. Food Hydrocolloids, 2011, 25(5):1181-1189. DOI:10.1016/j.foodhyd.2010.11.005.
[11] LESMES U, SANDRA S, DECKER E A, et al. Impact of surface deposition of lactoferrin on physical and chemical stability of omega-3 rich lipid droplets stabilised by caseinate[J]. Food Chemistry, 2010,123(1): 99-106. DOI:10.1016/j.foodchem.2010.04.007.
[12] TIPPETTS M, SHEN F K, MARTINI S, et al. Oil globule microstructure of protein/polysaccharide or protein/protein;bilayer emulsions at various pH[J]. Food Hydrocolloids, 2013, 30(2): 559-566. DOI:10.1016/j.foodhyd.2012.07.012.
[13] GARCÍA-MÁRQUEZ E, ROMÁN-GUERRERO A, CRUZSOSA F, et al. Effect of layer (calcium phosphate–chitosan)-bylayer (mesquite gum) matrix on carotenoids-in-water-emulsion properties[J]. Food Hydrocolloids, 2015, 43: 451-458. DOI:10.1016/j.foodhyd.2014.07.005.
[14] KRSTONOŠIĆ V, DOKIĆ L, NIKOLIĆ I, et al. Influence of xanthan gum on oil-in-water emulsion characteristics stabilized by OSA starch[J]. Food Hydrocolloids, 2015, 45: 9-17. DOI:10.1016/j.foodhyd.2014.10.024.
[15] HOU Zhanqun, GAO Yanxiang, YUAN Fang, et al. Investigation into the physicochemical stability and rheological properties of betacarotene emulsion stabilized by soybean soluble polysaccharides and chitosan[J]. Journal of Agricultural and Food Chemistry, 2010, 58(15):8604-8611. DOI:10.1021/jf1015686.
[16] ZHAO Jingjing, WEI Tong, WEI Zihao, et al. Influence of soybean soluble polysaccharides and beet pectin on the physicochemical properties of lactoferrin-coated orange oil emulsion[J]. Food Hydrocolloids, 2015, 44: 443-452. DOI:10.1016/j.foodhyd.2014.10.025.
[17] MAO Yingyi, DUBOT M, XIAO Hang, et al. Interfacial engineering using mixed protein systems: emulsion-based delivery systems for encapsulation and stabilization of β-carotene[J]. Journal of Agricultural and Food Chemistry, 2013, 61(21): 5163-5169. DOI:10.1021/jf401350t.
[18] TAHERIAN A R, BRITTEN M, SABIK H, et al. Ability of whey protein isolate and/or fish gelatin to inhibit physical separation and lipid oxidation in fish oil-in-water beverage emulsion[J].Food Hydrocolloids, 2011, 25(5): 868-878. DOI:10.1016/j.foodhyd.2010.08.007.
[19] RAMÍREZ-SANTIAGO C, LOBATO-CALLEROS C, ESPINOSAANDREWS H, et al. Viscoelastic properties and overall sensory acceptability of reduced-fat Petit-Suisse cheese made by replacing milk fat with complex coacervate[J]. Dairy Science & Technology,2012, 92(4): 383-398. DOI:10.1007/s13594-012-0077-2.
[20] CHOI A J, KIM C J, CHO Y J, et al. Characterization of capsaicinloaded nanoemulsions stabilized with alginate and chitosan by selfassembly[J]. Food and Bioprocess Technology, 2011, 4(6): 1119-1126.DOI:10.1007/s11947-011-0568-9.
[21] HOU Zhanqun, ZHANG Man, LIU Bing, et al. Effect of chitosan molecular weight on the stability and rheological properties of β-carotene emulsions stabilized by soybean soluble polysaccharides[J].Food Hydrocolloids, 2012, 26(1): 205-211. DOI:10.1016/j.foodhyd.2011.05.013.
[22] OGAWA S, DECKER A E, MCCLEMENTS D J. Production and characterization of O/W emulsions containing droplets stabilized by lecithin-chitosan-pectin mutilayered membranes[J]. Journal of Agricultural and Food Chemistry, 2004, 52(11): 3595-3600.DOI:10.1021/jf034436k.
[23] NAJAFI M N, HOSAINI V, MOHAMMADI-SANI A, et al. Physical stability, flow properties and droplets characteristics of Balangu(Lallemantia royleana) seed gum/whey protein stabilized submicron emulsions[J]. Food Hydrocolloids, 2016, 59: 2-8. DOI:10.1016/j.foodhyd.2016.02.017.
[24] DICKINSON E. Interfacial structure and stability of food emulsions as affected by protein-polysaccharide interactions[J]. Soft Matter, 2008,4(5): 932-942. DOI:10.1039/b718319d.
[25] GHARSALLAOUI A, YAMAUCHI K, CHAMBIN O, et al. Effect of high methoxyl pectin on pea protein in aqueous solution and at oil/water interface[J]. Carbohydrate Polymers, 2010, 80(3): 817-827.DOI:10.1016/j.carbpol.2009.12.038.
[26] XIANG Jun, LIU Fuguo, FAN Rui, et al. Physicochemical stability of citral emulsions stabilized by milk proteins (lactoferrin, α-lactalbumin,β-lactoglobulin) and beet pectin[J]. Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2015, 487: 104-112.DOI:10.1016/j.colsurfa.2015.09.033.
[27] BENGOECHEA C, JONES O G, GUERRERO A, et al. Formation and characterization of lactoferrin/pectin electrostatic complexes: impact of composition, pH and thermal treatment[J]. Food Hydrocolloids,2011, 25(5): 1227-1232. DOI:10.1016/j.foodhyd.2010.11.010.
[28] KALTSA O, PAXIMADA P, MANDALA I, et al. Physical characteristics of submicron emulsions upon partial displacement of whey protein by a small molecular weight surfactant and pectin addition[J]. Food Research International, 2014, 66: 401-408.DOI:10.1016/j.foodres.2014.10.005.
[29] QIU Chaoying, ZHAO Mouming, DECKER E A, et al. Influence of anionic dietary fibers (xanthan gum and pectin) on oxidative stability and lipid digestibility of wheat protein-stabilized fish oil-inwater emulsion[J]. Food Research International, 2015, 74: 131-139.DOI:10.1016/j.foodres.2015.04.022.
[30] PINHEIRO A C, COIMBRA M A, VICENTE A A. In vitro behaviour of curcumin nanoemulsions stabilized by biopolymer emulsifiers:effect of interfacial composition[J]. Food Hydrocolloids, 2016, 52:460-467. DOI:10.1016/j.foodhyd.2015.07.025.
[31] MCCLEMENTS D J, DECKER E A. Lipid oxidation in oil-in-water emulsions: impact of molecular environment on chemical reactions in heterogeneous food systems[J]. Journal of Food Science, 2000, 65(8):1270-1282. DOI:10.1111/j.1365-2621.2000.tb10596.x.
[32] SCHEFFLER S L, WANG X, HUANG L, et al. Phytoglycogen octenyl succinate, an amphiphilic carbohydrate nanoparticle, and ε-polylysine to improve lipid oxidative stability of emulsions[J].Journal of Agricultural and Food Chemistry, 2010, 58(1): 660-667.DOI:10.1021/jf903170b.
[33] TIPPETTS M, SHEN F K, MARTINI S. Oil globule microstructure of protein/polysaccharide or protein/protein bilayer emulsions at various pH[J]. Food Hydrocolloids, 2013, 30(2): 559-566. DOI:10.1016/j.foodhyd.2012.07.012.
[34] HASENHUETTL G L, HARTEL R W. Food emulsifiers and their applications[M]. New York: Springer, 2008: 63-156.DOI:10.1007/978-0-387-75284-6.
[35] KRALOVA I, SJÖBLOM J. Surfactants used in food industry: a review[J]. Journal of Dispersion Science and Technology, 2009, 30(9):1363-1383. DOI:10.1080/01932690902735561.
[36] JIMÉNEZ-MARTÍN E, GHARSALLAOUI A, PÉREZ-PALACIOS T, et al. Suitability of using monolayered and multilayered emulsions for microencapsulation of ω-3 fatty acids by spray drying: effect of storage at different temperatures[J]. Food & Bioprocess Technology,2015, 8(1): 100-111. DOI:10.1007/s11947-014-1382-y.
[37] LI Yan, MCCLEMENTS D J. Influence of cosurfactant on the behavior of structured emulsions under simulated intestinal lipolysis conditions[J]. Food Hydrocolloids, 2014, 40: 96-103. DOI:10.1016/j.foodhyd.2014.02.007.
[38] LIU Yan, QIU Shuang, LI Jinlong, et al. Peroxidase-mediated conjugation of corn fiber gum and bovine serum albumin to improve emulsifying properties[J]. Carbohydrate Polymers, 2015, 118: 70-78.DOI:10.1016/j.carbpol.2014.10.059.
[39] LI Weiwei, ZHAO Haibo, HE Zhiyong, et al. Modification of soy protein hydrolysates by Maillard reaction: effects of carbohydrate chain length on structural and interfacial properties[J]. Colloids and Surfaces B: Biointerfaces, 2016, 138: 70-77. DOI:10.1016/j.colsurfb.2015.11.038.
[40] YADAV M P, PARRIS N, JOHNSTON D B, et al. Corn fiber gum and milk protein conjugates with improved emulsion stability[J].Carbohydrate Polymers, 2010, 81(2): 476-483. DOI:10.1016/j.carbpol.2010.03.003.
[41] TAMNAK S, MIRHOSSEINI H, TAN C P, et al. Physicochemical properties, rheological behavior and morphology of pectin-pea protein isolate mixtures and conjugates in aqueous system and oil in water emulsion[J]. Food Hydrocolloids, 2016, 56: 405-416. DOI:10.1016/j.foodhyd.2015.12.033.
[42] LI Chen, WANG Jie, SHI Jing, et al. Encapsulation of tomato oleoresin using soy protein isolate-gum aracia conjugates as emulsifier and coating materials[J]. Food Hydrocolloids, 2015, 45: 301-308.DOI:10.1016/j.foodhyd.2014.11.022.
[43] KASRAN M, CUI S W, GOFF H D. Emulsifying properties of soy whey protein isolate-fenugreek gum; conjugates in oil-in-water emulsion model system[J]. Food Hydrocolloids, 2013, 30(2): 691-697.DOI:10.1016/j.foodhyd.2012.09.002.
[44] ZHANG Bei, GUO Xiaona, ZHU Kexue, et al. Improvement of emulsifying properties of oat protein isolate-dextran conjugates by glycation[J]. Carbohydrate Polymers, 2015, 127: 168-175.DOI:10.1016/j.carbpol.2015.03.072.
[45] O’REGAN J, MULVIHILL D M. Heat stability and freeze-thaw stability of oil-in-water emulsions stabilised by sodium caseinatemaltodextrin conjugates[J]. Food Chemistry, 2010, 119(1): 182-190.DOI:10.1016/j.foodchem.2009.06.019.
[46] WONG B T, DAY L, AUGUSTIN M A. Deamidated wheat protein-dextran Maillard conjugates: effect of size and location of polysaccharide conjugated on steric stabilization of emulsions at acidic pH[J]. Food Hydrocolloids, 2011, 25(6): 1424-1432. DOI:10.1016/j.foodhyd.2011.01.017.
[47] XU Duoxia, WANG Xiaoya, JIANG Junping, et al. Impact of whey protein: beet pectin conjugation on the physicochemical stability of β-carotene emulsions[J]. Food Hydrocolloids, 2012, 28(2): 258-266.DOI:10.1016/j.foodhyd.2012.01.002.
[48] ZHANG Jinbo, WU Nana, YANG Xiaoquan, et al. Improvement of emulsifying properties of Maillard reaction products from β-conglycinin and dextran using controlled enzymatic hydrolysis[J]. Food Hydrocolloids,2012, 28(2): 301-312. DOI:10.1016/j.foodhyd.2012.01.006.
[49] AL-HAKKAK J, AL-HAKKAK F. Functional egg white-pectin conjugates prepared by controlled Maillard reaction[J]. Journal of Food Engineering, 2010, 100(1): 152-159. DOI:10.1016/j.jfoodeng.2010.03.040.
[50] ZHUO Xiuying, QI Junru, YIN Shouwei, et al. Formation of soy protein isolate-dextran conjugates by moderate Maillard reaction in macromolecular crowding conditions[J]. Journal of the Science of Food and Agriculture, 2013, 93(2): 316-323. DOI:10.1002/jsfa.5760.
[51] ZEEB B, LOPEZ-PENA C L, WEISS J, et al. Controlling lipid digestion using enzyme-induced crosslinking ofbiopolymer interfacial layers in multilayer emulsions[J]. Food Hydrocolloids, 2015, 46: 125-133. DOI:10.1016/j.foodhyd.2014.12.018.
[52] ISRAELACHVILI J N. Intermolecular and surface forces[M]. New York:Academic Press, 1985: 213-254. DOI:10.1016/C2009-0-21560-1.
[53] KARTAL C, UNAL M K, OTLES S. Flaxseed oil-in-water emulsions stabilized by multilayer membranes: oxidative stability and the effects of pH[J]. Journal of Dispersion Science & Technology, 2016, 37(12):1683-1691. DOI:10.1080/01932691.2016.1141294.
[54] MCCLEMENTS D J. Food emulsions: principles, practices, and techniques[M]. Boca Raton: CRC Press, 2015: 334-349.
[55] MAO Like, ROOS Y H, O’CALLAGHAN D J, et al. Volatile release from whey protein isolate-pectin multilayer stabilized emulsions:effect of pH, salt, and artificial salivas[J]. Journal of Agricultural and Food Chemistry, 2013, 61(26): 6231-6239. DOI:10.1021/jf4011615.
[56] ZEEB B, WEISS J, MCCLEMENTS D J. Electrostatic modulation and enzymatic cross-linking of interfacial layers impacts gastrointestinal fate of multilayer emulsions[J]. Food Chemistry, 2015, 180: 257-264.DOI:10.1016/j.foodchem.2015.02.048.
[57] DOBRYNIN A V. Effect of solvent quality on polyelectrolyte adsorption at an oppositely charged surface[J]. Journal of Chemical Physics, 2001, 114(18): 8145-8153. DOI:10.1063/1.1350818.
[58] BORGES J, MANO J F. Molecular interactions driving the layer-bylayer assembly of multilayers[J]. Chemical Reviews, 2014, 114(18):8883-8942. DOI:10.1021/cr400531v.
[59] POPTOSHEV E, SCHOELER B, CARUSO F. Influence of solvent quality on the growth of polyelectrolyte multilayers[J]. Langmuir,2004, 20(3): 829-834. DOI:10.1021/la035485u.
[60] AOKI T, DECKER E A, MCCLEMENTS D J. Influence of environmental stresses on stability of O/W emulsions containing droplets stabilized by multilayered membranes produced by a layerby-layer electrostatic deposition technique[J]. Food Hydrocolloids,2005, 19(2): 209-220. DOI:10.1016/j.foodhyd.2004.05.006.
[61] OGAWA S, DECKER E A, MCCLEMENTS D J. Influence of environmental conditions on the stability of oil in water emulsions containing droplets stabilized by lecithin-chitosan membranes[J].Journal of Agricultural and Food Chemistry, 2003, 51(18): 5522-5527.DOI:10.1021/jf026103d.
[62] SURH J, GU Y S, DECKER E A, et al. Influence of environmental stresses on stability of O/W emulsions containing cationic droplets stabilized by SDS-fish gelatin membranes[J]. Journal of Agricultural and Food Chemistry, 2005, 53(10): 4236-4244. DOI:10.1021/jf047944i.
[63] ZHANG Zeyu, WANG Xibo, YU Jie, et al. Freeze-thaw stability of oil-in-water emulsions stabilized by soy protein isolate-dextran conjugates[J]. LWT-Food Science and Technology, 2017, 78: 241-249. DOI:10.1016/j.lwt.2016.12.051.
[64] ACEVEDO-FANI A, SILVA H D, SOLIVA-FORTUNY R, et al.Formation, stability and antioxidant activity of food-grade multilayer emulsions containing resveratrol[J]. Food Hydrocolloids, 2017, 71:207-215. DOI:10.1016/j.foodhyd.2017.05.007.
[65] BENJAMIN O, SILCOCK P, BEAUCHAMP J, et al. Volatile release and structural stability of β-lactoglobulin primary and multilayer emulsions under simulated oral conditions[J]. Food Chemistry, 2013,140(1/2): 124-134. DOI:10.1016/j.foodchem.2013.02.043.
[66] XU Duoxia, YUAN Fang, GAO Yanxiang, et al. Influence of whey protein-beet pectin conjugate on the properties and digestibility of β-carotene emulsion during in vitro digestion[J]. Food Chemistry,2014, 156: 374-379. DOI:10.1016/j.foodchem.2014.02.019.
[67] GUDIPATI V, SANDRA S, MCCLEMENTS D J, et al. Oxidative stability and in vitro digestibility of fish oil-in-water emulsions containing multilayered membranes[J]. Journal of Agriculture and Food Chemistry, 2010, 58(13): 8093-8099. DOI:10.1021/jf101348c.
[68] MCCLEMENTS D J, LI Y. Structured emulsion-based delivery systems: controlling the digestion and release of lipophilic food components[J]. Advances in Colloid & Interface Science, 2010,159(2): 213-228. DOI:10.1016/j.cis.2010.06.010.
[69] SEMYONOV D, RAMON O, KAPLUN Z, et al. Microencapsulation of Lactobacillus paracasei by spray freeze drying[J]. Food Research International, 2010, 43(1): 193-202. DOI:10.1016/j.foodres.2009.09.028.
[70] LIU Fuguo, WANG Di, SUN Cuixia, et al. Utilization of interfacial engineering to improve physicochemical stability of β-carotene emulsions: multilayer coatings formed using protein and proteinpolyphenol conjugates[J]. Food Chemistry, 2016, 205: 129-139.DOI:10.1016/j.foodchem.2016.02.155.
[71] WEI Zihao, GAO Yanxiang. Physicochemical properties of β-carotene emulsions stabilized by chitosan-chlorogenic acid complexes[J]. LWTFood Science and Technology, 2016, 71: 295-301. DOI:10.1016/j.lwt.2016.04.007.
[72] XU Duoxia, AIHEMAITI Z, CAO Yanping, et al. Physicochemical stability, microrheological properties and microstructure of lutein emulsions stabilized by multilayer membranes consisting of whey protein isolate, flaxseed gum and chitosan[J]. Food Chemistry, 2016,202: 156-164. DOI:10.1016/j.foodchem.2016.01.052.
Progress in Bilayer Emulsions as a Delivery System for Functional Food Components