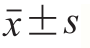 表示。采用SAS 9.1软件进行数据处理,新复极差法进行比较,以P<0.01为差异显著。
表示。采用SAS 9.1软件进行数据处理,新复极差法进行比较,以P<0.01为差异显著。施莉婷1,2,江和源1,*,张建勇1,王伟伟1,苏 威1,2
(1.中国农业科学院茶叶研究所,农业部茶树生物学与资源利用重点实验室,浙江省茶叶加工工程重点实验室,浙江 杭州 310008;2.中国农业科学院研究生院,北京 100081)
摘 要:选择不同的表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)和表儿茶素(epicatechin,EC)底物组合反应,通过酶促氧化过程得到脱氢聚酯型儿茶素A(dehydrotheasinensin A,DTSA)和茶黄素-3-没食子酸酯(theaf l avin-3-gallate,TF-3-G),探究EGCG的多条主要氧化反应途径,并探讨歧化途径与苯骈化途径的竞争机制。结果表明:EGCG溶液加入多酚氧化酶液催化反应后会形成DTSA、没食子酸等产物;在反应液中添加EC后,会形成TF-3-G。添加EC后,EGCG的总消耗率最终提高了3.86%~4.95%;反应前期DTSA的形成率差异不显著,后期DTSA含量在EGCG+EC体系中较单一体系有所降低,差异最大时可达10.84%;添加5 mmol/L EC体系中,TF-3-G的形成量显著高于添加2.5 mmol/L EC体系,其最大值增加了11.16%。EGCG+EC的酶促氧化反应过程,大致可分为4 个阶段:反应初始阶段、二聚产物增长阶段、主要途径变更阶段以及二聚产物消耗阶段。初始阶段,体系中以歧化途径和苯骈化途径为主,两条途径所占比例高于85%;在二聚产物增长阶段,随EC的加入,苯骈化途径所占比例增加,而转化形成DTSA的EGCG所占比例明显降低,歧化途径逐渐减弱。随反应进行,体系中逐步出现多条氧化聚合途径,其他物质所占的比例逐渐增大。产物形成主要途径变更阶段,DTSA出现消耗,TF-3-G缓慢增加。整个过程,歧化途径一直是EGCG酶促氧化的主要反应途径。
关键词:脱氢聚酯型儿茶素A;茶黄素-3-没食子酸酯;歧化途径;苯骈化途径
茶鲜叶中富含多酚类物质,其含量约占茶鲜叶干质量的18%~36%。茶鲜叶中多酚类物质含量最高的为儿茶素类,约占多酚类物质总量的70%~80%[1]。儿茶素属黄烷醇类,是2-苯基苯并吡喃的衍生物[2]。茶鲜叶中的儿茶素类主要包括表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)、表没食子儿茶素(epigallocatechin,EGC)、表儿茶素(epicatechin,EC)、表儿茶素没食子酸酯(epicatechin gallate,ECG)。其中,EGCG含量最为丰富,约占儿茶素总量的50%~80%[3]。
儿茶素的B环酚羟基易氧化形成邻醌,而邻醌极不稳定,易发生复杂的聚合、缩合反应,继而形成双黄烷醇类[4]、茶黄素类[5]和茶红素类[6]等。Verloop等[7]发现儿茶素和EGC在酪氨酸酶的作用下,可产生稳定且高含量的茶黄素。Matsuo等[8]发现连苯三酚型儿茶素与邻苯二酚型儿茶素可在日本梨匀浆的作用下酶促氧化形成茶黄素类和双黄烷醇类,未成熟的温州蜜柑果实匀浆则选择性地氧化连苯三酚型儿茶素形成双黄烷醇类。因此,儿茶素类能通过酶促氧化作用形成不同的氧化产物,其酶促氧化过程多样且复杂,具有重要的研究意义。目前,研究人员对儿茶素类氧化单一途径的分析较多[9-13],对多条途径同时分析涉及较少[14]。
聚酯型儿茶素A(theasinensin A,TSA)是双黄烷醇类的一种,是红茶加工过程中重要的儿茶素氧化产物,不仅影响成品茶的感官品质,而且有一定的保健作用[15-19]。脱氢聚酯型儿茶素A(dehydrotheasinensin A,DTSA)作为TSA的前体物质,是EGCG发生歧化反应产生的中间产物[6,12]。而EGCG在氧化过程中也会生成各类物质[20-22],这些物质的产生都需要经过不同的途径形成,加入EC后对这些反应进程又会产生一定的影响。
本研究通过在EGCG溶液中引入不同浓度的EC,对二者的可能反应途径进行了分析,探讨EGCG和EC经由歧化途径和苯骈化途径形成氧化反应产物的竞争机制,可为研究儿茶素氧化反应产物的形成及其机理奠定一定的基础。
儿茶素单体EGCG(纯度98%) 无锡太阳绿宝科技有限公司;儿茶素单体EC(纯度97%) 浙江一新制药股份有限公司;EGCG、EC定量所需标准品(纯度98%) 美国Sigma公司;TSA(纯度98%) 日本长崎大学;茶黄素-3-没食子酸酯(theaflavin-3-gallate,TF-3-G)(纯度98%) 上海金穗生物科技有限公司。
乙腈(色谱纯) 上海安谱实验科技股份有限公司;柠檬酸、磷酸氢二钠十二水合物 上海麦克林生化科技有限公司;偏磷酸 上海华精生物高科技有限公司;磷酸(85%分析纯) 国药集团化学试剂有限公司;纯净水 杭州娃哈哈集团有限公司。
1100高效液相色谱仪 美国Agilent公司;3K15超速离心机 德国Sigma公司;MR3001磁力搅拌器 德国Heidolph公司;HR2084匀浆机 珠海经济特区飞利浦家庭电器有限公司;KQ-300DE数控超声波清洗器 中国昆山市超声仪器有限公司。
1.3.1 丰水梨多酚氧化酶粗酶液的提取
在参考文献[23]方法基础上略作修改。将丰水梨置于冰箱冷藏室预冷2 h,削皮,去核,置于匀浆机中匀浆90 s,4 层滤布过滤后置于离心机中(8 000 r/min、4 ℃)离心10 min,弃去沉淀,上清液备用。
1.3.2 酶促氧化EGCG反应特性分析
用pH 5.6柠檬酸-磷酸盐缓冲液,配制10 mmol/L EGCG溶液。取60 mL EGCG溶液,加入15 mL丰水梨梨汁提取液,反应条件为温度30 ℃、磁力搅拌器转速500 r/min。反应开始后,在设置时间点分别取2 mL反应液加入0.5 mL偏磷酸溶液(1 mol/L)终止反应,取样过0.45 μm膜后进行液相色谱检测。实验重复2 次。
1.3.3 添加EC对EGCG酶促氧化产物的影响及其形成途径分析
用pH 5.6柠檬酸-磷酸盐缓冲液,配制10 mmol/L的EGCG+EC溶液,配制比例为5 mmol/L+5 mmol/L(1∶1)和7.5 mmol/L+2.5 mmol/L(3∶1)。各取60 mL两种比例的EGCG+EC混合液,分别加入15 mL丰水梨梨汁提取液,后续实验操作及其参数控制同1.3.2节。实验重复2 次。
1.3.4 高效液相色谱条件
色谱柱:日本cosmosil 5C18-AR-II柱(4.6 mm×250 mm)。流动相:A相为50 mmol/L磷酸,B相为100%乙腈。洗脱梯度:0~39 min,B相由4%线性升至30%;39~54 min,B相由30%线性升至75%;54~55 min,B相由75%线性降至4%。流速为0.8 mL/min,柱温为35 ℃,检测波长为280 nm。
为更直观地分析实验数据和探讨反应规律,实验数据用峰面积归一法进行分析比较。数据以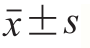 表示。采用SAS 9.1软件进行数据处理,新复极差法进行比较,以P<0.01为差异显著。
表示。采用SAS 9.1软件进行数据处理,新复极差法进行比较,以P<0.01为差异显著。
2.1.1 酶促氧化底物的消耗率
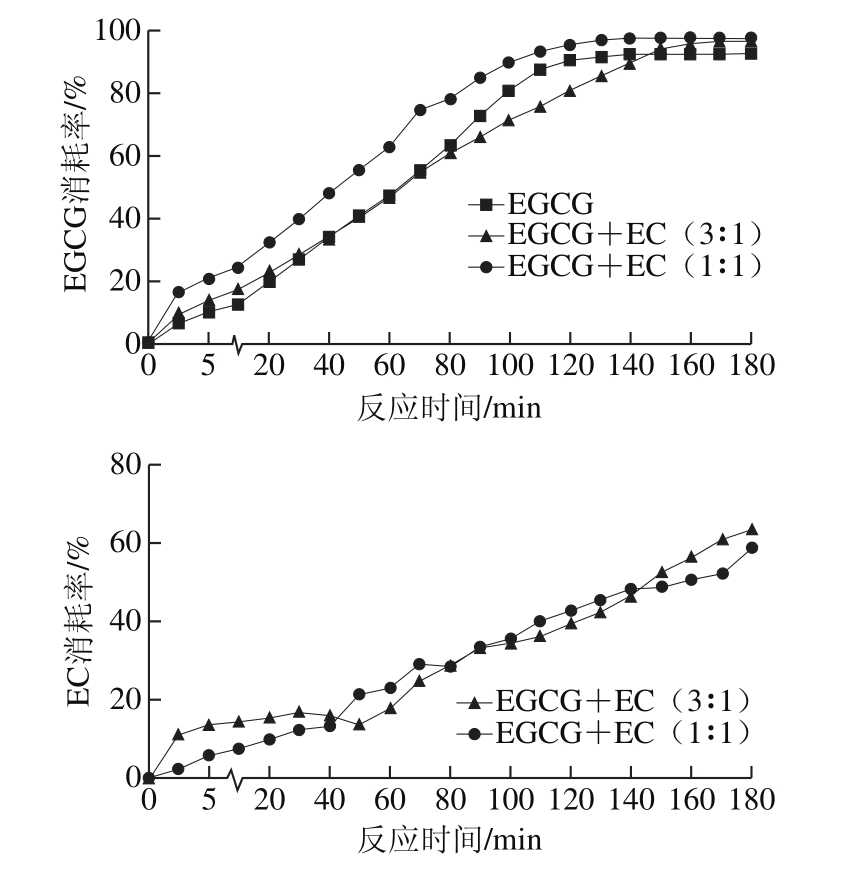
图1 不同底物比例条件下的EGCG和EC消耗率
Fig. 1 Changes in the consumption rate of EGCG and EC in different substrate systems
如图1所示,在溶液中EGCG与EC浓度均为5 mmol/L发生氧化反应时,与只添加EGCG相比,EGCG消耗率变化趋势相同,最终都呈现高消耗率的稳定状态。整个酶促氧化反应过程中,EGCG消耗率均有所增加。最终达到97.63%,高于单一体系中的EGCG消耗量92.55%。这可能说明,添加5 mmol/L的EC对EGCG的消耗有一定的促进作用。当溶液中EGCG与EC按3∶1反应时,EGCG消耗率变化趋势与只添加EGCG时相同,最终亦呈现高消耗率的稳定状态,但反应前期无显著影响,70~150 min,EGCG消耗率有所抑制,150 min之后EGCG消耗率有所促进(最终EGCG消耗率为96.55%)。而整个反应过程中,不同底物比例对EC消耗率影响差异不显著,最终消耗率分别为58.82%和63.42%。
在EGCG与EC共同反应过程中,EC的氧化还原电位值较大,易被催化形成醌类物质EC醌[14]。邻醌是一种不稳定的中间体,易作为电子供体氧化EGCG,自身则被还原生成EC,因此整个过程中氧化还原电位值比较低的EGCG易被氧化消耗,而EC有一部分会与EGCG共同氧化生成TF-3-G,还有一部分会残留在反应溶液中。总体而言,EC会加快EGCG的消耗,促进EGCG酶促氧化反应的进行。
2.1.2 主要反应产物分析
在实验过程中主要生成了3类反应产物,包括DTSA、TF-3-G以及没食子酸(gallic acid,GA)(图2)。其中DTSA和TF-3-G通过酶促氧化过程形成,GA则是EGCG经过水解途径形成。

图2 不同底物酶促氧化形成产物分析
Fig. 2 Analysis of enzymatic oxidation products of EGCG alone and its mixture with EC
2.1.2.1 经由歧化途径形成DTSA
实验结果表明,加入丰水梨酶(主要酶类为多酚氧化酶)催化后,EGCG发生氧化脱氢反应形成邻醌,之后发生二聚合形成DTSA,从图2可以看出,EGCG反应体系、EGCG+EC反应体系中均产生了DTSA。这与Matsuo等[8]实验结果一致。DTSA最终会歧化分解产生TSA、聚酯型儿茶素D和乌龙茶氨酸等[12,24-26]。因此,对脱氢聚酯型儿茶素类的形成分析也是对歧化反应途径的分析。
2.1.2.2 经由苯骈化途径形成TF-3-G
添加EC后,反应后体系中有新的物质TF-3-G的形成,从图2B可以看出,峰谱图中有TF-3-G出现。EGCG与EC均发生氧化脱氢反应形成邻醌,之后二聚合,发生苯骈化反应形成TF-3-G[27]。
2.1.2.3 经由水解途径形成GA
GA是由EGCG经过水解产生,这一结果与Fan Fangyuan等[28]研究一致。在实验研究中,整个过程GA形成量总体小于1%,对于氧化聚合反应途径主要产物的形成量影响较小。

图3 DTSA、TF-3-G及EGCG消耗占比变化趋势
Fig. 3 Changes in the production of DTSA and TF-3-G and EGCG consumption
A、C. EGCG+EC(1∶1)体系;B、D. EGCG+EC(3∶1)体系。
比较EGCG与EC浓度比分别为1∶1与3∶1的两种反应体系,可知整个过程中转化形成DTSA的EGCG消耗占比均高于转化形成TF-3-G的EGCG消耗占比(图3A、B),二者相差最高分别达到18.07%和27.40%,因此,可以推论,在EGCG酶促反应过程中,更多的EGCG转化形成DTSA,也就说明了歧化途径为EGCG的主要酶促反应途径,这与徐斌的研究结论相一致[14]。但由于DTSA是由2 个EGCG结合而成,TF-3-G则是1 个EGCG与1 个EC结合而成,可以发现在EGCG与EC为等物质的量(1∶1)反应体系中,生成的TF-3-G含量高于DTSA含量(图3C),TF-3-G形成率更高。这可能是由EC的量能够提供充足的底物同EGCG反应形成TF-3-G。在EGCG与EC浓度比3∶1体系中,生成的DTSA的含量高于TF-3-G的含量(图3D)。
在反应初始阶段,体系中EGCG反应途径基本以歧化途径和苯骈化途径进行。随反应的进行,两条途径所占比例逐渐下降,这可能说明体系中两条途径所产生的物质继续发生反应,形成其他物质(图4)。EGCG+EC反应体系中,转化形成DTSA的EGCG所占比例明显降低,较EGCG单一底物的反应体系而言,歧化途径的比重减弱。其原因在于,EC会与EGCG发生苯骈化反应形成TF-3-G,对EGCG底物的走向产生一定的竞争[14]。在二聚产物增长期,5 mmol/L的EC浓度能够促进EGCG反应形成更多的TF-3-G,苯骈化途径所占比例增加,此时歧化途径与苯骈化途径在EGCG底物上存在竞争性;产物消耗期,EGCG基本消耗殆尽,歧化途径和苯骈化途径均受到影响,且DTSA的消耗率比TF-3-G的消耗率快。其原因在于,EGCG消耗完全,DTSA作为中间产物,积累达到一定含量,易进一步发生反应,与其他物质结合形成高聚物[21]。
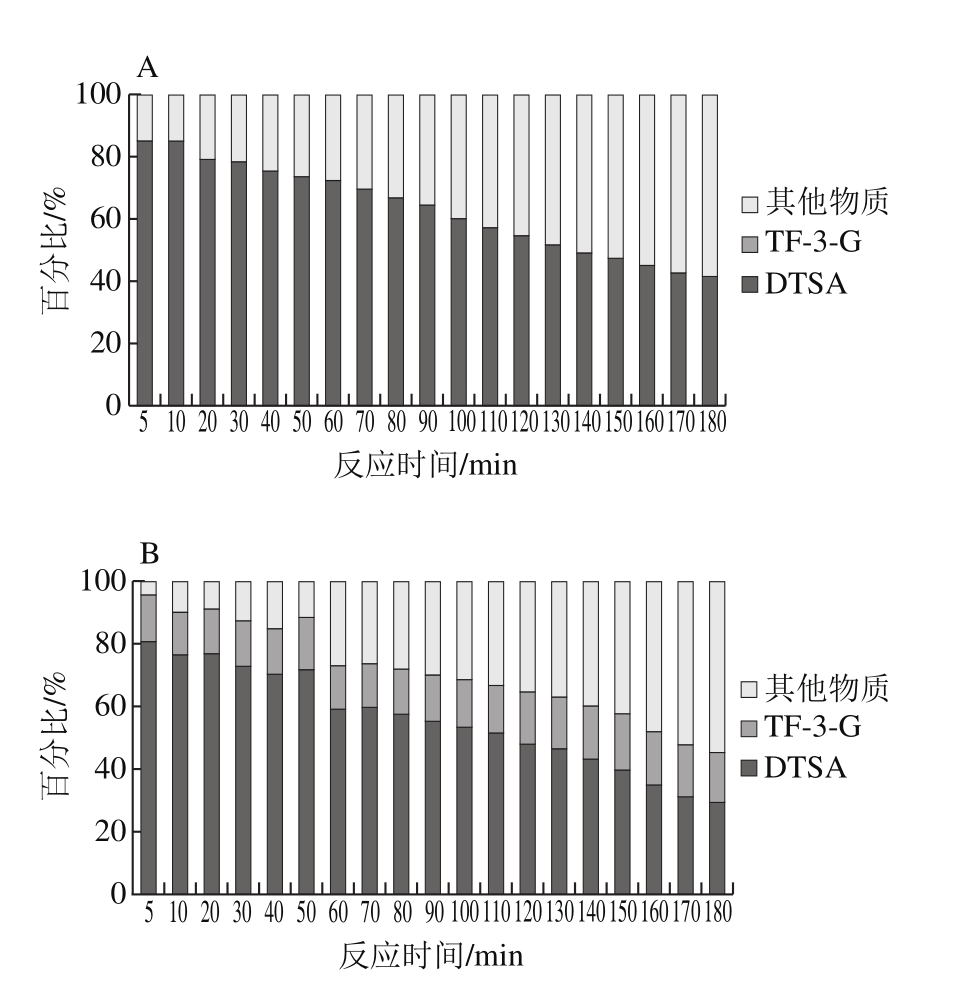
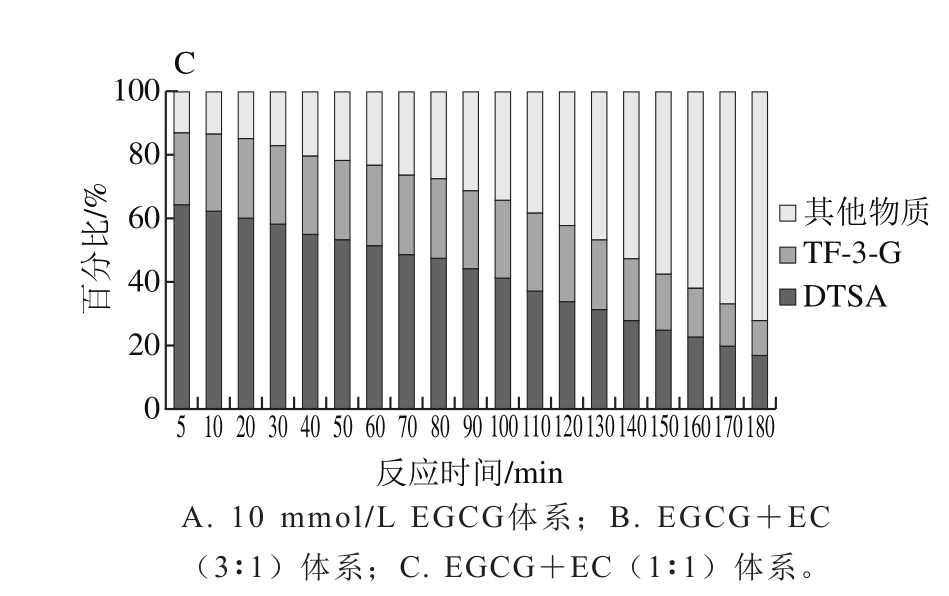
图4 EGCG转化形成各类产物所占比例
Fig. 4 Proportions of various products from EGCG + EC mixtures
2.2.1 DTSA和TF-3-G快速形成期

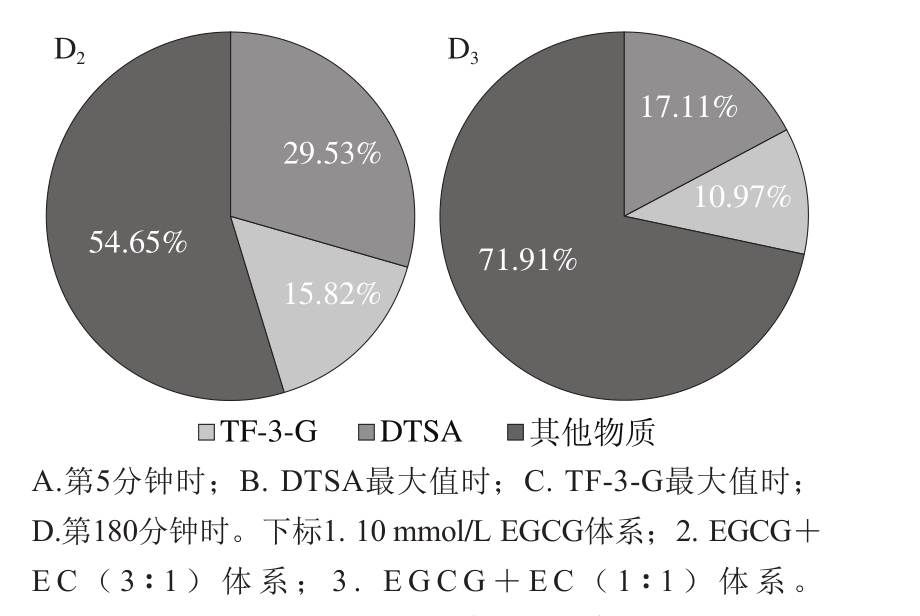
图5 不同时期EGCG各反应去向比例图
Fig. 5 Proportions of EGCG transformation into different products at different reaction stages
反应初始时期,主要反应途径为歧化途径以及苯骈化途径(图4),两条途径所占比例超过85%,其中EGCG体系该时间段为0~10 min;EGCG与EC浓度比3∶1体系该时间段为0~50 min;EGCG与EC浓度比1∶1体系该时间段为0~20 min。形成DTSA的EGCG消耗率始终高于形成TF-3-G的EGCG消耗率(图3A、B),说明该时期,EGCG更多在参与歧化途径。
图5A为第5分钟时转化形成各物质的EGCG比例,随着EC浓度的增加,EGCG转化形成DTSA的比例有所减少,而转化形成TF-3-G的比例均有所增加,相对单于一体系,加入2.5 mmol/L和5 mmol/L的EC,EGCG转化形成DTSA的比例分别减少了26.29%和20.64%。由此说明,在反应前期,由于EC的存在,EGCG形成DTSA的转化率减少,即歧化途径所占比例减少,EC浓度对DTSA的形成影响不显著;与2.5 mmol/L的EC体系比较,5 mmol/L的EC体系转化形成TF-3-G的EGCG比例提高了8.15%,即苯骈化途径所占比例有所增加。这表明物质形成积累期,歧化途径与苯骈化途径在底物上存在竞争性关系。
2.2.2 DTSA和TF-3-G持续增长期
这一时期,体系中反应途径有所增加,转化DTSA和TF-3-G的EGCG消耗量所占比例逐渐减少(图4),DTSA含量表现为增长速度减缓,并逐渐达到最大值,而TF-3-G则表现为持续增长,这可能是因为EGCG易与自身结合形成DTSA,较早达到最大值临界点,此时体系中EGCG少量存在,剩余的EGCG维持TF-3-G的生成。依据实验数据判断,EGCG体系、EGCG与EC浓度比3∶1、1∶1体系该时间段分别为20~110、60~130、30~90 min。
图5B为DTSA最大值时EGCG各反应去向比例图,其中单一体系转化形成DTSA的EGCG比例达57.25%,而随着EC浓度由2.5 mmol/L增加至5 mmol/L。转化形成TF-3-G的EGCG的比例增加了9.28%,形成DTSA的比例减少了2.28%,但DTSA间变化差异不显著。说明在该时期,随EC浓度增加,苯骈化途径所占比例增加,EC的加入使歧化途径所占比例降低,但EC的浓度对歧化途径的影响较小,歧化途径与苯骈化途径在这一时期存在竞争性(图6)。

图6 物质持续增长期体系内反应途径
Fig. 6 Reaction pathways involved in product formation
2.2.3 主要途径变更阶段
在该时间段,DTSA出现消耗,其含量开始降低,可能是由于DTSA的形成达到含量临界点,进一步形成TSA等其他物质,甚至再聚合形成其他高聚类产物(图7)。EGCG与EC浓度比1∶1体系和3∶1体系中该时间段为90~120、130~150 min,这一时期,DTSA含量开始下降,但TF-3-G仍在增长(图3),当TF-3-G达到最大值时,EGCG也基本消耗完全,说明此时基本已无底物供TF-3-G的形成,TF-3-G含量达到最大值临界点。该段时间EGCG与EC浓度比1∶1体系中EGCG减少了10.70%,TF-3-G形成了1.97%,转化率18.41%;该段时间EGCG与EC浓度比3∶1体系中EGCG减少了8.18%,TF-3-G形成了2.45%,转化率29.95%。这说明这一时期,高EGCG浓度体系更易转化形成TF-3-G。

图7 TF-3-G达到最大之前体系内反应途径
Fig. 7 Reaction pathways involved before TF-3-G reached the maximum
图5 C为TF-3-G最大值时转化形成各物质的EGCG比例,其中EGCG体系图示为第120分钟EGCG基本完全消耗时EGCG的反应去向图,该时间点,单一体系转化形成DTSA的EGCG比例达51.83%,而随着EC浓度的增加,转化形成TF-3-G的EGCG的比例增加了6.70%,而其转化形成DTSA的比例减少了0.86%,但DTSA的变化差异不显著,说明在该时期,EC能显著影响苯骈化途径的进行,提高EGCG向苯骈化途径进行的比例,降低EGCG向歧化途径进行的比例,但EC的浓度对歧化途径的影响较小,歧化途径与苯骈化途径在这一时期存在竞争性。
2.2.4 DTSA及TF-3-G物质消耗期
反应后期,是二聚产物DTSA和TF-3-G的消耗期,二者的含量均有所减少(图3C、D),其减少的原因可能是体系中剩余的EC氧化生成氧化还原电位较高的EC-O,进而通过提供电子氧化DTSA和TF-3-G,致使这两类氧化产物的含量锐减。其中DTSA可能发生进一步反应,并与TF-3-G形成茶红素、茶褐素等其他高聚物;TF-3-G可能与EC等结合形成有2个和3个苯骈卓酚酮环的茶黄素类物质[29];儿茶素可以与GA等物质氧化发生邻醌反应,从而生成茶黄棓灵或茶黄酸[30](图8)。
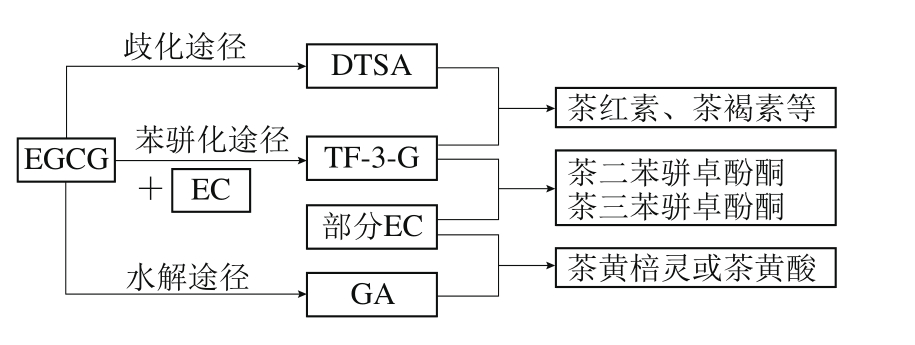
图8 物质消耗期体系内反应途径
Fig. 8 Reaction pathways involved in product consumption
后期,DTSA与TF-3-G均存在一定的消耗,其消耗速率均为DTSA大于TF-3-G,这说明稳定性上,DTSA弱于TF-3-G。可能是因为DTSA为中间产物,当积累达一定临界点后,易发生进一步反应,TF-3-G在后期也可以转化形成茶红素[31]、茶褐素等其他物质。对反应第180分钟时时转化形成各物质的EGCG比例(图5D)分析可发现,该时间点转化形成其他物质的比例明显增加,转化形成DTSA和TF-3-G的EGCG所占比例均显著降低,且EC浓度越高,二者所占比例降低越快,说明在消耗期,歧化途径以及苯骈化途径在该时期均不进行,DTSA和TF-3-G消耗形成其他物质。
本研究以丰水梨多酚氧化酶为酶源,对儿茶素单体进行酶促氧化,产物中出现DTSA以及TFDG,这一结果与Mastuo等[8]的研究结果一致。此外,Mastuo等[8]还利用未成熟的温州蜜柑果实匀浆酶促氧化儿茶素,结果体系中只产生了聚酯型儿茶素类,Lei Shicheng等[32]用皇冠梨酶促氧化EGCG和ECG,产物中出现TFDG。这说明,不同的酶类能够酶促氧化儿茶素形成不同的氧化产物。但目前酶类对儿茶素氧化方向的影响研究尚不全面,这也是未来儿茶素酶促氧化的一个重要方向。
对EGCG酶促氧化反应物质分析可得出:单独EGCG的氧化反应,主要产生DTSA、GA,分别发生了聚合反应、水解反应[28],两条反应途径中以歧化途径为主,水解途径次之。在EGCG溶液中引入EC物质后,会与EGCG发生苯骈化反应形成TF-3-G,且EGCG与EC等浓度时,TF-3-G形成量最大,这一结果与Robertson[33]之前所的结论一致。从歧化途径与苯骈化途径的竞争机制中研究可得出:在反应初始阶段,体系中以歧化途径和苯骈化途径为主;随反应进行,体系中出现多条途径,其他物质所占比例增大。加入EC,转化形成DTSA的EGCG比例显著降低,歧化途径所占比例减少;随EC含量的增加,转化形成TF-3-G的EGCG比例增加,体系中更多的EGCG沿苯骈化途径进行反应,歧化途径与苯骈化途径在底物方面存在竞争性。但在整个过程中,歧化途径一直是EGCG酶促氧化主要反应途径。这些研究进展,有望在后续深入研究机理的基础上,对控制儿茶素反应途径有一定的参考价值。
在儿茶素氧化反应的后期,DTSA和TF-3-G都有着一定程度的消耗,且其他未知物含量明显增加,具体的消耗途径以及消耗所产生的物质仍有待进一步探究。产物中有个别未知物质,如保留时间为24.1 min的物质尚未进行鉴定,对其进行检测分析及形成机理可以作为后续研究的一个重要方面。由于形成GA的EGCG转化率较小,本研究未对其转化量进行详细讨论。在以后的研究中,也可以对EGCG形成GA及其他产物的水解途径进行深入分析,以便全面了解儿茶素氧化的反应途径走向及其机制。
参考文献:
[1] 宛晓春, 黄继轸, 沈生荣, 等. 茶叶生物化学[M]. 北京: 中国农业出版社, 2011.
[2] 夏涛, 高丽萍, 刘亚军, 等. 茶树酯型儿茶素生物合成及水解途径研究进展[J]. 中国农业科学, 2013, 46(11): 2307-2320. DOI:10.3864/j.issn.0578-1752.2013.11.015.
[3] MATTTHEW E, HARBOWY, VALENTINE D A. Tea chemistry[J].Critical Reviews in Plant Sciences, 1997, 16(5): 415-480.
[4] 丁阳平, 陆昌琪, 候宏晓, 等. 儿茶素氧化产物及形成机制研究[J].中国中药杂志, 2017, 42(2): 239-253. DOI:10.19540/j.cnki.cjcmm.20161222.052.
[5] ROBERTSON A. Production and HPLC analysis of black tea theaflavins and thearubigins during in vitro oxidation[J].Phytochemistry, 1983, 4(22): 883-887. DOI:10.1016/0031-9422(83)85016-X.
[6] 李维熙, 王葳, 王文静. 茶多酚的氧化聚合机制研究进展[J]. 暨南大学学报(自然科学与医学版), 2016, 37(3): 193-200.
[7] VERLOOP A J W, GRUPPEN H, BISSCHOP R, et al. Altering the phenolics profile of a green tea leaves extract using exogenous oxidases[J]. Food Chemistry, 2016, 196: 1197-1206. DOI:10.1016/j.foodchem.2015.10.068.
[8] MATSUO Y, TADAKUMA F, SHII T, et al. Selective oxidation of pyrogallol-type catechins with unripe fruit homogenate of Citrus unshiu and structural revision of oolongtheanins[J]. Tetrahedron, 2015,71(17): 2540-2548. DOI:10.1016/j.tet.2015.03.016.
[9] WESTHUIZEN M, STEENKAMP L, STEENKAMP P, et al.Alternative pathway implicated as an inf l uencing factor in the synthesis of theaf l avin[J]. Biocatalysis & Biotransformation, 2016, 33(5/6): 289-309. DOI:10.3109/10242422.2016.1163341.
[10] KUSANO R, MATSUO Y, SAITO Y, et al. Oxidation mechanism of black tea pigment theaflavin by peroxidase[J]. Tetrahedron Letters,2015, 56(36): 5099-5102. DOI:10.1016/j.tetlet.2015.07.037.
[11] 黄莹捷, 伍梦瑶, 姚燕妮, 等. 不同反应条件对勐库大叶种多酚氧化酶合成茶黄素的影响[J]. 食品科学, 2017, 38(22): 54-59.DOI:10.7506/spkx1002-6630-201722009.
[12] 徐斌, 江和源, 张建勇, 等. 溶液中TSA及其前体物质DTSA的生成和稳定特性研究[J]. 中国食品学报, 2016, 16(5): 53-60.
[13] TENG J, GONG Z, DENG Y, et al. Purification, characterization and enzymatic synthesis of theaflavins of polyphenol oxidase isozymes from tea leaf (Camellia sinensis)[J]. LWT-Food Science and Technology, 2017, 84: 263-270. DOI:10.1016/j.lwt.2017.05.065.
[14] 徐斌, 江和源, 张建勇, 等. 不同pH条件下TSs的形成机理及其与TFs的竞争性形成研究[J]. 茶叶科学, 2015, 35(3): 281-289.
[15] WEERAWATANAKORN M, HUNG W, PAN M, et al. Chemistry and health beneficial effects of oolong tea and theasinensins[J]. Food Science and Human Wellness, 2015, 4(4): 133-146. DOI:10.1016/j.fshw.2015.10.002.
[16] KIMUTAI S, WANYOKO J, KINYANJUI T, et al. Determination of residual catechins, polyphenolic contents and antioxidant activities of developed theaflavin-3,3′-digallate rich black teas[J]. Food and Nutrition Sciences, 2016, 7(3): 180-191. DOI:10.4236/fns.2016.73020.
[17] HSIEH C, KUO P, HSU Y, et al. Arctigenin, a dietary phytoestrogen,induces apoptosis of estrogen receptor-negative breast cancer cells through the ROS/p38 MAPK pathway and epigenetic regulation[J].Free Radical Biology and Medicine, 2014, 67: 159-170. DOI:10.1016/j.freeradbiomed.2013.10.004.
[18] BEDRAN T B L, MORIN M, SPOLIDORIO D P, et al. Black tea extract and its theaflavin derivatives inhibit the growth of periodontopathogens and modulate interleukin-8 and β-defensin secretion in oral epithelial cells[J]. PLoS ONE, 2015, 10(11): 143-158.DOI:10.1371/journal.pone.0143158.
[19] CHEN G, WANG H, ZHANG X, et al. Nutraceuticals and functional foods in the management of hyperlipidemia[J]. Critical Reviews in Food Science and Nutrition, 2014, 54(9): 1180-1201. DOI:10.1080/10 408398.2011.629354.
[20] TANAKA T, MINE C, KOUNO I. Structures of two new oxidation products of green tea polyphenols generated by model tea fermentation[J]. Tetrahedron, 2002, 58(43): 8851-8856. DOI:10.1016/S0040-4020(02)01061-X.
[21] SANG S, YANG I, BUCKLEY B, et al. Autoxidative quinone formation in vitro and metabolite formation in vivo from tea polyphenol (-)-epigallocatechin-3-gallate: studied by real-time mass spectrometry combined with tandem mass ion mapping[J]. Free Radical Biology and Medicine, 2007, 43(3): 362-371. DOI:10.1016/j.freeradbiomed.2007.04.008.
[22] TANAKA T, MATSUO Y, KOUNO I. A novel black tea pigment and two new oxidation products of epigallocatechin-3-O-gallate[J].Journal of Agricultural and Food Chemistry, 2005, 53(19): 7571-7578.DOI:10.1021/jf0512656.
[23] MATSUO Y, TADAKUMA F, SHII T, et al. Selective oxidation of pyrogallol-type catechins with unripe fruit homogenate of Citrus unshiu and structural revision of oolongtheanins[J]. Tetrahedron, 2015,71(17): 2540-2548. DOI:10.1016/j.tet.2015.03.016.
[24] LI Y, TANAKA T, KOUNO I. Oxidative coupling of the pyrogallol B-ring with a galloyl group during enzymatic oxidation of epigallocatechin 3-O-gallate[J]. Phytochemistry, 2007, 68(7): 1081-1088. DOI:10.1016/j.phytochem.2007.01.005.
[25] HATANO T, KUSUDA M, HORI M, et al. Theasinensin A, a tea polyphenol formed from (-)-epigallocatechin gallate, suppresses antibiotic resistance of methicillin-resistant Staphylococcus aureus[J].Planta Medied, 2003, 69(11): 984-989. DOI:10.1055/s-2003-45142.
[26] TANAKA T, WATARUMI S, MATSUO Y, et al. Production of theasinensins A and D, epigallocatechin gallate dimers of black tea,by oxidation-reduction dismutation of dehydrotheasinensin A[J].Tetrahedron, 2003, 59(40): 7939-7947. DOI:10.1016/j.tet.2003.08.025.
[27] 凌甜, 刘仲华. 儿茶素酶促制备茶黄素的研究进展[J]. 茶叶通讯,2014, 41(2): 3-5.
[28] FAN F Y, SHI M, NIE Y, et al. Differential behaviors of tea catechins under thermal processing: formation of non-enzymatic oligomers[J]. Food Chemistry, 2016, 196: 347-354. DOI:10.1016/j.foodchem.2015.09.056.
[29] 李大祥, 宛晓春, 杨昌军, 等. 茶儿茶素氧化机理[J]. 天然产物研究与开发, 2006, 18(1): 171-181.
[30] 丁其欢, 字成庭, 周增志, 等. 茶黄素的理化性质·提取分离及生物活性研究进展[J]. 安徽农业科学, 2017, 45(11): 85-87; 113.DOI:10.13989/j.cnki.0517-6611.2017.11.026.
[31] 李大祥, 王华, 白蕊, 等. 茶红素化学及生物学活性研究进展[J].茶叶科学, 2013, 33(4): 327-335.
[32] LEI S C, XIE M, HU B, et al. Effective synthesis of theaf l avin-3,3′-digallate with epigallocatechin-3-O-gallate and epicatechin gallate as substrates by using immobilized pear polyphenol oxidase[J].International Journal of Biological Macromolecules, 2017, 94: 709-718. DOI:10.1016/j.ijbiomac.2016.10.072.
[33] ROBERTSON A. Effects of catechin concentration on the formation of black tea polyphenols during in vitro oxidation[J]. Phytochemistry,1983, 4(22): 897-903. DOI:10.1016/0031-9422(83)85018-3.
Enzymatic Oxidation Products of EGCG and EC and Their Formation Routes
SHI Liting1,2, JIANG Heyuan1,*, ZHANG Jianyong1, WANG Weiwei1, SU Wei1,2
(1. Tea Research Institute, Key Laboratory of Tea Plants Biology and Resources Utilization, Ministry of Agriculture,Key Laboratory of Tea Processing Engineering of Zhejiang Province, Chinese Academy of Agricultural Sciences,Hangzhou 310008, China; 2. Graduate School of Chinese Academy of Agricultural Sciences, Beijing 100081, China)
Abstract:The aim of this study was to explore several major oxidation pathways of epigallocatechin gallate (EGCG) and the competition mechanism between the disproportionation pathway and the benzene pathway. Dehydrotheasinensin A(DTSA) and theaf l avin-3-gallate (TF) were obtained by enzymatic oxidation of mixtures of different proportions of EGCG and epicatechin (EC). The results showed that several products including DTSA and GA were formed from the hydrolysis of EGCG by polyphenol oxidase (POD), while theaf l avin-3-gallate (TF-3-G) was formed and the consumption rate of EGCG was increased by 3.86%-4.95% when epicatechin (EC) was added to the reaction solution. The formation rate of DTSA was not significantly changed during the early reaction stage but it was lower in EGCG + EC systems than in the single system during the later stage with a maximum difference of up to 10.84%. The formation of TF-3-G was significantly higher (up to 11.16%) at 5 mmol/L EC than at 2.5 mmol/L EC concentration. The enzymatic oxidation process of EGCG + EC could be divided into four stages: initial stage, dimer formation, change of the main pathways and dimer consumption. At the initial stage, the disproportionation and the benzene pathways were both dominant and their proportions were higher than 85%.At the second stage, the proportion of the benzene pathway was increased with the addition of EC while the proportion of EGCG transformed into DTSA was significantly reduced and the disproportionation pathway was weakened. As the reaction processed, a number of oxidation polymerization pathways gradually appeared in the system and the proportions of other substances were increased. At the third stage, DTSA began to be consumed and TF-3-G was slowly increased. The disproportionation pathway was dominant during the whole process of EGCG enzymatic oxidation.
Keywords:dehydrotheasinensin A (DTSA); theaf l avin-3-gallate (TF-3-G); disproportionation pathway; benzene pathway
SHI Liting, JIANG Heyuan, ZHANG Jianyong, et al. Enzymatic oxidation products of EGCG and EC and their formation routes[J]. Food Science, 2018, 39(22): 1-7. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201822001.http://www.spkx.net.cn
引文格式:施莉婷, 江和源, 张建勇, 等. EGCG与EC酶促氧化产物及其形成途径分析[J]. 食品科学, 2018, 39(22): 1-7. DOI:10.7506/spkx1002-6630-201822001. http://www.spkx.net.cn
文章编号:1002-6630(2018)22-0001-07
文献标志码:A
中图分类号:S571.1
DOI:10.7506/spkx1002-6630-201822001
*通信作者简介:江和源(1974—),男,研究员,博士,研究方向为茶叶化学与加工。E-mail:jianghy@tricaas.com
第一作者简介:施莉婷(1993—),女,硕士研究生,研究方向为茶叶加工与质量控制。E-mail:ahhsslt@163.com
中国农业科学院科技创新工程项目(CAAS-ASTIP-2017-TRICAAS)
基金项目:国家自然科学基金面上项目(31670692);公益性行业(农业)科研专项(201503142-11);
收稿日期:2017-09-30