周广志,鲁 敏,安华明*
(贵州大学农学院,贵州省果树工程技术研究中心,贵州 贵阳 550025)
摘 要:为了解刺梨果实中活性物质含量变化及其对抗氧化性能的贡献,本研究测定‘贵农5号’刺梨果实发育过程中总酚、总黄酮、总三萜、VC及超氧化物歧化酶(superoxide dismutase,SOD)5 类主要活性物质含量,同时采用1,1-二苯基-2-三硝基苯肼、2,2’-联氮基-双-(3-乙基苯并噻唑啉-6-磺酸)二铵盐和铁离子还原体系分析体外抗氧化能力,并比较活性物质与抗氧化能力之间的相关性。结果显示,不同发育时期的刺梨果实中各活性物质的变化趋势不尽相同:VC含量随果实发育持续增加,花后100 d达到最大值;总酚、总黄酮和总三萜含量变化基本一致,均呈现先降低后升高的趋势,即幼果(花后20~40 d)和成熟果实中具有更高含量;而花后40~60 d的果实中SOD活性更强。总体上,3 种抗氧化能力表现与总酚含量变化一致,相关性分析显示它们之间呈极显著正相关关系(P<0.01)。主成分分析显示5种活性物质对抗氧化能力贡献的顺序依次为总酚、总黄酮>VC>总三萜>SOD,其中前3 种物质的累计贡献率达到80%以上。以上结果表明,刺梨果实的抗氧化能力是几类物质协同作用的结果,但其中总酚、总黄酮和VC起着决定性作用。
关键词:刺梨;发育时期;活性物质;抗氧化活性
自由基和氧化胁迫可导致许多人类疾病的产生,包括老年痴呆症、帕金森病、糖尿病、动脉粥样硬化、缺血再灌注损伤以及衰老[1],其致病机制是自由基诱导损伤DNA、蛋白质、脂类等生物分子[2-3]。据报道,以植物为主的饮食富含抗氧化剂可以降低氧化胁迫相关疾病的风险[4]。而植物产品中的天然抗氧化剂已被证明可以作为自由基清除剂,防止在健康细胞中氧化损伤,而不会造成负面的影响,因此,这些天然抗氧化剂常被用来治疗包括糖尿病、癌症、心血管疾病、神经退行性疾病和炎性疾病[5-7]。
刺梨(Rosa roxburghii Tratt.)属蔷薇科蔷薇属植物,因其果实风味独特和极高的营养价值而备受关注,近年来人们对其果实或提取物在医学或营养保健上的作用以及相关产品的开发日趋重视。刺梨作为贵州省重点发展产业,其种植面积已超过1 000 km2,加工产品已有数十种。迄今已探明刺梨果实中含有VC、多种有机酸、氨基酸、酚类、黄酮类、超氧化物歧化酶(superoxide dismutase,SOD)及三萜类等多种活性物质[8-12]。这些活性物质对于人体抗氧化反应、清除体内自由基并在抗衰老、抗辐射、消炎和抗肿瘤等过程发挥重要作用[13-14]。同时这些活性物质本身在植物细胞内就具有较强的清除自由基和抗氧化力。比如VC在机体内通过作为自由基清除剂、一些酶的辅酶、叶绿体和质膜电子共体或受体等方面的作用而发挥其生物学活性[15]。SOD是生物体内重要的抗氧化酶,主要是通过歧化反应能够催化超氧化物转化为氧气和过氧化氢,从而达到清除细胞内氧自由基、保护细胞的目的。酚类化合物是含羟基的芳烃衍生物,主要包括酚酸类、类黄酮类和单宁类等,具有清除自由基、提供氢原子或电子以及螯合金属离子的能力,在人体内能够抑制肿瘤、抵抗诱变和改善人体微循环[16]。三萜类化合物是由倍半萜金合欢醇焦磷酸酯尾-尾缩合生成的鲨烯经过不同的途径环合而成的,具有抑制肿瘤、抗炎、抗菌、抗衰老等广泛的生理活性[17],研究表明该类物质也是刺梨果实中的代表性成分之一[13]。正是以上这些物质的复合作用,才使得刺梨果实具有广泛的医药、保健和营养作用。
刺梨果实的活性物质成分及其营养价值的研究虽丰富,但果实发育过程中这些活性物质的变化特点及其与抗氧化活性的关系还不清楚。本实验系统测定刺梨果实发育过程中总酚、总黄酮、总三萜、VC及SOD 5 类主要活性物质以及1,1-二苯基-2-三硝基苯肼(1,1-dipheny1-2-picryl-hydrazyl,DPPH)、2,2’-联氮基-双-(3-乙基苯并噻唑啉-6-磺酸)二铵盐(2,2’-amino-di(3-ethyl-benzothiazoline sulphonic acid-6)ammonium salt,ABTS)和铁离子还原(ferric reducing antioxidant power,FRAP)3 种抗氧化活性的变化特点,分析这些物质对抗氧化能力的贡献,对于了解刺梨果实抗氧化能力的组成特点、挖掘其医药保健价值以及品质调控等都具有重要的理论和实践意义。
供试刺梨材料为‘贵农5号’刺梨果实,采于贵州大学刺梨种质资源圃。用于实验采样的刺梨植株为50 株。果实发育期样品于花后20 d开始取样,以后每隔20 d定期随机采取果实不少于100 g,直至果实成熟。以上样品立即用液氮处理后保存于-75℃备用。
福林-酚试剂 北京索莱宝科技有限公司;标准品没食子酸、芦丁、熊果酸(均为色谱级)、水溶性VE(Trolox)、DPPH、2,4,6-三吡啶吖嗪、ABTS 上海源叶生物科技有限公司。
SPX-250B智能光照培养箱 杭州汇尔仪器设备有限公司;UV-2100紫外分光光度计 上海优尼柯仪器有限公司;BiofugeStratos台式高速冷冻离心机 美国赛默飞世尔科技有限公司;KQ5200DE型数控超声波清洗仪昆山市超声仪器有限公司;LC-15C液相色谱仪 日本岛津公司。
1.3.1 刺梨果实发育过程中主要活性成分的测定
1.3.1.1 总酚含量的测定
采用福林-酚法[18]测定,在提取液用量、显色体积以及标准曲线测定上略加改动。以标准品没食子酸作为对照。每次称取0.5 g样品,加入15 mL 30%甲醇溶液,超声提取50 min,超声条件为50 ℃、40 kHz[19-20],过滤,定容至50 mL,备用。吸取50 µL样品加2.45 mL的蒸馏水,加0.2 mL福林-酚试剂、2.5 mL 20%碳酸钠溶液定容至10 mL,2 h后于波长765 nm处测吸光度。
1.3.1.2 总黄酮含量的测定
参照罗峰[21]、吴媛琳[22]等的方法,采用NaNO2-Al(NO3)3比色法测定,调整提取液用量和显色体积。以标准芦丁品作为对照。每次称取0.5 g样品,加入15 mL 30%甲醇溶液,超声提取50 min,超声条件为50 ℃、40 kHz[20],过滤,定容至50 mL,备用。吸取2 mL提取液,加入0.4 mL 5% NaNO2溶液,摇匀后放置6 min,加入0.6 mL 10% Al(NO3)3溶液,摇匀后放置6 min,然后加入4 mL 4% NaOH溶液,用30%甲醇溶液定容至10 mL,摇匀放置15 min后于波长510 nm处测吸光度。各时期样品按照上述处理方法至少重复3 次。按下式计算总黄酮含量:
式中:x为样品中总黄酮含量/(mg/100 g);m1为根据标准曲线计算出待测液中黄酮质量/µg;v1为样品中提取液测定用体积/mL;v2为样品提出液总体积/mL;m为称取的样品质量/g。
1.3.1.3 总三萜酸含量的测定
采用香草醛-冰乙酸法,参照周巧霞[23]和张雁冰[24]等的方法并调整提取液用量。以标准品熊果酸作为对照。每次称取样品0.5 g,加入15 mL 75%乙醇溶液,于50℃超声提取50 min,提取液过滤,定容至50 mL摇匀备用。测定时提取液用量为0.2 mL,5%香草醛-冰乙酸溶液0.3 mL,高氯酸1 mL,摇匀,置于60℃水浴中加热20 min,立即置于冰水浴中冷却,加冰乙酸10 mL摇匀,在波长545 nm处测吸光度。
1.3.1.4 VC含量测定
参考王乐乐等[25]的方法。提取时采用6%偏磷酸溶液5 mL在预冷的研钵中均匀研磨。将研磨液转移至10 mL离心管中,4 ℃、10 000 r/min离心15 min,移取上清液至10 mL容量瓶中,剩余残渣加提取液3~4 mL,相同条件离心10 min,移取并合并上清液,定容至刻度,摇匀后过0.45 μm滤膜即得用于测定的VC提取液。VC含量测定选用液相色谱法。色谱条件:Wondasil C18色谱柱(4.6 mm×150 mm,5 μm);流动相0.2%偏磷酸溶液;流速1 mL/min;柱温30 ℃;紫外检测器检测波长254 nm;进样量20 μL。
1.3.1.5 SOD活力测定
参考王学奎[26]的方法,采用氮蓝四唑(nitrobluetetrazolium,NBT)法测定SOD活力。准确称取去除种子的刺梨果实0.5 g于预冷的研钵中,加5 mL磷酸缓冲盐溶液(phosphate buffer saline,PBS)(分开多次)研磨成浆,转移到10 mL离心管中,于4 ℃、10 000 r/min离心10 min,上清液即为SOD粗提取液。于试管中依次加入3.0 mL 0.05 mol/L PBS,0.6 mL 130 mmol/L Met,0.6 mL 750 μmol/L NBT,0.6 mL 100 μmol/L EDTA-Na2,0.6 mL 20 μmol/L核黄素,0.1 mL酶液和0.5 mL蒸馏水。2支对照管用PBS代替酶液。混匀后将1支对照置暗处,其他各管于4 000 lx日光条件下显色反应20 min,于波长560 nm处测吸光度。
1.3.2 动态发育过程中刺梨果实的抗氧化能力测定
1.3.2.1 DPPH自由基清除能力测定
参考Li Xican等[27]的方法,在提取液用量、显色体积上略加改动。每次称取0.5 g样品,加入15 mL 30%甲醇溶液,超声提取50 min,超声条件为50℃、40 kHz,过滤,定容至50 mL,备用。测定时吸取10 μL样品提取液加到4 mL DPPH-甲醇溶液中,避光反应20 min后在波长519 nm处测定吸光度,对照以相同体积的提取溶剂代替样品提取液,最终结果以μmol/L Trolox等量抗氧化能力表示。
1.3.2.2 ABTS+·清除能力测定
参考Re等[28]的方法,在提取液用量、显色体积上略加改动。每次称取0.5 g样品,加入15 mL 30%甲醇溶液,超声提取50 min,超声条件为50℃、40 kHz,过滤,定容至50 mL,备用。测定时吸取5 μL样品提取液加到5 mL ABTS溶液中避光反应10 min后在波长734 nm处测定吸光度,最终结果以µmol/L Trolox等量抗氧化能力表示。
1.3.2.3 FRAP测定
参照Benzie等[29]的方法,在提取液用量、显色体积上略加改动。每次称取0.5 g样品,加入15 mL 30%甲醇溶液,超声提取50 min,超声条件为50℃、40 kHz,过滤,定容至50 mL,备用。测定时吸取3 μL样品提取液加入FRAP溶液8 mL,37 ℃反应10 min后在波长593 nm处测定吸光度,最终结果以μmol/L Trolox等量抗氧化能力表示。
3种体外抗氧化性评价方法中,均同时以0.1 g/mL的VC液代替提取液作为对照。
各样品至少重复测定3次。采用Excel软件进行实验数据统计,采用DPS v7.05统计软件进行显著性和相关性分析,多重比较采用Duncan’s新复极差法。
如表1所示,其中V C含量随果实发育呈持续上升趋势,花后1 0 0 d达到最高含量为(1 192.85±17.99) mg/100 g。总酚和总黄酮含量呈现先降低后升高的趋势,其中总酚含量在花后20 d含量最高,60 d降到最低,100 d又回升到最大值。而总黄酮含量前期(20~40 d)维持在最高水平,花后80 d降到最低,随后有少量上升。与总酚和总黄酮相反,SOD活性呈现先升高后降低的趋势,果实发育前期缓慢上升,花后40 d持续升高,并保持到60 d后再持续降低,直至达到最低值(100 d)。而总三萜物质含量变化呈现先升高后降低再升高的特殊趋势,果实发育前期迅速上升,花后40 d升到最高值,随后迅速下降,80 d降到最低值,随后(100 d)又迅速上升到最高水平。虽然刺梨最早是由于高含量的VC[30]而备受关注,但果实发育各时期总酚含量均高于VC,且有关研究证明总酚含量与抗氧化能力呈极显著正相关[31],这说明除了高含量的VC外,刺梨果实中高含量的总酚可能在主要活性物质中起着更重要的作用。
表1 刺梨果实发育过程中主要活性物质含量
Table 1 Contents of main bioactive substances in Rosa roxburghii fruit during development
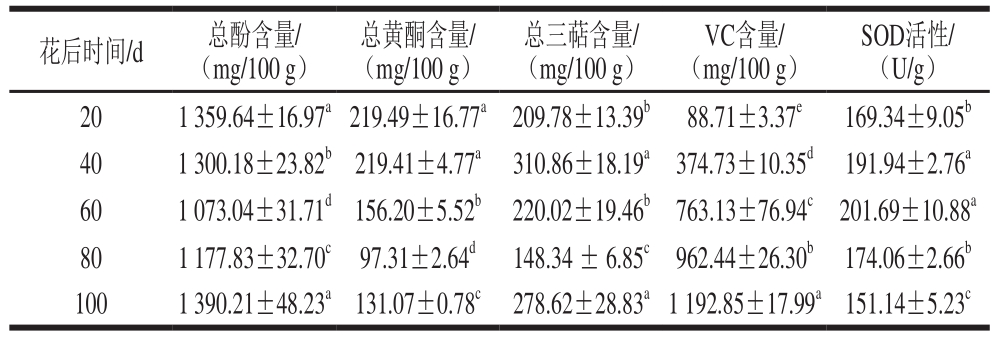
注:总酚、总黄酮、总三萜、VC含量均以湿基计;同列不同字母表示差异显著(P<0.05)。
2.2.1 刺梨果实发育过程中DPPH自由基清除能力
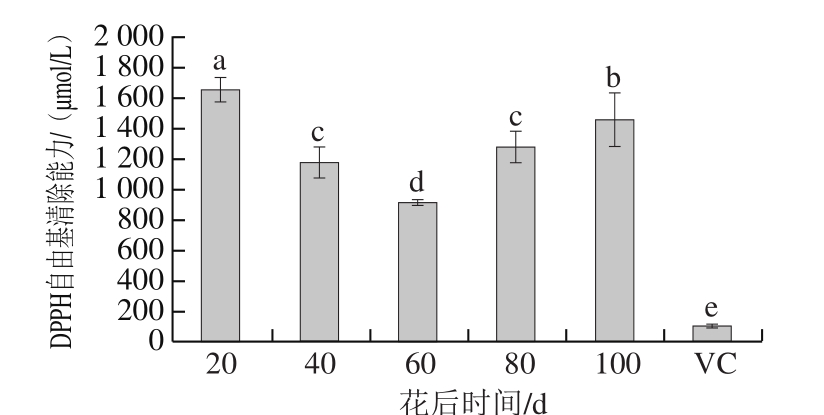
图1 刺梨果实发育过程中DPPH自由基清除能力
Fig. 1 DPPH free radical scavenging capacity in Rosa roxburghii fruit during development
不同字母表示差异显著(P<0.05)。下图同。
根据吸光度变小的程度与自由基被清除的程度呈定量关系,可测得刺梨果实对自由基的清除能力。被测样品如果能够清除DPPH自由基,则可以据此推断样品具有减弱羟自由基、烷基自由基或过氧自由基的有效浓度和抑制脂质过氧化反应的作用。如图1所示,动态发育的刺梨果实DPPH自由基清除能力显著高于VC。发育过程中刺梨果实DPPH自由基清除能力呈现先降低后升高的趋势,花后60 d的DPPH自由基清除能力最低(913.28 μmol/L),花后20 d(1 655.86 μmol/L)和100 d(1 463.27 μmol/L)果实的DPPH自由基清除能力是VC(110.18 μmol/L)的15 倍和13 倍。这是因为花后20 d和花后100 d的总酚、总黄酮含量极高,研究证明总酚、总黄酮与抗氧化密切相关,与有关研究[32]一致。
2.2.2 刺梨果实发育过程中ABTS+·清除能力
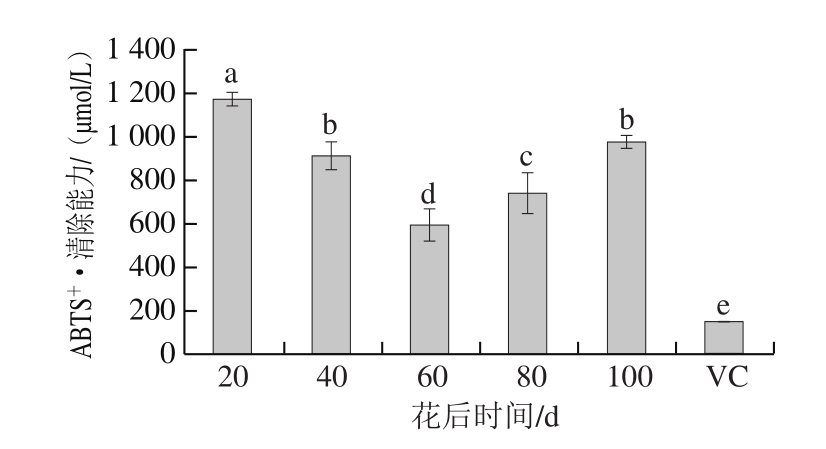
图2 刺梨果实发育过程中ABTS+·清除能力
Fig. 2 ABTS free radical scavenging capacity in Rosa roxburghii fruit during development
如图2所示,动态发育过程中的刺梨果实ABTS+·清除能力均显著高于VC。同时花后20 d(1 172.12 μmol/L)刺梨果实的A B T S+·清除能力最强,是对照V C(150.89 μmol/L)的7.8倍,随着果实发育,ABTS+·清除能力先降低,至花后60 d(590.53 μmol/L)时降到最低值,随后快速升高,花后100 d(974.92 μmol/L)的果实表现出次高的ABTS+·清除能力,是对照VC(150.89 μmol/L)的6.7倍。这与DPPH自由基清除能力趋势一致。
2.2.3 刺梨果实发育过程中FRAP
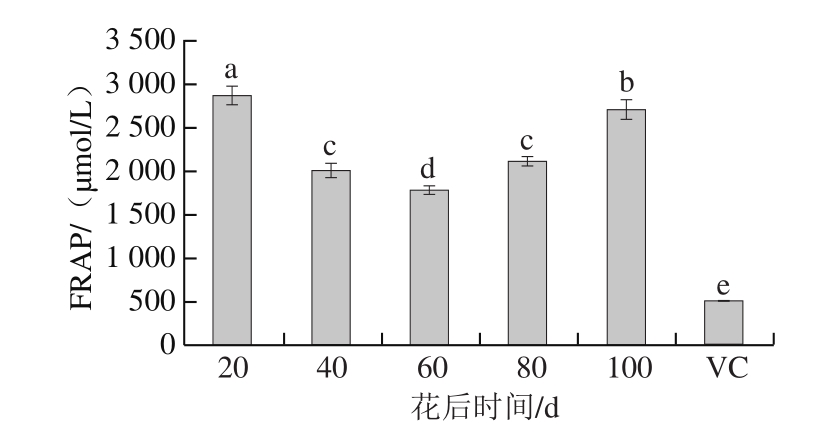
图3 刺梨果实发育过程中FRAP
Fig. 3 FRAP free radical scavenging capacity in Rosa roxburghii fruit during development
刺梨果实可将Fe3+还原成Fe2+,其与FRAP试剂结合,在波长593 nm处具有最大吸收峰。如图3所示,不同发育时期的刺梨果实FRAP均显著高于VC。随刺梨果实发育总还原能力呈现先降低后升高的趋势,与DPPH自由基清除能力和ABTS+·清除能力呈现出一致性。花后60 d FRAP最低(1 783.56 μmol/L),而花后20 d(2 876.47 μmol/L)和花后100 d(2 708.86 μmol/L)表现出极强的FRAP,分别是对照VC(515.8 μmol/L)的5.8倍和5.3倍。
如表2、3所示,总酚与抗氧化性能呈极显著正相关,说明总酚是刺梨抗氧化能力的主要活性物质,这与前人研究结果一致[33-34]。总黄酮和总三萜与抗氧化能力有一定的相关性,但不显著,可能是因为刺梨果实中与总酚相比,总黄酮和总三萜含量太低。而由于果实动态发育过程中VC含量和SOD活性变化与3 种抗氧化能力呈相反趋势,所以计算出的相关系数为负数(表2)。而如果以单个果实中的含量计算,则总酚、总黄酮、VC、总三萜、SOD均与3 种抗氧化能力呈(极)显著正相关(表3)。
表2 刺梨果实活性物质含量和抗氧化能力之间的相关性
Table 2 Correlation between bioactive substance contents and antioxidant capacity in Rosa roxburghii fruit
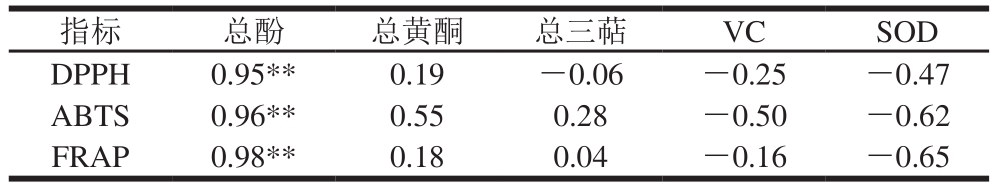
注:*.显著相关(P<0.05);**.极显著相关(P<0.01);表3同。
表3 刺梨单果中活性物质含量和抗氧化能力之间的相关性
Table 3 Correlation between bioactive substance contents and antioxidant capacity in single Rosa roxburghii fruit
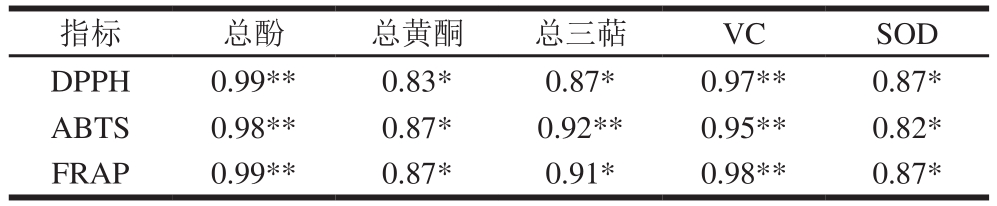
表4 5 种活性物质的主成分分析
Table 4 Principal component analysis of fi ve bioactive substances
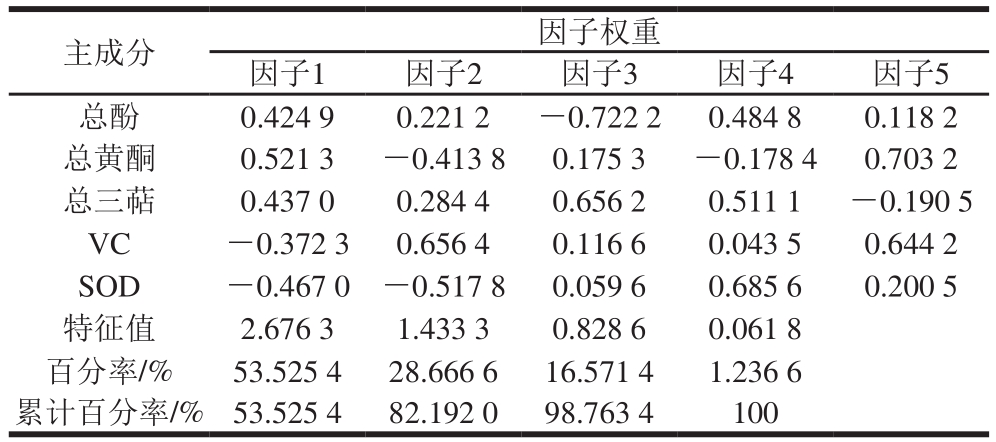
如表4所示,其中因子1的代表性指标为总酚和总黄酮含量,因子2的代表性指标为VC含量,因子3的代表性指标为总三萜含量,因子4的代表性指标为SOD活性。根据特征值大于1的原则提取2 个主成分,包含总酚、总黄酮和VC,它们的累计贡献率约为82.20%,表明活性物质对抗氧化能力的贡献率较为集中;而选择前3 个因子,其累计贡献率能达到98.0%以上,几乎反映了5 个活性物质对抗氧能力贡献的全部信息。前3 个因子的方差贡献率分别为53.53%、28.67%、16.57%。5 种活性物质对抗氧化能力贡献的顺序为总酚、总黄酮>VC>总三萜>SOD。
本研究以‘贵农5号’刺梨果实为实验材料,分析发育过程中刺梨果实总酚、总黄酮、总三萜、VC含量和SOD活性变化以及体外抗氧化活性。结果表明,动态发育过程中的刺梨果实活性物质含量及3 种抗氧化能力变化差异显著。VC含量随果实发育持续增加,随着果实成熟其含量达到最高;SOD活性在整个发育时期均维持在较高水平;而总酚、总黄酮和总三萜含量变化基本一致,均在幼果和成熟果中具有更高含量。整体上,幼果和成熟果具有较高的活性物质含量和抗氧化能力,但花后20 d为果实发育初期,果实小,产量低,其利用率和利用价值也较低。成熟期果实各活性物质含量丰富、抗氧化能力较强,综合营养价值最高,是开发功能食品或医药保健产品的优质原材料。
刺梨历来以极高的VC含量著称,虽然前期也发现其抗氧化能力是多种物质协同作用的结果[12],但人们自然认为VC是其中的主要作用因子。对成熟果实中活性成分与抗氧化能力的关系分析发现总酚与总黄酮含量与DPPH自由基或羟自由基清除能力均呈不同程度正相关关系[32]。之前,对刺梨果实提取物中总酚和总黄酮含量及体外抗氧化能力的研究也发现它们与DPPH等自由基清除能力具有不同程度的一致性[33]。此外,在其他果实如苹果[34]和枇杷[35-37]中也有类似的发现。本研究中,不同发育时期刺梨果实3 种抗氧化能力与总酚、总黄酮及总三萜含量变化相吻合,且均与总酚含量呈极显著正相关(P<0.01);在已检测的5类活性物质中,总酚和总黄酮对抗氧化能力的累计贡献率达到50%以上,而VC和总三萜的贡献率分别约为29%和17%,再次说明刺梨果实的抗氧化性能是几类物质共同作用的结果,而其中总酚和总黄酮发挥着非常重要的作用。本研究结果对于了解刺梨果实活性物质的组成特点及其抗氧化能力具有重要的理论和实践意义。
参考文献:
[1] PHAM-HUY L A, HE H, PHAM-HUY C. Free radicals, antioxidants in disease and health[J]. International Journal of Biomedical Science,2008, 4(2): 89-96.
[2] COOKE M S, EVANSM D, DIZDAROGLU M, et al. Oxidative DNA damage: mechanisms, mutation, and disease[J]. Faseb Journal Official Publication of the Federation of American Societies for Experimental Biology, 2003, 17(10): 1195-214. DOI:10.1096/fj.02-0752rev.
[3] OBULESU M, VENU R, SOMASHEKHAR R. Lipid peroxidation in Alzheimer’s disease: emphasis on metal-mediated neurotoxicity[J].Acta Neurologica Scandinavica, 2011, 124(5): 295-301. DOI:10.1111/j.1600-0404.2010.01483.x.
[4] MAYNE S T. Antioxidant nutrients and chronic disease: use of biomarkers of exposure and oxidative stress status in epidemiologic research[J]. Journal of Nutrition, 2003, 133(Suppl 3): 933S.DOI:10.1093/jn/133.3.933s.
[5] ALBARRACIN S L, STAB B, CASAS Z, et al. Effects of natural antioxidants in neurodegenerative disease[J]. Nutritional Neuroscience,2012, 15(1): 1-9. DOI:10.1179/1476830511Y.0000000028.
[6] KAWAGUCHI K, MATSUMOTO T, KUMZAZWAY. Effects of antioxidant polyphenols on TNF-alpha-related diseases[J].Current Topics in Medicinal Chemistry, 2011, 11(14): 1767-1779.DOI:10.2174/156802611796235152.
[7] SINGH B N, SHANKAR S, SRIVASTAVA R K. Green tea catechin,epigallocatechin-3-gallate (EGCG): mechanisms, perspectives and clinical applications[J]. Biochemical Pharmacology, 2011, 82(12):1807-1821. DOI:10.1016/j.bcp.2011.07.093.
[8] 安华明, 刘明, 杨曼, 等. 刺梨有机酸组分及抗坏血酸含量分析[J]. 中国农业科学, 2011, 44(10): 2094-2100. DOI:10.3846/j.issn.0578-175.2011.10.014.
[9] 鲁敏, 安华明, 赵小红. 无籽刺梨与刺梨果实中氨基酸分析[J].食品科学, 2015, 36(14): 118-121. DOI:10.7506/spkx1002-6630-2015140023.
[10] 方修贵, 李嗣彪, 郑益清. 刺梨的营养价值及其开发利用[J]. 食品工业科技, 2004, 25(1): 137-138. DOI:10.3969/j.issn.1002-0306.2004.01.053.
[11] AGATI G, CEROVIC Z G, MARTA A D, et al. Optically-assessed preformed fl avonoids and susceptibility of grapevine to Plasmopara viticola under different light regimes[J]. Functional Plant Biology,2008, 35(1): 77-84. DOI:10.1071/fp07178.
[12] 安华明, 樊卫国, 刘庆林, 等. 刺梨果实和叶片发育过程中抗坏血酸和抗氧化酶的协同变化[J]. 园艺学报, 2007, 34(5): 1293-1296.DOI:10.3321/j.issn:0513-353x.2007.05.038.
[13] 戴支凯, 余丽梅. 刺梨的药理作用[J]. 中国药房, 2007, 18(21):1668-1669. DOI:10.3969/j.issn.1001-0408.2007.21.029.
[14] 赵转地, 张爱华, 洪峰. 刺梨及其产品的营养及保健药用价值研究进展[J]. 环境与职业医学, 2007, 24(1): 82-84. DOI:10.3969/j.issn.1006-3617.2007.01.025.
[15] 陈坤明, 宫海军, 王锁民. 植物抗坏血酸的生物合成、转运及其生物学功能[J]. 西北植物学报, 2004, 24(2): 329-336. DOI:10.3321/j.issn:1000-4025.2004.02.026.
[16] FAN Z L, WANG Z Y, LIU J R. Cold-field fruit extracts exert different antioxidant and antiproliferative activities in vitro[J]. Food Chemistry,2011, 129(2): 402-407. DOI:10.1016/j.foodchem.2011.04.091.
[17] SHANMUGAM M K, AN H N, KUMAR A P, et al. Targeted inhibition of tumor proliferation, survival, and metastasis by pentacyclic triterpenoids: potential role in prevention and therapy of cancer[J]. Cancer Letters, 2012, 320(2): 158-170. DOI:10.1016/j.canlet.2012.02.037.
[18] 蔡文国, 吴卫, 邵金凤, 等. Folin-Ciocalteu法测定鱼腥草多酚的含量[J].食品科学, 2010, 31(14): 201-204.
[19] ZHANG W, ZHAO X, SUN C, et al. Phenolic composition from different loquat (Eriobotrya japonica Lindl.) cultivars grown in China and their antioxidant properties[J]. Molecules, 2015, 20(1): 542-555.DOI:10.3390/molecules20010542.
[20] 杜薇, 刘国文. 刺梨总黄酮的含量测定及资源利用[J]. 食品科学,2003, 24(1): 112-114. DOI:10.3321/j.issn:1002-6630.2003.01.030.
[21] 罗锋, 汪河滨, 杨玲, 等. 超声-微波协同萃取法提取甘草黄酮的研究[J]. 食品研究与开发, 2006, 27(8): 127-128. DOI:10.3969/j.issn.1005-6521.2006.08.040.
[22] 吴媛琳, 王世军, 张社奇, 等. 修剪对苹果枝(梢)皮层总黄酮含量的影响[J]. 西北林学院学报, 2013, 28(6): 103-107. DOI:10.3969/j.issn.1001-7461.2013.06.20.
[23] 周巧霞, 张经硕, 顾明,等. 测定山楂及提取物总三萜酸的含量[J]. 中国野生植物资源, 2004, 23(5): 43-44. DOI:10.3969/j.issn.1006-9690.2004.05.015.
[24] 张雁冰, 王克让, 刘宏民. 马桑叶中总三萜酸的含量测定[J].时珍国医国药, 2006, 17(4): 529-530. DOI:10.3969/j.issn.1008-0805.2006.04.012.
[25] 王乐乐, 安华明. HPLC测定刺梨果实中维生素C含量方法的优化[J].现代食品科技, 2013, 29(2): 397-400.
[26] 王学奎. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2006.
[27] LI X C, LIN J, GAO Y, et al. Antioxidant activity and mechanism of Rhizoma Cimicifugae[J]. Chemistry Central Journal, 2012, 6(1):140-150. DOI:10.1186/1752-153x-6-140.
[28] RE R, PELLEGRINI N, PROTEGGENTE A, et al. Antioxidant activity applying an improved ABTS radical cationdecolorization assay[J]. Free Radical Biology and Medicine, 1999, 26(9/10): 1231-1237. DOI:10.1016/s0891-5849(98)00315-3.
[29] BENZIE I, STRAIN J J. The ferric reducing ability of plasma (FRAP)as a measure of “antioxidant power”: the FRAP assay[J]. Analytical Biochemistry, 1996, 239(1): 70-76. DOI:10.1006/abio.1996.0292.
[30] 何照范, 牛爱珍, 向显衡, 等. 刺梨果实营养及其维生素C含量变化的研究[J]. 园艺学报, 1984(4): 271-273.
[31] ROUTABOUL J M, KERHOAS L, DEBEAUJON I, et al. Flavonoid diversity and biosynthesis in seed of Arabidopsis thaliana[J]. Planta,2006, 224(1): 96-107. DOI:10.1007/s00425-005-0197-5.
[32] XIANG Q S, XIAO H F, GAO S B, et al. In vitro antioxidant properties of Rosa roxburghiia queous extracts[J]. Australian Journal of Crop Science, 2012, 6(5): 854-860.
[33] HE J Y, ZHANG Y H, MA N, et al. Comparative analysis of multiple ingredients in Rosa roxburghii, and R. sterilis, fruits and their antioxidant activities[J]. Journal of Functional Foods, 2016, 27: 29-41.DOI:10.1016/j.jff.2016.08.058.
[34] 杜国荣. 猕猴桃、柿和苹果果实的抗氧化能力及其抗氧化活性成分的分析[D]. 杨凌: 西北农林科技大学, 2009.
[35] ZHANG W, ZHAO X, SUN C, et al. Phenolic composition from different loquat (Eriobotrya japonica Lindl.) cultivars grown in China and their antioxidant properties[J]. Molecules, 2015, 20(1): 542-555.DOI:10.3390/molecules20010542.
[36] XU H X, CHEN J W. Commercial quality, major bioactive compound content and antioxidant capacity of 12 cultivars of loquat (Eriobotrya japonica Lindl.) fruits[J]. Journal of the Science of Food &Agriculture, 2011, 91(6): 1057-1063. DOI:10.1002/jsfa.4282.
[37] 吴媛琳, 赵听, 张凯煜, 等. 枇杷不同部位主要有效成分含量及抗氧化活性比较[J]. 西北林学院学报, 2015, 30(1): 196-201.DOI:10.3969/j.issn.1001-7461.2015.01.32.
Analysis of Bioactive Substance Contents and Antioxidant Activities in Rosa roxburghii Fruits during Development
ZHOU Guangzhi, LU Min, AN Huaming*
(Guizhou Engineering Research Center for Fruit Crops, College of Agriculture, Guizhou University, Guiyang 550025, China)
Abstract:This study aimed to understand the changes in the contents of bioactive substances and their contributions to the antioxidant properties in the fruits of Rosa roxburghii (Guinong 5 cultivar). The contents of total phenolics, total fl avonoids,total triterpenes and vitamin C and superoxide dismutase (SOD) at different developmental stages were determined. The antioxidant activity in vitro was evaluated by measuring scavenging capacities against 1,1-diphenyl-2-picrylhydrazyl (DPPH)and 2,2’-amino-di(2-ethyl-benzothiazoline sulphonic acid-6)ammonium salt (ABTS) radicals and ferric reducing antioxidant power (FRAP). We also investigated the correlation between the bioactive substance contents and antioxidant activity. The results showed that different bioactive substances in the fruits of Rosa roxburghii changed differently with developmental stage. The VC content increased to reach the maximum at 100 d after anthesis. The contents of total phenolics, total fl avonoids and total triterpenes consistently decreased fi rstly and then increased; higher levels were observed in the young(20-40 d after anthesis) and ripe fruits. However, higher SOD activity was recorded at 40-60 d after anthesis. Overall, three antioxidant properties changed consistently with total phenolic content, showing a significantly positive correlation (P < 0.01).Principal component analysis (PCA) showed the contribution of fi ve bioactive substances to antioxidant capacity was in the decreasing order of total phenolics, total fl avonoids > VC > total triterpenes > SOD, and the cumulative contribution rate of the fi rst three substances to the total variance was over 80%. All of the above results showed that the antioxidant capacity of the fruit was ascribed to the synergistic effects of several bioactive substances, and the total phenolics, total fl avonoids and ascorbate played a decisive role.
Keywords:Rosa roxburghii Tratt.; fruit development; bioactive substance; antioxidant capacity
ZHOU Guangzhi, LU Min, AN Huaming. Analysis of bioactive substance contents and antioxidant activities in Rosa roxburghii fruits during development[J]. Food Science, 2018, 39(22): 20-25. (in Chinese with English abstract)DOI:10.7506/spkx1002-6630-201822004. http://www.spkx.net.cn
引文格式:周广志, 鲁敏, 安华明. 刺梨果实发育过程中主要活性物质含量及其抗氧化性分析[J]. 食品科学, 2018, 39(22): 20-25.DOI:10.7506/spkx1002-6630-201822004. http://www.spkx.net.cn
文章编号:1002-6630(2018)22-0020-06
文献标志码:A
中图分类号:S661.9
DOI:10.7506/spkx1002-6630-201822004
*通信作者简介:安华明(1973—),男,教授,博士,研究方向为果树生理与分子生物学。E-mail:anhuaming@hotmail.com
第一作者简介:周广志(1991—),男,硕士研究生,研究方向为果树种质资源与遗传育种。E-mail:1107684726@qq.com
基金项目:国家自然科学基金重点项目(31660549);贵州省高层次创新型人才培养计划项目(黔科合人才20164016)
收稿日期:2017-09-29