齐宝坤1,赵城彬2,李 杨1,徐 靓1,丁 俭1,王 欢1,江连洲1,*
(1.东北农业大学食品学院,黑龙江 哈尔滨 150030;2.吉林农业大学食品科学与工程学院,吉林 长春 130118)
摘 要:采用差示扫描量热仪、Lowry法以及傅里叶变换红外光谱法分别对大豆11S球蛋白的热性质、溶解性和二级结构进行测定与分析,研究热处理对11S球蛋白溶解性和二级结构的影响。热处理能够使大豆11S球蛋白Td和ΔH降低,导致蛋白质发生部分或完全变性。80 ℃热处理使大豆11S球蛋白的溶解性降低,这可能由于热处理改变了蛋白质的空间结构和表面电荷所致,此时蛋白质的α-螺旋结构逐渐转变为β-折叠和无规卷曲结构。而90 ℃和100 ℃热处理一定时间后,蛋白质溶解性又稍有升高,这可能是形成可溶性聚集体造成的。此时蛋白质的α-螺旋和β-折叠结构向β-转角和无规卷曲结构转变,表明β-转角和无规卷曲结构对热聚集体的形成具有重要作用。此外,蛋白质变性和氢键断裂是导致二级结构相互转变的重要因素。
关键词:热处理;大豆11S球蛋白;溶解性;二级结构
溶解性是大豆蛋白最重要的功能特性之一,它是大豆蛋白其他功能特性的基础,是大豆蛋白可应用性的重要参数。一般来说,蛋白质具有良好的功能特性,前提是必须有较高的溶解性,蛋白质的凝胶性、乳化性等其他功能特性都与蛋白质的溶解性密切相关[1]。在大豆蛋白食品生产加工过程中都包括热处理过程,如热杀菌、喷雾干燥等,这些操作都会对大豆蛋白的溶解性、乳化性、稳定性等功能性质产生较大的影响[2]。在食品生产加工过程中,温度较低或热处理时间较短时大豆蛋白的结构不会发生改变,使大豆蛋白表现出的功能特性不理想,但过高温度或过长时间的热处理又会使大豆蛋白过度变性和蛋白质分子发生聚集,使其失去大部分固有的功能性质[3]。热处理的温度和时间等因素对蛋白质的聚集程度具有重要影响,可以通过调整热处理条件控制蛋白质的溶解、聚集状态,从而控制蛋白质的功能性质[4]。大豆分离蛋白主要是由β-伴大豆球蛋白(7S)和大豆球蛋白(11S)组成,由于11S球蛋白具有紧密的分子结构,多数活性基团被包裹在球状结构的内部,这是限制大豆蛋白在食品中应用的关键因素[5]。因此,研究大豆11S球蛋白对改善大豆分离蛋白功能性质及拓展其应用具有重要意义[6-8]。目前已有较多研究以大豆分离蛋白、大豆7S球蛋白和11S球蛋白为对象,探讨热处理过程中蛋白质的结构变化及聚集行为。Weijers等[9]研究指出蛋白质的变性和聚集程度会对大豆蛋白的功能性质产生显著影响。Chen Nannan等[10]对中性条件下,50~95 ℃形成的大豆11S球蛋白热聚集体进行研究,发现聚集体的粒径随着热处理时间的延长而增大,而且在这种热处理条件下均能形成热凝胶。本实验对大豆11S球蛋白的溶解性和红外光谱进行分析,探讨热处理对大豆11S球蛋白溶解性和二级结构的影响,为功能性大豆食品开发和品质控制提供理论依据。
大豆(东农46) 东北农业大学大豆研究所;Lowry法蛋白质含量测定试剂盒 上海荔达生物科技有限公司;牛血清白蛋白 美国Sigma公司;溴化钾(分析纯) 天津市光复精细化工研究所;其他化学试剂均为国产分析纯。
Allegra 64R低温高速离心机 美国Beckman公司;FD 5-3型冷冻干燥机 美国SIM公司;AKTA-蛋白质纯化仪 美国GE公司;PE Pyris 6差示扫描量热(differential scanning calorimetry,DSC)仪 美国PULUS TA.XT公司;1600PC紫外-可见分光光度计上海美普达仪器有限公司;MAGNA-IR560傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)系统 美国尼高力公司。
1.3.1 大豆11S球蛋白的制备
根据Bojórquez-velázquez等[11]的方法。制备步骤如下:
大豆→脱皮→粉碎→过60 目筛→正己烷脱脂→脱脂大豆粉→与水混合(料液比1∶15(g/mL))→调节pH 7.5→提取2 h→离心分离(10 000×g,15 min)→取上清液→添加亚硫酸钠(0.98 g/L)→提取1 h→调节pH 6.4→4 ℃过夜→离心分离(12 000×g,20 min)→沉淀→冻干→大豆11S球蛋白粗提物。
应用AKTA-蛋白质纯化仪和HiLoad 16/60 Superdex 200 prep grade凝胶制备级预装柱,对大豆11S球蛋白粗提物进行纯化。根据Yadav等[12]的方法,采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分析蛋白质组成,分离胶为12%,浓缩胶为4%。蛋白质量浓度为1 mg/mL,上样量为10 μL,电泳结束后考马斯亮蓝R250进行染色,分析亚基组成。通过光密度扫描结果显示酸性亚基和碱性亚基之和占该泳道光密度强度的92%,即提取的大豆11S球蛋白纯度约为92%。
1.3.2 大豆11S球蛋白的热处理
将一定量大豆11S球蛋白溶于50 mL、0.1 mol/L的磷酸盐缓冲液中,配制成5%的蛋白溶液,蛋白质浓度采用Lowery法测定,参比蛋白为牛血清白蛋白。将蛋白溶液分别密封于加热套管中在温控水浴锅中分别进行80、90 ℃和100 ℃的热处理,热处理时间分别为10、20、30、45、60 min和90 min。
1.3.3 热性质测定
参考Tang Chuanhe等[13]的方法,利用PE Pyris 6-DSC仪测定大豆11S球蛋白样品的热力学特性。称取5 mg的样品放入铝盒中,加入10 μL、0.01 mol/L的磷酸缓冲液,压盘密封,室温条件下放置6 h;将平衡好的样品放到DSC操作台左侧,空白铝盒放在右侧。温度扫描范围为20~120 ℃,升温速率为10 ℃/min,在120 ℃保持1 min;随后以30 ℃/min的速率降温至20 ℃。利用Pyris 6.0软件进行数据采集和处理得到大豆11S球蛋白的DSC曲线,峰值温度为蛋白质的变性温度(Td),曲线与基线间的面积确定热焓变(ΔH)。
1.3.4 溶解性测定
参考Samoto等[14]的方法。称取100 mg大豆11S球蛋白样品分散于10 mL的去离子水中,磁力搅拌30 min后,12 000×g离心20 min。上清液经适度稀释,采用Lowry法测定稀释后的上清液中蛋白质的含量,以牛血清白蛋白为标准物制作标准曲线。蛋白质的溶解性表示为上清液中蛋白质量与样品中总蛋白质量的比值。溶解性按下式计算:
1.3.5 FTIR测定
参照Zhao Chengbin等[15]的方法。将冻干样品置于干燥器内用P2O5充分干燥,称取1 mg样品,与100 mg溴化钾研磨混匀压片后进行FTIR测定。在数据采集期间,为了减少水蒸汽红外吸收的干扰,持续用干燥的N2淋洗测量室。测定波数范围为4 000~400 cm-1,分辨率为4 cm-1,波数精度为0.01 cm-1,扫描次数为64 次,环境温度为25 ℃。谱图处理利用Systat的Peakfit Version 4.12软件拟合,通过计算各子峰积分面积得到二级结构4 种类型的相对含量。
每个样品重复3 次实验,ANOVA差异显著性分析利用SPSS V17.0软件完成,P值小于0.05为显著性差异,采用Origin 8.0软件作图。
表1 热处理大豆11S球蛋白DSC分析参数
Table 1 DSC characteristics of 11S glycinin before and after heat treatment
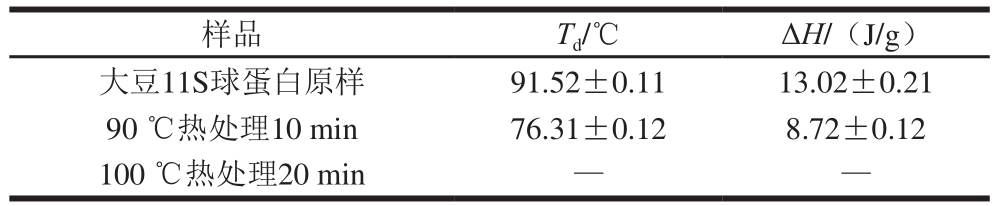
注:—.吸热峰消失。
变性温度(Td)反映蛋白质的热稳定性,Td越高则热稳定性越好,Td越低则热稳定性越差。热焓变(ΔH)表征蛋白质分子的聚集程度,反映有序结构所占比例[16],ΔH越大说明蛋白质的结构越紧密、含有的氢键数量越多、构象越稳定,ΔH越小说明蛋白质的结构越伸展、含有的氢键数量越少、构象越不稳定。由表1可知,未经热处理的大豆11S球蛋白的Td为(91.52±0.11) ℃,ΔH为(13.02±0.21) J/g。Zhao Chengbin等[17]采用DSC对大豆11S球蛋白进行分析,发现蛋白质的Td值分布在85~93 ℃范围内,这与本研究得到的结果相似。相对于未经热处理的大豆11S球蛋白而言,90 ℃热处理10 min能够导致蛋白质Td和ΔH的降低;在100 ℃热处理20 min条件下,大豆11S球蛋白的吸热峰消失,表明蛋白质发生完全变性。造成这种现象的原因可能是由于热处理降低了蛋白质分子间的相互作用,使得蛋白质分子发生一定程度的去折叠展开,分子内部的疏水基团在此过程中发生部分外露,蛋白质亚基组分解离[13],从而使DSC检测加热诱导分子展开需要的热量减少,使Td和ΔH降低,导致蛋白质发生部分或完全变性。

图1 热处理对大豆11S球蛋白溶解性的影响
Fig. 1 Effect of heat treatments on the solubility of 11S glycinin
在一定条件下,对大豆蛋白进行热处理会在一定程度上诱导大豆蛋白形成可溶性或不溶性的蛋白聚集体,从而改变大豆蛋白的溶解性。从图1可以看出,大豆11S球蛋白的溶解性在不同热处理条件下发生了一定程度的改变。经过80 ℃热处理后,大豆11S球蛋白的溶解性随着热处理时间的延长而逐渐降低,这与Mori等[18]报道的一致。经90 ℃和100 ℃热处理后,大豆11S球蛋白的溶解性呈先降低后又小幅度升高的趋势,且100 ℃热处理的大豆11S球蛋白溶解性先降低后升高所需的热处理时间比90 ℃热处理时间短。整体来看,热处理主要是降低了大豆11S球蛋白的溶解性。
大豆11S球蛋白经热处理后表现出的变化趋势可能是由于热处理改变了大豆11S球蛋白的空间结构和表面电荷所致。在未经热处理的球蛋白溶液中,蛋白质分子呈现出一种卷曲的紧密结构,表面被水化膜包围,具有相对的稳定性。热处理过程破坏了大豆11S球蛋白分子的天然结构,加热后的蛋白分子结构去折叠展开,使包埋于球蛋白结构内部的疏水基团暴露出来,相应降低了处于球蛋白分子外部亲水性基团的比例,从而使11S球蛋白溶解性降低[19]。此外,热处理引起蛋白分子结构的展开也可能会导致分子表面带电氨基酸重新排布,使蛋白表面电荷发生改变,对亲水性/疏水性平衡产生影响,从而导致溶解性降低。然而,当温度接近变性温度和处理时间达到一定值时,蛋白分子已经基本上达到最大化的伸展,再继续升高温度或延长处理时间会使蛋白质分子运动加剧,分子间交联机率增加,伸展开的大豆11S球蛋白分子之间通过疏水相互作用可以结合形成可溶性聚集体,使蛋白分子的疏水基团重新包裹在蛋白质分子内部[20]。在90 ℃热处理超过30 min和100 ℃热处理超过20 min时,大豆11S球蛋白的溶解性均有一定程度的升高,这可能是形成可溶性聚集体造成的。
FTIR能够提供蛋白质分子中的氨基基团、酰胺I带、酰胺II带、酰胺III带、蛋白质环状结构中的C—C振动和C—O—O糖苷键振动的波段信息[21]。如图2所示,其中酰胺I带(1 600~1 700 cm-1)的谱峰对于蛋白质结构分析最为重要,与蛋白质的二级结构之间存在一定的对应关系[22]。利用波段缩小技术将FTIR谱图中的酰胺I带细分,得到大豆11S球蛋白二级结构的定性定量信息[23]。不同热处理条件下大豆11S球蛋白的FTIR谱图分析依次进行基线校正、去卷积处理、二阶导数拟合处理,经多次拟合确保拟合残差最小[24]。如图3所示,确定拟合图谱中各子峰与二级结构类型的对应关系,通过计算各子峰积分面积得到二级结构4 种类型的相对含量。各子峰与二级结构对应关系:1 650~1 660 cm-1为α-螺旋,1 610~1 640 cm-1为β-折叠,1 661~1 700 cm-1为β-转角,1 640~1 650 cm-1为无规卷曲,1 612 cm-1附近的吸收峰为蛋白质和多肽的侧链吸收[25]。
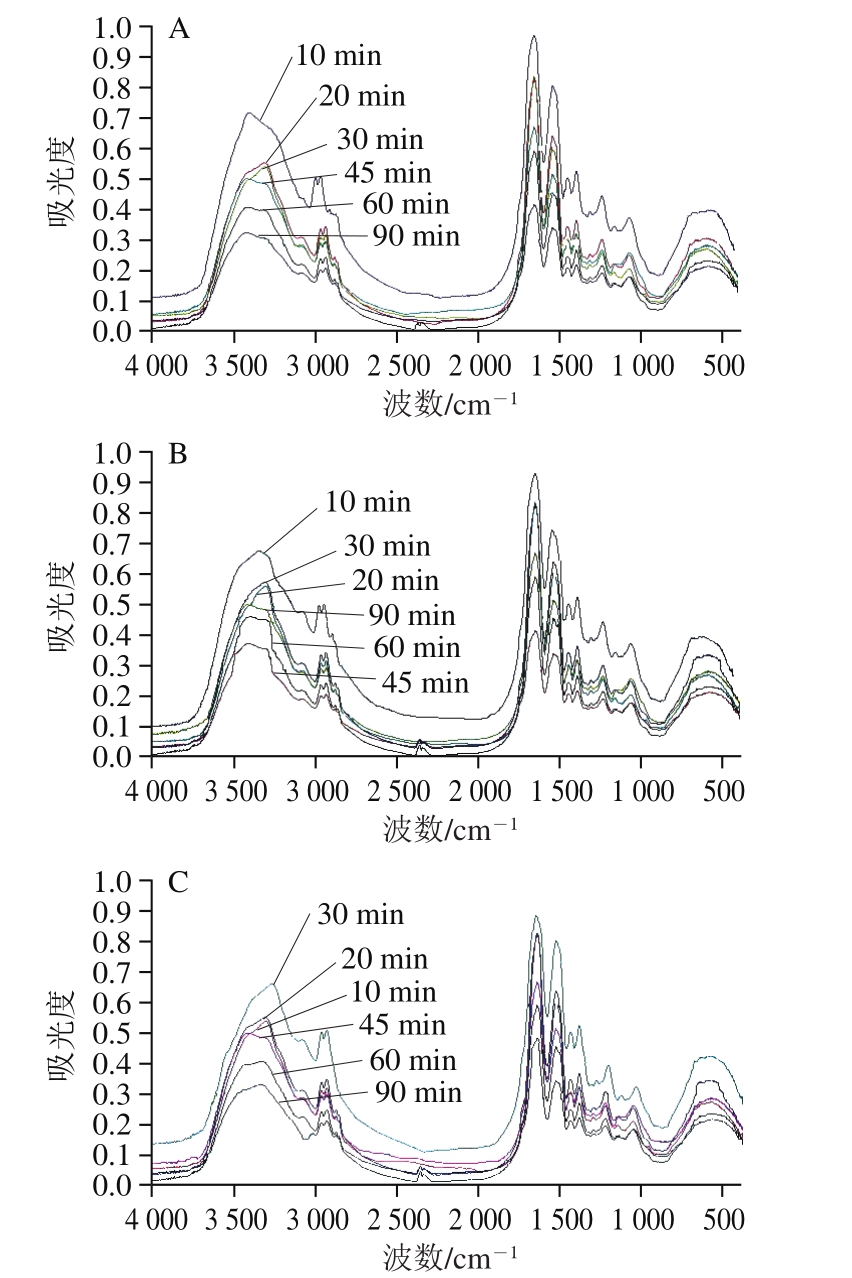
图2 热处理条件下大豆11S球蛋白FTIR谱图
Fig. 2 FTIR spectra of 11S glycinin under different heat treatment conditions
A. 80 ℃热处理;B. 90 ℃热处理;C. 100 ℃热处理。图4同。

图3 未经热处理大豆11S球蛋白去卷积酰胺I带二阶导数拟合图谱
Fig. 3 Second-derivative fi tting spectra in the amide I region for unheated 11S glycinin
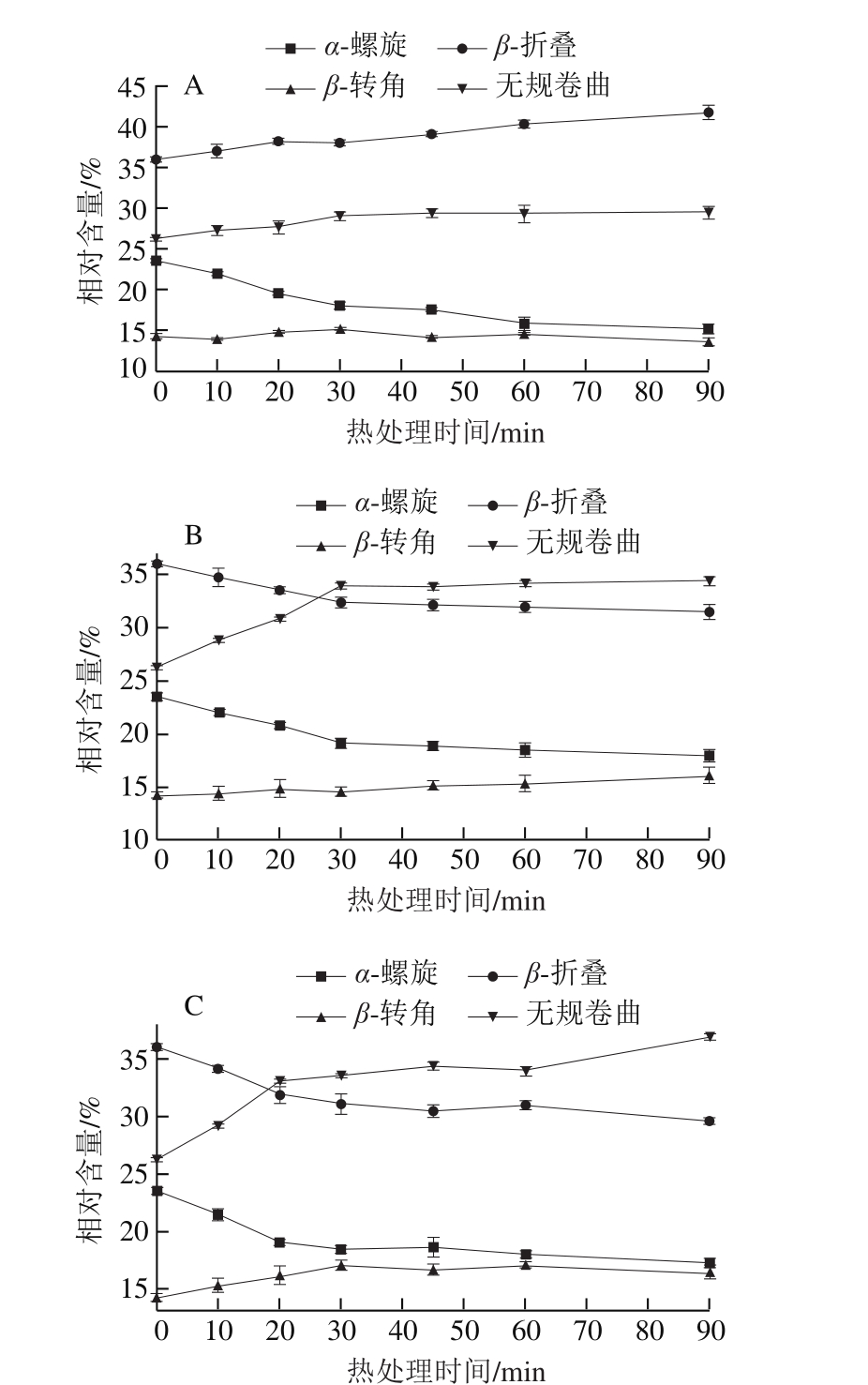
图4 热处理条件下大豆11S球蛋白二级结构相对含量的变化
Fig. 4 Changes in secondary structure contents of 11S glycinin under different heat treatment conditions
如图4A所示,在80 ℃热处理条件下,随热处理时间的延长,大豆11S球蛋白二级结构中α-螺旋结构相对含量逐渐降低,而β-折叠和无规卷曲结构相对含量逐渐升高,β-转角结构相对含量变化较小,这表明α-螺旋结构逐渐转变为β-折叠和无规卷曲结构。Moriyama等[26]对热变性过程中牛血清蛋白的二级结构进行研究,发现随着加热时间的延长,蛋白质中α-螺旋结构相对含量逐渐降低,而β-折叠和无规卷曲结构相对含量逐渐增加,这与本实验结果一致。分析原因可能是在加热过程中11S球蛋白分子相邻肽链之间的氢键受到破坏,使蛋白质分子内α-螺旋结构随之展开并形成松散的无规卷曲结构[27],从而使α-螺旋结构相对含量降低而无规卷曲结构相对含量升高。蛋白质分子中β-折叠结构是一种相当伸展的结构,由于氢键作用,β-折叠结构易存在于蛋白质聚集体的内部。热处理使β-折叠结构相对含量增加的原因可能是由于11S球蛋白分子内部的α-螺旋结构解旋后发生了分子间的相互作用产生较多的β-折叠结构[28]。与α-螺旋结构相比,β-折叠结构的弱水合作用使其在热聚集体和网络结构的形成过程中具有重要作用,这是由2 种结构中水分子与羰基基团相互作用几何学分布差异造成的[29]。
如图4B、C所示,在90 ℃和100 ℃热处理条件下,随热处理时间的延长,大豆11S球蛋白中α-螺旋和β-折叠结构相对含量逐渐降低,而β-转角和无规卷曲结构相对含量逐渐升高,表明大豆11S球蛋白分子的α-螺旋和β-折叠结构向β-转角和无规卷曲结构转变。这种结构改变可能与高温处理条件下大豆11S球蛋白中分子发生变性有关,发生变性的蛋白分子内部氢键遭到破坏,蛋白质分子去折叠展开,而α-螺旋和β-折叠结构主要是以氢键为作用力,因此氢键的破坏导致二者含量的降低[30]。此外,β-转角和无规卷曲结构可能是由更为有序结构单元转化而来,热聚集体分子间的β-折叠结构也易于转变为β-转角结构[31],从而导致β-转角和无规卷曲结构相对含量的升高。由此推断,β-转角和无规卷曲结构对热聚集体的形成具有重要作用。
热处理能够使大豆11S球蛋白Td和ΔH降低,甚至没有吸热峰,说明热处理导致蛋白质发生部分或完全变性。80 ℃热处理使大豆11S球蛋白的溶解性逐渐降低,这可能是由于热处理改变了蛋白质的空间结构和表面电荷所致。经90 ℃和100 ℃热处理后,11S球蛋白的溶解性呈先降低后升高的趋势,溶解性的升高可能是形成可溶性聚集体造成的。FTIR分析表明,80 ℃热处理能够使大豆11S球蛋白二级结构中的α-螺旋结构逐渐转变为β-折叠和无规卷曲结构。90 ℃和100 ℃热处理使α-螺旋和β-折叠结构向β-转角和无规卷曲结构转变。二级结构的变化可能与热处理条件下大豆11S球蛋白中分子发生变性有关,发生变性的蛋白分子内部氢键遭到破坏,蛋白质分子去折叠展开,从而导致蛋白质内二级结构发生相互转变。
参考文献:
[1] 孙欣, 王璋, 王莉, 等. 轻度酶解对大豆蛋白胶凝性和疏水性的影响[J]. 食品科学, 2005, 26(12): 37-40. DOI:10.3321/j.issn:1002-6630.2005.12.003.
[2] ZHAO C B, ZHOU L Y, LIU J Y, et al. Effect of ultrasonic pretreatment on physicochemical characteristics and rheological properties of soy protein/sugar Maillard reaction products[J].Journal of Food Science and Technology, 2016, 53(5): 2342-2351.DOI:10.1007/s13197-016-2206-z.
[3] HU X Z, CHENG Y Q, FAN J F, et al. Effects of drying method on physicochemical and functional properties of soy protein isolates[J].Journal of Food Processing and Preservation, 2010, 34(3): 520-540.DOI:10.1111/j.1745-4549.2008.00357.x.
[4] ZHANG J B, WU N, YANG X, et al. Improvement of emulsifying properties of Maillard reaction products from β-conglycinin and dextran using controlled enzymatic hydrolysis[J]. Food Hydrocolloids,2012, 28(2): 301-312. DOI:10.1016/j.foodhyd.2012.01.006.
[5] LUO D H, ZHAO Q Z, ZHAO M M, et al. Effects of limited proteolysis and high-pressure homogenisation on structural and functional characteristics of glycinin[J]. Food Chemistry, 2010,122(1): 25-30. DOI:10.1016/j.foodchem.2010.02.011.
[6] CRUZ-TORRES L F D L, PÉREZ-MARTÍNEZ J D, SÁNCHEZBECERRIL M, et al. Physicochemical and functional properties of 11S globulin from chan (Hyptis suaveolens L. Poit) seeds[J]. Journal of Cereal Science, 2017, 77: 66-72. DOI:10.1016/j.jcs.2017.06.017.
[7] WU C, HUA Y, CHEN Y, et al. Effect of temperature, ionic strength and 11S ratio on the rheological properties of heat-induced soy protein gels in relation to network proteins content and aggregates size[J]. Food Hydrocolloids, 2017, 66: 389-395. DOI:10.1016/j.foodhyd.2016.12.007.
[8] ZHAO H, LI W, QIN F, et al. Calcium sulphate-induced soya bean protein tofu-type gels: inf l uence of denaturation and particle size[J].International Journal of Food Science and Technology, 2016, 51(3):731-741. DOI:10.1111/ijfs.13010.
[9] WEIJERS M. Aggregate morphology and network properties of ovalbumin[D]. Wageningen: Wageningen Universiteit, 2005.
[10] CHEN N N, ZHAO M, CHASSENIEUX C, et al. Thermal aggregation and gelation of soy globulin at neutral pH[J]. Food Hydrocolloids,2016, 61: 740-746. DOI:10.1016/j.foodhyd.2016.06.028.
[11] BOJÓRQUEZ-VELÁZQUEZ E, LINO-LÓPEZ G J, HUERTAOCAMPO J A, et al. Purification and biochemical characterization of 11S globulin from chan (Hyptis suaveolens L. Poit)seeds[J]. Food Chemistry, 2016, 192: 203-211. DOI:10.1016/j.foodchem.2015.06.099.
[12] YADAV M P, PARRIS N, JOHNSTON D B, et al. Corn fi ber gum and milk protein conjugates with improved emulsion stability[J].Carbohydrate Polymers, 2010, 81: 476-483. DOI:10.1016/j.carbpol.2010.03.003.
[13] TANG C H, CHOI S M, MA C Y. Study of thermal properties and heat-induced denaturation and aggregation of soy proteins by modulated differential scanning calorimetry[J]. International Journal of Biological Macromolecules, 2007, 40(2): 96-104. DOI:10.1016/j.ijbiomac.2006.06.013.
[14] SAMOTO M, MAEBUCHI M, MIYAZAKI C, et al. Abundant proteins associated with lecithin in soy protein isolate[J].Food Chemistry, 2007, 102(1): 317-322. DOI:10.1016/j.foodchem.2006.05.054.
[15] ZHAO C B, ZHANG H, XU X Y, et al. Effect of acetylation and succinylation on physicochemical properties and structural characteristics of oat protein isolate[J]. Process Biochemistry, 2017,57: 117-123. DOI:10.1016/j.procbio.2017.03.022.
[16] ZHANG X, HUANG L, NIE S, et al. FTIR characterization of the secondary structure of insulin encapsulated within liposome[J]. Journal of Chinese Pharmaceutical Sciences, 2003, 12(1): 11-14.
[17] ZHAO C B, WU F, LI Y, et al. Effects of β-glucans on properties of soya bean protein isolate thermal gels[J]. International Journal of Food Science and Technology, 2015, 50(2): 347-355. DOI:10.1111/ijfs.12635.
[18] MORI T, NAKAMURA T, UTSUMI S. Behavior of intermolecular bond formation in the late stage of heat-induced gelation of glycinin[J].Journal of Agricultural and Food Chemistry, 1986, 34(1): 33-36.DOI:10.1021/jf00067a008.
[19] MARANGONI A G, BARBUT S, MCGAULEY S E, et al. On the structure of particulate gels-the case of salt-induced cold gelation of heat-denatured whey protein isolate[J]. Food Hydrocolloids, 2000,14(1): 61-74. DOI:10.1016/S0268-005X(99)00046-6.
[20] NISHINARI K, FANG Y, GUO S, et al. Soy proteins: a review on composition, aggregation and emulsification[J]. Food Hydrocolloids,2014, 39(2): 301-318. DOI:10.1016/j.foodhyd.2014.01.013.
[21] BARTH A. Infrared spectroscopy of proteins[J]. Biochimica et Biophysica Acta, 2007, 1767(9): 1073-1101. DOI:10.1016/j.bbabio.2007.06.004.
[22] ZHAO X, CHEN F, XUE W, et al. FTIR spectra studies on the secondary structures of 7S and 11S globulins from soybean proteins using AOT reverse micellar extraction[J]. Food Hydrocolloids, 2008,22(4): 568-575. DOI:10.1016/j.foodhyd.2007.01.019.
[23] MAUERER A, LEE G. Changes in the amide I FT-IR bands of poly-L-lysine on spray-drying from α-helix, β-sheet or random coil conformations[J]. European Journal of Pharmaceutics and Biopharmaceutics, 2006, 62(2): 131-142. DOI:10.1016/j.ejpb.2005.08.005.
[24] MENG G, MA C Y. Characterization of globulin from Phaseolus angularis (red bean)[J]. International Journal of Food Science and Technology, 2002, 37(6): 687-695. DOI:10.1046/j.1365-2621.2002.00601.x.
[25] CARBONARO M, MASELLI P. Relationship between digestibility and secondary structure of raw and thermally treated legume proteins:a Fourier transform infrared (FT-IR) spectroscopic study[J]. Amino Acids, 2012, 43: 911-921. DOI:10.1007/s00726-011-1151-4.
[26] MORIYAMA Y, KAWASAKA Y, TAKEDA K. Protective effect of small amounts of sodium dodecyl sulfate on the helical structure of bovine serum albumin in thermal denaturation[J]. Journal of Colloid and Interface Science, 2003, 257(1): 41-46. DOI:10.1016/S0021-9797(02)00017-6.
[27] HOU D H, CHANG S K. Structural characteristics of purified glycinin from soybeans stored under various conditions[J]. Journal of Agricultural and Food Chemistry, 2004, 52(12): 3792-3800.DOI:10.1021/jf035072z.
[28] LEE H J, CHOI C, LEE S J. Membrane-bound α-synuclein has a high aggregation propensity and the ability to seed the aggregation of the cytosolic form[J]. Journal of Biological Chemistry, 2002, 277: 671-678. DOI:10.1074/jbc.M107045200.
[29] PRZYBYCIEN T M, BAILEY J E. Secondary structure perturbations in salt-induced protein precipitates[J]. Biochimica et Biophysica Acta,1991, 1076(1): 103-111. DOI:10.1016/0167-4838(91)90226-P.
[30] SHILPASHREE B G, ARORA S, CHAWLA P, et al. Effect of succinylation on physicochemical and functional properties of milk protein concentrate[J]. Food Research International, 2015, 72(2): 223-230. DOI:10.1016/j.foodres.2015.04.008.
[31] LIU G, LI J, SHI K, et al. Composition, secondary structure, and selfassembly of oat protein isolate[J]. Journal of Agricultural and Food Chemistry, 2009, 57(11): 4552-4558. DOI:10.1021/jf900135e.
Effect of Heat Treatment on Solubility and Secondary Structure of Soybean 11S Glycinin
QI Baokun1, ZHAO Chengbin2, LI Yang1, XU Liang1, DING Jian1, WANG Huan1, JIANG Lianzhou1,*
(1. College of Food Science, Northeast Agricultural University, Harbin 150030, China;2. College of Food Science and Engineering, Jilin Agricultural University, Changchun 130118, China)
Abstract:The thermal properties, solubility and secondary structure of soybean 11S glycinin were measured by using differential scanning calorimetry, the Lowry method and Fourier transform infrared (FTIR) spectroscopy, respectively. The effects of heat treatment on the solubility and secondary structure of 11S glycinin were evaluated. The results obtained showed that Tdand ΔH were reduced by heat treatment, leading to partial or complete denaturation of protein. Heat treatment at 80 ℃ could reduce the solubility of soybean 11S globulin, which may be due to the changes in the spatial structure and surface charge of protein caused by heat treatment. At the same time, the α-helix structure of protein was gradually transformed into β-sheet and random coil structure. However, the solubility of protein was slightly increased after heating for a certain time at 90 or 100 ℃, which was ascribed to the formation of soluble aggregates. Furthermore, the α-helix and β-sheet structures of protein were transformed into β-turn and random coil structure, indicating that the β-turn and random coil structures play an important role in the formation of heat-induced aggregates. In addition, protein denaturation and rupture of hydrogen bond were important causes for mutual transformation of the secondary structures.
Keywords:heat treatment; 11S glycinin; solubility; secondary structure
DOI:10.7506/spkx1002-6630-201822007. http://www.spkx.net.cn QI Baokun, ZHAO Chengbin, LI Yang, et al. Effect of heat treatment on solubility and secondary structure of soybean 11S glycinin[J]. Food Science, 2018, 39(22): 39-44. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201822007.http://www.spkx.net.cn
引文格式:齐宝坤, 赵城彬, 李杨, 等. 热处理对大豆11S球蛋白溶解性和二级结构的影响[J]. 食品科学, 2018, 39(22): 39-44.
文章编号:1002-6630(2018)22-0039-06
文献标志码:A
中图分类号:TS201.2
DOI:10.7506/spkx1002-6630-201822007
*通信作者简介:江连洲(1960—),男,教授,博士,研究方向为粮食、油脂及植物蛋白工程。E-mail:jianglianzhou@163.com
第一作者简介:齐宝坤(1986—),男,讲师,博士,研究方向为粮食、油脂及植物蛋白工程。E-mail:zhaochengbin66@126.com
基金项目:“十三五”国家重点研发计划重点专项(2016YFD0401402)
收稿日期:2017-09-10