
宛美志,孟宪军*
(沈阳农业大学食品学院,辽宁 沈阳 110866)
摘 要:对蔓越莓花色苷的组成进行鉴定,并对其抗氧化能力进行测定。采用pH示差法测定花色苷提取量,超高压辅助提取蔓越莓花色苷含量为(75.49±0.43)mg/100 g,常规溶剂提取蔓越莓花色苷含量为(67.31±1.08)mg/100 g,蔓越莓中总花色苷含量为(79.52±0.50)mg/100 g;选择AB-8大孔树脂对蔓越莓花色苷粗提物进行纯化,冻干粉中花色苷含量从(46.10±0.92)mg/g提高到(309.26±2.37)mg/g。通过测定1,1-二苯基-2-三硝基苯肼自由基清除率、2,2’-联氮基-双-(3-乙基苯并噻唑啉-6-磺酸)二铵盐自由基清除能力和总抗氧化能力,比较蔓越莓花色苷与VC的抗氧化能力。结果表明:同质量浓度条件下,蔓越莓花色苷的抗氧化能力强于VC。通过高效液相色谱-质谱联用技术在蔓越莓中鉴定出7 种花色苷:芍药素-3,5-二己糖苷、矢车菊素-3-半乳糖苷、矢车菊素-3-葡萄糖苷、矢车菊素-3-阿拉伯糖苷、芍药素-3-半乳糖苷、芍药素-3-葡萄糖苷、芍药素-3-阿拉伯糖苷,其中芍药素-3,5-二己糖苷首次在蔓越莓中被鉴定出。
关键词:蔓越莓花色苷;超高压;高效液相色谱-质谱联用;抗氧化能力
蔓越橘又名蔓越莓、小红莓,原名“鹤莓”,因蔓越莓的花朵形似鹤的头和喙而得名,果实表皮鲜红,果肉泛白,空心有籽,干物质含量高且质地较轻。蔓越橘属于杜鹃花科越橘属红莓苔子亚属,植株为常绿灌木,喜生长在潮湿寒冷、地质弱酸的泥炭土壤,主要集中分布在北美、北欧地区,全球产区不到4万 英亩[1]。我国蔓越莓栽培区主要集中在大兴安岭地区、辽宁省和吉林省的东南部,这些区域具备蔓越橘生长所需要的土壤、温度、光照、水分以及无霜期等环境条件。蔓越橘富含活性成分[2]、营养价值极高[3-5]。柯春林等[6]研究表明乙醇提取蔓越莓花色苷含量可达5.5%;Cesoniene等[7]研究表明不同性系野生蔓越莓花色苷含量为40.7~207.3 mg/100 g;蔓越莓花色苷具有抗氧化能力[6,8](如清除1,1-二苯基-2-三硝基苯肼(1,1-dipheny1-2-picrylhydrazyl,DPPH)自由基的能力[9-11]、清除2,2’-联氮基-双-(3-乙基苯并噻唑啉-6-磺酸)二铵盐(2,2’-aminodi(3-ethyl-benzothiazoline sulphonic acid-6)ammonium salt,ABTS)自由基的能力[10]和还原铁离子的能力[11-12]等)及基于抗氧化活性的其他生理功能。近年来,随着食品科学和食品营养学等学科的发展,蔓越莓的营养价值得到普遍重视。本实验通过对蔓越莓花色苷进行提取、纯化、花色苷组成鉴定和抗氧化能力测定,为蔓越莓资源的发展、评价及利用提供理论依据。
超高压辅助提取通常的压力范围在100~600 MPa之间。在保证食品安全性的前提下,超高压提取具有提取时间短、提取率高、对生物活性物质影响小等特点[13-14]。目前超高压提取被视为生物活性物质最具潜力的提取方式之一,已经成功应用到多糖[15]、多酚[16]、果胶[17]等活性成分的提取,但是利用超高压提取技术提取蔓越莓花色苷鲜见报道。
高效液相色谱-质谱(high performance liquid chromatography-mass spectrometry,HPLC-MS)联用技术被广泛应用于食品、生物、医药、化工、环境和有害物质残留检测等方面[18-19]。Gomes等[13]通过超高效液相色谱和质谱联用技术鉴定出蔓越莓中7 种花色苷,分别为矢车菊素-3-半乳糖苷、矢车菊素-3-葡萄糖苷、矢车菊素-3-阿拉伯糖苷、芍药素-3-半乳糖苷、芍药素-3-葡萄糖苷、锦葵素-3-半乳糖苷、芍药素-3-阿拉伯糖苷。Cesonienė等[7]研究表明蔓越莓中包含6 种花色苷,其中以芍药素-3-半乳糖苷最常见。Jin[20]和Wang Yifei[21]等在蔓越莓中鉴定出矢车菊素-3-葡萄糖苷等花色苷和杨梅素-3-葡萄糖苷等类黄酮类化合物。
蔓越莓产地为吉林省,鲜果采摘后保存在-80 ℃超低温冰箱中,备用。
DPPH 美国Sigma公司;AB-大孔树脂 安徽三星树脂科技有限公司;ABTS试剂盒、T-AOC试剂盒南京建成生物工程研究所;无水乙醇(分析纯) 天津市富宇精细化工有限公司;盐酸(分析纯) 西陇化工股份有限公司;氯化钾、无水乙酸钠(均为分析纯)国药集团化学试剂有限公司。
MJ-BL25B3美的搅拌机 广东美的生活电器制造有限公司;BSA224S型电子分析天平、PB-10型pH计 北京赛多利斯科学仪器有限公司;RE-52型旋转蒸发仪、玻璃层析柱(18 mm×300 mm) 上海亚荣生化仪器厂;UV-1600型紫外-可见分光光度仪 北京瑞利分析仪器公司;DK-S26型电热恒温水浴锅 上海精宏实验设备有限公司;BYGY5L型超高压杀菌机 温州滨一机械科技有限公司;SHZ-D(III)循环水式真空泵 巩义市予华仪器有限责任公司;HL-2恒流泵、BS-100A自动部分收集器 上海沪西分析仪器厂有限公司;Epoch型酶标仪美国博腾仪器有限公司;1100型HPLC-MS联用仪美国Agilent公司;LG0.2真空冷冻干燥机 沈阳新阳航空速冻设备制造有限公司。
1.3.1 蔓越莓花色苷的超高压辅助提取
参考李新原等[16]的方法稍作修改。称取蔓越莓冻果于室温条件下避光解冻,转入搅拌机中打浆,准确称取20 份5.0 g蔓越莓果浆无损失地转移到PET真空包装袋中,分别加入100 mL体积分数为60%乙醇溶液(用质量分数36%~38%的浓盐酸将乙醇溶液调至pH值为2.0),塑封机封口,超高压400 MPa,提取12 min,过滤,测定其吸光度,旋转蒸发除去乙醇,所得花色苷浓缩液冷冻干燥成粉,-80 ℃避光密封贮存,使用时按需配制。
1.3.2 蔓越莓花色苷的常规溶剂提取
参考柯春林等[6]的方法稍作修改。称取等质量的蔓越莓果浆于烧杯中,按照料液比1∶20(g/mL)加入体积分数60%乙醇溶液(用质量分数36%~38%的浓盐酸将乙醇溶液调至pH值为2.0),保鲜膜封口,水浴温度40 ℃,提取60 min,测定其吸光度。在此条件下所得蔓越莓花色苷样品与超高压辅助提取蔓越莓花色苷样品作比较。
1.3.3 蔓越莓花色苷的纯化
称取一定量的AB-8大孔树脂,依次用无水乙醇、质量分数5%盐酸溶液、质量分数2%氢氧化钠溶液进行预处理,预处理后的大孔树脂采用湿法装柱,树脂填充体积为玻璃层析柱的2/3,以2 mL/min的流速将400 mL蒸馏水泵入层析柱进行平衡过滤,平衡后以2 mL/min的流速泵入由1.3.1节所得冻干粉配制的花色苷溶液,泵入量为大孔树脂体积的1/2,然后静置吸附12 h。待花色苷充分吸附后以4.3 mL/min的流速将800 mL蒸馏水泵入层析柱,洗去花色苷溶液中的蛋白质、多糖、无机盐等杂质。用无水乙醇以2 mL/min的流速洗脱花色苷,收集洗脱液,重复过柱2 次,最终得到的洗脱液转入旋转蒸发仪浓缩除去乙醇,浓缩液冷冻干燥成粉,密封,避光贮存在-80 ℃冰箱中,备用。
1.3.4 花色苷含量测定
取1 mL花色苷溶液,分别用pH 1.0的氯化钾缓冲溶液和pH 4.5的乙酸钠缓冲溶液稀释至10 mL,混匀后于室温条件下静置反应15~20 min,分别在波长520 nm和700 nm处,用1 cm比色皿测定吸光度,重复操作3 次,取平均值。采用示差法按照公式(1)、(2)计算蔓越莓花色苷的含量:

式中:ΔA为缓冲液稀释后的吸光度;V为提取液体积/mL;n为稀释倍数;M为矢车菊素-3-葡萄糖苷摩尔质量449.2 g/mol;ξ为矢车菊-3-葡萄糖苷消光系数26 900 L/(mol·cm);m为称取样品质量/g;b为比色皿厚度/cm。
1.3.5 花色苷提取率测定
将蔓越莓冻果于搅拌机中打浆,准确称取5.0 g蔓越莓果浆,加入50 mL体积分数60%乙醇溶液(用质量分数36%~38%的浓盐酸将乙醇溶液调至pH值为2.0),混匀,超高压400 MPa,提取时间12 min,过滤,滤渣重复提取2 次,合并滤液,取1 mL滤液,采用pH示差法按照公式(1)、(2)计算蔓越莓总花色苷的含量。超高压辅助提取蔓越莓花色苷的提取率是指粗提液中花色苷含量与蔓越莓总花色苷含量的百分比,按公式(3)计算:
式中:C1为超高压辅助提取蔓越莓花色苷粗提液中花色苷含量/(mg/g);C总为蔓越莓总花色苷含量/(mg/g)。
1.3.6 花色苷组成鉴定
准确称取10 μg 1.3.2节中所得冻干粉,用色谱级甲醇稀释至2 mL,经0.45 μm滤膜过滤,待测。
HPLC条件:1100型HPLC仪(配G4212B二极管阵列检测器);C18色谱柱(250 mm×4.6 mm,5 μm);流动相A为乙腈;流动相B为0.1%甲酸溶液;梯度洗脱程序:0~45 min,0%~45% A;45~50 min,0% A;流速0.7 mL/min;柱温25 ℃;进样量20 μL;检测波长520 nm。
MS条件:正离子模式,全自动二级质谱扫描;质量扫描范围m/z 50~1 000;干燥气压力40 psi;流速12 L/min;温度350 ℃;毛细管电压3 500 V。
1.3.7 DPPH自由基清除能力测定
参照吕春茂等[22]的方法稍作修改。用无水乙醇配制0.2 mmol/L DPPH溶液,称取1.3.2节所得花色苷冻干粉配制成不同质量浓度的待测液,100 μL花色苷待测液加入100 μL DPPH溶液,混匀后于室温避光放置30 min,在波长517 nm处测定吸光度为A1,无水乙醇溶液代替花色苷溶液测定吸光度为A0,无水乙醇代替DPPH溶液测定吸光度为A2;以同质量浓度VC作阳性对照。根据公式(4)计算DPPH自由基清除率:
1.3.8 ABTS+·清除能力测定
称取1.3.2节所得花色苷冻干粉配制成不同质量浓度的待测液,根据试剂盒方法配制ABTS工作液,200 μL ABTS工作液加入10 μL花色苷待测液,混匀后室温孵育6 min,在波长734 nm处测定吸光度,以同质量浓度VC作阳性对照,以Trolox代替花色苷测定吸光度作标准曲线,根据标准曲线计算花色苷待测液的ABTS+·清除能力。
1.3.9 总抗氧化能力测定
参照安小琦等[23]的方法稍作修改,称取1.3.2节所得花色苷冻干粉配制成不同质量浓度的待测液,以同质量浓度VC作阳性对照,按照T-AOC试剂盒说明书加入试剂,在波长520 nm处测定吸光度。T-AOC测定原理为花色苷和VC能使Fe3+还原成Fe2+,Fe2+与菲啉类物质络合,通过比色法测定抗氧化能力。在37 ℃时,每分钟每毫升花色苷溶液,使反应体系的吸光度,每增加0.01时,为一个总抗氧化能力单位(U)。根据公式(5)计算总抗氧化能力:
所有实验均重复操作3 次,采用Excel 2007软件对数据进行整理绘图,SPSS 19.0软件对数据进行方差分析(Duncan’s差异显著性分析),P<0.05,表示差异显著。
采用pH示差法测得超高压辅助提取蔓越莓花色苷含量为(75.49±0.43)mg/100 g,常规溶剂提取蔓越莓花色苷含量为(67.31±1.08)mg/100 g;蔓越莓中总花色苷含量为(79.52±0.50)mg/100 g。如表1所示,超高压辅助提取蔓越莓花色苷提取率为(94.92±0.54)%,常规溶剂提取蔓越莓花色苷提取率为(84.65±1.36)%。与常规溶剂提取法相比,超高压辅助提取法时间短,操作条件温和(不需加热),提取率显著高于常规溶剂提取法,因此,采用超高压辅助提取蔓越莓花色苷更合适。1.3.1节中所得粗提物冻干粉的花色苷含量为(46.10±0.92)mg/g,经AB-8大孔树脂纯化后,所得纯化物冻干粉的花色苷含量提高到(309.26±2.37)mg/g。
表1 不同方法提取条件及提取率的比较
Table 1 Comparison of extraction conditions and anthocyanin yield by different extraction methods


图1 蔓越莓花色苷色谱图
Fig. 1 HPLC chromatogram of cranberry anthocyanins
图中峰号与表2对应。

图2 芍药素-3,5-二己糖苷质谱图
Fig. 2 Mass spectra of peonidin-3,5-dihexoside
A.一级质谱;B.二级质谱。
表2 HPLC-MS鉴定蔓越莓花色苷种类
Table 2 Identi fi cation of cranberry anthocyanins by HPLC-MS
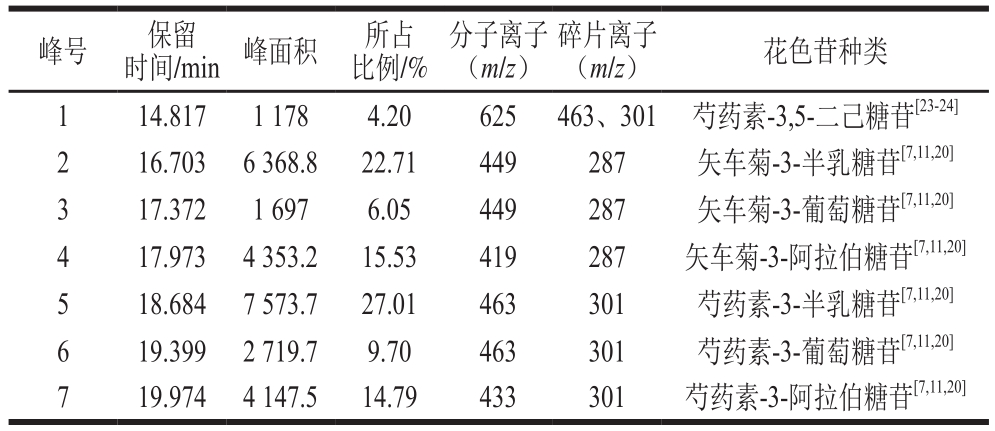
通过HPLC-MS联用技术对蔓越莓花色苷进行组成鉴定,如图1、2,表2所示。结合各物质的色谱保留时间、分子离子峰和碎片离子峰,鉴定出蔓越莓中主要有7 种花色苷,与Gomes[13]和Jin[20]等的研究结果基本一致,芍药素-3-半乳糖苷的含量最高,其次为矢车菊素-3-半乳糖苷和矢车菊素-3-阿拉伯糖苷,与Cesonienė[7]和Oszmiański[11]等研究结果一致。
如图2所示,峰1物质分子离子m/z 625,碎片离子m/z 463、301,是由分子离子失去一分子己糖苷[M-162]+而成,m/z 463和m/z 301之间也相差一个162的己糖苷,且m/z 301是芍药素的配离子峰,推测峰1物质可能是带有2 个己糖苷的芍药素花色苷,参考相关文献[23-24]可知峰1物质是芍药素-3,5-二己糖苷。该种花色苷首次在蔓越莓中被检测到。
综合参考文献[7,11,13,20]可知,峰2、3均为分子离子m/z 449,碎片离子m/z 287的物质,m/z 287是矢车菊素配离子峰,根据两者出峰顺序和保留时间不同分析可知,峰2物质是矢车菊-3-半乳糖苷,峰3物质是矢车菊-3-葡萄糖苷。峰4物质是母离子失去一分子阿拉伯糖[M-132]+而成,综合保留时间分析,峰4物质是矢车菊-3-阿拉伯糖苷。峰5物质的碎片离子m/z 301是芍药素配离子峰,是母离子失去一分子六碳糖[M-162]+而成,可知峰5物质是芍药素-3-半乳糖苷。峰6物质的碎片离子m/z 301是芍药素的配离子峰,是由母离子失去一个六碳糖[M-162]+而成,可知峰6物质是芍药素-3-葡萄糖苷。峰7物质的碎片离子m/z 301是芍药素配离子峰,是母离子失去一分子阿拉伯糖[M-132]+而成,可以确定峰7物质是芍药素-3-阿拉伯糖。
2.3.1 DPPH自由基清除能力测定结果
如图3所示,蔓越莓花色苷和VC对DPPH自由基的清除能力均随着质量浓度的增加而增强,相同质量浓度条件下,蔓越莓花色苷对DPPH自由基的清除能力强于VC,根据统计学分析,花色苷和VC的DPPH自由基清除率差异显著(P<0.05)。引入半抑制浓度(the half maximal inhibitory concentration,IC50)作为一个参考指标[25],IC50值在此定义为DPPH清除率50%时对应的花色苷或VC的质量浓度,IC50值越小,抗氧化能力越强;花色苷的IC50值为92.81 μg/mL,VC的IC50值为129.82 μg/mL,250 μg/mL花色苷和VC的清除率均在90%以上。原理为花色苷和VC可以与DPPH自由基的单电子配对,使其在517 nm波长处的吸收减弱,花色苷接受DPPH的电子数量多于VC,褪色更显著,清除率更高,所以抗氧化能力更强。

图3 蔓越莓花色苷的DPPH自由基清除率
Fig. 3 DPPH free radical scavenging capacity of cranberry anthocyanins
2.3.2 ABTS+·清除能力测定结果

图4 蔓越莓花色苷的ABTS+·清除能力
Fig.4 ABTS+· scavenging capacity of cranberry anthocyanins
如图4所示,蔓越莓花色苷和VC对ABTS+·的清除能力均随着质量浓度的增加而增强,在相同质量浓度条件下,蔓越莓花色苷对ABTS+·的清除能力强于VC,根据统计学分析,蔓越莓花色苷和VC对ABTS+·的清除能力差异显著(P<0.05)。ABTS在氧化剂作用下氧化成绿色的ABTS+·,花色苷和VC可以抑制ABTS+·的产生,削弱其在734 nm波长处的吸收[26]。Trolox是一种VE类似物,定义Trolox抗氧化能力为1,其他物质的抗氧化能力用其相比于Trolox的倍数表示。以标准品当量质量浓度为x,吸光度为y,作标准曲线为y=-0.040 83x-0.046 69,R2=0.999 2,在250 μg/mL时蔓越莓花色苷和VC对ABTS+·清除能力分别是Trolox的2.8 倍和2 倍,蔓越莓花色苷对ABTS+·的清除能力是VC的1.4 倍。
2.3.3 总抗氧化能力测定
如图5所示,在50~250 μg/mL范围内,蔓越莓花色苷和VC的总抗氧化能力均随着质量浓度的增加而增强,蔓越莓花色苷的总抗氧化能力显著高于VC(P<0.05),250 μg/mL蔓越莓花色苷和VC的总抗氧化能力分别为2.61、1.50 U/mL。蔓越莓花色苷的总抗氧化能力、DPPH自由基清除率和ABTS+·清除能力变化趋势一致,质量浓度越高,抗氧化能力越强,两者呈正相关[27-30]。
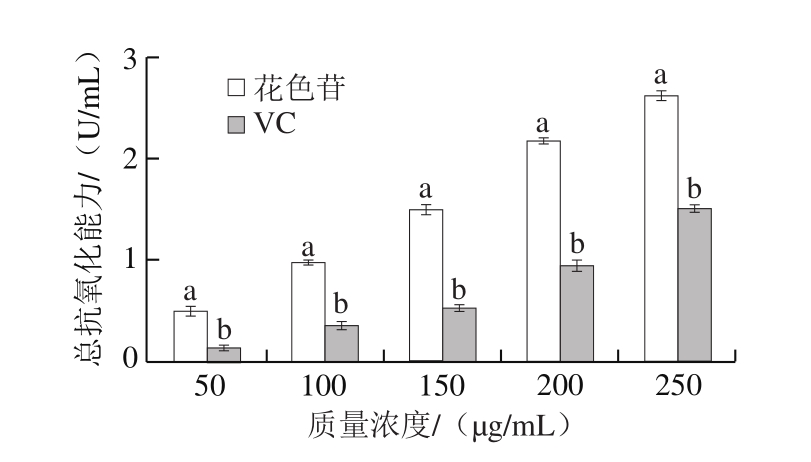
图5 蔓越莓花色苷的总抗氧化能力
Fig. 5 Total antioxidant capacity of cranberry anthocyanins
本实验采用超高压辅助提取法提取蔓越莓花色苷,提取条件为料液比1∶20(g/mL)、乙醇体积分数60%、pH 2.0、超高压压力400 MPa、提取时间12 min,花色苷含量为(75.49±0.43)mg/100 g;常规溶剂提取蔓越莓花色苷,提取条件为料液比1∶20(g/mL)、乙醇体积分数60%、pH 2.0、提取温度40 ℃、提取时间60 min,花色苷含量为(67.31±1.08)mg/100 g;蔓越莓中总花色苷含量为(79.52±0.50)mg/100 g,超高压辅助提取蔓越莓花色苷提取率为(94.92±0.54)%,常规溶剂提取蔓越莓花色苷提取率为(84.65±1.36)%,说明超高压辅助提取蔓越莓花色苷的效果较好。选择AB-8大孔树脂对蔓越莓花色苷粗提物进行纯化,冻干粉中花色苷含量从(46.10±0.92)mg/g提高到(309.26±2.37)mg/g。通过测定DPPH自由基清除率、ABTS+·清除能力、总抗氧化能力,比较蔓越莓花色苷与VC的抗氧化能力。结果表明:相同质量浓度条件下,蔓越莓花色苷的抗氧化能力强于VC。采用HPLC-MS联用技术对蔓越莓花色苷的组成进行鉴定,共鉴定出7 种花色苷,分别为芍药素-3,5-二己糖苷、矢车菊-3-半乳糖苷、矢车菊-3-葡萄糖苷、矢车菊-3-阿拉伯糖苷、芍药素-3-半乳糖苷、芍药素-3-葡萄糖苷、芍药素-3-阿拉伯糖苷,其中芍药素-3,5-二己糖苷首次在蔓越莓中被鉴定出。综上所述,超高压辅助提取蔓越莓花色苷效果较好,蔓越莓中花色苷含量较高,花色苷种类丰富,其抗氧化能力显著高于VC。
参考文献:
[1] 盖钰卓, 张强, 孙海悦, 等. 不同品种蔓越莓主要品质特性的测定及分析[J]. 食品工业科技, 2017, 38(8): 118-122; 132. DOI:10.13386/j.issn1002-0306.2017.08.015.
[2] SUN J, MARAIS J P, KHOO C, et al. Cranberry (Vaccinium macrocarpon) oligosaccharides decrease biofilm formation by uropathogenic Escherichia coli[J]. Journal of Functional Foods, 2015,17: 235-242. DOI:10.1016/j.jff.2015.05.016.
[3] 姚立君, 李赫宇, 李许伟, 等. 蔓越莓营养与保健功能研究进展[J]. 食品研究与开发, 2013, 34(8): 120-123. DOI:10.3969/j.issn.1005-6521.2013.08.033.
[4] ROIDOUNG S, DOLAN K D, SIDDIQ M. Estimation of kinetic parameters of anthocyanins and color degradation in vitamin C fortified cranberry juice during storage[J]. Food Research International,2017, 94: 29-35. DOI:10.1016/j.foodres.2017.01.013.
[5] FELICIANO R P, BOERES A, MASSACESSI L, et al. Identification and quantification of novel cranberry-derived plasma and urinary (poly)phenols[J]. Archives of Biochemistry & Biophysics, 2016, 599: 31-41.DOI:10.1016/j.abb.2016.01.014.
[6] 柯春林, 郭猛, 王娣, 等. 蔓越莓原花青素的提取工艺及其体外抗氧化活性研究[J]. 应用化工, 2015(1): 81-84.
[7] CESONIENĖ L, JASUTIENE I, SARKINAS A. Phenolics and anthocyanins in berries of European cranberry and their antimicrobial activity[J]. Medicina, 2009, 45(12): 992-995.
[8] CAILLET S, CÔTÉ J, DOYON G, et al. Antioxidant and antiradical properties of cranberry juice and extracts[J]. Food Research International, 2011, 44(5): 1408-1413. DOI:10.1016/j.foodres.2011.02.019.
[9] JESZKA-SKOWRON M, ZGOŁA-GRZEŚKOWIAK A, STANISZ E,et al. Potential health benefits and quality of dried fruits: goji fruits,cranberries and raisins[J]. Food Chemistry, 2017, 221: 228-236.DOI:10.1016/j.foodchem.2016.10.049.
[10] TUMBAS V T, ILAS S M, ANADANOVIBRUNET J M, et al. Solidphase extraction of antioxidant compounds from commercial cranberry extract and its antiradical activity[J]. Acta Periodica Technologica,2007, 38: 157-164. DOI:10.2298/APT0738157T.
[11] OSZMIAŃSKI J, KOLNIAK-OSTEK J, LACHOWICZ S, et al.Effect of dried powder preparation process on polyphenolic content and antioxidant capacity of cranberry (Vaccinium macrocarpon L.)[J].Industrial Crops & Products, 2015, 77: 658-665. DOI:10.1016/j.indcrop.2015.09.054.
[12] CHEN P X, BOZZO G G, FREIXAS-COUTIN J A, et al. Free and conjugated phenolic compounds and their antioxidant activities in regular and non-darkening cranberry bean (Phaseolus vulgaris L.)seed coats[J]. Journal of Functional Foods, 2015, 18: 1047-1056.DOI:10.1016/j.jff.2014.10.032.
[13] GOMES W F, TIWARI B K, ÓSCAR R, et al. Effect of ultrasound followed by high pressure processing on prebiotic cranberry juice[J]. Food Chemistry, 2017, 218: 261-268. DOI:10.1016/j.foodchem.2016.08.132.
[14] BAI Y, LIU L, ZHANG R, et al. Ultrahigh pressure-assisted enzymatic extraction maximizes the yield of longan pulp polysaccharides and their acetylcholinesterase inhibitory activity in vitro[J]. International Journal of Biological Macromolecules, 2016, 96: 214-222.DOI:10.1016/j.ijbiomac.2016.11.105.
[15] CHEN R, JIN C, LI H, et al. Ultrahigh pressure extraction of polysaccharides from Cordyceps militaris, and evaluation of antioxidant activity[J]. Separation & Purification Technology, 2014,134: 90-99. DOI:10.1016/j.seppur.2014.07.017.
[16] 李新原, 李斌, 颜廷才, 等. 超高压与超声波对蓝靛果多酚提取及抗氧化活性的影响[J]. 食品科学, 2017, 38(2): 271-277. DOI:10.7506/spkx1002-6630-201702042.
[17] GUO X, HAN D, XI H, et al. Extraction of pectin from navel orange peel assisted by ultra-high pressure, microwave or traditional heating:a comparison[J]. Carbohydrate Polymers, 2012, 88(2): 441-448.DOI:10.1016/j.carbpol.2011.12.026.
[18] 贺家亮, 李开雄, 刘海燕. 高效液相色谱法在食品分析中的应用[J]. 食品研究与开发, 2008, 29(11): 175-177. DOI:10.3969/j.issn.1005-6521.2008.11.050.
[19] 孟兆玲, 齐元英, 柳仁民. 高效液相色谱-质谱联用技术的应用进展[J]. 化学分析计量, 2006, 15(6): 99-103. DOI:10.3969/j.issn.1008-6145.2006.06.041.
[20] JIN Y H, SHIN H J, AHN H J, et al. Identification of anthocyanins in berry species using LC-ESI-MS combined with high-speed countercurrent chromatography[J]. Bulletin of the Korean Chemical Society,2016, 37(10): 1618-1624. DOI:10.1002/bkcs.10915.
[21] WANG Y F, JOHNSONCICALESE J, SINGH A P, et al.Characterization and quantification of flavonoids and organic acids over fruit development in American cranberry (Vaccinium macrocarpon) cultivars using HPLC and APCI-MS/MS[J]. Plant Science, 2017, 262: 91-102. DOI:10.1016/j.plantsci.2017.06.004.
[22] 吕春茂, 王新现, 包静, 等. 越橘果实花色苷的体外抗氧化性[J]. 食品科学, 2010, 31(23): 27-31.
[23] 安小琦, 王月华, 孟宪军. ‘蓓蕾’蓝靛果中花色苷组成鉴定及抗氧化能力比较分析[J]. 食品科学, 2016, 37(19): 82-87. DOI:10.7506/spkx1002-6630-201619014.
[24] WANG Y H, ZHU J, MENG X, et al. Comparison of polyphenol,anthocyanin and antioxidant capacity in four varieties of Lonicera caerulea berry extracts[J]. Food Chemistry, 2016, 197(Pt A): 522-529.DOI:10.1016/j.foodchem.2015.11.006.
[25] 韦献雅, 殷丽琴, 钟成, 等. DPPH法评价抗氧化活性研究进展[J].食品科学, 2014, 35(9): 317-322. DOI:10.7506/spkx1002-6630-201409062.
[26] BOROWSKA E J, MAZUR B, KOPCIUCH R G, et al. Polyphenol,anthocyanin and resveratrol mass fractions and antioxidant properties of cranberry cultivars[J]. Food Technology & Biotechnology, 2009,47(1): 183-205.
[27] AND S Y W, STRETCH A W. Antioxidant capacity in cranberry is inf l uenced by cultivar and storage temperature[J]. Journal of Agricultural &Food Chemistry, 2001, 49(2): 969-974. DOI:10.1021/jf001206m.
[28] 李颖畅, 李冰心, 孟良玉, 等. 圣云蓝莓花色苷不同组分的体外抗氧化性和稳定性[J]. 食品科学, 2012, 33(9): 105-109.
[29] 吕春茂, 杨宏, 孟宪军, 等. 不同成熟期“北春”越橘花色苷含量及抗氧化研究[J]. 食品工业科技, 2012, 33(7): 130-134.
[30] 程佑声, 王鸿飞, 许凤, 等. 蓝莓皮渣花色苷提取及抗氧化活性的研究[J]. 果树学报, 2015(4): 696-704.
Anthocyanin Composition and Antioxidant Activity of Cranberry
WAN Meizhi, MENG Xianjun*
(College of Food Science, Shengyang Agricultural University, Shenyang 110866, China)
Abstract:In this paper, the anthocyanin composition and antioxidant activity of cranberry were evaluated. By pH differential method, the amounts of anthocyanins extracted by ultra high pressure-assisted extraction and conventional solvent extraction were determined to be (75.49 ± 0.43) and (67.31 ± 1.08) mg/100 g, respectively. The anthocyanin content of cranberry was(79.52 ± 0.50) mg/100 g. AB-8 macroporous resin was used to purify anthocyanins from the crude extract of cranberry. After purification, the content of anthocyanins in the freeze-dried powder increased from (46.10 ± 0.92) to (309.26 ± 2.37) mg/g.The scavenging capacity against 1,1-diphenyl-2-picrylhydrazyl (DPPH) and 2,2’-azinobis(3-ethylbenzothiazoline-6-sulphonate) (ABTS+·) free radical and total antioxidant capacity of the purified anthocyanins were determined. The results indicated that the antioxidant capacity of cranberry anthocyanins was stronger than that of vitamin C at the same concentrations. Seven anthocyanins were identified by HPLC-MS, namely peonidin-3,5-dihexoside, cyanidin-3-galactoside,cyanidin-3-glucoside, cyanidin-3-arabinoside, peonidin-3-galactoside, peonidin-3-glucoside and peonidin-3-arabinoside.Peonidin-3,5-dihexoside was identified in cranberry for the fi rst time to our knowledge.
Keywords:cranberry anthocyanins; ultra high pressure; high performance liquid chromatography-mass spectrometry;antioxidant ability
WAN Meizhi, MENG Xianjun. Anthocyanin composition and antioxidant activity of cranberry[J]. Food Science, 2018,39(22): 45-50. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201822008. http://www.spkx.net.cn
引文格式:宛美志, 孟宪军. 蔓越莓花色苷的组成鉴定及抗氧化能力[J]. 食品科学, 2018, 39(22): 45-50. DOI:10.7506/spkx1002-6630-201822008. http://www.spkx.net.cn
文章编号:1002-6630(2018)22-0045-06
文献标志码:A
中图分类号:TS207.3
DOI:10.7506/spkx1002-6630-201822008
*通信作者简介:孟宪军(1962—),男,教授,博士,研究方向为小浆果深加工关键技术。E-mail:mengxjsy@126.com
第一作者简介:宛美志(1992—),女,硕士研究生,研究方向为果蔬加工与贮藏工程。E-mail:492249360@qq.com
基金项目:“十三五”国家重点研发计划重点专项(2017YFD0400704)
收稿日期:2017-09-17