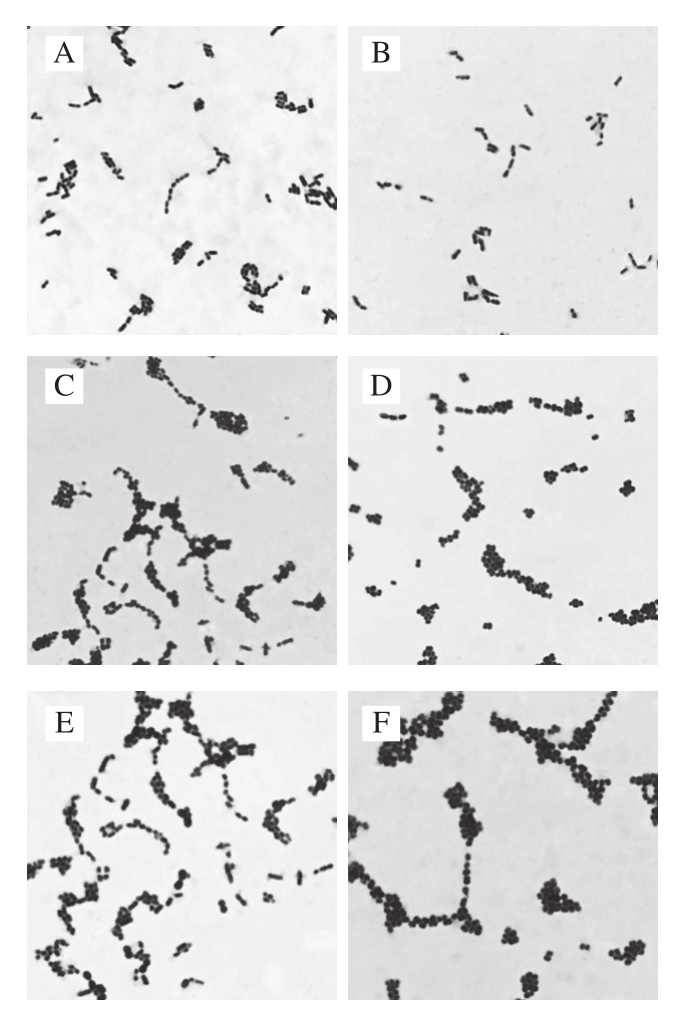
图1 部分明串珠菌疑似菌株的革兰氏染色图片(×100)
Fig. 1 Gram staining of some suspected Leuconostoc strains (× 100)
A.菌株MC3;B.菌株LBQ;C.菌株LBH;D.菌株FX6;E.菌株WQD;F.菌株WDX。
张 平,张鹏飞,刘斯琪,岳媛媛,乌日娜*
(沈阳农业大学食品学院,辽宁 沈阳 110866)
摘 要:分离筛选传统发酵豆酱中的明串珠菌,研究其益生特性。以采集自东北6 个地区的56 份自然发酵豆酱为研究对象,用稀释涂布平板方法对明串珠菌进行分离筛选,然后对疑似菌株进行形态学特征、生理生化特征和16S rRNA基因序列进行分析,确定菌株种属序列,然后对鉴定得到的明串菌株进行耐酸耐胆盐性能比较。结果表明:从56 份豆酱样品中共分离到118 株疑似乳酸菌,从中得到6 株明串珠菌,鉴定3 株为乳酸明串珠菌,3 株为肠膜明串珠菌肠膜亚种。综合比较6 株明串珠菌耐酸耐胆盐性,发现菌株FX6益生性最好,在pH 3.0环境培养3 h后存活率可达85.16%,在含0.3 g/100 mL胆盐环境培养6 h后存活率高达96.07%。因此,菌株FX6可用于进一步科研以及工业应用,其在豆酱发酵过程的作用机理仍需深入研究。
关键词:豆酱;16S rRNA基因;明串珠菌;益生性
发酵食品是在一系列微生物共同作用下发酵而成的食品,通过发酵不仅可以保存易腐食品,而且可以改善食品的生物利用性[1]。传统发酵食品中微生物的复杂性是有目共睹的,其中的微生物资源亟待人们开发利用。豆酱又名黄豆酱、黄酱或大豆酱,在我国东北地区也被称为大酱,是一种营养丰富、香气馥郁的传统发酵大豆食品[2-3]。豆酱不仅美味可口,还含有丰富的生物活性物质使其具有良好的保健功能,研究表明,豆酱具有抗癌[4]、有助于肝脏解毒、促进自然杀伤细胞的复活、抑制肿瘤[5]、预防高血压和降血压[6]、控制肥胖[7]、增强免疫功能、改善和预防过敏[8]、抑制胆固醇吸收、除却放射性物质、防止胃溃疡、抗氧化等功能[9]。在豆酱的自然发酵过程中,乳酸菌是与豆酱风味息息相关的细菌,它能够利用大豆中的蛋白质、脂肪、碳水化合物等,分解成为小分子的醛、酸、酯等风味物质,使豆酱的pH值和各种养分发生变化[10-11]。
明串珠菌是一种G+C含量低于50%的异型发酵乳酸菌,兼性厌氧,菌落为圆形,直径小于1.0 mm,呈灰白色,光滑湿润,中心凸起但边缘整齐,透明度较低[12],其大小约为0.7 μm×1.2 μm,在电镜下通常为椭圆形或球形,以成对或短链形态排列,极少为长链,革兰氏染色呈阳性。明串珠菌属于化能有机营养型,在兼性厌氧环境中生长情况最佳,即0.05 g/100 mL cysteine·HCl、19.8% CO2、11.4% H2和N2。其生长要求培养基内包含复杂的生长素和氨基酸。属内所有种的生长均离不开烟酸、硫胺素、泛酸、生物素,但都不需要钴胺素和对氨基苯甲酸。明串珠菌能够以碳水化合物为发酵底物来维持生长,同时伴随产生D-乳酸、乙酸、细菌素、胞外多糖、甘露醇、双乙酰等代谢产物[13-16],而明串珠菌的这些特性使其在医药卫生、食品保健等领域的发展拥有广阔前景。
明串珠菌的生存环境十分广泛[17-18],植物表面和根部较为常见。据报道明串珠菌是豆酱发酵初期的优势菌,对豆酱的启动发酵起到了重要的作用[19]。明串珠菌能够在发酵制品中代谢产生葡聚糖、甘露醇等多种功能化合物,可用于生产代血浆、保健性食品甜味剂、选择性刺激肠道内有益微生物的生长繁殖;也可代谢产生双乙酰等多种风味物质,影响发酵制品的风味[20];还可代谢生成细菌素,对一些常见致病菌等有抑制作用[21],能够用作新型食品防腐剂和饲料添加剂,除此之外明串珠菌还能产酸[22]、代谢生成K族维生素等。因此,明串珠菌在食品、医疗等领域一直受到人们的关注。然而,目前对豆酱中明串珠菌的研究鲜有深入报道。
因此,本实验旨在从传统自然发酵豆酱中分离明串珠菌,并对菌株的益生特性进行筛选,以期筛选出益生性优良的明串珠菌菌株,并为明串珠菌进一步研究、开发、保护以及在工业化生产方面的应用提供重要的理论依据。
1.1.1 样品采集
采自东北6 个地区(辽宁省沈阳市沈河区、辽宁省沈阳市辽中区、辽宁省沈阳市新民市、辽宁省丹东市、辽宁省阜新市、吉林省四平市)的传统自然发酵豆酱,共计56 份豆酱样品。包括沈阳3 份样品、辽中9 份样品、新民12 份样品、丹东12 份样品、阜新10 份样品、四平10 份样品。
1.1.2 试剂
10×TE缓冲液、1 mol/L Tris-HCl Buffer、0.5 mol/L乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA,pH 8.0)、10%十二烷基硫酸钠溶液(sodium dodecyl sulfate,SDS)、20 mg/mL蛋白酶K、10 mol/L十六烷基三甲基溴化铵溶液(hexadecyl trimethyl ammonium bromide,CTAB)、0.7 mol/L NaCl溶液、酚-氯仿-异戊醇(25∶24∶1)溶液、氯仿-异戊醇(24∶1)溶液、冰异丙醇。所有试剂均由国药集团化学试剂有限公司提供。
1.1.3 培养基
MRS液体培养基:10 g蛋白胨,10 g牛肉浸膏,4 g酵母粉,2 g K2HPO4,1 g Tween-80,20 g葡萄糖,2 g柠檬酸三钠,0.58 g MgSO4·7H2O,0.25 g MnSO4·4H2O,5 g三水乙酸钠,1 000 mL蒸馏水。用于明串珠菌的分离培养,以及菌株的生理特征鉴定。
MRS固体培养基:在MRS液体培养基基础上添加2%琼脂粉。用于明串珠菌的分离培养。
MRS半固体培养基:在MRS液体培养基基础上添加0.75%琼脂粉。用于明串珠菌的分离培养。
BL固体培养基:20 g蛋白胨,10 g乳糖,5 g牛胆盐,20 g琼脂粉,1 000 mL蒸馏水,pH 7.4。用于明串珠菌的分离培养。
GMSX280手提式压力蒸汽灭菌器 北京中科路达实验仪器有限公司;DNP-9022电热恒温培养箱 上海精宏实验设备有限公司;Mastercycler nexus SX1聚合酶链式反应(polymerase chain reaction,PCR)仪Eppendorf(中国)有限公司;DYY-12生化电泳仪 北京六一生物科技有限公司;GDS-8000凝胶成像系统美国UVP公司。
1.3.1 明串珠菌的富集和分离纯化
取适量白菜洗净擦干、切成小块后放入榨汁机打浆并过滤、离心然后加入NaCl至终质量浓度为3 g/100 mL,于121 ℃灭菌20 min。取5 g豆酱加入50 mL白菜汁液中,25 ℃密闭静置培养7 d。无菌条件下,取培养7 d后的白菜汁液体1 mL,加入含有9 mL灭菌生理盐水的试管中,得到豆酱样品质量浓度为10-2g/mL,按照10 倍稀释法将样品稀释至10-8g/mL。取10-4、10-5、10-6、10-7、10-8g/mL 5 个梯度样品100 μL分别涂布接种于含2 g/100 mL CaCO3的MRS固体培养基、BL固体培养基,置于厌氧培养罐中,25 ℃恒温培养48~72 h。挑取单个的明串珠菌典型菌落,纯化2~3 次,直至得到单菌落。对获得的单菌落进行革兰氏染色并置于显微镜下观察,将镜检结果为纯培养物、具有明串珠菌细胞形态的革兰氏阳性球菌穿刺于MRS半固体培养基或划线转入MRS固体斜面培养基中,低温保存,供进一步实验之用。
1.3.2 明串珠菌的形态特征和生理生化特征鉴定
根据《伯杰氏细菌鉴定手册》[23],进行生态学特征和生理生化特征鉴定。
1.3.3 16S rDNA分子鉴定
采用CTAB法[24]提取明串珠菌基因组DNA,利用微量紫外分光光度计检测疑似菌株的DNA浓度和纯度。以明串珠菌疑似菌株基因组总DNA为PCR扩增模板,利用16S rRNA基因通用引物[25-26]27F(5’-AGAGTTTGATCCTGGCT-CAG-3’)和1495R(5’-GGTTACCTTGTTACGACTT-3’)进行PCR扩增。50 µL PCR体系:10×PCR buffer(含Mg2+)5 μL,10 pmol/μL 27F和1495R各2 μL,dNTP Mix 4 μL,Taq DNA polymerase 0.6 μL。基因组DNA模板在反应体系内终质量浓度为200 ng/µL,剩余的体系体积用ddH2O补齐。PCR条件:94 ℃、5 min;94 ℃、30 s,58 ℃、30 s,72 ℃、1 min,30 个循环;72 ℃、10 min。PCR产物用1%琼脂糖凝胶电泳检测。将PCR产物送交至上海桑尼生物科技有限公司测序。将测序得到的16S rRNA基因序列与GenBank数据库中标准菌株序列进行BLAST同源性比对,通过BLASTn(http://www.ncbi.nlm.nih.gov/blast)完成序列比对。
1.3.4 明串珠菌的耐酸、耐胆盐性能比较
益生菌若在人体内定植并发挥有益作用,就必须能够耐受人体胃肠道的极端环境,根据人体胃肠道环境条件(进食后胃液的pH值不小于3.5,小肠胆盐质量浓度基本保持在0.03~0.3 g/100 mL之间),本实验将明串珠菌益生特性筛选的条件定为:pH 3.0、胆盐质量浓度0.3 g/100 mL。将活化后明串珠菌2%(体积分数,下同)接种量接种于pH 3.0的现配MRS液体培养基中,25 ℃恒温培养。采用倾注法对培养0、1、2、3 h的菌悬液进行活菌计数。将活化后明串珠菌以2%的接种量接种到含0.3 g/100 mL牛胆盐的现配MRS液体培养基中,25 ℃恒温培养。采用倾注法对培养0、2、4、6 h的菌悬液进行活菌计数。
1.3.5 分离株的保存
采用真空冷冻干燥法对菌体进行冻干保存。将明串珠菌菌株活化,于4 ℃、5 000 r/min离心10 min,收集菌体沉淀,用灭菌生理盐水冲洗菌体沉淀并混匀,再于4 ℃、12 000 r/min离心5 min,再次收集菌体沉淀,如此重复2~3 次洗涤菌体。向菌体沉淀中加入15 g/100 mL灭菌脱脂乳1 mL,充分混匀后分装于冻存管,预冻过夜后使用真空冷冻干燥机将其冻干,并置于-80 ℃的超低温冰箱中保藏。
采用含2 g/100 mL CaCO3的MRS培养基和BL培养基对豆酱中明串珠菌进行分离筛选,因目前还没有一种培养基能够精确地从样品中选择性培养明串珠菌,故本实验从豆酱中初步分离的菌株并不能确认为明串珠菌属细菌,仍需要进行形态学、生理生化以及分子鉴定才能最终认定为明串珠菌。根据明串珠菌的形态学特征,挑取MRS固体培养基上培养48 h后菌落呈灰白色、表面光滑、边缘整齐、黏稠有光泽、直径约1 mm的菌株并保存。本实验共从56 份豆酱样品中初步分离出118 株菌株,经过形态学鉴定后,有81 株菌株为革兰氏阳性菌,除去其中的34 株杆菌,剩余的47 株球菌被初步鉴定为明串珠菌疑似菌株。部分明串珠菌疑似菌株的革兰氏染色镜检图片见图1。

图1 部分明串珠菌疑似菌株的革兰氏染色图片(×100)
Fig. 1 Gram staining of some suspected Leuconostoc strains (× 100)
A.菌株MC3;B.菌株LBQ;C.菌株LBH;D.菌株FX6;E.菌株WQD;F.菌株WDX。
从传统豆酱中分离得到的47 株菌中,有22 株菌株的运动性以及在37 ℃、pH 6.5、pH 4.8、3.0 g/100 mL NaCl、6.5 g/100 mL NaCl和10%乙醇溶液条件下的生长情况(表1),与文献[23]中记录的明串珠菌特征基本一致。对符合明串珠菌菌株生理特性的22 株菌进行一系列生化实验后,共有6 株菌株表现为过氧化氢酶(接触酶)阴性、发酵葡萄糖产酸产气、精氨酸水解阴性等特性,被初步认定为明串珠菌属细菌。结合葡聚糖生成实验(图2)和碳水化合物利用实验(表1)进一步表明:菌株MC3、LBQ、LBH不能生成葡聚糖,而菌株FX6、WQD、WDX能发酵产生葡聚糖。同时,6 株菌株均能够利用果糖、半乳糖、麦芽糖、蔗糖,但在阿拉伯糖、熊果苷、纤维素、纤维二糖、核糖、海藻糖、木糖的利用上均具有一定差异,因此根据文献[23]将MC3、LBQ、LBH菌株鉴定为乳酸明串珠菌,而将FX6、WQD、WDX菌株鉴定为肠膜明串珠菌肠膜亚种。
表1 部分明串珠菌疑似菌株的生理生化特征
Table 1 Physiological and biochemical characteristics of suspected Leuconostoc strains
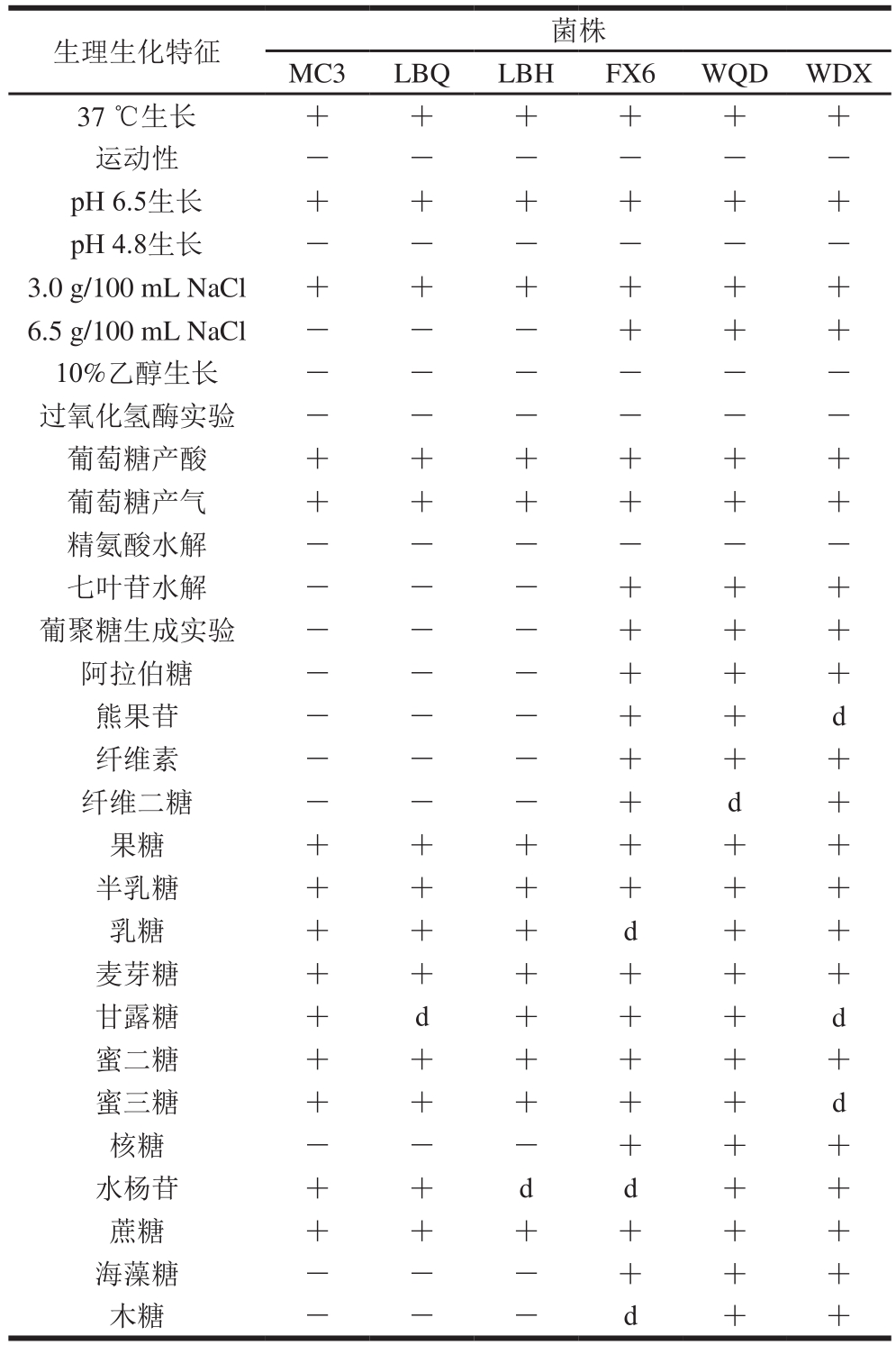
注:+.阳性;-.阴性;d.延时。
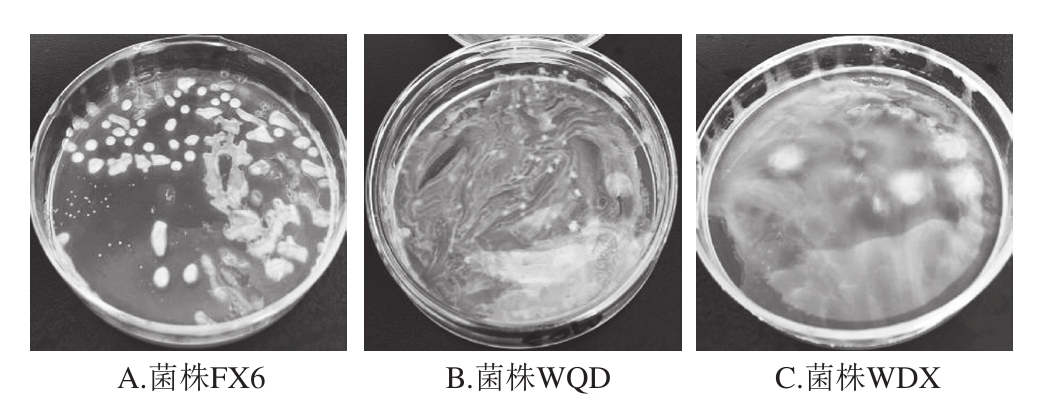
图2 部分明串珠菌疑似菌株葡聚糖生成实验结果
Fig. 2 Dextran production from sucrose by suspected Leuconostoc strains
利用微量紫外-可见分光光度计检测6 株明串珠菌疑似菌株DNA的浓度和纯度,发现菌株的DNA质量浓度均在200 ng/µL左右,且OD260nm/OD280nm值基本处于1.6~1.8之间,符合PCR扩增体系的要求,可以进行下一步PCR扩增实验。以获得的明串珠菌疑似菌株DNA作为模板,按照PCR程序进行扩增。用1%的琼脂糖凝胶电泳对PCR产物进行检测后发现,所有菌株的扩增产物均于1 500 bp处有单一明亮的条带,符合测序工作的要求。将测序结果中6 株明串珠菌疑似菌株的16S rRNA序列进行同源性比对分析,得到6 株明串珠菌属细菌,详细结果见表2。
表2 明串珠菌16S rRNA序列同源性对比结果
Table 2 Homology alignment of 16S rRNA sequences of suspected Leuconostoc strains
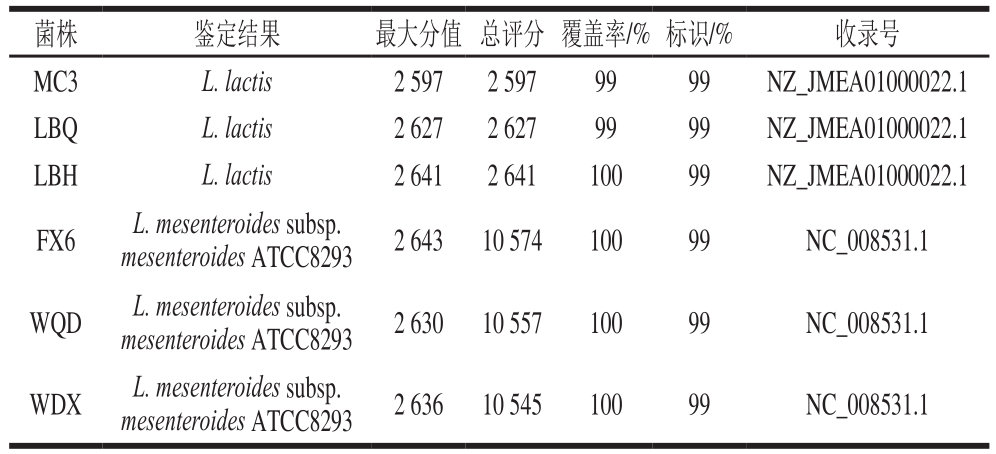
由表2可以看出,6 株菌鉴定结果均为明串珠菌(Leuconostoc)。其中菌株MC3、LBQ、LBH为乳酸明串珠菌(L. lactis),菌株FX6、WQD、WDX为肠膜明串珠菌肠膜亚种(L. mesenteroides subsp. mesenteroides),与形态学特征和生理生化特征鉴定结果一致。目前分子生物学鉴定最常用的是16S rDNA/rRNA序列分析技术,因16S rDNA/rRNA具有保守性,在漫长进化过程中几乎保持恒定,可以由此进行物种的系统发育分析,同时又含有可变区域,能够揭示出物种的特定核算序列,为分子生物学鉴定基础。
利用比浊法测定6 株供试菌株的生长曲线,利用菌悬液的浓度与混浊度呈正比的特性,采用分光光度计测量菌悬液的光密度来推算菌液的浓度。以测得的光密度OD600nm为纵坐标,以相应的培养时间为横坐标作图,绘制6 株明串珠菌属细菌在6 h内的生长曲线,见图3。
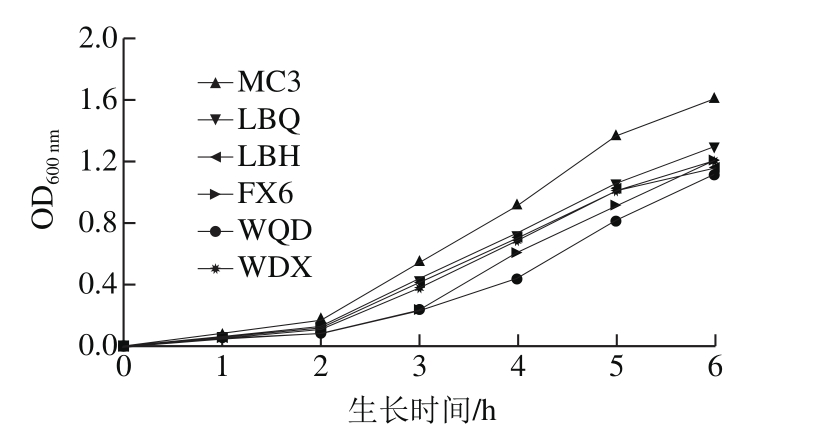
图3 明串珠菌菌株生长曲线
Fig. 3 Growth curves of six Leuconostoc strains
如图3所示,6 株明串珠菌属细菌生长曲线的趋势相似,在0~2 h内生长较为缓慢,而在2~6 h内迅速生长,6 h后OD600nm均达到了1.200 0以上;其中,菌株MC3的生长速度最快,菌株WQD的生长速度最慢。
将6 株明串珠菌菌株分别接种到pH值为3.0的新鲜配制的MRS液体培养基中,于0、1、2、3 h进行倾注平板法活菌计数,结果如表3所示。
表3 明串珠菌酸耐受性实验结果
Table 3 Acid tolerance of Leuconostoc strains
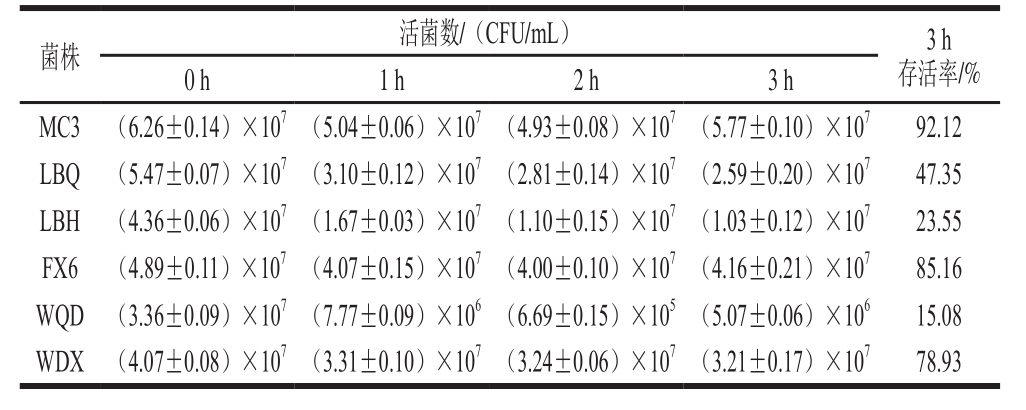
如表3所示,明串珠菌在pH 3.0的MRS培养基中培养0~3 h,随着时间的延长,菌株的活菌数大致呈下降趋势。6 株菌对酸都有一定的耐受性,但菌株之间存在差异。其中菌株MC3、FX6、WDX的耐酸性较好,3 h后存活率分别为92.12%、85.16%、78.93%,不仅如此,菌株MC3和FX6在2 h后活菌数有所回升;菌株WQD对酸的耐受性最差,与0 h相比,在3 h后活菌数已经下降了一个数量级,存活率仅达到15.08%。
将6 株明串珠菌菌株分别接种到含0.3 g/100 mL牛胆盐的新鲜配制的MRS液体培养基中,于0、2、4、6 h进行倾注平板法活菌计数,结果见表4。
表4 明串珠菌胆盐耐受性实验结果
Table 4 Bile tolerance of Leuconostoc strains
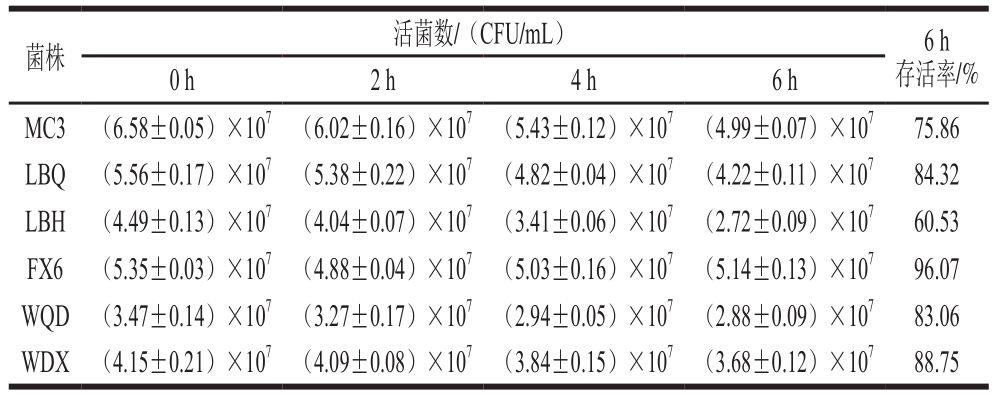
如表4所示,6 株明串珠菌实验菌株在含0.3 g/100 mL牛胆盐的MRS培养基中培养0~6 h,随着时间的延长,活菌数基本呈下降趋势,但是下降的幅度不大,说明6 株菌对牛胆盐都有一定的耐受性。纵向对比,菌株之间的活菌数各不相同,说明菌株之间对牛胆盐的耐受性存在差异。横向对比发现,菌株FX6、WDX、LBQ、WQD的胆盐耐受性较好,6 h后存活率分别达到96.07%、88.75%、84.32%和83.06%;菌株LBH在6 株菌中对胆盐的耐受性最差,培养6 h后存活率为60.53%。
综上所述,菌株FX6、MC3、WDX对酸的耐受性较好,菌株FX6、WDX、LBQ、WQD对胆盐的耐受性较好,故在6 株受试菌株中,菌株FX6、WDX的益生性较好。综合考虑比较两菌株在极端环境的存活率,菌株FX6在pH 3.0环境培养3 h后存活率达到85.16%,在含0.3 g/100 mL胆盐环境培养6 h后存活率达到96.07%,故推断6 株明串珠菌中菌株FX6的益生性最好。
人体胃排空时pH值约为3.0,进食后最低可达到1.5左右。人体肠道pH值一般为8.0,进食后食物经过小肠大概需要1~4 h,故一般实验选择能够耐受酸和胆盐的菌株作为待开发的益生菌株。益生菌能否耐受胃酸和胆盐,是其能够在肠道中存活下来并发挥益生功效的基本前提。赵小茜等[27]对4 株产多糖植物乳杆菌进行耐酸耐胆盐性能实验,以期获得耐酸耐胆盐的菌株,并将其投入生产实践中。结果发现4 株植物乳杆菌在pH 3.5的条件下生长缓慢,而在pH 3.0和2.5的条件下几乎不生长,而在0.3%的胆盐环境下,3 株菌存活率达到65%以上。陈欣等[28]测定4 株人源乳酸杆菌耐酸耐胆盐能力,结果表明4株乳酸杆菌能够耐受pH 3的酸度(存活率6.6%~71.8%)和0.3 g/100 mL的胆盐(存活率9.2%~31.8%)。杨晓宇等[29]对30 株不同来源乳酸菌进行耐酸耐胆盐实验,结果发现LS和LJ2菌株在pH 2.0环境下的存活率分别为135%和124%,LZ1株在pH 3.0环境下的存活率为137%,LJ1株对猪胆盐有较高耐受能力,LT株对牛胆盐有较高耐受能力。不同来源的益生菌耐盐耐胆盐性能均有差异。明串珠菌要作为益生菌在人体肠道内定植并发挥益生作用,就必须能够耐受人体消化道中强酸和高胆盐的极端环境。本实验对豆酱分离筛选得到的6 株明串珠菌进行耐酸、耐胆盐性能比较,发现菌株FX6、WDX能够在pH 3.0和含0.3 g/100 mL质量浓度胆盐的环境中良好生长。D’Angelo等[30]对奶制品中分离得到的29 株明串珠菌属适应食品中应激性进行测定,发现乳酸明串珠菌的应激适应性最好,其次是肠膜明串珠菌,而Leuconostoc pseudomesenteroides和柠檬酸明串珠菌展现出最弱的应激适应性。菌株MC3、LBQ和LBH经鉴定为乳酸明串珠菌,菌株FX6、WDX和WQD为肠膜明串珠菌,但菌株MC3、LBQ和LBH的耐酸耐胆盐性并没有显著优于菌株FX6、WDX和WQD,与D’Angelo等[30]研究结果不完全一致。现在已经可以通过技术手段利用肠溶胶囊等方法保护耐酸性弱的菌株通过胃部,故进行菌株筛选时,更看重菌株对人体肠道环境的耐受性。本实验中菌株FX6、WDX、LBQ、WQD对胆盐的耐受性较好,均可以做更深入的研究。
明串珠菌广泛分布于环境中,根据人们长期食用含有明串珠菌的食品历史来看,可以合理认为明串珠菌是安全的,而且目前没有报道有人因食用明串珠菌发酵食品导致感染疾病[31]。但若将明串珠菌投入生产实践,其安全性仍需进一步分析鉴定,针对本实验中得到的菌株FX6,仍需通过吲哚实验、硝酸盐还原酶实验、氨基脱羧酶实验、溶血实验、D-乳酸检测及质粒提取实验,确定菌株是否含有有害代谢产物及有无耐药性[32],从而鉴定菌株FX6的安全性。
本研究采用传统分离纯培养方法,从东北地区56 份传统自然发酵豆酱样品中成功获得了118 株明串珠菌疑似菌株,通过形态学观察、革兰氏染色,47株菌株为革兰氏阳性小球菌,6 株菌株符合明串珠菌属细菌的生理生化特征。采用16S rDNA序列鉴定法对菌株进行种属鉴定,结果显示其中菌株MC3、LBQ、LBH被鉴定为乳酸明串珠菌,菌株FX6、WQD、WDX被鉴定为肠膜明串珠菌肠膜亚种ATCC 8293。利用比浊法测定并绘制6 株明串珠菌供试菌株的生长曲线,其中,菌株MC3的生长速度最快,菌株WQD的生长速度最慢。对所有菌株进行酸和胆盐耐受性实验,结果显示菌株FX6、MC3、WDX对酸的耐受性较好,菌株FX6、WDX、LBQ、WQD对胆盐的耐受性较好。综合考虑,菌株FX6的益生性最好,在pH 3.0环境培养3 h后存活率可达85.16%,在含0.3 g/100 mL胆盐环境培养6 h后存活率高达96.07%。接下来,对菌株FX6的安全性仍需做进一步的分析。
参考文献:
[1] GU C, CHEN C C, LEI Z H. Meta-omics insights in the microbial community profiling and functional characterization of fermented foods[J]. Trends in Food Science & Technology, 2017, 65: 23-31.DOI:10.1016/j.tifs.2017.05.002.
[2] 徐鑫, 王茜茜, 王晓蕊, 等. 传统农家大酱中耐盐性乳酸菌的分离与鉴定[J]. 食品与发酵工业, 2014, 40(11): 33-40. DOI:10.13995/j.cnki.11-1802/ts.201411006.
[3] 乌日娜, 薛亚婷, 张平, 等. 豆酱微生物宏蛋白质组提取及分析[J]. 食品科学, 2017, 38(14): 17-23. DOI:10.7506/spkx1002-6630-201714003.
[4] YAN L, SPITZNAGEL E L, BOSLAND M C. Soy consumption and colorectal cancer risk in humans: a meta-analysis[J]. Cancer Epidemiology Biomarkers & Prevention, 2010, 19(1): 148-158.DOI:10.1158/1055-9965.EPI-09-0856.
[5] JUNG K O, PARK S Y, PARK K Y. Longer aging time increases the anticancer and antimetastatic properties of Doenjang[J]. Nutrition,2006, 22(5): 539-545. DOI:10.1016/j.nut.2005.11.007.
[6] YANG B. Hypolipidemic Effect of extracts of soybean paste containing mycelia of mushrooms in hyperlipidemic rats[J]. Korea Journal of Microbiology Biotechnology, 2000, 28: 228-232.
[7] KWON S, LEE K, IM K, et al. Weight reduction and lipid lowering effects of Korean traditional soybean fermented products[J]. Journal of the Korean Society of Food Science and Nutrition, 2006, 35(9): 1194-1199. DOI:10.3746/jkfn.2006.35.9.1194.
[8] JANG S, KIM K, KANG S. Effects of PGA-LM on CD4tCD25tfoxp3t treg cell activation in isolated CD4t T cells in NC/Nga mice[J]. Korean Journal of Microbiology and Biotechnology, 2008, 37(2): 160-169.
[9] 包启安. 豆酱的功能性[J]. 中国酿造, 2002, 21(3): 1-6. DOI:10.3969/j.issn.0254-5071.2002.03.001.
[10] 武俊瑞, 王晓蕊, 唐筱扬, 等. 辽宁传统发酵豆酱中乳酸菌及酵母菌分离鉴定[J]. 食品科学, 2015, 36(9): 78-83. DOI:10.7506/spkx1002-6630-201509015.
[11] 辛星, 宋刚, 周晓杭, 等. 传统发酵豆酱中乳酸菌的分离、筛选及鉴定[J]. 中国食品学报, 2014, 14(9): 202-207. DOI:10.16429/j.1009-7848.2014.09.033.
[12] 成文玉, 金红星, 胡炎华, 等. 明串珠菌筛选与分类的研究进展[J].中国酿造, 2010, 29(3): 7-9.
[13] HONG S P, SHIN S C, KANG W, et al. Complete genome sequence of Leuconostoc garlicum KCCM 43211 producing exopolysaccharide[J].Journal of Biotechnology, 2017, 246(20): 40-44. DOI:10.1016/j.jbiotec.2017.02.018.
[14] 白琴琴, 李志华, 李冬梅, 等. 高产甘露醇眀串珠菌的分离与鉴定[J]. 食品科技, 2013, 38(11): 12-15. DOI:10.13684/j.cnki.spkj.2013.11.003.
[15] CAPEKA P, HLAVONOVA E, MATULOVAA M, et al. Isolation and characterization of an extracellular glucan produced by Leuconostoc garlicum PR[J]. Carbohydrate Polymers, 2011, 83: 88-93.DOI:10.1016/j.carbpol.2010.07.024.
[16] 金红星, 成文玉. 明串珠菌发酵产甘露醇的研究进展[J]. 中国酿造,2012, 31(10): 4-6.
[17] FESSARD A, BOURDON E, PAYET B, et al. Identification, stress tolerance, and antioxidant activity of lactic acid bacteria isolated from tropically grown fruits and leaves[J]. Canadian Journal of Microbiology, 2016, 62(7): 550-561. DOI:10.1139/cjm-2015-0624.
[18] KUDA T, NOGUCHI Y, ONO M, et al. In vitro evaluation of the fermentative, antioxidant, and anti-inflammation properties of Lactococcus lactis subsp. lactis BF3 and Leuconostoc mesenteroides subsp. mesenteroides BF7 isolated from Oncorhynchus keta intestines in Rausu, Japan[J]. Journal of Functional Foods, 2014, 11: 269-277.DOI:10.1016/j.jff.2014.09.017.
[19] 张颖, 孙慧君, 武俊瑞, 等. 豆酱不同发酵阶段细菌群落多样性及动态变化分析[J]. 食品科学, 2017, 38(14): 30-35. DOI:10.7506/spkx1002-6630-201714005.
[20] POGACIC T, MAILLARD M B, LECLERC A, et al. Lactobacillus and Leuconostoc volatilomes in cheese conditions[J]. Applied Microbiology and Biotechnology, 2016, 100(5): 2335-2346.DOI:10.1007/s00253-015-7227-4.
[21] 王琳琳, 郑一敏, 杨宇清, 等. 肠膜明串珠菌产细菌素最适发酵条件的筛选[J]. 西南大学学报(自然科学版), 2011, 33(2): 82-85.DOI:10.13718/j.cnki.xdzk.2011.02.013.
[22] 王刚, 刘娟, 陈光, 等. 产D-乳酸假肠膜明串珠菌生长特性分析[J].湖北农业科学, 2016, 55(5): 1239-1241. DOI:10.14088/j.cnki.issn0439-8114.2016.05.038.
[23] 布坎南, 吉本斯. 伯杰氏细菌鉴定手册[M]. 8版. 北京: 科学出版社,1984: 274-770.
[24] 王笋, 吕嘉枥, 辛博, 等. 西北地区泡菜中乳酸杆菌的生物学特性[J]. 中国调味品, 2014, 39(3): 15-18. DOI:10.3969/j.issn.1000-9973.2014.03.004.
[25] CINDY D C C, NELLY C, VALENE B. 16S rDNA analysis of bacterial communities associated with the hyper accumulator Arabidopsis halleri grown on a Zn and Cd polluted soil[J]. European Journal of Soil Biology, 2014, 60: 16-23. DOI:10.1016/j.ejsobi.2013.10.006.
[26] 安美玲, 张艳, 刘忆冬, 等. 新疆喀什地区母乳中乳酸菌的多样性分析[J]. 微生物学通报, 2017, 44(9): 2104-2111. DOI:10.13344/j.microbiol.china.160878.
[27] 赵小茜, 魏旭丹, 陈戴玲, 等. 产多糖植物乳杆菌的耐酸耐胆盐能力[J]. 乳业科学与技术, 2016, 39(3): 1-3. DOI:10.15922/j.cnki.jdst.2016.03.001.
[28] 陈欣, 潘素华, 胡黎黎, 等. 人源乳酸杆菌耐酸耐胆盐能力的测定和鉴定[J]. 现代预防医学, 2006, 33(3): 278-279.
[29] 杨晓宇, 张七斤, 于晨龙, 等. 不同来源乳酸菌的耐酸耐胆盐实验[J]. 动物医学进展, 2014, 35(2): 73-77. DOI:10.16437/j.cnki.1007-5038.2014.02.009.
[30] D’ANGELO L, CICOTELLO J, ZAGO M, et al. Leuconostoc strains isolated from dairy products: response against food stress conditions[J].Food Microbiology, 2017, 66: 28-39. DOI:10.1016/j.fm.2017.04.001.
[31] OGIER J C, CASALTA E, FARROKH C, et al. Safety assessment of dairy microorganisms: the Leuconostoc genus[J]. International Journal of Food Microbiology, 2008, 126: 286-290. DOI:10.1016/j.ijfoodmicro.2007.08.012.
[32] 王梦姣, 李少英, 李淑芬, 等. 马奶及其制品中肠球菌属乳酸菌的安全性评价[J]. 食品科学, 2014, 35(17): 204-208. DOI:10.7506/spkx1002-6630-201417039.
Isolation and Identification of Leuconostoc from Traditional Fermented Soybean Paste
ZHANG Ping, ZHANG Pengfei, LIU Siqi, YUE Yuanyuan, WU Rina*
(College of Food Science, Shenyang Agricultural University, Shenyang 110866, China)
Abstract:The objective of this study was to separate Leuconostoc from traditional fermented soybean paste and to analyze their prebiotic properties. A total of 56 samples of naturally fermented soybean paste were collected from six regions in northeast China. We separated the suspected strains from these samples using the spread plate method, identified their morphological characteristics, physiological and biochemical characteristics, and analyzed their 16S rRNA gene sequences.The acid and bile salt tolerance of Leuconostoc strains were compared. As a result, we obtained 118 strains of lactic acid bacteria suspected of being Leuconostoc. Six of these were confirmed as Leuconostoc, three of which were identified as Leuconostoc lactis while the remaining three were identified as Leuconostoc mesenteroides subsp. mesenteroides. Among these Leuconostoc strains, strain FX6 had the best prebiotic potential and its survival rate was 85.16% after 3 h incubation at pH 3.0 and was up to 96.07% after 6 h incubation with 0.3 g/100 mL bile salt. Therefore, strain FX6 can be used for further research and industrial applications. The mechanism of action of FX6 in the soybean paste fermentation process still needs to be elucidated further.
Keywords:soybean paste; 16S rRNA gene; Leuconostoc; probiotics
ZHANG Ping, ZHANG Pengfei, LIU Siqi, et al. Isolation and identification of Leuconostoc from traditional fermented soybean paste[J]. Food Science, 2018, 39(22): 110-115. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201822017. http://www.spkx.net.cn
引文格式:张平, 张鹏飞, 刘斯琪, 等. 自然发酵豆酱中明串珠菌的分离鉴定[J]. 食品科学, 2018, 39(22): 110-115. DOI:10.7506/spkx1002-6630-201822017. http://www.spkx.net.cn
文章编号:1002-6630(2018)22-0110-06
文献标志码:A
中图分类号:TS214.2
DOI:10.7506/spkx1002-6630-201822017
*通信作者简介:乌日娜(1979—),女,副教授,博士,研究方向为食品生物技术。E-mail:wrn6956@163.com
第一作者简介:张平(1994—),女,硕士研究生,研究方向为食品生物技术。E-mail:2443533834@qq.coom
辽宁省“百千万人才工程”人选科技活动支持项目;沈阳市中青年科技创新人才支持计划项目(RC70212)
基金项目:国家自然科学基金面上项目(31471713);辽宁省高等学校优秀人才支持计划项目(LR2015059);
收稿日期:2017-10-11