表1 短小芽孢杆菌HN-10对几种病原细菌和真菌的拮抗作用
Table 1 Antimicrobial activity of B. pumilus HN-10 strain toward several kinds of pathogenic bacteria and fungi
注:+.有抑菌活性;-.无抑菌活性。
严海娇,贠建民*,白 杰,郭 娟,邓展瑞,李多佳
(甘肃农业大学食品科学与工程学院,甘肃 兰州 730070)
摘 要:长期大量使用杀菌剂不但会导致病原微生物产生耐药性,同时也存在着严重的环境和健康风险,因此开发不易产生耐药性的新型抗菌物质非常重要。本实验采用硫酸铵沉淀、AB-8大孔吸附树脂、Sephadex G-100凝胶和半制备型反相高效液相色谱对短小芽孢杆菌(Bacillus pumilus)HN-10发酵液进行逐级分离纯化,以粉红单端孢(Trichothecium roseum)为指示菌,测其抑菌活性,并通过基质辅助激光解析串联飞行时间串联质谱对纯化后的活性物质进行氨基酸序列分析。结果表明,经纯化后得到一种抗真菌肽P-1,其氨基酸序列为G-G-S-G-G-G-S-S-G-GS-I-G-G-R,分子质量为1 149.14 Da。经抑菌实验可知,抗真菌肽P-1在最小抑菌浓度为1 μg/mL时可抑制粉红单端孢生长。经ProtParam软件分析得到P-1理论等电点为9.75,带有1 个正电荷数。在NCBI数据库和APD数据库检索,与之序列相似性最高的仅为45%,因此判断这是一种新型抗真菌肽。抗真菌肽P-1抑菌效果良好,可为开发新型生防制剂提供理论依据。
关键词:抗菌肽;短小芽孢杆菌HN-10;分离纯化;粉红单端孢
粉红单端孢(Trichothecium roseum)是一种在植物病害中不容忽视的病原真菌,易造成多种果蔬发生红粉病,此外,粉红单端孢还会产生对人和动物有害的霉菌毒素——单端孢霉烯族毒素[1-2]。目前,主要是采取化学抑菌剂控制病害,但是化学抑菌剂所带来的杀菌剂毒性、病原物产生抗药性等因素潜在危害人类健康及环境[3-5]。因此,亟需寻找一种新的、安全无害的抑菌方式来控制植物病害。
抗菌肽又称抗微生物肽、宿主防御肽、抗生素肽,是生物体自身防御系统(如非特异性免疫)的重要组成部分[6-7],具有抗细菌、真菌、病毒,抑杀癌细胞等多种生物活性,且不易产生抗药性[8]。抗菌肽的这些特性使其能够代替化学杀菌剂达到控制植物病害的目的。
芽孢杆菌是广泛分布在自然界中的一种细菌,利用其产生的抗菌肽来防治植物病害已得到了多方面的应用。一些由芽孢杆菌属(Bacillus)产生的抗菌肽已经实现商业化使用,如蜡样芽孢杆菌(Bacillus cereus)产生的kanosamine、zwittermycin A[9-10]。国内陈德鑫等[11]发现一株短小芽孢杆菌(Bacillus pumilus)MK21具有高效降低烟碱含量的功能,通过MK21处理后的烟叶样品,达到刺激性降低、掩盖杂气和改善卷烟吸味的效果。王静等[12]发现一株短小芽孢杆菌AR03对烟草黑胫病菌(Phytophthora parasitica var. nicotianae)具有拮抗活性,且AR03固体发酵菌剂对烟草黑胫病、烟草青枯病(Rostonia solanacearum)混合发生病害有良好的田间防治效果。
本实验室在前期研究中从腐败的湿粉条中分离得到了1 株对粉红单端孢有抑菌作用的短小芽孢杆菌HN-10菌株(由16S rRNA序列鉴定,登录号:KT003271.1)。研究以短小芽孢杆菌HN-10发酵液为供试材料,通过多种层析方法对发酵液中活性物质进行分离纯化并进行抑菌活性鉴定。对经鉴定得到的抗菌肽进行氨基酸测序,最后通过生物信息学方法对此序列进行同源性对比,确定其是否为新型抗菌肽,以期为开发新型生防制剂提供理论依据。
1.1.1 供试菌
短小芽孢杆菌HN-10分离自甘肃省武山绿源贸易有限公司的腐败湿粉条。
大肠埃希氏菌(Escherichia coli)CGMCC 1.8732、金黄色葡萄球菌(Staphylococcus aureus)CGMCC 1.8721、沙门菌(Salmonella)CGMCC 1.10754、粉红单端孢(Trichothecium roseum)CGMCC 3.4509、鲜绿青霉(Penicillium visidicatum)CGMCC 3.5933、黑曲霉(Aspergillus niger)CGMCC 3.3928和伞枝犁头霉(Absidia corymbifera)CGMCC 3.3535均由中国普通微生物菌种保藏管理中心提供;互隔交链孢(Alternaria alternata)由甘肃农业大学食品科学与工程学院微生物实验室提供。
1.1.2 培养基
LB培养基:胰蛋白胨10 g,酵母提取物5 g,NaCl 10 g,琼脂15 g,水1 000 mL,pH 7.0,用于培养短小芽孢杆菌HN-10。
PDA培养基:马铃薯200 g,葡萄糖20 g,琼脂15 g,水1 000 mL,用于培养粉红单端孢。
1.1.3 试剂
AB-8大孔吸附树脂 天津市光复精细化工研究所;Sephadex G-100 上海玉博生物科技有限公司。
SCIENTZ-10ND冷冻干燥机 宁波新芝生物科技股份有限公司;2992高效液相色谱仪 日本岛津公司;Q Exactive质谱仪 美国Thermo Fisher公司。
1.3.1 抗菌活性的测定
短小芽孢杆菌HN-10抗细菌活性的测定采用琼脂孔径扩散法[13]。将HN-10菌种接种于LB琼脂培养基上,37 ℃培养48 h,刮取菌苔至LB液体培养基中,调节至1×109CFU/mL,吸取5 mL菌液平铺于LB培养基平皿上。表层铺满后迅速吸干,用直径5 mm的打孔器在上述培养基上打4 个孔,于孔径中添加30 μL被测物质,置于37 ℃培养箱中培养48 h,观察结果并测量抑菌圈直径。
短小芽孢杆菌HN-10抗真菌活性的测定采用琼脂孔径扩散法。将直径0.5 cm的病原真菌块放置在PDA平板中央,在距菌块2 cm处打4 个直径为0.5 cm的孔,于孔径中添加30 μL被测物质,置于28 ℃培养箱中培养,记录抑菌直径,以抑菌直径评价抑菌效果大小,实验设3 个重复[14]。
最小抑菌浓度测定:采用连续稀释法,对纯化后的抗菌肽做2 倍递减质量浓度稀释,分别为1.25、0.625、0.312 5、0.156 2、0.078 1、0.039、0.019 5、0.009 7、0.004 9、0.002 4、0.000 1 mg/mL,对粉红单端孢做抑菌实验,测量抑菌圈直径,实验重复3 次[15]。
1.3.2 抗真菌肽的分离纯化
1.3.2.1 抗菌物质的粗提
取1 环短小芽孢杆菌HN-10接种至LB液体培养基中,37 ℃、200 r/min培养3 d;将培养好后的菌液于4 ℃、10 000 r/min条件下离心20 min,收集上清液,然后向无菌的上清液中加入(NH4)2SO4至70%饱和度,4 ℃静置,沉淀过夜;将沉淀后的菌液于4 ℃、10 000 r/min离心20 min,去除上清液,加入20 mmol/L pH 6.8磷酸盐缓冲液(phosphate buffer saline,PBS)溶解沉淀,后放入截留分子质量为12 000~14 000 Da的透析袋中脱去(NH4)2SO4,透析24 h后,收集袋内样品,即得到具有抗菌活性的粗提液。将粗提液进行冷冻干燥浓缩,并测试其对粉红单端孢的抑制活性。
1.3.2.2 抗真菌肽的分离纯化
首先,采用AB-8大孔吸附树脂对粗提物进行纯化,取20 mL粗提物,加载进AB-8大孔吸附树脂,70%乙醇溶液洗脱,流速为2 BV/h,每管4 mL收集洗脱液,检测波长280 nm,以粉红单端孢为指示菌,测其抑菌活性,收集活性组分,进行冷冻干燥浓缩,-20 ℃保存,备用,便于下一步纯化。将从AB-8大孔吸附树脂收集到的活性组分通过Sephadex G-100 凝胶进行纯化,用20 mmol/L pH 6.8 PBS洗脱,流速为0.5 mL/min,检测波长280 nm,以粉红单端孢为指示菌,测其抑菌活性,收集活性组分,进行冷冻干燥浓缩,-20 ℃保存,备用,便于下一步纯化。
最后,将收集到的活性组分用半制备型反相高效液相色谱(reverse phase-high performance liquid chromatography,RP-HPLC)进行分离纯化。上样溶液质量浓度为5 mg/mL,用0.22 μm微孔滤膜过滤,备用。色谱条件:Kromasil C18柱(4.6 mm×250 mm),A相:0.1%三氟乙酸(tallow fatty acid,TFA)溶液, B相:0.1% TFA-乙腈溶液,流速1 mL/min,柱温25 ℃,进样量200 μL,检测波长280 nm。洗脱程序:0~5 min,A相10%~5%,B相90%~95%;5~10 min,A相5%~0%,B相95%~100%;10~11 min,A相0%~10%,B相100%~90%;11~30 min,A相10%,B相90%,洗脱总时间为30 min[16]。根据出峰时间,收集样品,并以粉红单端孢为指示菌,测其抑菌活性,收集活性组分,进行冷冻干燥浓缩,-20 ℃保存。
1.3.2.3 抗真菌肽氨基酸序列测定
将经半制备型RP-HPLC收集到的活性组分B、C分别用胰蛋白酶酶解,以TFA溶液提取酶解肽段[17]。上述肽段用样品溶解液(0.1%甲酸、2%乙腈)溶解,充分振荡涡旋,4 ℃、13 200 r/min离心10 min,上清液转移到上样管中,进行基质辅助激光解析串联飞行时间串联质谱(matrix assisted laser desorption ionization time of fl ight mass spectrometry,MALDI-TOF-MS/MS)鉴定氨基酸序列。
色谱条件:Acclaim PepMap RPLC C18柱(300 μm×5 mm,3 μm);流动相A:0.1%甲酸,2%乙腈;流动相B:0.1%甲酸,80%乙腈。流速:300 nL/min。洗脱程序:B相:0~8 min,6%~9%;8~24 min,9%~14%;24~60 min,14%~30%;60~75 min,30%~40%;75~78 min,40%~95%。
分离后的肽段直接进入Thermo Scientific Q Exactive质谱仪进行在线检测,一级质谱参数:分辨率:70 000;C-trap最大容量(AGC target):3×106;C-trap最大注入时间:40 ms;扫描范围:m/z 350~1 800。二级质谱参数:分辨率:17 500;C-trap最大容量(AGC target):1×105;C-trap最大注入时间:60 ms;动态排除:5 s。
将得到的质谱数据进行数据库检索:质谱原始文件,使用Maxquant检索uniprot全蛋白数据库。
所有数据均采用Origin 8.0和Excel 2010处理。
实验表明,短小芽孢杆菌HN-10只对粉红单端孢具有明显的抑菌活性,而对其他3 株供试细菌和4 株供试真菌无抑制活性(表1)。
表1 短小芽孢杆菌HN-10对几种病原细菌和真菌的拮抗作用
Table 1 Antimicrobial activity of B. pumilus HN-10 strain toward several kinds of pathogenic bacteria and fungi
注:+.有抑菌活性;-.无抑菌活性。
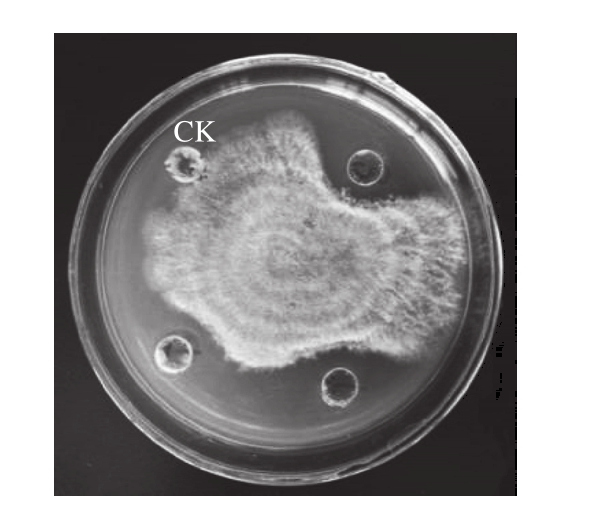
图1 粗提物对粉红单端孢的拮抗作用
Fig. 1 Antimicrobial activity of crude extract against T. roseum
CK组为30 μL 20 mmol/L、pH 6.8的PBS,下同;其余3孔为30 μL抗菌物质粗提物。
从图1可看出,抗菌粗提物在PDA平板上可以抑制粉红单端孢,在病原菌与粗提物之间有一条明显的抑制带。
抗菌粗提物通过AB-8大孔吸附树脂交换层析,经抑菌活性测定,发现洗脱体积在28~52 mL之间有抑菌活性(图2a、图3a),抑菌圈直径为(11±0.2)mm,收集这些活性组分,冷冻干燥。将收集到的活性组分通过Sephadex G-100凝胶层析进一步分离,洗脱体积分别在34~36 mL和40~48 mL有抑菌活性(图2b、图3b),抑菌圈直径分别为(9±0.2)mm和(12±0.2)mm,收集有活性组分,进行冷冻干燥。
抗菌物质粗提物经过大孔树脂和凝胶色谱两步分离后,样品组分相对较单一,随后采用半制备型RP-HPLC分离纯化后得到4 个峰A、B、C、D,收集并做抑菌实验。其中峰A抑菌活性较弱,抑菌圈直径小于(0.5±0.2)mm,而峰B和C抑菌活性良好,抑菌圈直径分别可达到(13±0.2)mm和(12±0.2)mm(图2c、图3c),峰D无活性。由于峰A活性弱,所以对A组分不进行氨基酸序列分析。
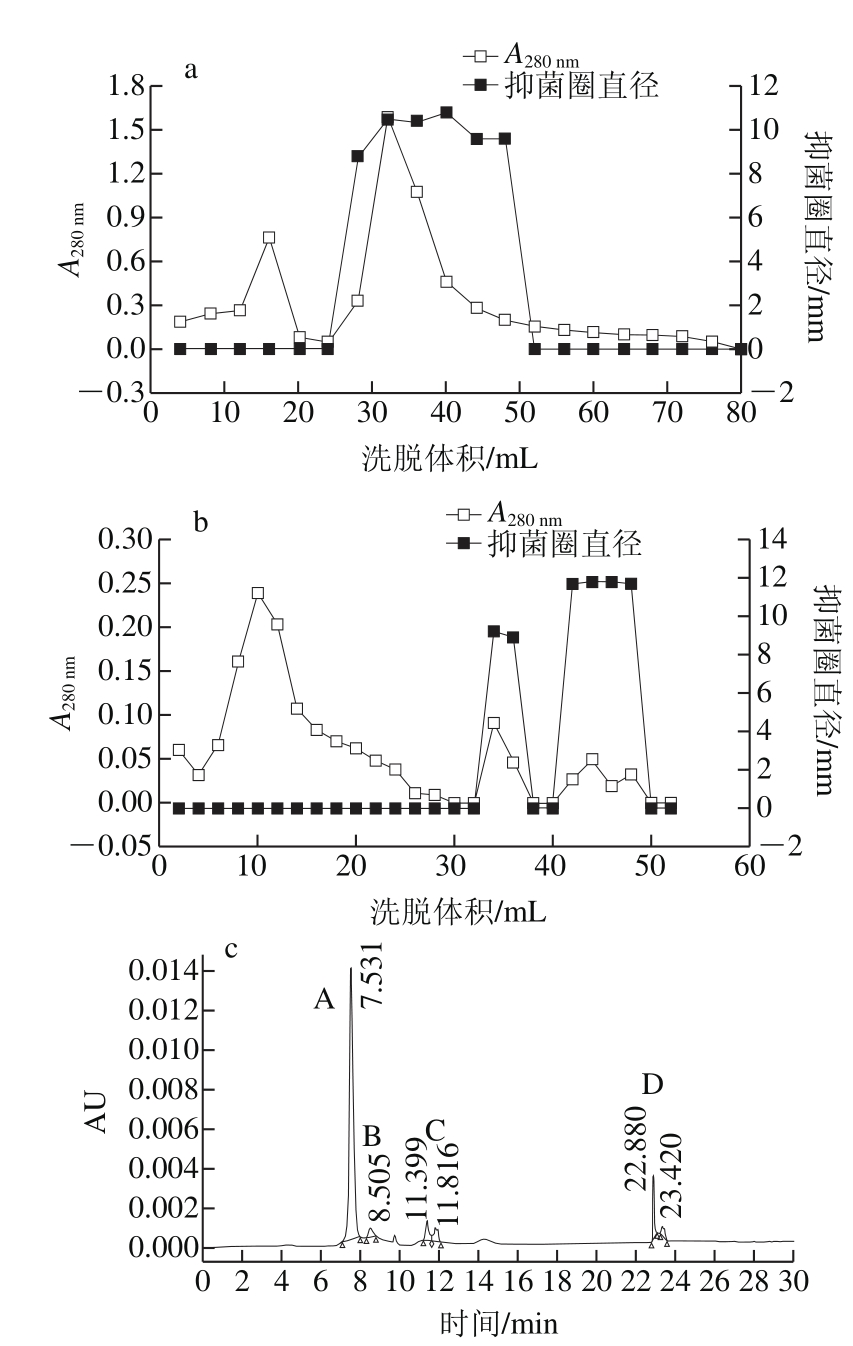
图2 抗真菌肽分离纯化色谱图
Fig. 2 Purification of the antimicrobial peptide
a. AB-8大孔吸附树脂交换层析;b. Sephadex G-100凝胶层析;c.半制备型RP-HPLC层析。图3同。
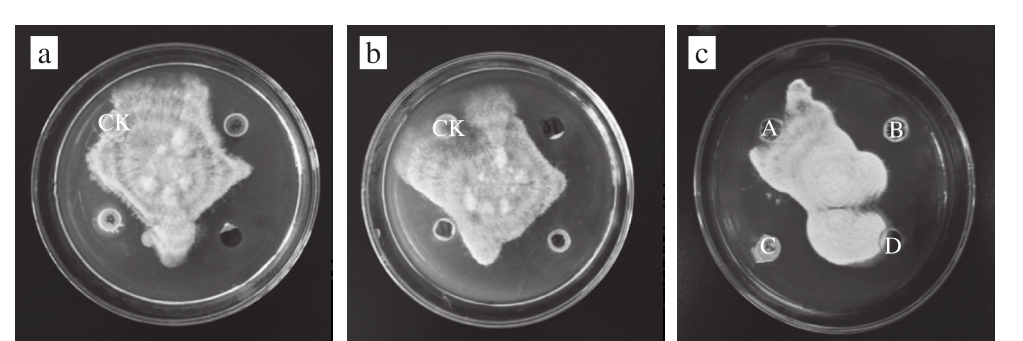
图3 各活性组分对粉红单端孢的抑制活性
Fig. 3 Antimicrobial activity of active fractions against T. roseum
a、b中除CK外其余3 孔为待测物质;c中A~D对应图2c峰号。
最小抑菌浓度是能够抑制细菌生长、繁殖的最低药物浓度。通过抑菌实验结果显示,经半制备型RP-HPLC纯化后的抗真菌肽P-1在1 μg/mL条件下能够抑制粉红单端孢的生长,此时抑菌圈直径为(10±0.5)mm。
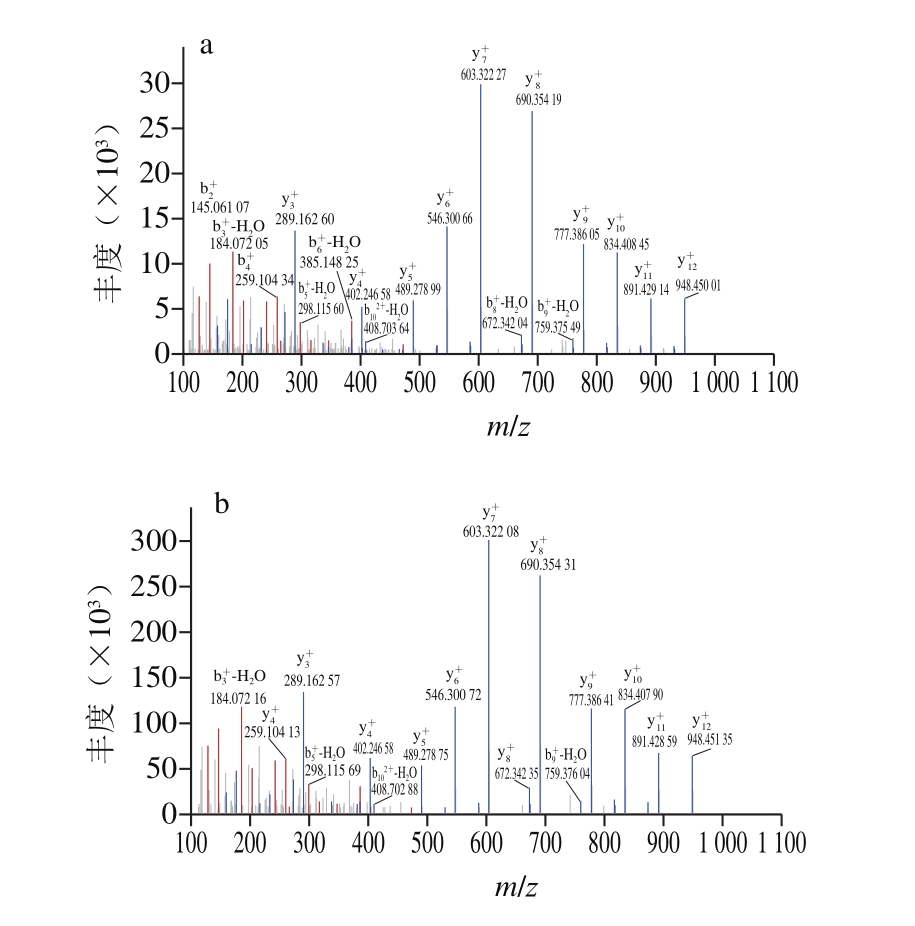
图4 组分B(a)、C(b)的MALDI-TOF-MS/MS图
Fig. 4 Amino acid sequence of fractions B (a) and C (b) analyzed by MALDI-TOF-MS/MS
表2 P-I与APD数据库中已知抗菌肽的比对
Table 2 Alignment of AMPs from the APD database with P-1

注:a. APD数据库中已知抗菌肽编号,加粗表示相同的氨基酸残基。
将通过MALID-TOF-MS/MS得到的氨基酸序列,于NCBI蛋白数据库(https://blast.ncbi.nlm.nih.gov/)、APD数据库(http://aps.unmc.edu/AP/main. php)、ExPASy(http://web.expasy.org/cgi-bin/protparam/protparam/)网站上进行在线生物信息学分析。通过MALID-TOF-MS/MS(图4)可知组分B与C为同一种肽,命名为P-1。推测组分B和C是同分异构体,所以为同一种肽,具体原因有待进一步实验论证。抗真菌肽P-1由15 个氨基酸残基组成,氨基酸序列为G-G-S-G-G-G-S-S-G-G-S-I-G-G-R,分子质量为1 149.14 Da,疏水率为6%,是一种富含甘氨酸抗真菌肽。同时将P-1氨基酸序列与NCBI数据库和APD数据库作比对,发现P-1的氨基酸序列与APD数据库中其他已知抗菌肽同源性较低,最高只达到45%(表2),因此,可判断P-1为新型抗真菌肽。利用ProtParam软件对抗真菌肽的理化参数进行分析,结果如下:P-1理论等电点9.75,GRAVY为-0.453,带电荷数+1,脂溶性指数26.00。
抗菌肽具有抗细菌、真菌、病毒及肿瘤等活性,对真核生物的正常细胞则无明显毒副作用,且几乎无耐药性[18-20],因此,抗菌肽成为国内外研究和开发的热点。抗菌肽来源广泛,可从植物、动物、微生物中提取出来,其中芽孢杆菌中含有大量的生物活性化合物,可作为研发新的抗菌肽的来源。
本实验通过硫酸铵沉淀、AB-8大孔吸附树脂、Sephadex G-100凝胶和半制备型RP-HPLC从短小芽孢杆菌HN-10发酵液中逐级分离纯化得到一种对粉红单端孢有抑制作用的新型阳离子抗真菌肽,氨基酸序列为G-GS-G-G-G-S-S-G-G-S-I-G-G-R。由于这种抗真菌肽属于短肽,所以合成较为简单,而这有利于扩大抗菌肽的应用范围。
已有研究报道,由短小芽孢杆菌产生的抗菌肽可作为生物防治剂应用于农业生产上[21]。Rishad等[22]从短小芽孢杆菌MCB-7中分离得到的抗菌肽可显著抑制黄曲霉、黑曲霉、烟曲霉菌和尖孢镰刀菌等病原真菌。Shali等[23]从短小芽孢杆菌SG2分离得到的几丁质酶可抑制小麦上的病原体禾谷镰刀菌和麦根腐平脐蠕孢的生长,可应用于生物防治。
一般认为,大多数的抗菌肽抑菌机制是抗菌肽能够与细胞膜表面相互作用,使膜的通透性改变,阳离子抗菌肽的正电荷区域与细胞膜上的负电荷区域相互作用,使抗菌肽分子的疏水端插入细胞膜的脂质膜中,进而改变脂质膜结构,造成细胞内容物泄漏,直接或间接地导致细胞死亡[6,24-25]。另外,抗菌肽的疏水性对抑菌活性也有影响,疏水性在抗菌肽插入细菌等微生物的脂质双分子层过程中具有重要作用。在一定范围内,虽然疏水性越大,抗菌肽的抗菌活力也就越强,但疏水性过高会导致抗菌肽自身聚集至沉淀析出,降低抗菌活性[26-28]。
由P-1的氨基酸序列可知,此种抗真菌肽为带正电荷+1的阳离子肽,P-1疏水率只有6%,疏水性较弱,与疏水性强的抗菌肽相比,其抑菌作用也较弱。但是经抑菌实验可看出,P-1的抑菌效果很好,这是由于P-1是一种富含甘氨酸肽,甘氨酸含量高达60%。
肽链中甘氨酸的存在使肽链结构更加灵活,它们一般位于带正电的双亲螺旋N端与疏水C端的连接部位,对活性起重要作用,能够抑制革兰氏阴性菌及真菌,同时也能够通过破坏细胞膜的方式抑制癌细胞生长[18,29]。如从番石榴种子中提取的富含甘氨酸抗菌肽Pg-AMP1,能够抑制革兰氏阳性菌(大肠杆菌、克雷伯氏肺炎杆菌、铜绿假单胞菌)和革兰氏阳性菌(金黄色葡萄球菌、表皮葡萄球菌)生长[30]。Thompson等[31]曾报道,采用羧肽酶从C端上移除谷氨酰胺和氨基酸,大量暴露甘氨酸,增强了肽的抑菌活性,同时提高了肽的稳定性。而这可得出甘氨酸是影响抗菌肽抑菌活性的一个关键因素。
在本研究中,已知抗菌肽P-1的氨基酸序列,但是这两种抗菌肽如何作用细胞壁并导致细胞死亡的机制还需进一步研究。
本研究通过硫酸铵沉淀、AB-8大孔吸附树脂、Sephadex G-100凝胶以及半制备型RP-HPLC对短小芽孢杆菌HN-10发酵液进行分级纯化,最终得到纯的抗菌肽P-1。利用MALDI-TOF-MS/MS分析确定该抗菌肽P-1由15 个氨基酸组成,分子质量为1 149.14 Da,等电点9.75。实验已对抗真菌肽的结构进行分析,但其具体空间结构还未得出,有待于进一步研究。
参考文献:
[1] NIU L L, BI Y, BAI X D, et al. Damage to Trichothecium roseum caused by sodium silicate is independent from pH[J]. Canada Journal Microbiology, 2016, 62(2): 161-172. DOI:10.1139/cjm-2015-0657.
[2] TANG Y M, XUE H L, BI Y, et al. A method of analysis for T-2 toxin and neosolaniol by UPLC-MS/MS in apple fruit inoculated with Trichothecium roseum[J]. Food Additives and Contaminants Part A-Chemistry Analysis Control Exposure & Risk Assessment, 2014,32(4): 480-487. DOI:10.1080/19440049.2014.968884.
[3] GE Y H, DENG H W, BI Y, et al. Postharvest ASM dipping and DPI pretreatment regulated reactive oxygen species metabolism in muskmelon(Cucumis melo L.) fruit[J]. Postharvest Biology & Technology, 2015, 99:160-167. DOI:10.1016/j.postharvbio.2014.09.001.
[4] NUNES C A. Biological control of postharvest diseases of fruit[J]. European Journal Plant Pathology, 2012, 133(1): 181-196.DOI:10.1007/s10658-011-9919-7.
[5] LI W H, BI Y, GE Y H, et al. Effects of postharvest sodium silicate treatment on pink rot disease and oxidative stress-antioxidative system in muskmelon fruit[J]. European Food Research Technology, 2012,234(1): 137-145. DOI:10.1007/s00217-011-1611-9.
[6] 苗建银, 柯畅, 郭浩贤. 抗菌肽的提取分离及抑菌机理研究进展[J]. 现代食品科技, 2014, 30(1): 233-240. DOI:10.13982/j.mfst.1673-9078.2014.01.042.
[7] 魏中琴, 高雅婷, 马奔科, 等. 抗菌肽的研究进展[J]. 黑龙江医药,2015, 21(8): 1-4. DOI:10.14035/j.cnki.hljyy.2015.01.001.
[8] 梁英. 抗菌肽的来源及应用[J]. 动物营养学报, 2014, 26(1): 7-16.DOI:10.3969/j.issn.1006-267x.2014.01.002.
[9] LEAES F L, VELHO R V, GOMES CALDAS D G, et al. Expression of essential genes for biosynthesis of antimicrobial peptides of Bacillus is modulated by inactivated cells of target microorganisms[J]. Research Microbiology, 2016, 167: 83-89. DOI:10.1016/j.resmic.2015.10.005.
[10] MARC O, PHILIPPE J. Bacillus lipopeptides: versatile weapons for plant disease biocontrol[J]. Trends Microbiology, 2008, 16(3): 115-125. DOI:10.1016/j.tim.2007.12.009.
[11] 陈德鑫, 许家来, 马志远, 等. 一株新的具有高效降低烟碱含量的短小芽孢杆菌MK21的分离筛选及作用研究[J]. 中国烟草学报, 2013,19(1): 60-64. DOI:10.3969/j.issn.1004-5708.2013.01.012.
[12] 王静, 孔凡玉, 秦西云, 等. 短小芽孢杆菌AR03对烟草黑胫病菌的拮抗活性及其田间防效[J]. 中国烟草学报, 2010, 16(5): 78-81.DOI:10.3969/j.issn.1004-5708.2010.05.015.
[13] 喻钢, 田万红, 董思国, 等. 枯草芽孢杆菌抗菌肽的分离纯化及质谱检测[J]. 药物分析杂志, 2014, 30(10): 1902-1906.
[14] 于杰, 张荣意, 谭志琼, 等. 枯草芽孢杆菌B25抗真菌作用及抗菌蛋白的分离纯化[J]. 基因组学与应用生物学, 2016, 35(3): 629-634.DOI:10.13417/j.gab.035.000629.
[15] 苏翔, 崔敬爱, 陈晓平. 蚂蚁抗菌肽的分离纯化及其活性[J]. 食品科学, 2013, 34(9): 70-73. DOI:10.7506/spkx1002-6630-201309016.
[16] SUNYI, CHANG R, LI Q Y, et al. Isolation and characterization of an antibacterial peptide from protein hydrolysates of Spirulina platensis[J]. European Food Research Technology, 2016, 242: 685-692. DOI:10.1007/s00217-015-2576-x.
[17] 胡瑞萍, 张铎, 张丽萍, 等. 枯草芽孢杆菌BSD-2一种抗菌肽的分离纯化与鉴定[J]. 华北农学报, 2011, 26(6): 201-206.
[18] 潘婕, 高振珅, 叶增民. 抗菌肽的结构功能关系及分子设计的研究现状[J]. 广东化工, 2011, 38(12): 58-59. DOI:10.3969/j.issn.1007-1865.2011.12.031.
[19] 周霞, 诸葛洪祥, 周洪福. 抗菌肽的分子生物学研究进展[J]. 国外医学: 流行病学传染病学分册, 2002, 29(5): 310-313. DOI:10.3760/cma.j.issn.1673-4149.2002.05.019.
[20] 黎观红, 洪智敏, 贾永杰, 等. 抗菌肽的抗菌作用及其机制[J].动物营养学报, 2011, 23(4): 546-555. DOI:10.3969/j.issn.1006-267x.2011.04.004.
[21] WANG G, YU M Z, DONG F, et al. Esterase activity inspired selection and characterization of zearalenone degrading bacteria Bacillus pumilus ES-21[J].Food Control, 2017, 77: 57-64. DOI:10.1016/j.foodcont.2017.01.021.
[22] RISHAD K S, REBELLO S, SHABANAMOL P S, et al. Biocontrol potential of Halotolerant bacterial chitinase from high yielding novel Bacillus pumilus MCB-7 autochthonous to mangrove ecosystem[J].Pesticide Biochemistry and Physiology, 2017, 137: 36-41.DOI:10.1016/j.pestbp.2016.09.005.
[23] SHALI A, GHASEMI S, AHMADIAN G, et al. Bacillus pumilus SG2 chitinases induced and regulated by chitin, show inhibitory activity against Fusarium graminearum and Bipolaris sorokiniana[J]. Phytoparasitica,2010, 38(2): 141-147. DOI:10.1007/s12600-009-0078-8.
[24] 李冠楠, 夏雪娟, 隆耀航, 等. 抗菌肽的研究进展及其应用[J].动物营养学报, 2014, 26(1): 17-25. DOI:10.3969/j.issn.1006-267x.2014.01.003.
[25] HUANG Y B, HUANG J F, CHEN Y X. Alpha-helical cationic antimicrobial peptides: relationships of structure and function[J].Protein Cell, 2010, 1(2): 143-152. DOI:10.1007/s13238-010-0004-3.
[26] 李志成, 苏晋文, 任娇, 等. 山羊乳酪蛋白抗菌肽分离纯化及结构鉴定[J]. 中国食品学报, 2014, 14(7): 214-223. DOI:10.16429/j.1009-7848.2014.07.033.
[27] 张兰廷, 刘忠渊, 张富春. 抗菌肽结构与功能关系及分子改造研究进展[J]. 生物技术, 2008, 18(5): 89-92. DOI:10.16519/j.cnki.1004-311x.2008.05.015.
[28] 李晓帆. 抗菌肽结构与抗菌活性关系及其在分子设计中的应用[J]. 科技信息, 2011, 12(5): 133. DOI:10.3969/j.issn.1001-9960.2011.05.098.
[29] 海力且木·艾力, 刘忠渊. 富含甘氨酸抗菌肽的研究进展[J]. 生物技术,2015, 25(3): 301-306. DOI:10.16519/j.cnki.1004-311x.2015.03.061.
[30] TAVARES L S, RETTOREA J V, FREITAS R M, et al. Antimicrobial activity of recombinant Pg-AMP1, a glycine-rich peptide from guava seeds[J]. Peptides, 2012, 37: 294-300. DOI:10.1016/j.peptides.2012.07.017.
[31] THOMPSON A H, BJOURSON A J, ORR D F, et al. A combined mass spectrometric and cDNA sequencing approach to the isolation and characterization of novel antimicrobial peptides from the skin secretions of Phyllomedusa hypochondrialis azurea[J]. Peptides, 2007,28(7): 1331-1343. DOI:10.1016/j.peptides.2007.05.001.
Purification of an Antimicrobial Peptide from Bacillus pumilus HN-10 and Its Inhibitory Activity against Trichothecium roseum
YAN Haijiao, YUN Jianmin*, BAI Jie, GUO Juan, DENG Zhanrui, LI Duojia
(College of Food Science and Engineering, Gansu Agricultural University, Lanzhou 730070, China)
Abstract:Chronic heavy use of bactericides could not only induce antibiotic resistance, but also could cause serious environmental and health risks. Thus, it is very important to develop new bactericides that kill pathogens without detectable resistance. In this study, a novel antimicrobial peptide produced by Bacillus pumilus HN-10 was purified consecutively by ammonium sulfate precipitation, macroporous resin AB-8 chromatography, Sephadex G-100 chromatography, and reversedphase high performance liquid chromatography (RP-HPLC). The antimicrobial activity of the peptide was tested against Trichothecium roseum. The amino acid sequence was analyzed by matrix assisted laser desorption ionization time of fl ight mass spectrometry (MALDI-TOF-MS/MS). The results showed that this peptide was designated as P-1 and its amino acid sequence was G-G-S-G-G-G-S-S-G-G-S-I-G-G-R with a molecular mass of 1 149.14 Da. P-1 exhibited strong antimicrobial activity against T. roseum with a minimum inhibitory concentration of 1 μg/mL. Analysis with the ProtParam software indicated that the theoretical isoelectric point of P-1 was 9.75, with one positive charge. P-1 was proved to be a novel peptide by NCBI database and APD database search with the highest similarity of only 45%.
Keywords:antimicrobial peptide; Bacillus pumilus HN-10; characterization and purification; Trichothecium roseum
YAN Haijiao, YUN Jianmin, BAI Jie, et al. Purification of an antimicrobial peptide from Bacillus pumilus HN-10 and its inhibitory activity against Trichothecium roseum[J]. Food Science, 2018, 39(22): 123-128. (in Chinese with English abstract)DOI:10.7506/spkx1002-6630-201822019. http://www.spkx.net.cn
引文格式:严海娇, 贠建民, 白杰, 等. 短小芽孢杆菌HN-10抗菌肽的分离纯化及其抗粉红单端孢活性[J]. 食品科学, 2018, 39(22):123-128. DOI:10.7506/spkx1002-6630-201822019. http://www.spkx.net.cn
文章编号:1002-6630(2018)22-0123-06
文献标志码:A
中图分类号:Q816
DOI:10.7506/spkx1002-6630-201822019
*通信作者简介:贠建民(1968—),男,教授,博士,研究方向为食品微生物发酵与发酵工程。E-mail:yunjianmin@gsau.edu.cn
第一作者简介:严海娇(1992—),女,硕士研究生,研究方向为食品微生物。E-mail:657344051@qq.com
基金项目:国家自然科学基金地区科学基金项目(31360405)
收稿日期:2017-10-09