杨钰昆1,杨文飞2,常媛媛1,郭园园1,翟豆豆1,王 津3,王兴华1,*
(1.山西大学生命科学学院,山西 太原 030006;2.山西大学生物技术研究所,山西 太原 030006;3.山西农业大学信息学院环境科学与食品工程系,山西 晋中 030800)
摘 要:利用酿酒酵母(Saccharomyces cerevisiae)作为模式生物,主要通过测定硒对镉胁迫下酿酒酵母细胞内活性氧(reactive oxygen species,ROS)和丙二醛(malondialdehyde,MDA)含量,及重要抗氧化酶包括超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)和过氧化物酶(peroxidase,POD)抗氧化活性的变化,研究硒对镉胁迫下酿酒酵母的抗氧化活性的影响。结果表明:镉处理能极显著提高酿酒酵母细胞内ROS和MDA含量(P<0.01),进而对酿酒酵母细胞产生氧化胁迫,在培养体系内加入一定量的外源硒可极显著(P<0.01)增加酿酒酵母细胞内抗氧化酶SOD、POD、CAT和GSH-Px活性,提高抗氧化物谷胱甘肽含量,加强酿酒酵母细胞对ROS和MDA的清除能力,这些结果表明外源硒的添加在酿酒酵母体内亦可对镉的影响产生拮抗作用,且与在动植物体内表现出一致的趋势,后续可以利用酿酒酵母作为模式生物进一步研究硒对镉毒性拮抗作用的一些机制。
关键词:硒;镉;酿酒酵母;抗氧化酶;活性氧
镉(Cd)以其移动性大、毒性高、污染面积最大成为当代环境中影响人类健康的主要污染物之一,对人体呼吸系统、心血管系统和生殖系统等均具有明显的毒害作用[1-2]。镉的毒性作用与其可以诱发自由基、诱导脂质过氧化有关[3-4],大量研究表明,镉会导致机体发生氧化应激作用进而诱导生物体产生大量的活性氧(reactive oxygen species,ROS),而ROS可以通过对细胞内大分子生物物质如蛋白质、DNA、脂质等的攻击,引起机体氧化胁迫损伤[5-11]。Yang Jingli等[12]研究表明抗氧化酶和ROS清除剂在抵御镉胁迫损伤中具有重要作用,硒是人体必需的微量元素,它是谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)的活性成分,同时可以改善生物体内其他抗氧化酶的活性,保护细胞和细胞膜免受氧化损伤[13-14]。
随着对硒的抗氧化作用的研究,已有实验证实硒可以通过多种途径拮抗镉引起的毒性效应,但这些实验大多是在动物或植物体内进行[15],具有周期长、影响因素复杂等缺点,而近些年来对硒的抗氧化性偏向分子机制研究,用动植物材料进行研究更是受到诸多限制。酿酒酵母(Saccharomyces cerevisiae)不仅在传统的食品工业方面有着广泛的应用,而且还是现代细胞生物学以及分子生物学研究中一种重要的模式生物[16-18]。酿酒酵母具有价格便宜、容易培养、生长快速、无致病性、基因组较小、与人类在某些方面具有同源性等特点,可以被用作研究重金属响应机制的模式生物[19-22]。目前应用酿酒酵母作为模式生物、利用硒作为拮抗剂来研究硒拮抗重金属镉引起的氧化胁迫机制的相关文献较少。
本实验旨在研究不同硒、镉条件对酿酒酵母生长的影响及硒拮抗剂对镉处理组酿酒酵母细胞生长的影响,通过比较添加硒拮抗剂前后镉对酵母细胞内ROS、丙二醛(malondialdehyde,MDA)含量及几种主要抗氧化酶活性的影响探究在酿酒酵母体内硒拮抗镉引起的氧化胁迫的机制。本研究可以为后续将酿酒酵母作为模式生物研究重金属氧化胁迫机制及镉拮抗剂的作用机理提供思路和依据。
酿酒酵母EGY48菌株保存于本实验室。
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose medium,YPD)培养基:酵母粉1%,蛋白胨2%,葡萄糖2%,pH值自然。
CdCl2·2.5H2O、无水亚硒酸钠等均为国产分析纯;超氧化物歧化酶(superoxide dismutase,SOD)测试盒、GSH-Px测试盒、过氧化氢酶(catalase,CAT)测试盒南京建成生物工程研究所。
TU-1810紫外-可见分光光度计 北京普析通用仪器有限责任公司;FACSCalibur流式细胞仪 美国BD公司。
1.3.1 酿酒酵母菌体浓度与OD600nm相关性分析
挑取保存于固体培养基上的酵母单菌落于YPD液体培养基中,30 ℃、200 r/min振荡培养过夜;取适量活化的菌液以2%接种量添加到YPD培养基中,用分光光度计测定初始OD600nm并用血球计数板测定菌体浓度,每隔2 h进行一次测定。对OD600nm和菌体浓度两组数据进行相关性分析。
1.3.2 测定不同浓度硒、镉对酿酒酵母生长的影响
依据生长曲线,在细胞生长对数期取酵母细胞,分别加至含有不同浓度镉(0、50、250、500、1 000 μmol/L)及硒(0、5、10、20、50、100、150 μmol/L)的YPD液体培养基中,通过稀释使培养液的初始OD600nm值一致后,于30 ℃、200 r/min条件下培养。每隔2 h测定培养液的OD值,根据式(1)计算各处理组的生长抑制率。选择生长抑制率为50%的镉浓度(EC50)和可以显著(P<0.05)促进酿酒酵母细胞生长的硒浓度进行后续实验。
1.3.3 硒对镉处理组酿酒酵母细胞生长的影响
取适量菌细胞至镉浓度为EC50的培养液中,同时加入一定浓度的硒,测定培养液的OD600nm值。以生长对数期的菌悬液OD600nm为主要参数,以培养液的初始OD600nm及未添加硒和镉的空白培养液OD600nm为对照,计算生长抑制率。选择一个合适的硒浓度进行后续实验。后续实验分为4 种处理方式进行实验,即空白对照组、EC50镉处理组、选定浓度硒处理组和EC50镉及选定浓度硒共同处理组并分别编号为0、1、2、3。
1.3.4 不同处理对酿酒酵母菌落生长的影响
用美兰染色法测定不同处理组死亡率,取在不同预处理12 h后培养液中大小相同的滤纸接种到不同的培养基上,30 ℃培养48 h之后用游标卡尺测量平板直径,并用Motic Images Plus 2.0软件中的三点圆测定方式对其菌落半径进行测量。
1.3.5 不同处理组ROS水平测定
低温下收集各处理组12 h时的菌体,按说明书逐步处理,用流式细胞仪测定不同处理组的ROS含量,用Cell Quest Pro软件进行数据采集,每个样本采集20 000 个细胞,用FlowJo 7.6.1进行数据分析。
1.3.6 GSH、MDA含量及各酶活性测定
取不同处理组酿酒酵母细胞培养液5 mL,4 ℃、4 000 r/min离心10 min,收集菌体。得到的菌体重悬于同体积的无菌生理盐水中洗涤2次,加入一定量PBS,置于冰上超声波破碎19 min(超声时间/间歇时间16 s/16 s,超声功率455 W)得粗提液。分别测定粗提液中各重要抗氧化酶活性及谷胱甘肽(glutathione,GSH)含量、MDA含量。蛋白质量浓度用考马斯亮蓝法测定,测定标准曲线方程为y=0.001 5x-0.002 7(R2=0.993 6)。
采用SPSS 19.0软件进行数据分析。
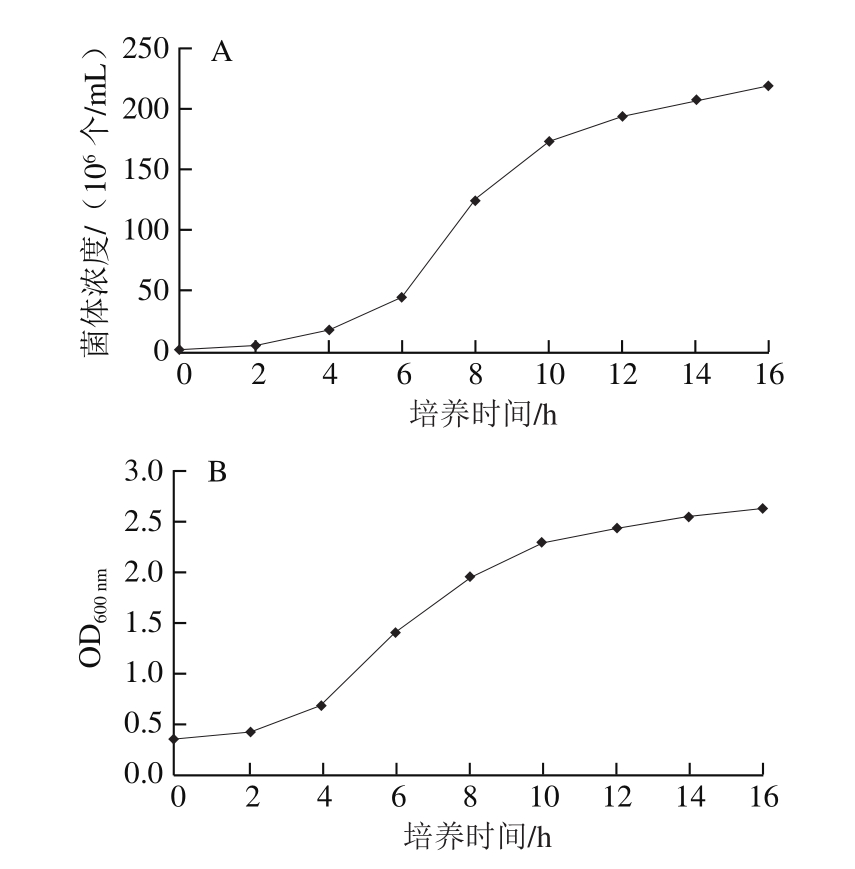
图1 菌体浓度(A)及OD600nm(B)随培养时间的变化
Fig. 1 Change in bacterial concentration (A) and OD600nm(B) with culture time
由图1可以看出,菌体浓度和培养液OD600nm变化趋势呈现出高度的一致性,且均在4 h左右开始进入对数生长期,从12 h开始渐渐进入平台期,选择4~12 h做酿酒酵母菌体浓度与OD600nm相关性分析结果如图2所示。

图2 菌体浓度与OD600nm相关性
Fig. 2 Correlation between bacterial concentration and OD600nm
由图2可以看出,在4~12 h内酿酒酵母菌体浓度与培养液OD600nm呈线性正相关,且拟合方程的R2为0.989 0,P<0.001,故在后续实验中可以用培养液OD600nm间接表示培养液中酿酒酵母菌体浓度。

图3 镉对酿酒酵母生长曲线的影响
Fig. 3 Inf l uence of cadmium on S. cerevisiae growth curve
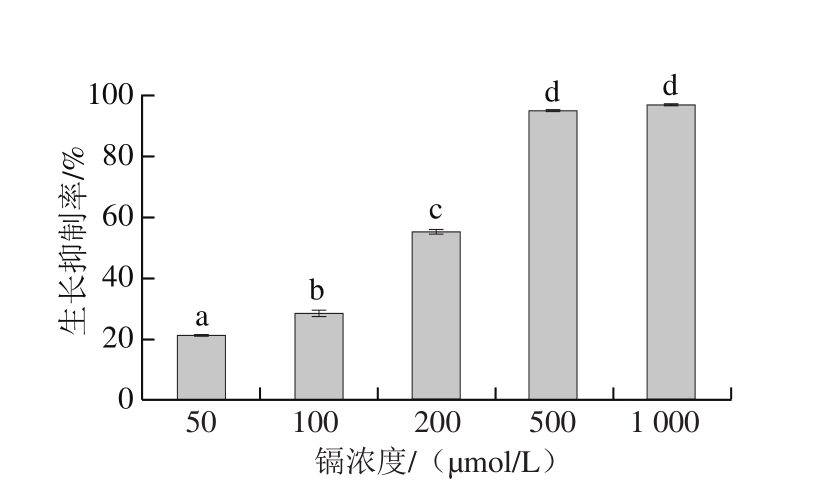
图4 镉浓度在第12小时对酿酒酵母的生长抑制率的影响
Fig. 4 Growth inhibition rate at different concentrations of cadmium at 12 h
不同字母表示差异显著(P<0.05)。
基于从生长曲线测定阶段得出酿酒酵母从第12小时开始进入平台期(图3),故对第12小时不同浓度镉对酿酒酵母生长的抑制率进行了单独分析,结果见图4。镉可以显著抑制酿酒酵母细胞生长(P<0.05),随着镉浓度的增加和作用时间延长,镉对酿酒酵母生长的抑制也更加显著,在镉浓度为500 μmol/L时,对酵母细胞生长的抑制率达到95%(P<0.05)。选择生长抑制率接近50%(P<0.05)的镉浓度200 μmol/L(EC50)作为后续实验的镉处理浓度。
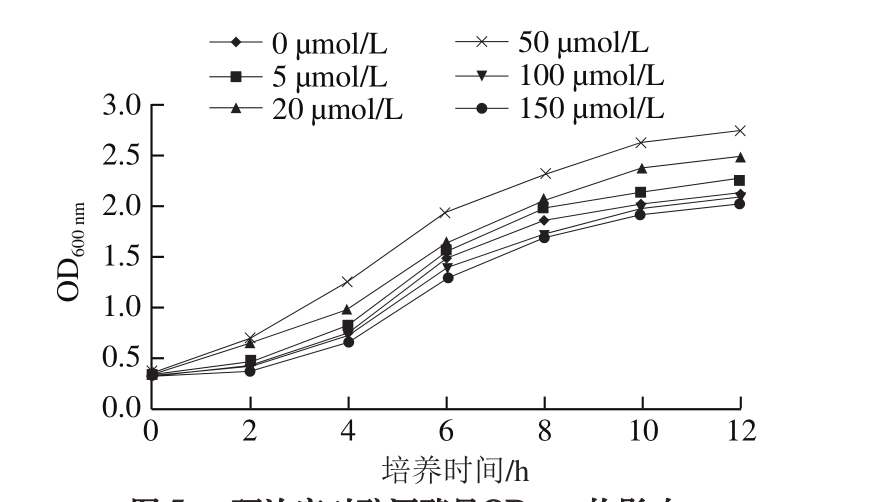
图5 硒浓度对酿酒酵母OD600nm的影响
Fig. 5 Effects of different concentrations of selenium on S. cerevisiae growth
由图5可知,浓度为5、20、50 μmol/L的硒对酿酒酵母的生长有一定的促进作用,且以50 μmol/L的硒处理组酿酒酵母的生长最好,而硒浓度大于100 μmol/L时对酵母细胞的生长表现抑制作用,故在后续实验中设计硒浓度为25、50、75 μmol/L三个水平来探究硒对镉毒性的拮抗作用,这3个梯度的硒在6 h和12 h对添加200 μmol/L镉后酿酒酵母生长的影响如图6所示。
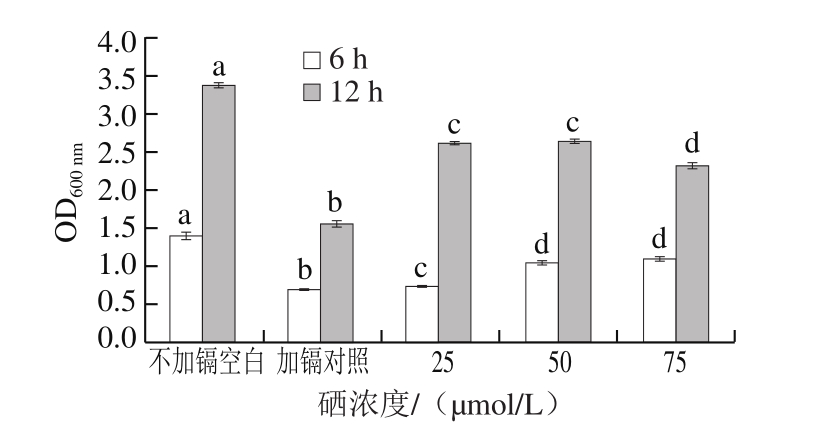
图6 硒浓度对镉毒性拮抗作用的影响
Fig. 6 Antagonistic effect of different concentrations of selenium on cadmium toxicity
同一时间不同字母表示差异显著(P<0.05)。
由图6可知,处理第6和12小时50 μmol/L硒处理组均有表现出高水平的拮抗作用。按4 种不同的处理方式0、1、2、3号组得到的酿酒酵母的生长曲线如图7所示。

图7 硒镉处理条件对酿酒酵母生长曲线的影响
Fig. 7 Effects of different combinations of selenium and cadmium on S. cerevisiae growth curve
0号组.不含硒和镉的YPD培养基处理组空白对照;1号组. 200 μmol/L镉处理;2号组. 50 μmol/L硒处理;3号组. 200 μmol/L镉和50 μmol/L硒共同处理。下同。
从图7可知,50 μmol/L硒可以显著(P<0.05)拮抗200 μmol/L镉对酿酒酵母生长的抑制作用,故选择50 μmol/L的硒进行后续实验。
在用0、1、2、3号组4 种不同预处理方式培养酿酒酵母12 h后,接种于0、1、2、3号组各自对应不含硒和镉的YPD培养基(YPD)、含有200 μmol/L镉的培养基(Cd200)、含有50 μmol/L硒(Se50)的培养基和同时含有50 μmol/L硒和200 μmol/L镉(Cd200+Se50)的培养基上,培养一定时间后对其菌落生长形态进行观察比较。

图8 预处理后酿酒酵母在不同培养基上菌落半径比较
Fig. 8 Comparison of colony radius of S. cerevisiae on different media after pretreatment
小写字母不同表示相同预处理条件下差异显著(P<0.05)。
实验结果表明:在相同的培养基上,0号和2号预处理组菌落与1、3号预处理组对应的菌落相比较菌落边缘整齐,质地均匀,致密度良好,1号预处理菌落几乎不生长或只是分布有一些小菌落,可能是部分菌体在生长过程中死亡导致,尤其在Cd200培养基上菌落几乎没有生长,3号预处理组菌落和1预处理相比较菌落较为稀薄。不同预处理后酿酒酵母在培养基上的菌落呈粉红色可能与菌体富硒有关[23]。从图8可以看出,在Cd200培养基上各预处理后的菌落半径均显著小于在YPD培养上的菌落半径(P<0.05)。经过1号组预处理之后,可以看出镉的预处理对酵母生长具有较强的抑制作用,而在Se50和Cd200+Se50培养基上的菌落半径与YPD上的菌落半径没有显著性差异,从而说明硒对镉对酵母生长的抑制作用具有拮抗性能。1、3号预处理组在Se50及Cd200+Se50培养基上的菌落半径均显著大于在Cd200培养基上菌落半径(P<0.05)。

图9 加硒对镉诱导的酿酒酵母ROS含量升高的影响
Fig. 9 Effects of selenium on cadmium-induced increase in ROS level in S. cerevisiae
字母不同表示差异极显著(P<0.01),下同。
由图9可以看出,200 μmol/L镉可以极显著诱导酵母细胞内ROS含量的升高(P<0.01),达到空白对照组5 倍的水平,50 μmol/L硒单独处理组酵母细胞内ROS含量略有降低但变化不显著,而在添加200 μmol/L镉的培养液中加50 μmol/L硒可以极显著降低200 μmol/L镉处理组胞内ROS含量(P<0.01)。
在用超声波破壁法制得粗提液后,按各试剂盒说明书测定各种抗氧化酶活性。本部分主要测定的几种重要抗氧化酶,其中在测定GSH-Px的同时还对GSH含量变化进行了测定,结果见表1。
表1 不同处理对抗氧化酶活性及GSH含量的影响
Table 1 Effects of different treatments on antioxidant enzyme activities and GSH and MDA contents in S. cerevisiae
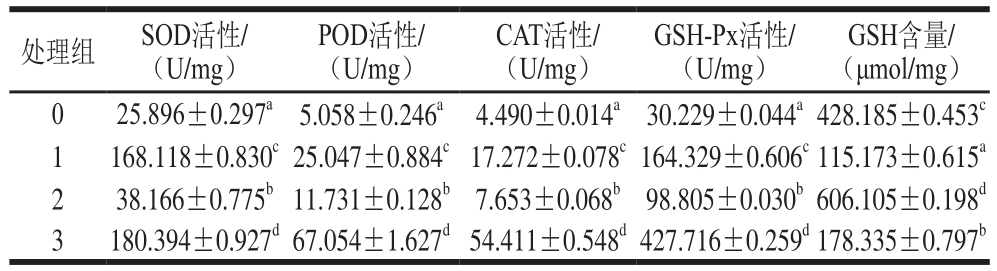
注:同列小写字母不同表示差异极显著(P<0.01)。
与空白对照组相比,200 μmol/L镉及50 μmol/L硒处理组酵母细胞SOD、CAT和GSH-Px活性均极显著提高(P<0.01),与镉单独处理组相比,200 μmol/L镉和50 μmol/L硒共同处理组酵母细胞SOD、POD、CAT和GSH-Px活性提高,且对GSH-Px水平影响最大,与空白对照组相比相差10 倍以上。加硒后酵母细胞GSH含量极显著升高(P<0.01),镉处理组GSH降低效应得到抑制。
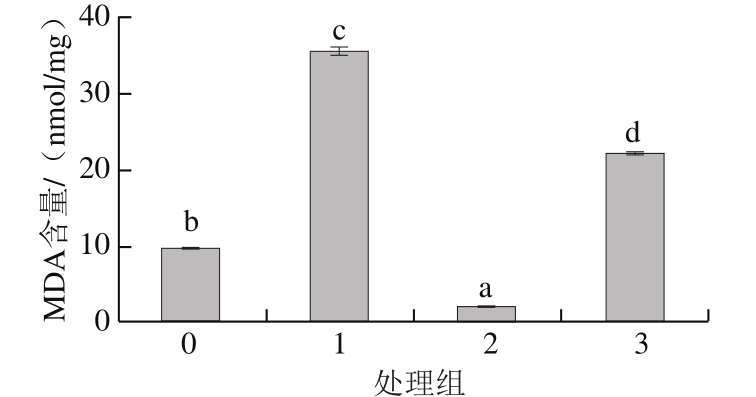
图10 加硒对镉诱导的MDA含量升高的影响
Fig. 10 Inf l uence of adding selenium on cadmium-induced increase in MDA content
由图10可以看出,与空白对照相比,添加200 μmol/L镉极显著升高酿酒酵母细胞内MDA含量(P<0.01),达到了空白对照组的3 倍以上,添加50 μmol/L硒可以降低酿酒酵母细胞内的MDA含量,二者共同处理组MDA含量较镉单独处理组极显著下降(P<0.01),但与空白对照组相比较差异仍为极显著(P<0.01);表明硒在降低酿酒酵母MDA含量方面有显著的作用,且可以极显著拮抗镉引起的MDA含量升高。
机体在受到镉的刺激后,体内会产生大量ROS[24],使细胞和组织发生氧化损伤。SOD、CAT、GSH-Px和POD是酿酒酵母中的几种重要抗氧化酶[15,25],它们可以直接清除体内ROS,其中GSH-Px在清除过氧化物时需GSH源源不断的补充才能充分发挥清除作用。膜系统中的不饱和脂肪酸极易被ROS氧化成MDA,因此MDA含量常作为判断膜系统损伤程度的指标[26]。本实验在选定200 μmol/L镉和50 μmol/L硒作为处理浓度后,分别测定了SOD、POD、CAT、GSH-Px等重要抗氧化酶活性及GSH含量,还测定了ROS和MDA含量。
同其他学者研究结果相比,本实验在添加200 μmol/L镉后也同样显著(P<0.05)抑制了酿酒酵母的生长,抑制率达到54.95%;并引起酿酒酵母ROS、MDA含量极显著增加(P<0.01),分别达到了空白对照组的5 倍和3 倍高的水平;不同于其他研究者实验结果的是,本研究在添加镉后未使酿酒酵母各抗氧化酶SOD、POD、CAT、GSH-Px活性显著下降[15,27],而是使得酿酒酵母各抗氧化酶活性均显著(P<0.05)增高,这可能是由于本研究选择的镉浓度较其他研究者要低[28],而高浓度的镉才会导致细胞抗氧化酶活性下降;同添加其他已知的外源抗氧化剂相同,添加硒后酿酒酵母几种抗氧化酶活性均显著(P<0.05)提高,其中对GSH-Px和GSH含量的影响最大,这可能与GSH-Px是含硒抗氧化酶有关[29];其ROS、MDA含量也均得到极显著(P<0.01)控制[15,30],但并未能恢复到空白对照组的水平。说明硒可以通过提高细胞内SOD、POD、CAT和GSH-Px、GSH含量降低细胞内因氧化胁迫引起的ROS含量上升,降低酿酒酵母细胞MDA水平,进而拮抗镉对酿酒酵母的氧化胁迫,这与张苗苗[31]、廖普兴[32]等研究的在植物和动物体内的结果相一致。说明硒在酿酒酵母体内亦可对镉产生拮抗作用,且与在动植物体内表现出一致的趋势,因此可以利用酿酒酵母作为模式生物进一步研究硒对镉毒性拮抗作用的一些机制。
参考文献:
[1] 杜丽娜, 余若祯, 王海燕, 等. 重金属镉污染及其毒性研究进展[J]. 环境与健康杂志, 2013, 30(2): 167-174. DOI:10.16241/j.cnki.1001-5914.2013.02.020.
[2] 赵静, 孙海娟, 冯叙桥. 食品中重金属镉污染状况及其检测技术研究进展[J]. 食品工业科技, 2014, 35(7): 357-363. DOI:10.13386/j.issn1002-0306.2014.07.069.
[3] 朱善良, 陈龙. 镉毒性损伤及其机制的研究进展[J]. 生物学教学,2006, 31(8): 2-5. DOI:10.3969/j.issn.1004-7549.2006.08.001.
[4] 廖琳, 胡晓荣, 李晖, 等. 生态环境中镉对生物体毒性作用机理及硒对该毒性拮抗作用的研究进展[J]. 四川环境, 2002, 21(2): 21-24.DOI:10.14034/j.cnki.schj.2002.02.006.
[5] PRADHAN A, PINHEIRO J P, SEENA S, et al. Polyhydroxyfullerene binds cadmium ions and alleviates metal-induced oxidative stress in Saccharomyces cerevisiae[J]. Applied & Environmental Microbiology,2014, 80(18): 5874. DOI:10.1128/AEM.01329-14.
[6] REHMAN A, ANJUM M S. Multiple metal tolerance and biosorption of cadmium by Candida tropicalis, isolated from industrial effluents: glutathione as detoxifying agent[J]. Environmental Monitoring & Assessment, 2011, 174(1/2/3/4): 585-595.DOI:10.1007/s10661-010-1480-x.
[7] NARGUND A M, AVERY S V, HOUGHTON J E. Cadmium induces a heterogeneous and caspase-dependent apoptotic response in Saccharomyces cerevisiae[J]. Apoptosis, 2008, 13(6): 811-821.DOI:10.1007/s10495-008-0215-8.
[8] SAHARAN R K, SHARMA S C. Effects of glutathione modulation on oxidative stress and enzymatic antioxidant defence in yeast pachysolen tannophilus[J]. Current Microbiology, 2011, 62(3):944-949. DOI:10.1007/s00284-010-9808-x.
[9] LIU J, ZHANG Y, HUANG D, et al. Cadmium induced MTs synthesis via oxidative stress in yeast Saccharomyces cerevisiae[J]. Molecular &Cellular Biochemistry, 2005, 280(1/2): 139-145. DOI:10.1007/s11010-005-8541-4.
[10] MUTHUKUMAR K, NACHIAPPAN V. Cadmium-induced oxidative stress in Saccharomyces cerevisiae[J]. Indian Journal of Biochemistry &Biophysics, 2010, 47(6): 383-387.
[11] GARDARIN A, CHÉDIN S, LAGNIEL G, et al. Endoplasmic reticulum is a major target of cadmium toxicity in yeast[J]. Molecular Microbiology, 2010, 76(4): 1034-1048. DOI:10.1111/j.1365-2958.2010.07166.x.
[12] YANG J L, WANG Y, LIU G, et al. Tamarix hispida metallothioneinlike ThMT3, a reactive oxygen species scavenger, increases tolerance against Cd(2+), Zn(2+), Cu(2+), and NaCl in transgenic yeast[J].Molecular Biology Reports, 2011, 38(3): 1567-1374. DOI:10.1007/s11033-010-0265-1.
[13] 谭志鑫, 李玉山. 硒的抗氧化作用研究进展[J]. 现代预防医学, 2003,30(6): 825-826. DOI:10.3969/j.issn.1003-8507.2003.06.034.
[14] 王敏娟, 李亚军, 张蓓, 等. 亚硒酸钠预处理对Aβ损伤PC12细胞的保护性作用[J]. 中国老年学, 2014(23): 6725-6728. DOI:10.3969/j.issn.1005-9202.2014.23.087.
[15] 丁坤峰. 镉对酿酒酵母及植物的损伤机制研究[D]. 郑州: 河南工业大学, 2011.
[16] TIAGO F C, PORTO B A, RIBEIRO N S, et al. Effect of Saccharomyces cerevisiae strain UFMG A-905 in experimental model of inflammatory bowel disease[J]. Beneficial Microbes, 2015, 6(6):807-815. DOI:10.3920/BM2015.0018.
[17] MARTINS F S, RODRIGUES A C, TIAGO F C, et al. Saccharomyces cerevisiae strain 905 reduces the translocation of Salmonella enterica serotype Typhimurium and stimulates the immune system in gnotobiotic and conventional mice[J]. Journal of Medical Microbiology, 2007, 56(Pt 3): 352-359. DOI:10.1099/jmm.0.46525-0.
[18] LI C, JIANG W, MA N, et al. Bioaccumulation of cadmium by growing Zygosaccharomyces rouxii and Saccharomyces cerevisiae[J].Bioresource Technology, 2014, 155(2): 116-121. DOI:10.1016/j.biortech.2013.12.098.
[19] ZHAO X Y, LIANG S F, YAO S H, et al. Identification and preliminary function study of Xenopus laevis DRR1 gene[J]. Biochemical &Biophysical Research Communications, 2007, 361(1): 74-78.DOI:10.1016/j.bbrc.2007.06.158.
[20] 陈彩平. 裂殖酵母中人DJ-1同源蛋白亚细胞定位及SpDJ-1在胁迫反应中作用的研究[D]. 南京: 南京师范大学, 2015.
[21] BAUDIN A, OZIERKALOGEROPOULOS O, DENOUEL A, et al.A simple and efficient method for direct gene deletion in Saccharomyces cerevisiae[J]. Nucleic Acids Research, 1993, 21(14):3329-3330. DOI:10.1093/nar/21.14.3329.
[22] 张丽琳. 酿酒酵母应对镉胁迫的分子机理研究[D]. 天津: 天津大学, 2012.
[23] 程立立. 富硒红米速食粥原料、加工工艺及体外抗氧化研究[D].福州: 福建农林大学, 2016.
[24] 王福海, 黄成华. 活性氧自由基的研究进展[J]. 广州化工, 2013,41(16): 10-12. DOI:10.3969/j.issn.1001-9677.2013.16.004.
[25] 吴丽华, 陈燕飞, 陈鹏, 等. 亚砷酸钠对酵母细胞抗氧化酶活性和脂质过氧化的影响[J]. 生态毒理学报, 2016, 11(3): 302-307.DOI:10.7524/AJE.1673-5897.20151105001.
[26] 刘时中, 林壮基, 黄谷送. 血清脂质过氧化产物-丙二醛测定及其意义[J]. 广东医药学院学报, 1985(1): 18-22. DOI:10.16809/j.cnki.1006-8783.1985.01.005.
[27] 黎明. 酿酒酵母镉反应机理及镉拮抗物筛选初步研究[D]. 重庆:西南交通大学, 2015.
[28] 何俊瑜, 任艳芳, 任明见, 等. 镉对小麦种子萌发、幼苗生长及抗氧化酶活性的影响[J]. 华北农学报, 2009, 24(5): 135-139.
[29] 李素媚. 微量元素硒的临床应用新进展[J]. 广东微量元素科学,2009, 16(7): 8-12. DOI:10.3969/j.issn.1006-446X.2009.07.002.
[30] 王兴华, 刘慧, 仪慧兰. 活性氧和钙离子参与镉诱导的酵母细胞死亡过程调节[J]. 环境科学学报, 2014, 34(7): 1869-1873.DOI:10.13671/j.hjkxxb.2014.0516.
[31] 张苗苗, 韩善华, 王亚男, 等. 硒对蚕豆胚根抗氧化酶系统的影响[J]. 四川师范大学学报(自然科学版), 2010, 33(2): 239-242.DOI:10.3969/j.issn.1001-8395.2010.02.025.
[32] 廖鲁兴, 赖玉熔. 硒、镉的摄入对大鼠肝细胞器膜元素分布的影响[J].卫生研究, 1995(3): 166-168.
Effects of Selenium on Antioxidant Activity of Saccharomyces cerevisiae under Cadmium Stress
YANG Yukun1, YANG Wenfei2, CHANG Yuanyuan1, GUO Yuanyuan1, ZHAI Doudou1, WANG Jin3, WANG Xinghua1,*
(1. School of Life Science, Shanxi University, Taiyuan 030006, China;
2. Institute of Biotechnology, Shanxi University, Taiyuan 030006, China; 3. Department of Environmental Science and Food Engineering, College of Information, Shanxi Agricultural University, Jinzhong 030800, China)
Abstract:The aim of this paper was to examine the effects of selenium on the antioxidant activity of Saccharomyces cerevisiae under cadmium stress. The levels of reactive oxygen species (ROS) and malondialdehyde (MDA), and the activities of important antioxidant enzymes including superoxide dismutase (SOD), catalase (CAT), glutathione peroxidase(GSH-Px) and peroxidase (POD) in S. cerevisiae cells were determined. The results obtained showed that cadmium treatment could significantly increase the contents of ROS and MDA in S. cerevisiae (P < 0.01), consequently generating oxidative stress. When a certain amount of exogenous selenium was added to the culture system, the activities of SOD, POD, CAT and GSH-Px were significantly increased (P < 0.01). The content of antioxidant GSH was also increased, enhancing the ability to scavenge ROS and MDA. These results indicated that the addition of exogenous selenium could also antagonize cadmium effects in S. cerevisiae, and this effect was also observed in plants and animals. S. cerevisiae could be used as a model organism for further study to investigate the mechanisms of selenium antagonism towards cadmium toxicity.
Keywords:selenium; cadmium; S. cerevisiae; antioxidant enzyme; reactive oxygen species (ROS)
YANG Yukun, YANG Wenfei, CHANG Yuanyuan, et al. Effects of selenium on antioxidant activity of Saccharomyces cerevisiae under cadmium stress[J]. Food Science, 2018, 39(22): 129-134. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201822020. http://www.spkx.net.cn
引文格式:杨钰昆, 杨文飞, 常媛媛, 等. 硒对镉胁迫下酿酒酵母抗氧化活性的影响[J]. 食品科学, 2018, 39(22): 129-134.DOI:10.7506/spkx1002-6630-201822020. http://www.spkx.net.cn
文章编号:1002-6630(2018)22-0129-06
文献标志码:A
中图分类号:Q933
DOI:10.7506/spkx1002-6630-201822020
*通信作者简介:王兴华(1958—),男,教授,本科,研究方向为微生物发酵及食品安全。E-mail:xhwang@sxu.edu.cn
第一作者简介:杨钰昆(1989—),男,讲师,博士,研究方向为食品安全与检测技术。E-mail:yangyukun@sxu.edu.cn
山西省科技厅攻关项目(20140311021-5)
基金项目:国家自然科学基金青年科学基金项目(31701686);山西省应用基础研究项目面上青年基金项目(201701D221180);
收稿日期:2017-10-27