邱 斌,孙文佳,刘 玮,徐同成,刘丽娜,宗爱珍,贾 敏,杜方岭*
(山东省农业科学院农产品研究所,山东省农产品精深加工技术重点实验室,农业部新食品资源加工重点实验室,山东 济南 250100)
摘 要:以反油酸诱导人脐静脉内皮细胞后,结合转录组学分析及其生物信息学分析,在转录水平上对相关差异表达基因进行研究。结果表明:共检测到95 条基因显著变化,其中31 条基因上调,64 条基因下调。并通过生物信息学分析,其中参与生物进程显著性差异表达基因共772 条,关于细胞组成的基因显著表达性差异基因共46 条,关于分子功能的基因显著表达性差异基因共122 条。共检测到93 条信号通路,其中显著变化的有11 条,其中包括萜类骨架生物合成通路、类固醇生物合成通路和脂肪酸代谢通路等。根据蛋白质基因互作通路图,重点分析了同时参与不同通路的靶基因,包括脂肪酸合成酶、STAT4转录因子及IL-23细胞因子等。
关键词:反式脂肪酸;反油酸;转录组学;信号通路;生物信息学
反式脂肪酸是油脂或含油脂的加工食品中比较常见的一种脂肪酸组分。反式脂肪酸中一般以主要反油酸(C18:19t)为主,约占20%~50%。目前已经有很多关于反式脂肪酸和人类健康关系的研究报道[1-4]。Slattery等[5]研究发现,高含量的反式脂肪酸摄入与女性结肠癌的风险具有显著相关性(其中相对危险度精确估计值1.5)。另外,还有研究发现反式脂肪酸与心血管疾病的发生呈正相关的关系[6-8]。反式脂肪酸所造成的血浆总胆固醇、甘油三酯水平、载脂蛋白B(apoB)水平的升高和血液黏稠度的增加都与冠心病、血栓和动脉粥样硬化的形成密切相关[9]。Mozaffarian等[10]通过对心脏病患者细胞膜水平的脂肪酸含量的分析发现,摄入反式脂肪酸的生物标志物IL-6、TNF受体等都与炎症密切相关。
前期已经研究报道C18:19t能通过caspase、Fas/FasL、p53等信号通路诱导内皮细胞损伤和凋亡[11-13]。但是,反式脂肪酸诱导内皮细胞是一个十分复杂的生物学过程,其中涉及大量基因的差异表达以及转录因子和miRNA等多种生物因子的调控作用。转录组学作为一个在综合水平上研究生物在某一生理进程中所有基因转录及其转录调控规律的手段,为研究反式脂肪酸诱导内皮细胞后相关基因变化提供了技术保障。目前,尚无针对反式脂肪酸对内皮细胞转录组学的相关报道。本研究通过反式脂肪酸中的C18:19t单体诱导内皮细胞后,通过转录组学筛选差异基因,结合生物信息学分析,探寻反式脂肪酸诱导内皮细胞相关基因功能和信号转导通路,为研究反式脂肪酸对基因表达、信号网络的调控提供理论依据。
人脐静脉内皮细胞HUVECs由山东大学提供。
试剂总RNA提取试剂盒、TBS380 Picogreen试剂盒美国Invitrogen公司;TruSeqTMRNA sample prep Kit试剂盒、cBot TruSeq PE Cluster Kit v3-cBot-HS试剂盒、HiSeq-TruSeq SBS Kit(300cycles)试剂盒 美国Illumina公司;Certified Low Range Ultra Agarose 美国Bio-Rad公司;低糖DMEM培养基、胰蛋白酶 美国Hycolne公司;胎牛血清 杭州四季青生物工程材料有限公司;C18:19t美国Sigma公司。
Eppendorf AG CO2培养箱 美国Sheldon公司;1×70-81FZ倒置显微镜 日本Olympus公司;2K15型冷冻离心机 美国Sigma公司;cBoT簇生成系统、HiSeq2500测序仪 美国Illumina公司。
1.3.1 细胞培养及样品处理
将细胞以1×105个/mL接种于培养瓶,待细胞长至融合,收集细胞并用总RNA提取试剂处理,该组作为对照组。反式脂肪酸实验组同时分别加入C18:19t,使其终浓度分别为200 μmol/L,诱导内皮细胞24 h后,用总RNA提取试剂处理并收集细胞留作转录组学检测,对照组和C18:19t组分别重复3 次。
1.3.2 转录组测序
以5 μg total RNA起始量建库;磁珠法分离mRNA后,离子打断mRNA(TruSeqTMRNA sample prep Kit);双链cDNA合成、补平、3’端加A、连接index接头(TruSeqTMRNA sample prep Kit);文库富集,聚合酶链式反应(polymerase chain reaction,PCR)扩增15个cycles;2%琼脂糖胶回收目的条带(Certified Low Range Ultra Agarose);TBS380(Picogreen)定量,按数据比例混合上机;cBot上进行桥式PCR扩增,生成clusters;Illumina HiSeq测序平台,进行2×150 bp测序。
1.3.3 基因差异表达分析
由转录组测序所得的数据称为原始读段(raw reads),首先对raw reads进行质控,确定测序数据是否适用于后续分析。
在RNA测序分析中,主要通过对定位到基因组区域的测序序列(clean reads)的数量来估计基因的表达水平。依据所有样本与参考基因组比对的结果,计算每个基因/转录本在样本中的百万外显子的碱基片段值(fragments per kilobase million,FPKM),以该值作为基因/转录本在样本中的表达量。最终对所有基因/转录本在各组样本中的表达进行差异显著性分析,找出相对差异表达的基因/转录本,并对其进行可视化分析。衡量基因表达水平的标准为FPKM值,即每1×106条序列中,每个基因以1 000 个碱基为单位,比对上的reads个数。由于各基因碱基长度不同,在分析其特定表达量时,会将比对上的测序条数和其基因长度关联分析,具体公式如下:
同实验条件下的基因差异表达分析使用Cuffdiff软件。差异蛋白筛选标准:倍数变化值≥2,P<0.05。对3次重复数据进行t检验,P值小于0.05为差异显著,满足以上要求的基因即被列出。
1.3.4 生物信息学分析
采用OmicsBean(http://www.omicsbean.com:88/)软件进行生物信息学分析,利用该软件每个差异表达基因的基因本体(geneontology,GO)富集分析、KEGG通路分析、蛋白质互作(protein-protein interaction,PPI)分析。
基因在不同表达水平的转录本,被有效检测时对数据量的要求不同。因此,高表达量的基因测序时需要较少的数据量就可趋近于饱和;低表达量的基因则需要较大的数据量要求才能保证检测的准确性。饱和度曲线可以描述不同测序量的条件下各基因的表达检测是否准确。

图1 测序饱和度曲线
Fig. 1 Sequencing saturation curves
如图1所示,待测样本(包括对照组和C18:19t组)测序饱和度较高,大部分中等以上表达量的基因(即FPKM值在3.5以上的基因)在测序reads的40%比对上时已经接近饱和(纵轴数值趋近于1),说明饱和度总体质量较高,该测序量能够覆盖绝大多数的表达基因。
结果显示:C18:19t作用于内皮细胞后,与对照组相比,共检测到95 条基因显著变化,其中31 条基因上调,64 条基因下调。具体基因ID及其信息详见表1。
表1 C18:19t诱导内皮细胞表达有显著差异的基因
Table 1 Elaidic acid induced differential gene expression in endothelial cells

续表1
对该所有差异基因GO富集(生物进程、细胞组成、分子功能)和KEGG通路富集结果总数以及显著(P<0.05)数目进行汇总,并通过柱形图(图2)形式进行直观展示。
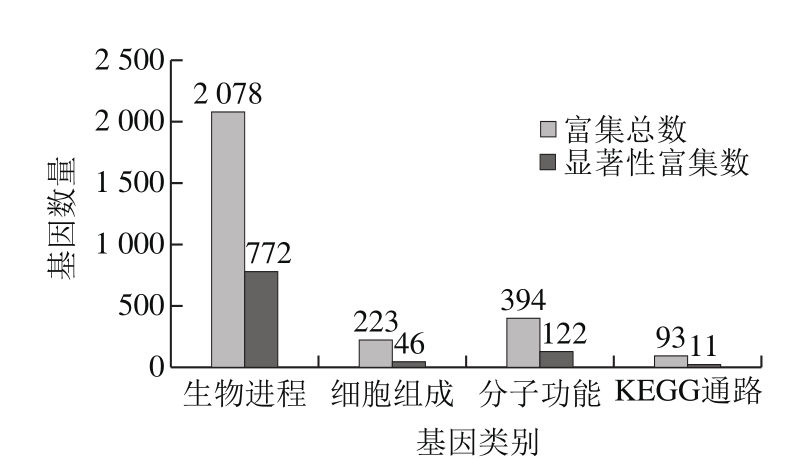
图2 生物信息分析汇总图
Fig. 2 Summary of bioinformatics analysis
一个基因通常会参与很多的功能或者通路,所以一般GO富集和KEGG通路富集结果总数会远大于差异表达基因数目,显著性功能或者通路是指富集到的该功能或者通路是差异显著的,即置信度比较高,P值越小,置信度越高。通过生物信息学汇总分析,图2显示其中生物进程共富集到2 078 条,显著性富集基因共772 条,关于细胞组成的基因共富集到223 条,其中显著性富集基因共46 条,关于分子功能的基因共富集到394条,其中显著性富集基因共122 条。C18:19t作用于内皮细胞后,与对照组相比,共检测到93条信号通路,其中显著变化的有11 条。

图3 GO注释分析图
Fig. 3 GO annotation analysis
GO是基因本体联合会(Gene Ontology Consortium)所建立的数据库。GO总共有3 个本体:生物进程描述分子功能的有序组合;细胞组分描述亚细胞结构、位置和大分子复合物;分子功能描述基因及基因产物个体的功能,达成更广泛的生物功能。本实验GO富集分析基于主流的数据库David 6.7(http://david.abcc.ncifcrf.gov/)和QuickGO(http://www.ebi.ac.uk/QuickGO/)对筛选的差异表达基因进行GO分类注释和富集分析。
图3展示了生物进程、细胞组成和分子功能3 种类别富集分析显著性排名前20的条目,在生物进程中,包括胆固醇生物合成、胆固醇代谢、脂质代谢、磷酸代谢等与脂质合成代谢相关生物过程占据一半以上,说明反式脂肪酸作用于内皮细胞细胞后,参与了细胞的脂质相关生物过程并对其产生了显著影响。细胞组成分析结果显示,其中涉及细胞外区域及胶原蛋白锚定的生物过程共8 条,以bcl3-10基因相关复合物为主的细胞内生物进程2 条,脂质复合物相关生物进程3 条,细胞质相关区域生物进程2 条。细胞定位揭示了反式脂肪酸从内皮细胞细胞膜外到细胞质的不同作用位点,为研究反式脂肪酸在内皮细胞内转运等生物进程提供了依据。分子功能富集分析结果显示,其中参与蛋白、前体蛋白等绑定功能4 条,NADPH还原酶、脂酰胺酶、异戊烯转移酶、氧化还原酶等参与的与脂肪酸合成、代谢相关功能共16 条,分子功能富集结果与生物进程结果一致。
KEGG(http://www.kegg.jp/kegg/pathway.html)是一个整合了基因组、化学和系统功能信息的数据库。把差异表达基因信息映射到KEGG数据库,可以获得其富集到的KEGG通路。

图4 KEGG通路富集分析图
Fig. 4 KEGG pathway enrichment analysis
KEGG通路富集分析的结果(图4)显示:最显著的通路为萜类骨架生物合成通路和类固醇生物合成通路,其中类固醇生物合成通路是调控胆固醇从细胞内转运进入线粒体的关键通路[14]。这两条通路涉及反式脂肪酸诱导的脂肪酸、萜类及其胆固醇等的代谢,在代谢过程中涉及多种酶、辅酶及底物[15]。
结合GO分析中生物进程中细胞定位富集结果,NADPH、脂酰胺酶等多种酶参与了上述通路。类风湿关节炎通路涉及细胞自身免疫等功能,作为该通路的标志蛋白-脂联素与脂质代谢、动脉粥样硬化等密切相关[16]。研究报道n-3脂肪酸能够刺激生长并在心血管疾病[17]和炎症反应(类风湿关节炎和溃疡性结肠炎)中起到保护作用[18-19]。相反本研究中发现C18:19t诱导内皮细胞后,类风湿相关炎症因子表达上调,说明C18:19t诱导了内皮细胞炎症反应生物进程的发展。反式脂肪酸诱导内皮细胞后,同时参与的还有包括脂肪酸代谢、不饱和脂肪酸合成通路等代谢通路。其中值得关注的两条通路是JAK-STAT信号通路和肿瘤坏死因子通路。近来有研究发现JAK-STAT信号通路的激活对促进脂肪酸的分解有着重要的调节作用[20]。JAK-STAT信号通路中激活的STATs转运到核内,调节基因的转录,如编码线粒体解偶联蛋白2基因和编码过氧化体增殖物激活型受体γ(peroxisome proliferatoractivated receptor-gamma,PPARγ),进而通过PPARγ对脂肪组织中甘油三酯水解的限速酶激素敏感脂酶进行转录调节[21]。γ-亚麻酸能通过小鼠胃肠黏膜系统和血液系统传递信号,通过NF-κB、P38/JNK/MAPK、JAKSTAT等途径调节机体的免疫[22]。研究发现,二十二碳六烯酸(docosahexenoic acid,DHA)、二十碳五烯酸(eicosapentenoic acid,EPA)等欧米伽多不饱和脂肪酸(ω-3-polyunsaturated fatty acid,ω-3 PUFA)具有下调炎性细胞因子TNF-α、IL-6表达的功能[23],已有研究报道C18:19t能够导致内皮细胞TNF-α分泌升高[8],而本研究发现结果与之相反。但本研究同时发现MMP-1表达上调,在病理情况下如创伤愈合、修复或重塑过程中,MMP-1表达量增加[24]。而本研究发现与炎症相关的STAT4却表达升高,相对于实时定量PCR,转录组学对于某个基因的表达定性可能会出现误差或者表达上调分类划分不准确,后续实验需要对TNF通路进行实时定量PCR验证。
基因互作基于string数据库进行分析,string数据库是蛋白质间预测的功能相关性的一个数据库,可以搜寻已知蛋白质/基因之间和预测蛋白质/基因之间相互作用的系统。这种相互作用既包括蛋白质/基因之间直接的物理的相互作用,也包括蛋白质/基因之间间接功能的相关性。它除了包含有实验数据、从PubMed摘要中文本挖掘的结果和综合其他数据库数据外,还有利用生物信息学的方法预测的结果。
根据PPI通路图分析(图5),反式脂肪酸诱导内皮细胞生物进程主要分为两大类,一类是以脂肪酸代谢等为主的脂质代谢进程,另一类是包括类风湿关节炎通路和肿瘤坏死因子通路等与炎症和凋亡相关的生物进程。在互作图里面,有些基因不仅仅参与了一条信号通路,可能同时参与调控多条信号通路。这些基因为了解反式脂肪酸调控内皮细胞生物进程机制提供了重要靶点。
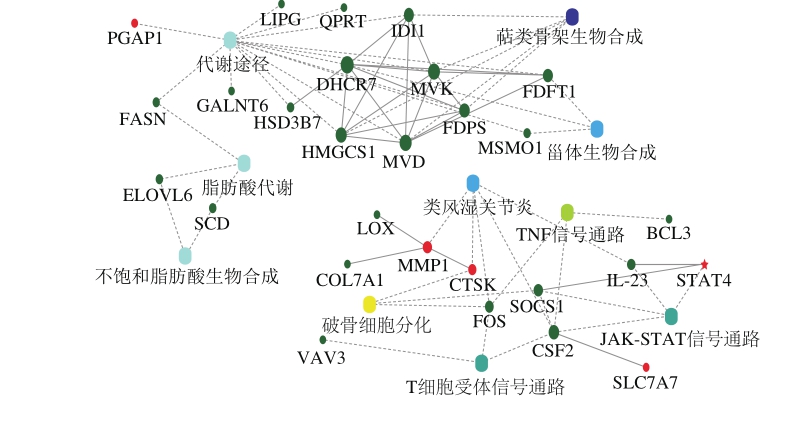
图5 信号通路网络基因互作图
Fig. 5 Gene-gene interaction in signaling pathway network
图中为圆点(基因或蛋白)与圆点连线(互作关系,虚线为未经实验验证,实线为已有相关验证报道)、圆点与圆角矩形(生物过程、细胞定位、分子功能或信号通路)连线(关联和参与)以及颜色变化(红色示意表达量上调,绿色示意表达量下调,黄色和蓝色渐变则表示显著性由低到高)等展示的分子相互作用网络与机制。
在脂质代谢过程中,共6 条基因同时参与了至少2 条代谢相关通路,具体如下:1)本研究发现脂肪酸合成酶(fatty acid synthetase,FASN)基因同时参与代谢途径和脂肪酸代谢两条信号通路。FASN是一种多功能的复合酶,是合成脂肪酸的关键酶。FASN的激活被证实与脂肪生成途径诱导的缺氧和脂肪酸缺乏呈正相关[25]。Vizio等[26]发现脂筏上存在cav-1和FASN相互作用的作用位点。Clarke等[27]发现日粮中多不饱和脂肪酸显著降低肝脏中的FASN mRNA水平,鱼油比红花油更有效,而软脂酸甘油酯和三油酸甘油酯对FASN mRNA无影响。通过上述研究,说明C18:19t能通过激活FASN从而干预脂肪酸在体内代谢,最终导致相关基本的发生和发展。2)同时,本研究还发现IDI1基因同时参与代谢途径和萜类骨架生物合成通路;3)FDFT1、DHCR7同时参与了代谢途径和甾族化合物生物合成通路;4)ELOVL6、SCD基因同时参与了脂肪酸代谢信号通路和不饱和脂肪酸生物合成通路。
在炎症和凋亡相关的生物进程中,共4 条基因同时参与了至少2条相关信号通路,具体如下:1)FOS基因同时参与破骨细胞分化通路、类风湿关节炎通路和肿瘤坏死因子通路;2)CTSK基因参与破骨细胞分化通路和类风湿关节炎通路;3)CSF2同时参与类风湿关节炎通路、T细胞受体信号通路、肿瘤坏死因子通路和JAKSTAT信号通路;4)SOCS1同时参与了JAK-STAT信号通路和破骨细胞分化通路。JAK-STAT通路涉及多条基因的显著表达,包括CSF2、SOCS1、STAT4和IL23。STATs是一个转录因子家族,它们对于细胞信号转导具有至关重要的作用,因此可以作为细胞渗透小分子吸引靶蛋白,它们的活化均依赖分子内Tyr残基的磷酸化。STAT4是机体自身免疫过程中,调控炎症的核心。有报道发现在人内皮细胞内,STAT4的磷酸化与JAK1和Tyk2密切相关[28]。IL-23是IL-12细胞因子家族中新的一员,主要由活化的巨噬细胞及树突状细胞产生。IL-23在感染、炎症、自身免疫性疾病及肿瘤免疫中发挥重要的作用。本研究通过PPI互作发现:STAT4转录因子被激活,表达上调,同时发现IL-23下调,后续实验可以STAT4和IL-23为靶点,重点研究JAK-STAT在反式脂肪酸诱导内皮细胞中的调控作用。
实验利用转录组学技术,对反式脂肪酸诱导内皮细胞后,差异表达基因及其相关生物信息学进行了分析。其中共检测到95 条基因显著变化,并对显著表达基因所涉及生物进程进行分类。根据基因互作通路分析,发现反式脂肪酸诱导内皮细胞生物进程主要分为以脂肪酸代谢等为主的脂质代谢进程和肿瘤坏死因子通路等与炎症和凋亡相关的生物进程。后续可根据生物信息学分析,进行相关通路验证研究。
参考文献:
[1] BOOKER C S, MANN J I. Trans fatty acids and cardiovascular health: translation of the evidence base[J]. Nutrition, Metabolism &Cardiovascular Diseases, 2008, 18: 448-456. DOI:10.1016/j.numecd.2008.02.005.
[2] 邱斌, 刘蓉, 邓泽元, 等. trans C18:1通过NOS-NO系统诱导内皮细胞损伤研究[J]. 食品科学, 2011, 32(15): 277-280.
[3] BLOCK R C, HARRIS W S, REID K J, et al. Omega-6 and trans fatty acids in blood cell membranes: a risk factor for acute coronary syndromes[J]. American Heart Journal, 2008, 156(6): 1117-1123.DOI:10.1016/j.ahj.2008.07.014.
[4] TRICOT O, MALLAT Z, HEYMES C, et al. Relalion between endolhelial cell apoptosis and blood flow direction in human atherosclerotic plaques[J]. Circulation, 2000, 101: 2450-2453.DOI:10.1161/01.CIR.101.21.2450.
[5] SLATTERY M L, BENSON J, MA K N. Trans fatty acids and colon cancer[J]. Nutrition of Cancer, 2001, 39(2): 170-175. DOI:10.1207/S15327914nc392_2.
[6] LOPEZ G E, SCHULZE M B, MEIGS J B, et al. Consumption of trans fatty acids is related to plasma biomarkers of inf l ammation and endothelial dysfunction[J]. Nutritional Epidemiology, 2005, 135(3):562-566. DOI:10.1093/jn/135.3.562.
[7] BARE D J, JUDD J T, CLEVIDENCE B A, et al. Dietary fatty acids affect plasma markers of inf l ammation in healthy men fed controlled diets: a randomized crossover study[J]. American Journal of Clinical Nutrition, 2004, 79(6): 969-973. DOI:10.1093/ajcn/79.6.969.
[8] HU F B, STAMPFER M J, MANSON J E, et al. Dietary fat intake and the risk of coronary heart disease in women[J]. New England Journal of Medicine, 1997, 337: 1491-1499. DOI:10.1056/NEJM199711203372102.
[9] 杨永宗. 中国动脉粥样硬化病理生理学研究近况[J]. 中国动脉硬化杂志, 2004, 12(4): 481-489.
[10] MOZAFFARIAN D, RIMM E B, KING I B, et al. Trans fatty acids and systemic inflammation in heart failure[J]. American Journal of Clinical Nutrition, 2004, 80(6): 1521-1525. DOI:10.1093/ajcn/80.6.1521.
[11] QIU B, HU J N, LIU R, et al. Caspase pathway of elaidic acid(9t-C18:1)-induced apoptosis in human umbilical vein endothelial cells[J]. Cell Biology International, 2012, 36(3): 255-260.DOI:10.1042/CBI20110164.
[12] RAO H, MA L X, XU T T, et al. Lipid rafts and Fas/FasL pathway may involve in elaidic acid-induced apoptosis of human umbilical vein endothelial cells[J]. Journal of Agricultural & Food Chemistry, 2014,62(3): 798-807. DOI:10.1021/jf404834e.
[13] 于化泓, 梁中爽, 李湘梅, 等. 反式脂肪酸对血管内皮细胞损伤的影响[J]. 食品科学, 2011, 32(19): 244-247.
[14] LIU J, RONE M B, PAPADOPOULOS V. Protein-protein interactions mediate mitochondrial cholesterol transport and steroid biosynthesis[J].The Journal of Biological Chemistry, 2006, 281(50): 38879-38893.DOI:10.1074/jbc.M608820200.
[15] BETANCOR M B, SPRAGUE M, SAYANOVA O, et al. Evaluation of a high-EPA oil from transgenic Camelina sativa in feeds for Atlantic salmon (Salmo salar L.): effects on tissue fatty acid composition, histology and gene expression[J]. Aquaculture, 2015,444: 1-12. DOI:10.1016/j.aquaculture.2015.03.020.
[16] 彭静, 杨帆, 李洋. 脂联素: 类风湿关节炎的又一生物标志物[J].国际免疫学杂志, 2014, 37(4): 312-316.
[17] KROMHOUT D, BOSSCHIETER E B, COULANDER C D L.The inverse relationship between fish consumption and 20-year mortality from coronary heart disease[J]. New England Journal of Medicine, 1985, 312(19): 1205-1209. DOI:10.1056/NEJM198505093121901.
[18] LORENZ R, WEBER P C, SZIMMAU P, et al. Supplementation with n-3 fatty acids from fi sh oil in chronic inf l ammatory bowel disease:a randomized placebo-controlled, double blind cross-over trial[J].Journal of Internal Medicine, 1989, 225: 225-232.
[19] HAWTHOME A B, DANESHMEND T K, HAWKEY C J, et al.Treatment of ulcerative colitis with fish oil supplementation: a prospective 12-month randomized controlled trial[J]. Gut, 1992, 33(7):922-928. DOI:10.1136/gut.33.7.922.
[20] 王文正, 赵素梅, 高士争. Leptin介导的JAK/STAT信号通路对脂类代谢调节的研究进展[J]. 中国细胞生物学学报, 2011, 33(5): 584-589.
[21] FAN C, YAN J, QIAN Y, et al. Regulation of lipoprotein lipaseexpression by effect of hawthorn flavonoids on peroxisome proliferator response element pathway[J]. Journal of Pharmacological Sciences, 2006, 100(1): 51-58. DOI:10.1254/jphs.FP0050748.
[22] 乔冬, 庞广昌, 李杨. γ-亚麻酸对小鼠免疫系统的调节作用[J]. 食品科学, 2011, 32(21): 247-252.
[23] ULF R. Trans fatty acids and insulin resistance[J]. Atherosclerosis Supplements, 2006, 7(2): 37-39. DOI:10.1016/j.atherosclerosiss up.2006.04.008.
[24] 闫越, 孔毅, 杨天雨. 基质金属蛋白酶-1的研究进展[J]. 西北药学杂志, 2012, 27(6): 607-609.
[25] MENENDEZ J A, VELLON L, OZA B P, et al. Does endogenous fatty acid metabolism allow cancer cells to sense hypoxia and mediate hypoxic vasodilatation? Characterization of a novel molecular connection between fatty acid synthase (FAS) and hypoxia-inducible factor-1alpha (HIF-1alpha)-related expression of vascular endothelial growth factor (VEGF) in cancer cells overexpressing her-2/neu oncogene[J]. Journal of Cellular Biochemistry, 2005, 94(5): 857-863.DOI:10.1002/jcb.20367.
[26] VIZIO D D, ADAM R M, KIM J, et al. Caveolin-1 interacts with a lipid raft-associated population of fatty acid synthase[J]. Cell Cycle,2008, 7(14): 2257-2267. DOI:10.4161/cc.7.14.6475.
[27] CLARKE S D, AMSTRONG M K, JUMP D B. Dietary polyunsaturated fats uniquely suppress rat liver fatty acid synthane and S14 mRNA content[J]. Journal of Nutrition, 1990, 120: 225-231.DOI:10.1093/jn/120.2.225.
[28] DUMLER I, KOPMANN A, WAGNER K, et al. Urokinase induces activation and formation of Stat4 and Stat1-Stat2 complexes in human vascular smooth muscle cells[J]. Journal of Biological Chemistry,1999, 274(34): 24059-24065. DOI:10.1074/jbc.274.34.24059.
Transcriptomic and Bioinformatic Analyses of Human Umbilical Vein Endothelial Cells Induced by Elaidic Acid
QIU Bin, SUN Wenjia, LIU Wei, XU Tongcheng, LIU Lina, ZONG Aizhen, JIA Min, DU Fangling*
(Shandong Provincial Key Laboratory of Agro-Products Processing Technology,Key Laboratory of Novel Food Resources Processing, Ministry of Agriculture, Institute of Agro-Food Science and Technology,Shandong Academy of Agricultural Sciences, Jinan 250100, China)
Abstract:After being induced by elaidic acid, the differentially expressed genes in human umbilical vein endothelial cells were studied by transcriptional analysis and bioinformatics analysis at the transcriptional level. The results showed that a total of 95 genes were found to significantly changed, 31 of which were up-regulated while 64 were down-regulated. The bioinformatics analysis showed that a total of 772 genes were significantly differentially expressed during the biological evolution. There were 46 and 122 differentially expressed genes related to cell composition and molecular functions,respectively. A total of 93 signaling pathways were detected, of which 11 including terpenoid skeleton biosynthetic pathway,steroid biosynthetic pathway and fatty acid metabolic pathway were significantly changed. Based on the protein-protein interaction (PPI) and gene-gene interaction pathways, the target genes involved in different pathways including fatty acid synthase, STAT4 transcription factor and IL-23 cytokine were further analyzed.
Keywords:trans fatty acid; elaidic acid; transcriptomics; signaling pathway; bioinformatics
QIU Bin, SUN Wenjia, LIU Wei, et al. Transcriptomic and bioinformatic analyses of human umbilical vein endothelial cells induced by elaidic acid[J]. Food Science, 2018, 39(22): 147-152. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201822023. http://www.spkx.net.cn
引文格式:邱斌, 孙文佳, 刘玮, 等. 反油酸诱导人脐静脉内皮细胞转录组学及生物信息学分析[J]. 食品科学, 2018, 39(22):147-152. DOI:10.7506/spkx1002-6630-201822023. http://www.spkx.net.cn
文章编号:1002-6630(2018)22-0147-06
文献标志码:A
中图分类号:Q256
DOI:10.7506/spkx1002-6630-201822023
*通信作者简介:杜方岭(1972—),男,研究员,硕士研究生,主要从事食品营养及特殊医学用途配方食品研究。E-mail:duf l@saas.ac.cn
第一作者简介:邱斌(1982—),男,副研究员,博士,主要从事食品营养研究。E-mail:qiubin2009@live.cn
基金项目:国家自然科学基金青年科学基金项目(31401487)
收稿日期:2017-09-08