表1 正交试验因素与水平
Table 1 Code and level of independent variables used for orthogonal array design
蔡孟轩1,邓丽莉1,2,姚世响1,2,曾凯芳1,2,*
(1.西南大学食品科学学院,重庆 400715;2.西南大学食品贮藏与物流研究中心,重庆 400715)
摘 要:选用真空冷冻干燥技术,糖醇类试剂包括海藻糖、蔗糖、乳糖、山梨糖醇,抗氧化类试剂谷氨酸钠,以及赋形剂包括脱脂奶粉和β-环糊精三大类试剂作为保护剂,通过保护剂的单因素筛选试验、正交试验得到真空冷冻干燥橄榄假丝酵母的最优保护剂配方为海藻糖添加量15%、谷氨酸钠添加量2%和脱脂奶粉添加量10%,所得酵母存活率为69.7%。此外,通过比较冻干橄榄假丝酵母和新鲜橄榄假丝酵母对苹果果实青霉病的发病率和病斑直径的研究,并测定冻干橄榄假丝酵母和新鲜橄榄假丝酵母接种处理后酵母在苹果果实伤口处的生长动态,以期制备性能良好的生物防治试剂。
关键词:橄榄假丝酵母;保护剂;真空冷冻干燥;生物防治
在果蔬采后生理病害的防治中,利用拮抗微生物对采后果蔬病害进行控制成为近年来的研究热点[1]。研究发现,在果蔬采后病害控制中具有较好效果的酵母大约有20多种,其主要为假丝酵母属(Candida)、隐球酵母属(Cryptococcus)、梅奇酵母属(Metschnikowia)、毕赤酵母属(Pichia)、粘红酵母属(Rhodotorula)和丝孢酵母属(Trichosporon)等[2-5]。假丝酵母属在果蔬采后病害控制中应用较多,诸多研究发现其在果蔬采后的病害控制中具有较好效果。Arars[6]通过电镜观察发现,拮抗菌无名假丝酵母(Candida famata)可以在病菌菌丝上定植,并促使菌丝裂解;研究发现,橄榄假丝酵母(Candida oleophila)能有效抑制苹果果实上灰霉病病斑直径的扩展[7],且当用C. oleophila作用于番木瓜时能降低其自然发病率[8]。但由于液态酵母菌液在运输和储存中存在一定的困难,因此将其转化为固态菌剂并提高其商品化价值尤为重要。
真空冷冻干燥技术是将物料预先冻结到共晶点温度以下,在一定的真空状态下,通过升华除去物料中水分的一种干燥方法[9-10]。与其他干燥方式相比,具有脱水彻底、质量轻、利于长期运输和贮藏的优点[11-12]。在真空冷冻干燥过程中,添加保护剂系统对微生物在冻干过程中的细胞存活率有着较好作用,同时也对贮藏期间细胞稳定性有着一定影响。糖类和蛋白质是应用最广泛的两类保护剂[13],研究表明,海藻糖、脱脂奶粉、蔗糖、乳糖适用于多种酵母。海藻糖可作为微生物碳源,能够有效提高冻干微生物的存活率,同时它在稳定细胞膜结构和蛋白质结构方面起着重要作用[14],Yang Chanyuan等[15]对长双歧杆菌(Bifidobacterium longum)研究,发现单个保护剂作用时,海藻糖添加量10%保护效果最好,其存活率可达53.22%左右。脱脂奶粉则能为干粉提供较轻的疏松多孔结构,使之容易复水,因此可用作一种赋形剂[16]。谷氨酸钠是一种常用且有效的保护剂,大量研究表明,谷氨酸钠分子中的—NH2、α-COOH和γ-COOH在冻干过程中发挥保护作用,还可与水作用使干粉保留适量的水分,满足微生物维持生命的最低需求。此外,谷氨酸钠还具有抗氧化作用,可抑制三酰甘油的氧化和自由基的形成,防止其对细胞膜造成不可逆转的破坏。低分子保护剂在冻干过程中的作用方式是与菌体细胞膜磷脂中的磷酸基团或与菌体蛋白质极性基团形成氢键,从而保护了细胞膜和蛋白质结构与功能的完整性,而高分子保护剂则是通过“包埋”形式达到保护菌体的效果[17-18]。本实验通过以C. oleophila为研究对象,采用真空冷冻干燥技术,首先选择谷氨酸钠作为抗氧化剂,从糖类和赋形剂中分别筛选出2 种保护剂,再通过正交试验优化这3 种保护剂,得到真空冷冻干燥C. oleophila的最优保护剂配方,通过苹果果实发病率和病斑直径及果实伤口生长动态实验,比较新鲜C. oleophila和冻干C. oleophila对苹果果实青霉病的控制效果。
“红富士”苹果产自甘肃静宁,取大小均一、无机械损伤、成熟度基本一致的果实作为实验材料。经2%次氯酸钠溶液浸泡2 min后,自来水冲洗,晾干备用[19]。
C. oleophila分离自重庆北碚歇马镇冯家槽柑橘树(锦橙447)叶片表面(C. oleophila JX188107.1,同源性99%,分离号FL14)。该菌株于NYDA培养基(酵母膏5 g,牛肉膏8 g,葡萄糖10 g,琼脂20 g,水1 000 mL)4 ℃保藏,每2 个月活化1 次。
SW-CJ-1F超净工作台 苏净集团安泰有限公司;B203生物显微镜 重庆奥特光学仪器有限公司;BS-4G振荡培养箱 金坛市富华仪器有限公司;DHP-9082电热恒温培养箱 上海齐欣科学仪器有限公司;PSX-280手提式高压杀菌锅 上海申安医疗器械厂;XB.K.25型血球计数板 上海求精生化试剂有限公司;GL-20G-II高速冷冻离心机 上海安亭科学仪器厂;SL602N高精度电子天平 上海民桥精密科学仪器有限公司;LGJ-10真空冷冻干燥机 北京松源华兴有限公司。
1.3.1 酵母悬浮液的制备
活化菌种:在NYDA培养基上28 ℃扩大培养C. oleophila 48 h;液体培养:挑取一环NYDA培养基上的C. oleophila于NYDB培养基中,在180 r/min、28 ℃摇床中培养24 h;离心浓缩:4 000 r/min、4 ℃离心10 min,用无菌水洗涤2 次;血球计数板计数后用无菌水稀释到1×109、1×108、1×107CFU/mL备用。
1.3.2 扩展青霉菌孢子悬浮液的制备
Penicillium expansum接种于PDA培养基上,25 ℃培养7 d后,用接种环刮取适量扩展青霉孢子,4 层纱布过滤,血球计数板计数,并用无菌水调整浓度至1×105spores/mL的孢子悬浮液,待用。
1.3.3 保护剂悬浮液的制备
所有保护剂按比例溶解到无菌水中以制备保护剂悬浮液,使得最后与酵母悬浮液混合后浓度如实验方案所示。
1.3.4 保护剂的单因素试验
固定酵母的初始浓度1×109CFU/mL、冷冻温度-50 ℃。以无菌水为对照组,单因素试验分别设置海藻糖添加量1%、5%、10%、15%、20%、25%;乳糖添加量1%、5%、10%、15%、20%、25%;蔗糖添加量1%、5%、10%、15%、20%、25%;山梨糖醇添加量1%、5%、10%、15%、20%、25%;谷氨酸钠添加量1%、2%、4%、6%、8%、10%;脱脂奶粉添加量1%、5%、10%、15%、20%、25%;β-环糊精添加量1%、5%、10%、15%、20%、25%,考察各因素对存活率的影响。
1.3.5 保护剂的正交试验
根据保护剂的单因素筛选试验结果,选择海藻糖、谷氨酸钠、脱脂奶粉添加量进行3因素3水平的正交试验。具体试验方案见表1。
表1 正交试验因素与水平
Table 1 Code and level of independent variables used for orthogonal array design

1.3.6 样品的制备及真空冷冻干燥
保护剂悬浮液与酵母悬浮液等体积混合得到样品。参考Siaterlis等[20]的方法并修改。样品在旋涡混合仪中均匀混合1 min,之后在室温下孵化60 min,在此过程中不断摇动以确保酵母与保护剂混合均匀。
为避免其他因素对冻干C. oleophila存活率的影响,固定酵母的初始浓度1×109CFU/mL、冷冻温度-50 ℃。分装2 mL的样品在称量瓶(40 mm×25 mm)中,-20 ℃冷冻12 h,之后在冷却温度为-50 ℃、真空度为1~10 Pa条件下冻干12 h。实验重复3 次。
1.3.7 C. oleophila酵母存活率的测定
参考Zhao Guoqun等[21]的方法并修改。酵母存活率由冻干前酵母的菌落总数(N0)以及冻干后酵母总数(Nf)所决定,并用每毫升酵母的菌落总数(CFU/mL)表示。冻干前,将稀释到合适浓度的酵母悬浮液涂布在NYDA平板上。冻干后,每个冻干样品用2 mL的无菌水溶解,用旋涡混合仪均匀混合1 min,再在室温下孵化60 min,稀释到合适的浓度,涂布在NYDA平板上。上述平板均于28 ℃培养48 h。实验重复3 次,用公式(1)计算存活率:
1.3.8 荧光染色测定C. oleophila存活率
将样品适当稀释并根据说明进行染色。通过荧光显微镜观察染色样品,捕捉明视野和荧光视野下的图像,对比明视野和荧光视野下的细胞,存活率计算见公式(2):
1.3.9 冻干C. oleophila对苹果果实采后青霉病的控制
将果实随机分成4 组。用无菌打孔器在果实赤道部位等距离打孔(直径3 mm,深度3 mm),每个苹果打3 个伤口,每个处理组果实伤口处分别加入20 μL无菌水(阳性对照)、保护剂、冻干酵母(1×108CFU/mL)、液体酵母(1×108CFU/mL)。同孔接种:4 h后,在果实伤口处接入20 μL的1×105spores/mL P. expansum孢子悬浮液。待菌液吸收后,单果包装,置于25 ℃、相对湿度90%~95%条件下贮藏,定期统计果实发病率和病斑直径。每个处理重复3 次,每个重复5 个果实。
1.3.10 冻干C. oleophila接种处理后酵母在苹果果实伤口处的生长动态测定
用无菌打孔器在果实赤道部位等距离处打伤口(直径3 mm,深度3 mm),每个果实打3 个伤口,每个伤口处分别接入20 μL冻干酵母(1×107CFU/mL)和液体酵母(1×107CFU/mL)。待菌液吸收后,单果包装,贮藏在25 ℃、相对湿度90%~95%条件下,以接种后1 h测定的酵母菌数为起始值,每1 d取一次样,用稀释平板法测定酵母数目。取样时,用消毒的打孔器取伤口处直径为10 mm的果肉组织10 份,放入含10 mL无菌水的消毒研钵内研磨至匀浆,稀释到合适的浓度,涂布在NYDA平板上。上述平板均在28 ℃条件下培养48 h。结果以每伤口处酵母数量(lg(cells/wound))表示。实验重复3 次[22]。
Excel 2016统计分析所有数据,计算标准误差并制图;应用SPSS 22软件进行方差分析(ANOVA),利用邓肯氏多重比较对差异显著性进行分析(P<0.05)。
2.1.1 保护剂单因素筛选试验结果
从图1A可看出,最有效的保护剂为海藻糖;使用海藻糖作为保护剂时,随着添加量的增加,酵母冻干粉的存活率先升高后下降,15%海藻糖添加量保护效果较好;由图1B可知,随着谷氨酸钠添加量的增加,酵母冻干粉的存活率先升高后下降,6%谷氨酸钠添加量酵母存活率最高。从图1C可看出,最有效的赋形剂为脱脂奶粉;使用脱脂奶粉作为赋形剂时,随着添加量的增加,酵母冻干粉的存活率先升高后下降,10%脱脂奶粉添加量保护效果最好。根据3 类保护剂的保护效果,选择海藻糖、谷氨酸钠、脱脂奶粉3 种保护剂进行复配。


图1 糖类和山梨糖醇(A)、谷氨酸钠(B)和赋形剂(C)对真空冷冻干燥C. oleophila存活率的影响
Fig. 1 Effects of saccharides and sorbitol (A), monosodium glutamate (B),and excipient (C) on the viability of freeze-dried C. oleophila
2.1.2 保护剂的正交试验结果
表2为C. oleophila真空冷冻干燥保护剂正交试验L9(34)设计及结果,表3为该试验的方差分析。由表2可知,正交试验所得较优配方条件为A2B2C3,但存活率(64.7%)结果不如组合A2B1C2高(69.7%),综合考虑可得最优保护剂配方为A2B1C2,即海藻糖添加量15%、谷氨酸钠添加量2%和脱脂奶粉添加量10%复配,应用该配方冻干C. oleophila的存活率可达69.7%。从表3可看出,海藻糖、谷氨酸钠、脱脂奶粉添加量的F值分别为1 680.486(P<0.01)、21.963(P<0.05)和151.069(P<0.01),说明海藻糖和脱脂奶粉这两种保护剂对冻干C. oleophila存活率的影响极显著,谷氨酸钠保护剂对冻干C. oleophila存活率的影响显著。
表2 L9(34)正交试验设计及结果
Table 2 L9(34) orthogonal array design with experimental results
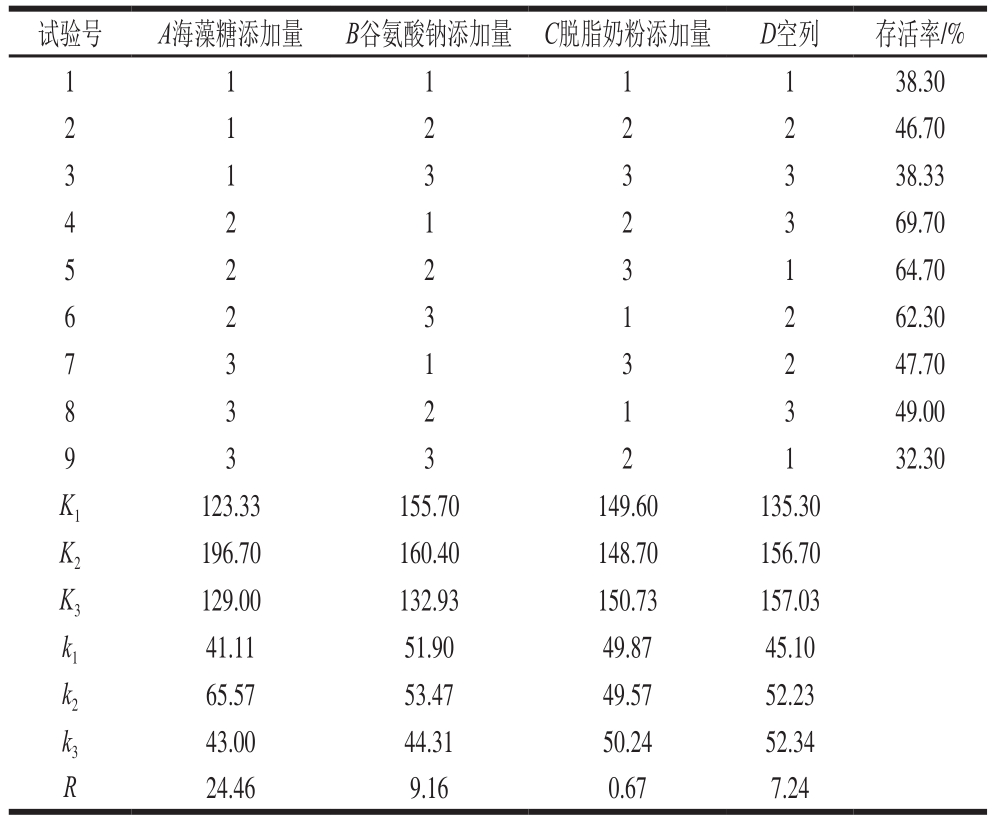
表3 正交试验结果方差分析
Table 3 Analysis of variance of the experimental results from orthogonal array design
注:*.差异显著,P<0.05;**.差异极显著,P<0.01。
当酵母在未添加任何保护剂情况下进行真空干燥时,约93%的酵母细胞显示细胞膜受损(图2A);当添加优化保护剂配方对酵母进行真空干燥后,结果显示约38%的酵母细胞死亡(图2B),与稀释涂布法测定的存活率结果相符。

图2 荧光染色测定C. oleophila存活率
Fig. 2 Determination of survival rate of yeast by fl uorescence staining
A.未添加保护剂;B.添加保护剂;下标1.明视野;2.荧光暗视野。

图3 冻干C. oleophila对苹果果实采后青霉病的控制效果
Fig. 3 Effect of reeze-dried C. oleophila yeast on disease incidence and lesion diameter of apple fruit
相同贮藏时间不同小写字母表示差异显著,P<0.05。
由图3可知,接种冻干酵母和新鲜酵母处理的果实发病率和病斑直径显著低于对照果实(P<0.05),对照果实在贮藏第3天发病率达到100%;在5 d的贮藏期内,新鲜酵母和冻干酵母在控制果实发病率和病斑直径没有显著性差异(P>0.05)。在4 d和5 d的贮藏期内,冻干酵母处理的果实发病率和病斑直径显著低于对照组(P<0.05)。
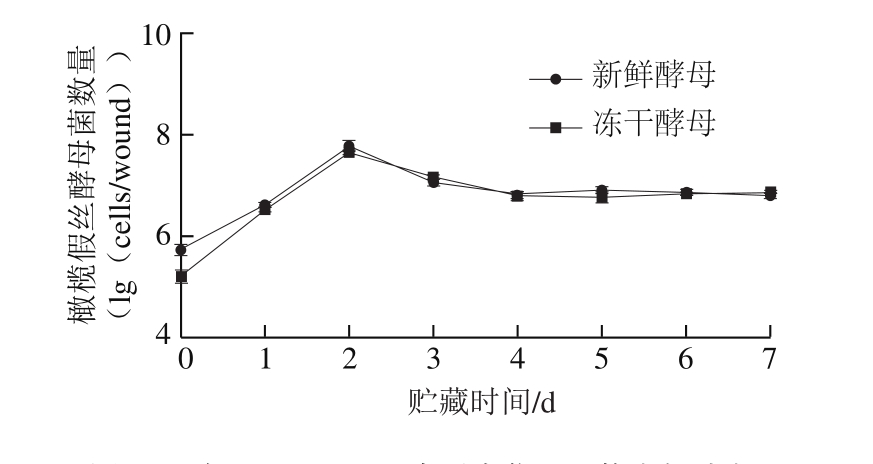
图4 冻干C. oleophila在果实伤口处的生长动态
Fig. 4 Population dynamics of freezing-dried C. oleophila inoculated in apple fruit wounds
如图4所示,冻干酵母和新鲜酵母都能在果实伤口处迅速定植、扩增;在整个贮藏时间内,冻干酵母和新鲜酵母在果实伤口处保持相同的数量级。在第2天时,冻干C. oleophila和新鲜C. oleophila在苹果伤口处的活菌数达到最高值。从第3天起,冻干C. oleophila和新鲜C. oleophila的活菌数虽略有下降,但基本保持稳定。
大量实验研究表明,糖醇类试剂是冻干微生物常用于保护剂的有效试剂,但其在不同的菌种中存在差异[21,23]。本实验研究发现,在所用的几种糖醇类试剂中,海藻糖效果最好,使用海藻糖作为保护剂时,随着添加量的增加,冻干酵母粉的存活率先升高后下降。同时发现,山梨糖醇的效果不及糖类,此结果与Abadias等[24]研究相似。在抗氧化保护剂效果实验中发现,使用谷氨酸钠作为保护剂时,随着添加量的增加,冻干酵母粉的存活率先升高后下降,在冻干C. oleophila中可发挥较好的保护效果[25]。在赋形剂的选择中,最有效的保护剂为脱脂奶粉,这可能是由于在冻干过程中,当脱脂奶粉作为保护剂时可固定冻干酶类,在菌体细胞外能形成蛋白膜从而对冻干酵母进行保护[26],同时能使冻干C. oleophila的表面形成疏松多孔的结构,这些结果与Zayed等[27]研究结果相似。根据3 类保护剂的保护效果,本实验选择海藻糖、谷氨酸钠、脱脂奶粉3 种保护剂进行复配,并得出最优复配方案为海藻糖添加量15%、谷氨酸钠添加量2%和脱脂奶粉添加量10%,应用该配方冻干C. oleophila的存活率可达69.7%。
冻干C. oleophila对苹果果实青霉病控病效果研究表明,冻干酵母和新鲜酵母处理组果实发病率和病斑直径显著低于对照果实(P<0.05),但二者并无显著差异(P>0.05),表明将酵母冻干后其活力和生物防治效果与新鲜酵母相比没有显著下降,该结果与Melin等[28]的研究结果相似。营养和空间的竞争抑制病原菌的生长是酵母控制果蔬采后病害的机制之一[29-30],本实验表明冻干酵母和新鲜酵母都能在果实伤口处迅速定植、扩增;在整个贮藏时间内,冻干酵母和新鲜酵母在果实伤口处保持相同的数量级,这说明冻干酵母在果实伤口处能较快恢复代谢,从而抑制苹果采后青霉病的发生。
参考文献:
[1] JANISIEWICZ W J, KORSTEN L. Biological control of postharvest diseases of fruits[J]. Annual Review of Phytopathology, 2002, 40(1):411-441. DOI:10.1016/S1874-5334(02)80012-0.
[2] BANANI H, SPADARO D, ZHANG D, et al. Postharvest application of a novel chitinase cloned from Metschnikowia fructicola and overexpressed in Pichia pastoris to control brown rot of peaches[J].International Journal of Food Microbiol, 2015, 199: 54-61.DOI:10.1016/j.ijfoodmicro.2015.01.002.
[3] CHEN X, ZHANG Y, FU X, et al. Isolation and characterization of Bacillus amyloliquefaciens PG12 for the biological control of apple ring rot[J]. Postharvest Biology & Technology, 2016, 115: 113-121.DOI:10.1016/j.postharvbio.2015.12.021.
[4] QUAGLIA M, EDERLI L, PASQUALINI S, et al. Biological control agents and chemical inducers of resistance for postharvest control of Penicillium expansum Link. on apple fruit[J]. Postharvest Biology & Technology, 2011, 59(3): 307-315. DOI:10.1016/j.postharvbio.2010.09.007.
[5] TERAO D, NECHET K D L, PONTE M S, et al. Physical postharvest treatments combined with antagonistic yeast on the control of orange green mold[J]. Scientia Horticulturae, 2017, 224: 317-323.DOI:10.1016/j.scienta.2017.06.038.
[6] ARRAS G. Mode of action of an isolate of Candida famata in biological control of Penicillium digitatum in orange fruits[J].Postharvest Biology & Technology, 1996, 8(3): 191-198.DOI:10.1016/0925-5214(95)00071-2.
[7] LIU J, WISNIEWSKI M, ARTLIP T, et al. The potential role of PR-8 gene of apple fruit in the mode of action of the yeast antagonist,Candida oleophila, in postharvest biocontrol of Botrytis cinerea[J].Postharvest Biology & Technology, 2013, 85(11): 203-209.DOI:10.1016/j.postharvbio.2013.06.007.
[8] GAMAGAE S U, SIVAKUMAR D, RSW W, et al. Use of sodium bicarbonate and Candida oleophila to control anthracnose in papaya during storage[J]. Crop Protection, 2003, 22(5): 775-779.DOI:10.1016/S0261-2194(03)00046-2.
[9] CORREIA R, GRACE M H, ESPOSITO D, et al. Wild blueberry polyphenol-protein food ingredients produced by three drying methods: comparative physico-chemical properties, phytochemical content, and stability during storage[J]. Food Chemistry, 2017, 235:76-85. DOI:10.1016/j.foodchem.2017.05.042.
[10] HUANG X, LI D, WANG L J. Characterization of pectin extracted from sugar beet pulp under different drying conditions[J].Journal of Food Engineering, 2017, 211: 1-6. DOI:10.1016/j.jfoodeng.2017.04.022.
[11] 潘永康, 王喜忠, 刘相东. 现代干燥技术[M]. 北京: 化学工业出版社,2007: 450-451.
[12] 徐艳阳, 张慜, 孙金才. 真空冷冻干燥毛竹笋的实验研究[J].食品工业科技, 2005, 26(2): 99-101. DOI:10.13386/j.issn1002-0306.2005.02.021.
[13] TANIGUCHI H, HONNDA Y. Amylases[J]. Encyclopedia of Microbiology, 2009, 49(8): 159-173. DOI:10.1016/B978-012373944-5.00130-9.
[14] 李博强. 海藻糖提高酵母拮抗菌生活力和生防效力的作用机制[D].北京: 中国科学院研究生院(植物研究所), 2006: 69-70.
[15] YANG C Y, ZHU X L, FAN D D, et al. Optimizing the chemical compositions of protective agents for freeze-drying Bifidobacterium longum BIOMA 5920[J]. 中国化学工程学报(英文版), 2012, 20(5):930-936. DOI:10.1016/S1004-9541(12)60420-0.
[16] HUANG L, LU Z, YUAN Y, et al. Optimization of a protective medium for enhancing the viability of freeze-dried Lactobacillus delbrueckii subsp. bulgaricus based on response surface methodology[J]. Journal of Industrial Microbiology & Biotechnology,2006, 33(1): 55-61. DOI:10.1007/s10295-005-0041-8.
[17] 吕兵, 张国农, 林金资. 酸奶发酵剂速效干剂制备中保护剂的研究[J].中国乳品工业, 1996(2): 3-5.
[18] 陈声明, 吕琴. 微生物冷冻干燥的抗性机理[J]. 微生物学通报,1996(4): 236-238.
[19] 邵兴锋, 屠康, 静玮, 等. 热处理对红富士苹果贮藏期间青霉病的抑制效果[J]. 园艺学报, 2007(3): 743-746. DOI:10.16420/j.issn.0513-353x.2007.03.037.
[20] SIATERLIS A, DEEPIKA G, CHARALAMPOPOULOS D.Effect of culture medium and cryoprotectants on the growth and survival of probiotic lactobacilli during freeze drying[J]. Letters in Applied Microbiology, 2009, 48(3): 295-301. DOI:10.1111/j.1472-765X.2008.02529.x.
[21] ZHAO G Q, ZHANG G. Inf l uences of protectants, rehydration media and storage on the viability of freeze-dried Oenococcus oeni for malolactic fermentation[J]. World Journal of Microbiology & Biotechnology, 2009,25(10): 1801-1806. DOI:10.1007/s11274-009-0080-9.
[22] 罗杨. 膜醭毕赤酵母对柑橘采后青绿霉病害的生物防治及机理研究[D]. 重庆: 西南大学, 2011: 27.
[23] STRASSER S, NEUREITER M, GEPPL M, et al. Influence of lyophilization, fluidized bed drying, addition of protectants,and storage on the viability of lactic acid bacteria[J]. Journal of Applied Microbiology, 2009, 107(1): 167-177. DOI:10.1111/j.1365-2672.2009.04192.x.
[24] ABADIAS M, BENABARRE A, TEIXIDÓ N, et al. Effect of freeze drying and protectants on viability of the biocontrol yeast Candida sake[J].International Journal of Food Microbiology, 2001, 65(3): 173-182.
[25] POŁOMSKA X, WOJTATOWICZ M, ZAROWSKA B, et al. Freezedrying preservation of yeast adjunct cultures for cheese production[J].Polish Journal of Food & Nutrition Sciences, 2012, 62(3): 143-150.DOI:10.2478/v10222-011-0045-1.
[26] 徐致远, 刘荣, 郭本恒, 等. 保护剂在乳酸菌冻干过程中的应用[J].乳业科学与技术, 2006, 29(4): 155-157.
[27] ZAYED G, ROOS Y H. Inf l uence of trehalose and moisture content on survival of Lactobacillus salivarius subjected to freeze-drying and storage[J]. Process Biochemistry, 2004, 39(9): 1081-1086.DOI:10.1016/S0032-9592(03)00222-X.
[28] MELIN P, HÅKANSSON S, SCHNÜRER J. Optimisation and comparison of liquid and dry formulations of the biocontrol yeast Pichia anomala J121[J]. Applied Microbiology & Biotechnology,2007, 73(5): 1008-1016. DOI:10.1007/s00253-006-0552-x.
[29] SPADARO D, DROBY S. Development of biocontrol products for postharvest diseases of fruit: the importance of elucidating the mechanisms of action of yeast antagonists[J]. Trends in Food Science &Technology, 2015, 47(49): 39-49. DOI:10.1016/j.tifs.2015.11.003.
[30] MEDINA-CÓRDOVA N, LÓPEZ-AGUILAR R, ASCENCIO F, et al.Biocontrol activity of the marine yeast Debaryomyces hansenii against phytopathogenic fungi and its ability to inhibit mycotoxins production in maize grain (Zea mays L.)[J]. Biological Control, 2016, 97: 70-79.DOI:10.1016/j.biocontrol.2016.03.006.
Formulation Optimization of a Cryoprotectant for Freeze-Dried Candida oleophila and Its Application to Control Blue Mold in Apple
CAI Mengxuan1, DENG Lili1,2, YAO Shixiang1,2, ZENG Kaifang1,2,*
(1. College of Food Science, Southwest University, Chongqing 400715, China;2. Food Storage and Logistics Research Center, Southwest University, Chongqing 400715, China)
Abstract:Candida oleophila is an ef fi cient antagonist. Many studies have shown that it can control postharvest diseases in various fruits. However, because of difficulties in its transportation and storage, C. oleophila is difficult to apply commercially. Freeze-drying is widely used to preserve microorganisms. Thus, in the present research, the selection and optimization of cryoprotectant components (sugars and sugar alcohols including trehalose, sucrose, lactose and sorbitol;the antioxidant sodium glutamate; excipients including skim milk and β-cyclodextrin) as well as their levels for vacuum freeze-drying of C. oleophila were optimized using one-factor-at-a-time and orthogonal array design methods. The optimal formulation was composed of 15% trehalose, 2% sodium glutamate, and 10% skim milk powder. A survival rate of 69.7%was obtained using this formulation. The effects of fresh and freeze-dried C. oleophila on the incidence of blue mold and lesion diameter in apple were compared, and the growth dynamics of the yeast inoculated in apple wounds. Through this study, we hope to obtain a good biocontrol agent against blue mold in apple.
Keywords:Candida oleophila; cryoprotectant; freeze-drying; biological control
CAI Mengxuan, DENG Lili, YAO Shixiang, et al. Formulation optimization of a cryoprotectant for freeze-dried Candida oleophila and its application to control blue mold in apple[J]. Food Science, 2018, 39(22): 153-158. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201822024. http://www.spkx.net.cn
引文格式:蔡孟轩, 邓丽莉, 姚世响, 等. 真空冷冻干燥橄榄假丝酵母的制备及其对苹果青霉病的防治[J]. 食品科学, 2018, 39(22):153-158. DOI:10.7506/spkx1002-6630-201822024. http://www.spkx.net.cn
文章编号:1002-6630(2018)22-0153-06
文献标志码:A
中图分类号:TS255.3
DOI:10.7506/spkx1002-6630-201822024
*通信作者简介:曾凯芳(1972—),女,教授,博士,研究方向为农产品贮藏工程。E-mail:zengkaifang@163.com
第一作者简介:蔡孟轩(1994—),男,硕士研究生,研究方向为食品生物技术。E-mail:caimx007@outlook.com
基金项目:“十二五”国家科技支撑计划项目(2015BAD16B07);中央高校基本科研业务费专项(XDJK2017D135)
收稿日期:2018-04-04