陈 萍,刘 璐,李晓东*,曲秀伟,王海霞,张秀秀
(东北农业大学食品学院,乳品科学教育部重点实验室,黑龙江 哈尔滨 150030)
摘 要:为确定益生菌对契达干酪抗氧化性变化的影响,在菌株具备良好耐酸、耐盐性,适用于干酪生产前提下,以水解性和抗氧化性为指标,分别筛选出水解能力和抗氧化能力较强的菌株,并将其添加到契达干酪中,不添加益生菌的干酪为空白组,对干酪成熟过程中活菌数和抗氧化性进行分析。结果表明,9 株益生菌中,瑞士乳杆菌(Lactobacillus helveticus)1.0612和鼠李糖乳杆菌(Lactobacillus rhamnosus)1.0911分别具有较强的水解能力和抗氧化能力。在成熟过程中,添加L. helveticus 1.0612和L. rhamnosus 1.0911的两组干酪活菌数无显著差异,但均显著高于空白组。3 组干酪抗氧化能力均先升高再降低、最后趋于平缓,1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基和羟自由基清除能力均在第4个月达到最大,还原能力在第5个月达到最大,且添加水解能力强的L. helveticus 1.0612干酪各项抗氧化能力的最大值(DPPH自由基、羟自由基清除能力和还原能力分别为51.05%、49.97%、0.66)均显著高于添加L. rhamnosus 1.0911的干酪(47.30%、46.19%、0.56)(P<0.05)。因此,在契达干酪中添加水解能力较强的菌株,相比于添加本身具有良好抗氧化活性的菌株,可能会加剧干酪的蛋白水解,生成具有抗氧化能力的短肽和氨基酸,从而提高干酪的抗氧化活性。
关键词:益生菌;契达干酪;水解能力;抗氧化活性;成熟期
近年来,高血压、糖尿病、癌症等疾病的发病率逐年升高,其原因是摄入较多的脂肪及体内存在过多的自由基[1]。过多的自由基会导致膜脂质、酶、蛋白质和DNA的氧化损伤[2]。食源性天然抗氧化物质与人工合成抗氧化物质相比,具有安全、易消化、营养功能等特点。
契达干酪是世界上消费最多的一种干酪,在干酪成熟过程中伴随着一系列复杂的生化反应,产生了多种生物活性物质,使其具有较高的营养价值[3]。乳源性抗氧化物质具有阻止自由基生成、清除已形成自由基和活性氧的功能,从而防止这些物质对机体大分子的损伤[4]。牛乳发酵可以进一步促进酪蛋白中抗氧化物质的释放,发酵产生的酪蛋白衍生物可清除自由基和提高人类淋巴细胞过氧化氢酶活性和谷胱甘肽水平,这使干酪的抗氧化活性远高于液态乳[5]。益生菌作为一种微生物,除了能将周围某些特定物质分解成可利用的小分子物质,自身还有很多益生功能[6]。Zhang Yong等[7]研究了40株益生菌,证明这些菌株都有一定的抗氧化能力,能够有效清除氧自由基。Abadía-García等[8]将干酪乳杆菌加入到农家干酪中,发现益生菌能提高农家干酪的抗氧化性。
目前,关于干酪抗氧化物质产生的原因众说纷纭。Meira等[9]提取鉴定了巴西牛乳干酪中的生物活性物质,证实其来源于αs1-酪蛋白。Timón等[10]研究了不同凝乳酶对Burgo干酪提取物自由基清除能力的影响,结果表明植物源凝乳酶干酪具有最高的抗氧化能力。马玲等[11]认为干酪的抗氧化性与发酵菌种有关,其结果表明干酪提取液的抗氧化效果随菌种、成熟时间的不同而不同。Abadía-García等[8]又猜测益生菌干酪中的生物活性物质与干酪中的活菌数有关。
因此,本实验在保证菌株的耐酸、耐盐性良好,适用于干酪生产的前提下,以水解性和抗氧化活性为指标,筛选出水解能力较强和抗氧化能力较强的益生菌,将其分别添加到契达干酪中,比较分析干酪在成熟过程中活菌数和抗氧化活性的变化,探究益生菌自身的抗氧化能力和水解能力对干酪抗氧化性的影响。
瑞士乳杆菌(Lactobacillus helveticus)1.0612、鼠李糖乳杆菌(Lactobacillus rhamnosus)1.0911、L. rhamnosus 1.0385、植物乳杆菌(Lactobacillus plantarum)1.0320、L. rhamnosus 1.0205、嗜酸乳杆菌(Lactobacillus acidophilus)1.0357、L. helveticus 1.0618、嗜酸乳杆菌(Lactobacillus casei)1.0407、双歧杆菌(Bifidobacterium bifidum)07-300B 9 株菌是从乳中或健康的成人肠道中分离得到,经16S rDNA技术和序列分析比对鉴定,属于联合国粮农组织/世界卫生组织联合专家委员会规定的益生菌的菌种,并对分离后的9 株菌进行活性测定,证实其具有益生功能,现保存于东北农业大学乳品重点实验室菌种库。
商业发酵菌种Lactococcus lactis subsp. cremoris和Lactococcus lactis subsp. lactis混合菌种、凝乳酶Stamix 1150 北京科汉森公司;生牛乳 哈尔滨市香坊农场完达山奶源基地;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH) 上海华蓝化学科技有限公司;铁氰化钾、硫酸亚铁 天津博迪化工股份有限公司;三氯化铁 天津市巴斯夫化工有限公司;1,10-邻二氮菲 天津市科密欧化学试剂有限公司;双氧水 天津市天力化学试剂有限公司。
JD500-2电子天平 沈阳龙腾电子称量仪器有限公司;VD-1320超净工作台 哈尔滨东联电子技术公司;SYQDSX-280B手提式蒸汽灭菌锅 上海申安医疗器械厂;ULTRA-TURRAX T8均质机 德国IKA公司;数显恒温水浴箱 上海比朗仪器有限公司;3k15离心机 德国Sigma公司;UT-1800紫外-可见分光光度计 北京普析通用仪器有限公司。
1.3.1 菌株的活化与保存
MRS培养基于121 ℃灭菌15 min,接种实验菌株后37 ℃培养24 h,传代至活菌数为1.0×109CFU/mL,将菌液与50%灭菌甘油1∶1混合,-20 ℃冻存备用。再将益生菌按体积分数2%接种到60 mL质量分数12%脱脂乳和MRS培养基中,培养至活菌数为1.0×109CFU/mL。
1.3.2 益生菌初筛
1.3.2.1 益生菌耐酸能力测定
20 mL活化后的菌悬液于4 ℃、6 000 r/min离心10 min,沉淀用pH 7.0磷酸盐缓冲液洗涤,调整菌体浓度为1.0×109CFU/mL,加入20 mL灭菌的pH 3.0盐酸,37 ℃水浴4 h,每隔1 h取样做活菌计数。
1.3.2.2 耐盐能力测定
向MRS培养基中添加NaCl,质量浓度分别为0、2、4、6、8 g/100 mL,121 ℃灭菌30 min后,按2%接种益生菌,37 ℃培养24 h后测定620 nm波长处的吸光度(A),并按式(1)计算其存活率:
1.3.2.3 蛋白水解能力测定
采用邻苯二甲醛法对蛋白水解能力进行测定[12],以L-亮氨酸计(mmol/L)。
1.3.2.4 抗氧化能力测定
益生菌细胞悬浮液制备:菌液在4 ℃、8 000×g离心20 min获得菌体沉淀,用灭菌的磷酸缓冲溶液(pH 7.2)洗涤后,重悬于磷酸盐缓冲液中并调整细胞浓度为1.0×109CFU/mL,为完整细胞悬液[13]。
菌株DPPH自由基清除率测定参照Arasu等[14]方法。测定各组吸光度(A),DPPH与磷酸盐缓冲液(pH 7.2)混合作为空白,按式(2)计算益生菌DPPH自由基清除率:
羟自由基清除率参照Wong等[15]的方法进行测定。用去离子水替代菌悬液,表示为A空白,将H2O2换成同体积的去离子水,以同样条件培养并检测,为A对照,按照式(3)计算益生菌羟自由基清除率:
还原能力测定参照王曦等[16]的方法。
1.3.3 益生菌契达干酪的制作
原料乳→标准化→巴氏杀菌(63 ℃,30 min)→冷却(32℃)→添加发酵剂和益生菌→发酵(32 ℃,60 min)→添加CaCl2和凝乳酶→凝乳(32 ℃,90 min)→切割(1 cm3)→搅拌升温至42 ℃(每3~5 min升高1 ℃)→保温搅拌(30 min)→静置(30 min)→排乳清→凝块堆砌(每15 min反转堆积一次,反转7 次)→破碎与加盐→成型压榨→包装、8 ℃成熟
Batch-1:发酵剂添加量为0.01%(质量分数,下同);Batch-2:发酵剂添加量为0.005%,抗氧化活性较好的益生菌添加量为1.2%;Batch-3:发酵剂添加量为0.005%,水解能力较好的益生菌添加量为1.2%。
1.3.4 契达干酪成分分析
总蛋白质的测定参照GB 5009.5—2010《食品中蛋白质的测定》;脂肪测定参照GB 5413.3—2010《婴幼儿食品和乳品中脂肪的测定》;水分测定参照GB 5009.3—2010《食品中水分的测定》;氯化钠测定参照GB/T 12457—2008《食品中氯化钠的测定》;pH值测定:干酪与去离子水在无菌条件下以1∶2比例均匀混合,用pH计直接测定。
1.3.5 契达干酪活菌数的测定
将10 g干酪溶于90 mL蛋白胨水中,20 000 r/min匀浆1 min,稀释后平板计数。
1.3.6 益生菌契达干酪抗氧化活性分析
根据Gómez-Ruiz等[17]的方法制备干酪水溶性提取物。50 mg冻干样品溶于1 mL去离子水用于DPPH自由基和羟自由基清除能力分析,15 mg样品溶于1 mL去离子水用于还原能力测定。
DPPH自由基清除能力的测定:0.1 mL(50 mg/mL)水溶性提取物与3.9 mL新制备的60 µmol/L DPPH-甲醇溶液混合,室温避光45 min后用在517 nm波长处测吸光度,并用去离子水代替样品作空白[18]。羟自由基清除能力的测定:根据Liu Jun等[19]的方法。还原能力的测定:根据Duh等[20]的方法。
1.3.7 质构分析
参照Liu等[21]的方法进行测定。
1.3.8 感官评价
根据Ahmed等[22]的方法进行感官评价,评分标准见表1。
表1 契达干酪感官评价细则
Table 1 Criteria for sensory evaluation of Cheddar cheese

每个实验重复3 次,结果表示为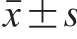 ,数据统计分析采用Statistix 8.1分析软件(P<0.05表示差异显著)。采用Sigmaplot 12.5软件作图。
,数据统计分析采用Statistix 8.1分析软件(P<0.05表示差异显著)。采用Sigmaplot 12.5软件作图。
2.1.1 益生菌耐酸实验结果
酸是益生菌最大的胁迫之一,在干酪制作过程中,益生菌要克服低pH值环境,同时也要保证菌株在胃液中的存活率。耐酸能力的强弱可直接影响益生菌最终的成活率和功效,因此耐酸能力是评价益生菌的关键指标之一。益生菌在酸性环境下的存活率如表2所示,9 株益生菌均有一定的耐酸能力,当作用1 h 后,L. casei 1.0407、L. helveticus 1.0612和L. rhamnosus 1.0911的存活率在50%以上,作用4 h 后,这3 株均的存活率仍在10%以上。
表2 益生菌在pH 3.0的稀盐酸中作用不同时间后的存活率
Table 2 Survival rates of probiotics in HCl (pH 3.0) at different time points

注:小写字母不同表示同列差异显著,大写字母不同表示同行差异显著(P<0.05)。下同。
2.1.2 益生菌耐盐实验结果
契达干酪的含盐度较高,对益生菌的生长存在抑制作用。筛选出耐盐益生菌性好的菌株对其在干酪中的存活率起关键作用。益生菌在不同NaCl质量浓度MRS培养基中的存活率如表3所示,当NaCl质量浓度为2 g/100 mL时,除L. helveticus 1.0618外,其他菌株存活率均在90%以上,且无显著差异。NaCl质量浓度为8 g/100 mL时,B. bifidum 07-300B的存活率最高,L. acidophilus 1.0357、L. casei 1.0407、L. helveticus 1.0612和L. rhamnosus 1.0911这4 株菌的存活率无显著差异(P>0.05),具有良好的耐盐性[23]。
表3 益生菌在不同NaCl质量浓度MRS培养基中的存活率
Table 3 Survival rates of probiotics in MRS at various concentrations of NaCl

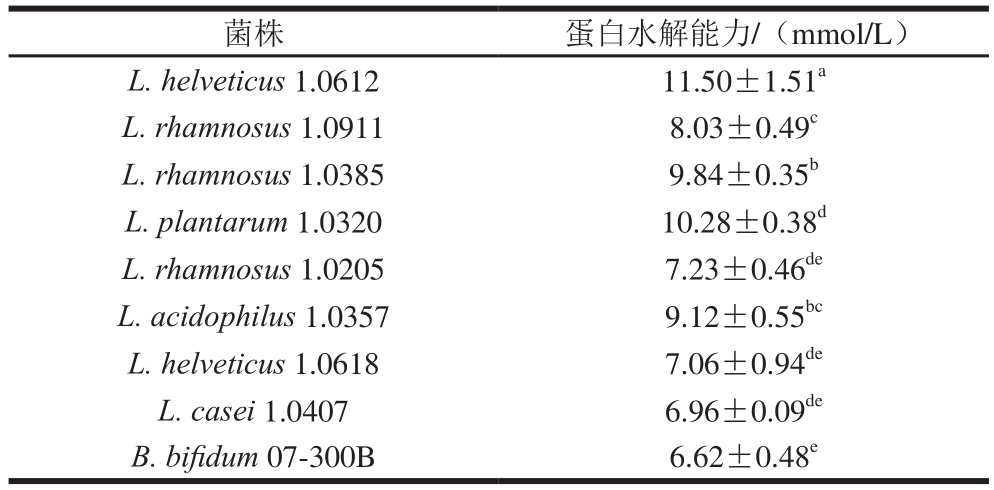
2.1.3 益生菌蛋白水解能力分析
由表4可知,9 株菌中蛋白水解能力最好的4 株菌依次为L. helveticus 1.0612、L. plantarum 1.0320、L. rhamnosus 1.0385和L. acidophilus 1.0357。
表4 益生菌的蛋白水解能力分析
Table 4 Analysis of protein hydrolysis degree by probiotics
2.1.4 益生菌抗氧化能力分析
表5 益生菌的抗氧化能力
Table 5 Antioxidant capacities of probiotics
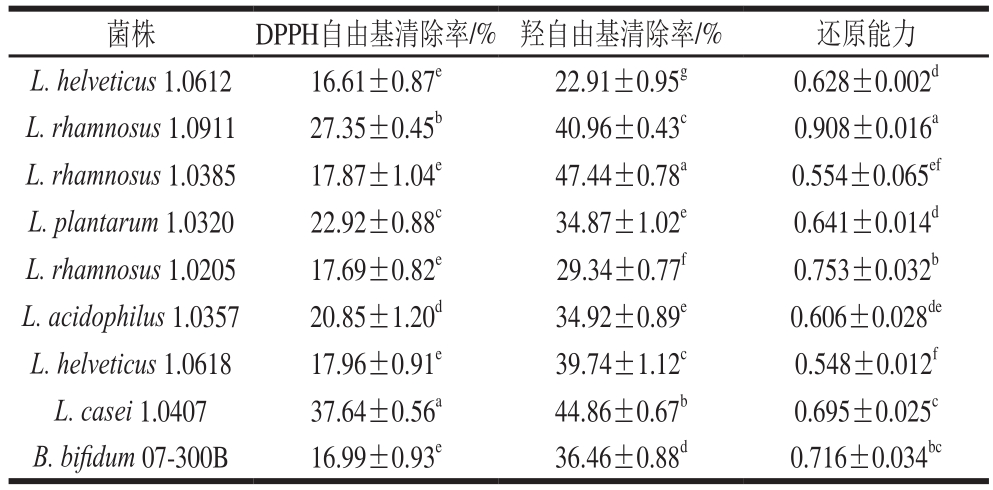
由表5可知,DPPH自由基清除率最高的4 株菌依次为L. casei 1.0407、L. rhamnosus 1.0911、L. plantarum 1.0320和L. acidophilus 1.0357,还原能力最好的4 株菌依次为L. rhamnosus 1.0911、L. rhamnosus 1.0205、B. bifidum 07-300B和L. casei 1.0407。
综上所述,最终确定将水解能力较好的L. helveticus 1.0612和抗氧化性较好的L. rhamnosus 1.0911添加到契达干酪中。
表6 契达干酪成分分析
Table 6 Analysis of chemical composition of Cheddar cheese
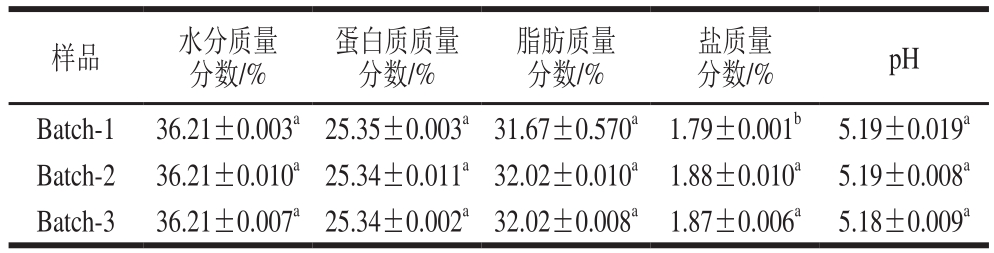
标准契达干酪组成成分为:蛋白质20%~30%,脂肪20%~34%,盐1%~3%,pH 4.7~5.3。由表6可知,3 组干酪的成分含量均在标准范围内,实验组契达干酪盐含量显著高于空白组(P<0.05),可能是由于实验室规模制作干酪存在着参数的不可控性。除盐分外其他成分均无显著性差异,但盐含量也在标准范围内。由此而知添加益生菌对干酪组成成分没有显著影响(P>0.05),可进行下一步研究。
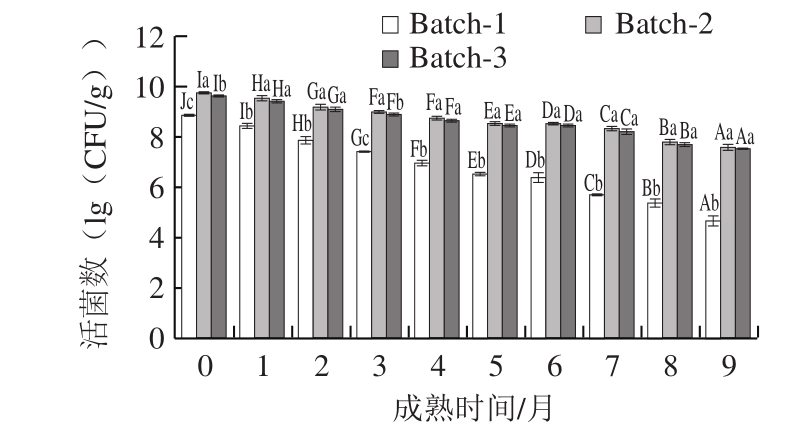
图1 契达干酪成熟过程中的活菌数
Fig. 1 Viable counts of Cheddar cheese during ripening period
小写字母不同表示同一时间不同样品差异显著,大写字母不同表示同一样品不同时间差异显著(P<0.05)。下同。
由图1可知,3 组干酪在成熟过程中活菌数均呈下降趋势,下降率分别为47.40%、22.18%和21.91%,但益生菌干酪的活菌数显著高于空白组(P<0.05),且在成熟末期,两组益生菌干酪活菌数均高于7.0(lg(CFU/g)),达到益生菌食品的菌数要求,具有益生功能[24]。结果表明选实验添加的L. helveticus 1.0612和L. rhamnosus 1.0911在干酪中均有良好的存活率。除第0和第3个月外,两组益生菌干酪间的活菌数均无显著差异,因此,可排除益生菌菌数对干酪抗氧化性的影响。
2.4.1 DPPH自由基清除能力
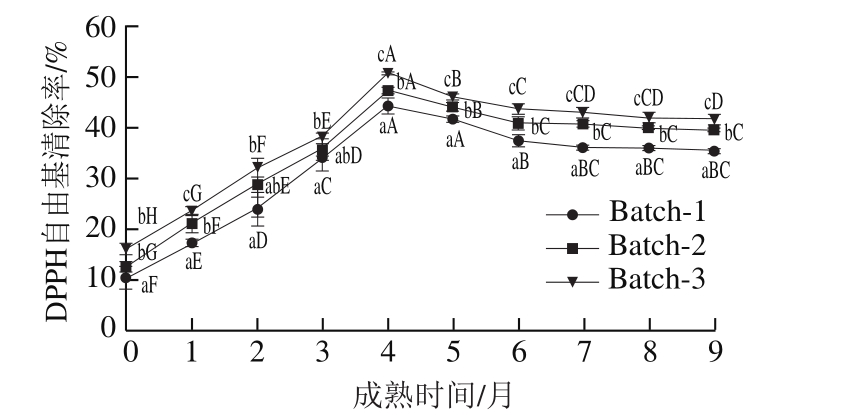
图2 契达干酪成熟过程中水溶性提取物的DPPH自由基的清除能力
Fig. 2 Scavenging capacity against DPPH radical of water soluble extract (WSE) from Cheddar cheese during ripening period
由图2可知,3 组干酪在成熟过程中,DPPH自由基的清除能力均先增大再减小,最后趋于平稳,并在第4个月时达到最大,分别为44.38%、47.30%和51.05%,且三者间存在显著差异(P<0.05)。从成熟的0~4 个月内,3 组干酪DPPH自由基清除率均显著升高,并在第5个月呈显著下降趋势(P<0.05),而在后3 个月中,每组的DPPH自由基清除率变化不显著,但添加L. helveticus 1.0612干酪的DPPH自由基清除率显著高于添加L. rhamnosus 1.0911干酪和空白组(P<0.05)。这是因为L. helveticus 1.0612的水解能力强,增加了酪蛋白的降解,产生了更多具有抗氧化性的肽类或氨基酸[25]。Ong等[26]的实验也表明,乳制品中的生物活性肽含量与种类受乳源种类、生产技术和发酵剂种类等因素的影响,因此,干酪的抗氧化性一定程度上取决于蛋白的水解程度和所用的发酵剂种类。干酪成熟期较长,在这一过程中,蛋白质不断降解,生成具有抗氧化性的短肽,提高了干酪的抗氧化性,而4 个月后,蛋白降解速度减慢,这些抗氧化肽又被分解成不具有抗氧化性的氨基酸,干酪抗氧化性降低。第7个月后,小肽的进一步生成和水解达到消长平衡状态,使干酪的抗氧化性趋于稳定。
2.4.2 羟自由基清除能力

图3 契达干酪成熟过程中水溶性提取物的羟自由基清除率
Fig. 3 Scavenging capacity against hydroxyl radical of WSE from Cheddar cheese during ripening period
如图 3 所示,在前4 个月的成熟过程中,3 组契达干酪的羟自由基清除能力均随时间的延长而显著增加,在第5、6个月内显著下降(P<0.05),在后3 个月内无显著变化。3 组干酪在第4个月时羟自由基清除能力达到最大,分别为43.86%、46.19%和49.97%。在第5~7个月内,添加L. helveticus 1.0612干酪的羟自由基清除率显著高于其他两组(P<0.05),这是因为益生菌加入后,可作为抗氧化剂与羟自由基发生反应,阻止其与蛋白质的结合,增加蛋白质降解生成具有抗氧化性质短肽的几率,从而增加干酪的抗氧化性[27]。
同一干酪水溶提取物对不同自由基清除能力表现不同,是因为自由基结构不同,与抗氧化物质反应方式也不同。但两种方法都表明添加L. helveticus 1.0612和L. rhamnosus 1.0911能增强契达干酪的自由基清除力。因此,添加益生菌可以增加契达干酪的抗氧化性,相比于益生菌自身抗氧化性而言,菌株的水解能力对干酪的抗氧化活性影响较大。
2.4.3 还原能力
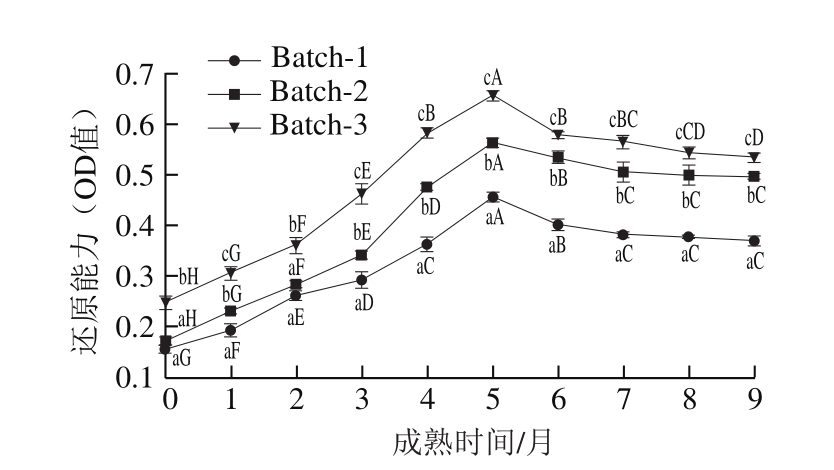
图4 契达干酪成熟过程中水溶性提取物的还原能力
Fig. 4 Reducing power of WSE from Cheddar cheese during ripening period
由图4可知,3 组干酪还原能力在前5 个月均显著增加,在第6、7个月内显著下降(P<0.05),在最后3 个月内无显著变化,并在第5个月时达到最大值。在整个成熟过程中,添加益生菌的契达干酪还原能力显著高于空白组(0.46)(P<0.05),其中Batch-3(0.66)又显著高于Batch-2(0.56)(P<0.05),这是因为干酪随着成熟期的延长,蛋白质逐渐降解生成小分子肽和氨基酸等。Farvin等[28]研究结果表明,大于10 kDa的大分子片段还原能力明显低于抗坏血酸,而小于3 kDa的低分子物质还原能力要高于抗坏血酸,所以分子质量越低,还原能力越强。因此,水解能力好的L. helveticus 1.0612能将酪蛋白降解为分子质量更小的肽和氨基酸,使得契达干酪的还原能力提高。
表7 契达干酪成熟9 个月后的质构分析
Table 7 Texture properties of Cheddar cheese after 9 months of ripening

由表7可知,空白干酪硬度显著高于益生菌干酪(P<0.05),这可能是因为L. helveticus 1.0612和L. rhamnosus 1.0911的加入增加了蛋白的水解程度,使干酪在成熟过程中产生大量水溶性物质,酪蛋白原来的网状结构被破坏,干酪结构变得松散,硬度下降[29]。3 组契达干酪的胶黏性和咀嚼性无显著差异。加入L. rhamnosus 1.0911干酪的弹性与空白组无显著差异,但加入L. helveticus 1.0612干酪的弹性显著高于空白组(P<0.05),这可能是由于菌株特殊的胞内酶作用,使干酪原有的网络结构被破坏[30],分解产生的小物质间形成更多的连接键,形成更多小的网络结构,有利于保持干酪的弹性[31]。
表8 契达干酪成熟9 个月后的感官评分
Table 8 Sensory evaluation of Cheddar cheese after 9 months of ripening
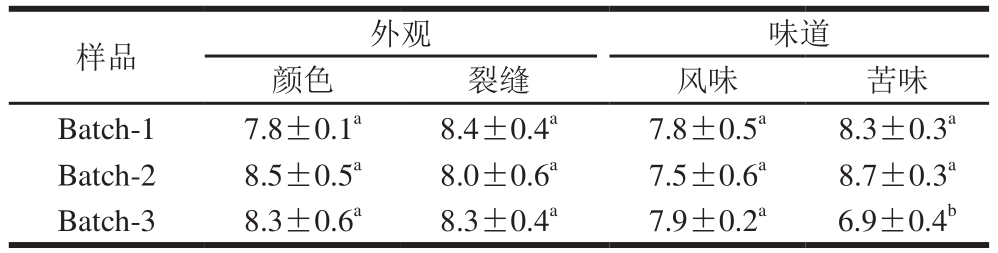
由表8可知,添加L. helveticus 1.0612的干酪苦味评分显著低于其他两组(P<0.05),可能是因为添加L. helveticus 1.0612后增强了酪蛋白的水解程度,产生了具有苦味的氨基酸或短肽,苦味肽的分子质量一般较小,且具有疏水性[32],因此苦味肽一定程度上也具有抗氧化性,所以添加L. helveticus 1.0612能增加契达干酪的抗氧化性,而控制该菌所引起的成熟契达干酪苦味增强这一问题,还有待进一步解决。
契达干酪成熟过程中,3 组干酪抗氧化能力均先升高、再降低、最后趋于平缓,其中DPPH自由基和羟自由基清除能力均在第4个月时达到最大,还原能力在第5个月时达到最大。L. helveticus 1.0612和L. rhamnosus 1.0911的添加可显著提高契达干酪的抗氧化活性(P<0.05),在契达干酪中添加水解能力较强的菌株,相比于添加本身具有良好抗氧化活性的菌株,可能会加剧干酪的蛋白水解,生成具有抗氧化能力的短肽和氨基酸,从而提高干酪的抗氧化活性。通过对益生菌干酪质构、感官的分析得出L. helveticus 1.0612和L. rhamnosus 1.0911的加入对契达干酪的品质无显著影响,但L. helveticus 1.0612的添加在增加干酪抗氧化活性的同时,会加剧酪蛋白水解,增加干酪的苦味感。
参考文献:
[1] ZEREHPOOSH S, DARSANAKI R K. Probiotics and health[J].Current Opinion in Biotechnology, 2013, 2(1): 41-52.
[2] HUANG S, DING S, FAN L. Antioxidant activities of five polysaccharides from Inonotus obliquus[J]. International Journal of Biological Macromolecules, 2012, 50(5): 1183-1187. DOI:10.1016/j.ijbiomac.2012.03.019.
[3] MURTAZA M A, UR-REHMAN S, ANJUM F M, et al. Cheddar cheese ripening and flavor characterization: a review[J]. Critical Reviews in Food Science and Nutrition, 2014, 54(10): 1309-1321.DOI:10.1080/10408398.2011.634531.
[4] SUO H, QIAN Y, FENG X, et al. Free radical scavenging activity and cytoprotective effect of soybean milk fermented with Lactobacillus fermentum Zhao[J]. Journal of Food Biochemistry, 2016, 40(3): 294-303. DOI:10.1111/jfbc.12223.
[5] MOSQUERA M, GIMÉNEZ B, RAMOS S, et al. Antioxidant, ACE-inhibitory, and antimicrobial activities of peptide fractions obtained from dried giant squid tunics[J]. Journal of Aquatic Food Product Technology, 2016, 25(3): 444-455. DOI:10.1080/10498850.2013.819543.
[6] PHILLIPS M, KAILASAPATHY K, LAI T. Viability of commercial probiotic cultures (L. acidophilus, Bifidobacterium sp., L. casei,L. paracasei, and L. rhamnosus) in Cheddar cheese[J]. International Journal of Food Microbiology, 2006, 108(2): 276-280. DOI:10.1016/j.ijfoodmicro.2005.12.009.
[7] ZHANG Y, DU R, WANG L, et al. The antioxidative effects of probiotic Lactobacillus casei Zhang on the hyperlipidemic rats[J].European Food Research and Technology, 2010, 231(1): 151-158.DOI:10.1007/s00217-010-1255-1.
[8] ABADÍA-GARCÍA L, CARDADOR A, DEL CAMPO S T M, et al.Inf l uence of probiotic strains added to cottage cheese on generation of potentially antioxidant peptides, anti-listerial activity, and survival of probiotic microorganisms in simulated gastrointestinal conditions[J].International Dairy Journal, 2013, 33(2): 191-197. DOI:10.1016/j.idairyj.2013.04.005.
[9] MEIRA S M M, DAROIT D J, HELFER V E, et al. Bioactive peptides in water-soluble extracts of ovine cheeses from Southern Brazil and Uruguay[J]. Food Research International, 2012, 48(1): 322-329.DOI:10.1016/j.foodres.2012.05.009.
[10] TIMÓN M L, PARRA V, OTTE J, et al. Identification of radical scavenging peptides (< 3 kDa) from Burgos-type cheese[J]. LWTFood Science and Technology, 2014, 57(1): 359-365. DOI:10.1016/j.lwt.2014.01.020.
[11] 马玲, 彭登峰, 李慧, 等. 不同菌种组合Mozzarella干酪成熟过程中水溶性提取液的抑菌及抗氧化活性研究[J]. 现代食品科技,2015(8): 103-109.
[12] 罗艳华, 王全杰, 陈沛海, 等. 蛋白水解物水解度测定方法的研究[J].皮革与化工, 2017, 34(2): 26-31.
[13] BAEJIN L, JINSOO K, KANG Y M, et al. Antioxidant activity and γ-aminobutyric acid (GABA) content in sea tangle fermented by Lactobacillus brevis BJ20 isolated from traditional fermented foods[J]. Food Chemistry, 2010, 122(1): 271-276. DOI:10.1016/j.foodchem.2010.02.071.
[14] ARASU M V, DA H K, KIM P I, et al. In vitro antifungal, probiotic and antioxidant properties of novel Lactobacillus plantarum K46 isolated from fermented sesame leaf[J]. Annals of Microbiology, 2014,64(3): 1333-1346. DOI:10.1007/s13213-013-0777-8.
[15] WONG P Y Y, KITTS D D. Chemistry of buttermilk solid antioxidant activity[J]. Journal of Dairy Science, 2003, 86(5): 1541-1547.
[16] 王曦, 罗霞, 许晓燕, 等. 不同乳酸菌菌株抗氧化能力的比较研究[J].食品科学, 2010, 31(9): 197-201.
[17] GÓMEZ-RUIZ J Á, RAMOS M, RECIO I. Angiotensin-converting enzyme-inhibitory peptides in Manchego cheeses manufactured with different starter cultures[J]. International Dairy Journal, 2002, 12(8):697-706. DOI:10.1016/S0958-6946(02)00059-6.
[18] SHIMADA K, FUJIKAWA K, YAHARA K, et al. Antioxidative properties of xanthan on the autoxidation of soybean oil in cyclodextrin emulsion[J]. Journal of Agricultural and Food Chemistry, 1992, 40(6):945-948. DOI:10.1021/jf00018a005.
[19] LIU J, LUO J, YE H, et al. Production, characterization and antioxidant activities in vitro of exopolysaccharides from endophytic bacterium Paenibacillus polymyxa EJS-3[J]. Carbohydrate Polymers,2009, 78(2): 275-281. DOI:10.1016/j.carbpol.2009.03.046.
[20] DUH P D, TU Y Y, YEN G C. Antioxidant activity of water extract of Harng Jyur (Chrysanthemum morifolium Ramat)[J]. LWT-Food Science and Technology, 1999, 32(5): 269-277. DOI:10.1006/fstl.1999.0548.
[21] LIU L, LI X, BI W, et al. Isomaltooligosaccharide increases the Lactobacillus rhamnosus viable count in Cheddar cheese[J].International Journal of Dairy Technology, 2015, 68(3): 389-398.DOI:10.1111/1471-0307.12201.
[22] AHMED N H, EL SODA M, HASSAN A N, et al. Improving the textural properties of an acid-coagulated (Karish) cheese using exopolysaccharide producing cultures[J]. LWT-Food Science and Technology, 2005, 38(8): 843-847. DOI:10.1016/j.lwt.2004.10.001.
[23] WU R N, WU Z X, ZHAO C Y, et al. Identification of lactic acid bacteria in suancai, a traditional Northeastern Chinese fermented food,and salt response of Lactobacillus paracasei, LN-1[J]. Annals of Microbiology, 2014, 64(3): 1325-1332.
[24] 李军训, 罗学刚, 高洁, 等. 益生菌的分类、生理功能与有效性评价研究进展[J]. 中国农业科技导报, 2010, 12(6): 49-55.
[25] CORRÊA A P F, DAROIR D J, FONTOURA R, et al. Hydrolysates of sheep cheese whey as a source of bioactive peptides with antioxidant and angiotensin-converting enzyme inhibitory activities[J]. Peptides,2014, 61: 48-55. DOI:10.1016/j.peptides.2014.09.001.
[26] ONG L, HENRIKSSON A, SHAH N P. Angiotensin converting enzyme-inhibitory activity in Cheddar cheeses made with the addition of probiotic Lactobacillus casei sp.[J]. Le Lait, 2007, 87(2): 149-165.DOI:10.1051/lait: 2007004.
[27] LI W, JI J, CHEN X, et al. Structural elucidation and antioxidant activities of exopolysaccharides from Lactobacillus helveticus MB2-1[J]. Carbohydrate Polymers, 2014, 102(1): 351-359.DOI:10.1016/j.carbpol.2013.11.053.
[28] FARVIN K H S, BARON C P, NIELSEN N S, et al. Antioxidant activity of yoghurt peptides: part 1-in vitro assays and evaluation in ω-3 enriched milk[J]. Food Chemistry, 2010, 123(4): 1081-1089.DOI:10.1016/j.foodchem.2010.05.067.
[29] 陈俊亮, 田芬, 霍贵成, 等. 乳酸乳球菌对切达干酪成熟过程中质构和风味的影响[J]. 食品科学, 2013, 34(21): 163-167. DOI:10.7506/spkx1002-6630-201321034.
[30] ZHANG K P, TIAN J J, DEPARTMENT E. Analysis of Cheddar cheese texture during ripening period[J]. Food Research &Development, 2014, 15: 1-7.
[31] ONG L, HENRIKSSON A, SHAH N P. Development of probiotic Cheddar cheese containing Lactobacillus acidophilus, Lb. casei,Lb. paracasei and Bifidobacterium spp. and the influence of these bacteria on proteolytic patterns and production of organic acid[J].International Dairy Journal, 2006, 16(5): 446-456. DOI:10.1016/j.idairyj.2005.05.008.
[32] 宋雪梅, 张炎, 杨敏, 等. 牦牛乳硬质干酪苦味肽的分离与特征鉴定[J].食品科学, 2016, 37(15): 160-164. DOI:10.7506/spkx1002-6630-201615027.
Effect of Probiotics on Antioxidant Activities of Cheddar Cheese during Ripening Period
CHEN Ping, LIU Lu, LI Xiaodong*, QU Xiuwei, WANG Haixia, ZHANG Xiuxiu
(Key Laboratory of Dairy Science, Ministry of Education, College of Food Science,Northeast Agricultural University, Harbin 150030, China)
Abstract:Our study evaluated the acid and salt tolerance of 9 strains of probiotics to screen them for cheese production.We selected one strain with higher hydrolysis activity and another strain with higher antioxidant activity, and added them to Cheddar cheese, respectively. Cheddar cheese without probiotics was used as the control. We studied the viability and antioxidant activity of all samples to determine the effect of various probiotics on antioxidant properties of cheese. The results showed that Lactobacillus helveticus 1.0612 possessed better hydrolysis activity while Lactobacillus rhamnosus 1.0911 possessed better antioxidant activity. During the ripening period, viable counts in the probiotic cheeses were significantly higher than those in the control (P < 0.05), but there was no significant difference between the probiotic cheeses (P > 0.05). For all three cheeses, antioxidant properties were increased fi rst, then decreased, and fi nally leveled off. The scavenging capacities against 1,1-diphenyl-2-picrylhydrazyl (DPPH) and hydroxyl radicals reached the maximum at the 4thmonth while reducing power reached the maximum at the 5thmonth. The DPPH and hydroxyl radical scavenging capacity and reducing power (51.05%, 49.97% and 0.66) of the cheese with L. helveticus 1.0612 were significantly higher than those (47.30%, 46.19% and 0.56) of the cheese with L. rhamnosus 1.0911, respectively (P < 0.05). Therefore, we concluded that compared with the strain with good antioxidant activity, adding the strain with high hydrolysis activity to cheese can promote protein breakdown into antioxidant short-chain peptides and amino acids, consequently enhancing antioxidant activity in cheese.
Keywords:probiotics; Cheddar cheese; hydrolysis activity; antioxidant activities; ripening period
CHEN Ping, LIU Lu, LI Xiaodong, et al. Effect of probiotics on antioxidant activities of Cheddar cheese during ripening period[J]. Food Science, 2018, 39(22): 179-185. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201822028. http://www.spkx.net.cn
引文格式:陈萍, 刘璐, 李晓东, 等. 益生菌对契达干酪成熟过程中抗氧化性变化的影响[J]. 食品科学, 2018, 39(22): 179-185.DOI:10.7506/spkx1002-6630-201822028. http://www.spkx.net.cn
文章编号:1002-6630(2018)22-0179-07
文献标志码:A
中图分类号:TS252.53
DOI:10.7506/spkx1002-6630-201822028
*通信作者简介:李晓东(1968—),男,教授,博士,研究方向为食品科学。E-mail:hrblxd@163.com
第一作者简介:陈萍(1992—),女,硕士研究生,研究方向为食品科学。E-mail:525177747@qq.com
基金项目:哈尔滨市应用技术研究与开发项目(2017RAQXJ087)
收稿日期:2017-09-15