表1 植物油样品信息
Table 1 Information about vegetable oils tested in this study

白云慧1,温海超1,张 磊2,倪元颖1,李景明1,*
(1.中国农业大学食品科学与营养工程学院,北京 100083;2.新疆农业大学科研管理处,新疆 乌鲁木齐 830052)
摘 要:采用超高效液相色谱-串联质谱联用技术,对葵花籽油、菜籽油、花生油、胡麻油、橄榄油、玉米油和芝麻油中的酚类化合物进行检测,采用主成分分析、线性判别分析和层次聚类分析3 种方法识别植物油。结果表明:植物油中酚类化合物组成和含量存在明显差异;主成分分析中,提取4 个主成分可以反映原变量89.42%的信息,花生油、橄榄油、葵花籽油和芝麻油分布在不同象限,区分良好;线性判别分析结果显示,在84.4%程度上可以对7 种植物油实现良好区分;层次聚类分析中,菜籽油、橄榄油、芝麻油可以同其他植物油明显区分。
关键词:植物油;酚类化合物;主成分分析;线性判别分析;层次聚类分析
植物油多源自植物果实、种子、胚芽等,常用于烹饪。部分植物油由于富含特殊的营养成分,其商业价值及营养价值较高。比如,胡麻油富含木酚素类化合物[1],具有抗氧化[2]、抗肿瘤[3]和抗病毒的功能[4];橄榄油中含有羟基酪醇、酪醇等苯乙醇类[5]化合物,能够预防心脑血管疾病、癌症[6]。由于精炼植物油同其物化性质相似,准确识别是食用油脂商品检验一大难题。目前检测目标主要集中在油脂常量成分及微量成分,前者主要针对甘油酯、脂肪酸,如依赖三亚油酸甘油酯含量和三酰基甘油酯平均碳原子数鉴别橄榄油真伪,后者根据植物油中甾醇类化合物组成判断植物油是否存在掺假[7]。
植物酚类化合物是植物次生代谢产物,在油料作物中普遍存在,伴随提取加工进入食用油脂中。目前已知植物油脂中的酚类化合物包括水解和缩合两大类,具体有羟基肉桂酸、羟基苯甲酸、芪化物、微量类黄酮、黄酮、黄酮醇、异类黄酮、木酚素、酚醇和环烯醚萜类。不同植物油的酚类化合物组成及含量存在差异,根据现有研究报道,白藜芦醇是花生油中特有的酚类化合物,在其他植物油中未检测发现,异类黄酮类化合物目前只在大豆油中检测发现[8-10],醚萜类化合物只有在橄榄油中发现并报道[11-13]。因此,基于植物油中特征性酚类化合物有可能实现不同品种植物油脂的识别、区分。
植物油中酚类化合物含量极低[14],因此其提取和检测方法尤为重要。植物油脂中酚类化合物常见的提取方法有液液萃取、固相萃取[1,5,15]。近年来一些新技术,如磁性纳米材料,用于提取植物油中的酚类化合物也有研究报道[16-18]。酚类化合物检测分析方法有高效液相色谱-串联紫外检测器和高效液相色谱-串联质谱检测,后者作为一种高通量筛选和定性工具,是近年来广泛推崇的酚类化合物检测技术[17]。
化学计量学通过解析化学测量数据获取化学及相关信息,从而阐明物质的成分、结构和性能关系[19]。常见的化学计量学方法包括模式识别和多维校正,其中模式识别又分为多类聚类、判别分析和一类分类分析,前者适用于多类样品识别,后者适用于一类样品的识别[20]。常用的多类聚类和判别分析有主成分分析(principal component analysis,PCA)、聚类分析、判别分析、人工神经网络等。
本研究采用超高效液相色谱-串联质谱(ultra performance liquid chromatography-tandem mass spectrometry,UPLC-MS/MS)方法对植物油中的25 种酚类化合物进行检测分析,并基于植物油酚类化合物组成的不同,通过PCA、线性判别分析(linear discriminant analysis,LDA)和层次聚类分析(hierarchical cluster analysis,HCA)对植物油进行判别,为植物油掺杂检测提供实验依据。
7 种植物油样品,包括葵花籽油3 种(SU1、SU2、SU3)、菜籽油3 种(R1、R2、R3)、花生油3 种(P1、P2、P3)、胡麻油2 种(F1、F2)、橄榄油2 种(O1、O2)、玉米油1 种(C)、芝麻油1 种(SE),均购自新疆昌吉隆源超市,具体样品信息如表1所示。
表1 植物油样品信息
Table 1 Information about vegetable oils tested in this study

甲醇、盐酸(均为分析纯) 国药集团化学试剂有限公司;酚类化合物标样 Sigma-Aldrich上海贸易有限公司;甲酸、乙腈(均为色谱纯) 北京百灵威科技有限公司。
Xevo TQD型UPLC-MS/MS联用仪 美国沃特世科技有限公司;S22-2恒温磁力搅拌器 上海司乐仪器有限公司;SE812型氮吹仪 北京帅恩科技有限公司;GL-20G-II型高速冷冻离心机 上海安亭科学仪器厂;Genius 3 IKA混合器 德国IKA公司;Poroshell 120 EC-C18色谱柱(3.0 mm×100 mm,2.7 μm) 美国安捷伦公司;超纯水装置 美国Millipore公司。
1.3.1 植物油酚类化合物提取
参考Monaco等的方法[11]进行提取。准确称取5.00 g植物油,加入5 mL 70%甲醇-1%盐酸溶液,旋涡混合,剧烈振荡2 min,37 ℃、150 r/min磁力搅拌30 min,4 ℃、4 000 r/min离心15 min,保留上清液至试管中,铝箔包裹,4 ℃低温保存待分析。
1.3.2 植物油酚类化合物的检测
参考Jin Qing等[21]的方法,并加以修正。采用Poroshell 120 EC-C18反相色谱柱(3.0 mm×100 mm,2.7 μm);流动相A为0.1%甲酸溶液,B相为乙腈;梯度洗脱程序:0~1 min,5% B;1~3 min,15% B;3~15 min,25% B;15~18 min,40% B;18~20 min,60% B;20~20.1 min,5% B;20.1~30 min,5% B;柱温25 ℃;流速0.3 mL/min;上样量2 μL。质谱条件:电喷雾离子源,负离子模式;干燥气温度330 ℃;鞘气流速10 L/min;雾化器压力35 psi;鞘气温度350 ℃;干燥气流速10 L/min;毛细管电压3 500 V;喷嘴电压500 V。
1.3.3 酚类化合物的定性和定量
在多级反应监测模式下,根据标准品的质谱信息和保留时间定性;根据标准曲线对样品中的各酚类化合物进行定量。
采用IBM SPSS Statistics 21软件对数据进行统计分析、LDA、PCA,采用HemI软件对数据进行HCA。
采用UPLC-MS/MS方法,对表1植物油样品中的25 种酚类化合物进行检测,质谱条件如表2所示,各酚类化合物均在负离子模式下检测,以响应值最高的作为定量离子(Q),响应值次之的作为定性离子(q)。
表2 多级反应监测模式下酚类化合物UPLC-MS/MS条件
Table 2 UPLC-MS/MS conditions for phenolic compounds in multiple reaction monitoring (MRM) mode

如表3所示,葵花籽油中含有较多的黄酮醇类化合物,包括槲皮素、桑色素等,此外还含有大量的绿原酸。菜籽油和胡麻油中的酚类化合物以羟基肉桂酸和羟基苯甲酸类化合物为主。玉米油中的酚类化合物较少,本研究在玉米油中只检测到木犀草素(130.2 μg/kg)和阿魏酸(136.8 μg/kg),有研究认为这是由于精炼工艺造成了酚类化合物的损失[22]。花生油中含有丰富的酚类化合物,主要包括绿原酸、异鼠李素、芥子酸、阿魏酸、咖啡酸、香草酸、对香豆酸、原儿茶酸、对羟基苯甲酸和水杨酸等,此外,检测发现有微量的反-白藜芦醇,其含量为63.8 μg/kg。研究发现,在所有的植物油当中,目前仅在花生油中检测到白藜芦醇的存在[8-10]。橄榄油中含有大量的黄酮类化合物,包括木犀草素和芹黄素,相关文献[12-13,16]均有研究报道。此外,芝麻油同样检测到黄酮类化合物木犀草素和芹黄素。本研究在橄榄油中还检测到黄烷醇类化合物花旗松素,含量为520.5 μg/kg。Taamalli等[23]也在橄榄油中检测到花旗松素。研究发现,花旗松素能够减少由于胆固醇氧化产物诱导的神经细胞凋亡[24]。
油料种类及加工工艺都会影响到植物油中酚类化合物的种类及含量,特别是加工工艺。McDowell等[25]研究发现,冷榨菜籽油的总酚含量为0.581 mg/kg,经精炼后,含量降低为0.008 mg/kg;Ghazani等[26]研究发现,溶剂浸提同压榨相比,前者能更多地保留植物油中的酚类化合物,而经过精炼工艺的芥子油,其中的酚类化合物含量显著性降低。本研究中选用的植物油均采用压榨方式生产,造成样本间含量差异的主要原因可能为精炼工艺,在橄榄油、葵花籽油中同样发现这一规律[22,27],精炼工艺对酚类化合物含量的影响可能会进一步影响植物油的识别研究,但对于植物油中的特异性酚类化合物,比如花生油特有的白藜芦醇,大豆油中的异类黄酮类化合物[8-10],橄榄油中的醚萜类化合物[11-13],对于识别植物油仍具有一定的研究意义。
通过数据降维,PCA在保留主要变量信息的前提下,通过相关性较大的成分反映因变量间的关系[28]。有研究采用PCA,基于橄榄油中龙胆酸、儿茶素、酪醇等14 种酚类化合物含量差异,实现橄榄油与掺伪油的区分[11]。本研究以7 种植物油中的25 种酚类化合物为变量进行分析,如表4所示,经分析得到5 个成分的特征值大于1,共解释了总变量的98.00%,其中PC1占34.10%,PC2占25.95%,累计达到60.04%。
表3 植物油中酚类化合物的含量
Table 3 Contents of phenolic compounds in different vegetable oils

注:ND.未检出。
表4 PCA的总方差
Table 4 Total variance in PCA
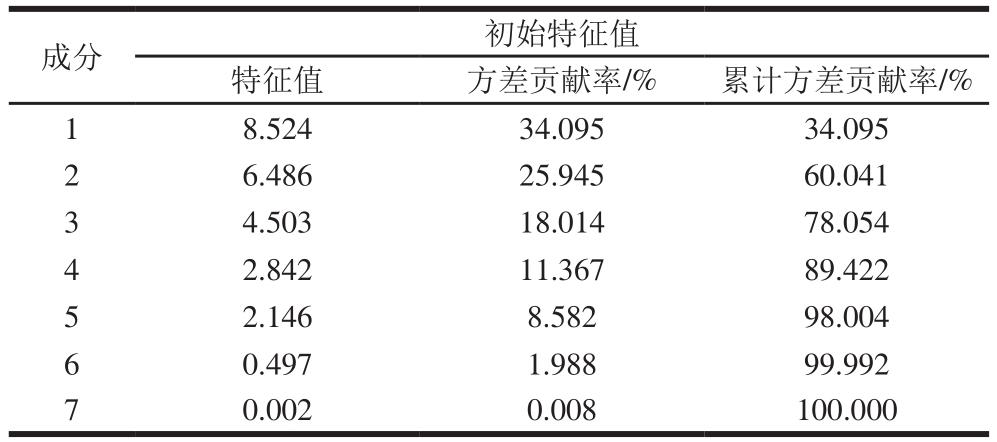
如图1A所示,7 种植物油中花生油分布在第1象限,芦丁、杨梅苷、绿原酸、异鼠李素、桑色素、反-白藜芦醇、对香豆酸、原儿茶素和水杨酸含量较高。葵花籽油分布在第2象限,槲皮素-3-O-葡糖苷酸、杨梅素、槲皮素、山柰素含量较高。橄榄油分布在第3象限,花旗松素、木犀草素、咖啡酸和芹黄素含量较高。芝麻油和亚麻籽油分布在第4象限,鼠李素、芥子酸、丁香酸、阿魏酸、香草酸、龙胆酸、原儿茶酸、对羟基苯甲酸和水杨酸含量相对较高。PCA载荷图用于表示公因子与原始变量之间的相关性,绝对值越大,说明两者关系越密切。如图1B所示,同PC1相关性较大的化合物包括芦丁、异鼠李素-3-O-葡萄糖苷、异鼠李素、绿原酸、对香豆酸、原儿茶酸、水杨酸和反-白藜芦醇,表明葵花籽油、玉米油、菜籽油、橄榄油和花生油、胡麻油、芝麻油能够相互区别;同PC2相关的化合物包括杨梅苷和桑色素,表明葵花籽油、花生油和玉米油、橄榄油、菜籽油、胡麻油、芝麻油能够相互区别。
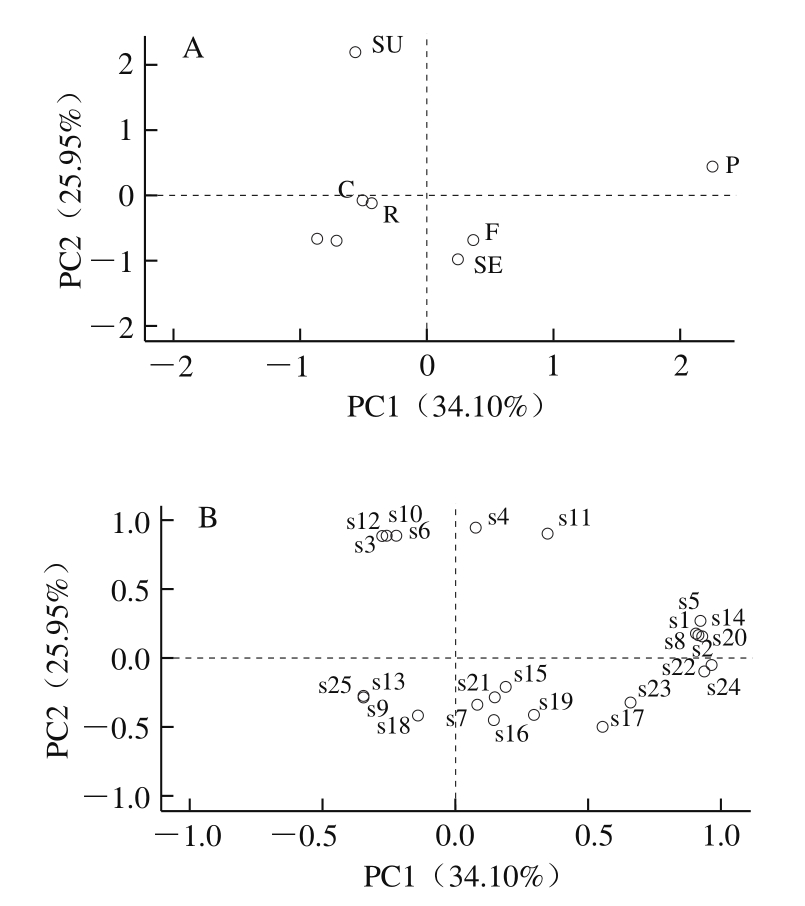
图1 植物油PCA得分图(A)和载荷图(B)
Fig. 1 PCA score (A) and loading (B) plots for different vegetable oils
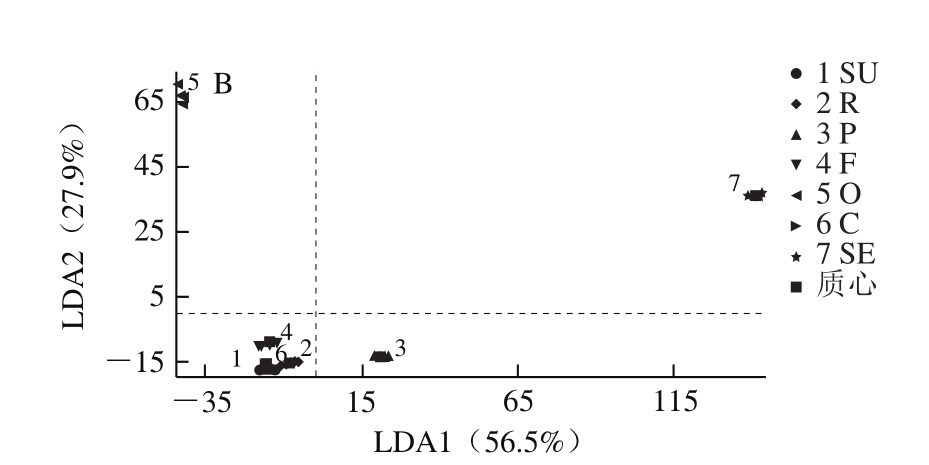
图2 基于酚类化合物组成的植物油LDA得分图
Fig. 2 LDA score plots for vegetable oils based on their phenolic compound composition
LDA依据变量信息建立判别函数,通过降低类内方差比例,实现判别分析的准确性。基于橄榄油中酚类化合物组成及含量存在差异,采用LDA的方法,可实现不同品种[23]和不同产地[29]橄榄油的区分。Jabeur等[7]基于橄榄油中甾醇等微量成分同其他植物油的差异,采用LDA方法可实现橄榄油同掺杂油的区分。本研究采用LDA方法,依据植物油中酚类化合物组成的差异,在84.4%程度上实现7 种植物油的区分。如图2所示,化合物香草酸、芹黄素、异鼠李素、花旗松素、对香豆酸、原儿茶酸、鼠李素、桑色素、芥子酸、对羟基苯甲酸、水杨酸、丁香酸、阿魏酸和龙胆酸14 种酚类化合物参与LDA,其中LDA1同香草酸存在相关性,可实现芝麻油同其他6 种植物油的区分;LDA2和芹黄素、花旗松素存在相关性可实现橄榄油、芝麻油同葵花籽油、菜籽油、花生油、胡麻油、玉米油的区分。
HCA可实现测量不同类别之间的差异,对样本和变量同时聚类,此外,通过HCA热图可以了解到酚类化合物在不同植物油中的分布和含量情况。有研究采用HCA方法,对植物油中23 种酚类化合物和7 种植物油聚类分析,实现了7 种植物油的有效分类[30]。如图3所示,基于25 种酚类化合物对植物油进行分析发现,菜籽油、橄榄油、芝麻油可以同其他植物油实现有效区分,而葵花籽油、花生油、胡麻油之前区分度小。花生油中的特征化合物反-白藜芦醇,橄榄油和其他植物油相比,含有较多的黄酮类化合物,包括木犀草素和芹黄素,这同PCA的结果相一致。
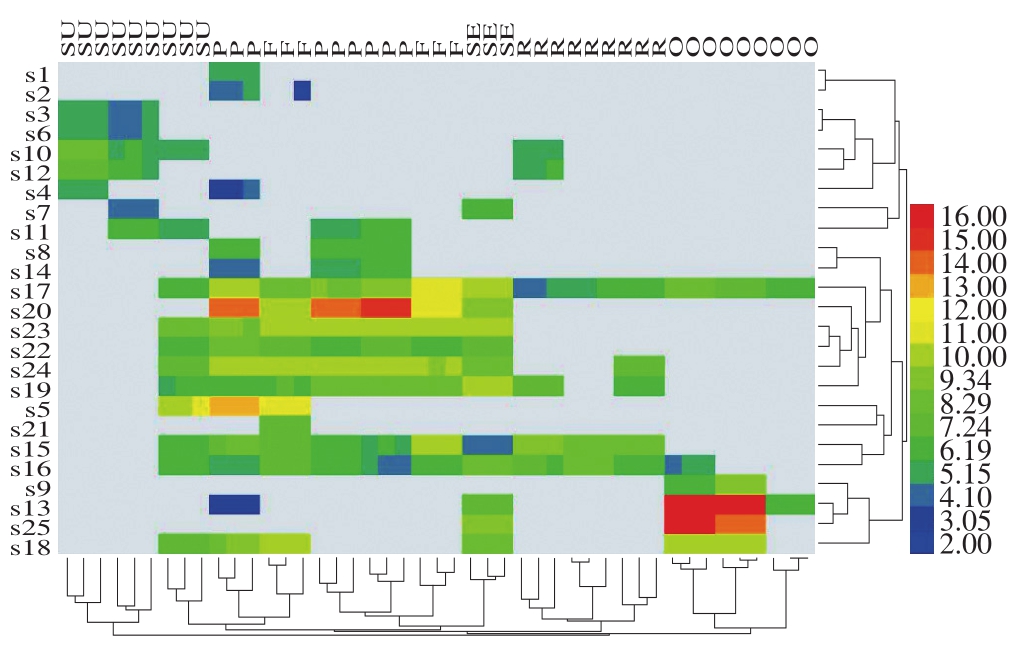
图3 植物油的HCA热图
Fig. 3 HCA heatmap for vegetable oils
采用UPLC-MS/MS方法,检测分析7 种植物油中的25 种酚类化合物,发现植物油中的酚类化合物主要以羟基肉桂酸和羟基苯甲酸为主,不同植物油的酚类化合物组成及含量又存在差异。PCA能够良好区分花生油、橄榄油、葵花籽油和芝麻油;LDA能够在84.4%程度上对7 种植物油实现区分,可实现多种植物油间的区分;采用HCA方法可将菜籽油、橄榄油和芝麻油同其他植物油明显区分。
参考文献:
[1] HERCHI W, SAWALHA S, ARRÁEZ-ROMÁN D, et al.Determination of phenolic and other polar compounds in flaxseed oil using liquid chromatography coupled with time-of-flight mass spectrometry[J]. Food Chemistry, 2011, 126(1): 332-338.DOI:10.1016/j.foodchem.2010.10.070.
[2] KITTS D D, YUAN Y V, WIJEWICKREME A N, et al. Antioxidant activity of the flaxseed lignan secoisolariciresinol diglycoside and its mammalian lignan metabolites enterodiol and enterolactone[J].Molecular & Cellular Biochemistry, 1999, 202(1/2): 91-100.
[3] HIRANO T, GOTOH M, OKA K. Natural flavonoids and lignans are potent cytostatic agents against human leukemic HL-60 cells[J].Life Sciences, 1994, 55(13): 1061-1069. DOI:10.1016/0024-3205(94)00641-5.
[4] CHARLTON J L. Antiviral activity of lignans[J]. Journal of Natural Products, 1998, 61(11): 1447-1451. DOI:10.1021/np980136z.
[5] KOTSIOU K, TASIOULA-MARGARI M. Monitoring the phenolic compounds of Greek extra-virgin olive oils during storage[J]. Food Chemistry, 2016, 200: 255-262. DOI:10.1016/j.foodchem.2015.12.090.
[6] VILAPLANA-PÉREZ C, AUÑÓN D, GARCÍAFLORES L A, et al.Hydroxytyrosol and potential uses in cardiovascular diseases, cancer,and AIDS[J]. Frontiers in Nutrition, 2014, 1: 1-11. DOI:10.3389/fnut.2014.00018.
[7] JABEUR H, ZRIBI A, MAKNI J, et al. Detection of chemlali extravirgin olive oil adulteration mixed with soybean oil, corn oil, and sunflower oil by using GC and HPLC[J]. Journal of Agricultural &Food Chemistry, 2014, 62(21): 4893-4904. DOI:10.1021/jf500571n.
[8] ZHAO X, MA F, LI P W, et al. Simultaneous determination of isof l avones and resveratrols for adulteration detection of soybean and peanut oils by mixed-mode SPE LC-MS/MS[J]. Food Chemistry,2015, 176: 465-471. DOI:10.1016/j.foodchem.2014.12.082.
[9] LU Q, ZHAO Q, YU Q W, et al. Use of pollen solid-phase extraction for the determination of trans-resveratrol in peanut oils[J]. Journal of Agricultural and Food Chemistry, 2015, 63: 4771-4776. DOI:10.1021/jf505938w.
[10] MA F, LI P W, ZHANG Q, et al. Rapid determination of transresveratrol in vegetable oils using magnetic hydrophilic multi-walled carbon nanotubes as adsorbents followed by liquid chromatographytandem mass spectrometry[J]. Food Chemistry, 2015, 178: 259-266.DOI:10.1016/j.foodchem.2015.01.021.
[11] MONACO G D, OFFICIOSO A, D’ANGELO S, et al.Characterization of extra virgin olive oils produced with typical Italian varieties by their phenolic profile[J]. Food Chemistry, 2015, 184: 220-228. DOI:10.1016/j.foodchem.2015.03.071.
[12] BALLUS C A, QUIRANTESPINÉ R, BAKHOUCHE A, et al.Profile of phenolic compounds of Brazilian virgin olive oils by rapid resolution liquid chromatography coupled to electrospray ionisation time-of-flight mass spectrometry (RRLC-ESI-TOF-MS)[J]. Food Chemistry, 2015, 170(170C): 366-377.
[13] FRANCO M N, GALEANO-DÍAZ T, LÓPEZ Ó, et al.Phenolic compounds and antioxidant capacity of virgin olive oil[J]. Food Chemistry, 2014, 163(20): 289-298. DOI:10.1016/j.foodchem.2014.04.091.
[14] SIGER A, NOGALA-KALUCKA M, LAMPART-SZCZAPA E.The content and antioxidant activity of phenolic compounds in coldpressed plant oils[J]. Journal of Food Lipids, 2008, 15(2): 137-149.DOI:10.1111/j.1745-4522.2007.00107.x.
[15] 罗凡, 费学谦, 方学智, 等. 固相萃取/高效液相色谱法测定茶油中的多种天然酚类物质[J]. 分析测试学报, 2011, 30(6): 696-700.
[16] 吴娆, 马飞, 张良晓, 等. 高效液相色谱-串联质谱法测定紫苏籽油中11 种酚类化合物[J]. 分析化学, 2015, 43(10): 1600-1606.DOI:10.11895/j.issn.0253-3820.150367.
[17] WU R, FEI M, ZHANG L X, et al. Simultaneous determination of phenolic compounds in sesame oil using LC-MS/MS combined with magnetic carboxylated multi-walled carbon nanotubes[J]. Food Chemistry, 2016, 204: 334-342. DOI:10.1016/j.foodchem.2016.02.086.
[18] SHI Z H, QIU L N, ZHANG D, et al. Dispersive liquid-liquid microextraction based on amine-functionalized Fe3O4nanoparticles for the determination of phenolic acids in vegetable oils by highperformance liquid chromatography with UV detection[J]. Journal of Separation Science, 2015, 38(16): 2865-2872. DOI:10.1002/jssc.201500330.
[19] LAVINE B, WORKMAN J. Chemometrics[J]. Analytical Chemistry,2008, 78(12): 4519-4531. DOI:10.1021/ac800728t.
[20] 陈峰, 李鹤东, 王亚棋, 等. 化学计量学方法在食品分析中的应用[J]. 食品科学技术学报, 2017, 35(3): 1-15. DOI:10.3969/j.issn.2095-6002.2017.03.001.
[21] JIN Q, YANG J F, MA L Y, et al. Comparison of polyphenol profile and inhibitory activities against oxidation and α-glucosidase in mulberry (genus Morus) cultivars from China[J]. Journal of Food Science, 2015, 80(11): C2440-C2451. DOI:10.1111/1750-3841.13099.
[22] NERGÍZ C. The effect of refining processes on the total polyphenol and 1,2-diphenol content of olive oil[J]. International Journal of Food Science & Technology, 1993, 28(5): 461-464. DOI:10.1111/j.1365-2621.1993.tb01295.x.
[23] TAAMALLI A, GÓMEZ-CARAVACA A M, ZARROUK M, et al. Determination of apolar and minor polar compounds and other chemical parameters for the discrimination of six different varieties of Tunisian extra-virgin olive oil cultivated in their traditional growing area[J]. European Food Research and Technology, 2010, 231: 955-975. DOI:10.1007/s00217-010-1350-3.
[24] KIM A, NAM Y J, LEE C S. Taxifolin reduces the cholesterol oxidation product-induced neuronal apoptosis by suppressing the Akt and NF-κB activation-mediated cell death[J]. Brain Research Bulletin,2017, 134: 63-71. DOI:10.1016/j.brainresbull.2017.07.008.
[25] McDOWELL D, ELLIOTT C T, KOIDIS A. Characterization and comparison of UK, Irish, and French cold pressed rapeseed oils with refined rapeseed oils and extra virgin olive oils[J]. European Journal of Lipid Science and Technology, 2017, 119: 1-12. DOI:10.1002/ejlt.201600327.
[26] GHAZANI S M, GARCÍ-LLATAS G, MARANGONI A G.Micronutrient content of cold-pressed, hot-pressed, solvent extracted and RBD canola oil: implications for nutrition and quality[J]. European Journal of Lipid Science and Technology, 2014, 116(4): 380-387.DOI:10.1002/ejlt.201300288.
[27] KOSTADINO-VICVELICKOVSKA S, MITREV S. Characterization of fatty acid profile, polyphenolic content and antioxidant activity of cold pressed and refined edible oils from Macedonia[J]. Journal of Food Chemistry and Nutrition, 2013, 1(1): 41-48.
[28] TARKO T, DUDA-CHODAK A, SATORA P, et al. Application of principal component analysis for optimization of polyphenol extraction from alternative plant sources[J]. Journal of Food and Nutrition Research, 2017, 56(1): 61-72.
[29] BAJOUB A, AJAL E A, FERNÁNDEZ-GUTIÉRREZ A, et al.Evaluating the potential of phenolic profiles as discriminant features among extra virgin olive oils from Moroccan controlled designations of origin[J]. Food Research International, 2016, 84: 41-51.DOI:10.1016/j.foodres.2016.03.010.
[30] 吴娆. 食用植物油多元掺伪鉴别技术研究[D]. 武汉: 中国农业科学院油料作物研究所, 2016.
Phenolic Compositions and Discrimination of Seven Vegetable Oils
BAI Yunhui1, WEN Haichao1, ZHANG Lei2, NI Yuanying1, LI Jingming1,*
(1. College of Food Science and Nutritional Engineering, China Agricultural University, Beijing 100083, China;2. Scientific Research Administration Department, Xinjiang Agricultural University, Ürümqi 830052, China)
Abstract:The phenolic compositions of sunf l ower oil, rapeseed oil, peanut oil, fl axseed oil, olive oil, corn oil and sesame oil were determined by ultra-performance liquid chromatography-tandem mass spectrometry (UPLC-MS/MS). Principal component analysis, linear discriminant analysis and cluster analysis were applied to discriminate these vegetable oils.Results showed that phenolic composition and contents greatly varied among these vegetable oils. In PCA analysis, four principal components were extracted, which accounted for 89.42% of the total variance explained. The PCA score plots showed a noticeable difference among the seven oils. The vegetable oils were apparently distinguished by linear discriminant analysis with an accuracy rate of 84.4%. Good discrimination of rapeseed oil, olive oil and rapeseed oil from other oils was achieved by hierarchical cluster analysis.
Keywords:vegetable oil; phenolic compound; principal component analysis; linear discriminant analysis; hierarchical cluster analysis
BAI Yunhui, WEN Haichao, ZHANG Lei, et al. Phenolic compositions and discrimination of seven vegetable oils[J]. Food Science,2018, 39(22): 207-212. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201822032. http://www.spkx.net.cn
引文格式:白云慧, 温海超, 张磊, 等. 基于酚类化合物组成差异的7 类植物油脂识别[J]. 食品科学, 2018, 39(22): 207-212.DOI:10.7506/spkx1002-6630-201822032. http://www.spkx.net.cn
文章编号:1002-6630(2018)22-0207-06
文献标志码:A
中图分类号:TS225.1
DOI:10.7506/spkx1002-6630-201822032
*通信作者简介:李景明(1969—),男,副教授,博士,研究方向为天然产物提取及功能食品研发。E-mail:lijingming@cau.edu.cn
第一作者简介:白云慧(1992—),女,硕士研究生,研究方向为天然产物提取及功能食品研发。E-mail:S20153060716@cau.edu.cn
基金项目:公益性行业(农业)科研专项(201303072)
收稿日期:2017-09-29