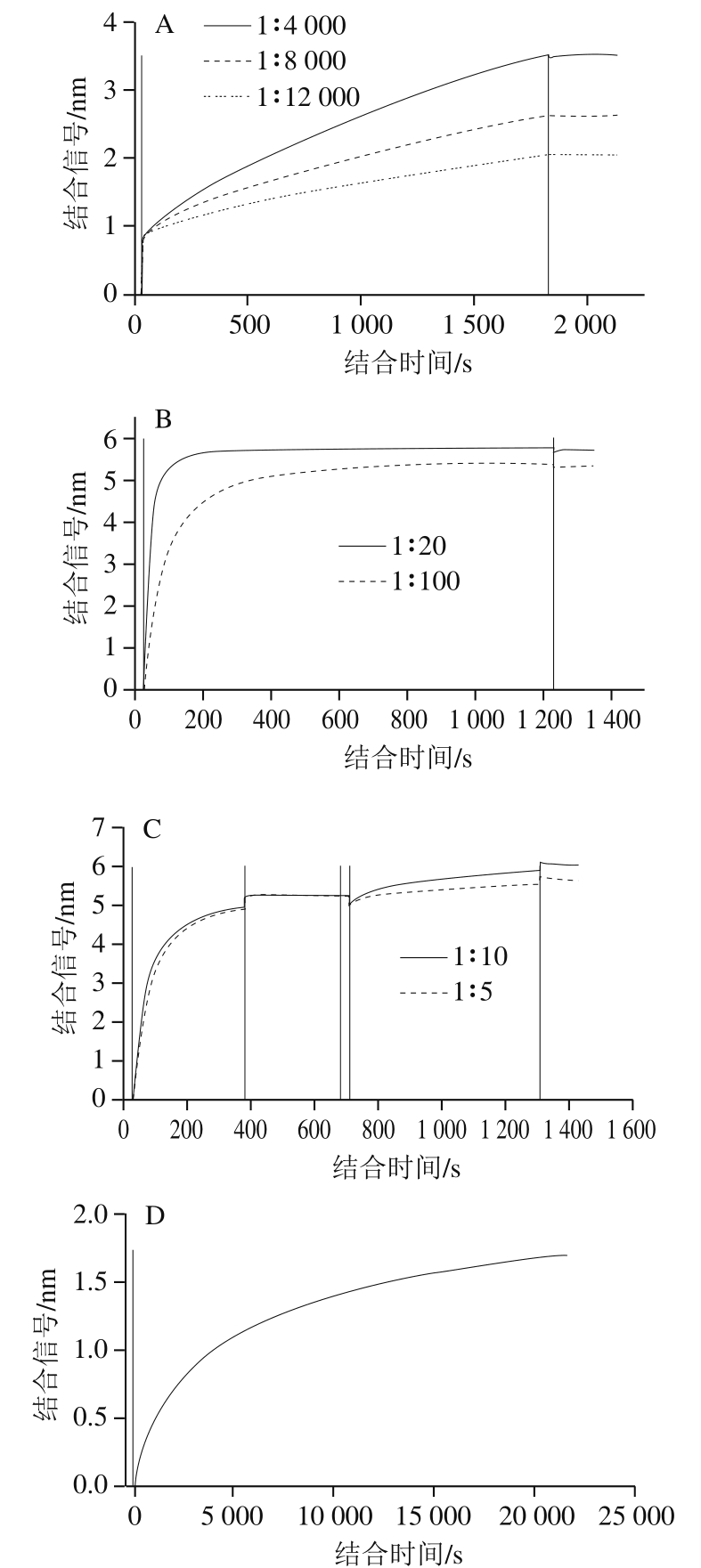
图1 测定条件的优化
Fig. 1 Optimization of experimental conditions
A.不同高稀释倍数抗体的结合曲线;B.不同低稀释倍数抗体的结合曲线;C.不同稀释倍数的花生过敏患者血清池结合曲线;D. 1∶10稀释的花生过敏患者血清池结合曲线。
张 英1,2,李 坤1,3,颜 琪1,2,陈红兵1,4,吴志华1,4,*
(1.南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047;2.南昌大学食品学院,江西 南昌 330031;3.南昌大学资源环境与化工学院,江西 南昌 330031;4.南昌大学中德联合研究院,江西 南昌 330047)
摘 要:探索基于生物膜干涉技术对花生蛋白与花生过敏患者血清中免疫球蛋白E(immunoglobulin E,IgE)的结合能力进行检测的方法。利用链霉亲和素(streptavidin,SA)标记的传感器、生物素化的羊抗人IgE抗体、花生过敏患者血清池以及花生蛋白建立了一种测定花生蛋白与花生过敏患者血清IgE结合能力的新方法,优化检测条件为抗体1∶100稀释后线下固化20 min,血清1∶10稀释后过夜结合,完成传感器修饰。在线洗基线后用质量浓度为1 mg/mL的花生蛋白与传感器结合3 600 s,解离120 s。利用该法对不同热加工后花生蛋白与患者血清IgE的结合能力进行评估,并与常用的酶联免疫吸附实验(enzyme linked immunosorbent assay,ELISA)检测进行比较。结果表明,本方法可以直接评估过敏原蛋白与血清IgE的结合能力,与ELISA结果相关系数达到0.91。热加工中,油炸处理提高了花生蛋白的IgE结合能力,水煮和烘烤降低了花生蛋白的IgE结合能力,且去壳热加工比带壳热加工花生的蛋白的IgE结合能力更强。
关键词:花生蛋白;IgE;生物膜干涉技术;IgE结合能力;热加工
花生作为一种较为普遍的食物或食品加工原料,属于八大过敏原之一[1],可引起严重的过敏反应[2-3],在西方发达国家,花生过敏影响约1%~3%的儿童[4-5]。花生过敏的发生机制主要为免疫球蛋白E(immunoglobulin E,IgE)介导的I型超敏反应[6],一定量的花生过敏原蛋白初次进入患者体内后,机体会产生与膜表面特定受体结合的IgE,使得机体处于致敏状态。当相同的或相似的过敏原再次进入机体后,会与体内已有的IgE结合,引起多个FcεRI交联,启动活化信号,导致肥大细胞、嗜碱性粒细胞脱颗粒,释放前列腺素、组胺等炎症因子并出现炎症反应[1,7-9]。
因此,检测过敏原蛋白与过敏患者血清IgE的结合能力,或者其后由过敏反应引起的炎症因子的释放程度,是研究过敏原蛋白潜在致敏性强弱的重要指标。对于后者,检测炎症因子释放的常用方法有细胞实验和动物实验,细胞实验常采用肥大细胞或嗜碱性粒细胞进行,通过检测过敏原刺激后细胞上清液中的组胺、β-己糖胺酶、IL-4等细胞因子的释放、细胞内钙离子的变化等指标反映过敏原的致敏能力[10-12]。动物实验也被用于食物致敏性评估,一般使用特定种类的小鼠作为研究模型。小鼠与人类有很多生理学、基因和免疫学上的相似之处,它的整个免疫系统与人类也非常相似,于是可以通过模拟人体过敏反应的机制进行过敏原致敏能力的体内评估[13-14]。这两种检测方法均需要较长的培养时间、较大的人力物力消耗和较高的操作技术要求。
检测过敏原蛋白与过敏患者血清IgE结合能力的常用技术为酶联免疫吸附实验(enzyme linked immunosorbent assay,ELISA)[15],是一种将抗原抗体的免疫反应和酶的催化反应结合而建立的一门通过结合量的多少判定结合能力的技术。其中间接竞争ELISA方法较常用,但此方法的判定结果会受到较多因素的影响[16],首先由于操作步骤繁琐,很容易受到人为因素的影响,且多次洗板时容易发生孔间交叉污染、洗板不干净等问题;另外实验温度也会通过加快或者减缓反应程度影响实验结果;同时,ELISA测定方法具有一定的检测限,在对杂交瘤细胞上清液抗体进行筛选时,当抗体的平衡解离常数(即亲和力常数)低于10 pmol/L时,ELISA方法将无法区分其IgE结合能力强弱,而生物膜干涉(biolayer interferometry,BLI)技术可以进行较好的分辨和筛选[17]。
已有研究表明[18-19],BLI技术检测分子间相互作用具有分辨率高、速度快、结果精准、可实现高通量以及不需要样品前处理等优点。更重要的是弥补了ELISA容易受到人为因素影响以及只能检测抗原抗体结合量的缺点,BLI技术通过传感器的连续上机检测联合结合速率Ka与解离速率Kd计算得到亲和力常数,亲和力常数越小则说明其与血清IgE的结合能力越强,由此直接评估分子之间的结合能力强弱。
BLI技术所使用的传感器光纤表面末端包裹一层特殊的光学膜,可以选择性的结合相应生物分子,通过分子与分子之间的特异性相互作用在传感器头部形成分子层。当白光直射入传感器,两束光线将会反射到传感器的末端。第1道光线由传感器内表面反射而来,第2道光线来自于分子层。这两束光线由于生物膜导致的干涉现象造成的波长变化与传感器表面分子吸附分子质量有关。与表面等离子共振(surface plasmon resonance,SPR)技术相比,BLI技术具有不受样品组分变化影响的特点[20],并因此应用广泛,如Wallner等[19]使用链霉亲和素(streptavidin,SA)传感器检测重组人红细胞生成素与3 种不同脂质体的结合能力,发现1,2-二棕榈酰-sn-甘油-3-磷酰胆碱具有最强的结合能力。Morita等[21]检测与大麻素具有高亲和力的基因定点突变的Fv片段和野生型Fv片段分别与Δ9-四氢大麻酚的亲和力常数,发现经过基因突变后的Fv片段具有比野生型高10 倍的结合能力。Sun Tingwan等[22]运用BLI技术检测抗体自身相互作用从而可以在数小时之内进行大量抗体的筛选。
生物素-亲和素的结合是一种很强的非特异性分子相互作用,能快速反应形成稳定的复合物[23]。本研究采用的SA传感器表面固定有链霉亲和素,偶联生物素标记的羊抗人IgE抗体,形成稳定复合物,再特异性结合过敏患者血清IgE,之后令其与花生过敏原蛋白反应且经解离步骤检测由于分子膜厚度变化引起的光谱波长位移变化,即可通过计算其亲和力常数KD分析结合能力大小。
本实验基于BLI技术利用SA传感器、生物素化的羊抗人IgE抗体、花生过敏患者血清池以及花生蛋白建立了对花生蛋白与花生过敏患者血清IgE结合能力的检测方法,并利用该方法对不同热加工花生中蛋白与过敏患者血清IgE的结合能力进行了检测。
花生为购自江西南昌青山湖市场的新鲜赣花品种。
SA传感器(18-5019) 美国ForteBio公司;生物素标记的羊抗人IgE抗体 美国Bio-Rad公司;花生过敏患者血清池(10 位花生过敏患者血清组成,特异性IgE的平均水平约66.5 IU/mL) 重庆曼纽艾克科技有限公司。
BLItz系统 美国ForteBio公司;1860酶标仪、Power Pac3000迷你蛋白垂直电泳仪 美国Bio-Rad公司;FDV型超细粉碎机 中国台湾欣镇企业有限公司;LEGEND MACH 1.6R高速冷冻离心机 美国Thermo公司;RH basic 2 S25磁力搅拌器 德国IKA公司;GBOX-CHEMI-XRQ凝胶成像系统 英国Syngene公司。
1.3.1 条件优化
参考张峰等[24]的方法并略有改动,用0.01 mol/L pH 7.2~7.4的磷酸盐缓冲溶液(phosphate buffer saline,PBS)作为缓冲液,缓冲液中加入体积分数0.1%的牛血清白蛋白(bovine serum albumin,BSA)和0.05%的Tween-20作为稀释液,依次将生物素化的羊抗人IgE抗体、花生过敏原患者血清设置不同的浓度进行实验,上机操作用量均为250 μL/孔,筛选实验浓度和检测时间。
1.3.1.1 生物素标记羊抗人IgE抗体稀释倍数的确定
固化抗体作为生物传感器检测分子间相互作用中较重要的一个步骤[25],可以提高实验的高效性和特异性。采用不同稀释倍数的生物素标记的羊抗人IgE抗体固化传感器,比较固化信号曲线,观察生物素标记抗体的结合情况。
高稀释倍数的生物素标记抗体的结合曲线测定操作步骤为:传感器预湿(缓冲液)10 min,平衡基线(缓冲液)30 s,固化(生物素标记抗体)1 800 s,封阻(稀释液)300 s,洗基线(稀释液)30 s。
低稀释倍数的生物素标记抗体的结合曲线测定操作步骤为:传感器预湿(缓冲液)10 min,平衡基线(缓冲液)30 s,固化(生物素标记抗体)1 200 s,解离(缓冲液)120 s。
1.3.1.2 血清稀释倍数的确定
根据已优化的稀释倍数稀释生物素标记羊抗人IgE抗体,固化传感器,将血清稀释5、10 倍进行检测,观察信号变化。选择较优曲线。
操作步骤为:传感器预湿(缓冲液)10 min,平衡基线(缓冲液)30 s,固化(生物素标记抗体)350 s,封阻(稀释液)300 s,洗基线(稀释液)30 s,结合(血清)600 s,解离(稀释液)120 s。
1.3.2 花生的热加工
参考Zhang Wenju[26]和Sayers[27]等的方法略有改动。将新鲜花生进行不同形式的热处理,分组为鲜花生未加工(XX)、鲜花生带壳水煮(DZ,水煮15 min)、鲜花生去壳水煮(QZ,水煮15 min)、鲜花生带壳烘烤(DH,170 ℃、80 min)、鲜花生去壳烘烤(QH,170 ℃、60 min)和鲜花生油炸(YZ,花生油150 ℃、400 s)。
1.3.3 脱脂粉的制备
参考Wu Zhihua等[28]的方法,将处理后的花生进行去壳去红衣得到花生仁,用液氮在超细粉碎机研磨,并用质量体积比为1∶5的含有体积分数0.07%的β-巯基乙醇的丙酮在4 ℃条件下磁力搅拌脱脂2 h,抽滤,重复脱脂2 次,共脱脂3 次。3 次脱脂结束后抽滤并置于通风橱风干至质量恒定即可。
1.3.4 花生蛋白的提取
参考Zhang Wenju等[26]的方法,采用Tris-HCl(20 mmol/L,pH 8.2)作为蛋白提取缓冲液,花生脱脂粉与蛋白提取缓冲液5 g/100 mL混合,于4 ℃磁力搅拌提取3 h,之后4 ℃、5 000×g离心5 min,取上清液,4 ℃、20 000×g再次离心30 min,收集上清液,用0.45 μm的滤膜过滤,并通过二喹啉甲酸(bicinchoninic acid disodium,BCA)试剂盒测定蛋白浓度。
1.3.5 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDSPAGE)分析
参考詹少德[29]的测定方法略有改动。采用12%的分离胶和4%的浓缩胶制备单块胶,蛋白样品与上样缓冲液1∶1混合,并煮沸加热5 min,之后3 000 r/min离心3 min,每个样品的上样量为10 μL,设定条件为6 mA 30 min,12 mA 90 min,使得板中溴酚蓝指示剂泳动到板底即可关闭电泳仪。使用考马斯亮蓝染色15 min后进行脱色,直至有清晰条带出现。采用SDS-PAGE对花生蛋白进行分离并通过灰度扫描分析其平均分子质量,作为计算花生蛋白摩尔质量的数据用于BLI技术分析。
1.3.6 BLI技术检测花生蛋白与过敏患者血清IgE的结合能力
用蛋白提取缓冲液将各蛋白样品稀释至1 mg/mL的质量浓度。蛋白提取缓冲液中加入体积分数0.1%的BSA和0.05%的Tween-20作为实验稀释液。根据相关研究[19-20]以及本研究的优化条件,本实验的操作步骤分为线下处理和线上检测,线下处理包括:传感器预湿(蛋白提取缓冲液,100 μL/孔)10 min,固化(1∶100稀释的生物素标记羊抗人IgE抗体,100 μL/孔)23 min,封阻(实验稀释液,100 μL/孔)20 min,结合(1∶10稀释的花生过敏患者血清池,50 μL/孔)12 h,线上检测包括:洗基线(实验稀释液,250 μL/孔)60 s,结合(花生蛋白,250 μL/孔)3 600 s,解离(实验稀释液,250 μL/孔)120 s。将上机数据结合各花生蛋白样品的摩尔质量,计算亲和力常数KD(KD=Kd/Ka),亲和力常数越小说明其IgE结合能力越强。
1.3.7 间接竞争ELISA检测花生蛋白与过敏患者血清IgE的结合能力
参考李坤等[30]的方法略有改动。10 μg/mL未加工鲜花生蛋白作为包被抗原,空白组用PBS代替花生蛋白;热加工花生蛋白和未加工花生蛋白作为竞争抗原(质量浓度梯度设置为0.05、0.15、0.5、1.5、5 μg/mL),阳性对照组用PBS替代竞争蛋白参与反应,1∶80稀释的花生过敏患者血清池作为一抗,1∶5 000稀释的生物素标记羊抗人IgE抗体作为二抗,用1∶100稀释的HRP标记的链霉亲和素放大信号,最后加OPD溶液显色15 min,酶标仪在490 nm波长处测量其OD值。阳性对照孔和实验组OD值均扣除空白组OD值后分别标记为B0和B。以抑制率(抑制率/%=[1-(B/B0)]×100)值为纵坐标,以相对应的竞争蛋白浓度为横坐标,绘制竞争ELISA曲线,根据IC50值的大小判定花生蛋白的IgE结合能力强弱,IC50值越小代表其IgE结合能力越强。
2.1.1 生物素标记羊抗人IgE抗体稀释倍数的确定
首先采用说明书建议ELISA使用的稀释倍数:1∶4 000、1∶8 000和1∶12 000进行传感器的固化30 min,得到结合曲线如图1A所示:固化曲线的上升趋势与稀释倍数有良好的对应关系,但经过30 min的结合均未达到饱和,可能是由于固化抗体浓度过低引起的结合速率缓慢,因此选用低稀释倍数进行固化,用1∶20和1∶100稀释的抗体进行结合实验,如图1B所示,在100 倍的稀释条件下仍然可以得到明显的且可接受的结合信号,在短时间内可以达到平衡状态,且不会发生明显的解离,说明亲和素与生物素的结合在此条件下是稳定的,考虑到试剂用量以及防止过多的抗体会产生拥挤,导致空间位阻和聚集效应,影响后续检测,选择100 倍稀释的生物素标记羊抗人IgE抗体结合350 s进行下一步的优化,选用上机时间的4倍作为线下处理时长(即23 min)以达到同样的效果进行花生蛋白与过敏患者血清IgE亲和力的测定实验。

图1 测定条件的优化
Fig. 1 Optimization of experimental conditions
A.不同高稀释倍数抗体的结合曲线;B.不同低稀释倍数抗体的结合曲线;C.不同稀释倍数的花生过敏患者血清池结合曲线;D. 1∶10稀释的花生过敏患者血清池结合曲线。
2.1.2 血清稀释倍数的确定
如图1C可见,1∶5稀释倍数下可能由于血清稠度的影响,结合曲线信号变化并不明显,1∶10稀释的血清具有明显的结合信号。但是对进行结合时间表征时(图1D),结合6 h后仍未达到饱和,考虑到结合效果以及实验时间,本研究后续均采用10 倍稀释的血清过夜结合的方法进行线下预处理。
2.1.3 检测稳定性

图2 检测稳定性评估
Fig. 2 Evaluation of the stability of the method
A. 1∶100稀释倍数的生物素标记羊抗人IgE抗体固化稳定性;B.带壳烘烤鲜花生亲和力常数测定稳定性。
使用1∶100稀释倍数的抗体,进行多个传感器的重复实验,从图2A可以看到,这些结合曲线几乎是相互重合叠加的。对于同一个样品蛋白(带壳烘烤鲜花生)进行结合实验(图2B),发现即使单独分析(local分析模式)数据得到的亲和力常数也是无显著性差异的,故本研究中均不设置平行组。

图3 不同热加工花生的蛋白SDS-PAGE图
Fig. 3 SDS-PAGE profiles of proteins from different heat treated peanuts
M. Marker;XX.鲜花生未加工;DZ.鲜花生带壳水煮;QZ.鲜花生去壳水煮;DH.鲜花生带壳烘烤;QH.鲜花生去壳烘烤;YZ.油炸鲜花生。下同。
表1 不同热加工花生蛋白分子质量
Table 1 Relative molecular masses of proteins from different heat treated peanuts
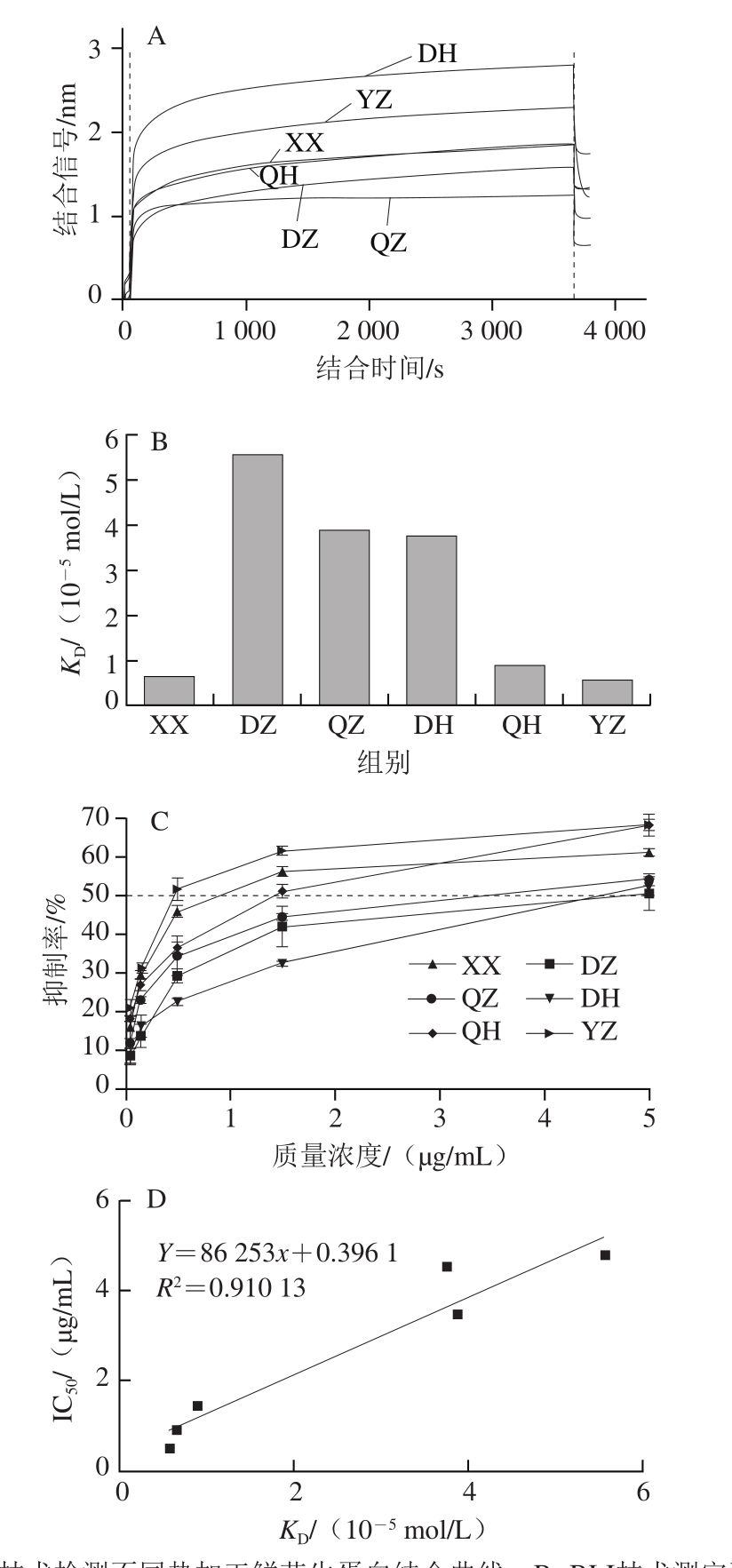
图4 BLI技术与ELISA检测结果
Fig. 4 Results of BLI and ELISA
A. BLI技术检测不同热加工鲜花生蛋白结合曲线;B. BLI技术测定不同热加工花生蛋白的亲和力常数;C. ELISA检测不同热加工花生蛋白的IgE结合能力;D. ELISA检测IC50与BLI技术检测亲和力常数KD的相关性。
使用SDS-PAGE分析结果(图3,表1)计算得到的花生蛋白摩尔质量用于BLI技术分析,得到不同热加工花生蛋白与花生过敏患者血清IgE的结合能力情况(图4A、B)。将BLI方法的检测结果与间接竞争ELISA的检测结果比对,BLI方法检测各花生蛋白的IgE结合能力的大小顺序为:YZ>XX>QH>DH>QZ>DZ,间接竞争ELISA检测得到IgE结合能力的大小顺序为:YZ>XX>QH>QZ>DH>DZ(图4C),两者的检测结果具有较高的匹配度,均表现为油炸鲜花生蛋白的IgE结合能力最强,带壳水煮鲜花生蛋白的IgE结合能力最弱,去壳处理热加工比带壳处理热加工花生的蛋白的IgE结合能力更强。用间接竞争ELISA的测定结果IC50值作为纵坐标,BLI技术检测的KD值作为横坐标,由图4D可以看出,两种检测方法的结果之间具有很好的相关性(R2=0.91),因此BLI技术在检测不同热加工花生蛋白与花生过敏患者血清IgE的结合能力方面具有较好的可行性,可应用于评估花生过敏原蛋白的IgE结合能力。
相比于ELISA检测方法,本研究得到的BLI技术操作简便,上机一个程序只需要62 min,在使用多通道进样设备,如OCTET RED384型号的设备时,可以同时检测16个样品,很容易实现高通量检测,缩短检测时间,且有望更进一步减少样品需要量(最少40 μL/孔)。另外,BLI技术可以很大程度地减少人为误差,且通过亲和力常数可以更直接准确地反映花生蛋白与过敏患者血清IgE的结合能力,计算简便。
根据人们的食用习惯,西方国家常常食用烘烤花生[5],我国则较常食用水煮或油炸花生[26],研究发现不同的加工方式会引起花生蛋白致敏性的不同[31],故本研究将鲜花生进行了不同的热加工处理,包括带壳水煮、去壳水煮、带壳烘烤、去壳烘烤和油炸,检测不同形式的热加工对花生过敏原蛋白与花生过敏患者血清IgE结合能力的影响。
高温加热会导致过敏原蛋白结构的改变主要是由于高级结构的解聚或聚集,使过敏原蛋白失去构象抗原表位、将表面抗原表位包埋或内部抗原表位暴露,从而影响IgE结合活性,降低或增加其致敏性[32-33]。在水煮过程中,也可能是由于水煮时部分花生蛋白会浸出到水煮液中或加工导致过敏原蛋白结构变化[34-35],从而降低了提取得到的花生蛋白的IgE结合能力[36]。油炸花生同样在较高温度下制备而成,其花生蛋白的IgE结合能力升高可能与烘烤加工引起花生蛋白的IgE结合能力升高[36-37]原因相似,高温加热会导致聚合物[38]或美拉德反应终产物的产生,也可能会导致新的过敏原表位的出现,从而提高花生蛋白的IgE结合能力[31,39]。但本研究结果均表明烘烤加工降低了花生蛋白的IgE结合能力,这可能是由于花生蛋白的提取条件会影响过敏原蛋白的提取效率[40],影响其过敏原的含量[41]。本研究所用缓冲液在提取烘烤加工后花生脱脂粉中的高分子质量聚合物时效果不显著,从油炸花生中可以提取得到稍多的高于180 kDa的蛋白聚集体(图3)。
在比较去壳水煮和带壳烘烤两组花生蛋白的IgE结合能力大小时,BLI方法检测结果显示去壳水煮较带壳烘烤组略低,而ELISA检测结果显示去壳水煮较带壳烘烤组有较高的IgE结合能力,这可能与检测方法的不同有关。在Mondoulet等[35]的研究中,采用酶标记过敏原吸附实验方法测定不同热加工花生(生花生、水煮花生、烘烤花生)的IgE结合能力,发现水煮后花生的IgE结合能力仅为生花生的1/2,烘烤花生与生花生的IgE结合能力无明显差别。而Maleki等[42]采用竞争抑制ELISA法发现烘烤可以提高花生蛋白的IgE结合能力。由此可见不同的检测方法对于花生蛋白结合IgE能力的判定存在一定的影响。
另外本实验还发现去壳处理热加工均比带壳处理热加工的花生蛋白IgE结合能力强,这可能是由于去壳加工与带壳加工得到的花生结构变化存在差异或者由于缓冲液对两者的提取效率(图3)不同而导致。
本研究利用BLI技术对花生蛋白与花生过敏患者血清IgE的结合能力进行表征,优化了检测方法,优化的检测条件为抗体1∶100稀释后固化20 min,血清1∶10稀释后过夜结合,完成传感器修饰。洗基线后,将1 mg/mL的花生蛋白与传感器结合3 600 s,并解离120 s,监测结合/解离曲线并计算亲和力常数。研究显示,BLI技术检测结果与常用检测方法ELISA具有较好的匹配性,二者结果的相关系数达到0.91。BLI技术能够实现过敏原蛋白与血清IgE结合能力的高通量检测,缩减检测时间,减少人为误差。研究还发现,不同方式的热加工会不同程度地影响花生蛋白的IgE结合能力,其中油炸鲜花生蛋白的IgE结合能力最强,而其他热加工均可降低蛋白的IgE结合能力,去壳处理热加工花生蛋白比带壳处理热加工花生蛋白的IgE结合能力更强。
参考文献:
[1] CHANG A S, SREEDHARAN A, SCHNEIDER K R. Peanut and peanut products: a food safety perspective[J]. Food Control, 2013,32(1): 296-303. DOI:10.1016/j.foodcont.2012.12.007.
[2] CAI Q, ZHANG W J, ZHU Q Q, et al. Inf l uence of heat treatment on the structure and core IgE-binding epitopes of rAra h 2.02[J]. Food Chemistry, 2016, 202: 404-408. DOI:10.1016/j.foodchem.2016.02.004.
[3] MUELLER G A, GOSAVI R A, POM S A, et al. Ara h 2: crystal structure and ige binding distinguish two subpopulations of peanut allergic patients by epitope diversity[J]. Allergy, 2011, 66(7): 878-885.DOI:10.1111/j.1398-9995.2010.02532.x.
[4] HUSAIN Z, SCHWARTZ R A. Peanut allergy: an increasingly common life-threatening disorder[J]. Journal of the American Academy of Dermatology, 2012, 66(1): 136-143. DOI:10.1016/j.jaad.2011.02.031.
[5] TAO B, BERNARDO K, ELDI P, et al. Extended boiling of peanut progressively reduces ige allergenicity while retaining T cell reactivity[J]. Clinical and Experimental Allergy, 2016, 46(7): 1004-1014. DOI:10.1111/cea.12740.
[6] LONG F Y, YANG X, SUN J, et al. Effects of combined high pressure and thermal treatment on the allergenic potential of peanut in a mouse model of allergy[J]. Innovative Food Science and Emerging Technologies, 2016, 35: 133-138. DOI:10.1016/j.ifset.2016.04.003.
[7] BURKS A W. Peanut allergy[J]. The Lancet, 2008, 371: 1538-1546.DOI:10.1016/S0140-6736(08)60659-5.
[8] 刘颖慧. 食物过敏的诊治及研究进展[J]. 中国临床医生, 2003, 31(9):13-15. DOI:10.3969/j.issn.1008-1089.2003.09.007.
[9] GLEICH G J. Mechanisms of eosinophil-associated inf l ammation[J].Journal of Allergy and Clinical Immunology, 2000, 105(4): 651-663.DOI:10.1067/mai.2000.105712.
[10] 王诗羽, 庄朋伟, 崔广智, 等. 体外检测RBL-2H3细胞脱颗粒方法的研究进展[J]. 天津中医药大学学报, 2014, 33(3): 185-187.DOI:10.11656/j.issn.1673-9043.2014.03.16.
[11] LIU Q, WANG Y, CAO M, et al. Anti-allergic activity of R-phycocyanin from porphyra haitanensis in antigen-sensitized mice and mast cells[J]. International Immunopharmacology, 2015, 25(2): 465-473.DOI:10.1016/j.intimp.2015.02.032.
[12] YAMADA P, ZARROUK M, KAWASAKI K, et al. Inhibitory effect of various tunisian olive oils on chemical mediator release and cytokine production by basophilic cells[J]. Journal of Ethnopharmacology,2008, 116(2): 279-287. DOI:10.1016/j.jep.2007.11.028.
[13] LIU T, NAVARRO S, LOPATA A L. Current advances of murine models for food allergy[J]. Molecular Immunology, 2016, 70: 104-117.DOI:10.1016/j.molimm.2015.11.011.
[14] TORDESILLAS L, MONDOULET L, BLAZQUEZ A B, et al.Epicutaneous immunotherapy induces gastrointestinal Lap + regulatory T cells and prevents food-induced anaphylaxis[J]. Journal of Allergy and Clinical Immunology, 2017, 139(1): 189-201. e184. DOI:10.1016/j.jaci.2016.03.057.
[15] 张翼, 李志辉, 段翠蓉, 等. 过敏原特异性抗体IgE和IgG检测分析[J].继续医学教育, 2014, 28(12): 102-103.
[16] 谭立明. ELISA法检测的影响因素及其对策[J]. 实验与检验医学,2013, 31(4): 300-305.
[17] LAD L, CLANCY S, KOVALENKO M, et al. High-throughput kinetic screening of hybridomas to identify high-affinity antibodies using biolayer interferometry[J]. Journal of Biomolecular Screening, 2015,20(4): 498-507. DOI:10.1177/1087057114560123.
[18] 张晟, 罗弟祥, 刘怡, 等. 生物膜干涉技术, HPLC及ELISA在抗体定量检测中的比较分析[J]. 免疫学杂志, 2014, 30(4): 338-341.
[19] WALLNER J, LHOTA G, JESCHEK D, et al. Application of bio-layer interferometry for the analysis of protein/liposome interactions[J].Journal of Pharmaceutical and Biomedical Analysis, 2013, 72: 150-154. DOI:10.1016/j.jpba.2012.10.008.
[20] SHAH N B, DUNCAN T M. Bio-layer interferometry for measuring kinetics of protein-protein interactions and allosteric ligand effects[J]. Journal of Visualized Experiments: JoVE, 2014, 18(84): e51383. DOI:10.3791/51383.
[21] MORITA I, OYAMA H, YASUO M, et al. Antibody fragments for on-site testing of cannabinoids generated via in vitro affinity maturation[J]. Biological and Pharmaceutical Bulletin, 2017, 40(2):174-181. DOI:10.1248/bpb.b16-00669.
[22] SUN T W, REID F, LIU Y Q, et al. High throughput detection of antibody self-interaction by bio-layer interferometry[J]. Mabs, 2013, 5(6): 838-841.
[23] HOLMBERG A, BLOMSTERGREN A, NORD O, et al. The biotinstreptavidin interaction can be reversibly broken using water at elevated temperatures[J]. Electrophoresis, 2005, 26(3): 501-510.DOI:10.1002/elps.200410070.
[24] 张峰, 武刚, 于传飞, 等. 应用生物膜干涉技术测定治疗性单抗与新生儿 Fc 受体的亲和力[J]. 中国新药杂志, 2016, 25(16): 1861-1867.
[25] KIM J, HONG S C, HONG J C, et al. Clinical immunosensing of tuberculosis Cfp-10 Antigen in urine using interferometric optical fi ber array[J]. Sensors and Actuators B: Chemical, 2015, 216: 184-191.DOI:10.1016/j.snb.2015.04.046.
[26] ZHANG W J, ZHU Q Q, ZHANG T, et al. Thermal processing effects on peanut allergen Ara h 2 allergenicity in mice and its antigenic epitope structure[J]. Food Chemistry, 2016, 212: 657-662.DOI:10.1016/j.foodchem.2016.06.036.
[27] SAYERS R, JOHNSON P, MARSH J, et al. The effect of thermal processing on the behaviour of peanut allergen peptide targets used in multiple reaction monitoring mass spectrometry experiments[J].Analyst, 2016, 141(13): 4130-4141. DOI:10.1039/C6AN00359A.
[28] WU Z H, ZHOU N L, XIONG F Q, et al. Allergen composition analysis and allergenicity assessment of Chinese peanut cultivars[J]. Food Chemistry, 2016, 196: 459-465. DOI:10.1016/j.foodchem.2015.09.070.
[29] 詹少德. 花生过敏原Ara h 2免疫亲和层析分离方法的建立[D]. 南昌:南昌大学, 2016: 19-20.
[30] 李坤, 连君, 朱瑾, 等. 还原协同加热处理对花生过敏原Ara h 2结构及抗原性的影响[J]. 食品科学, 2017, 38(11): 89-94. DOI:10.7506/spkx1002-6630-201711015.
[31] 赵瑞芳, 吴志华, 连君, 等. 加工导致的花生过敏原蛋白结构变化及其对性质的影响[J]. 食品工业科技, 2015, 36(23): 386-390.DOI:10.13386/j.issn1002-0306.2015.23.072.
[32] MILLS E, SANCHO A I, RIGBY N M, et al. Impact of food processing on the structural and allergenic properties of food allergens[J]. Molecular Nutrition and Food Research, 2009, 53(8):963-969. DOI:10.1002/mnfr.200800236.
[33] 李颖超. 加工处理对花生致敏原的影响及其机理[D]. 无锡: 江南大学, 2016: 1-3.
[34] BLANC F, VISSERS Y M, ADEL-PATIENT K, et al. Boiling peanut Ara h 1 results in the formation of aggregates with reduced allergenicity[J]. Molecular Nutrition and Food Research, 2011, 55(12):1887-1894. DOI:10.1002/mnfr.201100251.
[35] MONDOULET L, PATY E, DRUMARE M, et al. Influence of thermal processing on the allergenicity of peanut proteins[J]. Journal of Agricultural and Food Chemistry, 2005, 53(11): 4547-4553.DOI:10.1021/jf050091p.
[36] TURNER P J, MEHR S, SAYERS R, et al. Loss of allergenic proteins during boiling explains tolerance to boiled peanut in peanut allergy[J].Journal of Allergy and Clinical Immunology, 2014, 134(3): 751-753.DOI:10.1016/j.jaci.2014.06.016.
[37] CABANILLAS B, CUADRADO C, RODRIGUEZ J, et al. Potential changes in the allergenicity of three forms of peanut after thermal processing[J]. Food Chemistry, 2015, 183: 18-25. DOI:10.1016/j.foodchem.2015.03.023.
[38] STARKL P, KRISHNAMURTHY D, SZALAI K, et al. Heating affects structure, enterocyte adsorption and signalling, as well as immunogenicity of the peanut allergen Ara h 2[J]. The Open Allergy Journal, 2011, 4: 24-34. DOI:10.2174/1874838401104010024.
[39] 张雅君, 张浩, 杨选, 等. 花生主要致敏物质及其脱敏方法研究进展[J].食品科学, 2014, 35(17): 312-318. DOI:10.7506/spkx1002-6630-201417059.
[40] 丛艳君, 薛文通, 张惠, 等. 加工方式和蛋白提取方法对花生蛋白致敏性的影响[J]. 食品科学, 2007, 28(11): 207-210. DOI:10.3321/j.issn:1002-6630.2007.11.045.
[41] WALCZYK N E, SMITH P M, TOVEY E R, et al. Peanut protein extraction conditions strongly inf l uence yield of allergens Ara h 1 and 2 and sensitivity of immunoassays[J]. Food Chemistry, 2017, 221:335-344. DOI:10.1016/j.foodchem.2016.10.063.
[42] MALEKI S J, CHUNG S Y, CHAMPAGNE E T, et al. The effects of roasting on the allergenic properties of peanut proteins[J]. Journal of Allergy and Clinical Immunology, 2000, 106(4): 763-768.DOI:10.1067/mai.2000.109620.
Detection of the Binding Capacity between Peanut Protein and Serum IgE from Peanut Allergy Sufferers Using Biolayer Interferometry
ZHANG Ying1,2, LI Kun1,3, YAN Qi1,2, CHEN Hongbing1,4, WU Zhihua1,4,*
(1. State Key Laboratory of Food Science and Technology, Nanchang University, Nanchang 330047, China;2. School of Food Science and Technology, Nanchang University, Nanchang 330031, China;3. School of Environment & Chemical Engineering, Nanchang University, Nanchang 330031, China;4. Sino-German Joint Research Institute, Nanchang University, Nanchang 330047, China)
Abstract:In the present study, an approach to detect the binding capacity between peanut protein and serum IgE from patients with peanut allergy was explored using biolayer interferometry (BLI). For this purpose, the experiment was designed using a streptavidin (SA) dip and read biosensor, biotin labeled goat anti-human IgE antibody, the serum pool of patients with peanut allergy and peanut proteins. The optimized conditions for sensor modification were as follows: immobilization of the 100-fold diluted IgE for 20 min before being bound to the 10-fold diluted serum overnight. After being washed to baseline online, peanut protein (1 mg/mL) was bound to the sensor for 3 600 s and then dissociated for 120 s. This method was applied to detect the IgE binding capacity of peanut protein subjected to different thermal treatments and compare with enzyme linked immunosorbent assay (ELISA). The results showed that this method could directly evaluate the IgE binding capacity of allergenic protein and had good consistency with the ELISA results with correlation coefficient of 0.91. After frying treatment, the IgE binding capacity of peanut protein increased but decreased after boiling and roasting treatments.Protein extracted from thermally processed peanuts without shells had a stronger IgE binding capacity than that from thermally processed peanuts with shells.
Keywords:peanut protein; IgE; biolayer interferometry; IgE binding capacity; thermal processing
ZHANG Ying, LI Kun, YAN Qi, et al. Detection of the binding capacity between peanut protein and serum IgE from peanut allergy sufferers using biolayer interferometry[J]. Food Science, 2018, 39(22): 256-262. (in Chinese with English abstract)DOI:10.7506/spkx1002-6630-201822039. http://www.spkx.net.cn
引文格式:张英, 李坤, 颜琪, 等. 生物膜干涉法检测花生蛋白与花生过敏患者血清IgE的结合能力[J]. 食品科学, 2018, 39(22):256-262. DOI:10.7506/spkx1002-6630-201822039. http://www.spkx.net.cn
文章编号:1002-6630(2018)22-0256-07
文献标志码:A
中图分类号:R392.33
DOI:10.7506/spkx1002-6630-201822039
*通信作者简介:吴志华(1976—),男,教授,博士,研究方向为食品科学。E-mail:wuzhihua@ncu.edu.cn
第一作者简介:张英(1995—),女,硕士研究生,研究方向为食品科学。E-mail:1164017709@qq.com
食品科学与技术国家重点实验室自主探索项目(SKLF-ZZB-201514)
食品科学与技术国家重点实验室目标导向课题(SKLF-ZZA-201612);
江西省主要学科学术和技术带头人资助计划项目(20172BCB22003);
国家自然科学基金地区科学基金项目(31660446);
基金项目:国家高技术研究发展计划(863计划)项目(2013AA102205);国家自然科学基金面上项目(31771924);
收稿日期:2017-08-24