表1 流动相梯度洗脱条件
Table 1 Eluent gradient conditions
孙 星,闫小龙,杨邦保,丁 悦,余向阳*
(农业农村部农产品质量安全控制技术与标准重点实验室,农业农村部农产品质量安全风险评估实验室(南京),江苏 南京 210014)
摘 要:采用QuEChERS前处理方法结合高效液相色谱-串联质谱测定40%丙硫·戊唑醇悬浮剂中丙硫菌唑及其代谢物硫酮菌唑在小麦和土壤中的残留量。经方法验证,丙硫菌唑及其代谢物硫酮菌唑在仪器中检出限为2×10-3ng,方法定量限为0.02 mg/kg。丙硫菌唑在小麦籽粒、小麦植株和土壤中的添加回收率分别为87.3%~103.0%、93.6%~100.3%和85.0%~100.5%;硫酮菌唑在小麦籽粒、小麦植株和土壤中的添加回收率分别为93.2%~109.9%、92.7%~101.9%和81.7%~95.6%。研究残留降解动态,结果表明丙硫菌唑及其代谢物硫酮菌唑在小麦植株中降解动态符合一级动力学指数模型,丙硫菌唑在江苏、河南和北京三地小麦植株中的半衰期分别为4.4、1.8 d和3.3 d,硫酮菌唑在江苏、河南和北京三地小麦植株中的半衰期分别为6.2、2.9 d和6.0 d。丙硫菌唑在小麦籽粒、小麦植株和土壤中的最终残留量分别为<0.02、<0.02~0.225 mg/kg和<0.02~0.033 mg/kg;硫酮菌唑在小麦籽粒、小麦植株和土壤中的最终残留量分别为<0.02、<0.02~0.282 mg/kg和<0.02~0.049 mg/kg。40%丙硫·戊唑醇悬浮剂以300 g a.i./hm2剂量,施药2 次时,丙硫菌唑在小麦籽粒中的最终残留浓度符合GB 2763—2016要求,可以安全使用。
关键词:丙硫菌唑;硫酮菌唑;QuEChERS;高效液相色谱-串联质谱;降解;残留
丙硫菌唑是一种新型广谱三唑硫酮类杀菌剂,由拜耳公司开发[1],主要用于防治由子囊菌、担子菌以及半知菌引起的病害[2],其作用机理是抑制真菌中甾醇的前体——羊毛甾醇或2,4-亚甲基二氢羊毛甾醇14位上的脱甲基化作用,即脱甲基化抑制剂[3]。丙硫菌唑具有毒性低、无致畸、致突变性、对胚胎无毒性、对人和环境安全等特点,具有很好的内吸活性,可以优异的保护、治疗和根除活性,并且持效期长,具有广谱的杀菌活性[4-5]。2004年上市以来,丙硫菌唑在谷类、麦类、豆类农产品中广泛应用,几乎对麦类所有病害,均有很好的防效[6-7]。丙硫菌唑在作物和土壤中的主要代谢物为其脱硫产物硫酮菌唑[8]。目前关于丙硫菌唑的研究主要集中在毒力测定[9-10]、合成工艺[4-5,11-13]、田间防治效果[7,14]及含量检测分析[15-18]、土壤中的残留消解及转化研究以及对其在土壤中的降解规律进行阐述[8]。鲜见丙硫菌唑在小麦中残留以及降解动态的报道。本实验采用QuEChERS样品前处理方法结合高效液相色谱-串联质谱(high performance liquid chromatography-tandem mass spectrometry,HPLCMS/MS)检测技术,研究丙硫菌唑及其代谢物在小麦和土壤中的残留降解动态和最终残留量,为丙硫菌唑在小麦上的施用剂量和安全间隔期提供科学依据。
98.5 %丙硫菌唑标准品、99%硫酮菌唑标准品 德国Dr. Ehrenstorfer公司;乙腈(分析纯) 天津科密欧化学试剂有限公司;甲醇(色谱级) 德国默克化工技术有限公司;十八烷基键合硅胶吸附剂(C18) 上海安谱实验科技股份有限公司;40%丙硫·戊唑醇悬浮剂(其中丙硫菌唑含量为20%) 溧阳中南化工有限公司。
1290-6470A液相色谱-串联质谱仪 美国Agilent公司;R10.v.v食品切碎搅拌机 法国Robot Coupe公司;QL-901涡流混合器 江苏海门市麒麟医用仪器厂;Talboys数显型多管式旋涡混合器 上海安谱实验科技股份有限公司;AL204十万分之一电子天平 梅特勒-托利多仪器(上海)有限公司;JJ-200百分之一电子天平常州双杰电子有限公司。
1.3.1 田间试验设计
40%丙硫·戊唑醇悬浮剂在小麦植株和土壤中降解动态和最终残留试验按NY/T 788—2004《农药残留试验准则》执行[19],设有空白对照区、低剂量处理区、高剂量处理区和消解动态处理区。降解动态试验:分别与小麦试验地及空白土壤地均匀施药。施药剂量为制剂量75 g/667 m2(450 g a.i./hm2),施药后2 h,1、3、7、10、14、21、30 d采样。植株样本的采集:随机在试验小区内剪取地表以上的全株(去根)1 kg,切碎、混匀后采用四分法留样500 g,装入样本容器中,黏好标签,备用。土壤样本的采集:随机取点5~10 个,用土钻采集0~10 cm的土壤2 kg,除去土壤中的碎石、杂草和植物根茎等杂物,在盆中混合均匀后采用四分法留样500 g,装入样本容器中,黏好标签,备用。最终残留试验:分别设50 g/667 m2(300 g a.i./hm2)与75 g/667 m2(450 g a.i./hm2)低高2 个施药剂量,施药2~3 次,施药间隔期7 d。距离最后1 次施药的间隔时间28、35、42 d采样。植株样本采集:用随机方式在试验小区中剪取土表以上的全株1 kg,切碎、混匀后采用四分法留样500 g,装入样本容器中包扎妥当,黏好标签,备用。小麦籽粒样本采集:用随机方式在小区中剪取稻穗2 kg,装入样本袋中包扎妥当,黏好标签,备用。土壤样本采集:随机取点5~10 个,采用土钻采集0~15 cm的土壤1~2 kg,除去土壤中的碎石、杂草和植物根茎等杂物,装入样本容器中包扎妥当,黏好标签,备用。
1.3.2 样品提取净化
称取5.0 g样品于50 mL离心管中,加20 mL乙腈,数显型多管式旋涡混合器振荡20 min,经5 000 r/min离心,取1 mL上清液转移至5 mL离心管中,氮吹至干,2 mL色谱甲醇定容,加入100 mg无水硫酸镁和50 mg C18填料,旋涡振荡,5 000 r/min离心,取上清液于进样瓶中待测。
1.3.3 HPLC-MS/MS检测条件
色谱条件:Agilent ZORBAX Eclipse Plus C18色谱柱(2.1 mm×50 mm,1.8 μm);柱温35 ℃;进样体积2.0 µL;流动相及洗脱程序见表1。
表1 流动相梯度洗脱条件
Table 1 Eluent gradient conditions

质谱条件:电喷雾离子源;多反应监测正负离子扫描;毛细管电压3 500 V;干燥气温度300 ℃;干燥气流速6 L/min;喷雾器压力25 psi;鞘流气温度250 ℃;鞘流气流速5 L/min;采集参数见表2。
表2 丙硫菌唑及脱硫代谢物硫酮菌唑的质谱参数
Table 2 MS parameters for determination of prothioconazole and prothioconazole-desthio
注:*.定量离子。
HPLC-MS/MS测定采用标准曲线法定量,组分含量按公式(1)计算:
式中:Xi为试样中北侧组分含量/(mg/kg);Ci为从标准工作曲线得到的试样溶液中被测组分的质量浓度/(mg/L);M为被测样品质量/g;Vm为试样提取液的总体积/mL;V1为试样移取提取液的体积/mL;V2为试样定容体积/mL。
1.3.4 降解半衰期的计算
丙硫菌唑及硫酮菌唑消解反应动力学方程按公式(2)计算,降解半衰期按公式(3)计算[20]:
式中:Ct为t时刻丙硫菌唑及硫酮菌唑的残留含量/(mg/kg);C0为丙硫菌唑及硫酮菌唑的初始质量浓度/(mg/L);k为降解速率常数/d-1;t1/2为降解半衰期/d。
采用甲醇与水的梯度洗脱为HPLC-MS/MS的流动相,正负离子扫描反应离子监测模式检测丙硫菌唑与硫酮菌唑,保证丙硫菌唑与硫酮菌唑有较高的灵敏度和准确度。进入一级质谱后,在正离子检测方式下,硫酮菌唑产生稳定的[M+H]+分子离子峰,即m/z 312.1;在负离子检测方式下,丙硫菌唑产生稳定的[M-H]-准分子离子峰,即m/z 342.0。进行二级质谱扫描,得到硫酮菌唑的特征碎片离子为m/z 70.1和m/z 124.9;丙硫菌唑的特征碎片离子为m/z 99.9和m/z 125.0。分别选取m/z 70.1和m/z 99.9为硫酮菌唑和丙硫菌唑的定量离子,m/z 124.9和m/z 125.0为硫酮菌唑和丙硫菌唑的定性离子。
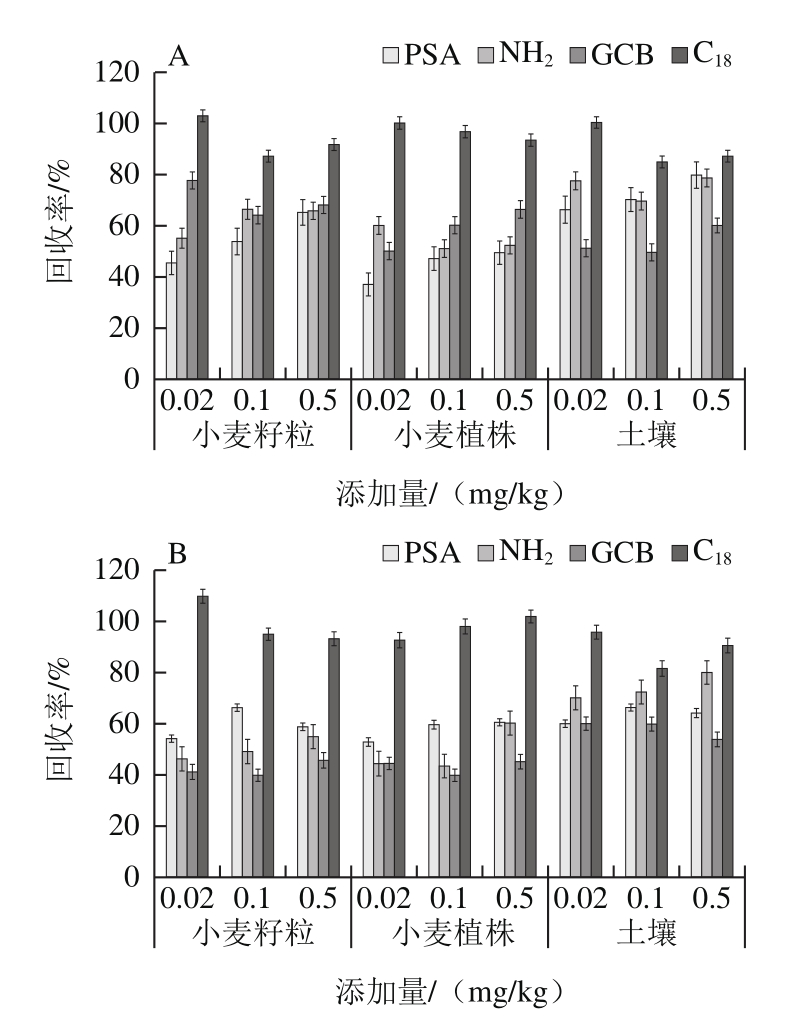
图1 4 种净化方式下丙硫菌唑(A)及硫酮菌唑(B)在小麦籽粒、小麦植株及土壤中的回收率情况
Fig. 1 Recoveries of prothioconazole (A) and prothioconazole-desthio (B)in wheat grains, wheat straw and soil with four purification methods
乙腈是农药残留检测方面常用提取溶剂,难以提取农作物中糖、蛋白质类化合物,对绝大多数农药有较高的回收率[21],因此选择乙腈作为本实验提取试剂,以确保目标化合物的有效提取并使提取液中的干扰物较少,本实验借鉴QuEChERS净化方法[22-29],比较了PSA、NH2、C18及GCB 4 种填料在净化上的效果,如图1所示,PSA、NH2及GCB填料虽然除杂效果好,但对丙硫菌唑吸附明显,影响回收率,C18除杂效果稍弱,但不影响回收率。为保持良好的添加回收率,综合考虑本实验使用100 mg无水硫酸镁和50 mg C18作为QuEChERS处理的吸附剂。
2.3.1 线性范围及检出限结果
使用空白溶剂,配制标准工作溶液1、2、5、10、20、50、100 μg/L和200 μg/L,在1.3.3节液相色谱-质谱条件下测定,以丙硫菌唑和硫酮菌唑标准溶液的质量浓度为横坐标,峰面积为纵坐标,绘制标准工作曲线。其中,丙硫菌唑线性回归方程为y=83 815x-17.443,r2=0.996 8;硫酮菌唑线性回归方程为y=94 182x-6.143 3,r2=0.999 8。峰面积与溶液质量浓度呈良好的线性关系。以3 倍信噪比为仪器检出限,丙硫菌唑及其代谢物的检出限均为2×10-3ng。
2.3.2 方法准确度、精密度和灵敏度测定结果
表3 丙硫菌唑及硫酮菌唑在小麦籽粒、小麦植株及土壤中的添加回收率和相对标准偏差(n=5)
Table 3 Recoveries and relative standard deviations (RSDs) for prothioconazole and prothioconazole-desthio in wheat grains, wheat straw and soil (n= 5)
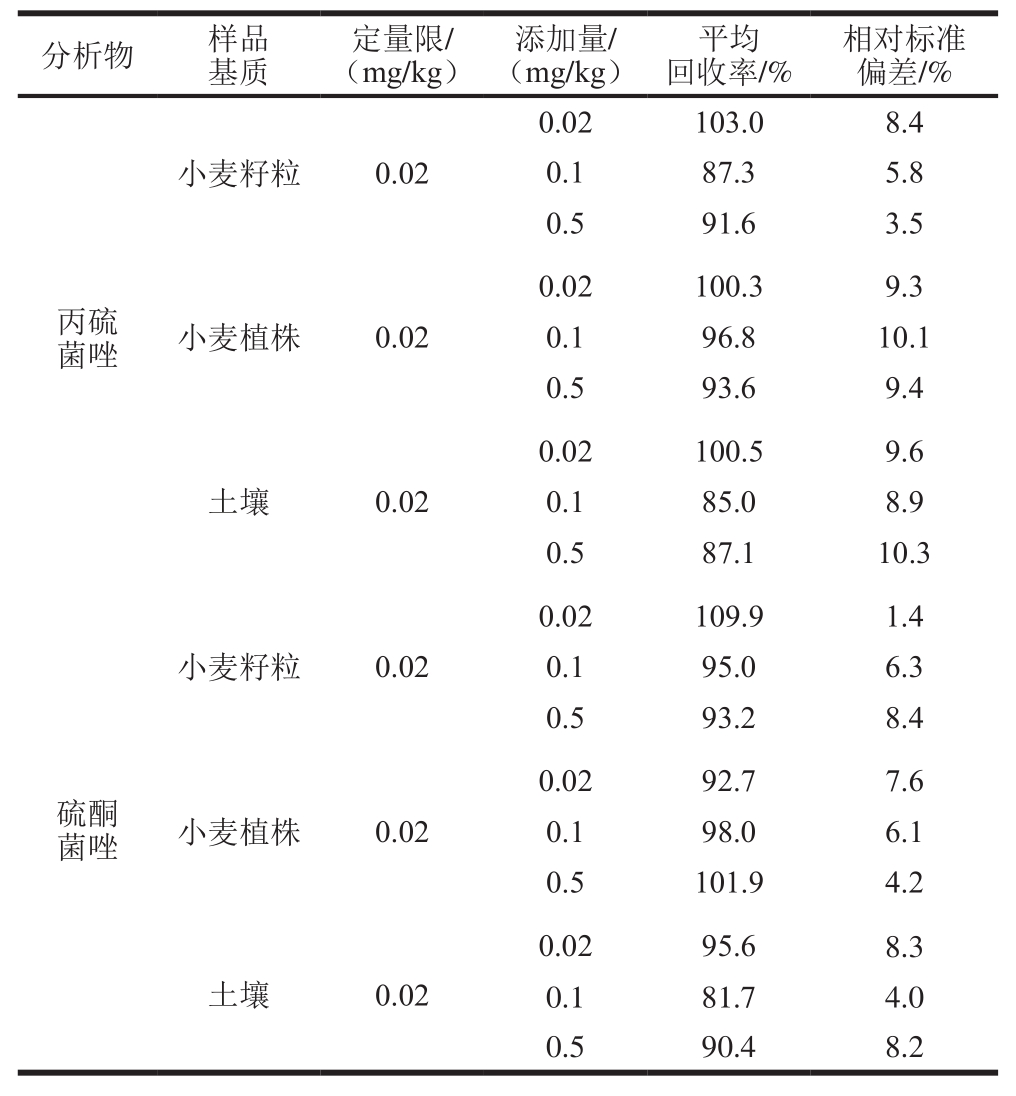
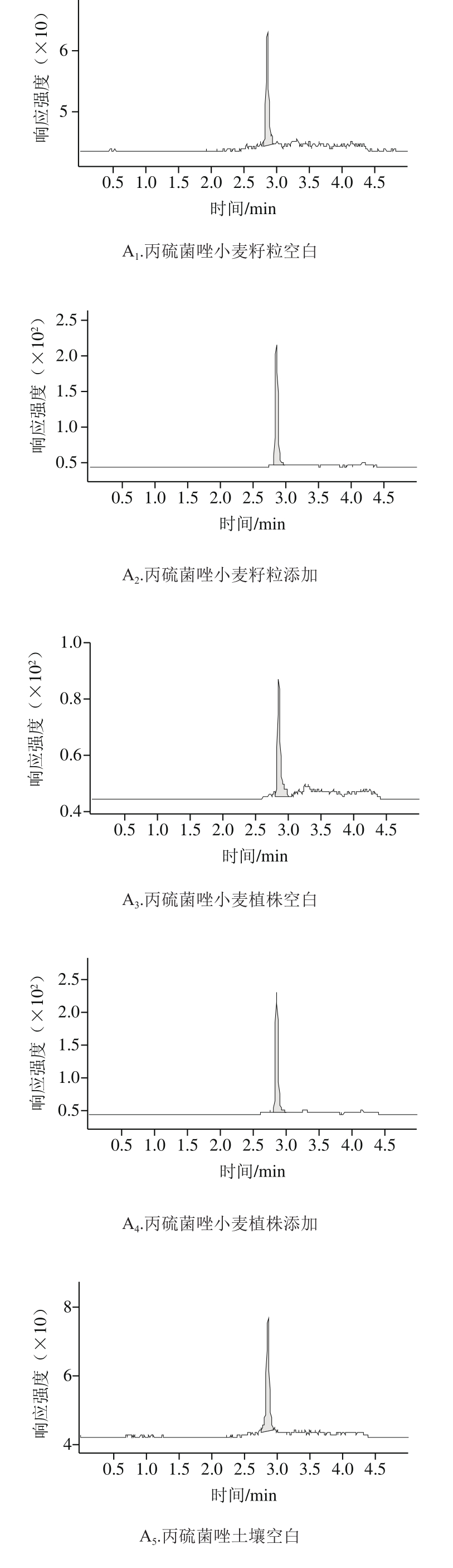
如表3所示,在0.02、0.1 mg/kg和0.5 mg/kg 3 个添加水平下,丙硫菌唑在小麦籽粒、小麦植株和土壤中回收率分别为87.3%~103.0%、93.6%~100.3%和85.0%~100.5%,相对标准偏差分别为3.5%~8.4%、9.3%~10.1%和8.9%~10.3%;硫酮菌唑在小麦籽粒、小麦植株和土壤中回收率分别为93.2%~109.9%、92.7%~101.9%和81.7%~95.6%,相对标准偏差分别为1.4%~8.4%、4.2%~7.6%和4.0%~8.3%。各样本的添加回收率和变异系数在允许范围内,符合NY/T 788—2004的要求。空白添加典型图谱见图2。


图2 丙硫菌唑及硫酮菌唑在小麦籽粒、小麦植株及土壤中的空白与添加回收样品HPLC-MS/MS图
Fig. 2 HPLC-MS/MS pro fi les of prothioconazole and prothioconazoledesthio in wheat grains, wheat straw and soil
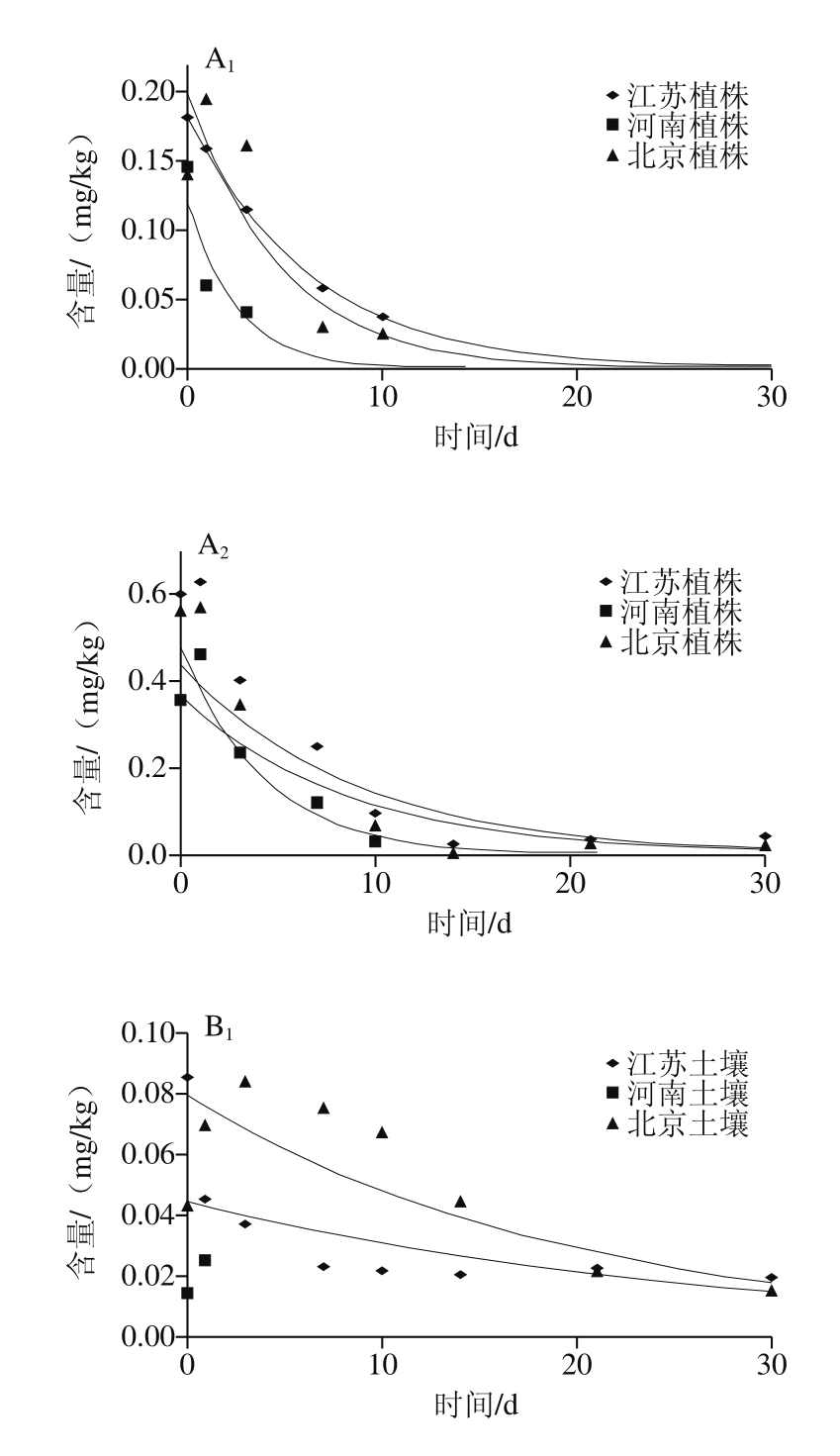
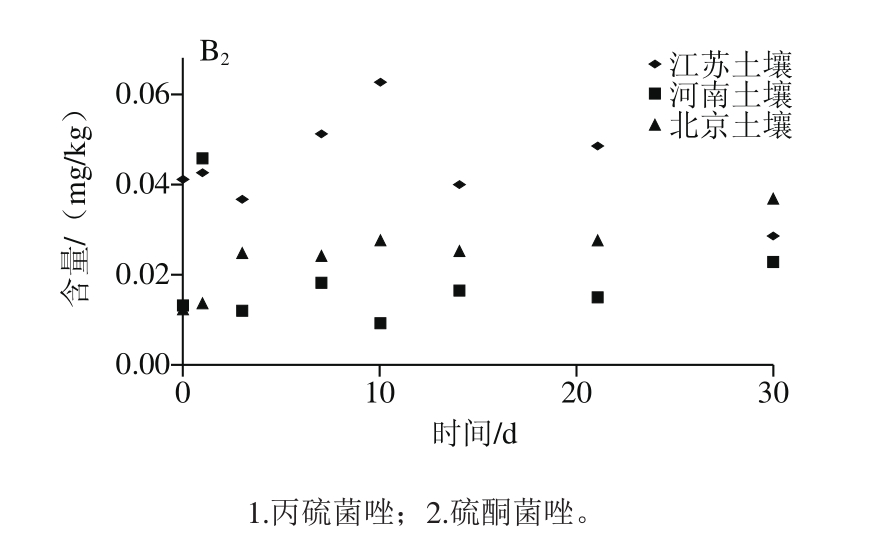
图3 丙硫菌唑及硫酮菌唑在小麦植株(A)及土壤(B)的消解动态曲线
Fig. 3 Dynamic curves of prothioconazole and prothioconazole-desthio residue in wheat straw (A) and soil (B)
江苏、河南和北京三地中丙硫菌唑在植株的原始沉积量分别为0.182、0.148 mg/kg和0.142 mg/kg,在土壤中的原始沉积量分别为0.086、0.025 mg/kg和0.044 mg/kg,其残留量与施药后间隔时间呈指数关系,降解动态符合一级动力学方程回归曲线。如图3所示,植株消解动力学方程:江苏试验点为Ct=0.184 7e-0.159t,R2=0.999 0,半衰期t1/2=4.4 d;河南试验点为Ct=0.123 7e-0.395t,R2=0.824 2,半衰期t1/2=1.8 d;北京试验点为Ct=0.202 6e-0.211t,R2=0.872 6,半衰期t1/2=3.3 d。河南土壤中残留量的检出值少于3 个,未作回归曲线;江苏和北京土壤中消解动力学方程:江苏试验点为Ct=0.044 7e-0.037t,R2=0.555 1,半衰期t1/2=18.7 d;北京试验点为Ct=0.079 8e-0.050t,R2=0.740 1,半衰期t1/2=13.9 d。
江苏、河南和北京三地中硫酮菌唑在植株的原始沉积量分别为0.599、0.361 mg/kg和0.566 mg/kg,在土壤中的原始沉积量分别为0.041、0.014 mg/kg和0.013 mg/kg,植株中残留量与施药后间隔时间呈指数关系,降解动态符合一级动力学方程回归曲线。如图3B2所示,土壤中残留量与施药后间隔时间不呈指数关系,这可能与土壤环境更复杂有关,未作回归曲线。植株消解动力学方程:江苏试验点为Ct=0.438 6e-0.111t,R2=0.709 2,半衰期t1/2=6.2 d;河南试验点为Ct=0.484 4e-0.236t,R2=0.934 2,半衰期t1/2=2.9 d;北京试验点为Ct=0.365 1e-0.115t,R2=0.738 1,半衰期t1/2=6.0 d。
如表4所示,小麦收获时采收,在一年三地小麦籽粒样品中均未检出丙硫菌唑和硫酮菌唑的残留,丙硫菌唑在小麦植株中残留量为<0.02~0.225 mg/kg,在土壤中残留量为<0.02~0.033 mg/kg;硫酮菌唑在小麦植株中残留量为<0.02~0.282 mg/kg,在土壤中残留量为<0.02~0.049 mg/kg。
表4 丙硫菌唑及硫酮菌唑在小麦籽粒、小麦植株及土壤中的残留量
Table 4 Residues of prothioconazole and prothioconazole-desthio in wheat grains, wheat straw and soil

本研究采用QuEChERS前处理方法结合HPLC-MS/MS检测技术,定性、定量研究丙硫菌唑及其代谢物硫酮菌唑在小麦籽粒、小麦植株和土壤中的残留降解动态和最终残留量。研究结果发现河南地区丙硫菌唑与硫酮菌唑的半衰期低于江苏和北京两地,江苏和北京这两地在2016年平均日照时间约为250 h,而河南地区2016年的平均日照时间在350 h以上,这可能是随着日照时间的延长从而加速了丙硫菌唑与硫酮菌唑的降解。植株动态样品中丙硫菌唑的原始沉积量均小于硫酮菌唑的原始沉积量,丙硫菌唑的半衰期比硫酮菌唑半衰期短。相同间隔期的终残样品中丙硫菌唑检出值均小于硫酮菌唑的检出值,说明在自然环境中丙硫菌唑很快转化为硫酮菌唑。GB 2763—2016《食品中农药最大残留限量》[30]中丙硫菌唑的残留定义为丙硫菌唑脱硫代谢物(硫酮菌唑),以丙硫菌唑计,小麦中的临时限量标准为0.1 mg/kg;食品法典委员会中丙硫菌唑的残留定义为硫酮菌唑。现有定义中均未涉及丙硫菌唑的残留,本实验同时研究丙硫菌唑和硫酮菌唑的消解趋势,结果表明,丙硫菌唑很快转化为硫酮菌唑,硫酮菌唑残效期长于丙硫菌唑残效期。在三地的小麦籽粒中丙硫菌唑及其代谢物硫酮菌唑均未检出,但植株中硫酮菌唑检出值均高于丙硫菌唑,因此,与丙硫菌唑相比,硫酮菌唑在小麦中的残留量更需引起人们的关注。
丙硫菌唑在小麦植株和土壤中降解动态符合一级动力学指数模型,硫酮菌唑在小麦植株中降解动态符合一级动力学指数模型,土壤中降解动态不符合一级动力学指数模型。丙硫菌唑在小麦植株中半衰期为1.8~4.4 d,土壤中的半衰期分别为13.9~18.7 d;硫酮菌唑在小麦植株中半衰期为2.9~6.2 d。40%丙硫·戊唑醇悬浮剂以300 g a.i./hm2推荐剂量及450 g a.i./hm2剂量施药时,丙硫菌唑及其代谢物硫酮菌唑在小麦籽粒中均未检出。表明在推荐使用剂量条件下,在小麦上施用丙硫菌唑是安全的。
参考文献:
[1] 柏亚罗. 世界农药市场概况及新产品研发[J]. 中国农药, 2012(1): 5-22.
[2] 白雪, 周成合, 米佳丽. 三唑类化合物研究与应用[J]. 化学研究与应用, 2007, 19(7): 721-729. DOI:10.3969/j.issn.1004-1656.2007.07.001.
[3] PARKER J E, WARRILOW A G, COOLS H J, et al. Mechanism of binding of prothioconazole to Mycosphaerella graminicola CYP51 differs from that of other azole antifungals[J]. Applied &Environmental Microbiology, 2011, 77(4): 1460-1465. DOI:10.1128/AEM.01332-10.
[4] 付庆, 沈德隆, 袁其亮. 丙硫菌唑的合成路线述评[J]. 河南化工,2005, 22(5): 8-10. DOI:10.3969/j.issn.1003-3467.2005.05.003.
[5] 王美娟, 廖道华, 曾仲武, 等. 丙硫菌唑的合成[J]. 农药, 2009, 48(9):172-173; 201. DOI:10.3969/j.issn.1006-0413.2009.03.005.
[6] 张爱萍, 李勇. 新型三唑硫酮类杀菌剂丙硫菌唑的研究进展[J].今日农药, 2011(6): 27-28.
[7] 陈宣明, 赵杰, 吴公信, 等. 40%丙硫菌唑悬浮剂对黄瓜白粉病的防治效果[J]. 农药, 2015, 54(4): 299-300. DOI:10.16820/j.cnki.1006-0413.2015.04.020.
[8] 石凯威, 李莉, 刘丰茂. 丙硫菌唑及代谢物硫酮菌唑在土壤中的残留分析方法及消解[J]. 农药学学报, 2016, 18(5): 659-663.DOI:10.16801/j.issn.1008-7303.2016.0093.
[9] SCHISLER D A, BOEHM M J, PAUL P A, et al. Reduction of fusarium head blight using prothioconazole and prothioconazole tolerant variants of the fusarium head blight antagonist Cryptococcus flavescens OH 182.9[J]. Biological Control, 2015, 86: 36-45.DOI:10.1016/j.biocontrol.2015.04.002.
[10] 王斌, 赵杰, 司乃国, 等. 烯肟菌酯与丙硫菌唑混配在防治禾谷类作物病害上的应用[J]. 农药, 2017, 56(3): 231-234. DOI:10.16820/j/cnki.1006-0413.2017.03.022.
[11] 关云飞, 孙克, 张敏恒. 丙硫菌唑合成方法述评[J]. 农药, 2014, 53(9):696-698. DOI:10.16820/j.cnki.1006-0413.2014.09.023.
[12] 余波. 丙硫菌唑的合成工艺优化[J]. 农药, 2017, 56(2): 105-107.DOI:10.16820/j.cnki.1006-0413.2017.02.007.
[13] 秦永其. 丙硫菌唑的工艺改进[J]. 农药, 2017, 56(4): 250-252.DOI:10.16820/j.cnki.1006-0413.2017.04.004.
[14] 王斌, 孙芹, 吴公信, 等. 40%丙硫菌唑悬浮剂对番茄叶霉病的防效试验[J]. 农药, 2016, 55(1): 65-66. DOI:10.16820/j.cnki.1006-0413.2016.01.018.
[15] 徐仲玉, 周翾, 马红梅, 等. 反相高效液相色谱法测定丙硫菌唑的含量[J]. 农药, 2009, 48(9): 656-657. DOI:10.16820/j.cnki.1006-0413.2009.09.010.
[16] 刘淑杰, 孙克, 张敏恒. 丙硫菌唑分析方法述评[J]. 农药, 2014, 53(9):699-701. DOI:10.16820/j.cnki.1006-0413.2014.09.024.
[17] 张万昌. 40%丙硫菌唑悬浮剂的高效液相色谱测定方法[J]. 现代农药, 2016, 15(4): 36-37. DOI:10.3969/j.issn.1671-5284.2016.04.011.
[18] 史晓梅, 金芬, 杜欣蔚, 等. 液相色谱-串联质谱法测定花生中丙硫菌唑及其脱硫代谢物[J]. 分析化学, 2012, 40(8): 1284-1288.DOI:10.3724/sp.j.1096.2012.11265.
[19] 农业部. 农药残留试验准则: NY/T 788—2004[S]. 北京: 中国农业出版社, 2004: 3-7.
[20] GAO J P, GARRISON W, HOEHAMER C, et a1. Uptake and phytotransformation of organophosphorus pesticides by axenically cultivated aquatic plants[J]. Journal of Agricultural and Food Chemistry, 2000, 48(12): 6114-6120. DOI:10.1021/jf9904968.
[21] 刘荔彬, 端裕树, 秦亚萍, 等. 农产品中多种残留农药的气相色谱质谱快速检测[J]. 分析化学, 2006, 34(6): 783-786. DOI:10.3321/j.issn:0253-3820.2006.06.009.
[22] LEHOTAY S J. Quick, Easy, cheap, effective, rugged, and safe approach for determining pesticide residues[J]. Pesticide Protocols,2006, 19: 239-261. DOI:10.1385/1-59259-929-X:239.
[23] LEHOTAY S J. Determination of pesticide residues in foods by acetonitrile extraction and partitioning with magnesium sulfate:collaborative study[J]. Journal of AOAC International, 2007, 90(2):485-520.
[24] RASHID A, NAWAZ S, BARKER H, et al. Development of a simple extraction and clean-up procedure for determination of organochlorine pesticides in soil using gas chromatography-tandem mass spectrometry[J]. Journal of Chromatography A, 2010, 1217(17):2933-2939. DOI:10.1016/j.chroma.2010.02.060.
[25] 李福琴, 石丽红, 王飞, 等. QuEChERS-液相色谱-串联质谱法同时检测土壤和柑橘中吡唑醚菌酯、甲基硫菌灵及其代谢物多菌灵的残留[J]. 色谱, 2017, 35(6): 620-626. DOI:10.3724/SP.J.1123.2017.01031.
[26] 王建华, 葛敏敏, 张慧丽, 等. QuEChERS法-液相色谱-串联质谱法测定蔬菜中7 种农药及其代谢物的残留量[J]. 食品科学, 2017,38(20): 235-241. DOI:10.7506/spkx1002-6630-201720034.
[27] 叶倩, 黄健祥, 骆冲, 等. QuEChERS-超高效液相色谱-串联质谱法快速测定3 种叶菜中矮壮素和丙环唑残留[J]. 分析科学学报, 2017,33(3): 342-346. DOI:10.13526/j.issn.1006-6144.2017.03.010.
[28] 孙星, 丁悦, 汪佳蕾, 等. QuEChERS-高效液相色谱-串联质谱法测定果蔬中多效唑残留[J]. 食品科学, 2014, 35(8): 76-79.DOI:10.7506/spkx1002-6630-201408014.
[29] 粟有志, 周均, 孟茹, 等. QuEChERS-液相色谱-串联质谱法测定果蔬及其制品中噻霉酮残留[J]. 农药学学报, 2016, 18(1): 135-140.DOI:10.16801/j.issn.1008-7303.2016.0018.
[30] 农业部. 食品中农药最大残留限量: GB 2763—2016[S]. 北京: 中国农业出版社, 2016.
Degradation Dynamics and Residue Analysis of Prothioconazole and Its Metabolite Prothioconazole-Desthio in Wheat and Soil by QuEChERS-High Performance Liquid Chromatography-Tandem Mass Spectrometry
SUN Xing, YAN Xiaolong, YANG Bangbao, DING Yue, YU Xiangyang*
(Key Laboratory of Control Technology and Standard for Agro-Product Safety and Quality, Ministry of Agriculture and Rural Affairs,Key Laboratory of Agro-Product Safety Risk Evaluation (Nanjing), Ministry of Agriculture and Rural Affairs, Nanjing 210014, China)
Abstract:The degradation dynamics and residues of prothioconazole and its metabolite prothioconazole-desthio from 40% prothioconazole + tebuconazole suspension concentrate (SC) in wheat and soil were investigated by QuEChERS-high performance liquid chromatography-tandem mass spectrometry (HPLC-MS/MS). The limit of detection (LOD) for both prothioconazole and prothioconazole-desthio was 2 × 10-3ng, and the limit of quantitation (LOQ) was 0.02 mg/kg. The recoveries of prothioconazole from spiked wheat grains and straw and soil were 87.3%-103.0%, 93.6%-100.3% and 85.0%-100.5%, respectively, and the recoveries of prothioconazole-desthio were 93.2%-109.9%, 92.7%-101.9% and 81.7%-95.6%,respectively. The degradation of prothioconazole and its metabolite in wheat straws was fi tted to a fi rst-order reaction kinetic model. The half-lives of degradation of prothioconazole in wheat straw from Jiangsu, Henan and Beijing were 4.4, 1.8 and 3.3 d, respectively. The half-lives of degradation of prothioconazole-desthio in wheat straw from Jiangsu, Henan and Beijing were 6.2, 2.9 and 6.0 d, respectively. The fi nal residues of prothioconazole in wheat grains and straw and soil were < 0.02, <0.02-0.225 and < 0.02-0.033 mg/kg, respectively. The fi nal residues of prothioconazole-desthio were < 0.02, < 0.02-0.282 and < 0.02-0.049 mg/kg, respectively. The spray application of 40% prothioconazole + tebuconazole SC twice at a dose of 300 g a.i./hm2gave a fi nal residual prothioconazole concentration in wheat grains consistent with the national standard(GB 2763-2016); thus, it can be safely used.
Keywords:prothioconazole; prothioconazole-desthio; QuEChERS; HPLC-MS/MS; degradation; residue DOI:10.7506/spkx1002-6630-201822041
SUN Xing, YAN Xiaolong, YANG Bangbao, et al. Degradation dynamics and residue analysis of prothioconazole and its metabolite prothioconazole-desthio in wheat and soil by QuEChERS-high performance liquid chromatography-tandem mass spectrometry[J]. Food Science, 2018, 39(22): 269-275. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201822041. http://www.spkx.net.cn
引文格式:孙星, 闫小龙, 杨邦保, 等. QuEChERS-HPLC-MS/MS法分析丙硫菌唑及其代谢物在小麦和土壤中的残留[J]. 食品科学,2018, 39(22): 269-275. DOI:10.7506/spkx1002-6630-201822041. http://www.spkx.net.cn
文章编号:1002-6630(2018)22-0269-07
文献标志码:A
中图分类号:S482
*通信作者简介:余向阳(1972—),男,研究员,博士,研究方向为食品安全分析。E-mail:yuxy@jaas.ac.cn
第一作者简介:孙星(1985—),男,助理研究员,学士,研究方向为食品安全分析。E-mail:sun0519@sohu.com
基金项目:“十三五”国家重点研发计划重点专项(2016YFD0200203);农药登记残留试验项目(CL20216003)
收稿日期:2017-11-27