江荣花1,苏 亮2,任鹏程2,孙琳珺1,王 翔1,刘 箐1,董庆利1,*
(1.上海理工大学医疗器械与食品学院,上海 200093;2.国家食品安全风险评估中心,北京 100022)
摘 要:为完善低温乳化香肠中单核细胞增生李斯特氏菌的风险管理研究,采用检出率-剂量曲线法,同时基于本课题组之前已完成的低温乳化香肠中单核细胞增生李斯特氏菌定量风险评估研究结果,分别制定整合和未整合交叉污染过程低温乳化香肠的食品安全目标(food safety objective,FSO)。基于低温乳化香肠的FSO值,进一步推算,制定相应的执行目标、执行标准以及微生物标准(microbiological criteria,MC)等,同时采用操作特征曲线对已制定的采样方案和MC性能进行评估。结果表明:整合和未整合交叉污染过程低温乳化香肠的FSO值分别为0.36(lg(CFU/g))、-4.58(lg(CFU/g))。整合交叉污染的标准制定结果更为严格,且过程中耗费的人力物力更少。未整合交叉污染的过程高估了消费者风险,同时低估了生产者风险。
关键词:低温乳化香肠;单核细胞增生李斯特氏菌;交叉污染;风险管理;食品安全标准
食品安全标准的制定是风险管理的首要内容,可用于监控消费者感染食源性致病菌的风险。近年来单核细胞增生李斯特氏菌感染事件频发,部分国家均制定相应的食品安全标准,德国、荷兰、加拿大、丹麦和法国规定“即食食品中单核细胞增生李斯特氏菌浓度不可超过2(lg (CFU/g))”,美国和意大利规定“25 g样品中不得检出单核细胞增生李斯特氏菌”[1],我国GB 29921—2013《食品中致病菌限量》规定“25 g熟肉样品中不得检出单核细胞增生李斯特氏菌”[2],而具体的熟肉类别有待进一步探究。
食品安全标准的制定需综合考虑食品加工过程中的处理方式、污染和贮藏过程中食源性致病菌增殖的可能性以及消费者的易感性等因素[3-5]。食品安全目标(food safety objective,FSO)定义了消费时危害的最大频率或最高浓度,可结合检出率-剂量(prevalence-dose,PD)曲线法进行设定[6-7],可用作即食肉制品中单核细胞增生李斯特氏菌的风险管理工具。食品安全期望常基于工厂的执行能力,而工厂执行能力的体现需将FSO转化为执行目标(performance objective,PO)、执行标准(performance criteria,PC)和微生物标准(microbiological criteria,MC)等标准,MC的性能一般用操作特征(operating characteristic,OC)曲线进行描述。
低温乳化香肠是以畜禽肉为主要原料,加入适当辅料经斩拌、灌装、蒸煮和巴氏杀菌等加工工艺,中心温度达到75~85 ℃并保持一定时间而制成的产品。其中,斩拌和灌装过程的交叉污染、烘烤过程的失活以及贮藏过程中的生长对终产品中单核细胞增生李斯特氏菌的污染水平影响尤为显著[8-9]。食品安全标准的制定可对食品加工链进行控制,减少加工过程中单核细胞增生李斯特氏菌的污染以及单核细胞增生李斯特氏菌增长至高浓度的可能性,从而降低食源性李斯特菌病发生的概率。
本实验结合本课题组之前已完成的定量风险评估结果[10]和PD曲线法设定低温乳化香肠的FSO,进而基于已设定的FSO进行推算,制定相应的PO、PC以及MC等食品安全标准,最后用OC曲线对已制定的采样方案和MC性能进行评估,为微生物风险管理工作提供参考,完善风险管理体系。
PD曲线用于描述消费时引起相似风险的不同致病菌检出率和消费剂量的组合,区分可容许和不可容许2 个区域,可测试检出率和剂量的组合风险是否可容许[11]。应用@Risk 5.5软件(美国Palisade公司)建立消费时单核细胞增生李斯特氏菌检出率Pf和每餐消费剂量D之间的非线性关系[12],选用的概率方法按式(1)计算:
式中:R为每年李斯特菌病总事件数;r为单位致病菌导致的发病率;Sall为高风险人群每年消费总餐次。
1.2.1 FSO的制定
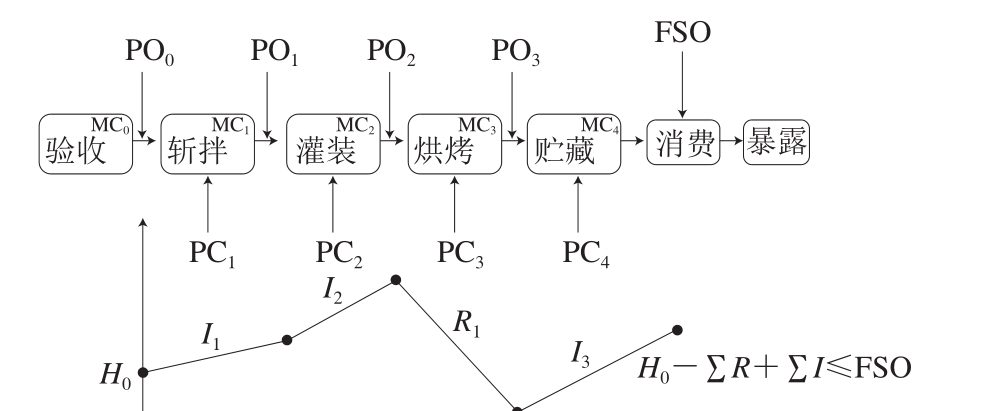
图1 低温乳化香肠加工过程单核细胞增生李斯特氏菌的风险管理模式
Fig. 1 L. monocytogenes risk management during low-temperature emulsified sausage processing
H0.危害的初始水平;I.危害水平增加量;R.危害水平减少量。
单核细胞增生李斯特氏菌从验收至消费整个加工阶段的风险管理如图1所示,参考相关文献[13]得知消费时香肠样品的单核细胞增生李斯特氏菌检出率,同时根据本课题组已完成的香肠中单核细胞增生李斯特氏菌定量风险评估结果[10]确定消费剂量。通过PD曲线测试该检出率和消费剂量组合是否可容许。应用@Risk 5.5软件拟合消费时单核细胞增生李斯特氏菌的浓度分布,同时整合可容许的检出率制定FSO。
1.2.2 PO的制定
应用Microsoft Excel 2010软件进行低温乳化香肠加工过程各环节PO的推算,选用的计算方法如式(2)、(3)所示:
式中:ΣI为危害水平的累积增加量,包括致病菌的污染量和/或生长量;ΣR为危害水平的累积减少量;Z为标准分数,计算方法如式(4)所示;S为默认的标准差(S=0.2,样品中致病菌均匀分布,如液体食品;S=0.4,样品中致病菌中度均匀分布,如碎牛肉;S=0.8,样品中致病菌不均匀分布,如固体食品[14])。
式中:μ、σ分别为致病菌浓度分布的均值、标准差。
1.2.3 PC的制定
PC为危害水平的减少量或最大可增加量,应用Microsoft Excel 2010软件对低温乳化香肠加工过程各环节PC进行推算,计算方法如式(5)所示[15]:
式中:H0为危害的初始水平,ΣI和ΣR如1.2.2节所述。
具体推算过程如等式(6)所示,贮藏是香肠加工过程的最终过程,因此贮藏过程的PO值可等于消费时的FSO值。任一过程的PO值是下一过程的H0值,如斩拌过程的PO值等于灌装过程的H0值(PO1=H0-2)。
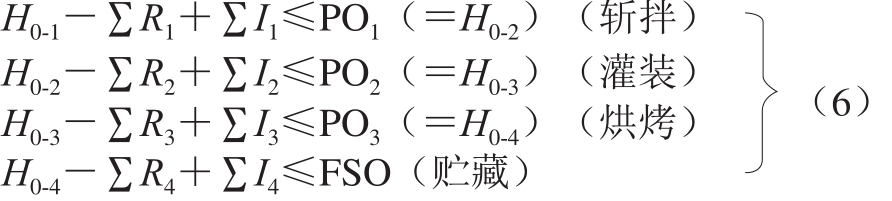
根据1.2节中已建立的FSO或PO值,建立相应的符合致病菌FSO和PO值的MC需做出以下假设:其一,定义采集样品批次内致病菌的分布,一般假定为对数正态(lognormal)分布,分布的标准差采用缺省值:S=0.2,样品中致病菌均匀分布,如液体食品;S=0.4,样品中致病菌中度均匀分布,如碎牛肉;S=0.8,样品中致病菌不均匀分布,如固体食品。其二,定义满足FSO或PO的危害最大频率或浓度。其三,定义不合格样品不可接受的置信水平(Pd)。其四,定义样品的分析单元大小[16]。
基于以上假定,样品单元数(n)计算方法如式(7)所示:
式中:pa为一个样品可接受的概率值,计算方法如式(8)所示:
式中:x为微生物限量(lg (CFU/g));μ为微生物浓度分布的均值(lg(CFU/g));σ为微生物浓度分布的标准差;cumulative为一个逻辑值:当Normdist返回累积分布时,设置为1;当Normdist返回为频率分布时,设置为0。
OC曲线可用于描述MC的性能,应用Minitab 17软件(美国Minitab公司)可建立基于样本单元数(n)和可允许的阳性样品数(c)的OC曲线;另一类基于生产者和消费者可接受安全水平的OC曲线[17]可用式(9)进行计算:
式中:Pa为一个批次样品可接受的概率值;x、μ和σ如1.3节所述。
应用@Risk 5.5软件拟合贮藏后样品中致病菌浓度(μ, σ),将μ的拟合值带入式(9)中计算出相应的Pa值,应用Microsoft Excel 2010软件对μ-Pa的相关性进行描述。

图2 消费时低温乳化香肠中单核细胞增生李斯特氏菌的浓度分布
Fig. 2 Probability distribution of L. monocytogenes upon consumption of low-temperature emulsified sausage
基于已完成的低温乳化香肠加工过程中定量风险评估结果[10],整合消费时样品中单核细胞增生李斯特氏菌分布和样品中单核细胞增生李斯特氏菌的检出率可评估出样品中单核细胞增生李斯特氏菌的限量值m,如图2所示。将图2中2 组限量值转化为剂量D(D=m×M,M为每餐香肠消费量(g)),并将剂量值(D)和检出率(P)组合带入图3中进行验证,由图3可知,2 组PD组合(分别为P=1.35%、D=-2.92(lg CFU)和P=1.35%、D=2.02(lg CFU))均在可容许区域内。因此,图2中限量值可设置为低温乳化香肠的FSO。

图3 低温乳化香肠消费时的PD等值线
Fig. 3 Prevalence-dose equivalence curve upon consumption of low-temperature emulsified sausage
基于斩拌和灌装过程中单核细胞增生李斯特氏菌的交叉污染,低温乳化香肠的FSO可设定为消费时低温乳化香肠中单核细胞增生李斯特氏菌污染水平不可超过0.36(lg(CFU/g))或消费时污染单核细胞增生李斯特氏菌的低温乳化香肠需低于1.35%。未整合斩拌和灌装过程中单核细胞增生李斯特氏菌的交叉污染时,低温乳化香肠的FSO可设定为消费时低温乳化香肠中单核细胞增生李斯特氏菌污染水平不可超过-4.58(lg(CFU/g))或消费时污染单核细胞增生李斯特氏菌的低温乳化香肠需低于1.35%。由整合和未整合交叉污染的FSO设定结果可知,未整合斩拌和灌装过程中单核细胞增生李斯特氏菌交叉污染的FSO值明显低于整合交叉污染的结果,低估了低温乳化香肠的食用风险。
表1 低温乳化香肠加工过程中各环节PO及PC的设定
Table 1 Setting of PO and PC during low-temperature emulsi fi ed sausage processing

注:ND.未检测。下表同。
如表1所示,以烘烤过程为例,基于斩拌和灌装过程中单核细胞增生李斯特氏菌的交叉污染,香肠烘烤时的PO可设定为烘烤时低温乳化香肠中单核细胞增生李斯特氏菌污染水平不可超过-2.32(lg(CFU/g))或烘烤时污染单核细胞增生李斯特氏菌的低温乳化香肠需低于23.3%;未整合斩拌和灌装过程中单核细胞增生李斯特氏菌的交叉污染时,香肠烘烤时的PO可设定为烘烤时低温乳化香肠中单核细胞增生李斯特氏菌污染水平不可超过-7.26(lg(CFU/g))或烘烤时污染单核细胞增生李斯特氏菌的低温乳化香肠需低于23.3%。
基于制定的PO值,相应的香肠烘烤时的PC设定结果为:整合交叉污染时,烘烤过程中需确保6.56(lgCFU)的单核细胞增生李斯特氏菌减少量;未整合交叉污染时,烘烤过程中需确保5.33 (lg CFU)的单核细胞增生李斯特氏菌减少量。另以贮藏过程为例,香肠贮藏时的PC设定结果为:整合交叉污染时,贮藏过程中单核细胞增生李斯特氏菌的增加量不可超过5.68(lgCFU);未整合交叉污染时,贮藏过程中单核细胞增生李斯特氏菌的增加量不可超过4.54(lgCFU)。由整合和未整合交叉污染的PO及PC设定结果可知,整合斩拌和灌装过程中单核细胞增生李斯特氏菌交叉污染的PO及PC更为严格。
表2 低温乳化香肠加工过程中各环节的采样方案
Table 2 Sampling plans for different steps of low-temperature emulsi fi ed sausage processing

如表2所示,以贮藏过程为例,香肠贮藏时的MC制定结果为:整合交叉污染时,样品中单核细胞增生李斯特氏菌的浓度分布为μ=-3.27(lg(CFU/g)),σ=1.64,分析单元大小为25 g,独立采样所得样品单元为222,允许的阳性样品单元为0,单核细胞增生李斯特氏菌限量值为0.36(lg(CFU/g));未整合交叉污染时,样品中单核细胞增生李斯特氏菌的浓度分布为μ=-7.48(lg(CFU/g)),σ=1.31,分析单元大小为25 g,独立采样所得样品单元为222,允许的阳性样品单元为0,单核细胞增生李斯特氏菌限量值为-4.58(lg(CFU/g))。由表2可知,验收、烘烤和贮藏过程中,未整合交叉污染的采样数高于整合交叉污染的结果,因此,考虑生产成本和经济性,整合交叉污染的过程耗费的人力和物力更少。
以灌装和烘烤过程为例,综合表1、2可知,烘烤过程结束时,低温乳化香肠污染单核细胞增生李斯特氏菌的最大污染水平低于灌装过程,同时基于理论推导可知,烘烤过程检出单核细胞增生李斯特氏菌阳性的低温乳化香肠数低于灌装过程(0.233×12<0.013×224)。
2.4.1 基于样本单元数和可接受水平限量值的OC曲线
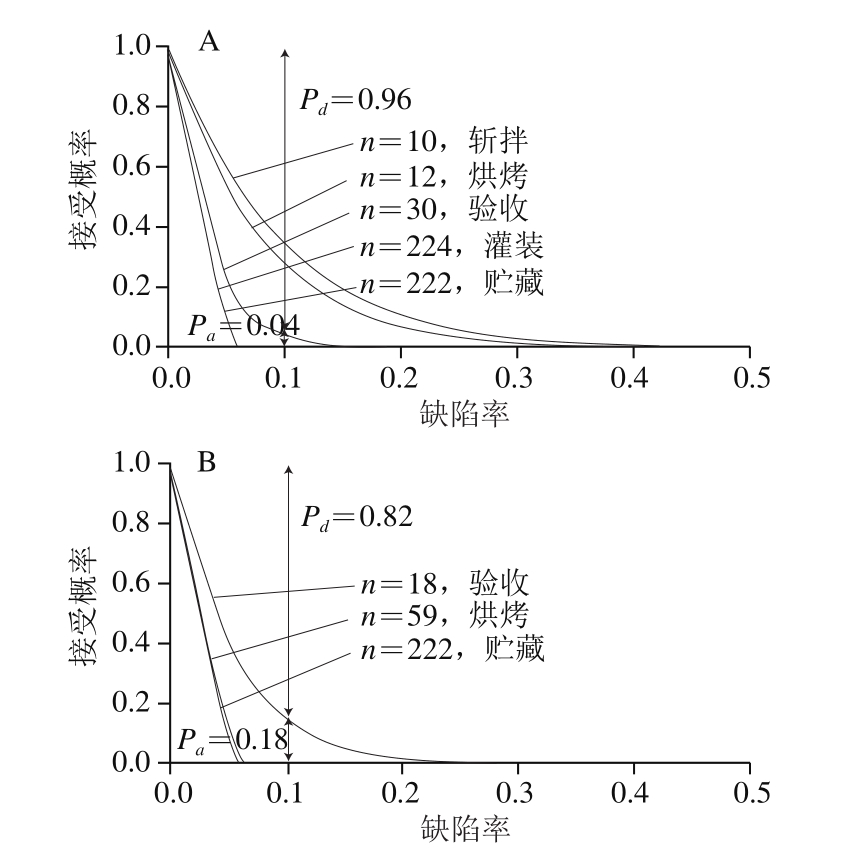
图4 基于样本单元数和可接受水平限量值的OC曲线
Fig. 4 OC curves based on the number of samples tested and the maximum number of those samples that may exceed the specified level
A.整合交叉污染;B.未整合交叉污染。
以验收过程为例,图4A中,假设样品中10%缺陷率的限量,则Pa=0.04,表明检测缺陷率为10%的样品时,100 次检测中有4 次可能得到30 份检样中有0 份检样为阳性的情况,因而接受;但若100 次检测中有96 次得到30 份检样中有大于等于0 份检样为阳性的情况,则拒绝(Pd=0.96)。未整合交叉污染的场景如图4B所示,假设样品中10%缺陷率的限量时,Pa=0.18>0.04,Pd=0.82<0.96,因此,相同样品单元缺陷率的批次在整合交叉污染的场景下被视为“可接受”的概率较低,因此整合交叉污染的采样方案更为严格。
图4反映了在特定可接受限量条件下,不同加工过程的可接受概率从100%降至0%时对某批产品可接受或不可接受的判别力。批次的样品单元(n)越大,OC曲线越陡峭,采样方案越接近理想状态。因此,整合交叉污染的场景下(图4A),不同加工过程采样方案的严格性排序为灌装>贮藏>验收>烘烤>斩拌;未整合交叉污染的场景下(图4B),不同加工过程采样方案的严格性排序为贮藏>烘烤>验收。
2.4.2 基于生产者和消费者可接受安全水平的OC曲线
以贮藏过程为例,整合交叉污染的贮藏过程OC曲线和相应的消费者及生产者可接受安全水平的浓度分布情况如图5a~c所示,图5a展示了95%拒绝水平(消费者可接受安全水平)和95%可接受水平(生产者可接受安全水平)下单核细胞增生李斯特氏菌的平均污染水平,图5b反映了消费者的可接受安全水平,平均污染水平为-0.53(lg(CFU/g))的批次有95%的概率被拒绝,同时99%点对应的浓度水平0.36(lg(CFU/g))可设定为FSO值,确保99%的样品单元不超过FSO值,图5c展示了生产者的可接受安全水平,平均污染水平为-1.04(lg(CFU/g))的批次有95%的概率被接受。
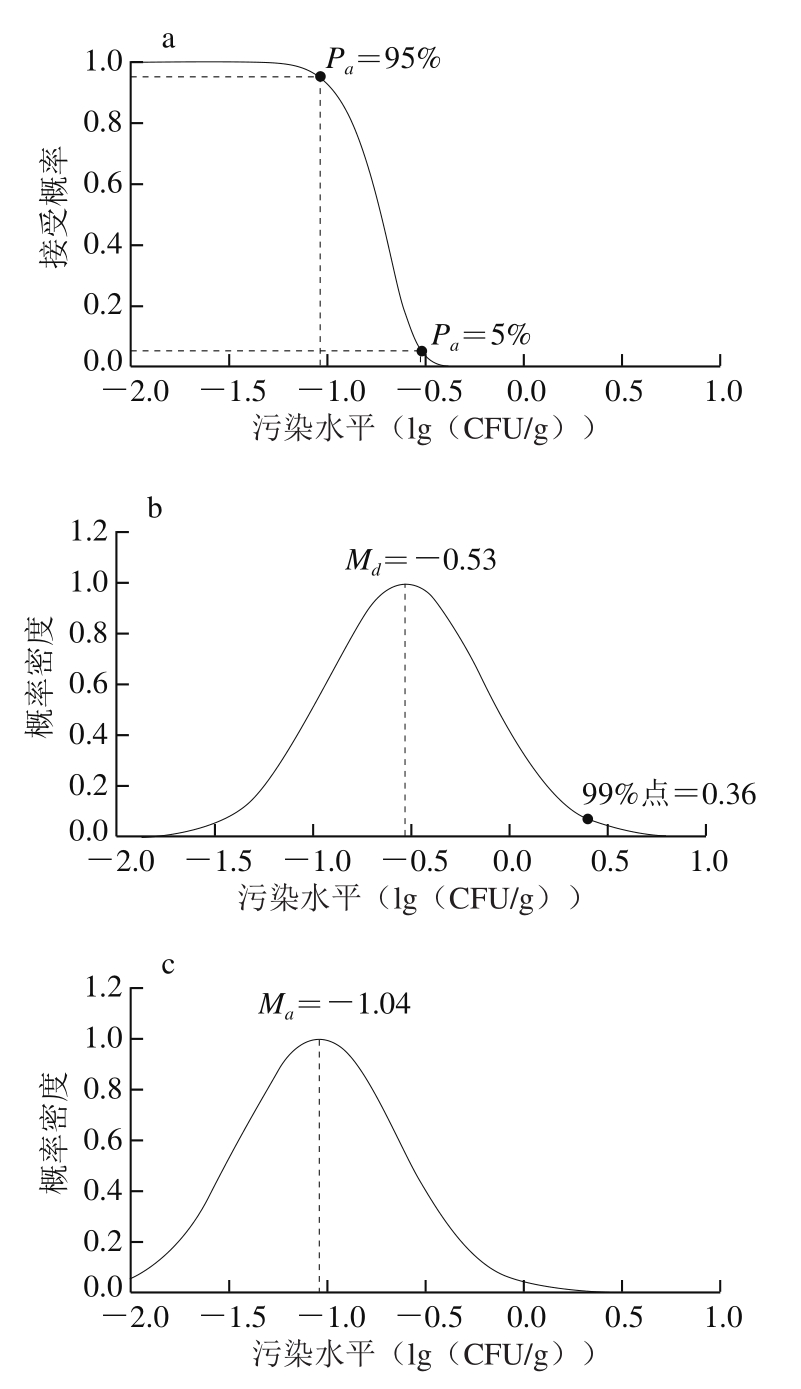
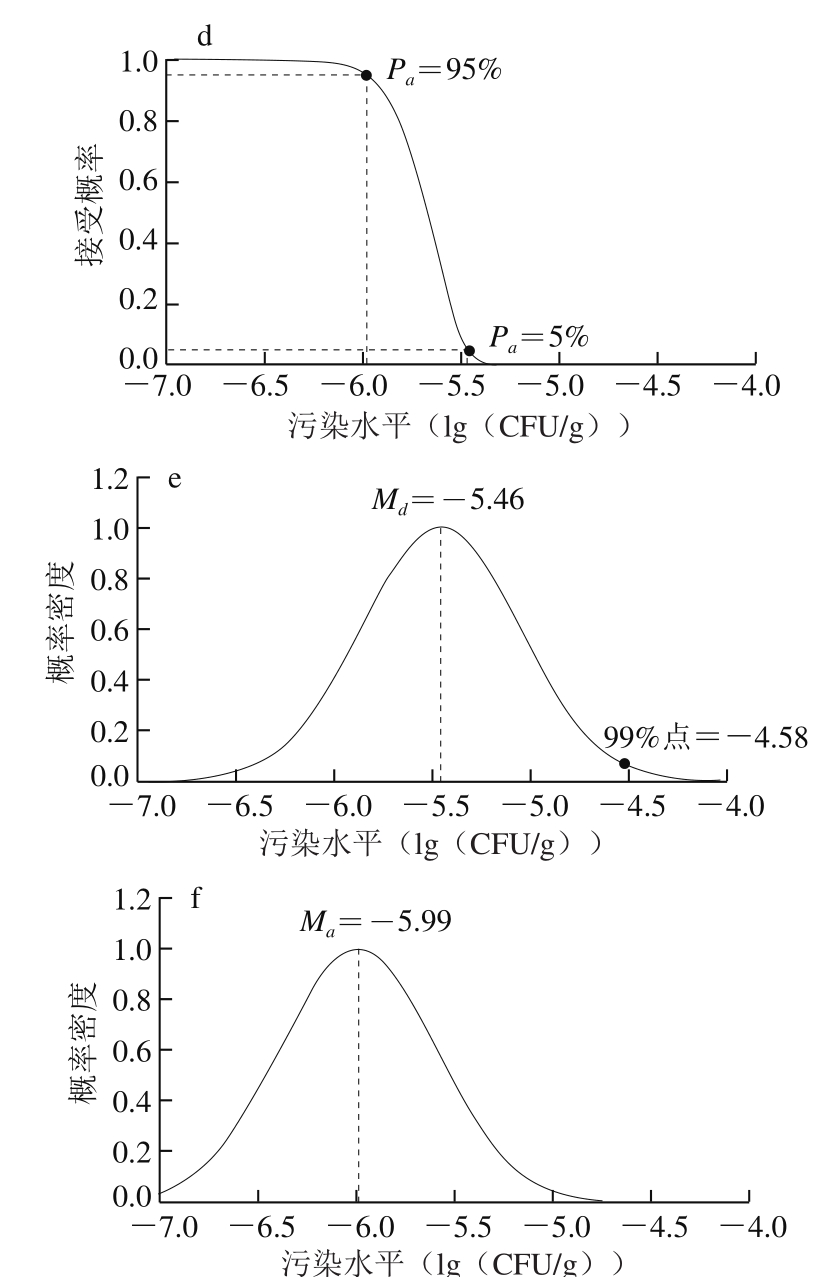
图5 基于生产者和消费者可接受安全水平的OC曲线
Fig. 5 OC curves of the acceptable level for safety of producer and consumer
a~c.整合交叉污染贮藏过程;d~f.未整合交叉污染贮藏过程。
未整合交叉污染的贮藏过程OC曲线和相应的消费者和生产者的可接受安全水平的浓度分布情况如图5d~f所示,图5d为95%拒绝水平和95%可接受水平下单核细胞增生李斯特氏菌的平均污染水平分布,图5e为消费者的可接受安全水平分布,平均污染水平为-5.46(lg(CFU/g))的批次有95%的概率被拒绝,同时99%点对应的浓度水平-4.58 (lg(CFU/g))设定为FSO值,图5f为生产者的可接受安全水平分布,平均污染水平为-5.99(lg(CFU/g))的批次有95%的概率被接受。由整合和未整合交叉污染的贮藏过程OC曲线对比结果可知,未整合交叉污染的场景高估了消费者风险(-5.46<-0.53,食品批次应该被拒绝时却被接受),同时低估了生产者风险(-5.99<-1.04,食品批次应该被接受时却被拒绝)。
近年来食品安全事件频发,基于制定科学合理的食品安全标准的理念,国际食品微生物标准委员会(International Commission on Microbiological Specifications for Foods,ICMSF)提出适当保护水平(appropriate level of protection,ALOP)的概念,定义为:成员国制定并认为适当的卫生或植物检疫措施以保护本国人、动物或植物的生命或健康的保护水平[1]。ALOP可以用于衡量食品卫生标准的科学合理性,属于国家水平上的公众健康目标,范围较为宽泛、抽象,因此在食品工厂设定FSO方面,并不是一个有效方式[18-19]。因此,ICMSF提出FSO的概念,用于连接ALOP和食品供应链的目标点。
FSO定义为在能够提供适当保护水平的基础上,消费时食品中微生物危害的最大频率和/或最高浓度[1]。FSO的设置需结合消费前食品加工链中所有控制点污染的可能性和影响,因此,食品法典委员会提出PO和PC的概念,PO定义为:在确保FSO或ALOP实现的基础上,消费前食品加工链的某阶段食品中危害的最大频率和/或最高浓度。PC定义为:通过采取一项或多项控制措施,控制食品中有害因素的发生频率和浓度,以满足PO和/或FSO的要求[20]。基于微生物学检测验证PO和PC需建立相应的MC。
MC定义为:基于单位质量、体积、面积或批次中微生物(包括寄生虫)和/或其毒素/代谢产物的有无或数量判定某一产品或食品批次的可接受性[21-22]。MC的主要内容包括:样品中致病菌的浓度分布(μ, σ);适宜于食物链特定环节的微生物限量;定义采集样本数量和大小的采样方案[23]。欧盟法规设立了2 类MC:食品安全标准和加工卫生标准。食品安全标准是某一产品或食品批次应用于市场销售的可接受性;加工卫生标准表明产品加工过程运作的可接受性[24]。一般用OC曲线描述MC的性能。
OC曲线是指基于测试的样本单元数、样品单元的比例或批次等份和特定的可接受水平(如最大可容忍缺陷率)判定批次样本可接受的概率曲线。OC曲线主要用2 个指标进行描述:样本单元数(n)和可允许的阳性样本单元数(c),这类OC曲线主要用于评估采样方案的性能[1,25]。另一类整合样品批次中致病菌浓度分布的OC曲线可用于评估MC的性能,MC性能的评估依据主要是检验食品批次是否满足FSO或PO[11]。
FSO的制定方法主要包括正序法、倒序法和PD曲线。基于流行病学数据的正序法是国家水平上较好的风险评估方法。正序法一般使用反向剂量效应模型进行评估,假定特定的交叉污染路径为唯一影响消费时食品中致病菌污染水平的因素,因此模型进行参数设置时,输入值的不确定性和变异性较小,但是数据质量要求较高[21-22]。基于食品供应链数据的倒序法是国际水平上较好的风险评估方法。倒序法构建的模型较为复杂,因此模型中所需数据的获得具有很大挑战性。模型的输入值较多,因此累积在风险特征描述阶段的不确定性和变异性较大,但是特定致病菌的阳性检出率和浓度数据较易获得[26]。暴露量主要受交叉污染过程中介质数量、介质类型及污染路径等因素影响,因此FSO的制定需使用细胞数定义风险。对比采用正序法和倒序法制定FSO,PD曲线使用食品消费剂量代替食品中致病菌的浓度或阳性检出率进行制定更为全面[6]。
本研究中采用PD曲线,同时整合消费时样品中单核细胞增生李斯特氏菌的分布和样品中单核细胞增生李斯特氏菌的检出率对低温乳化香肠的FSO进行制定,结果表明,整合和未整合交叉污染的结果均在可容许区域内,因此2 种场景均可用于低温乳化香肠FSO的制定。Havelaar等[6]研究结果表明,FSO的定义需修正为考虑食品中致病菌污染的变异性和不确定性、食品中致病菌的阳性检出率和浓度分布,因此建议采用PD曲线用于FSO的制定。Gkogka等[27]研究并比较了正序法和倒序法2 种风险评估方法制定荷兰鸡肉的FSO,结果表明,2 种方法得到的FSO值具有显著性差异(P<0.05),可能因为方法不同或可得到的数据有限影响了FSO的制定,与Konstantinos等[26]的研究相似。关于低温乳化香肠FSO制定方法的选用可为风险管理者提供借鉴。
食源性致病菌的交叉污染是指制作表面污染致病菌的食品时操作不当污染到其他食品[28]。香肠加工过程的斩拌和灌装过程交叉污染现象尤为严重。本研究表明,对比未整合交叉污染的食品安全标准制定结果,整合交叉污染的结果更为严格,且过程中耗费的人力物力更少。单核细胞增生李斯特氏菌广泛存在于香肠加工环境中,同时可在香肠贮藏环境中生长,因此关于香肠样品中单核细胞增生李斯特氏菌的检出报道频发[29-31]。香肠加工过程中,斩拌机或灌装机等设备清洗不当或操作人员卫生不合格均会造成单核细胞增生李斯特氏菌的交叉污染。Gkogka等[27]采用Spearman相关系数对影响FSO制定的因素进行敏感性分析,结果表明交叉污染是影响FSO制定的重要因素(Spearman相关系数为0.39)。关于香肠加工过程中单核细胞增生李斯特氏菌交叉污染的研究可为香肠加工过程中完整的风险管理研究提供借鉴。
本实验研究交叉污染对低温乳化香肠加工过程中食品安全标准制定的影响,结果表明,整合交叉污染的标准制定结果更为严格,且过程中耗费的人力物力更少。评估制定的采样方案和MC,结果表明,整合交叉污染的采样方案较为严格,未整合交叉污染的场景高估了消费者风险,同时低估了生产者风险。比较了已制定的食品安全标准、GB 29921—2013和其他国家食品安全标准,为微生物风险管理工作提供参考。
参考文献:
[1] International Commission on Microbiological Specifications of Foods(ICMSF): microorganisms in foods 7: microbiological testing in food safety management[M]. New York: Kluwer Academic/Plenum Publishers, 2002.
[2] 卫生部. 食品中致病菌限量: GB 29921—2013[S]. 北京: 中国标准出版社, 2013.
[3] Codex Committee on Food Hygiene (CCFH). Proposed draft guidelines for the control of Listeria monocytogenes in foods[R]. 2000.
[4] HUSS H H, JØRGENSEN L V, VOGEL B F. Control options for Listeria monocytogenes in seafood[J]. International Journal of Food Microbiology, 2000, 62(3): 267-269. DOI:10.1016/S0168-1605(00)00347-0.
[5] NØRRUNG B. Microbiological criteria for Listeria monocytogenes,in foods under special consideration of risk assessment approaches[J].International Journal of Food Microbiology, 2000, 62(3): 217-221.DOI:10.1016/S0168-1605(00)00338-X.
[6] HAVELAAR A H, NAUTA M J, JANSEN J T. Fine-tuning food safety objectives and risk assessment[J]. International Journal of Food Microbiology, 2004, 93(1): 11-29. DOI:10.1016/j.ijfoodmicro.2003.09.012.
[7] RIEU E, DUHEM K, VINDEL E, et al. Food safety objectives should integrate the variability of the concentration of pathogen[J].Risk Analysis, 2007, 27(2): 373-386. DOI:10.1111/j.1539-6924.2007.00888.x.
[8] 江荣花, 汪雯, 蔡铮, 等. 肉制品加工过程中食源性致病菌交叉污染及风险评估的研究进展[J]. 食品科学, 2018, 39(7): 305-311.DOI:10.7506/spkx1002-6630-201807045.
[9] 马婷, 李芳, 单大亚. 基于物联网技术的食品冷链物流跟踪及追溯问题研究[J]. 上海理工大学学报, 2013, 35(6): 557-562.DOI:10.13255/j.cnki.jusst.2013.06.010.
[10] 董庆利, 郑丽敏, 党维鑫, 等. 即食食品中单增李斯特菌的半定量风险评估[J]. 食品工业科技, 2012, 33(11): 321-323. DOI:10.13386/j.issn1002-0306.2012.11.087.
[11] MATARAGAS M, ZWIETERING M H, SKANDAMIS P N, et al. Quantitative microbiological risk assessment as a tool to obtain useful information for risk managers—specific application to Listeria monocytogenes and ready-to-eat meat products[J]. International Journal of Food Microbiology, 2010, 141(8): 170-179. DOI:10.1016/j.ijfoodmicro.2010.01.005.
[12] YUHUAN C, ROSS W H, SCOTT V N, et al. Listeria monocytogenes:low levels equal low risk[J]. Journal of Food Protection, 2003, 66(4):570-577.
[13] 国家食品安全风险评估中心. 熟肉制品中单增李斯特菌初步定量风险评估[R]. 北京: 国家食品安全风险评估中心, 2015.
[14] MATARAGASA M, ALESSANDRIA V, RANTSIOU K, et al.Management of Listeria monocytogenes in fermented sausages using the Food Safety Objective concept underpinned by stochastic modeling and meta-analysis[J]. Food Microbiology, 2015, 49(1): 33-40. DOI:10.1016/j.fm.2015.01.001.
[15] STEWART C M, TOMPKIN R B, COLE M B. Food safety: new concepts for the new millennium[J]. Innovative Food Science and Emerging Technologies, 2002, 3(2): 105-112. DOI:10.1016/S1466-8564(02)00010-3.
[16] GONZALES-BARRON U A, CADAVEZ V A P, BUTLER F. Statistical approaches for the design of sampling plans for microbiological monitoring of foods[J]. Mathematical and Statistical Methods in Food Science and Technology, 2014, 1(1): 363-384.
[17] ZWIETERING M H, ROSS T, GORRIS L G M. Food safety assurance systems: microbiological testing, sampling plans, and microbiological criteria[J]. Encyclopedia of Food Safety, 2014, 4(1):244-253. DOI:10.1016/B978-0-12-378612-8.00363-2.
[18] ZWIETERING M. Practical considerations on food safety objectives[J]. Food Control, 2005, 16(9): 817-823. DOI:10.1016/j.foodcont.2004.10.022.
[19] GORRIS L G M. Food safety objective: an integral part of food chain management[J]. Food Control, 2005, 16(9): 801-809. DOI:10.1016/j.foodcont.2004.10.020.
[20] FAO/WHO. The use of microbiological risk assessment outputs to develop practical risk management strategies: metrics to improve food safety[EB/OL]. [2017-09-21]. http://www.fao.org/3/b-at657e.pdf.
[21] VAN S M, ZWIETERING M H, ROSS T, et al. Relating microbiological criteria to food safety objectives and performance objectives[J]. Food Control, 2009, 20(11): 967-979. DOI:10.1016/j.foodcont.2008.11.005.
[22] ZWIETERING M H, STEWART C M, WHITING R C.Validation of control measures in a food chain using the FSO concept[J]. Food Control, 2010, 21(12): 1716-1722. DOI:10.1016/j.foodcont.2010.05.019.
[23] MAARTEN N, JENS K A, PIRKKO T, et al. Risk-based microbiological criteria for Campylobacter in broiler meat: a comparison of two approaches[J]. Food Control, 2015, 53(1): 177-184.DOI:10.1016/j.foodcont.2015.01.019.
[24] Regulation (EC) No 2073/2005: Commission Regulation (EC) No 2073/2005 of 15 November 2005 on microbiological criteria for foodstuffs[S].
[25] SUSANNE D. Microbiological sampling plans-statistical aspects[J].Mitteilungen Aus Lebensmittel Untersuchung und Hygiene, 2004,95(1): 32-44. DOI:10.1109/20.22584.
[26] KONSTANTINOS P K, ZAFIRO A. Moving towards a risk-based food safety management[J]. Current Opinion in Food Science, 2016,12(1): 36-41. DOI:10.1016/j.cofs.2016.06.008.
[27] GKOGKA E, REIJ M W, GORRIS L G M, et al. Risk assessment strategies as a tool in the application of the Appropriate Level of Protection (ALOP) and Food Safety Objective (FSO) by risk managers[J]. International Journal of Food Microbiology, 2013,167(1): 8-28. DOI:10.1016/j.ijfoodmicro.2013.04.013.
[28] 董庆利, 陆冉冉, 汪雯, 等. 案板材质对单增李斯特菌在生熟食品间交叉污染的影响[J]. 农业机械学报, 2016, 47(3): 207-213.DOI:10.6041/j.issn.1000-1298.2016.03.029.
[29] CARTWRIGHT E J, JACKSON K A, JOHNSON S D, et al.Listeriosis outbreaks and associated food vehicles, United States,1998-2008[J]. Emerging Infectious Diseases, 2013, 19(1): 1-9.DOI:10.3201/eid1901.120393.
[30] GOTTLIEB S L, NEWBERN E C, GRIFFIN P M, et al. Multistate outbreak of listeriosis linked to Turkey deli meat and subsequent changes in us regulatory policy[J]. Clinical Infectious Diseases, 2006,42(1): 29-36. DOI:10.1086/498113.
[31] THOMAS M K, VRIEZEN R, FARBER J M, et al. Economic cost of a Listeria monocytogenes outbreak in Canada, 2008[J]. Foodborne Pathogens and Disease, 2015, 12(12): 966-971. DOI:10.1089/fpd.2015.1965.
Suggestions Concerning Limit Standard for Listeria monocytogenes during Low-Temperature Emulsified Sausage Processing
JIANG Ronghua1, SU Liang2, REN Pengcheng2, SUN Linjun1, WANG Xiang1, LIU Qing1, DONG Qingli1,*
(1. School of Medical Instrument and Food Engineering, University of Shanghai for Science and Technology,Shanghai 200093, China; 2. China National Center for Food Safety Risk Assessment, Beijing 100022, China)
Abstract:The aim of this study was to optimize the risk management of Listeria monocytogenes during low-temperature emulsified sausage processing. The food safety objective (FSO) for low-temperature emulsified sausage was set by the prevalence-dose (PD) equivalence curve method based on the results of quantitative risk assessment completed by our group with or without cross-contamination of L. monocytogenes. Moreover, other food safety standards, including performance objective (PO), performance criterion (PC) and microbiological criteria (MC), were obtained based on their relationship with FSO. The operating characteristic (OC) curve was used to evaluate the performance of sampling plans and MC. The results showed that the FSO for low-temperature emulsified sausage with and without cross-contamination of L. monocytogenes was 0.36 (lg(CFU/g)) and -4.58 (lg(CFU/g)), respectively. The food safety standard with crosscontamination of L. monocytogenes was stricter, labor saving and economical. However, the consumer risk was overestimated and the producer risk was underestimated in the food safety standard without integrating the crosscontamination of L. monocytogenes.
Keywords:low-temperature emulsified sausage; Listeria monocytogenes; cross-contamination; risk management;food safety standard
JIANG Ronghua, SU Liang, REN Pengcheng, et al. Suggestions concerning limit standard for Listeria monocytogenes during low-temperature emulsified sausage processing[J]. Food Science, 2018, 39(22): 276-282. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201822042. http://www.spkx.net.cn
引文格式:江荣花, 苏亮, 任鹏程, 等. 低温乳化香肠加工过程中单核细胞增生李斯特氏菌的限量标准建议[J]. 食品科学, 2018,39(22): 276-282. DOI:10.7506/spkx1002-6630-201822042. http://www.spkx.net.cn
文章编号:1002-6630(2018)22-0276-07
文献标志码:A
中图分类号:TS201.3
DOI:10.7506/spkx1002-6630-201822042
*通信作者简介:董庆利(1979—),男,教授,博士,研究方向为畜产品安全与质量控制。E-mail:dongqingli@126.com
第一作者简介:江荣花(1993—),女,硕士研究生,研究方向为畜产品安全与质量控制。E-mail:truda0726@163.com
基金项目:“十二五”国家科技支撑计划项目(2015BAK36B04)
收稿日期:2017-09-23