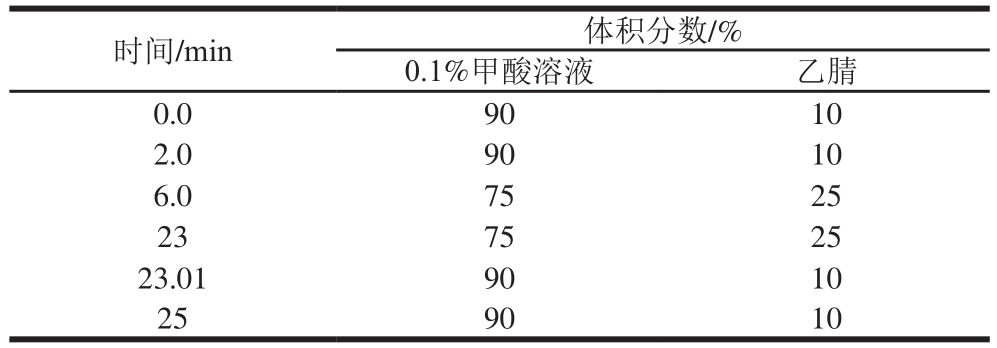
表1 梯度洗脱条件
Table 1 Gradient elution conditions
范素芳1,马俊美1,刘 茁2,俞 婧1,翟洪稳1,李 强1,*,张 岩1,*
(1.河北省食品检验研究院,河北省食品安全重点实验室,河北 石家庄 050091;2.河北科技大学生物科学与工程学院,河北 石家庄 050018)
摘 要:建立高效液相色谱-串联质谱法测定食品中15 种有毒生物碱。研究和优化提取条件、净化方式、色谱-质谱参数等指标,样品经体积分数20%乙醇溶液提取、离心后,经高效液相色谱分离、质谱测定,外标法定量。结果表明,15 种有毒生物碱的检出限范围为4~20 μg/kg,定量限范围为10~80 μg/kg,在1、3、5 倍定量限添加水平时,方法的回收率范围为80.9%~119.8%,相对标准偏差低于10%,符合分析方法要求。该方法可用于植物源饮料、粮谷类食品及果蔬中15 种有毒生物碱的快速筛查和定量分析。
关键词:高效液相色谱-串联质谱;食品;有毒生物碱
生物碱是存在于自然界(主要为植物)中的一类含氮碱性有机化合物,大多数生物碱具有复杂的环状结构,并且具有明显的生物活性[1]。生物碱广泛存在于毛茛科、芸香科、豆科等植物的根、果实中,很多食品中也含有生物碱,如马铃薯中含有配糖生物碱龙葵素、茄子中含有茄碱、槟榔中含有槟榔碱等[2]。很多生物碱是中药的有效成分,如吗啡能镇痛,麻黄碱可以止咳平喘,喜树碱、秋水仙碱具有抗癌作用等,生物碱具有生物活性的同时也具有毒性,必须控制其用量,摄入量过大时会产生副作用[3]。生物碱是引发食物中毒的主要原因之一。马铃薯尤其是发芽的马铃薯中含有龙葵素,常有因食用了发芽的马铃薯而引发的中毒案例,而且通常为群体性事件[4]。乌头碱、颠茄碱(阿托品)、东莨菪碱、秋水仙碱、马钱子碱、鬼臼毒素等生物碱由于具有毒性,在临床应用的同时也会因使用不当造成食物中毒[5-10]。因此检测粮食谷物、果蔬、植物饮料中有毒生物碱对保障食品安全非常必要。本实验选择粮谷类玉米粉、面粉、锅巴和薯片,选择果蔬类番茄、茄子、桃和土豆,选择植物源饮料山楂汁、雪梨汁、芒果汁和王老吉,其中土豆中易含龙葵素,茄子中有茄碱,植物源饮料中易混入乌头碱、莨菪碱、马钱子碱等有毒生物碱的成分。
目前,生物碱的检测方法主要有高效液相色谱法[11-13]、液相色谱-串联质谱法[7,14-17]、气相色谱-串联质谱法[18-19]、高效液相色谱-四极杆/静电场轨道阱高分辨质谱[20-21]等,样品基质多为生物样品。Murauer等[22]用超临界流体色谱测定金鸡纳树皮中喹啉类生物碱,其中定量测定了金鸡纳碱、奎宁和金鸡纳啶。Li Lou等[23]用双环糊精系统的毛细管电泳分离并测定了4 种钩藤碱。Long Zhen等[24]用强离子交换二维液相色谱测定了莨菪烷生物碱。段存贤等[25]用氨基键合硅胶为固定相的正相高效液相色谱法测定神农丸中士的宁与马钱子碱的含量。丁琳等[26]建立了莨菪浸膏片的高效液相色谱特征指纹图谱,并对其中阿托品、山莨菪碱、东莨菪碱、樟柳碱4 种莨菪烷类生物碱进行定量分析。已经有火锅底料[27]及罂粟壳[28-29]中生物碱的高效液相色谱-串联质谱方法,秦军燕等[30]建立了肉苁蓉、枸杞和山药中6 种生物碱的高效液相色谱-串联质谱方法,贺琦等[3]建立了红酒、牛奶、面包和玉米粉中20 种有害生物碱的高效液相色谱-串联质谱方法。但大宗食品中有毒生物碱的高效液相色谱-串联质谱方法鲜见报道。本实验建立了粮谷、植物源性饮料、蔬菜、水果中茄碱、东莨菪碱、马钱子碱、士的宁、麻黄碱、乌头碱、次乌头碱、新乌头碱、秋水仙碱、阿托品、槟榔碱、毒芹碱、鬼臼毒素、毛果芸香碱及钩吻碱15 种生物碱的高效液相色谱-串联质谱测定方法。
植物源性饮料:山楂汁 北京京膳堂饮料有限公司;冰糖雪梨 康师傅控股有限公司;芒果汁 韩国乐天集团;凉茶饮料 广州王老吉药业股份有限公司。粮谷类样品:小米锅巴 良品铺子股份有限公司;薯片美国乐事公司;面粉、玉米粉 市购。果蔬样品:番茄、茄子、桃、土豆 市购。
乙腈、甲醇、乙醇(均为色谱纯) 美国Fisher Scientific公司;正己烷(分析纯) 北京化学试剂公司;甲酸(色谱纯) 美国Supelco Analytical公司;去离子水 屈臣氏集团(香港)有限公司;15 种生物碱标准品(纯度≥99%) 上海源叶生物科技有限公司;阳离子交换柱(3cc,60 mg) 美国Waters公司。
Triple Quad 6500液相色谱-串联质谱仪(配有电喷雾离子源和MultiQuant 3.0.1数据处理系统) 美国AB Sciex公司;3K13高速冷冻离心机 德国Sigma公司;涡旋混匀仪 德国IKA公司;KQ-500DB超声仪 昆山市超声仪器公司。
1.3.1 溶液配制及试样制备
标准溶液的配制:分别称取各标准物质10 mg置于100 mL容量瓶中,用体积分数20%乙醇溶液溶解并定容至刻度,摇匀,制得100 mg/L的标准储备液,于-20 ℃避光保存,可使用2 个月。根据实验需要,用20%乙醇溶液将标准储备液配制成不同质量浓度的标准工作溶液,现配现用。
液态样品进行摇匀;固态样品粉碎均匀;果蔬样品切碎后匀浆。制备好的试样于0~5 ℃保存,尽快测定。
1.3.2 样品前处理
1.3.2.1 液态试样
称取1.000 g植物源性饮料于离心管中,加入20%乙醇溶液定容至20 mL,9 500 r/min离心10 min,吸取1.0 mL上层清液,0.22 μm滤膜过滤,待测。
1.3.2.2 固态样品(粮谷类)
取1.000 g样品加入10 mL 20%乙醇溶液,超声提取30 min,9 500 r/min离心10 min,过滤,收集滤液。残渣用10 mL 20%乙醇溶液重复提取1 次,合并滤液,并用乙醇定容至20 mL。取5 mL滤液,加入5 mL正己烷,涡旋混匀1 min,于4 ℃、9 500 r/min离心5 min,取1 mL下层清液,过0.22 μm滤膜,待测。
1.3.2.3 果蔬样品
取1.000 g样品加入10 mL 20%乙醇溶液,室温超声辅助提取30 min,于4 ℃、9 500 r/min离心10 min,上层清液过滤,收集滤液。残渣用10 mL 20%乙醇溶液重复提取1 次,合并滤液,并用乙醇定容至20 mL。取1 mL滤液,过0.22 μm滤膜过滤,待测。
1.3.2.4 空白实验
除不加试样外,均按上述步骤进行。
1.3.3 高效液相色谱-质谱条件
1.3.3.1 色谱条件
Waters Xbridge BEH C18色谱柱(100 mm×2.1 mm,5 μm);0.1%甲酸溶液和乙腈为流动相,梯度洗脱,洗脱条件见表1;流速0.30 mL/min;柱温30 ℃;进样量2 μL。
表1 梯度洗脱条件
Table 1 Gradient elution conditions

1.3.3.2 质谱条件
电离方式:电喷雾电离,正离子模式;喷雾电压:5.5 kV;离子源温度:500 ℃;气帘气压力:30 psi;雾化气压力:50 psi;辅助气压力:50 psi;扫描模式:多反应监测模式,15 种生物碱的质谱参数见表2。
表2 15 种生物碱的质谱参数
Table 2 Mass spectrometric parameters for 15 alkaloids
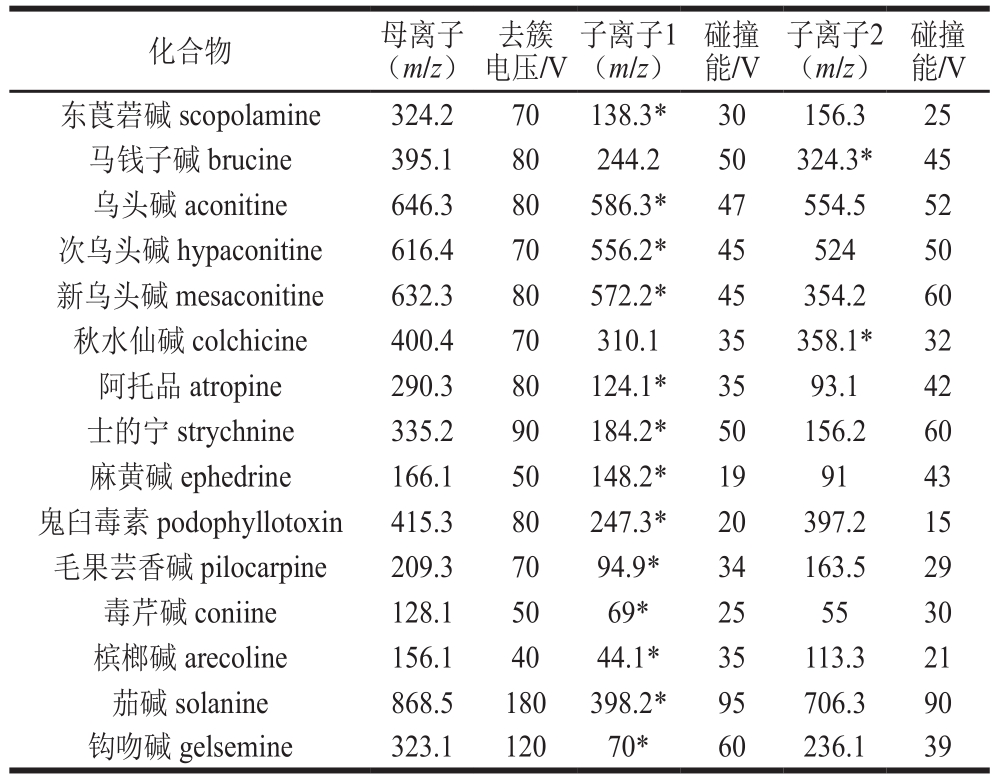
注:*.定量离子。
通过向阴性样品中添加标准样品,按相同的方法进行测定,外标法定量,验证方法的回收率。分别向不同基质添加1、3、5倍定量限3个水平的标准样品,每个水平5个平行,计算相对标准偏差。
在番茄阴性样品中添加待测物,按照本方法处理后,在第0、4、8、12、16、20、24小时分别测定,代入标准曲线计算被测物质的浓度,并计算其相对标准偏差,考察被测物质在测试溶液中放置24 h内的稳定性(环境温度25℃)。
定量测定空白基质提取液配制的标准溶液与20%乙醇溶液中相同质量浓度待测物的离子响应强度,计算二者相对比值评价其基质效应:
式中:A和B分别为20%乙醇溶液配制的标准溶液与空白基质液配制的标准溶液峰面积。
配制质量浓度为100 ng/mL的15 种生物碱的单标溶液,采用针泵注射的方式将标准溶液泵入质谱,优化质谱参数。生物碱大都含有杂环原子,在正离子模式下易得到一个H+形成准分子离子峰[M+H]+,所以实验选用正离子模式。采用全扫描模式找到母离子,通过子离子扫描模式选择响应较高的两个碎片离子,对碰撞能、去簇电压等参数进行优化。最终选定母离子与丰度较高,干扰较小的1 对特征子离子进行定性分析,选择其中响应值高的作为定量离子。
考察3 种色谱柱(Waters Xbridge BEH C18(2.1 mm×100 mm,2.5 μm);Thermo Accuore-150 C18(2.1 mm×100 mm,2.5 μm)和资生堂Capcell PAK C18(2.1 mm×100 mm,2 μm))对15 种生物碱的分离效果。结果表明,使用Thermo C18柱时槟榔碱和毛果芸香碱没有基线分离,士的宁、马钱子碱、阿托品也没有基线分离;使用资生堂色谱柱时,15 种生物碱峰形良好,但峰面积普遍偏低;使用Waters C18时,15 种生物碱实现了基线分离,并且峰形良好,峰响应也有所提高,因此选择Waters Xbridge BEH C18柱。
本研究对比了甲醇-水体系、甲醇-0.1%甲酸溶液体系、乙腈-水体系、乙腈-0.1%甲酸溶液体系作为流动相时15 种生物碱的色谱行为和质谱响应。结果表明,流动相中含有0.1%甲酸溶液时,仪器信号响应明显高,因此选择含0.1%甲酸溶液的体系;有机相为乙腈时,色谱柱的柱压比有机相为甲醇时低,并且有机相为乙腈时分析物的峰形相对更好。因此选择乙腈-0.1%甲酸溶液作为流动相。
为实现15 种生物碱的基线分离,考察不同梯度条件下的分离情况。C18柱对毛果芸香碱几乎没有保留,不同梯度条件下毛果芸香碱的保留时间变化不大。槟榔碱和毛果芸香碱、士的宁、马钱子碱、阿托品的出峰时间比较接近,为实现基线分离,需要比较平缓的梯度;次乌头碱、乌头碱结构类似,保留时间也比较接近。通过改变梯度洗脱条件,最终实现了15 种生物碱的基线分离,最终优化的梯度洗脱条件见表1。在优化好的洗脱条件下,分离情况最差的槟榔碱和毛果芸香碱的分离度达1.8,能满足定量分析要求。玉米基质中15 种生物碱的总离子流图(添加量100 μg/kg)见图1。
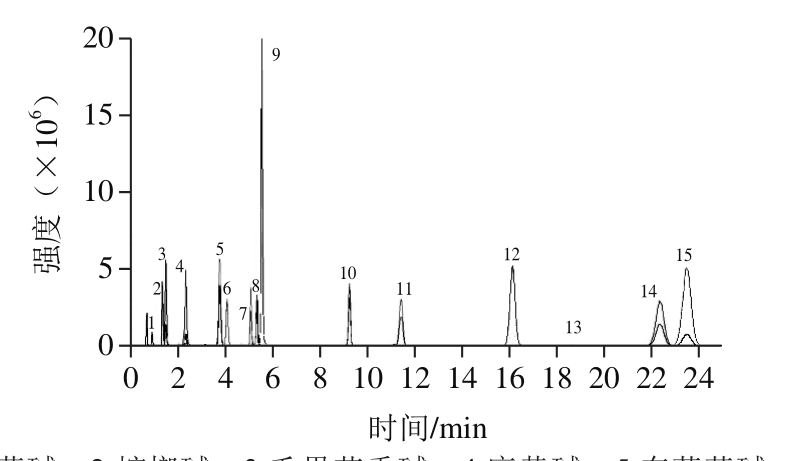
图1 玉米基质中15 种生物碱的总离子流图(添加量100 μg/kg)
Fig. 1 Total ion chromatogram of 15 alkaloids in corn samples at spiked level of 100 μg/kg
1.毒芹碱;2.槟榔碱;3.毛果芸香碱;4.麻黄碱;5.东莨菪碱;6.钩吻碱;7.士的宁;8.马钱子碱;9.阿托品;10.秋水仙碱;11.茄碱;12.新乌头碱;13.鬼臼毒素;14.次乌头碱;15.乌头碱。
2.3.1 提取溶剂的选择
文献[31]报道采用酸性溶液振荡,超声提取后用三氯甲烷萃取测定药材中二萜类生物碱,另外根据大部分生物碱难溶或微溶于水、易溶于有机溶剂的特点选择常用的甲醇和乙醇、乙腈有机溶剂,考察三氯甲烷、甲醇、乙醇、乙腈4 种有机溶剂的提取效果。通过标品添加方式考察不同提取溶剂时分析物的回收率最终确定20%乙醇溶液为后续实验的提取溶剂。
2.3.2 净化方法的考察
由于食品基质复杂,形态多样,为降低基质效应的影响采用固相萃取柱对目标物进行净化。选择玉米粉为基质,15 种生物碱添加量为100 μg/kg,考察阳离子交换柱的净化效果。
经阳离子交换柱后,秋水仙碱、鬼臼毒素没有检测到,表明阳离子交换柱不适合这两种物质;毛果芸香碱、茄碱,回收率分别为2.9%和64.5%;马钱子碱的回收率为75.6%,其他10 种生物碱的回收率在86.3%~110.7%之间。
后续选择番茄、雪梨汁加标样品经阳离子交换柱后进行测定,结果与玉米粉类似。因此,该前处理过程没有采用阳离子固相萃取柱净化。
用20%乙醇溶液配制质量浓度分别为1、2、5、10、20、50 ng/mL和100 ng/mL的系列标准工作溶液,按照质量浓度由低到高依次进行测定。以分析物质量浓度为横坐标,以分析物定量离子对的质谱响应值为纵坐标,拟合曲线,得到线性回归方程,15 种化合物的相关系数均高于0.99。阿托品的线性范围为0.5~100 μg/L,次乌头碱、新乌头碱的线性范围为1~100 μg/L,东莨菪碱、马钱子碱、乌头碱、秋水仙碱、士的宁、鬼臼毒素、毛果芸香碱、槟榔碱的线性范围为2~100 μg/L,麻黄碱、毒芹碱、茄碱、钩吻碱的线性范围为4~100 μg/L。采用加标回收的方法确定方法的检出限和定量限,分别以3、10 倍信噪比为方法的检出限和定量限。各生物碱的线性范围、相关系数、回归方程、检出限和定量限见表3。阿托品的检出限为4 μg/kg,次乌头碱、新乌头碱为6 μg/kg,东莨菪碱、马钱子碱、乌头碱、秋水仙碱、士的宁、鬼臼毒素、毛果芸香碱、槟榔碱为10 μg/kg,麻黄碱、毒芹碱、茄碱、钩吻碱为20 μg/kg。阿托品的定量限为10 μg/kg,次乌头碱、新乌头碱为20 μg/kg,东莨菪碱、马钱子碱、乌头碱、秋水仙碱、士的宁、鬼臼毒素、毛果芸香碱、槟榔碱为40 μg/kg,麻黄碱、毒芹碱、茄碱、钩吻碱为80 μg/kg。
表3 15 种生物碱的标准曲线及相关参数
Table 3 Standard curve equations, LODs and LOQs for 15 alkaloids
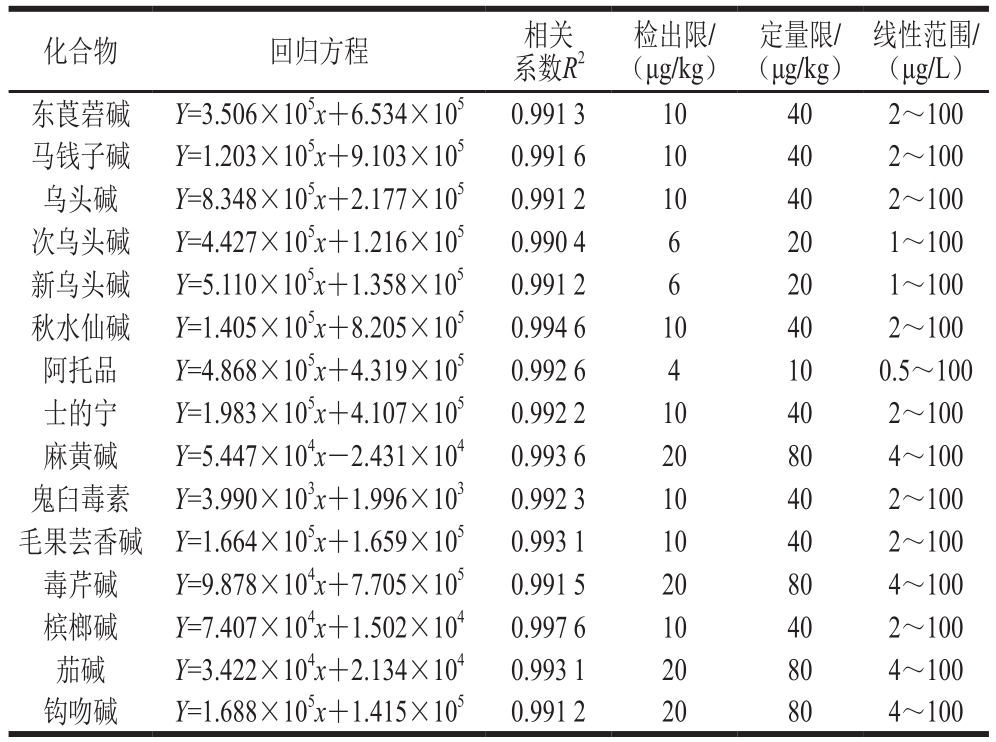
注:Y为峰面积;x为分析物质量浓度/(μg/L)。
表4 方法回收率
Table 4 Recoveries of the method
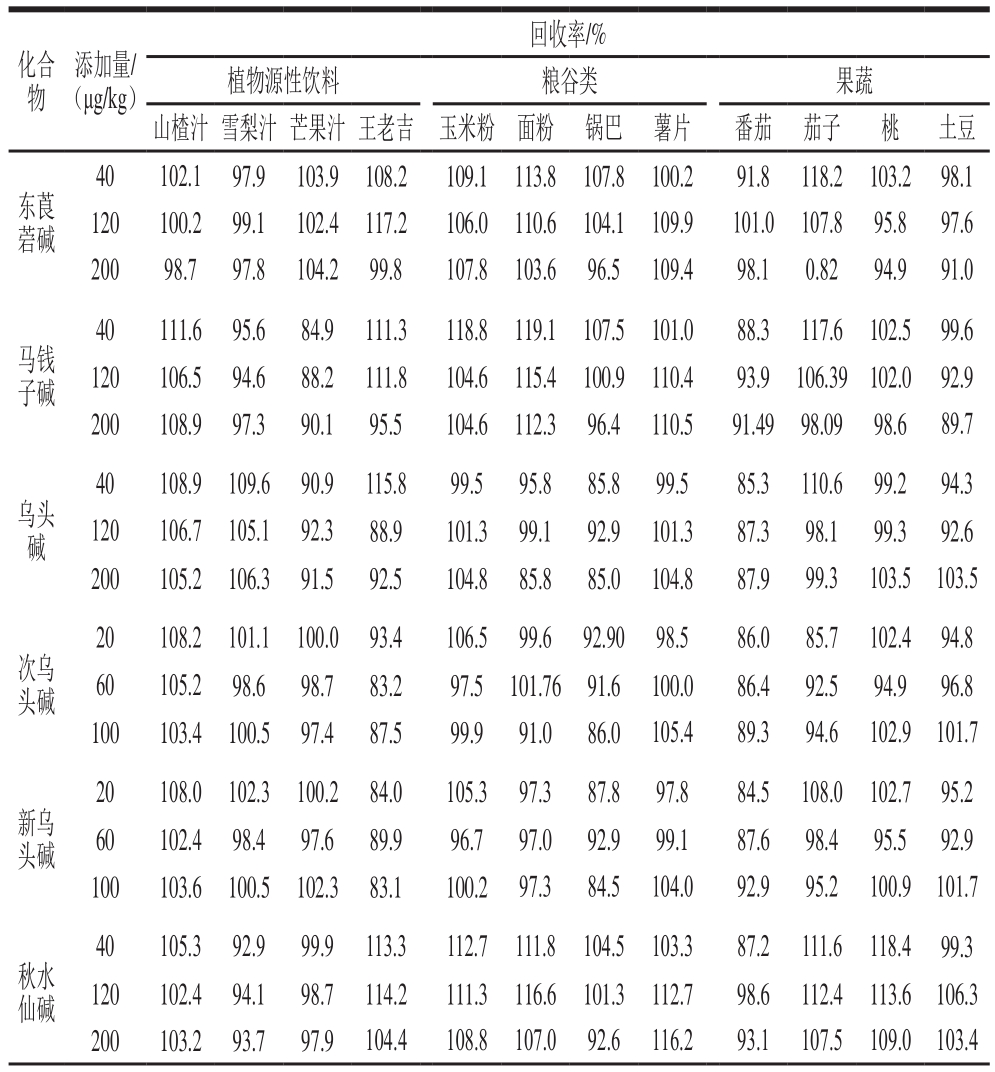
续表4

注:—.选择的添加样品存在本底,该添加水平回收率无法计算。
由表4可知,生物碱在植物源性饮料中回收率为83.1%~119.8%,相对标准偏差为0.05%~9.81%;粮谷类食品中回收率为82.4%~119.4%,相对标准偏差为0.06%~9.86%;果蔬类食品中回收率为80.9%~118.4%,相对标准偏差为0.01%~9.9%,均满足标准检测方法的要求。
表5 日内稳定性
Table 5 Intra-day stability

日内稳定性测定结果见表5,相对标准偏差为2.78%~5.21%,符合检测要求。
15 种生物碱质量浓度为20 μg/L,平行测定3 次。结果显示,各分析物的平均基质效应为17.5%~117.7%。评价结果见表6,阿托品、东莨菪碱、槟榔碱、士的宁、钩吻碱基质效应比较明显,实际样品检测时如检出该类物质,应该用阴性基质提取液配制的标准溶液定量。
表6 基质效应
Table 6 Matrix effect %
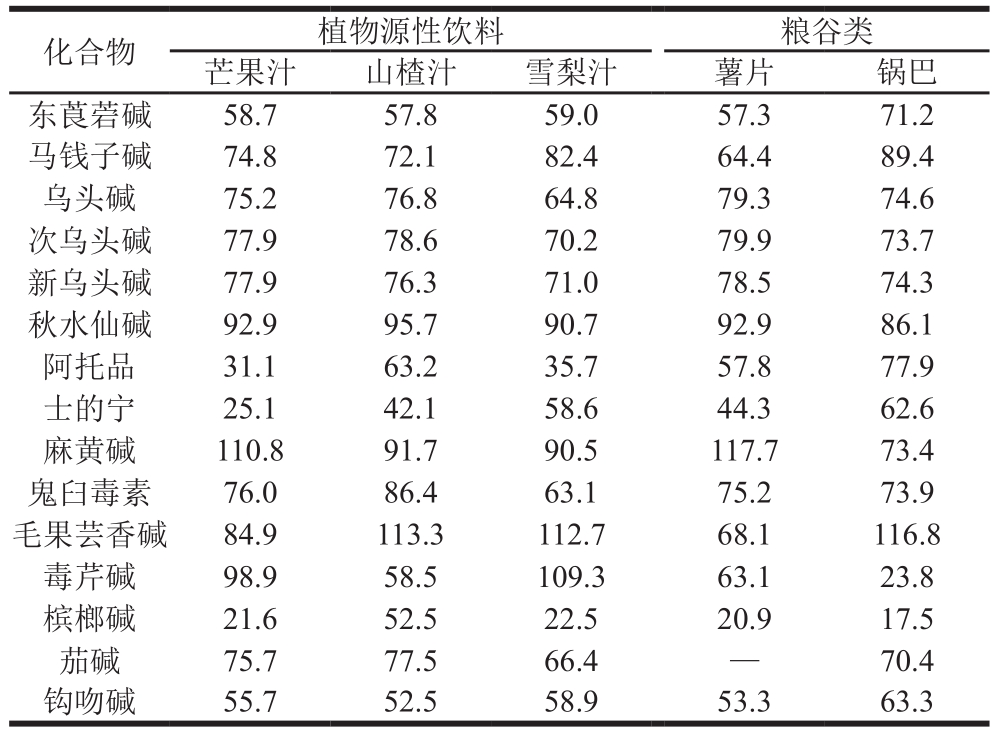
注:—.选择的基质样品存在本底,基质效应值无法计算。
使用本研究建立的分析方法,对典型植物源饮料、粮谷食品和果蔬等15 个样品进行了检测,其中锅巴和薯片样品中有茄碱检出,检出含量分别为800.4 μg/kg和100.3 μg/kg,其他生物碱均未检出。
本实验建立了食品中15 种有毒生物碱的高效液相色谱-串联质谱法,研究和优化提取条件、净化方式、色谱-质谱参数等指标,对方法的检出限、线性范围、回收率、精密度、基质效应进行评价和验证。经实际样品测定表明建立的高效液相色谱-串联质谱方法适用于植物源饮料、粮谷食品和果蔬等样品中15 种生物碱的检测。与贺琦等[3]建立的食品(红酒、牛奶、面包、米粉)中20 种有害生物碱含量测定的液相色谱-质谱法相比,本方法的适用范围更广,对粮谷类玉米粉、面粉、锅巴和薯片,果蔬类番茄、茄子、桃和土豆,植物源饮料类山楂汁、雪梨汁、芒果汁和王老吉等样品进行验证,并且前处理过程简单、快速,适用于主要食品中15 种有毒生物碱的快速筛查分析。本方法的建立为相关监测机构提供技术支撑,有利于保障消费者健康。
参考文献:
[1] 周贤春, 何春霞, 苏力坦·阿巴白克力. 生物碱的研究进展[J].生物技术通讯, 2006, 17(3): 476-479. DOI:10.3969/j.issn.1009-0002.2006.03.050.
[2] 吴丹, 巩江, 高昂, 等. 食物中常见生物碱研究进展[J]. 宁夏农林科技,2011, 52(3): 63-64; 66. DOI:10.3969/j.issn.1002-204X.2011.03.030.
[3] 贺琦, 黄玲凤, 李忠达, 等. HPLC-MS法同时检测多类食品中20 种有害生物碱含量[J]. 闽南师范大学学报(自然科学版), 2017(3):54-62. DOI:10.16007/j.cnki.issn2095-7122.2017.03.007.
[4] 徐敏慧, 刘珂伟, 张晓慧, 等. 马铃薯中龙葵素的研究进展[J]. 保鲜与加工, 2017, 17(1): 112-116; 121.
[5] 陈学国, 赖永权, 蔡宗苇. 液相色谱-电喷雾离子阱质谱分析乌头碱及其代谢物[J]. 质谱学报, 2012, 33(2): 65-72.
[6] 唐步罡, 孟品佳, 孟梁. 有毒生物碱阿托品的检验现状[J]. 刑事技术,2013, 38(5): 33-36. DOI:10.3969/j.issn.1008-3650.2013.05.011.
[7] 佘彩蒙, 杜鸿雁, 王芳琳, 等. 超高效液相色谱-串联质谱法检测全血中的东莨菪碱和阿托品[J]. 刑事技术, 2017, 42(2): 133-136.DOI:10.16467/j.1008-3650.2017.02.011.
[8] 申利红, 李雅. 秋水仙碱的研究与应用进展[J]. 中国农学通报, 2009,25(21): 185-187.
[9] 范洪涛, 尤楠, 唐世军. 秋水仙碱分析方法的研究概述[J]. 化工研究,2010, 21(4): 96-101. DOI:10.3969/j.issn.1008-1011.2010.04.024.
[10] 陆炜强, 傅承新, 赵云鹏. 鬼臼毒素生物合成研究进展[J]. 中国中药杂志, 2011, 36(9): 1109-1114. DOI:10.4268/cjcmm20110901.
[11] 王朝虹, 果德安, 胡春华. 反相高效液相色谱法测定全血中马钱子碱和士的宁的含量[J]. 色谱, 2003, 21(4): 382-384. DOI:10.3321/j.issn:1000-8713.2003.04.019.
[12] 候士果, 谷学新, 王书妍, 等. HPLC测定洋金花中东莨菪碱和阿托品的含量[J]. 中国中药杂志, 2006, 31(13): 1065-1067.
[13] 唐湘伟. 高效液相色谱法检测不同采收期邵阳龙牙百合的秋水仙碱含量[J]. 食品安全质量检测学报, 2018(5): 65-68.
[14] MAO Z S, WANG X, LIU Y D, et al. Simultaneous determination of seven alkaloids from Rhizoma Corydalis Decumbentis in rabbit aqueous humor by LC-MS/MS: application to ocular pharmacokubetic studies[J]. Journal of Chromatography B, 2017, 1057: 46-53.DOI:10.1016/j.jchromb.2017.04.040.
[15] ZHANG L, GAI Q H, ZU Y G, et al. Simultaneous quantitative determination of five alkaloids in Catharanthus rouseus by HPLCESI-MS/MS[J]. Chinese Journal of Natural Medicines, 2014, 12(10):786-793. DOI:10.1016/S1875-5364(14)60120-5.
[16] LI L Q, HUANG M Y, SHAO J L, et al. Rapid determination of alkaloids in Macleaya cordata using ionic liquid extraction followed by multiple reaction monitoring UPLC-MS/MS analysis[J]. Journal of Pharmaceutical and Biomedical Analysis, 2017, 135: 61-66.DOI:10.1016/j.jpba.2016.12.016.
[17] 韦力志, 陆仕华. UPLC-MS/MS同时测定十一方药酒中的马钱子碱与士的宁的含量[J]. 中国药师, 2018(2): 348-350.
[18] 王朝虹, 何毅, 张继宗, 等. 生物检材中乌头碱的GC/MS分析[J].中国法医学杂志, 2003, 18(3): 145-146; 153. DOI:10.3969/j.issn.1001-5728.2003.03.005.
[19] 杨玉林, 温忆敏, 芮振荣, 等. 气相色谱-质谱联用技术分析中毒样品中四种生物碱[J]. 中国卫生检疫杂志, 2004, 14(3): 272-273.DOI:10.3969/j.issn.1004-8685.2004.03.004.
[20] MARÍN-SÁEZ J, ROMERO-GONZÁLEZ R, GARRÍDO F A.Multi-analysis determination of tropane alkaloids in cereals and solanaceaes seeds by liquid chromatography coupled to single exactive-orbitrap[J]. Journal of Chromatography A, 2017, 1518: 46-58.DOI:10.1016/j.chroma.2017.08.052.
[21] 赛那, 金蓉, 布仁, 等. 高效液相色谱-四极杆/静电场轨道阱高分辨质谱法快速检测大鼠血浆中6 种附子生物碱[J]. 中国药房, 2018(6):46-50.
[22] MURAUER A, GANZERA M. Quantitative determination of major alkaloids in Cinchona bark by supercritical fl uid chromatography[J].Journal of Chromatography A, 2018, 1554: 117-122. DOI:10.1016/j.chroma.2018.04.038.
[23] LI L, XU L Y, CHEN M, et al. Simultaneous separation and determination of four uncaria alkaloids by capillary electrophoresis using dual cyclodextrin system[J]. Journal of Pharmaceutical and Bilmedical Analysis, 2017, 141: 39-45. DOI:10.1016/j.jpba/2017.04.001.
[24] LONG Z, ZHANG Y H, GAMACHE P, et al. Determination of tropane alkaloids by heart cutting reversed phase-strong cation exchange two dimensional liquid chromatography[J]. Journal of Chromatography B,2018, 1072: 70-77. DOI:10.1016/j.jchromb.2017.10.064.
[25] 段存贤, 郭承军. HPLC法测定神农丸中士的宁与马钱子碱的含量[J]. 药物分析杂质, 2018, 38(2): 331-335. DOI:10.16155/j.0254-1793.2018.02.21.
[26] 丁琳, 戴涌, 杨亚婷, 等. 莨菪浸膏片HPLC指纹图谱及莨菪烷类生物碱的定量分析研究[J]. 中草药, 2018(7): 100-104. DOI:10.7501/j.issn.0253-2670.2018.07.015.
[27] 刘晓茂, 杨志伟, 崔宗岩, 等. 固相萃取-液质联用测定火锅底料中5种生物碱[J]. 食品研究与开发, 2016, 37(22): 144-148. DOI:10.3969/j.issn.1005-6521.2016.22.033.
[28] 颜晓丽. 超高效液相色谱-串联质谱法测定食品中4 种罂粟壳生物碱[J]. 分析测试技术与仪器, 2017, 23(1): 11-17. DOI:10.16495/j.1006-3757.2017.01.003.
[29] 林黛琴, 王婷婷, 万承波, 等. 高效液相色谱-串联质谱法快速测定食品中5 种罂粟壳生物碱[J]. 质谱学报, 2017, 38(2): 239-247.DOI:10.7538/zpxb.youxian.2016.0041.
[30] 秦军燕, 陈文, 夏寅强, 等. HPLC-MS法测定食品中生物碱的研究[J]. 食品工业科技, 2012, 33(16): 73-75; 78. DOI:10.13386/j.issn1002-0306.2012.16.028.
[31] 康雪琴. 铁牛七生物碱提取工艺及几种乌头属药材中三种二萜生物碱的HPLC同时测定研究[D]. 西安: 陕西师范大学, 2007: 38-42.
Determination of 15 Toxic Alkaloids in Food Samples by High Performance Liquid Chromatography-Tandem Mass Spectrometry
FAN Sufang1, MA Junmei1, LIU Zhuo2, YU Jing1, ZHAI Hongwen1, LI Qiang1,*, ZHANG Yan1,*
(1. Hebei Food Inspection and Research Institute, Hebei Food Safety Key Laboratory, Shijiazhuang 050091, China;2. College of Bioscience and Bioengineering, Hebei University of Science and Technology, Shijiazhuang 050018, China)
Abstract:In this paper, a high performance liquid chromatography-tandem mass spectrometry (HPLC-MS/MS) method was established for the determination of 15 toxic alkaloids in food samples. Extraction conditions, purification methods and instrumental parameters were optimized. Samples were extracted with 20% ethanol solution, and the supernatant was separated and analyzed after centrifugation. The external standard method was used for quantification. The limits of detection (LODs) of 15 alkaloids were in range of 4-20 μg/kg and the limits of quantification (LOQ) were in range of 10-80 μg/kg. The recoveries of the method were in range of 80.9%-119.8% at spiked levels of LOQ, 3 LOQ and 5 LOQ, with relative standard deviations (RSDs) lower than 10%, which met the analytical requirements. This method was found to be useful for rapid screening and quantitative analysis of 15 toxic alkaloids in plant-derived drinks, cereal products, fruits and vegetables.
Keywords:high performance liquid chromatography-tandem mass spectrometry; food; toxic alkaloids
FAN Sufang, MA Junmei, LIU Zhuo, et al. Determination of 15 toxic alkaloids in food samples by high performance liquid chromatography-tandem mass spectrometry[J]. Food Science, 2018, 39(22): 283-288. (in Chinese with English abstract)DOI:10.7506/spkx1002-6630-201822043. http://www.spkx.net.cn
引文格式:范素芳, 马俊美, 刘茁, 等. 高效液相色谱-串联质谱测定食品中15 种有毒生物碱[J]. 食品科学, 2018, 39(22): 283-288.DOI:10.7506/spkx1002-6630-201822043. http://www.spkx.net.cn
文章编号:1002-6630(2018)22-0283-06
文献标志码:A
中图分类号:TS207.3
DOI:10.7506/spkx1002-6630-201822043
张岩(1979—),男,正高级工程师,博士,研究方向为食品安全。E-mail:snowwinglv@126.com
李强(1982—),男,正高级工程师,硕士,研究方向为食品安全。E-mail:liqiang@nepp.com.cn
*通信作者简介:
第一作者简介:范素芳(1985—),女,高级工程师,博士,研究方向为食品安全。E-mail:fansufang840502@163.com
基金项目:国家重大科学仪器设备开发专项(2012YQ03011110)
收稿日期:2018-04-03