
图1 菌株YL-1在光学显微镜下形态(10×40)
Fig. 1 Morphology of strain YL-1 under optical microscope (10 × 40)
宋佳佳1,古汶玉1,林昌浩1,张晓勇2,甘忠宏1,谢 莉1,高向阳1,*
(1.华南农业大学食品学院,广东 广州 514642;2.华南农业大学海洋学院,广东 广州 514642)
摘 要:目的:为弥补传统方法在检测菌株产毒素上的不足,用基因组方法分析橘青霉YL-1(Penicillium citrinum YL-1,P. citrinum YL-1)物质生物合成途径及关键基因,以此评价P. citrinum YL-1在鱼露发酵生产过程中的安全性。方法:应用ITS基因测序鉴定菌株,利用Illumina平台HiSeq测序技术对菌株YL-1进行基因组survey测序,通过生物信息分析产青霉毒素、黄曲霉毒素及典型丝状真菌毒素的非核糖体多肽合成代谢、聚合酮酶代谢、聚合酮酶-非核糖体多肽联合代谢、萜类化合物代谢和氨基酸相关代谢途径及基因,考察菌株YL-1产真菌毒素能力,判断其是否存在产真菌毒素的潜在危害。结果:ITS鉴定菌株YL-1与P. citrinum同源性99%,survey测序结果表明P. citrinum YL-1全基因组大小为31.92 Mb,GC为46.27%。利用Maker2基因预测技术得到预测基因11 980 个。其中,被KOG注释基因5 417 个,被COG注释基因4 946 个;比对KEGG数据库被注释通路323 条,注释基因3 525 个。代谢分析表明,注释到可能产真菌毒素相关的代谢途径有5 条,仅注释到1 种产黄曲霉毒素代谢途径的同源基因Af l d及其他5 种相关基因,但并未注释到其完整代谢途径。结论:ITS基因测序鉴定菌株YL-1为P. citrinum,P. citrinum YL-1基因注释存在1 种产黄曲霉毒素的同源基因及其他5 种相关基因,虽不存在完整代谢链,但P. citrinum YL-1运用于鱼露及相关产品的发酵安全性仍值得进一步考察。
关键词:橘青霉YL-1;真菌毒素;安全性;基因测序
真菌毒素是真菌代谢产生的次级天然毒性物质,主要包括黄曲霉毒素、镰刀菌毒素、赭曲霉毒素、棒曲霉毒素、玉米赤霉烯酮、青霉毒素等,它们几乎能污染所有食用和饲用农产品并对人类和动物健康造成巨大威胁[1-2]。橘青霉(Penicillium citrinum)是丝状真菌,青霉属,能作为发酵菌株[3]。青霉能产黄曲霉毒素和青霉毒素等真菌毒素[4],易使果蔬作物致病[5];部分青霉亦具有很高经济价值,如能产有机酸、制酶制剂、产青霉素等。由于青霉所具有的两面性,其应用备受争议。
真菌菌株YL-1是从中国潮汕传统酿造鱼露中分离的一株耐盐、高产蛋白酶菌株[6-7],经多方鉴定为P. citrinum,其能有效缩短鱼露发酵时间,能促进鱼露风味形成[8],但P. citrinum YL-1是否能产真菌毒素鲜见报道。基因测序技术可为真菌毒素研究提供一种便捷手段,能评估预测真菌潜在的毒素代谢途径和基因。吴荣等[9]运用基因测序技术对华根霉进行基因组测序,对基因序列进行功能注释及代谢分析,显示华根霉中仅存在少量聚酮合成、萜类化合物合成途径代谢基因,并未注释到根霉素、小孢根霉素及典型丝状真菌毒素的合成关键基因,且存在大量异源物质降解途径基因,表明华根霉基本不具备产目前已知的真菌毒素的关键基因或合成能力。对低渗及高渗压条件下的茯砖茶发酵黑曲霉进行基因组测序和转录组测序,基因功能注释及联合代谢分析均未检测到与致癌物产生有关的基因簇,从基因水平和转录水平验证了茯砖茶发酵黑曲霉的安全性[10]。随着基因测序技术的发展及完善,菌株基因测序越来越常态化,这为工业菌株的安全评价提供了一种可靠模式。
本实验通过分析P. citrinum YL-1基因组,主要针对非核糖体多肽合成代谢(nonribosomal peptide synthetase,NRPS)、聚合酮酶代谢(polyketide synthase,PKS)、PKS-NRPS联合代谢和萜类化合物代谢、氨基酸相关代谢等涉及产真菌毒素基因和途径进行分析[11],从基因水平判定P. citrinum YL-1安全性,弥补传统手段针对真菌毒素检测存在的缺陷。
菌株YL-1由中国著名汕头鱼露厂所产鱼露发酵液中分离[6]。
硝酸钠、磷酸氢二钾、硫酸镁(MgSO4·7H2O)、氯化钾、硫酸亚铁(均为分析纯) 广州精科仪器试剂有限公司;三羟甲基氨基甲烷、琼脂糖、Gold View染液、冰醋酸、乙二胺四乙酸 广州生工生物科技有限公司。
Ba600mot普通生物学显微镜 广州汇腾科学仪器有限公司;DYY-6C型电泳仪 北京市六一仪器厂;聚合酶链式反应(polymerase chain reaction,PCR)扩增仪美国Bio-Rad公司;YA28X-4T/10高压灭菌锅 上海江霞阀门成套设备有限公司;SW-CJ-1G型单人净化工作台广州瑞智设备有限公司。
1.3.1 菌株YL-1培养及形态学观察
察式培养基配制参考Xiao Yunzhu[6]、Xie Li[8]等方法,10%盐度察式液体培养基在原基础加入对应浓度氯化钠。菌株YL-1经10%盐度察式培养基培养24 h后,菌体挑于显微镜下压片观察。
1.3.2 菌株YL-1分子生物学鉴定
参照ZR Fungal/Bacterial DNA MiniPrepTM试剂盒提取菌株YL-1 DNA,依据霉菌通用ITS1/ITS4引物扩增YL-1菌株ITS基因序列。反应体系共25 µL,包含Premix Taq 12.5 µL,ITS1及ITS4各1 µL,YL-1菌株DNA 1 µL,无菌水9.5 µL。95 ℃预变性5 min,95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,25 次循环,72 ℃延伸10 min。在凝胶成像系统中观察扩增产物凝胶电泳结果,并切取合适条带进行纯化,并送上海美吉生物医药科技有限公司测序[6]。
依据BLAST软件及GenBank数据库比对测定菌株的ITS基因序列,在NCBI数据库中进行分析,选取1 株雅致放射毛霉菌株(Actinomucor elegans strain QH23)及3 株霉菌模式种的ITS基因序列作为外群,采用MEGA 5.05软件分析菌株YL-1系统发育,依据Neighbor-Joining法构建菌株YL-1的系统发育树[6]。
1.3.3 菌株YL-1保藏
菌株YL-1鉴定为P. citrinum,经广东省微生物研究中心再次鉴定后保藏。
1.3.4 菌株P. citrinum YL-1样品制备及测序
10%盐度察式液体培养基培养菌株YL-1,菌液12 000 r/min离心10 min,获得P. citrinum YL-1菌体,-80 ℃保藏送样测序,菌株基因组survey测序由广州美吉生物科技有限公司完成。
1.3.5 P. citrinum YL-1基因组扫描测序数据
P. citrinum YL-1委托广州美吉生物科技有限公司应用Illumina平台HiSeq测序技术进行基因组survey测序,原始图像数据经过Base Calling转化为序列数据,对序列数据进行碱基质控及数据质量剪切及评估。运用SOAPdenovoV2.04组装软件对优化序列进行拼接,再利用GapCloser v1.12软件对组装结果进行碱基校正及局部内洞填充。对获取的优化序列进行包括rRNA/tRNA查找、重复序列筛选等生物信息分析;其他匹配基因相关信息获取来自网络数据库公布数据(https://www.ncbi.nlm.nih.gov/)。
1.3.6 P. citrinum YL-1 survey测序基因预测与注释
利用GeneMark软件与Augustus软件分析优化序列,评估预测编码区及基因,得到基因序列信息后上传至NR、GO、Genes、String等数据库并进行比对,从而获得预测基因的注释信息。
1.3.7 基因组比较
依据MUMmer工具包中Mummer程序比对P. citrinum YL-1基因组与其他典型的产真菌毒素菌的菌株的基因组信息,评估P. citrinum YL-1基因组产真菌毒素性能。
数据采用SPSS 12.0进行初步处理;基因进化树采用MEGA N-J法构建,其他图像采用Origin Pro 8.5、Adobe_Photo shop_CS5及Vision 2003处理。
如图1所示,在显微镜下观察菌株YL-1形态学特征,发现分生孢子链为明显的分散柱状,大多分生孢子梗从基质生出,梗壁平滑,少量从气生菌丝生出,且长度较小;孢子近球形,大小2.5~3.2 μm,孢子壁圆滑;呈帚状枝单轮生或双轮生;每轮梗基3~5 个,大小为8.0~16×2.5~3.0 μm,顶端膨大,囊状;中部瓶状,梗颈短,大小为8.0~9.0×2.0~2.5 μm。在形态学上与青霉属菌株相近。

图1 菌株YL-1在光学显微镜下形态(10×40)
Fig. 1 Morphology of strain YL-1 under optical microscope (10 × 40)
1%琼脂糖凝胶电泳显示YL-1菌株ITS基因序列PCR扩增的DNA长度在500~750 bp之间,条带清晰,亮度高。达到常规ITS基因序列鉴定要求。如图2所示,经测定,其DNA长度为bp。

图2 菌株YL-1的ITS扩增序列电泳图
Fig. 2 PCR amplification of the ITS sequence of strain YL-1

图3 基于ITS基因序列相似性构建菌株YL-1系统进化树
Fig. 3 Phylogenetic tree constructed for strain YL-1 based on ITS gene sequence similarity
依据BLAST软件与GenBank数据库中的已知模式霉菌序列对菌株YL-1的ITS序列进行同源性比对,结果表明,菌株YL-1与Penicillium同源性极高。构建进化树如图3所示,菌株YL-1与P. citrinum处于同一分支上,且同源性高达99%,因此确定菌株YL-1为P. citrinum(P. citrinum YL-1,NCBI登录号:KF544957)。
菌株YL-1交由广东省微生物菌株保藏中心再次鉴定为P. citrinum,鉴定结果与本实验室鉴定结果一致;并对菌株进行保藏,保藏号GDMC60027,保藏方式为-80 ℃真空冷冻冻干。
2.5.1 P. citrinum YL-1基因组测序拼接与注释
P. citrinum YL-1测序结果表明其基因组大小在31.92 Mb左右,大小适中,GC含量为46.27%,属于常规真菌GC含量范围。对基因数据进行质量分析发现1 000 bp以上基因组覆盖率为99.51%。对测序后拼接片段进行基因预测与编码区分析,共预测得编码基因11 980 个,平均基因长度为1 349 bp。预测基因序列转换成蛋白序列与多个数据库NR、KEGG、COG/KOG、Genes、GO及String进行比对,获得相应功能注释信息,最终被KOG注释基因5 417 个,被COG注释基因4 946 个,未被KOG/COG注释1 289 个,KOG/COG注释率高达86.5%,表明编码基因质量良好;被KEGG注释基因3 525 个(表1)。P. citrinum YL-1基因组序列原始数据NCBI登陆号:SRR6322469。
表1 组装及注释结果统计
Table 1 Genomic assembly and annotation statistics

2.5.2 P. citrinum YL-1基因功能KOGs分类
对菌株进行KOGs基因注释与功能分类可进一步揭示菌株的生理代谢过程。P. citrinum YL-1基因功能可分为24 个功能组,如图4所示,其中约13.38%预测为常规的功能基因分组;涉及分子功能的也较多,包括基因复制、转录、修复、翻译、重组和核糖体结构和生物合成、翻译后修饰及信号传导机制,蛋白翻转和分子伴侣、碳水化合物转运与代谢及氨基酸运输与代谢等,在250~400之间;而针对细胞保护、胞外结构及核结构注释的基因较少,几乎没有注释到细胞修饰相关的基因;约7.65%的预测基因由于蛋白质功能不能确定,匹配性较差,所具备的生理功能尚不清楚,未能有良好匹配结果。而在次级代谢中,存在较多的降解途径,主要涉及对芳香族类化合物、萜烯类化合物等,这与鱼露发酵中丰富的风味物质形成可能相关,鱼露在发酵初期优势菌经分泌各种酶(主要为蛋白酶)水解鱼体生成多种氨基酸、糖类,这些物质通过一系列的变化进一步形成醛类、酮类、芳香族类及萜烯类化合物,构成鱼露发酵后期特殊的色泽、香气,并最终赋予鱼露特征滋味[12];同时KOGs注释也匹配到一些与药物代谢的途径,可能与青霉属菌株具有产青霉素等同源性基因相关[13]。
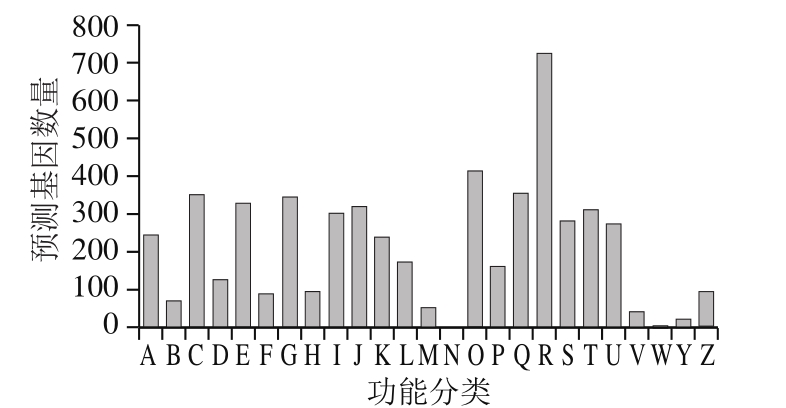
图4 P. citrinumYL-1预测基因KOGs分类
Fig. 4 KOGs functional classi fi cation of predicted genes of P. citrinum YL-1
A.加工和修饰;B.染色质结构和形态;C.能量生产和转换;D.细胞周期控制、细胞分裂、染色体分割;E.氨基酸转运和代谢;F.核苷酸转运和代谢;G.碳水化合物的运输和代谢;H.辅酶转运和代谢;I.脂质转运和代谢;J.翻译、核糖体结构和生物转化;K.转录;L.复制、重组和修复;M.细胞壁/膜/包膜生物发生;N.细胞运动;O.翻译后修饰、蛋白质翻转、分子伴侣;P.无机离子转运和代谢;Q.次生代谢产物的生物合成、转运和分解代谢;R.预测只有常规功能;S.未知功能;T.信号转导机制;U.细胞内运输、分泌和囊泡运输;V.防御机制;W.细胞外结构;Y.核结构;Z.细胞骨架。
据报道,已有400多种真菌毒素相继被发现,其中包含霉菌毒素300多种。对这些真菌毒素的产生途径分析可知,大多毒素形成都需要通过PKS、NRPS等四大途径及关键基因调控,极少部分通过氨基酸代谢等途径产生[9]。基于P. citrinum YL-1基因组分析与基因注释结果,分析涉及到的途径及关键基因,可以从基因水平上评估P. citrinum合成真菌毒素的潜在可能性及产真菌毒素的能力。
2.6.1 非核糖体多肽类与聚酮代谢
大多数真菌毒素合成中的关键代谢途径是非核糖体多肽类与聚酮代谢及混合代谢。在青霉属中,多数真菌毒素也是由这些代谢途径产生前体物质,再经过催化和后期修饰合成,典型的如黄曲霉毒素[14]、青霉素[15]等真菌毒素的前体物质。另外在曲霉中也有报道PKS-NRPS是环匹阿尼酸生物合成的关键途径[16];红曲霉被运用于我国传统酿造工业中,研究发现少量红曲霉也能产生毒素,并大多通过PKS途径进行合成[17]。同样在青霉中发现的大多数真菌毒素也主要是通过NRPS途径、PKS途径调控合成。如表2所示,仅注释到一种能合成黄曲霉毒素的基因簇基因Alfd(去氧松酸酮还原酶)及其他5 种相关基因:乙酰辅酶A羧化酶基因Acac、葡萄球菌8-O-甲基转移酶基因Mota 2 个、去甲基海马胆囊素6-O-甲基转移酶基因Motb 2 个(KO:00254)。在黄曲霉合成基因簇的基因中,pksL、Alfc、pksA为合成关键基因,LaeA为全局调控因子,在转录水平上的调节至关重要;而Af l R和Af l r这2 个基因对黄曲霉毒素合成基因簇中的特异性转录因子起到了十分重要的作用,除Af l J外其他基因均受到Af l R基因的调控[18]。虽注释到一种能合成黄曲霉毒素的基因簇同源基因Alfd,但其他黄曲霉合成基因簇同源基因并未注释,特别是调控基因LaeA及aflR基因等;且Alfd基因主导的黄曲霉毒素代谢途径尚不完整,缺乏关键的基因Pksa、Alfc、pksA,注释到的黄曲霉毒素合成基因Alfd同源性仅为81%,相似性不高。因此以目前的数据不认为P. citrinum YL-1在鱼露发酵过程中存在产真菌毒素的PKS途径。
表2 注释涉及产真菌毒素四大途径及其他代谢
Table 2 Annotation of the 4 key biosynthetic pathways and related genes as well as other metabolites

注:—.未作统计或无法计数;关键基因.该途径或者该物质合成的主要调控基因;涉及基因.目前该途径或者该物质合成的所有相关基因;注释基因. P. citrinum YL-1测序基因注释到该物质或者该途径的基因。
对于NRPS途径,仅注释到微囊藻毒素合成途径中的一种天冬氨酸消旋酶McyF相关基因(KO:01054),表明P. citrinum YL-1基本不存在产生真菌毒素的NRPS途径。PKS-NRPS联合代谢途径一般存在于共生菌中,如小孢根霉素及根霉素是由根霉Rhizopus microsporus内共生菌Burkholderia属菌所产生,在根霉属(Rhizopus spp.),有存在内共生细菌的报道[19],也有报道提及Aspergillus也可能作为红曲霉的内生菌[20],但目前在P. citrinum相关研究中鲜见报道。


图5 17-mer杂合率评估
Fig. 5 Evaluation of 17 mer hybrid rate
采用模拟数据拟合,分别加入杂合率0.1%、0.2%、0.3%、0.5%、1%、2%进行模拟;A. P. citrinum YL-1 17-mer测序图;B.拟合图。
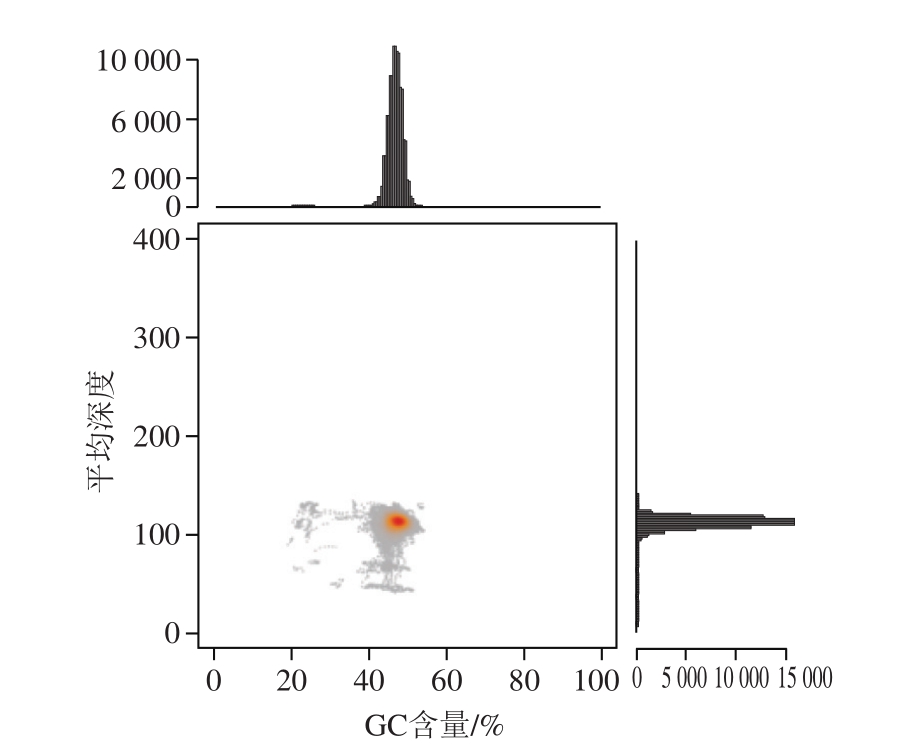
图6 P. citrinumYL-1测序深度与GC含量相关性分析(以10 000 bp为标准)
Fig. 6 Correlation analysis between sequencing depth and GC content of P. citrinum YL-1 (Standardized by 10 000 bp)
对P. citrinum YL-1菌株杂合率、测序深度与GC含量关联分析来考察P. citrinum YL-1测序序列信息的质量情况,来判断在P. citrinum YL-1基因组测序数据中是否存在其他菌种(内共生菌)基因序列。对菌株杂合率进行分析,运用K-mer频率分布统计确定,如图5所示。P. citrinum YL-1的杂合率远低于0.1%,杂合率低。这一结果和送样菌株检测与P. citrinum同源性极高的结果相吻合。由图6可知,GC含量和覆盖率数据相对集中,不成分散状态,GC含量在44%~56%之间。杂合率、测序深度与GC含量关联分析表明P. citrinum YL-1菌株不存在共生菌。吴荣等[9]在华根霉全基因组数据时,通过杂合率分析排除了华根霉产共生菌的可能性,也是基于此种分析。在基因注释结果中,也未发现PKS-NRPS混合代谢途径,表明P. citrinum YL-1不存在PKS-NRPS混合代谢合成途径。
2.6.2 萜类化合物代谢途径
真菌毒素也可能由萜类化合物代谢产生,如典型的单端孢霉烯族毒素,此类毒素主要是由Fusarium、Stachybotrys和Myrothecium等真菌属产生[21-23]。目前已有200多种单端孢霉烯族毒素被报道。它的合成机理是先经过萜类化合物代谢生成前体物质,再经法尼基焦磷酸环化为萜类物质,在这一过程中乙酰转移酶和多个C15细胞色素P450单加氧酶起到关键调控作用,并有转运蛋白参与合成[21]。但并不是所有的萜类物质都均有毒性,相反还具有一定的生理活性,如名贵中草药灵芝三萜[24]、角鲨烯[25]等对人类许多疾病的预防和治疗有显著疗效。
P. citrinum YL-1基因组次级代谢部分KEGG注释(图4),P. citrinum YL-1基因组有40 个基因注释到萜类化合物代谢中(KO:0013、00900、00909、00904),包括15 个有关萜类化合物降解的基因,他们主要分布在辅酶Q和其他萜类-醌类化合物代谢途径中,参与生育酚、质醌等物质的合成;在萜类物质合成骨架结构注释到20 个基因,三萜和倍半萜合成途径注释到4 个基因,二萜化合物合成途径仅注释到1 个基因(表2),这些结果表明P. citrinum YL-1有合成萜类物质的潜在可能性,但并不意味能合成真菌毒素。代谢通路关联分析表明,戊磷酸代谢后产物能间接作用于辅酶Q和其他类萜醌合成,并进入倍半类萜和三萜化合物代谢途径,参与角鲨烯三萜化合物的合成;而对于二萜合成途径,仅注释到一个赤霉素双氧酶基因,二萜化合物的合成不成完整途径,赤霉素双氧酶也不属于真菌毒素物质合成关键酶[26],故此注释途径无法形成产生真菌毒素相关的通路。综上表明P. citrinum YL-1不存在合成毒性萜类化合物的途径,反而注释到角鲨烯合成的完整途径,这为P. citrinum YL-1的研究及综合开发利用提供一个良好的契机。作为中国传统鱼露发酵中的重要产酶菌株,经过长时间的微生物菌群演变,P. citrinum YL-1能在高盐环境中脱颖而出,可见其具有多方面的应用价值。
2.6.3 其他次级代谢途径
P. citrinum YL-1还存在其他大量次级代谢途径(图4),其中注释到的部分细胞色素P450不仅是萜类化合物代谢的关键酶,许多还是药物代谢、异源物质代谢等药物代谢过程中的关键酶[21]。相对来说,P. citrinum YL-1个别的基因与酶注释到青霉素、链霉素、新生霉素等抗生素合成途径,但并没有完整的代谢通路(KO:00521、00401、00311),暗示P. citrinum YL-1可能存在合成青霉素、链霉素、新生霉素等抗生素的潜在性(表2)。这与P. citrinum YL-1存在于鱼露发酵生产,在长时间多菌相发酵中能强势生长的情况存在关联,高盐及P. citrinum菌株可能分泌的抗生素对其他微生物有抑制作用,而P. citrinum本身对盐度有高度的耐受性[6]。除了以上四大途径,部分真菌毒素还能由氨基酸合成或协助合成,但注释到的氨基酸代谢途径仅参与了质醌、生育酚、维生素等物质的合成,这与测序基因组中RNA查找的某些转运氨基酸个数的多少可能存在一定联系,如图7所示;注释途径关联分析中并没有发现氨基酸代谢流向真菌毒素产生途径的趋势,表明P. citrinum YL-1存在氨基酸代谢产生真菌毒素的可能性极小。由目前报道可知,虽可能还存在真菌毒素产生的其他途径,但几乎均由上述几大类代谢途径单个或多个协同作用产生,如在对Aspergillus ustus和A. terreus研究中发现聚酮代谢同萜类化合物代谢混合作用能产生Austin[27]与Austinol[28]。基于以上分析表明,在P. citrinum YL-1中,仅注释到黄曲霉毒素的合成途径,但其合成途径并不完整,并不存在其他典型真菌毒素合成的完整代谢途径,相反注释到的药物代谢途径可能对部分毒素还存在降解能力,但并不能完全排除P. citrinum YL-1产真菌毒素的可能性。

图7 P. citrinumYL-1注释tRNA氨基酸种类统计图
Fig. 7 The types and amounts of tRNA amino acids annotated in P. citrinum YL-1
鱼露在我国食用历史悠久,其味道滋润鲜美,香气宜人,且营养价值高,富含各种必需氨基酸、多种有机酸和微量元素,并且还富含牛磺酸,因此广受人们喜爱。菌株YL-1是从鱼露发酵液中分离出的一株真菌,具有耐盐及高产蛋白酶的特性,本研究对菌株YL-1进行生物学及分子学鉴定其为P. citrinum,与实验室前期研究结果高度一致[6]。利用菌株基因组survey测序信息从基因水平上分析P. citrinum YL-1产毒素的潜在能力,相对验证了该菌株的安全性,与传统菌株毒理性的研究相比,其简单便捷。全基因survey测序显示P. citrinum YL-1基因组大小为31.92 Mb,与大多数真菌的基因含量相吻合;GC含量为46.27%,属于常规物种的水准,表明测序结果良好。初步注释基因11 980 个,主要注释基因分布在糖酵解、氨基酸代谢及碳水化合物转运与代谢等途径,其次在核糖体结构和生物合成、翻译后修饰、信号传导机制等途径也存在大量注释基因,另外在分子伴侣和蛋白翻转、氨基酸运输与代谢等也存在较多注释基因,注释基因功能覆盖面较为全面,能良好代表P. citrinum YL-1实际生物信息。通过基因注释信息与特异序列比对可知,在P. citrinum YL-1中,不存在目前已报道的青霉毒素和其他典型真菌毒素关键代谢途径;可能存在1 种产黄曲霉毒素的同源性基因Afld及其他5 种相关基因,但并未注释到其完整通路,显示P. citrinum YL-1在基因水平上几乎不产真菌毒素,与吴荣等[9]基于基因组测序数据对华根霉产真菌毒素进行分析的方法及结果相似。在对鱼露发酵不同时期的菌相做分析时,也发现有黄曲霉的存在,因此,对鱼露中是否含有黄曲霉毒素以及它的合成代谢来源还应做进一步分析。
由于仍有很多真菌毒性物质的产生途径及基因没有被挖掘和分析,或者仍有一些毒素的产生机理并不属于以上四大途径,亦或未在各数据库中公布,所以并不能完全排除P. citrinum YL-1不产真菌毒素的可能性。可结合当前动物实验、仪器检测[29]或探针免疫技术[30]等其他技术对P. citrinum YL-1安全性进行综合性评价。在对P. citrinum YL-1溶血性实验中,以洛克福青霉P. roqueforti NL-1为阴性对照,结果显示P. citrinum YL-1作用小鼠血液后没有出现溶血现象,表明P. citrinum YL-1对小鼠红细胞没有毒害作用,这与从基因水平上分析P. citrinum YL-1不产毒素的结果相吻合,在现有的数据上进一步佐证了P. citrinum YL-1运用于鱼露及相关产品的发酵相对是安全的,但也不能绝对排除P. citrinum YL-1不产毒素的特性,P. citrinum YL-1应用于鱼露发酵的安全性仍值得进一步关注考察。
参考文献:
[1] 何智勇, 牛红红, 魏春雁, 等. 真菌毒素的危害及应对措施[J]. 吉林农业, 2016(22): 100-101. DOI:10.14025/j.cnki.jlny.2016.22.052.
[2] 张焕, 王加启, 高亚男, 等. 霉菌毒素对畜禽的危害及其毒性降解研究进展[J]. 中国饲料, 2017(4): 12-16. DOI:10.15906/j.cnki.cn11-2975/s.20170404.
[3] NOUT M J R, AIDOO K E. Asian fungal fermented food[J]. Industrial Applications, 2010, 10: 29-58. DOI:10.1007/978-3-642-11458-8_2.
[4] 吉小凤, 张巧艳, 李文均, 等. 黄曲霉毒素B1脱毒菌株LAB-10的分离、鉴定及降解能力分析[J]. 微生物学通报, 2012(8): 1094-1101.DOI:10.13344/j.microbiol.china.2012.08.003.
[5] 王永崇. 作物病虫害分类介绍及其防治图谱: 柑橘青霉病及其防治图谱[J]. 农药市场信息, 2017(3): 69. DOI:10.13378/j.cnki.pmn.2017.03.060.
[6] XIAO Y Z, WU D K, ZHAO S Y, et al. Statistical optimization of alkaline protease production from Penicillium citrinum YL-1 under solid-state fermentation[J]. Preparative Biochemistry and Biotechnology,2015, 45(5): 447-462. DOI:10.1080/10826068.2014.923450.
[7] XIAO Y Z, ZHAO S Y, WU D K, et al. Real-time PCR quantification of protease-producing bacteria in traditional Chinese fish sauce[J].Food Analytical Methods, 2014, 7(8): 1634-1642. DOI:10.1007/s12161-014-9799-5.
[8] XIE L, XIAO Y Z, GAO X Y. Purification and characterization of a halotolerant alkaline serine protease from Penicillium citrinum YL-1 isolated from traditional Chinese fi sh sauce[J]. Food Biotechnology,2016, 30(2): 137-153. DOI:10.1080/08905436.2016.1168305.
[9] 吴荣, 王栋, 徐岩, 等. 基于全基因组数据华根霉产真菌毒素分析[J].微生物学通报, 2013, 40(8): 1437-1447. DOI:10.13344/j.microbiol.china.2013.08.004.
[10] GE Y Y, WANG Y H, LIU Y X, et al. Comparative genomic and transcriptomicanalyses of the Fuzhuan bricktea-fermentation fungus Aspergillus cristatus[J]. BMC Genomics, 2016, 17(1): 428.DOI:10.1186/s12864-016-2637-y.
[11] 王龑, 刘阳, 刘伊宁. 产毒真菌基因组研究进展[J]. 生物技术通报, 2015, 31(2): 26-34. DOI:10.13560/j.cnki.Biotech.bull.1985.2015.02.004.
[12] ZHAO J, JIANG Q, XU Y, et al. Effect of mixed kojis on physiochemical and sensory properties of rapid-fermented fi sh sauce made with freshwater fi sh by-products[J]. International Journal of Food Science & Technology,2017, 56(9): 2088-2096. DOI:10.1111/ijfs.13487.
[13] LIU H, ZHENG Z, WANG P, et al. Morphological changes induced by class III chitin synthase gene silencing could enhance penicillin production of Penicillium chrysogenum[J]. Applied Microbiology & Biotechnology,2013, 97(8): 3363-3372. DOI:10.1007/s00253-012-4581-3.
[14] 王后苗, 廖伯寿, 雷永, 等. 黄曲霉菌主要真菌毒素次级代谢与调控的研究进展[J]. 微生物学通报, 2014, 41(7): 1425-1438.DOI:10.13344/j.microbiol.china.130598.
[15] ARSECULERATNE S N, ARSECULERATNE G. A re-appraisal of the conventional history of antibiosis and penicillin[J]. Mycoses, 2017,60(5): 343-347. DOI:10.1111/myc.12599.
[16] UKA V, MOORE G G, ARROYO M N, et al. Unravelling the diversity of the cyclopiazonic acid family of mycotoxins in Aspergillus flavus by UHPLC Triple-TOF HRMS[J]. Toxins, 2017, 9(1): 35-75.DOI:10.3390/toxins9010035.
[17] LIANG B, DU X, PING L, et al. Orf6 gene encoded glyoxalase involved in mycotoxin citrinin biosynthesis in Monascus purpureus,YY-1[J]. Applied Microbiology & Biotechnology, 2017, 101(19): 1-12.DOI:10.1007/s00253-017-8462-7.
[18] 支庆庆, 李洁莹, 于雷, 等. 黄曲霉毒素生物合成代谢相关的基因组信息挖掘和转录调控因子研究进展[J]. 生命科学, 2016, 28(1): 44-50.DOI:10.13376/j.cbls/2016006.
[19] ROSS C, OPRL V, SCHERLACH K, et al. Biosynthesis of antifungal and antibacterial polyketides by Burk-holderia gladioli in coculture with Rhizopus microsporus[M]//The constitution of glasses:Interscience Publishers, 2014: 48-55. DOI:10.1111/myc.12246.
[20] LONG Y, CUI H, LIU X, et al. Acetylcholinesterase inhibitory meroterpenoid from a mangrove endophytic fungus Aspergillus sp. 16-5c[J]. Molecules, 2017, 22(5): 727-734. DOI:10.3390/molecules22050727.
[21] ETZERODT T, WETTERHORN K, DIONISO G, et al. Functional characterization of a soluble NADPH-cytochrome P450 reductase from Fusarium graminearum[J]. Protein Expression & Purification,2017, 138: 69-75. DOI:10.1016/j.pep.2017.07.001.
[22] SKROBOT F I, DIEHL S V, BORAZIJANI H. Mycotoxin production by Stachybotrys chartarum on water-damaged building materials[J]. Bioresources, 2017, 12(3): 6490-6503. DOI:10.15376/biores.12.3.6490-6503.
[23] LI S, LI Z, TAN Q, et al. New cytotoxic trichothecene macrolide epimers from endophytic Myrothecium roridum IFB-E012[J]. Journal of Antibiotics, 2016, 69(8): 652-655. DOI:10.1038/ja.2016.86.
[24] 陈慧, 杨海龙, 刘高强. 灵芝三萜的生物合成和发酵调控[J]. 菌物学报, 2015, 34(1): 1-9. DOI:10.13346/j. mycosystema.130185.
[25] 刘纯友, 马美湖, 靳国锋, 等. 角鲨烯及其生物活性研究进展[J]. 中国食品学报, 2015, 15(5): 147-156. DOI:10.16429/j.1009- 7848.2015.05.020.
[26] 黄桃鹏, 李媚娟, 王睿, 等. 赤霉素生物合成及信号转导途径研究进展[J]. 植物生理学报, 2015, 51(8): 1241-1247. DOI:10.13592/j.cnki.ppj.2015.0242.
[27] STIERLE D B, STIERLE A A, HOBBS J D, et al. Berkeleydione and berkeleytrione, new bioactive metabolites from an acid mine organism[J]. Cheminform, 2004, 35(32): 1049-1052. DOI:10.1021/ol049852k.
[28] LO H C, ENTWISTLE R, GUO C J, et al. Two separate gene clusters encode the biosynthetic pathway for the meroterpenoids austinol and dehydroaustinol in Aspergillus nidulans[J]. Journal of the American Chemical Society, 2012, 134(10): 4709-4720. DOI:10.1021/ja209809t.
[29] 李莉, 金铭特. 应用高效液相色谱法检测食品中黄曲霉毒素[J]. 食品安全导刊, 2018(12): 104. DOI:10.16043/j.cnki.cfs.2018.12.071.
[30] 谢体波, 易重任, 陈旭, 等. 食品中黄曲霉毒素B1ELISA试剂盒检测方法的建立及验证[J]. 湖北农业科学, 2016, 55(4): 1008-1012.DOI:10.14088/j.cnki.issn0439-8114.2016.04.048.
Molecular Identification and Safety Evaluation of Penicillium citrinum YL-1 from Fish Sauce Based on Fungal Genomic Sequencing
SONG Jiajia1, GU Wenyu1, LIN Changhao1, ZHANG Xiaoyong2, GAN Zhonghong1, XIE Li1, GAO Xiangyang1,*
(1. College of Food Science, South China Agricultural University, Guangzhou 514642, China;2. College of Marine Sciences, South China Agricultural University, Guangzhou 514642, China)
Abstract:Objective: In order to overcome the deficiency of the traditional method to toxin-producing fungi, the toxin biosynthetic pathways and related key genes in Penicillium citrinum YL-1 were investigated by genomics to evaluate the safety of P. citrinum YL-1 during fi sh sauce fermentation. Methods: The strain was identified by internal transcribed spacer(ITS) sequencing. Genome survey of strain YL-1 was performed using the Illumina HiSeq platform. The key synthetic pathways and genes involved in the synthesis of Penicillium toxin and aflatoxin, as well as mycotoxin metabolism in which strain YL-1 may be involved were analyzed. The metabolic pathways of non-ribosomal peptide synthetase (NRPS),polyketide synthase (PKS), PKS-NRPS, terpenoid and amino acids and related genes were analyzed by bioinformatics tools.The mycotoxin-producing ability of YL-1 was determined to evaluate whether there was a potential hazard of mycotoxin.Results: Strain YL-1 was identified as P. citrinum with a 99% similarity. The genome of P. citrinum YL-1 was 31.92 Mb in length with GC content of 46.27%. A total of 11 980 genes were predicted using Maker2 sequencing by homology analysis,including 5 417 eukaryotic genes and 4 946 prokaryotic genes annotated in eukaryote clusters of orthologous groups (KOG)and cluster of orthologous groups of proteins (COG) databases, respectively. Kyoto Encyclopaedia of Genes and Genomes(KEGG) analysis was used to assign 3 525 genes to 323 pathways. Five metabolic pathways related to the biosynthesis of mycotoxins were annotated in P. citrinum YL-1, including only one homologous gene (Af l d) involved in the metabolic pathway of af l atoxin and fi ve other related genes. However, no complete metabolic pathway was annotated. Conclusion:Despite the above fi ndings, further studies should be done to evaluate the safety of P. citrinum YL-1 in fi sh sauce and other related products.
Keywords:Penicillium citrinum YL-1; mycotoxins; safety; genomic sequence
SONG Jiajia, GU Wenyu, LIN Changhao, et al. Molecular identification and safety evaluation of Penicillium citrinum YL-1 from fi sh sauce based on fungal genomic sequencing[J]. Food Science, 2018, 39(22): 305-311. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201822046. http://www.spkx.net.cn
引文格式:宋佳佳, 古汶玉, 林昌浩, 等. 基于基因测序鱼露发酵橘青霉YL-1鉴定及安全性评价[J]. 食品科学, 2018, 39(22):305-311. DOI:10.7506/spkx1002-6630-201822046. http://www.spkx.net.cn
文章编号:1002-6630(2018)22-0305-07
文献标志码:A
中图分类号:TS201.3
DOI:10.7506/spkx1002-6630-201822046
*通信作者简介:高向阳(1966—),女,教授,博士,研究方向为食品生物化学。E-mail:gaoxiangyang@scau.edu.cn
第一作者简介:宋佳佳(1990—),男,硕士研究生,研究方向为食品安全与营养。E-mail:291806302@qq.com
基金项目:广东省公益研究与能力建设项目(2016B020204004)
收稿日期:2017-09-29