硬毛地笋(Lycopus lucidus Turcz.)又名虫草参、地参,为唇形科泽兰属多年生草本植物,具有很高的营养及保健功效,是药食兼用的佳品,享有“植物珍品”、“山中之王”的美称,晒干后可入药,其功能与冬虫夏草相似[1]。硬毛地笋资源丰富,主要分布在云南昆明、大理、丽江等少数民族聚居地区,以大理地区分布最为广泛,且品质最优。已有的研究表明该属植物的主要成分有挥发油、黄酮类、酚类、三萜类、糖类及酸类化合物[2-5],具有很好的抗菌、抗氧化、降血脂、降血糖等多种生理功效[6-16]。大量的研究表明,酚类化合物是良好的还原剂、金属离子螯合剂、单线态氧淬灭剂及供氢体,具有较强的抗氧化活性[17-25]。
DNA是生命的重要遗传物质,控制细胞的增殖与分化。自由基是带有未成对电子的分子与离子,具有较高的反应活性。细胞内产生的自由基可以攻击DNA,造成严重的DNA氧化损伤,进而引起遗传物质的改变。其中,过氧自由基(ROO·)可对DNA、蛋白质、脂质、糖类等生物大分子造成严重的氧化损伤,导致细胞凋亡与组织损伤,进而引起多种疾病的产生,如癌症、慢性炎症、心血管疾病、神经退行性疾病等。王长松等[26]曾对5 种中药酚酸类化合物体外抗DNA损伤的作用进行研究,但有关硬毛地笋酚类化合物对DNA损伤保护作用的研究尚鲜见报道。本实验通过体外2,2-偶氮二异丁基脒二盐酸盐(2,2-azobis(2-methylpropionamidine)dihydrochloride,AAPH)引发ROO·损伤pBR322质粒DNA模型,对硬毛地笋酚类化合物保护ROO·介导的DNA损伤作用进行研究,旨在为硬毛地笋及天然抗氧化剂的开发利用提供理论依据。
硬毛地笋:分别于2016年11月16日(T1)、2016年12月15日(T2)和2017年1月14日(T3)采于云南大理剑川县沙溪镇四联村,洗净烘干、粉碎,冻存备用。材料经大理大学药学与化学学院中药研究所鉴定为唇形科泽兰属多年生草本植物硬毛地笋(L. lucidus Turcz.)。
咖啡酸、迷迭香酸、没食子酸、福林-酚试剂、水溶性VE(Trolox)、pBR322质粒DNA 美国Sigma公司;甲醇、冰乙酸(色谱纯) 美国Thermo Fisher公司;甲醇、乙酸乙酯、AAPH、Tris、琼脂糖均为国产分析纯。1.2 仪器与设备
Scientz-ND系列真空冷冻干燥机 宁波新芝生物科技股份有限公司;WFJ 2000型紫外-可见分光光度计上海尤尼科仪器有限公司;1200高效液相色谱(high performance liquid chromatography,HPLC)仪、ZORBAX SB-C18色谱柱 美国Agilent公司;DYY-6C型电泳仪 北京市六一仪器厂;Image Quant 300 CCD凝胶成像分析系统 美国通用电器公司。
1.3.1 硬毛地笋酚类化合物的提取
参考文献[27]的方法,稍作修改后进行提取。准确称取硬毛地笋粉末5 g,用体积分数80%甲醇溶液于室温下超声波辅助提取3 次,每次10 min,合并滤液,旋转蒸发除去甲醇。水相用HCl溶液将pH值调节至1~2,然后用乙酸乙酯萃取,合并乙酸乙酯相,旋转蒸发除去乙酸乙酯,剩余残留物冷冻干燥,得游离酚(free phenolics,FP)提取物。FP提取后所得残渣加入NaOH溶液(含乙二胺四乙酸(ethylene diaminete traacetic acid,EDTA)和抗坏血酸),在氮气保护下室温振荡水解4 h。待水解完毕,用HCl溶液将pH值调节至1~2,真空抽滤,滤液经乙酸乙酯萃取,合并乙酸乙酯相,旋转蒸发除去乙酸乙酯,剩余残留物冷冻干燥,得到不溶性细胞壁结合酚(insoluble cell wall bound phenolics,ICP)提取物。
1.3.2 硬毛地笋提取物酚含量的测定
提取物酚含量采用福林-酚法测定[28-29],得到没食子酸标准曲线方程为y=0.096 5x+0.097 4(0~6.4 μg/mL),相关系数R=0.991 7。样品中酚含量以每毫克提取物中没食子酸质量表示(μg/mg)。
1.3.3 硬毛地笋酚类化合物HPLC分析
采用HPLC法对硬毛地笋FP和ICP提取物的组成进行分析,条件如下:ZORBAX SB-C18色谱柱(250 mm×4.6 mm,5 μm),流速1 mL/min,柱温30 ℃,进样量10 μL;检测波长为320 nm。流动相A为体积分数100%甲醇,流动相B为甲醇-冰乙酸-超纯水溶液(体积比为1∶10∶89)。梯度洗脱程序如下:FP提取物:0~1 min:15%流动相A;1~16 min:15%~25%流动相A;16~18 min:25%流动相A;18~30 min:25%~30%流动相A;30~35 min:30%~40%流动相A;35~40 min:40%~20%流动相A;40~43 min:20%~15%流动相A;ICP提取物:0~1 min:20%流动相A;1~16 min:20%~38%流动相A;16~18 min:38%流动相A;18~30 min:38%~60%流动相A;30~35 min:60%流动相A;35~40 min:60%~20%流动相A;40~43 min:20%流动相A。
以迷迭香酸和咖啡酸标准品制作回归曲线,得到回归方程如下:FP提取物:y=20.75x-335.16(R=0.998 5,40~200 µg/mL)和y=65.704x-989.22(R=0.992 5,40~200 µg/mL);ICP提取物:y=14.186x-54.828(R=0.991 4,5~40 µg/mL)和y=53.679x-166.8(R=0.993 4,5~40 µg/mL)。
1.3.4 硬毛地笋酚类化合物对ROO·介导的DNA损伤保护作用的测定
参考Spanou等[30]的方法略作修改。将FP和ICP提取物分别配制成质量浓度为2、4、6、8、10 mg/mL的待测液,反应液共20 μL,包括1 μL 0.5 μg/L pBR322质粒DNA、11 μL磷酸盐缓冲液(phosphate buffered saline,PBS)(10 mmol/L,pH 7.4)、5 μL待测液和3 μL AAPH溶液(50 mmol/L,PBS溶解)充分混匀,置于37 ℃水浴锅中避光反应45 min。待反应结束后,取出4 μL反应液并加入2 μL loading buffer(质量分数0.15%溴酚蓝溶液、10 mmol/L EDTA和质量分数40%蔗糖溶液),混匀后吸取4 μL置于质量分数1.0%琼脂糖凝胶(含0.5 μg/mL溴化乙锭)中,于Tris/乙酸/EDTA缓冲液中电泳50 min。待电泳结束,用凝胶成像系统进行半定量分析。空白对照用PBS代替提取液,正常对照用PBS代替提取液和AAPH溶液,用人工合成抗氧化剂Trolox作为阳性对照组。按下式计算双螺旋比例。
式中:A1为双螺旋DNA的灰度值;A2为开环型DNA的灰度值;A3为线性DNA的灰度值。
所有实验重复3 次,数据用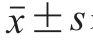 表示,采用SPSS 17.0软件进行数据处理、显著性检验(单因素方差分析)及相关性分析(Pearson相关系数法),P<0.05表示差异或相关性显著。
表示,采用SPSS 17.0软件进行数据处理、显著性检验(单因素方差分析)及相关性分析(Pearson相关系数法),P<0.05表示差异或相关性显著。
表1 硬毛地笋酚类化合物提取物的酚含量
Table1 Phenolic contents of L. lucidus Turcz. on different dates μg/mg

注:同行不同肩标小写字母表示差异显著(P<0.05);下同。
?
从表1可以看出,采收期对硬毛地笋酚类化合物提取物酚含量的影响具有显著性。FP提取物的酚含量在T1和T2采收期之间无显著性差异,在T3采收期时显著下降;而ICP提取物随着采收期的延后其酚含量呈现先降低后升高的趋势。


图1 标准品及FP和ICP提取物的HPLC图
Fig.1 HPLC chromatograms of phenolic standards, FP and ICP
表2 硬毛地笋酚类化合物提取物中迷迭香酸和咖啡酸的含量
Table2 Contents of rosmarinic acid and caffeic acid in phenolic extracts from L. lucidus Turcz.μg/mg

注:nd.未检出。
?
从图1可以看出,硬毛地笋ICP提取物中分离出的色谱峰多于FP提取物。表2结果表明,不同的酚类化合物在硬毛地笋FP和ICP提取物中的质量浓度具有明显差异。在FP提取物中,迷迭香酸是主要的酚类化合物,而咖啡酸质量浓度较低甚至未检出;相反地,在ICP提取物中,咖啡酸是主要的酚类化合物,而迷迭香酸质量浓度较低。这可能是因为在ICP提取过程中使用NaOH水解,使咖啡酸苷类化合物在碱性条件下水解,从而导致咖啡酸质量浓度升高。此外,采收期对迷迭香酸和咖啡酸在FP和ICP提取物中质量浓度的影响不同。在FP提取物中,迷迭香酸的质量浓度在T1和T2采收期之间无显著性差异,从T2到T3采收期下降了37%,这与其酚含量的变化趋势基本一致;在ICP提取物中,这两种化合物的质量浓度随着采收期的延后均呈现先上升后下降的变化趋势,这与酚含量的变化趋势相反,表明其他未鉴定出的酚类物质对总酚含量的变化也具有显著的贡献。
硬毛地笋酚类化合物对ROO·介导的DNA损伤的保护作用以DNA双螺旋比例进行表征,双螺旋比例越高,表明其对DNA损伤的保护作用越强。由图2可以看出,正常pBR322质粒DNA以双螺旋结构为主,被ROO·损伤后,双螺旋DNA转变成了开环型甚至是线型结构,当添加硬毛地笋酚类化合物提取物和Trolox后,未观察到双链断裂后的线性DNA分子,表明硬毛地笋酚类化合物提取物和Trolox可以阻止ROO·介导的DNA双链的断裂。

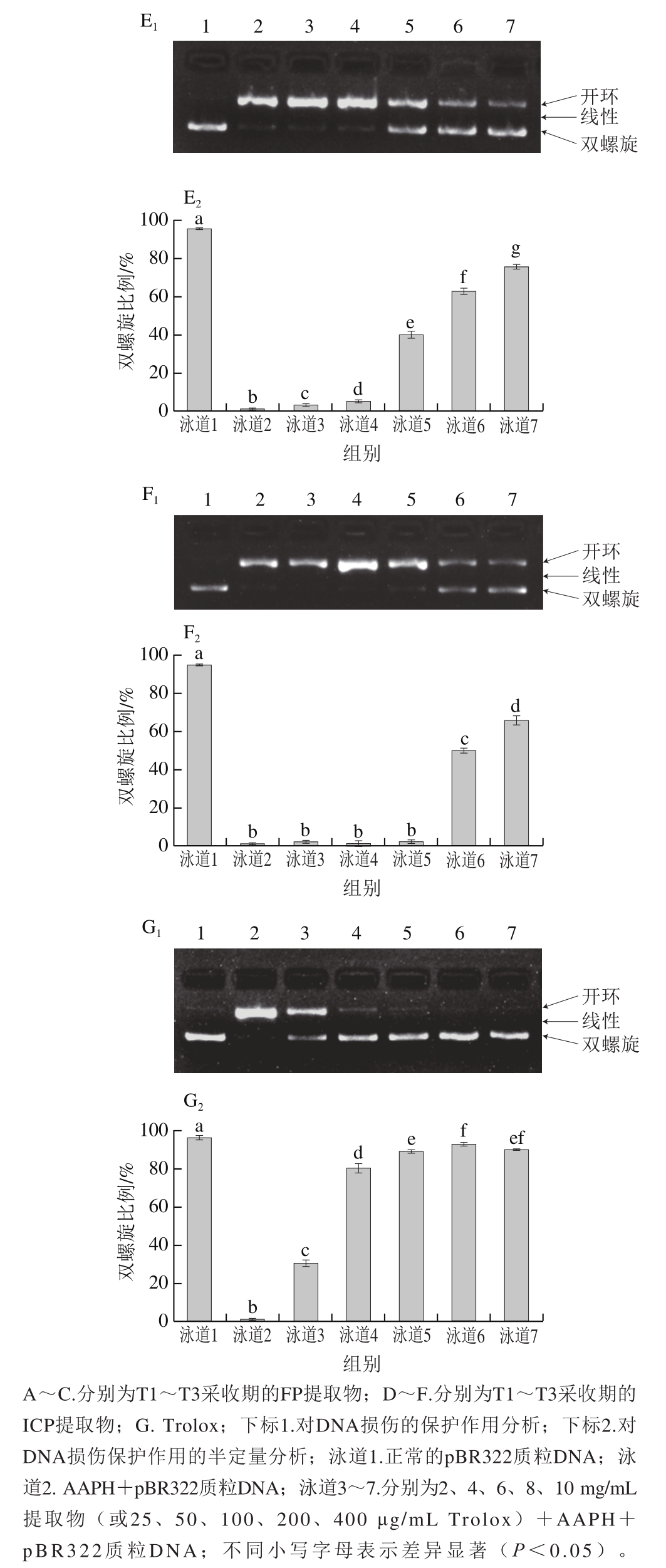
图2 硬毛地笋酚类化合物和Trolox对ROO·介导的DNA损伤的保护作用
Fig.2 Protective effects of phenolic compounds from L. lucidus Turcz.and Trolox on ROO·-mediated DNA damage
硬毛地笋FP和ICP提取物对DNA损伤的保护作用不同。就FP提取物而言:在2~10 mg/mL质量浓度范围内,T1采收期的双螺旋比例在87.52%~89.52%范围内,且随FP提取物质量浓度的增加,保护作用无显著性变化(P>0.05);T2采收期双螺旋比例在64.57%~90.32%范围内,当FP提取物质量浓度由2 mg/mL增加至4 mg/mL时,保护作用显著升高(P<0.05),但在4~10 mg/mL质量浓度范围内时,保护作用随质量浓度的增加而显著降低(P<0.05);T3采收期双螺旋比例在65.71%~92.35%范围内,2~8 mg/mL质量浓度范围内保护作用无显著差异(P>0.05),当质量浓度由8 mg/mL上升至10 mg/mL时,保护作用显著下降(P<0.05)。就ICP提取物而言:在2~10 mg/mL质量浓度范围内,T1采收期的双螺旋比例在4.4%~71.9%范围内,当质量浓度由2 mg/mL增加至4 mg/mL时,保护作用显著下降(P<0.05),但4~10 mg/mL范围内保护作用随着质量浓度增加而显著上升(P<0.05);T2采收期双螺旋比例在3.09%~75.49%之间,保护作用随着质量浓度的增加而显著升高(P<0.05);T3采收期双螺旋比例在2.25%~65.94%之间,在2~6 mg/mL质量浓度范围内保护作用无显著性差异(P>0.05),当质量浓度由6 mg/mL上升至10 mg/mL时,保护作用随着质量浓度的增加而显著上升(P<0.05)。
Trolox对ROO·介导的DNA损伤具有显著的保护作用,在25~400 μg/mL质量浓度范围内,Trolox的双螺旋比例在30.46%~92.28%之间,当质量浓度在25~200 μg/mL范围内时,保护作用随着质量浓度的增加而显著上升(P<0.05);进一步增加质量浓度,保护作用未显著上升(P>0.05)。与Trolox相比,2~10 mg/mL范围内的FP提取物最大保护作用接近于200~400 μg/mL范围内Trolox的最大保护作用,而ICP提取物在测定质量浓度范围内的最大保护作用小于Trolox。可以看出,FP提取物对DNA损伤的保护作用显著强于ICP提取物,这与其酚类化合物组成不同有关。
表3 提取物酚含量与DNA损伤保护作用的相关性分析
Table3 Correlational analysis between phenolic contents and protective effects on DNA damage

注:*.相关性显著(P<0.05);**.相关性极显著(P<0.01)。
?
由表3可以看出,T2和T3采收期的ICP提取物酚含量与保护ROO·介导的DNA损伤的作用具有显著的正相关性,说明提取物中的酚类物质对DNA损伤的保护作用具有显著的贡献;而其他提取物中的酚含量与保护DNA损伤的作用没有显著的正相关性,甚至出现负相关,说明其保护作用不仅与酚含量有关,还与酚类化合物的组成有关。硬毛地笋酚类化合物可能通过其主要成分,也可能通过其各成分之间的协同作用发挥保护DNA损伤的作用。
不同采收期对硬毛地笋酚类化合物提取物酚含量的影响具有显著差异。硬毛地笋酚类化合物提取物中共鉴定出2 种化合物,分别为咖啡酸和迷迭香酸,不同化合物在FP和ICP提取物中的质量浓度具有明显差异。硬毛地笋酚类化合物对ROO·介导的DNA损伤具有显著的保护作用,但不同组分酚类化合物的保护作用存在差异,其中FP提取物对DNA损伤的保护作用明显强于ICP提取物。
[1] 国家中医药管理局. 中华本草[M]. 上海: 上海科学技术出版社,1999: 558-559.
[2] 彭涛, 王金梅, 张前军, 等. 硬毛地笋挥发性成分研究[J]. 天然产物研究与开发, 2012, 24(3): 342-344. DOI:10.3969/j.issn.1001-6880.2012.03.014.
[3] LIBY K, HONDA T, WILLIAMS C R, et al. Novel semisynthetic analogues of betulinic acid with diverse cytoprotective,antiproliferative, and proapoptotic activities[J]. Molecular Cancer Therapeutics, 2007, 6(7): 2113-2119. DOI:10.1158/1535-7163.MCT-07-0180.
[4] 彭涛, 王微, 张前军, 等. 硬毛地笋化学成分研究[J]. 天然产物研究与开发, 2013, 25(6): 782-784; 806. DOI:10.3969/j.issn.1001-6880.2013.06.012.
[5] 彭涛, 尹震花, 康文艺, 等. 硬毛地笋脂溶性成分GC-MS分析[J].中国实验方剂学杂志, 2011, 17(16): 100-102. DOI:10.3969/j.issn.1005-9903.2011.16.030.
[6] LU Y H, HUANG J H, LI Y C, et al. Variation in nutritional compositions, antioxidant activity and microstructure of Lycopus lucidus Turcz. root at different harvest times[J]. Food Chemistry,2015, 183: 91-100. DOI:10.1016/j.foodchem.2015.03.033.
[7] 周宁娜, 雷秀玲. 地参的急性毒性和部分药效学实验[J]. 云南中医学院学报, 1998(1): 6-11. DOI:10.19288/j.cnki.issn.1000-2723.1998.01.002.
[8] 熊伟, 陈贵元, 谭德勇, 等. 野生地参多糖对四氧嘧啶致糖尿病小鼠血糖和血脂的影响[J]. 生物加工过程, 2011, 9(6): 45-48.DOI:10.3969/j.issn.1672-3678.2011.06.010.
[9] 熊伟, 焦扬, 罗永会, 等. 地参多糖对实验肿瘤细胞体内外增殖的影响[J]. 生物加工过程, 2012, 10(4): 64-69. DOI:10.3969/j.issn.1672-3678.2012.04.014.
[10] 林春榕, 左绍远, 熊伟, 等. 地参多糖对D-半乳糖所致衰老小鼠的抗氧化作用研究[J]. 安徽农业科学, 2012, 40(18): 9646-9647.DOI:10.3969/j.issn.0517-6611.2012.18.027.
[11] 熊伟, 谭德勇, 陈贵元, 等. 地参多糖对正常及实验性糖尿病小鼠血糖的影响实验研究[J]. 生命科学仪器, 2010, 8(5): 64-66.DOI:10.3969/j.issn.1671-7929.2010.05.016.
[12] 熊伟, 谭德勇, 陈贵元, 等. 地参多糖对小鼠免疫功能影响的实验研究[J]. 时珍国医国药, 2011, 22(1): 11-13. DOI:10.3969/j.issn.1008-0805.2011.01.005.
[13] LEE Y J, KANG D G, KIM J S, et al. Lycopus lucidus inhibits high glucose-induced vascular inflammation in human umbilical vein endothelial cells[J]. Vascular Pharmacology, 2008, 48(1): 38-46.DOI:10.1016/j.vph.2007.11.004.
[14] LEE W S, IM K R, PARK Y D, et al. Human ACAT-1 and ACAT-2 inhibitory activities of pentacyclic triterpenes from the leaves of Lycopus lucidus Turcz.[J]. Biological & Pharmaceutical Bulletin,2006, 29(2): 382-384. DOI:10.1248/bpb.29.382.
[15] TAKADA Y, AGGARWAL B B. Betulinic acid suppresses carcinogen-induced NF-κB activation through inhibition of IκBα kinase and p65 phosphorylation: abrogation of cyclooxygenase-2 and matrix metalloprotease-9[J]. Journal of Immunology, 2003, 171(6):3278-3286.
[16] YUN Y H, HAN S H, PARK E, et al. Immunomodulatory activity of betulinic acid by producing pro-inflammatory cytokines and activation of macrophages[J]. Archives of Pharmacal Research, 2003, 26(12):1087-1095. DOI:10.1007/BF02994763.
[17] ZHANG S, LU B, HAN X, et al. Protection of the flavonoid fraction from Rosa laevigata Michx fruit against carbon tetrachloride-induced acute liver injury in mice[J]. Food and Chemical Toxicology, 2013,55(3): 60-69. DOI:10.1016/j.fct.2012.12.041.
[18] CHO B O, RYU H W, SO Y, et al. Hepatoprotective effect of 2,3-dehydrosilybin on carbon tetrachloride-induced liver injury in rats[J]. Food Chemistry, 2013, 138(1): 107-115. DOI:10.1016/j.foodchem.2012.10.026.
[19] GAO C Y, TIAN C R, ZHOU R, et al. Phenolic composition, DNA damage protective activity and hepatoprotective effect of free phenolic extract from Sphallerocarpus gracilis seeds[J]. International Immunopharmacology, 2014, 20(1): 238-247. DOI:10.1016/j.intimp.2014.03.002.
[20] KIM H Y, PARK J, LEE K H, et al. Ferulic acid protects against carbon tetrachloride-induced liver injury in mice[J]. Toxicology, 2011,282(3): 104-111. DOI:10.1016/j.tox.2011.01.017.
[21] LIU H Y, QIU N X, DING H H, et al. Polyphenols contents and antioxidant capacity of 68 Chinese herbals suitable for medical or food uses[J]. Food Research International, 2008, 41(4): 363-370.DOI:10.1016/j.foodres.2007.12.012.
[22] CAI Y, LUO Q, SUN M, et al. Antioxidant activity and phenolic compounds of 112 traditional Chinese medicinal plants associated with anticancer[J]. Life Sciences, 2004, 74(17): 2157-2184. DOI:10.1016/j.lfs.2003.09.047.
[23] SOONG Y Y, BARLOW P J. Antioxidant activity and phenolic content of selected fruit seeds[J]. Food Chemistry, 2004, 88(3): 411-417. DOI:10.1016/j.foodchem.2004.02.003.
[24] SURVESWARAN S, CAI Y Z, CORKE H, et al. Systematic evaluation of natural phenolic antioxidants from 133 Indian medicinal plants[J]. Food Chemistry, 2007, 102(3): 938-953. DOI:10.1016/j.foodchem.2006.06.033.
[25] AMAROWICZ R, PEGG R B, RAHIMI-MOGHADDAM P, et al.Free-radical scavenging capacity and antioxidant activity of selected plant species from the Canadian prairies[J]. Food Chemistry, 2004,84(4): 551-562. DOI:10.1016/S0308-8146(03)00278-4.
[26] 王长松, 田莉莉, 张俊刚, 等. 五种中药酚酸类化合物体外抗DNA损伤的作用[J]. 中国药理学与毒理学杂志, 2012, 26(4): 529-533.DOI:10.3867/j.issn.1000-3002.2012.04.011.
[27] XU G H, YE X Q, LIU D H, et al. Composition and distribution of phenolic acids in Ponkan (Citrus poonensis Hort. ex Tanaka) and Huyou (Citrus paradisi Macf. Changshanhuyou) during maturity[J].Journal of Food Composition and Analysis, 2008, 21(5): 382-389.DOI:10.1016/j.jfca.2008.03.003.
[28] 陈磊, 杨建荣, 黄雪松. 高效液相色谱法快速测定红富士苹果渣中的6 种多酚[J]. 食品与发酵工业, 2008, 34(8): 158-161.DOI:10.13995/j.cnki.11-1802/ts.2008.08.03.
[29] 黄菊华. 地参多酚的组成及其抗氧化活性研究[D]. 大理: 大理学院,2015: 1-60.
[30] SPANOU C, BOUROU G, DERVISHI A, et al. Antioxidant and chemopreventive properties of polyphenolic compounds derived from Greek legume plant extracts[J]. Journal of Agricultural and Food Chemistry, 2008, 56(16): 6967-6976. DOI:10.1021/jf800842p.
Protective Effect of Phenolic Compounds fromLycopus lucidusTurcz. on DNA Damage