北豆腐中蛋白质、脂肪、糖类含量丰富,含有异黄酮、低聚糖、大豆磷脂等功能性成分,且钙、镁等微量元素含量较高[1],深受我国消费者喜爱。由于北豆腐营养丰富、水分活度高且pH值呈中性,适合微生物代谢繁殖;此外,由于原料微生物污染严重、自动化加工程度不高、杀菌温度过高易影响大豆蛋白凝胶性质[2],导致北豆腐产品货架期极短,严重限制了豆制品企业的规模化发展。
豆腐中的微生物主要来源于大豆原料及加工环境,研究表明豆腐中最普遍的微生物有肠道菌、链球菌属、乳杆菌属、片球菌属、假单胞菌属、稳杆菌属、芽孢杆菌属等[3-5];内酯豆腐中腐败菌为芽孢杆菌属和屎肠球菌属[6];鱼豆腐等豆制品中主要为乳杆菌属、魏斯氏菌属、肠球菌属和葡萄球菌属[7]。目前,微生物污染及控制依旧是限制传统豆制品发展的重要瓶颈,尤其在北豆腐加工过程中大豆浸泡工序耗时长(8~12 h),微生物快速增殖,豆浆品质不稳定,点脑需靠人工经验值指导,标准化自动控制难以实现;大型加工企业目前大多采用流水浸泡减轻微生物的影响,但耗费大量水资源并产生大量污水;科研人员也将生物防腐剂、超高压、微波、射线等技术引入豆制品防腐并取得一定效果[8-10],但目前未在产业化中应用。关于豆腐腐败方面的研究主要集中于豆腐货架期间微生物数量及种类,针对不同腐败菌对北豆腐的腐败作用、加工过程腐败菌分析及控制的报道较少。低耗水制浆技术是本团队前期研发的具有低耗水、耗时短、低排放等优势的绿色制浆技术,关于其对豆制品制浆过程的微生物控制作用还鲜有报道。本研究通过分离北豆腐加工贮藏期间的优势菌,分析腐败菌在北豆腐产品中的生长规律及腐败作用,探明北豆腐加工过程中主要腐败菌来源及增殖环节,并研究低耗水制浆技术对豆制品加工过程中微生物的控制作用,保障传统豆制品加工稳定性,为豆制品加工自动化及食品安全保障提供依据。
盒装北豆腐 北京某豆制品加工企业;散装北豆腐北京市西红门市场手工作坊;微生物培养基 北京陆桥技术股份有限公司;溶菌酶、蛋白酶K、细菌总DNA提取试剂盒、DNA胶回收试剂盒 宝生物工程(大连)有限公司;引物合成及序列测定 北京博迈德生物技术有限公司;其余试剂均为国产分析纯。
ME204E分析天平 瑞士Mettler Toledo公司;高压蒸汽灭菌锅 长沙平凡仪器仪表有限公司;DM750显微镜 德国Leica公司;TC-512聚合酶链式反应(polymerase chain reaction,PCR)仪 英国TechNet公司;PB-10 pH计 德国Sartorius公司。
1.3.1 北豆腐优势腐败菌分离纯化及鉴定
1.3.1.1 优势菌分离纯化
从北豆腐菌落总数计数平皿中收集不同菌落形态的菌落进行反复划线纯化,分离主要优势菌。
1.3.1.2 形态学鉴定
观察菌株的菌落形态,包括大小、形态、颜色、质地、边缘状态及透明度等。挑取培养18~24 h长势好的单菌落,经革兰氏染色观察菌体形态。
1.3.1.3 16S rDNA鉴定
采用细菌总DNA试剂盒提取腐败菌DNA,16S rDNA鉴定引物:LPW57(5’-AGTTTGATCCTGGCTCAG-3’)、LPW205(5’-CTTGTTACGACTTCACCC-3’)[11]。PCR体系(25 μL):2×Taq PCR Master Mix 11 μL,上、下游引物各1.5 μL,模板DNA 1.0 μL,ddH2O 10 μL。程序:94 ℃初始变性5 min;94 ℃变性1 min,50 ℃退火30 s,72 ℃延伸90 s,30 个循环;72 ℃延伸10 min。PCR产物纯化后连接T载体测序,将结果与GenBank中收录的其他菌株序列进行分析比对。结合菌株形态学及分子生物学对主要腐败菌进行鉴定。
1.3.2 腐败菌对北豆腐的腐败作用测定
盒装北豆腐沸水加热20 min,将腐败菌稀释成105CFU/mL回接至豆腐表面,于25 ℃下贮藏,测定豆腐活菌数、理化指标及感官品质。
1.3.2.1 活菌数
无菌操作称取北豆腐10 g,捣碎后于90 mL灭菌生理盐水中充分振摇,体积比1∶10稀释,用稀释平板法测定样品的活菌数。
1.3.2.2 pH值
用清洁小勺取北豆腐样品,捣碎后于6 000 r/min离心5 min,用pH计测定上清液pH值。
1.3.2.3 可溶性氨基酸态氮质量分数
按GB 5009.235—2016《食品安全国家标准 食品中氨基酸态氮的测定》,取样品5 g加50 mL水研碎,50 ℃放置10 min,离心取10 mL滤液加入70 mL水中,用0.1 mol/L NaOH溶液滴定至pH 8.2,加入10 mL体积分数38%甲醛溶液(pH 8.2),用0.1 mol/L NaOH溶液滴定至pH 9.2,以空白水样为对照。氨基酸态氮质量分数按下式计算。
式中:c为NaOH溶液浓度(0.1 mol/L);V1为样品消耗NaOH溶液体积/mL;V01为对照消耗NaOH溶液体积/mL。
1.3.2.4 感官评价
北豆腐接种腐败菌后每隔6 h取样,观察其颜色、气味、质地和产黏情况,评价豆腐腐败程度。
1.3.3 北豆腐加工及贮藏过程的微生态分析
按北豆腐生产工序(某豆制品企业北豆腐生产线)取样,市售盒装及散装北豆腐于25 ℃贮藏24 h,按GB 4789.2—2016《食品安全国家标准 食品微生物学检验 菌落总数测定》检测菌落总数,根据菌落形态统计菌群数量,研究北豆腐加工及贮藏过程中的微生态。
1.3.4 低耗水制浆技术对微生物的控制作用
将相同原料分别采用如下不同工艺浸泡制浆,检测制浆后生浆的菌落总数及腐败菌种类,研究不同工艺对北豆腐加工过程中微生物的影响。
传统工艺:大豆原料清洗一遍,按料液比1∶7加水浸泡12 h制浆;流水浸泡工艺:大豆原料清洗一遍,按料液比1∶7流水浸泡12 h制浆(某豆制品企业制浆生产线);低耗水制浆技术[12]:大豆破碎脱皮,按料液比1∶7加水浸泡3 h制浆。
数据采用Excel 2016软件和SPSS 22.0软件进行统计分析,实验数据均重复3 次,采用Duncan法进行差异显著性分析,P<0.05表示差异显著。
2.1.1 形态学鉴定结果
采用平板培养技术从北豆腐成品及贮藏过程中筛选分离出5 类菌落形态不同的优势菌(图1),分别命名为BDF-1~5。
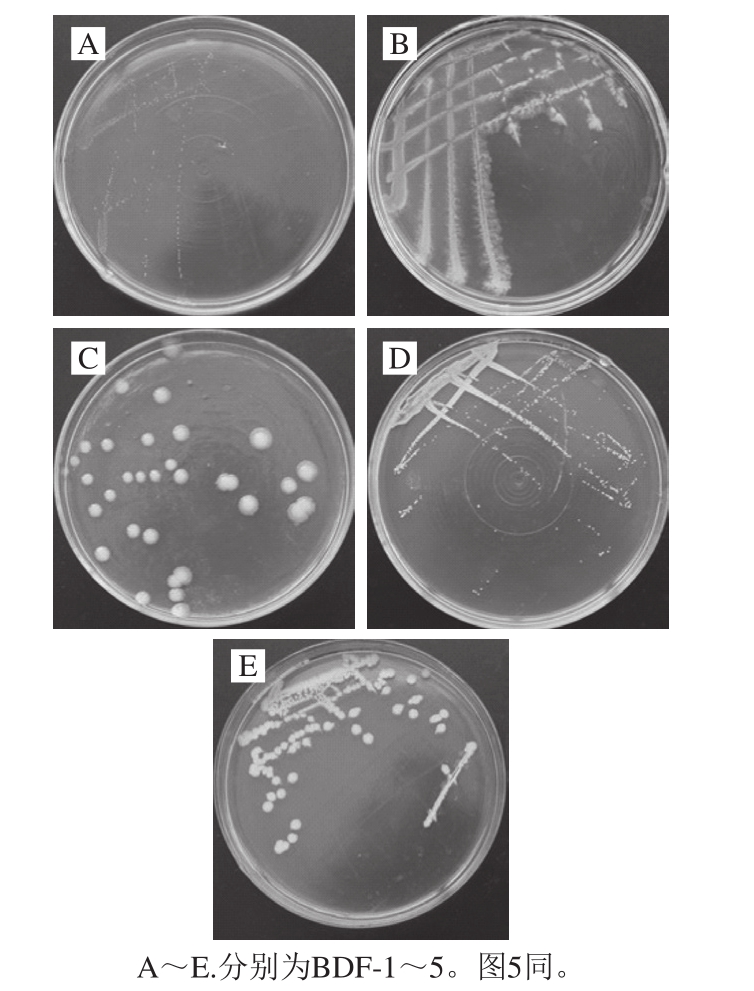
图1 腐败菌菌落形态图
Fig.1 Colonial morphology of spoilage bacteria
BDF-1为白色针尖状小菌落,显微镜下鉴定为革兰氏阳性链球菌;BDF-2在固体培养基上生长时呈不规则假根状,边缘呈羽毛状,表面干燥,革兰氏染色呈阳性,幼龄培养物杆状,长时间培养出现球状细胞;BDF-3为较大乳白色圆形菌落,革兰氏染色呈阴性;BDF-4为典型的黄色菌落,边缘整齐,表面湿润,光滑有光泽,显微镜下观察为革兰氏阴性球杆菌;BDF-5为圆形白色菌落,边缘不整齐,表面微皱,革兰氏染色为阳性杆菌,产芽孢。
2.1.2 16S rDNA序列同源性分析结果
分别提取5 株优势菌的总DNA,利用细菌16S rDNA基因为目标片段,扩增获得1 400 bp左右(1 420、1 452、1 420、1 384、1 420 bp)特异性扩增条带,经测序后5 株菌的16S rDNA测序结果在美国国立生物技术信息中心网站(https://www.ncbi.nlm.nih.gov/)使用BLASTN比对确定属,结果如表1所示。
表1 腐败菌16S rDNA鉴定
Table1 Identification of spoilage bacteria by 16S rDNA gene sequence analysis

?
北豆腐因营养丰富,水分含量高,适宜微生物快速增殖,在豆腐腐败过程中,部分种类的微生物将占据优势,大量增殖生成代谢产物使豆腐产生臭味、黏液、颜色变化及变软等现象,此类微生物被称为特定腐败菌。目前国内外报道的豆腐腐败菌主要是库特氏菌、肠杆菌、假单胞菌、芽孢杆菌属等细菌,由于原料和加工环境的差别,报道的菌群有较大差异。本研究将分离到的5 株优势菌反接至豆腐,研究其对北豆腐的腐败作用。
2.2.1 优势菌在豆腐中的增殖规律
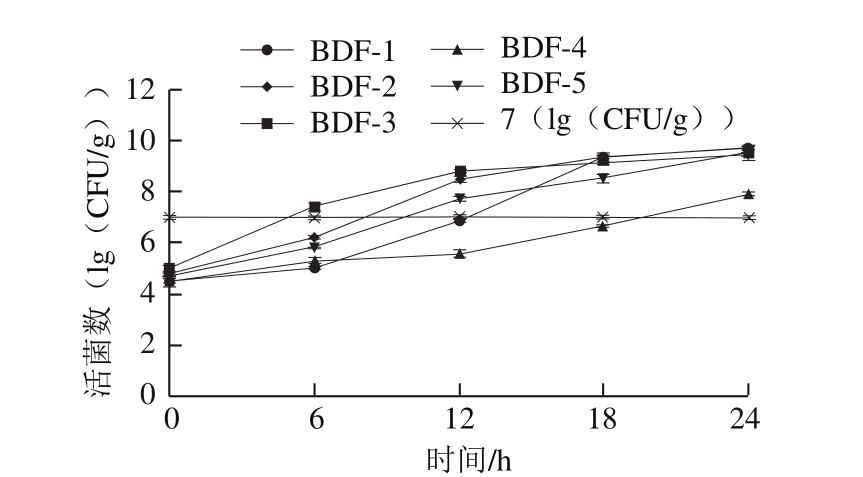
图2 优势菌在北豆腐贮藏过程中的变化
Fig.2 North Chinese of curves of bacteria in tofu during storage
图2表明,豆腐接种5 种腐败菌后在25 ℃贮存,微生物快速增殖。BDF-3(产气肠杆菌)生长速率最快,在6 h时达107CFU/g,北豆腐已有异味,至24 h时,BDF-3活菌数达109CFU/g,样品已严重腐败。BDF-2(吉氏库特氏菌)、BDF-5(枯草芽孢杆菌)在6 h后进入快速生长期,于12 h时达108CFU/g左右,此时接种BDF-2、BDF-5的样品已有轻微异味,至24 h时已严重腐败,散发恶臭。BDF-1(乳酸乳球菌)在6 h后快速增殖,于12 h时达107CFU/g,18 h时达109CFU/g,除产生酸味外,对样品其余性质无明显影响。BDF-4(短稳杆菌)生长较为迟缓,至18 h时样品产生品质劣变,活菌数接近107CFU/g,贮藏24 h时活菌数近108CFU/g,产生恶臭味,短稳杆菌目前主要应用于微生物杀虫剂,可能随原料进入豆制品加工环节[13]。
2.2.2 优势菌对豆腐pH值的影响
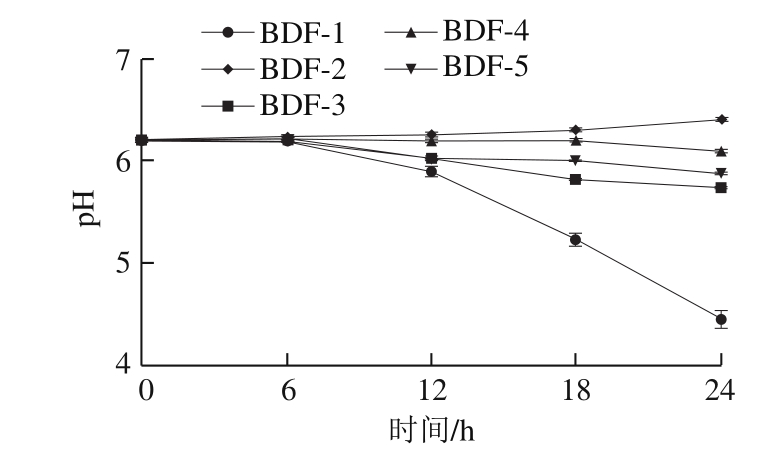
图3 优势菌对贮藏期间豆腐pH值的影响
Fig.3 Effect of dominant bacteria on pH of tofu during storage
如图3所示,北豆腐在初始6 h内pH值无明显变化。6 h后,接种BDF-1的北豆腐pH值明显下降,放置24 h后其pH值降至4.5。接种BDF-3和BDF-5的样品pH值小幅下降,24 h后pH值为5.8左右。北豆腐pH值下降可能是微生物利用碳水化合物产生乳酸、乙酸等有机酸所致[14]。据报道,乳酸乳球菌、产气肠杆菌有较强产酸能力[15-16],可使样品pH值迅速下降。BDF-4对北豆腐pH值影响较小,其pH值保持相对稳定。接种BDF-2的样品贮藏24 h后pH值升至6.4,可能是由于豆腐富含蛋白质,微生物代谢产生碱性胺类化合物,从而导致其pH值上升[17-18]。
2.2.3 优势菌对可溶性氨基酸态氮质量分数的影响

图4 优势菌对贮藏期间豆腐可溶性氨基酸态氮质量分数的影响
Fig.4 Effect of dominant bacteria on soluble amino nitrogen content of tofu during storage
氨基酸态氮质量分数是蛋白质水解程度的一个重要指标,其质量分数越高表明蛋白质水解越严重[19]。图4表明,随着北豆腐贮藏时间延长,其可溶性氨基酸态氮质量分数不断升高。贮藏24 h时,氨基酸态氮质量分数由高至低依次为BDF-5、BDF-3、BDF-2、BDF-4、BDF-1。接种BDF-1的样品氨基酸态氮质量分数基本保持稳定,稍有上升。接种其余菌株的样品氨基酸态氮质量分数均有明显上升,其中BDF-3、BDF-5增加最为迅速。据报道,产气肠杆菌和枯草芽孢杆菌产蛋白酶能力较强[20],微生物通过分泌蛋白酶水解蛋白质产生氨基酸,破坏由7S、11S球蛋白形成的三维网络结构,将豆腐腐化成软泥状[21]。
2.2.4 感官评价结果
表2 北豆腐感官评价结果
Table2 Sensory evaluation of north Chinese tofu

?

图5 贮藏24 h时的豆腐样品
Fig.5 Tofu samples during storage for 24 h
北豆腐样品初始状态均为乳白色,表面湿润,有弹性、无黏液、无异味。随着微生物的繁殖,豆腐的颜色、质地及风味产生了显著变化。表2及图5表明,乳酸乳球菌(BDF-1)对北豆腐色泽及质地影响较小,其不产生黏液及色素,于25 ℃放置24 h,豆腐仍保持乳白色及原有质地;其产酸能力强,样品放置18 h时开始有较明显的酸味;产蛋白酶能力弱,对豆腐蛋白质凝胶结构破坏较小,仅弹性降低、硬度变大,可能与pH值下降引起豆腐凝胶收缩有关。接种库特氏菌(BDF-2)的豆腐从18 h时开始表面出现黄膜,至24 h时已覆满鹅黄色黏膜,质地变软,从12 h时开始出现馊味。产气肠杆菌(BDF-3)、短稳杆菌(BDF-4)和枯草芽孢杆菌(BDF-5)均能使豆腐颜色变为灰黄色,放置24 h时豆腐成泥状,这与菌株生长过程中水解大豆蛋白破坏原有凝胶结构有关,样品质地的腐坏速率与氨基酸态氮质量分数变化趋势一致。此外菌株在代谢过程中催化氨基酸脱羧,生成生物胺、氨气、吲哚、硫化物等[22],严重影响产品品质及安全性。
根据豆腐样品感官评价与微生物生长趋势分析,微生物增长速率与豆腐腐败速率(样品感官品质劣变程度)一致,当腐败菌数量增长到107CFU/g时,样品感官品质出现明显劣变,为食品能被接受的最大微生物限量值[23],腐败速率由快至慢为产气肠杆菌(BDF-3)、库特氏菌(BDF-2)、枯草芽孢杆菌(BDF-5)、乳酸乳球菌(BDF-1)、短稳杆菌(BDF-4)。
蛋白类食品的防腐保鲜技术一直是科研人员关注的重点及难点,由于大豆蛋白对温度较敏感,温度过高易导致蛋白变性影响其凝胶特性[24],豆腐类产品难以彻底杀菌。不同包装形式的北豆腐微生物污染情况有显著差异(P<0.05)。经高温杀菌处理的盒装产品菌落总数为(3.3±0.5)×102CFU/g,当天生产的散装北豆腐菌落总数高达(1.3±0.1)×105CFU/g,远超过盒装产品(P<0.05)。样品经25 ℃贮藏24 h,散装和盒装北豆腐菌落总数分别达(2.9±0.3)×109CFU/g和(1.0±0.1)×108CFU/g,样品已腐败变质。豆腐类产品蛋白质含量丰富,水分含量高,适合微生物繁殖[25],且北豆腐基本为敞开式加工,原料、设备及加工环境中的微生物均会污染产品。散装豆腐成型后无杀菌措施且无冷链保藏,产品微生物污染更为严重,存在较大的食品安全问题;盒装豆腐成品经杀菌后仍需冷链运输、销售,才能保证北豆腐产品的品质及安全性,但货架期较短。

图6 北豆腐贮藏过程微生态分析
Fig.6 Changes in bacterial counts of north Chinese tofu during storage
如图6所示,5 类主要腐败菌均可在散装产品中检测到,盒装豆腐经杀菌后,生物多样性明显小于散装豆腐,仅能检测到乳酸乳球菌。样品经25 ℃贮藏24 h后完全腐败,BDF-1和BDF-2快速增殖,为散装和盒装北豆腐的主要腐败菌,散装产品中利用本研究方法未检出BDF-3~5(活菌数小于106CFU/g)。乳酸乳球菌发酵产酸导致样品pH值大幅下降,此外,其能产生抑菌代谢产物或信号分子抑制其余微生物繁殖[26]。乳酸菌是豆制品加工及贮藏中普遍存在的一类微生物,传统酸浆豆腐即利用乳酸菌发酵酸浆作为酸凝固剂[27]。库特氏菌在吴丽樱报道的3 种品牌豆腐中均有检出[28],也是本研究中散装和盒装北豆腐的主要腐败菌,该菌可能在北豆腐产品中普遍存在,但在未腐败豆腐中并不占优势,温度适宜时其快速增殖造成北豆腐腐败,针对该菌污染来源及毒理学等方面的报道较少。肠杆菌、短稳杆菌和芽孢杆菌在盒装北豆腐成品中未检出,但存在于散装北豆腐产品中,与其他研究中报道的豆制品中常见腐败微生物一致[5,23,28]。
2.4.1 北豆腐加工过程的微生态分析

图7 盒装北豆腐加工环节微生态分析
Fig.7 Bacterial community analysis of packaged north Chinese tofu during processing
如图7所示,在盒装北豆腐加工过程中,浸泡、生浆工序的微生物数量最高(大于105CFU/g),生物多样性最丰富,优势菌为乳酸乳球菌(BDF-1)、产气肠杆菌(BDF-3)和短稳杆菌(BDF-4)。我国传统豆制品加工一般选用蛋白质含量较高的国产大豆,在田间收获后未经筛选、除杂、清洗等处理,大豆原料携带大量微生物进入浸泡环节[28-29],经10~12 h流水浸泡,蛋白质、糖类物质溶出,微生物大量繁殖(105CFU/g),温度较高时,微生物快速繁殖产酸导致pH值下降,还可能产生胺类等有害成分,严重影响豆浆加工稳定性及安全性。
熟浆的微生物数量最低(24 CFU/g),与李博[6]、石彦国[30]等的报道一致,这是因为大部分微生物被杀灭,仅残留少量乳酸乳球菌。点脑成型过程温度高,微生物数量变化不显著(P>0.05)。豆腐成型后经冷却、分割、包装,微生物数量显著上升(至104CFU/g),主要为乳酸乳球菌和产气肠杆菌,这是由于北豆腐为敞开式加工,设备、包布、冷却水、环境中微生物容易污染产品。包装后北豆腐经巴氏杀菌,微生物数量显著降低(至102CFU/g),不耐热微生物基本被杀灭,冷链条件下货架期可保持7 d,在常温下不足1 d。
库特氏菌在加工过程并未检出,但在散装及盒装产品中均出现。据报道,库特氏菌主要存在于鸡粪、不流动淡水、肉制品、牛乳中[31],曾在豆腐切割刀上检出[28],豆腐成品中的库特氏菌可能是成型后冷却、分割过程中由设备及冷却水带入,在加热过程中未完全杀灭,在适宜温度下快速增殖,成为豆腐的主要腐败菌。
2.4.2 不同浸泡工艺对制浆过程中微生物增殖的影响

图8 不同浸泡工艺对制浆过程中微生物增殖的影响
Fig.8 Effect of different pulping technologies on microbial proliferation in soymilk during processing
大豆浸泡过程中的微生物主要为乳酸乳球菌、产气肠杆菌、短稳杆菌三大类,主要来源于大豆原料,散装产品由于杀菌程度低,这3 类菌均能在成品中检出,盒装产品杀菌较为彻底,乳酸乳球菌为主要优势菌。前期研究证实,乳酸乳球菌和产气肠杆菌在豆浆中发酵产酸使蛋白凝聚,短稳杆菌产生黄色菌膜,3 类腐败菌都会严重影响豆浆的加工稳定性和产品品质[32]。
图8表明,低耗水制浆技术可大幅降低原料微生物数量,菌落总数从传统工艺的3.7×105CFU/g降至8.6×103CFU/g(P<0.05)。大豆原料携带的微生物主要来源于种皮[29],采用低耗水制浆技术的原料经前处理脱皮,可有效降低原料中携带的各类微生物数量。
传统大豆制浆技术由于耗时长(12 h),微生物增殖迅速,制浆后菌落总数达2.3×108CFU/g,温度较高时,微生物腐败速率更快,对豆浆品质影响更为显著。大型豆制品加工厂为保证产品品质及安全性,采用流水浸泡制浆技术将微生物总数控制在105~106CFU/g,但此工艺耗水量及污水排放量巨大,给企业造成极大的经济负担和环境压力。低耗水制浆技术由于破碎后的大豆颗粒较小,吸水面积增加,蛋白质吸水迅速,3 h即可完成浸泡;且由于原料污染程度降低,制浆结束后菌落总数(7.0×104CFU/g)较传统工艺和流水浸泡工艺显著下降(P<0.05),与传统工艺浸泡初始阶段相当。低耗水制浆技术制浆过程中微生物污染少且繁殖慢,无需换水,浸泡用水可直接用于磨浆,可大幅降低工艺耗水量及污水排放量,有利于传统豆制品加工行业的可持续发展;此外,由于耗时短,微生物对豆浆的水解腐败作用较小,豆浆的加工稳定性和安全性得以保障,有利于豆制品加工过程的标准化自动控制。
本研究考察市售散装及盒装北豆腐微生物污染及多样性,发现散装北豆腐成品菌落总数高,微生物种类繁多,盒装北豆腐经杀菌处理,微生物多样性较单一,主要为乳酸乳球菌。从北豆腐成品中分离出5 株优势菌,经16S rDNA鉴定为乳酸乳球菌、吉氏库特氏菌、产气肠杆菌、短稳杆菌及枯草芽孢杆菌。腐败菌回接实验表明,微生物数量达107CFU/g时,豆腐开始产生较明显的腐败现象,乳酸乳球菌产酸使豆腐pH值下降,其余4 种优势菌可导致北豆腐颜色变化、质地变软、产生不良气味,严重影响产品品质及安全性。
豆制品企业加工过程浸泡、制浆工序中由于原料携带大量微生物且条件适宜,微生物污染严重,主要污染微生物为乳酸乳球菌、产气肠杆菌和短稳杆菌,经煮浆后微生物数量大幅下降,仅为24 CFU/g,经点脑、压榨成型、冷却、分割后的成品微生物数量上升,经杀菌后成品微生物数量控制在102CFU/g。本研究发现,通过低耗水制浆技术可减少工艺用水量并缩短耗时,有效控制浸泡及制浆过程中微生物数量,降低加工过程中微生物对产品加工稳定性及安全性的影响,为传统豆制品的标准化控制及工业化生产提供依据。
[1] 郦金龙. W/O、W/O/W乳液型缓释凝固剂的制备及其对传统卤水豆腐品质的调控[D]. 北京: 中国农业大学, 2014: 1-5.
[2] 陶汝青, 夏宁, 滕建文. 热处理对大豆分离蛋白结构和凝胶性的影响[J]. 食品科学, 2018, 39(9): 60-66. DOI:10.7506/spkx1002-6630-201809010.
[3] 杨明, 陈信宇, 张辉, 等. 豆腐致腐细菌的分离鉴定及控制研究[J].食品工业科技, 2014, 35(12): 218-221; 225. DOI:10.13386/j.issn1002-0306.2014.12.039.
[4] ROSSI F, FELIS G E, MARTINELLI A, et al. Microbiological characteristics of fresh tofu produced in small industrial scale and identification of specific spoiling microorganisms (SSO)[J]. LWTFood Science and Technology, 2016, 70: 280-285. DOI:10.1016/j.lwt.2016.02.057.
[5] 郑玉玺. 盒装豆腐腐败菌多样性及品质变化研究[D]. 广州: 华南理工大学, 2018: 1-5.
[6] 李博, 李里特, 辰巳英三, 等. 豆腐(豆浆)中屎肠球菌生长的温度预测模型[J]. 中国农业大学学报, 2003, 8(2): 49-54. DOI:10.3321/j.issn:1007-4333.2003.02.013.
[7] 邹强, 汪正熙, 张琼, 等. 高通量测序与传统方法对豆制品腐败菌的研究[J]. 食品工业, 2018, 39(3): 178-182.
[8] 赵贵丽, 罗爱平, 黄名正, 等. 乳酸乳球菌生物凝固剂对豆腐贮藏性的影响[J]. 食品工业, 2018, 39(1): 141-144.
[9] JIA Q, GAO M X, LI S R, et al. Effects of gamma and electron beam irradiation on the microbial quality of steamed tofu rolls[J].Radiation Physics and Chemistry, 2013, 82: 119-121. DOI:10.1016/j.radphyschem.2012.09.014.
[10] CEN C, XIN R, ZHOU L, et al. Enhanced shelf-life of tofu by using bacteriocinogenic Weissella hellenica D1501 as bioprotective cultures[J]. Food Control, 2014, 46: 203-209. DOI:10.1016/j.foodcont.2014.05.004.
[11] WOO P C Y, FUNG A M Y, LAU S K P, et al. Identification by 16S rRNA gene sequencing of Lactobacillus Salivarius bacteremic cholecystitis[J]. Journal of Clinical Microbiology, 2002, 40(1): 265-267. DOI:10.1128/JCM.40.1.265-267.2002.
[12] 金杨, 柴萍萍, 鲍鲁生, 等. 快速制浆工艺对大豆吸水率及豆浆乳化性的影响[J]. 食品科学, 2013, 34(22): 44-47. DOI:10.7506/spkx1002-6630-201322009.
[13] 王国戗, 邢善霞, 傅政. 短稳杆菌的分离情况和耐药性分析[J].实用医学杂志, 2011, 27(21): 3960-3962. DOI:10.3969/j.issn.1006-5725.2011.21.054.
[14] LI C, RUI X, ZHANG Y H, et al. Production of tofu by lactic acid bacteria isolated from naturally fermented soy whey and evaluation of its quality[J]. LWT-Food Science and Technology, 2017, 82: 227-234.DOI:10.1016/j.lwt.2017.04.054.
[15] 孟宪刚, 李雪萍, 李建宏, 等. 浆水中乳酸菌分离鉴定及其代谢特性的初步研究[J]. 食品工业科技, 2015, 36(1): 181-186; 210.DOI:10.13386/j.issn1002-0306.2015.01.029.
[16] 徐忠义, 王新磊, 闫巧娟, 等. 产气肠杆菌发酵蔗糖产乳酸条件的优化[J]. 中国酿造, 2011, 33(1): 78-81. DOI:10.3969/j.issn.0254-5071.2011.01.023.
[17] 李苗云, 张秋会, 高晓平, 等. 冷却猪肉贮藏过程中腐败品质指标的关系研究[J]. 食品与发酵工业, 2008, 34(7): 168-171. DOI:10.13995/j.cnki.11-1802/ts.2008.07.028.
[18] 岑剑伟. 冰温气调结合高压静电场对罗非鱼片保鲜及其机理研究[D].广州: 华南农业大学, 2016: 3-6.
[19] 鲍志宁, 林伟锋, 叶君, 等. 高浓度发酵乳基料的制备及复合酶对其特性的影响[J]. 食品科学, 2013, 34(9): 95-98. DOI:10.7506/spkx1002-6630-201309021.
[20] 刘颖, 张彬彬, 孙冰玉, 等. 枯草芽孢杆菌高产中性蛋白酶发酵条件的优化[J]. 食品科学, 2014, 35(13): 166-170. DOI:10.7506/spkx1002-6630-201413032.
[21] 汪建明, 张燕, 于水淼, 等. 速熟腐乳生产中腐乳成分及微观结构的分析[J]. 天津科技大学学报, 2015, 30(4): 35-39; 44. DOI:10.13364/j.issn.1672-6510.20140055.
[22] 李彬. 产气肠杆菌(E. aerogenes)和阴沟肠杆菌(E. cloacae)产生物胺作用的研究[D]. 南京: 南京农业大学, 2011: 3-7.
[23] 李除夕, 董明盛, 陈晓红, 等. 豆腐中库特氏菌生长动力学模型和货架期预测[J]. 农业工程学报, 2009, 25(1): 82-86. DOI:10.3969/j.issn.1002-6819.2009.z1.017.
[24] PENG X Y, REN C G, GUO S T. Particle formation and gelation of soymilk: effect of heat[J]. Trends in Food Science & Technology,2016, 54: 138-147. DOI:10.1016/j.tifs.2016.06.005.
[25] LEE D Y, KWON K H, CHAI C H, et al. Microbial contamination of tofu in Korea and growth characteristics of Bacillus cereus isolates in tofu[J]. LWT-Food Science and Technology, 2017, 78: 63-69.DOI:10.1016/j.lwt.2016.11.081.
[26] HWANHLEM N, IVANOVA T, HAERTLE T, et al. Inhibition of food-spoilage and foodborne pathogenic bacteria by a nisin Z-producing Lactococcus Lactis subsp. lactis KT2W2L[J]. LWTFood Science and Technology, 2017, 82: 170-175. DOI:10.1016/j.lwt.2017.04.052.
[27] FEI Y T, LI L, CHEN L Y, et al. High-throughput sequencing and culture-based approaches to analyze microbial diversity associated with chemical changes in naturally fermented tofu whey, a traditional chinese tofu-coagulant[J]. Food Microbiology, 2018, 76: 69-77.DOI:10.1016/j.fm.2018.04.004.
[28] 吴丽樱. 豆腐主要腐败菌的研究及其来源分析[D]. 无锡: 江南大学,2017: 21-45.
[29] 柳玉. 大豆籽粒中微生物的分布及黑龙江大豆致腐菌的种类比较[D].北京: 中国农业大学, 2007: 9-18.
[30] 石彦国, 李博, 于志鹏. 传统豆腐微生物污染途径的研究[J].食品工业科技, 2011, 32(5): 186-189. DOI:10.13386/j.issn1002-0306.2011.05.116.
[31] 李除夕. 豆腐特定腐败菌研究及货架期预测模型的建立[D]. 南京:南京农业大学, 2008: 26.
[32] 刘丽莎, 彭义交, 鲍鲁生, 等. 大豆浸泡过程中腐败微生物对豆浆品质的影响[J]. 食品科学, 2015, 36(14): 161-164. DOI:10.7506/spkx1002-6630-201514031.
Microbial Community Analysis of North Chinese Tofu and Effect of Low-Water Pulping on Controlling Spoilage Microorganisms