表1 单因素试验设计
Table1 Independent variables and their levels used in one-factor-at-a-time design

?
5-羟甲基糠醛是食品在热处理、发酵等加工过程中形成的毒素,蜂蜜[1]、牛奶[2]、咖啡[3]、酒类[4]、焦糖[5]、调味品[6]、干果[7]等食品中均含有5-羟甲基糠醛。国际果汁生产商联合会规定:果汁中5-羟甲基糠醛的含量不应超过25 mg/kg[8]。在食品的热加工过程中,5-羟甲基糠醛可以由2 种途径生成:一种是美拉德反应途径;另一种是焦糖化反应途径[9]。葡萄糖通过置换反应生成席夫碱,再生成1,2-果糖胺,加成消除生成1,2-二酮糖;同样地,葡萄糖加氢还原生成1,2-烯二醇,1,2-烯二醇和葡萄糖、果糖发生脱水反应可以生成5-羟甲基糠醛形成过程中的关键中间体——3-脱氧邻酮糖。3-脱氧邻酮糖进一步脱水环化,也能够生成1,2-二酮糖,最终形成5-羟甲基糠醛。5-羟甲基糠醛的含量与热处理的温度、热处理的时间呈正相关关系。研究称,在干燥和热解条件下,蔗糖可以分解成游离的葡萄糖和高活性呋喃果糖基离子,呋喃果糖基离子可以直接转化成5-羟甲基糠醛。在超过250 ℃时,呋喃果糖基离子可以迅速生成5-羟甲基糠醛[10]。
研究人员在天然产物土茯苓、罗汉果浸膏、蜜制麻黄、长裙竹荪甲醇提取物以及炮制五味子中也检测到了5-羟甲基糠醛[11]。含糖量较高的食品在加工和保存过程中,不可避免地会产生5-羟甲基糠醛。因此,5-羟甲基糠醛的含量可以用作水果、咖啡、蜂蜜、牛奶等食品的质量标记,同时还可以用于监测谷物产品的加热过程[12]。在食品行业中得到广泛应用的转化糖浆是由蔗糖通过酸水解形成的,在此过程中,同时也会发生焦糖化反应、还原糖的分解反应以及美拉德反应[13]。这些反应同时发生并且互相影响,从而使得反应进程及生成物十分复杂。此时,反应过程中产生的5-羟甲基糠醛可以作为指示剂,指示反应的程度[14]。在权衡蜂蜜品质时也是以5-羟甲基糠醛的含量为指标,其能够评估蜂蜜的新鲜程度及加工处理贮藏水平的优劣[15]。5-羟甲基糠醛含量高表明蜂蜜热加工过度,或者贮存时间过长,贮存条件较差等。在评估果蔬汁产品的品质时,5-羟甲基糠醛也已经成为一个重要的品质评价指标[16-17]。在含糖量高的食品中,5-羟甲基糠醛对其风味、颜色、口感、外观有很大的影响,同时也会降低食品的食用安全性[18]。5-羟甲基糠醛很少存在于新鲜和未经加工的食品中,同时它的含量能够随着热处理或者贮存时间的延长而增加[19]。5-羟甲基糠醛的含量与食品存放的容器、加工和贮藏条件、原料的特性(pH值、总酸和金属离子含量)、湿度、光等因素有很大的关系[20]。各类食品如蜂蜜、饮品、甜品、药品、乳制品、调味品中5-羟甲基糠醛的含量差别较大。
目前对肉味香精制备过程中的糖-酶解液体系5-羟甲基糠醛形成的动力学研究较少。本实验以肉味香精制备过程中的糖-酶解液体系为研究对象,研究体系中糖种类、糖添加量、加热时间、加热温度等因素对5-羟甲基糠醛形成的影响;通过对糖-酶解液体系中5-羟甲基糠醛形成量的实验测定和数据拟合,揭示其形成5-羟甲基糠醛的动力学特征,旨在为研究热加工香精中5-羟甲基糠醛的形成过程提供新的理论参考。
猪后尖、三黄鸡、牛腩为市售;葡萄糖 冀州市华阳化工有限责任公司;蔗糖 北京羽利兴商贸有限公司;中性蛋白酶、动物蛋白酶、风味蛋白酶、复合蛋白酶(20万 U/g) 南宁庞博生物有限公司;5-羟甲基糠醛(色谱纯) 美国Sigma公司;甲醇(色谱纯)美国Fisher控制设备国际有限公司;戊烷、己烷(均为分析纯) 国药集团化学试剂有限公司;超纯水由Milli-Q Integral纯水/超纯水一体化系统制备。
1260高效液相色谱仪(配有Quat Pump洗脱泵、ALS自动进样器、TCC柱温箱、DAD检测器、OpenLAB CDS工作站) 美国安捷伦科技有限公司;Venusil XBP-C18(L)色谱柱(250 mm×4.6 mm,5 µm) 博纳艾杰尔科技有限公司;3K15高速冷冻离心机 德国Sigma公司。
1.3.1 酶解液的制备
1.3.1.1 猪肉酶解液的制备
猪肉酶解液的制备参考文献[21]。将新鲜去皮猪后尖切成2 cm×2 cm×2 cm左右的肉块,进绞肉机绞成肉馅,依照m(猪肉)∶m(水)=2∶3加入超纯水并混合均匀,在水浴加热下搅拌,待混合液到达指定温度50 ℃时,加入0.25%(质量分数,下同)中性蛋白酶和0.08%动物蛋白酶进行酶解,80 min后,升温至90 ℃,维持10 min灭酶活力,停止加热,室温冷却,收集备用。
1.3.1.2 牛肉酶解液的制备
牛肉酶解液的制备参考文献[22]。将牛肉绞碎,按照m(牛肉)∶m(水)=3∶4加入超纯水并混合均匀,水浴加热下搅拌,待混合液到达45 ℃时,加入0.10%风味蛋白酶进行酶解、酶解时间3 h。酶解结束后,迅速升温至100 ℃,维持10 min灭酶活力,停止加热,室温冷却,收集备用。
1.3.1.3 鸡肉酶解液的制备
鸡肉酶解液的制备参考文献[23]。将鸡身剁碎,按照m(皮)∶m(肉)∶m(骨)=1∶4∶2,分别放入绞肉机中进一步绞碎,按照m(鸡肉)∶m(水)=1.5∶1.0加入超纯水并混合均匀,水浴加热下搅拌,待混合液到达50 ℃时,加入0.20%中性蛋白酶进行酶解、酶解2.5 h后,升温至90 ℃,维持10 min灭酶活力,停止加热,室温冷却,收集备用。
1.3.2 模型体系的制备
分别称取猪肉、牛肉、鸡肉酶解液50 g于四口烧瓶中,分别加入10 g葡萄糖和蔗糖,油浴条件下加热到指定温度(90~110 ℃),分别加热回流0、1、2、3、4、5、6 h,进行美拉德反应。样品预处理后,经0.45 µm过滤膜过滤,待高效液相色谱仪检测。糖-酶解液模型体系单因素试验的因素及水平如表1所示,糖-酶解液模型体系动力学实验设计梯度温度分别为90、95、100、105、110 ℃,各温度下分别加热0、1、2、3、4、5、6 h。
表1 单因素试验设计
Table1 Independent variables and their levels used in one-factor-at-a-time design

?
1.3.3 5-羟甲基糠醛含量的测定
将糖-酶解液于4 ℃冷藏静置过夜,然后于4 ℃离心去除油脂层,重复3 次,得脱脂液。取脱脂液和甲醇按质量比1∶1混匀,静置10 min,9 600 r/min、4 ℃条件下离心15 min,沉淀蛋白,取上清液。上清液经0.45 µm滤膜过滤后,待高效液相色谱仪测定分析。
液相色谱条件为:Venusil XBP-C18色谱柱(250 mm×4.6 mm,5 µm);柱温30 ℃;UV检测器,检测波长284 nm;甲醇-超纯水质量比5∶95,等梯度洗脱;流动相流速1.0 mL/min;进样量20 µL;检测时间25 min。
模拟体系中5-羟甲基糠醛含量的变化规律用零级动力学模型和一级动力学模型两种动力学模型进行分析,分别见公式(1)、(2)。
式中:Ct代表5-羟甲基糠醛在任意时间的含量/(mg/kg);C0为该5-羟甲基糠醛的起始含量/(mg/kg);t为反应时间/h;k0和k1为速率/h-1。

图1 糖添加量与模型中5-羟甲基糠醛含量的关系
Fig.1 Effect of sugar concentration on the formation of 5-HMF
由图1可知,5-羟甲基糠醛的含量与糖添加量呈现出正相关关系,在单糖体系[24]、蛋糕体系[25]中,5-羟甲基糠醛含量随着糖添加量的增加而积累。在葡萄糖-猪肉酶解液模型体系中5-羟甲基糠醛含量最高,其次是葡萄糖-鸡肉酶解液模型体系、葡萄糖-牛肉酶解液模型体系。其中葡萄糖-猪肉酶解液模型体系、葡萄糖-鸡肉酶解液模型体系、葡萄糖-牛肉酶解液模型体系中5-羟甲基糠醛含量分别由(53.131±0.288)、(4.274±0.028)、(8.982±0.176)mg/kg增加至(533.505±4.870)、(523.341±14.189)、(166.006±0.895)mg/kg。葡萄糖-鸡肉酶解液模型体系中,葡萄糖的添加量大于10 g时,5-羟甲基糠醛在葡萄糖-鸡肉酶解液中含量呈现出较为明显的积累。蔗糖-猪肉酶解液模型体系、蔗糖-鸡肉酶解液模型体系、蔗糖-牛肉酶解液模型体系中5-羟甲基糠醛的含量受糖添加量的影响较小。
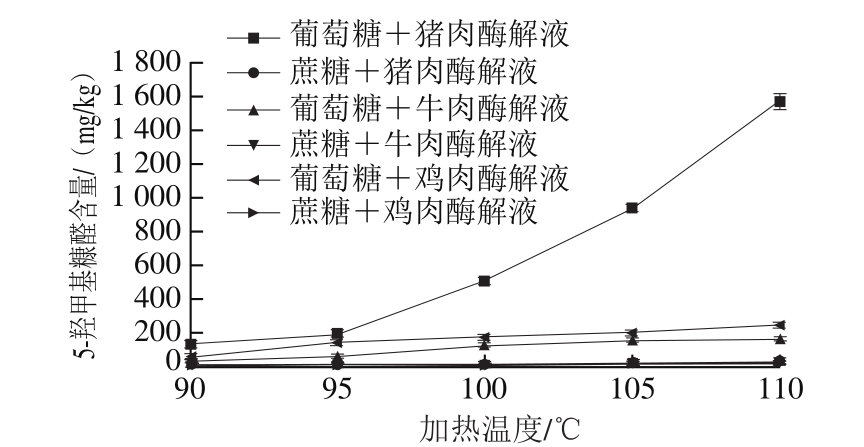
图2 加热温度与模型中5-羟甲基糠醛含量的关系
Fig.2 Effect of temperature on the formation of 5-HMF
5-羟甲基糠醛在单糖溶液模型体系中主要是通过焦糖化反应产生的,然而在复杂的糖-酶解液的体系中,5-羟甲基糠醛的生成途径则相对较多。由图2可知,在90~110 ℃的温度范围内,在葡萄糖-猪肉酶解液体系中5-羟甲基糠醛的含量随着加热温度的升高而快速积累,蔗糖参与的模型体系中5-羟甲基糠醛的含量均较葡萄糖参与的模型体系低。在葡萄糖与猪肉酶解液体系中,温度为90~100 ℃时,5-羟甲基糠醛含量的增长趋势相对平缓,100 ℃之后增长较迅速,由(510.146±0.817)mg/kg(100 ℃)增加至(1 569.920±47.293)mg/kg(110 ℃)。其余5 种模型体系中5-羟甲基糠醛含量的增长趋势均相对平缓,5-羟甲基糠醛在葡萄糖与猪肉酶解液体系中更容易生成。5-羟甲基糠醛的生成在较低的加热温度下,是一个逐步积累的过程[26]。
由图3可知,在加热时间逐步延长的过程中,模型体系中的5-羟甲基糠醛含量逐步增加。与加热温度、糖添加量模型体系相同,葡萄糖-猪肉酶解液模型体系中5-羟甲基糠醛含量的变化最明显,从(12.112±0.237)mg/kg增加至(1 210.408±3.735)mg/kg。在此模型体系中,加热时间为0~3 h时,5-羟甲基糠醛的积累相对缓慢,随后5-羟甲基糠醛的积累相对迅速,由(251.889±2.110)mg/kg(3 h)增加至(1 210.408±3.735)mg/kg(6 h)。相比之下,葡萄糖-牛肉酶解液模型体系、葡萄糖-鸡肉酶解液模型体系、蔗糖-猪肉酶解液模型体系、蔗糖-牛肉酶解模型体系、蔗糖-鸡肉酶解模型体系中5-羟甲基糠醛的生成量受时间影响较小,但仍呈现出随时间延长而增加的趋势。5-羟甲基糠醛的含量在蜂蜜样品中也是与时间的推移呈正相关关系[27]。

图3 加热时间与模型中5-羟甲基糠醛含量的关系
Fig.3 Effect of heating time on the formation of 5-HMF
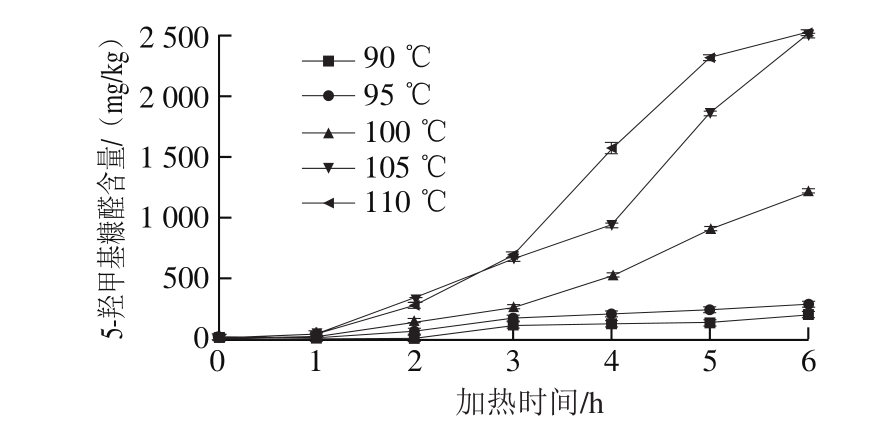
图4 加热温度、时间与葡萄糖-猪肉酶解液模型中5-羟甲基糠醛含量的关系
Fig.4 Effect of heating temperature and time on the formation of 5-HMF in glucose-pork protein hydrolysate system
表2 葡萄糖-猪肉酶解液模型体系中5-羟甲基糠醛的形成动力学分析
Table2 Kinetic analysis of 5-HMF formation in glucose-pork protein hydrolysate system

注:90、95、100、105、110 ℃(0~6 h)依照零级动力学公式拟合:Ct=C0+k0t;R2.回归系数;RMSE.根平均方差;Af.精确因子;Bf.偏差因子;SS.实测值和预测值之比的自然对数的平方和。下同。
?
由图4可知,在0~3 h内,5 个温度下,模型体系中的5-羟甲基糠醛含量均呈现出缓慢的积累,3 h后,100、105、110 ℃体系中5-羟甲基糠醛的累积速率增大,5-羟甲基糠醛的含量呈现出显著的积累,其中110 ℃条件下增长最快,6 h时,5-羟甲基糠醛的形成量达到2 517.062 mg/kg,且仍有增长趋势。在较低温度(90、95 ℃)条件下,0~6 h内,模型体系中5-羟甲基糠醛逐步积累。葡萄糖-猪肉酶解液模型体系中5-羟甲基糠醛的生成动力学分析如表2所示,5 个温度梯度下,葡萄糖-猪肉酶解液模型体系中5-羟甲基糠醛的生成量与加热时间均呈线性关系,符合零级动力学模型。葡萄糖-猪肉酶解液模型体系中5-羟甲基糠醛的生成速率与加热温度呈现出正相关的规律,速率从35.576 h-1(90 ℃)升高至477.800 h-1(110 ℃)。

图5 加热温度、加热时间与蔗糖-猪肉酶解液模型体系中5-羟甲基糠醛含量的关系
Fig.5 Effect of heating temperature and time on the formation of 5-HMF in sucrose-pork protein hydrolysate system
表3 蔗糖-猪肉酶解液模型体系中5-羟甲基糠醛的形成动力学分析
Table3 Kinetic analysis of 5-HMF formation in sucrose-pork protein hydrolysate system

?
从图5和表3可以看出,在5 个温度下,蔗糖-猪肉酶解液模型体系中5-羟甲基糠醛的含量均与加热时间呈现出正相关的关系。由动力学分析得出在90、95、100、105、110 ℃条件下,0~6 h内,5-羟甲基糠醛的生成量在蔗糖-猪肉酶解液模型体系中与加热时间均呈线性关系,符合零级动力学模型;该模型体系与葡萄糖-猪肉酶解液模型体系相比,5-羟甲基糠醛的生成量和生成速率均较低。
从图6可以看出,在0~1 h(110 ℃除外),5-羟甲基糠醛在葡萄糖-牛肉酶解液模型体系中的含量呈现出相对缓慢的累积,在1~3 h,5-羟甲基糠醛的累积速率较快,3~6 h,5-羟甲基糠醛仍表现出累积趋势,但速率有所减缓。由表4可以看出,在5 个温度下5-羟甲基糠醛的生成量均与加热时间呈现出正相关的关系。由动力学分析得出在90、95、100、105、110 ℃条件下,5-羟甲基糠醛在葡萄糖-牛肉酶解液模型体系中的生成量与加热时间均呈线性关系,符合零级动力学模型。

图6 加热温度、加热时间与葡萄糖-牛肉酶解液模型体系中5-羟甲基糠醛含量的关系
Fig.6 Effect of heating temperature and time on the formation of 5-HMF in glucose-beef protein hydrolysate system
表4 葡萄糖-牛肉酶解液模型体系中5-羟甲基糠醛的形成动力学分析
Table4 Kinetic analysis of 5-HMF formation in glucose-beef protein hydrolysate system
?

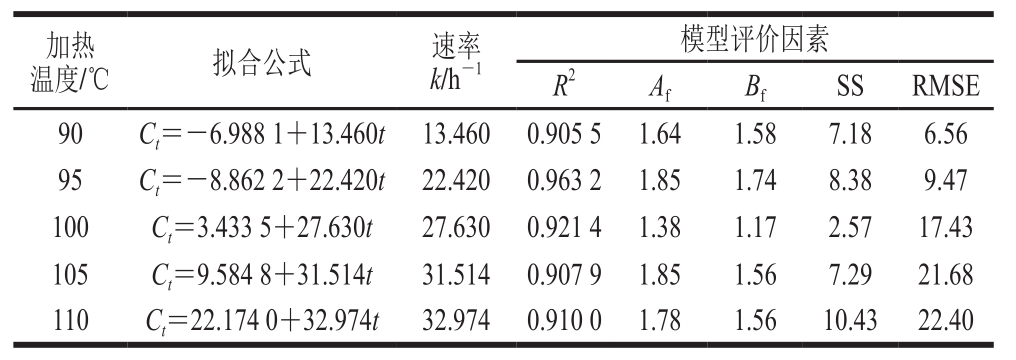
图7 加热温度、加热时间与蔗糖-牛肉酶解液模型体系中5-羟甲基糠醛含量的关系
Fig.7 Effect of heating temperature and time on formation of 5-HMF in sucrose-beef protein hydrolysate system
从图7可以看出,在0~1 h,5-羟甲基糠醛在蔗糖-牛肉酶解液模型体系中的含量呈现出相对迟缓的积累,1~2 h,5-羟甲基糠醛含量呈现出较为显著的增长。由表5可以看出,在5 个温度下5-羟甲基糠醛在蔗糖-牛肉酶解液模型体系中的生成量均与加热时间呈现正相关规律。由动力学分析得出在90、95、100、105、110 ℃条件下,5-羟甲基糠醛在蔗糖-牛肉酶解液模型体系中的生成量与加热时间均呈线性关系,符合零级动力学模型。随着温度的升高,模型体系中5-羟甲基糠醛形成的速率增大,由0.421 9(90 ℃)增长至4.571 6(110 ℃)。
表5 蔗糖-牛肉酶解液模型体系中5-羟甲基糠醛的形成动力学分析
Table5 Kinetic analysis of 5-HMF formation in sucrose-beef protein hydrolysate system

?

图8 加热温度、加热时间与葡萄糖-鸡肉酶解液模型体系中5-羟甲基糠醛含量的关系
Fig.8 Effect of heating temperature and time on the formation of 5-HMF in glucose-chicken protein hydrolysate system
表6 葡萄糖-鸡肉酶解液模型体系中5-羟甲基糠醛的形成动力学分析
Table6 Kinetic analysis of 5-HMF formation in glucose-chicken protein hydrolysate system

?
从图8和表6可以看出,在5 个温度下5-羟甲基糠醛在葡萄糖-鸡肉酶解液模型体系中的形成量均随着时间的延长呈现出增长趋势。由动力学分析得出在90、95、100、105、110 ℃条件下,葡萄糖-鸡肉酶解液模型体系中5-羟甲基糠醛的形成量与加热时间均成线性关系,符合零级动力学模型。
从图9可以看出,90、95、100 ℃条件下,0~6 h内5-羟甲基糠醛在蔗糖-鸡肉酶解液模型体系中的含量增长较为缓慢;105、110 ℃条件下,0~1 h,5-羟甲基糠醛增长较为缓慢,1~6 h,5-羟甲基糠醛的生成量较多,且增长速率远大于0~1 h。总体来说,在5 个温度下5-羟甲基糠醛在蔗糖-鸡肉酶解液模型体系中的生成量均与加热时间呈现出正相关关系。由表7动力学分析得出,在90、95、100、105、110 ℃条件下,蔗糖-鸡肉酶解液模型体系中5-羟甲基糠醛的生成量与加热时间均呈线性关系,符合零级动力学模型。

图9 加热温度、加热时间与蔗糖-鸡肉酶解液模型体系中5-羟甲基糠醛含量的关系
Fig.9 Effect of heating temperature and time on the formation of 5-HMF in sucrose-chicken protein hydrolysate system
表7 蔗糖-鸡肉酶解液模型体系中5-羟甲基糠醛的形成动力学分析
Table7 Kinetic analysis of 5-HMF formation in sucrose-chicken protein hydrolysate system

?
不同种类的糖、加热时间、加热温度对5-羟甲基糠醛在不同体系中的生成量影响差别较大。因此动力学模型也不尽相同。张玉玉等[28-29]先后研究了5-羟甲基糠醛在单糖、双糖溶液体系中的动力学模型,发现在单糖溶液体系中,葡萄糖、果糖和半乳糖在加热温度为80、100、120 ℃时,5-羟甲基糠醛的生成量符合一级动力学模型;在双糖溶液体系中,乳糖、蔗糖和麦芽糖在加热温度为80、100 ℃时,5-羟甲基糠醛的生成量符合零级动力学模型[30]。可见,选用的糖种类及考察的体系不同,5-羟甲基糠醛形成的动力学模型也不同。在蛋糕的烘焙过程中,随着温度的升高和时间的延长,5-羟甲基糠醛的含量与蛋糕的pH值成反比。5-羟甲基糠醛在蛋糕中的生成量符合一级动力学模型[24]。温度对5-羟甲基糠醛的生成有着十分重要的影响,在糖-酶解液模型体系中,葡萄糖-猪肉酶解液模型体系中110 ℃(6 h),5-羟甲基糠醛的生成量为2 517.062 mg/kg,远远超过了GB/T 18796—2005《蜂蜜》对蜂蜜中5-羟甲基糠醛的限量(40 mg/kg)。由于在较高的反应温度下,烯醇缩合反应以及相关的水解和脱水反应过程均相对容易发生,使得较高的反应温度能够加快反应速率。所以,提倡在确定肉味香精的热加工温度时,应尽量选取较低的热加工温度,可以有效地降低5-羟甲基糠醛的生成。
在90~110 ℃条件下,葡萄糖参与的模型体系中5-羟甲基糠醛的生成量均高于蔗糖参与的模型体系,由此可以看出,在此温度范围下,单糖参与的模型体系形成的5-羟甲基糠醛的量和速率远大于双糖。但也有研究报道,在超过250 ℃ 的条件下烘烤饼干,蔗糖模型体系中5-羟甲基糠醛的生成量远大于葡萄糖模型体系中的生成量,分析缘由应该是蔗糖在250 ℃的条件下产生了呋喃果糖基离子,而具备较高活性的呋喃果糖基离子可以直接转化成5-羟甲基糠醛,这就加快了蔗糖参与的模型体系中5-羟甲基糠醛的生成速率[31]。所以在肉味香精的制备过程中,应尽量根据加热时间和温度,选择合适的糖及添加量,以降低产品中5-羟甲基糠醛的含量。
5-羟甲基糠醛的形成量与糖添加量、加热时间和加热温度有关,6 种糖-酶解液热反应模型体系中5-羟甲基糠醛的生成量与糖添加量、加热温度、加热时间均呈现出正相关规律。因此,在制备肉味香精时,应尽量降低糖的添加量,并选用较低的加热温度和较短的加热时间,从而减少5-羟甲基糠醛在肉味香精产品中的积累。
本实验建立了葡萄糖-猪肉酶解液、葡萄糖-牛肉酶解液、葡萄糖-鸡肉酶解液、蔗糖-猪肉酶解液、蔗糖-牛肉酶解液、蔗糖-鸡肉酶解液模型体系,研究了5-羟甲基糠醛的形成动力学,结果显示:5-羟甲基糠醛的生成量与糖添加量、糖种类、加热时间和加热温度有关;加热温度为90~110 ℃、加热时间为0~6 h的条件下,5-羟甲基糠醛的形成量与加热时间均符合零级动力学模型;5-羟甲基糠醛在糖-酶解液模型体系中的含量与加热时间呈现出正相关规律,并且在葡萄糖-酶解液模型体系中5-羟甲基糠醛的积累远远高于蔗糖-酶解液模型体系。所以,在香精的加工过程中,尽量选择较低的热处理温度、较短的热处理时间以及用蔗糖代替葡萄糖的方式,以有效减少5-羟甲基糠醛的形成。
[1] VERÍSSIMO M I S, GAMELAS J A F, EVTUGUIN D V, et al.Determination of 5-hydroxymethylfurfural in honey, using headspacesolid-phase microextraction coupled with a polyoxometalate-coated piezoelectric quartz crystal[J]. Food Chemistry, 2017, 220(9): 420-426. DOI:10.1016/j.foodchem.2016.09.204.
[2] GOKMEN V, ACAR O C, KOKSEL H, et al. Effects of dough formula and baking conditions on acrylamide and hydroxymethylfurfural formation in cookies[J]. Food Chemistry, 2007, 104(3): 1136-1142.DOI:10.1016/j.foodchem.2007.01.008.
[3] ARRIBAS-LORENZO G, MORALES F J. Estimation of dietary intake of 5-hydroxymethylfurfural and related substances from coffee to Spanish population[J]. Food and Chemical Toxicology, 2010, 48(2):644-649. DOI:10.1016/j.fct.2009.11.046.
[4] SERRA-CAYUELA A, AGUILERA-CURIEL M A, RIUAUMATELL M, et al. Browning during biological aging and commercial storage of Cava sparkling wine and the use of 5-HMF as a quality marker[J]. Food Research International, 2013, 53(1): 226-231.DOI:10.1016/j.foodres.2013.04.010.
[5] 陆兔林, 殷放宙, 何箐旋, 等. 炮制对五味子药理作用的影响[J]. 中药材, 2005, 28(10): 933-935. DOI:10.3321/j.issn:1001-4454.2005.10.029.
[6] 张玉玉, 宋弋, 周婷婷, 等. 高效液相色谱法测定镇江香醋中5-羟甲基糠醛的含量[J]. 北京工商大学学报(自然科学版), 2012, 30(2): 39-42. DOI:10.3969/j.issn.1671-1513.2012.02.008.
[7] PALMA M, TAYLOR L T. Supercritical fluid extraction of 5-hydroxymethyl-2-furaldehyde from raisins[J]. Journal of Agricultural and Food Chemistry, 2001, 49(2): 628-632. DOI:10.1021/jf001070s.
[8] International Federation of Fruit Juice Producers. International Federation of Fruit Juice Producers Methods, analysen-analyses[G].Suizzera Frutta, Switzerland: Fruit-Union Suisse Assoc, 1985, 12: 1-2.
[9] NGUYEN T H, FELS-KLERX J, BOEKEL A. Acrylamide and 5-hydroxymethylfurfural formation during biscuit baking. part II: effect of the ratio of reducing sugars and asparagine[J]. Food Chemistry,2017, 230(3): 14-23. DOI:10.1016/j.foodchem.2017.03.009.
[10] 孙颖, 丁奇, 张莉莉, 等. Maillard反应体系中HMF和丙烯酰胺的含量分析[J]. 食品科技, 2016, 42(12): 35-40. DOI:10.13684/j.cnki.spkj.2016.12.009.
[11] MARIA I, EDUARDO L, KARINE C. Paper platform for reflectometric determination of furfural and hydroxymethylfurfural in sugarcane liquor[J]. Microchemical Journal, 2017, 133(7): 286-292.DOI:10.1016/j.microc.2017.03.046.
[12] ZHANG Z H, ZOU Y Y, TAI G. Chlorogenic acid increased 5-hydroxymethylfurfural formation when heating fructose alone or with aspartic acid at two pH levels[J]. Food Chemistry, 2016, 190:832-835. DOI:10.1016/j.foodchem.2015.06.041.
[13] 李红蕾. 麻花中丙烯酰胺和5-羟甲基糠醛形成规律研究[D]. 天津:天津科技大学, 2013: 5-8.
[14] 李宇栋. 羟甲基糠醛在乳制品热损伤评价中的应用[D]. 天津: 天津科技大学, 2013: 2-5.
[15] KHALIL M I, SULAIMAN S A, GAN S H. High 5-hydroxymethylfurfural concentrations are found in Malaysian honey samples stored for more than one year[J]. Food and Chemical Toxicology, 2010, 48(8/9): 2388-2392.DOI:10.1016/j.fct.2010.05.076.
[16] 江姗姗. 绿原酸对Maillard反应体系中丙烯酰胺和羟甲基糠醛形成的影响[D]. 广州: 暨南大学, 2013: 10-12.
[17] 张振华. 绿原酸及其类似物对美拉德反应中羟甲基糠醛生成的影响[D]. 广州: 暨南大学, 2015: 4-8.
[18] 曾哲灵, 高荫榆, 薛艳辉. 单花蜜中羟甲基糠醛生成反应动力学研究[J]. 食品科学, 2006, 27(10): 219-222. DOI:10.3321/j.issn:1002-6630.2006.10.049.
[19] FALLICO B, ZAPPALÀ M, ARENA E, et al. Effects of conditioning on HMF content in unifloral honeys[J]. Food Chemistry, 2004, 85(2):305-313. DOI:10.1016/j.foodchem.2003.07.010.
[20] SPANO N, CASULA L, PANZANELLI A, et al. An RP-HPLC determination of 5-hydroxymethylfurfural inhoney: the case of strawberry tree honey[J]. Talanta, 2006, 68(4): 1390-1395. DOI:3321/j.issn:1002-6630.2006.10.049.
[21] 张玉玉, 孙颖, 赵静, 等. 应用逐级正交优化排骨汤香精制备工艺[J].精细化工, 2016, 33(7): 803-810. DOI:10.13550/j.jxhg.2016.07.015.
[22] 杨绍祥, 刘洋, 程玥, 等. 酶解对热反应番茄牛腩香精风味的影响[J].精细化工, 2014, 31(6): 739-744. DOI:10.13550/j.jxhg.2014.06.066.
[23] 陈怡颖. 鸡汤鲜味影响因素及其热反应配方的优化[D]. 北京: 北京工商大学, 2016: 33-43.
[24] OHARA M, TAKAGAKI A, NISHIMURA S, et al. Syntheses of 5-hydroxymethylfurfural and levoglucosan by selective dehydration of glucose using solid acid and base catalysts[J]. Applied Catalysis A:General, 2010, 383(1/2): 149-155. DOI:10.1016/j.apcata.2010.05.040.
[25] BINDER J B, RAINES R T. Simple chemical transformation of lignocellulosic biomass into fiirans for fuels and chemicals[J].Journal of the American Chemical Society, 2009, 131(5): 1979-1985.DOI:10.1021/ja808537j.
[26] ZHANG Y Y, SONG Y, ZHOU T T, et al. Kinetics 5-hydroxymethylfurfural formation in Chinese Acacia honey during heat treatment[J]. Food Science and Biotechnology, 2012, 21(6): 1627-1632. DOI:10.1007/s10068-012-0216-9.
[27] FABÍOLA C, FABIANA D, GABRIELA P, et al. 5-HMF and carbohydrates content in stingless bee honey by CE before and after thermal treatment[J]. Food Chemistry, 2014, 159: 244-249.DOI:10.1016/j.foodchem.2014.03.016.
[28] 张玉玉, 张兴, 章慧莺, 等. 3 种单糖模拟体系中5-羟甲基糠醛的形成动力学分析[J]. 食品科学, 2014, 35(17): 41-47. DOI:10.7506/spkx1002-6630-201417009.
[29] 张玉玉, 张兴, 章慧莺, 等. 双糖体系中5-羟甲基糠醛的形成动力学分析[J]. 食品工业科技, 2014, 35(3): 93-100. DOI:10.13386/j.issn1002-0306.2014.03.046.
[30] PAINE J, PITHAWALL Y, NAWORA J. Carbohydrate pyrolysis mechanisms from isotopic labeling part 4. the pyrolysis of D-glucose:the formation of furans[J]. Journal of Analytical and Applied Pyrolysis, 2008, 83(1): 37-63. DOI:10.1016/j.jaap.2008.05.008.
[31] 张玉玉. 热处理对含糖食品中 5-羟甲基糠醛的影响与动力学分析[D].北京: 中国农业大学, 2013: 6-12.
Kinetic Studies on 5-Hydroxymethylfurfural Formation in Six Sugar-Enzymatic Protein Hydrolysate Model Systems