大豆分离蛋白(soybean protein isolate,SPI)可作为一种食品添加剂应用于食品体系中,不仅具有高营养价值,还具有乳化性、凝胶性、起泡性等多种功能特性,对食品品质的改善具有重要作用[1]。这些功能特性均受蛋白质溶解性的影响,良好的溶解性是大豆蛋白发挥其他功能特性的基础[2]。近年来,蛋白质糖基化改性受到国内外学者的广泛关注。蛋白质与糖之间可以通过共价键结合形成稳定的共价复合物,共价键一般由糖的还原羧基与蛋白质的活性氨基通过化学反应形成,最终能够得到一种酰胺化合物[3]。Wang Xibo等[4]将SPI与乳糖进行糖基化反应,发现其功能性质尤其是溶解性得到明显改善。然而,采用传统方法进行糖基化反应时间长、效率低,同时产生较多副产物,不利于工业化生产。超声波技术作为一种改性方法广泛应用于食品蛋白加工中,超声波直接作用于食品蛋白,能够修饰蛋白质分子结构,改善蛋白质功能特性。另外,超声波也可作为预处理手段或辅助手段促进蛋白质与其他物质的化学反应,达到改性目的[5]。Jiang Lianzhou等[6]采用频率为20 kHz、功率为150 W的超声探头对黑豆蛋白溶液处理12 min,发现黑豆蛋白分子的空间结构发生改变,溶解性得到改善。Li Chen等[7]采用超声法和湿热法对花生分离蛋白与葡甘露聚糖进行糖基化反应制备共价复合物,发现超声处理能够加快蛋白质与多糖之间的接枝反应速率,超声法制备的复合物具有更少的α-螺旋结构、更多的β-结构和无规卷曲、较高的表面疏水性和更松散三级结构,且溶解性和乳化性均得到改善。然而,关于超声预处理制备SPI/糖复合物的分子结构与溶解性的构效关系及促溶机制的报道较少。本实验对湿热法制备的SPI/糖复合物进行超声预处理,采用傅里叶变换红外光谱(Fourier transform infrared spectroscopic,FTIR)和荧光光谱技术对糖基化复合物的分子结构进行分析,同时测定其溶解度,探讨超声预处理对SPI/糖复合物结构和溶解性的影响,为改善大豆蛋白溶解性以及进一步了解超声作用下SPI/糖复合物的促溶机制提供理论依据。
SPI 哈高科食品有限责任公司;葡萄糖(glucose,G)、麦芽糖(maltose,M)、邻苯二甲醛(o-phthalaldehyde,OPA)、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、β-巯基乙醇 美国Sigma公司;溴化钾 上海化学试剂公司;牛血清白蛋白(bovine serum albumin,BSA) 国药集团化学试剂有限公司;其他试剂均为国产分析纯。
HH-4电热恒温水浴锅 余姚市东方电工仪器厂;JY92-2D超声探头发生器 宁波Scientz生物科技股份有限公司;GL-21M高速冷冻离心机 上海市离心机械研究所;LGJ-1冷冻干燥机 上海医用离心机厂;DU800型紫外-可见分光光度计 美国贝克曼库尔特有限公司;TNZ1-5700 FTIR仪 美国Thermo Fisher公司;F2000荧光光谱仪 日本日立公司。
1.3.1 SPI糖基化复合物的制备
将SPI分散到0.1 mol/L磷酸盐缓冲液(pH 7.0)中,配制质量分数为8%的SPI溶液。以SPI/糖质量比1∶1分别向SPI溶液中添加葡萄糖和麦芽糖混合均匀,配成SPI/糖混合液。将混合液在室温下磁力搅拌2 h,4 ℃贮藏过夜,以确保SPI完全溶解并充分与糖混匀。控制超声功率为200 W,室温下分别对混合液超声预处理5、10、20、30 min。超声处理模式为开启3 s、关闭1 s。超声预处理后将混合液置于95 ℃水浴中热处理15 min,迅速冷却后冷冻干燥即得超声SPI/G复合物和超声SPI/M复合物,分别记作U-SPI/G和U-SPI/M。相同的混合液未经超声预处理直接进行95 ℃水浴热处理,随后的处理与超声SPI/糖复合物相同,得到非超声SPI/G复合物和非超声SPI/M复合物,分别记作NU-SPI/G和NU-SPI/M。
以不添加糖的SPI样品为对照。SPI在相同的条件下经超声预处理后,95 ℃水浴加热15 min的样品为超声SPI,记作U-SPI;SPI在相同的条件下未经超声预处理,直接进行95 ℃水浴加热15 min的样品为非超声SPI,记作NU-SPI;未经任何处理的SPI为天然SPI。
1.3.2 DG测定
采用OPA试剂法测定接枝度(degree of graft,DG)。将80 mg OPA溶解在2 mL体积分数95%乙醇溶液中,并与50 mL 10 mmol/L四硼酸钠缓冲液(pH 9.7)、5 mL质量分数20% SDS溶液以及200 μL β-巯基乙醇混合,充分混匀后用蒸馏水稀释至100 mL,配成OPA试剂。将200 μL复合体系样品溶液(2 mg/mL)与4 mL OPA试剂在室温下反应5 min,然后采用紫外-可见分光光度计测定340 nm波长处的吸光度,以天然SPI作为对照样品,DG的计算公式如下。
式中:Ac为对照样品的吸光度;As为样品的吸光度。
1.3.3 褐变强度测定
根据Abdelhedi等[8]的方法测定褐变强度。将待测样品采用去离子水稀释至质量分数1%,空白样品为去离子水。采用紫外-可见分光光度计测定420 nm波长处的吸光度A420nm以表示褐变强度。
1.3.4 FTIR测定
参照赵城彬等[9]的方法测定FTIR图谱,将蛋白样品与溴化钾研磨成均匀粉末,压片后置于FTIR仪中测定。FTIR仪的测定温度为25 ℃,波数扫描范围为500~4 000 cm-1,分辨率为4 cm-1,波数精度为0.01 cm-1,扫描次数为64 次。采用Peak Fit 4.12 FTIR图谱分析软件对样品的酰胺I带(1 600~1 700 cm-1)进行分析,计算蛋白质各二级结构含量。
1.3.5 内源荧光光谱测定
蛋白样品的内源荧光光谱根据Zhao Chengbin等[10]的方法测定。采用10 mmol/L磷酸盐缓冲液(pH 7.0)配制1.5 mg/mL蛋白溶液,在激发波长为290 nm,发射波长为300~450 nm,狭缝宽度为5 nm的条件下,通过F2000荧光光谱仪测定样品的内源荧光光谱。
1.3.6 溶解度测定
将样品溶于去离子水中,配成蛋白质量浓度为2 mg/mL的溶液。采用0.1 mol/L HCl溶液和0.1 mol/L NaOH溶液分别调节样品溶液pH值至2、3、4、4.5、5、6、7、8、9,在12 000×g下离心30 min。以BSA为标准物,采用Lowry法测定上清液中可溶性蛋白含量。蛋白质溶解度以上清液可溶性蛋白含量占总蛋白含量的比例表示。
每组实验重复3 次,采用SPSS V17.0软件进行ANOVA差异显著性分析,P<0.05为差异显著。采用Origin 8.5软件作图。
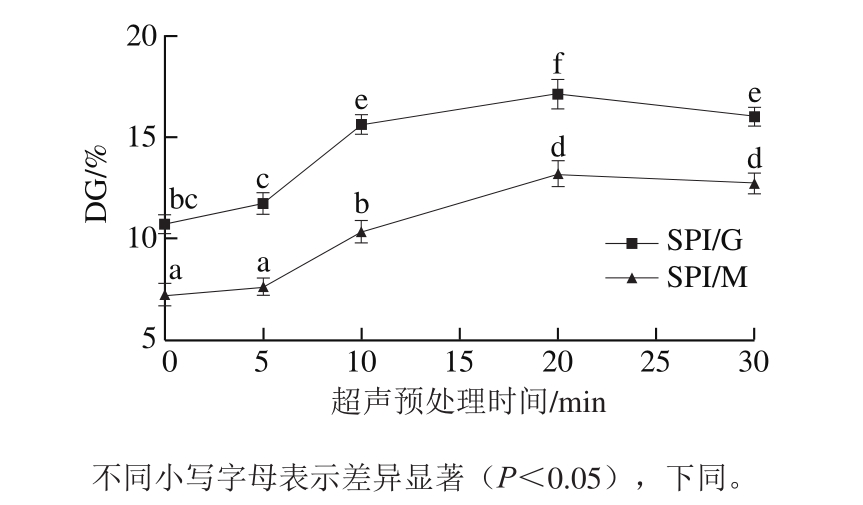
图1 SPI与葡萄糖和麦芽糖糖基化复合物DG随超声时间的变化
Fig.1 The changes in the degree of graft for glycoconjugates of SPI with glucose and maltose as ultrasound time
如图1所示,无论是否进行超声预处理,在相同处理条件下,SPI/G复合物的DG均显著高于SPI/M复合物(P<0.05),这表明SPI更容易与葡萄糖发生反应。根据Chevalier等[11]的报道,糖基化反应速率与参加反应的还原糖分子质量大小有关,单糖比双糖具有更高的反应活性,这也是SPI/G复合物的DG高于SPI/M复合物的原因。超声预处理制备的SPI/糖复合物DG比未经超声预处理制备的SPI/糖复合物高,这表明超声处理后的糖基化反应速率比未经超声处理更快。原因很可能是由于超声处理过程中蛋白质肽链展开,利于反应基团的相互靠近[12],从而促进蛋白质与糖之间的糖基化反应。此外,超声预处理20 min时DG达到最大,而超过20 min后DG稍有降低,这可能是由于过长的超声处理时间会使蛋白质展开的肽链重新聚集,不利于糖基化反应的进行[13]。因此,采用超声预处理时间为20 min进行后续实验。
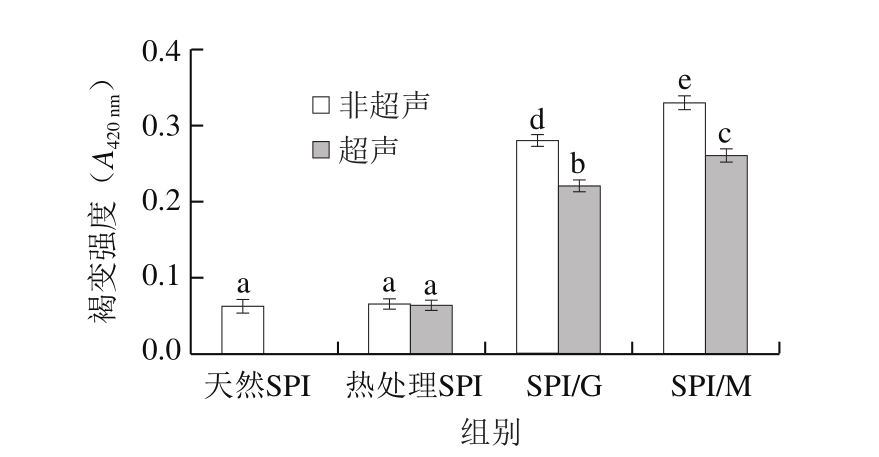
图2 非超声和超声预处理下SPI和SPI/糖复合物的褐变强度
Fig.2 Browning intensity of SPI and SPI-sugar conjugates with and without ultrasonic pretreatment
褐变强度能够表征糖基化反应的高级阶段,是糖基化反应进程的指示器[14]。如图2所示,与天然SPI相比,对SPI进行热处理不会导致A420nm的增加。然而,SPI/糖复合物的A420nm明显增加。SPI与糖(葡萄糖和麦芽糖)加热后,由于发色团的形成[15],出现了褐变,这表明SPI与糖发生了糖基化反应。与SPI/G复合物相比,SPI/M复合物的褐变强度显著增加(P<0.05)。这很可能是由于糖基化反应过程中双糖形成的酸比单糖多,导致体系pH值下降,从而加快糖基化反应进程,这与Li Yue等[16]对大米蛋白糖基化反应的研究结果相似。此外,Wang Heya等[17]的研究表明,褐色产物(类黑精)是通过中间产物聚合形成的。超声预处理能够降低SPI/糖复合物的A420nm,这可能是由于超声预处理通过抑制糖基化反应中间产物的聚合而阻碍褐色产物的形成。尽管超声SPI/糖复合物具有较高的DG(图1),但是超声预处理还是会降低SPI/糖复合物的褐变强度,这一结果表明超声预处理能够制备高DG且低褐变的SPI/糖复合物。
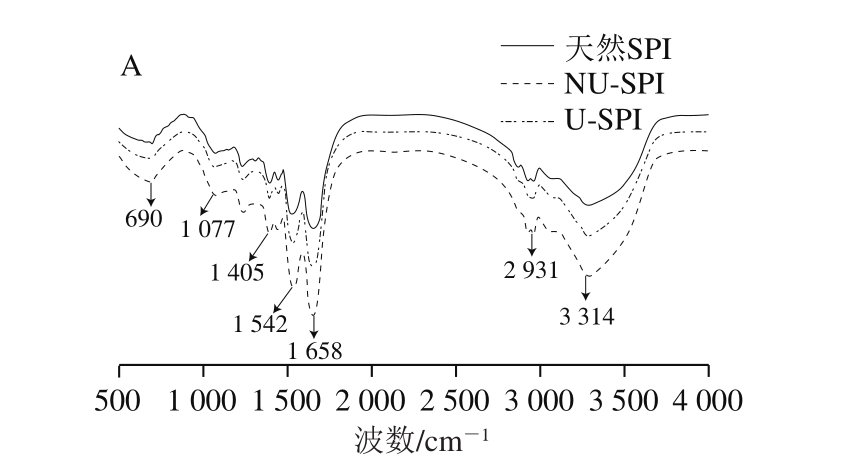
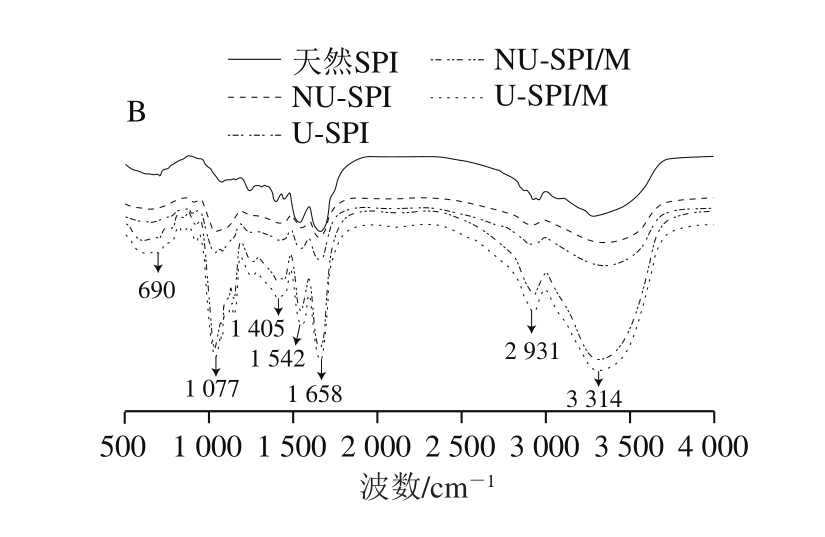
图3 非超声和超声预处理下SPI(A)和SPI/糖复合物(B)的FTIR图谱
Fig.3 FTIR spectra of SPI (A) and SPI-sugar conjugates (B) with and without ultrasonic pretreatment
FTIR技术作为大分子物质分析的有效手段,通过分子内原子振动产生的能量吸收,广泛应用于食物的组分、大分子聚合物的化学组成以及蛋白质的二级结构分析等方面[18]。由图3A可以看出,无论是否进行超声预处理,在不添加糖的情况下,热处理SPI的FTIR吸收峰的变化趋势及峰形与天然SPI相似。热处理能够使SPI在1 658 cm-1(酰胺I带)和1 542 cm-1(酰胺II带)处的吸收峰强度明显增加,这分别是由蛋白质肽链中C=O伸缩振动和N—H弯曲振动产生的[19]。
由图3B可以看出,糖基化作用使SPI的FTIR图谱发生显著改变。与天然SPI相比,SPI/糖复合物在3 314 cm-1处出现一个宽峰且吸收强度增大,这是由于游离—OH的伸缩振动产生的[20]。这表明SPI发生糖基化反应后,糖分子以共价键形式接入SPI中,使—OH的数量增多。与SPI/G复合物相比,SPI/M复合物在3 314 cm-1处具有更强的吸收峰,这可能是由于麦芽糖由两个葡萄糖分子构成,具有更多的—OH,导致此处吸收峰更强。在1 077 cm-1处,天然SPI几乎没有吸收峰,而SPI/糖复合物具有很强的吸收峰,这是由糖分子中C—O—C糖苷键的伸缩振动产生的[21],表明糖分子与SPI发生了糖基化反应,引入了相应的功能性基团,导致蛋白分子侧链振动,并产生了相应的吸收峰。SPI/M复合物在1 077 cm-1处的吸收峰比SPI/G复合物强,这是由于麦芽糖比葡萄糖具有更多能够在此处产生吸收峰的基团。与天然SPI相比,在1 658 cm-1(酰胺I带)、1 542 cm-1(酰胺II带)和1 405 cm-1(酰胺III带)处,SPI/糖复合物的吸收峰增强,SPI/M复合物具有比SPI/G复合物更强的吸收峰。Gu Fenglin等[22]在对酪蛋白与葡萄糖美拉德反应的研究中发现,美拉德产物(如糖胺化合物、席夫碱和吡嗪类化合物)含量升高会使酰胺I带、酰胺II带和酰胺III带处的吸收峰增强。酰胺I~III带处的吸收峰强度的变化表明糖基化反应的发生。此外,SPI/糖复合物在2 931 cm-1处的吸收变强,这是由糖分子中—CH3和—CH2基团中C—H的伸缩振动产生的[23],进一步证实了糖分子与SPI形成了共价复合物。超声预处理不会改变SPI/糖复合物FTIR的吸收峰。以上分析可以得出,SPI与糖分子之间发生了复杂的交联和聚合作用,形成了SPI/糖复合物。
利用波段缩小技术将蛋白质FTIR酰胺I带(1 600~1 700 cm-1)细分,采用二阶导数红外去卷积光谱拟合法对二级结构进行定量分析。确定拟合图谱中各子峰与二级结构类型的对应关系:1 610~1 640 cm-1为β-折叠结构;1 640~1 650 cm-1为无规卷曲结构;1 650~1 660 cm-1为α-螺旋结构;1 660~1 700 cm-1为β-转角结构[24]。通过计算各二级结构的峰面积与酰胺I带总峰面积之比,得到α-螺旋、β-折叠、β-转角、无规卷曲含量,结果见表1。
表1 非超声和超声预处理下SPI和SPI/糖复合物的二级结构含量
Table1 Secondary structure content of SPI and SPI-sugar conjugates with and without ultrasonic pretreatment
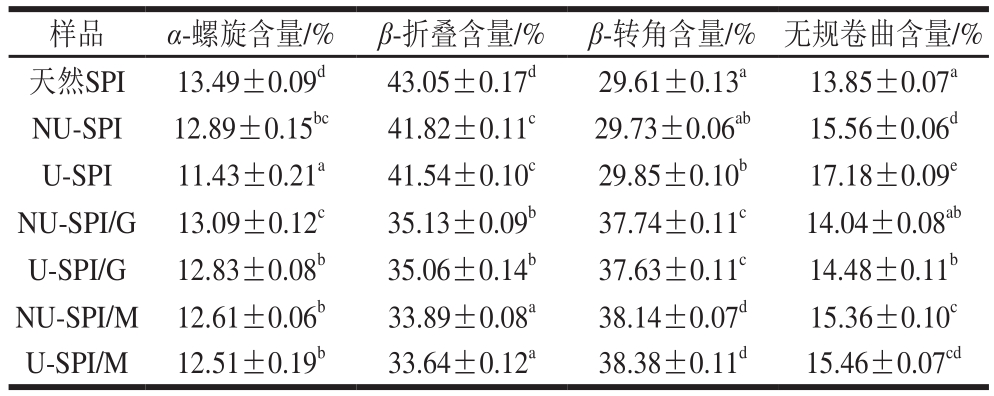
注:同列肩标小写字母不同表示差异显著(P<0.05)。
样品 α-螺旋含量/% β-折叠含量/% β-转角含量/% 无规卷曲含量/%天然SPI 13.49±0.09d43.05±0.17d29.61±0.13a13.85±0.07aNU-SPI 12.89±0.15bc41.82±0.11c29.73±0.06ab15.56±0.06dU-SPI 11.43±0.21a41.54±0.10c29.85±0.10b17.18±0.09eNU-SPI/G 13.09±0.12c35.13±0.09b37.74±0.11c14.04±0.08abU-SPI/G 12.83±0.08b35.06±0.14b37.63±0.11c14.48±0.11bNU-SPI/M 12.61±0.06b33.89±0.08a38.14±0.07d15.36±0.10cU-SPI/M 12.51±0.19b33.64±0.12a38.38±0.11d15.46±0.07cd
由表1可以看出,天然SPI的二级结构α-螺旋和无规卷曲含量相对较少,主要以β-结构为主。对SPI进行热处理后,α-螺旋和β-折叠含量显著降低(P<0.05),而无规卷曲含量显著增加(P<0.05),这表明热处理会使SPI分子结构由有序变为无序,可能是由于蛋白分子发生热变性使其结构展开,破坏了原来的有序结构,导致无序结构含量增加[25]。此外,超声预处理会使热处理过程中蛋白分子结构变得更加无序,结构展开的更加充分,暴露出更多的活性基团,改善了蛋白分子的柔韧性[26],这也可能是超声能够促进糖基化反应的原因。与热处理SPI相比,SPI/糖复合物α-螺旋含量的增加和无规卷曲含量的降低说明糖基化反应会减少热处理过程中SPI二级结构由有序向无序的转变程度,这可能是由于SPI与糖共价复合抑制了蛋白质热变性而导致的[27]。SPI/G复合物结构比SPI/M复合物更加有序,说明葡萄糖比麦芽糖具有更强的抑制蛋白质热变性作用,这可能与两种糖DG的不同有关(图1)。此外,尽管超声预处理会使热处理蛋白的二级结构变的更加无序,但超声作用对于SPI/糖复合物二级结构的影响并不显著(P>0.05)。Li Chen等[28]发现在80 ℃超声处理下,花生分离蛋白与葡聚糖发生糖基化反应后生成的复合物二级结构发生显著改变,与本研究结果有所不同,这可能是由于大分子多糖和小分子糖的结构和性质不同而导致的。

图4 非超声和超声预处理下SPI(A)和SPI/糖复合物(B)的内源荧光光谱
Fig.4 Intrinsic fluorescence spectra of SPI (A) and SPI-sugar conjugates (B) with and without ultrasonic pretreatment
内源荧光光谱用于评价蛋白质色氨酸(Trp)残基周围的构象变化,表征蛋白质三级结构[29]。由图4A可知,与天然SPI相比,无论是否采用超声预处理,热处理均能够增加SPI的荧光强度,这可能是由于热处理过程中蛋白质变性引起Trp残基周围结构改变导致的[30]。超声SPI的荧光强度高于非超声SPI,这表明超声预处理能够促进蛋白质热变性,导致其结构进一步改变。此外,非超声SPI和超声SPI的荧光发射最大波长(λmax)均比天然SPI高,表明λmax发生了红移。与非超声SPI相比,超声SPI的λmax红移程度更大,这表明超声预处理能够促进SPI的构象变化。
由图4B可知,SPI/糖复合物的荧光强度相比于天然SPI明显增加。Jing Hao等[31]对酪蛋白-糖美拉德产物理化性质的研究表明,荧光复合物的增加可能与热诱导糖基化反应有关。超声预处理能够使SPI/糖复合物的荧光强度进一步增加,这表明超声作用促进了荧光复合物的生成。与SPI/M复合物相比,SPI/G复合物具有更高的荧光强度,这与不同糖复合物的光谱学性质和荧光化学结构有关[32],该结果与β-乳球蛋白糖基化复合物的研究结果相似[33]。此外,所有SPI/糖复合物的λmax均发生红移。SPI/糖复合物λmax的红移表明糖基化会改变SPI的构象,同时使SPI三级结构变得松散。与非超声SPI/糖复合物相比,超声预处理制备的SPI/糖复合物具有更松散的三级结构,这与Perusko等[34]对乳清蛋白/阿拉伯糖复合物的研究结果相似。
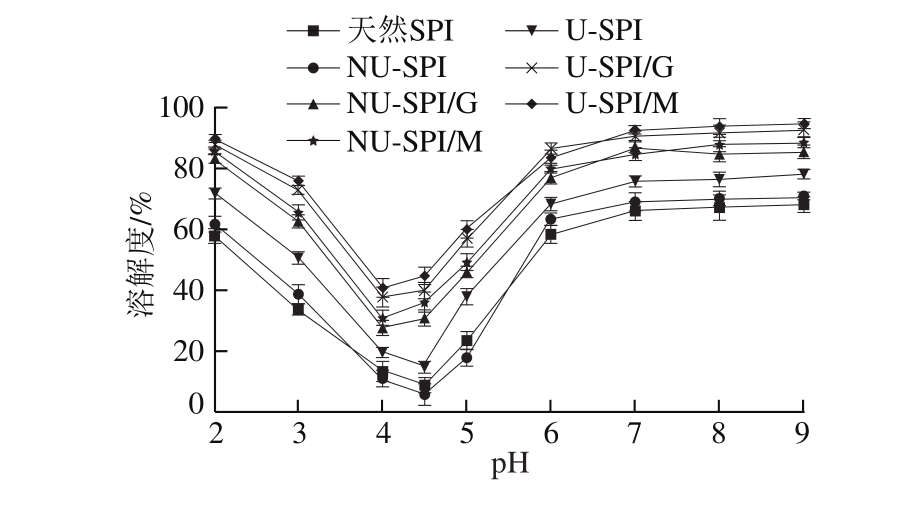
图5 非超声和超声预处理下SPI和SPI/糖复合物溶解度随pH值的变化
Fig.5 Changes in solubility of SPI and SPI-sugar conjugates with and without ultrasonic pretreatment as a function of pH
如图5所示,天然SPI在pH 4.5时的溶解度最低,这说明SPI的等电点在pH 4.5附近。对SPI进行热处理会降低蛋白质等电点附近的溶解性,但会增加远离蛋白质等电点处的溶解性。在对SPI加热前进行超声预处理会明显增加SPI溶解性,这可能是由于超声作用改变了SPI结构,使蛋白分子内部的氨基酸残基暴露出来,增加了蛋白质表面电荷,通过静电排斥作用降低了蛋白质的聚集,从而改善其溶解性[35]。当SPI与葡萄糖或麦芽糖发生糖基化反应后溶解度显著增加(P<0.05),尤其是在等电点附近。这是由于糖分子中亲水性羟基的引入增加了蛋白质与水分子之间的亲和力,同时降低由蛋白质之间的静电相互作用引起的聚集,导致蛋白质溶解性增加[36]。SPI/M复合物比SPI/G复合物溶解性高,这是由于麦芽糖分子具有更多的亲水性羟基。超声预处理会明显增加SPI/糖复合物的溶解性,这可能与超声预处理提高SPI/糖复合物的DG有关(图1)。Qu Wenjuan等[37]的研究发现,超声作用能够提高菜籽分离蛋白-葡聚糖复合物的DG,导致其溶解性得到改善,与本研究结果一致。此外,虽然超声作用对SPI/糖复合物二级结构的影响并不显著(表1),但能使复合物三级结构变得更加松散(图4),这可能是改善蛋白质溶解性的主要原因。无论是否进行超声预处理,SPI/糖复合物的等电点都会向酸性方向偏移,这可能是由于糖基化反应会消耗带正电的游离氨基,从而减少蛋白质表面的正电荷[38]。
将SPI分别与葡萄糖和麦芽糖发生糖基化反应。DG与褐变强度的分析表明,与麦芽糖相比,SPI更容易与葡萄糖发生反应,超声预处理20 min时,SPI/糖复合物的DG最大,且超声预处理制备的SPI/糖复合物具有较低的褐变强度。FTIR分析表明SPI与糖分子形成了SPI/糖复合物。对酰胺I带拟合后得到蛋白质各二级结构含量,糖基化反应会减少热处理过程中SPI二级结构由有序向无序的转变程度,超声预处理对SPI/糖复合物二级结构的影响并不显著。内源荧光光谱分析表明糖基化作用会使SPI的λmax发生红移,导致蛋白质三级结构变得松散,超声预处理能够增加SPI/糖复合物λmax的红移程度。溶解性分析表明糖基化反应能够提高SPI溶解性,尤其是在等电点附近。超声预处理会增加SPI/糖复合物的溶解性,这可能与较高的DG有关。此外,超声预处理使SPI/糖复合物三级结构变得松散也可能是其改善蛋白质溶解性的原因。
[1] ZHANG J B, WU N N, YANG X Q, et al. Improvement of emulsifying properties of Maillard reaction products from β-conglycinin and dextran using controlled enzymatic hydrolysis[J]. Food Hydrocolloids,2012, 28(2): 301-312. DOI:10.1016/j.foodhyd.2012.01.006.
[2] 孙欣, 王璋, 王莉, 等. 轻度酶解对大豆蛋白胶凝性和疏水性的影响[J]. 食品科学, 2005, 26(12): 37-40. DOI:10.3321/j.issn:1002-6630.2005.12.003.
[3] DE OLIVEIRA F C, COIMBRA J S, DE OLIVEIRA E B, et al. Food protein-polysaccharide conjugates obtained via the Maillard reaction:a review[J]. Critical Reviews in Food Science and Nutrition, 2016,56(7): 1108-1125. DOI:10.1080/10408398.2012.755669.
[4] WANG Xibo, ZHANG Yinghua, JIANG Lianzhou. Improvement of emulsifying properties of soybean protein isolate through glycosylation modification[J]. Advanced Materials Research, 2013,781/782/783/784: 1495-1499. DOI:10.4028/www.scientific.net/AMR.781-784.1495.
[5] HU H, WU J H, LI-CHAN E C Y, et al. Effects of ultrasound on structural and physical properties of soy protein isolate (SPI)dispersions[J]. Food Hydrocolloids, 2013, 30(2): 647-655.DOI:10.1016/j.foodhyd.2012.08.001.
[6] JIANG Lianzhou, WANG Jing, LI Yang, et al. Effects of ultrasound on the structure and physical properties of black bean protein isolates[J].Food Research International, 2014, 62: 595-601. DOI:10.1016/j.foodres.2014.04.022.
[7] LI Chen, HUANG Xingjian, PENG Qiang, et al. Physicochemical properties of peanut protein isolate-glucomannan conjugates prepared by ultrasonic treatment[J]. Ultrasonics Sonochemistry, 2014, 21(5):1722-1727. DOI:10.1016/j.ultsonch.2014.03.018.
[8] ABDELHEDI O, MORA L, JEMIL I, et al. Effect of ultrasound pretreatment and Maillard reaction on structure and antioxidant properties of ultrafiltrated smooth-hound viscera proteins-sucrose conjugates[J]. Food Chemistry, 2017, 230: 507-515. DOI:10.1016/j.foodchem.2017.03.053.
[9] 赵城彬, 张浩, 许秀颖, 等. 不同分子质量葡聚糖对玉米醇溶蛋白糖基化产物结构和功能性的影响[J]. 食品科学, 2018, 39(16): 68-73.DOI:10.7506/spkx1002-6630-201816011.
[10] ZHAO Chengbin, ZHANG Hao, XU Xiuying, et al. Effect of acetylation and succinylation on physicochemical properties and structural characteristics of oat protein isolate[J]. Process Biochemistry, 2017, 57: 117-123. DOI:10.1016/j.procbio.2017.03.022.
[11] CHEVALIER F, CHOBERT J M, POPINEAU Y, et al. Improvement of functional properties of β-lactoglobulin glycated through the Maillard reaction is related to the nature of the sugar[J]. International Dairy Journal, 2001, 11(3): 145-152. DOI:10.1016/S0958-6946(01)00040-1.
[12] KARDOS N, LUCHE J L. Sonochemistry of carbohydrate compounds[J]. Carbohydrate Research, 2001, 332(2): 115-131.DOI:10.1016/S0008-6215(01)00081-7.
[13] LIU G X, TU Z C, YANG W H, et al. Investigation into allergenicity reduction and glycation sites of glycated β-lactoglobulin with ultrasound pretreatment by high-resolution mass spectrometry[J]. Food Chemistry, 2018, 252: 99-107. DOI:10.1016/j.foodchem.2018.01.086.
[14] WANG L, WU M, LIU H M. Emulsifying and physicochemical properties of soy hull hemicelluloses-soy protein isolate conjugates[J].Carbohydrate Polymers, 2017, 163: 181-190. DOI:10.1016/j.carbpol.2017.01.069.
[15] AJANDOUZ E H, TCHIAKPE L S, ORE D F, et al. Effects of pH on caramelization and Maillard reaction kinetics in fructose-lysine model systems[J]. Journal of Food Science, 2001, 66(7): 926-931.DOI:10.1111/j.1365-2621.2001.tb08213.x.
[16] LI Yue, LU Fang, LUO Changrong, et al. Functional properties of the Maillard reaction products of rice protein with sugar[J]. Food Chemistry, 2009, 117(1): 69-74. DOI:10.1016/j.foodchem.2009.03.078.
[17] WANG Heya, QIAN He, YAO Weirong. Melanoidins produced by the Maillard reaction: structure and biological activity[J]. Food Chemistry,2011, 128(3): 573-584. DOI:10.1016/j.foodchem.2011.03.075.
[18] KAMNEV A A, TUGAROVA A V, DYATLOVA Y A,et al. Methodological effects in Fourier transform infrared(FTIR) spectroscopy: implications for structural analyses of biomacromolecular samples[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2018, 193: 558-564. DOI:10.1016/j.saa.2017.12.051.
[19] HUANG G Q, SUN Y T, XIAO J X, et al. Complex coacervation of soybean protein isolate and chitosan[J]. Food Chemistry, 2012, 135(2):534-539. DOI:10.1016/j.foodchem.2012.04.140.
[20] SHI Y, LI R Y, TU Z C, et al. Effect of γ-irradiation on the physicochemical properties and structure of fish myofibrillar proteins[J]. Radiation Physics and Chemistry, 2015, 109(10): 70-72.DOI:10.1016/j.radphyschem.2014.12.016.
[21] LIU J H, RU Q M, DING Y T. Glycation a promising method for food protein modification: physicochemical properties and structure,a review[J]. Food Research International, 2012, 49(1): 170-183.DOI:10.1016/j.foodres.2012.07.034.
[22] GU Fenglin, KIM J M, HAYAT K, et al. Characteristics and antioxidant activity of ultrafiltrated Maillard reaction products from a casein-glucose model system[J]. Food Chemistry, 2009, 117(1): 48-54.DOI:10.1016/j.foodchem.2009.03.074.
[23] LIU Q, KONG B H, HAN J C, et al. Structure and antioxidant activity of whey protein isolate conjugated with glucose via the Maillard reaction under dry-heating conditions[J]. Food Structure, 2014, 1(2):145-154. DOI:10.1016/j.foostr.2013.11.004.
[24] SHU J J, YONG K Y. Fourier-based classification of protein secondary structures[J]. Biochemical & Biophysical Research Communications,2017, 485(4): 731-735. DOI:10.1016/j.bbrc.2017.02.117.
[25] ZISU B, LEE J, CHANDRAPALA J, et al. Effect of ultrasound on the physical and functional properties of reconstituted whey protein powders[J]. Journal of Dairy Research, 2011, 78(2): 226-232.DOI:10.1017/S0022029911000070.
[26] ARZENI C, MARTÍNEZ K, ZEMA P, et al. Comparative study of high intensity ultrasound effects on food proteins functionality[J].Journal of Food Engineering, 2012, 108(3): 463-472. DOI:10.1016/j.jfoodeng.2011.08.018.
[27] ZHAO C B, ZHOU L Y, LIU J Y, et al. Effect of ultrasonic pretreatment on physicochemical characteristics and rheological properties of soy protein/sugar Maillard reaction products[J].Journal of Food Science and Technology, 2016, 53(5): 2342-2351.DOI:10.1007/s13197-016-2206-z.
[28] LI Chen, XUE Haoran, CHEN Zhiyan, et al. Comparative studies on the physicochemical properties of peanut protein isolatepolysaccharide conjugates prepared by ultrasonic treatment or classical heating[J]. Food Research International, 2014, 57: 1-7. DOI:10.1016/j.foodres.2013.12.038.
[29] ALIEVA R R, KUDRYASHEVA N S. Variability of fluorescence spectra of coelenteramide-containing proteins as a basis for toxicity monitoring[J]. Talanta, 2017, 170: 425-431. DOI:10.1016/j.talanta.2017.04.043.
[30] JIMÉNEZ-CASTAÑO L, VILLAMIEL M, LOPEZ-FANDIÑO R.Glycosylation of individual whey proteins by Maillard reaction using dextran of different molecular mass[J]. Food Hydrocolloids, 2007,21(3): 433-443. DOI:10.1016/j.foodhyd.2006.05.006.
[31] JING Hao, KITTS D D. Chemical and biochemical properties of casein-sugar Maillard reaction products[J]. Food and Chemical Toxicology, 2002, 40(7): 1007-1015. DOI:10.1016/S0278-6915(02)00070-4.
[32] MORALES F J, VAN BOEKEL M A J S. A study on advanced Maillard reaction in heated casein/sugar solutions: fluorescence accumulation[J]. International Dairy Journal, 1997, 7(11): 675-683.DOI:10.1016/S0958-6946(99)00014-X.
[33] DRAGANA S V, IVANA P, DANIJELA A, et al. Structure and antioxidant activity of β-lactoglobulin-glycoconjugates obtained by high-intensity-ultrasound-induced Maillard reaction in aqueous model systems under neutral conditions[J]. Food Chemistry, 2013, 138(1):590-599. DOI:10.1016/j.foodchem.2012.10.087.
[34] PERUSKO M, AL-HANISH A, VELICKOVIC C T, et al.Macromolecular crowding conditions enhance glycation and oxidation of whey proteins in ultrasound-induced Maillard reaction[J]. Food Chemistry, 2015, 177: 248-257. DOI:10.1016/j.foodchem.2015.01.042.
[35] MOLINA E, PAPADOPOULOU A, LEDWARD D A. Emulsifying properties of high pressure treated soy protein isolate and 7S and 11S globulins[J]. Food Hydrocolloids, 2001, 15(3): 263-269. DOI:10.1016/S0268-005X(01)00023-6.
[36] JIMÉNEZ-CASTAÑO L, LÓPEZ-FANDIÑO R, OLANO A, et al.Study on β-lactoglobulin glycosylation with dextran: effect on solubility and heat stability[J]. Food Chemistry, 2005, 93(4): 689-695.DOI:10.1016/j.foodchem.2004.09.050.
[37] QU Wenjuan, ZHANG Xinxin, CHEN Weiyu, et al. Effects of ultrasonic and graft treatments on grafting degree, structure,functionality, and digestibility of rapeseed protein isolate-dextran conjugates[J]. Ultrasonics Sonochemistry, 2018, 42: 250-259.DOI:10.1016/j.ultsonch.2017.11.021.
[38] ÁLVAREZ C, GARCÍA V, RENDUELES M, et al. Functional properties of isolated porcine blood proteins modified by Maillard’s reaction[J]. Food Hydrocolloids, 2012, 28(2): 267-274. DOI:10.1016/j.foodhyd.2012.01.001.
Structure and Solubility of Soybean Protein Isolate-Sugar Conjugates Prepared by Ultrasonic Pretreatment