活性氧(reactive oxygen species,ROS)是超氧化合物阴离子自由基、羟自由基、过氧化氢、单线态氧、过氧化脂质和次氯酸盐等物质的总称。低浓度的ROS在细胞内信号传导和防御病原体方面起着不可或缺的作用,而较高浓度的ROS会导致一些普遍的疾病和病症,包括心血管疾病、关节炎、癌症、糖尿病、动脉粥样硬化、局部缺血、免疫力和内分泌功能障碍等[1-4]。为了防止机体的氧化损伤,可以通过机体内酶抗氧化系统(谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT))和非酶抗氧化系统(VC、VE、谷胱甘肽(glutathione,GSH)、类胡萝卜素等还原性物质)有效清除ROS[5-6]。除了细胞自身调节之外,来自食物中的一些抗氧化活性物质也可以通过调节细胞内这两种抗氧化系统或者抑制自由基的产生起到防止ROS积聚或将其从系统中消除的作用[7]。
许多动物和植物都富含天然存在的一些抗氧化剂,而目前动物蛋白作为抗氧化活性肽的重要来源已经被广泛研究,例如在鹅蛋[8]、草鱼[9]、泥鳅[10]等动物性蛋白来源中已发现了具有抗氧化活性的多肽。在天然植物中也存在许多具有抗氧化活性的物质,包括类黄酮、α-生育酚、VE、VC、甘露醇及GSH等,这些物质既可直接与ROS反应而将其还原,又可作为酶的底物在ROS的清除中发挥重要作用[11-12]。另外,在酒类饮料中也有很多关于抗氧化活性肽的研究。例如,2015年王正元等[13]以黍米黄酒为研究对象,分离纯化得到了氨基酸序列为Cys-Gly-Ser-Pro的四肽,该四肽具有自由基清除功能,可以起到一定的抗氧化作用。2007年,Alcaide-Hidalgo等[14]从葡萄酒中分离出的酵母多肽,并对酵母多肽的血管紧张素转化酶抑制活性和抗氧化活性(氧化自由基吸收能力法)进行了考察。但是,关于白酒中多肽的研究很少。2014年,Zhang Rong等[15]采用高效液相色谱(high performance liquid chromatography,HPLC)分离结合四极杆-飞行时间质谱(quadrupole-time-of-flight mass spectrometer,Q-TOF-MS)与核磁共振检测技术,分析鉴定出白酒体系中非挥发性特征成分地衣素,并剖析了地衣素影响小分子香气化合物挥发性的作用机制。2016年,吴继红等[16]在白酒中发现一种多肽,具有明显的抑制血管紧张素转换酶活性的作用。而关于白酒中的抗氧化肽,目前仅有少量文献有所报道,有研究发现来自芝麻香型白酒中的一种四肽具有细胞内抗氧化活性,可以对2,2’-偶氮双(2-甲基丙脒)二盐酸盐(2,2’-azobis(2-methylpropanimidamidine) dihydrochloride,AAPH)诱导的人体肝癌HepG2细胞的氧化损伤起防护作用[17]。
抗氧化活性物质的评价方法目前主要有细胞模型法、体内法和体外法3 种:体外法是一种常用的方法,具有实验周期短、成本低、重复性好等优点,但不能反映细胞内真实的生理条件[18];体内法(动物模型和临床研究)是评估样品抗氧化作用较好的方法,但其样品用量大、成本高、实验周期长;而采用细胞模型法评价物质的抗氧化活性,既可以符合机体真实的生理条件,同时也克服了动物模型成本高、实验周期长等缺点,使得研究更经济、快捷[7,19]。
本研究主要通过HPLC-Q-TOF-MS鉴定了从芝麻香型白酒中分离出来的一种三肽,同时利用AAPH诱导的HepG2细胞氧化损伤模型探究其细胞内抗氧化活性,为中国白酒的健康发展提供理论支持,也为今后健康白酒的研发提供一定参考。
芝麻香型白酒原浆酒(乙醇体积分数65%) 山东扳倒井股份有限公司;HepG2细胞 中国疾病预防控制中心;Arg-Asn-His(RNH)合成肽标准品(纯度大于95%)吉尔生化(上海)有限公司;乙腈(色谱纯,纯度大于99%)赛默飞世尔(中国)公司;甲酸(色谱纯,纯度大于99%)北京迪科马科技有限公司;胎牛血清(fetal bovine serum,FBS)、抗生素、AAPH 美国Sigma-Aldrich公司;微量丙二醛(malondialdehyde,MDA)、SOD、CAT、GSH-Px和总蛋白检测试剂盒 南京建成生物技术研究所;ROS、GSH测定试剂盒 碧云天生物技术研究所;细胞计数试剂盒(CCK-8) 日本Dojindo公司;Dulbecco’s modified Eagle medium(DMEM)培养基 美国Corning公司;磷酸盐缓冲液(phosphate buffered saline,PBS) 上海源叶生物科技有限公司;无菌去离子水 北京索莱宝科技有限公司;胰蛋白酶美国Gibco公司;RIPA细胞溶解缓冲液 北京康为世纪生物科技有限公司;其他试剂均为国产分析纯。
HPLC-Q-TOF-MS(HPLC型号为1290,Q-TOF型号为6530)、ZORBAX SB-C18反相色谱柱(150 mm×4.6 mm,5 μm)、100 μL自动进样针、2.0 mL进样瓶 美国Agilent公司;CCL-170B-8细胞培养箱 新加坡ESCO科技有限公司;SpectraMax M2e多功能酶标仪 美国Molecular Devices公司;TGL-20B-C高速台式离心机 上海安亭科学仪器厂;荧光显微镜日本Nikon公司;SHB-III循环水式多用真空泵 郑州长城科工贸有限公司;DKB-501A超级恒温水槽 上海森信实验仪器有限公司;RE-52AA旋转蒸发仪 上海亚荣生化仪器厂;FD-1B-80型冷冻干燥机 南京普森仪器设备有限公司;漩涡混合器 北京大龙兴创实验仪器有限公司;SL-N电子天平 上海民桥精密科学仪器有限公司;1.0 mL和200、100、10 μL移液枪 北京吉尔森科技有限公司;50~300 μL电动排枪 德国Eppendorf公司;Costa 96 孔板 美国Corning公司。
1.3.1 白酒前处理
量取5 L酒样,采用旋转蒸发仪在50 ℃、-0.1 MPa条件下浓缩至50 mL,残留物用重蒸的乙酸乙酯萃取3 次,每次50 mL,将萃取后的水相冻干后用1.0 mL超纯水复溶,置于-20 ℃冰箱内保存备用。
1.3.2 白酒中多肽的定性方法
将1.3.1节中处理的酒样过0.45 μm滤膜后,置于1.5 mL进样瓶中,采用HPLC-Q-TOF-MS鉴定该样品中的多肽,多肽的氨基酸序列通过从头测序算法(De novo)进行解析。
1.3.2.1 色谱条件
流动相A:超纯水(含体积分数0.1%甲酸溶液),流动相B:乙腈(含体积分数0.1%甲酸溶液);洗脱程序:0~3 min,92%流动相A;3~15 min,92%~20%流动相A;15~20 min,20%~8%流动相A;20~25 min,8%~92%流动相A;25~30 min,92%流动相A;流速:0.5 mL/min;检测波长:214 nm;柱温:室温(25 ℃);进样量:10 μL。
1.3.2.2 MS条件
TOF模式:离子源:电喷雾离子源(electron spray ionization,ESI);扫描模式:正离子模式;干燥气温度:300 ℃;流量:8 L/min;喷雾器压力:241.32 kPa;毛细管电压:4 000 V;离子扫描范围:m/z 100~1 000;采集速率:4 张质谱图/s;裂解电压:120 V;碰撞池电压:0 V。
MS模式:离子源:ESI;扫描模式:正离子模式;干燥气温度:300 ℃,流量:8 L/min;鞘气温度:350 ℃,流量:12 L/min;喷雾器压力:241.32 kPa;毛细管电压:4 000 V;裂解电压:120 V;碰撞池电压:18 V;MS扫描范围:m/z 50~1 000;采集速率:2 张质谱图/s。
1.3.3 白酒中多肽的定量分析
采用外标曲线法对多肽进行定量分析,方法如下:用超纯水配制质量浓度分别为0.01、0.10、1.00、5.00、10.00、25.00 mg/L的RNH标准品溶液,HPLC-Q-TOF-MS分析条件同1.3.2节。将经过前处理的酒样同不同质量浓度的RNH标准品溶液在同等条件下采用MS扫描模式对目标母离子进行扫描,对积分峰面积与标准品质量浓度绘制标准曲线,然后根据标准曲线计算多肽的质量浓度。
1.3.4 多肽的细胞内抗氧化活性测定
1.3.4.1 细胞培养
HepG2细胞采用含有质量分数2.5% FBS和50 μg/mL抗生素(庆大霉素、青霉素和链霉素)的DMEM培养基,在5% CO2、95%空气、37 ℃的湿润培养箱中培养。每2 d更换一次培养基,待细胞融合度达到80%~90%时,使用质量分数0.25%胰蛋白酶和质量分数0.02%乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)溶液进行分离。为了避免FBS的干扰,在测定之前将平板更换为无FBS培养基。取对数生长期的细胞进行后续实验。
1.3.4.2 多肽对HepG2细胞毒性的影响
为避免多肽对细胞存活率产生的影响,确定适合后续实验的样品浓度,将密度为1×105个/mL的细胞接种到Costa 96 孔板中,每孔加入100 μL细胞悬液,于37 ℃、5% CO2培养箱中贴壁培养24 h后进行实验。实验分为2 组,分别为样品组和对照组,每组设置4 个孔。样品组中加入10 μL质量浓度分别为12.00、8.00、4.00、2.00、1.00、0.500、0.250、0.125 mg/mL的多肽,对照组加入等体积的无FBS培养基,继续培养24 h;之后各组每孔加入10 μL CCK-8,放置4 h后用酶标仪检测波长450 nm处的OD值,并按照下式计算细胞存活率。
1.3.4.3 多肽对AAPH诱导氧化损伤的HepG2细胞中ROS的影响
实验分为4 组,分别为样品组、AAPH对照组、阳性对照组和空白组,每组设置4 个孔。样品组加入100 μL质量浓度分别为1.00、2.00、4.00 mg/mL的多肽,以及含10 μmol/L 2’,7’-二氯荧光黄双乙酸盐(2’,7’-dichlor odihydrofluorescein diacetate,DCFH-DA)的无FBS培养基,对照组和空白组分别加入100 μL不含样品、含10 μmol/L DCFH-DA的无FBS培养基,在37 ℃培养箱中培养20 min后取出,弃去培养液后用无FBS培养基小心清洗细胞3 次。向样品组和AAPH对照组加入100 μL浓度为200 μmol/L的AAPH溶液,向空白组加入等体积无FBS培养基,放入培养箱中继续孵育3 h后取出,用荧光显微镜拍照,并使用荧光酶标仪测定荧光强度,激发波长488 nm、发射波长525 nm[17]。阳性对照组加入100 μL按体积比1∶1 000稀释后的Rosup,放入培养箱中继续孵育0.5 h后取出测定其荧光强度,测定条件同空白组。
1.3.4.4 细胞内MDA含量和抗氧化酶(GSH-Px、SOD、CAT)活力的测定
实验分为3 组,分别为空白组、AAPH对照组和样品组,每组设置4 个孔。将HepG2细胞以1×105个/mL的密度接种在Costa 24 孔板中,每孔加入1 mL细胞悬液,于37 ℃、5% CO2培养箱中贴壁培养24 h后进行实验。弃去培养液,样品组每孔细胞加入600 μL质量浓度分别为1.00、2.00、4.00 mg/mL的多肽,AAPH对照组和空白组加入等体积无FBS培养基,在细胞培养箱中孵育2 h,然后将细胞用PBS清洗两次。为了诱导氧化应激,样品组和AAPH对照组每孔均加入600 μL 200 μmol/L AAPH溶液,空白组加入等体积无FBS培养基,在细胞培养箱中孵育3 h后将细胞用PBS清洗3 次。用含有1 mmol/L苯基甲烷磺酰氟的RIPA裂解液在4 ℃裂解10 min,收集裂解后的细胞,在10 000×g条件下离心5 min获得上清液。测定上清液中的MDA含量以及GSH-Px、SOD和CAT活力,以牛血清白蛋白为标准品定量测定细胞溶质中的蛋白质量浓度,按试剂盒说明书进行操作。
1.3.4.5 细胞内GSH浓度的测定
将HepG2细胞以1×105个/mL的密度接种在Costa 24 孔板中,每孔加入1.0 mL细胞悬液,于37 ℃、5% CO2培养箱中贴壁培养24 h后进行实验。通过1.3.4.4节方法处理细胞。将加入600 μL 200 μmol/L AAPH溶液孵育3 h之后的细胞用质量分数0.25%胰蛋白酶-EDTA溶液在37 ℃消化5 min,然后用PBS清洗2 次。加入含FBS的培养基终止消化,并将混合物在4 ℃下以10 000×g离心10 min,收集细胞碎片沉淀物。用蛋白去除试剂去除细胞碎片沉淀物中的细胞内蛋白,再将细胞碎片沉淀在-80~37 ℃之间快速循环两次,然后将细胞碎片沉淀物在4 ℃保持5 min,以10 000×g离心10 min后获得上清液。使用试剂盒测定细胞上清液中的GSH浓度。
所有实验重复4 次,结果以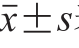 表示,采用最小显著性差异法检验显著性,P<0.05表示差异显著,使用SPSS 16.0软件完成数据分析。通过Agilent Masshunter B.06.00电脑工作站软件对MS数据进行分析。通过ChemDraw Ultra 12.0软件完成结构式的绘制,其余图片均使用Origin 8.5软件绘制。
表示,采用最小显著性差异法检验显著性,P<0.05表示差异显著,使用SPSS 16.0软件完成数据分析。通过Agilent Masshunter B.06.00电脑工作站软件对MS数据进行分析。通过ChemDraw Ultra 12.0软件完成结构式的绘制,其余图片均使用Origin 8.5软件绘制。
对MS数据进行分析,提取离子色谱图,发现保留时间为6.794 min处m/z 426.218 4([M+H]+)的组分峰面积最大,而且峰纯度高。将m/z 426.218 4的离子作为母离子进行MS/MS分析,其离子色谱图、MS图及MS/MS图如图1所示。
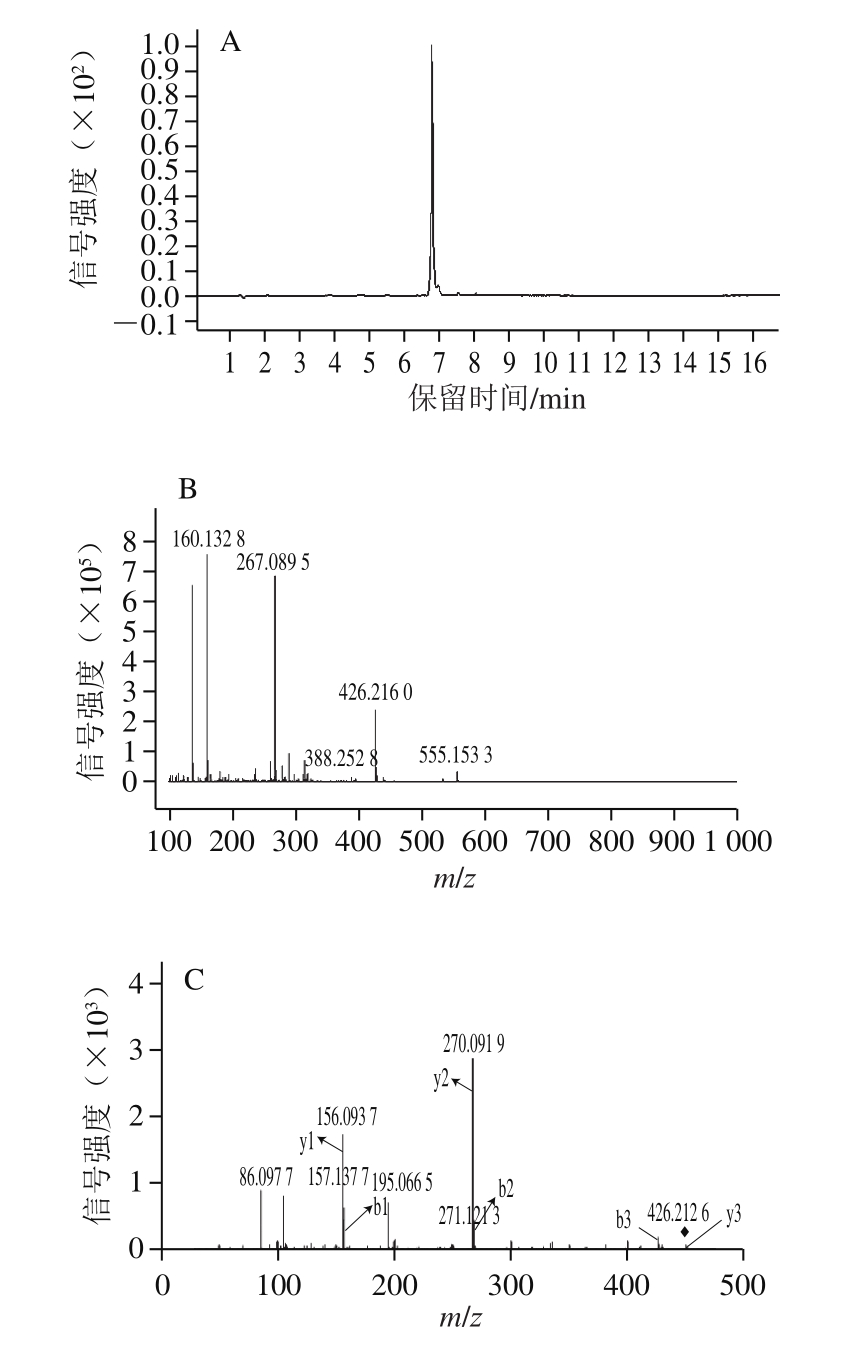
图1 多肽母离子m/z 426.218 4的离子色谱图(A)、MS图(B)和MS/MS图(C)
Fig.1 Extracted ion chromatogram (A), MS (B), and MS/MS (C) of m/z 426.218 4
为了得到多肽的氨基酸序列,根据文献[10,17,20-23]报道的方法,采用从头测序算法解析未知多肽的MS/MS碎片信息,确认其氨基酸序列。多肽通常在ESI-MS/MS条件下被质子化,当碰撞能量在10~200 eV时,多肽主要在酰胺键处发生断裂,而侧链的化学键在此低能量下较难发生断裂,因此,MS/MS碎片离子主要是b离子和y离子[23]。
如图1B所示,分析本研究得到的母离子m/z 426.218 4的MS/MS图,推测m/z 270.091 9的碎片离子为y2离子,可能是Asn-His;推测m/z 271.121 3的碎片离子为b2离子,可能是Arg-Asn;推测m/z 156.093 7的碎片离子为y1离子,可能是His;推测m/z 157.137 7的碎片离子为b1离子,可能为Arg。综上所述,确定m/z 426.218 4的多肽氨基酸序列为Arg-Asn-His。其结构如图2所示。
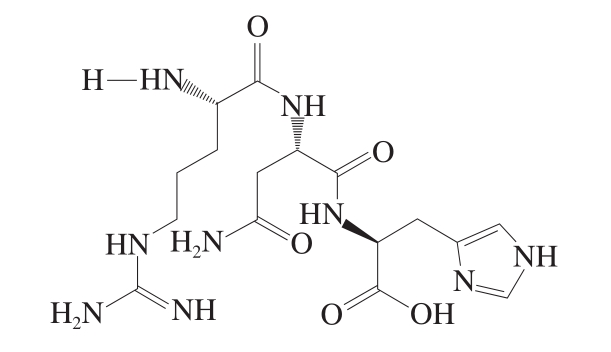
图2 RNH结构式
Fig.2 Structure of RNH
本研究采用外标法对RNH进行定量分析,标准曲线的方程为y=142 567x-51 242(R2=0.997 7),计算出白酒中RNH质量浓度为(18.78±0.34)μg/L。
2.3.1 RNH对HepG2细胞毒性的影响
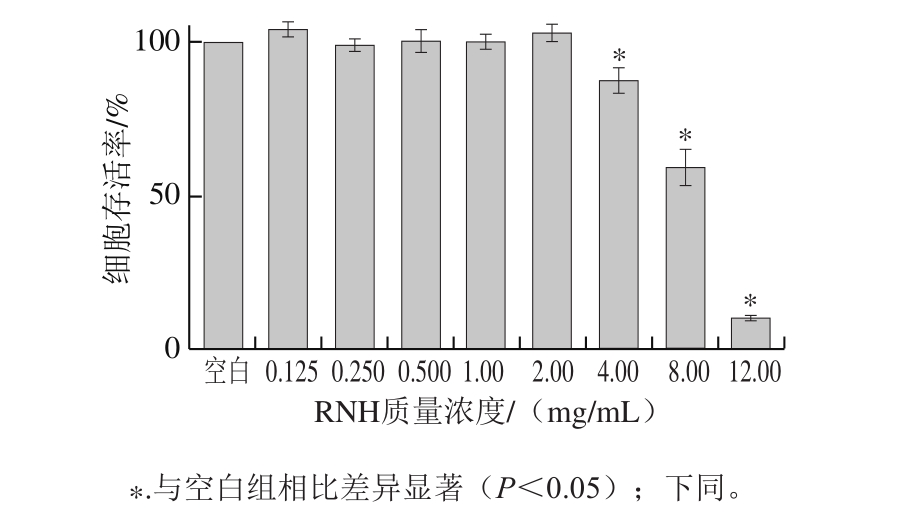
图3 RNH质量浓度对HepG2细胞存活率的影响
Fig.3 Effect of RNH concentration on viability of HepG2 cells
如图3所示,当RNH质量浓度在4.00 mg/mL以内时,随着样品质量浓度的增加,细胞死亡率基本没有变化;但当RNH质量浓度达到4.00 mg/mL时,细胞死亡率显著增加(P<0.05),表明在此质量浓度下HepG2细胞已经受到损伤,但是存活率依旧在80%以上,可以视为细胞在此条件下能正常存活。为了考察不同RNH质量浓度对细胞抗氧化性的影响,选择3 个质量浓度1.00、2.00、4.00 mg/mL作为后续实验的样品质量浓度。
2.3.2 RNH对AAPH诱导的氧化损伤HepG2细胞内ROS的影响
AAPH是一种偶氮化合物,在37 ℃下可以自发分解产生自由基。其产生的自由基与氧立即发生反应而引起脂质氧化[24]。细胞膜脂质的氧化降解可导致其丧失完整性,同时导致运输机制产生缺陷并且增加细胞膜的渗透性,使得AAPH可渗透细胞膜进入细胞内部,引起ROS的产生[25]。因此,用AAPH诱导氧化应激,通过细胞内ROS的浓度来反映HepG2细胞的氧化损伤是一种有效方式。
本研究利用荧光探针DCFH-DA进行ROS检测。DCFH-DA本身没有荧光,可以自由穿过细胞膜,进入细胞后,可以被细胞内的酯酶水解生成没有荧光的DCFH,而DCFH不能透过细胞膜,而且可以被细胞内ROS氧化为具有荧光的7’-二氯荧光素(7’-dichlorofluorescein,DCF),根据DCF荧光强度即可知细胞内ROS水平[26-27]。
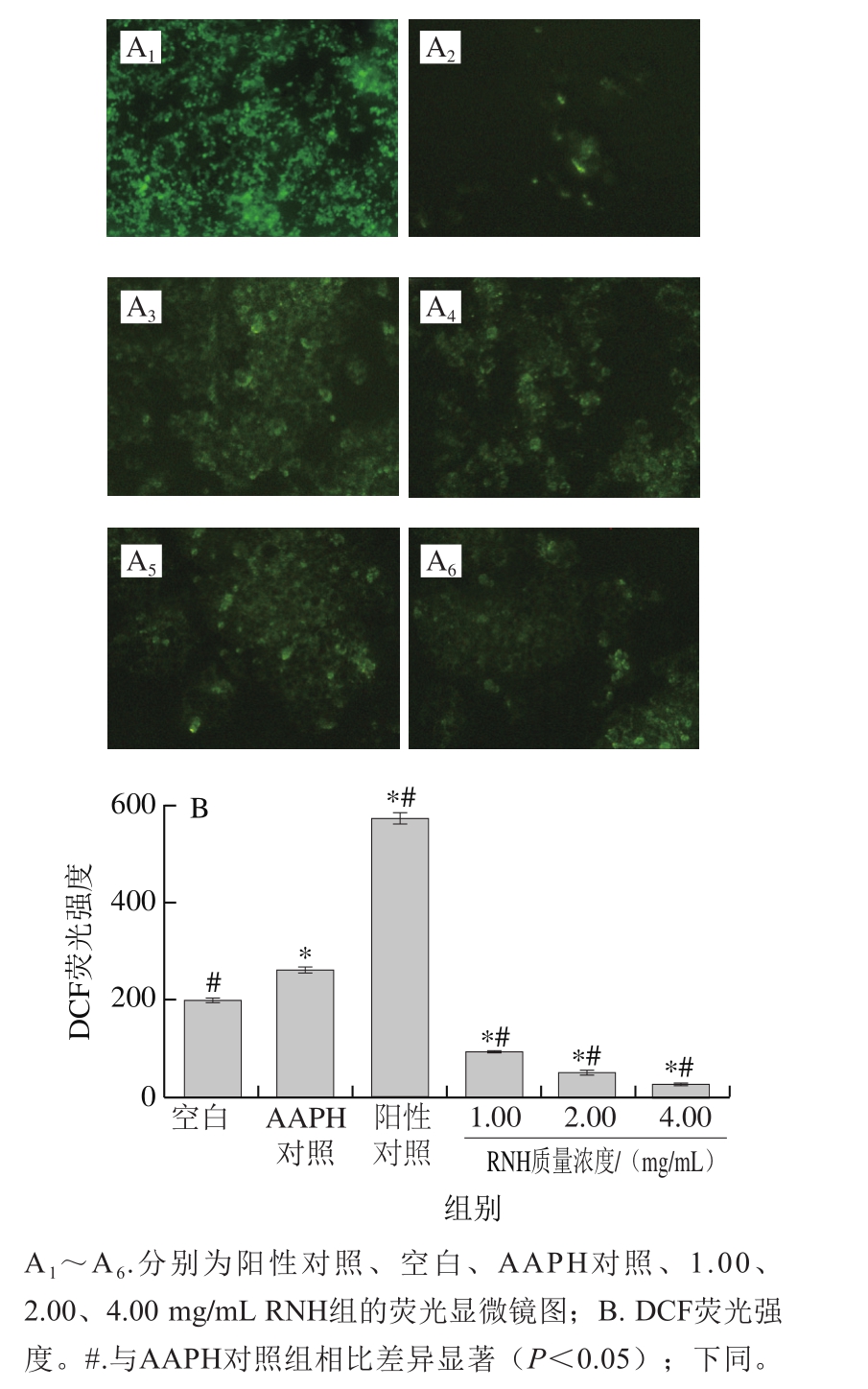
图 4 RNH对AAPH诱导的氧化损伤HepG2细胞内ROS的影响
Fig.4 Effect of RNH on intracellular ROS in HepG2 cells with AAPH-induced oxidative damage
如图4A所示,空白组未经AAPH处理,显示出比较弱的荧光,说明细胞没有受到氧化损伤。相比而言,AAPH对照组荧光较强。与AAPH对照组相比,经过不同质量浓度RNH预处理的样品组表现出了较弱的荧光,说明多肽在一定程度上降低了细胞内ROS水平。为了避免人眼主观性的差异,用酶标仪对细胞内荧光强度进行测定,结果如图4B所示。与AAPH对照组相比,加入不同质量浓度的RNH显著减少了ROS产生(P<0.05),而且呈浓度依赖性。这表明用RNH处理后的HepG2细胞受到部分保护,可防止其受到氧化损伤,而且RNH的质量浓度越高,保护效果越好。
2.3.3 多肽对细胞内MDA含量的影响
细胞膜降解的一个重要步骤是ROS与多不饱和脂肪酸(polyunsaturated fatty acid,PUFA)的双键反应,产生脂质过氧化氢,引发脂质过氧化作用,并因此形成脂质过氧化物[28]。MDA是一种由过氧化PUFA(主要是花生四烯酸)断裂形成的三碳化合物,是脂质过氧化的主要产物之一[29]。因此,MDA含量可以反映机体内过氧化程度,从而间接反映细胞损伤程度。
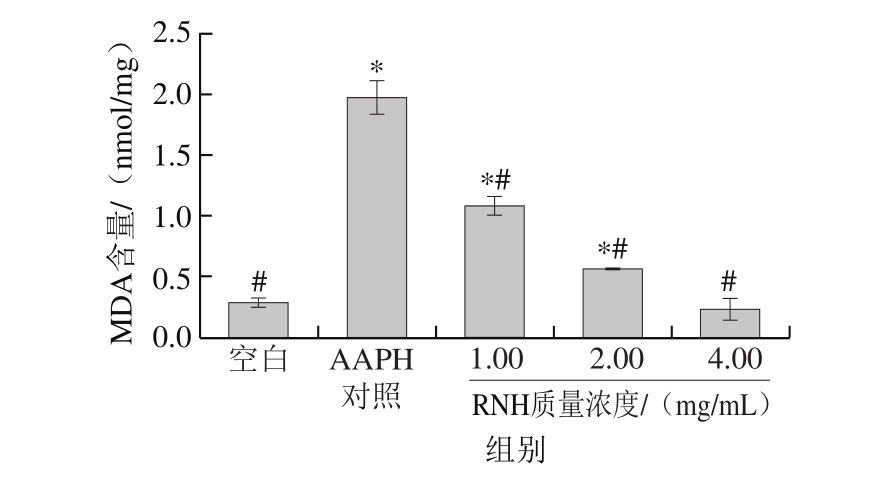
图 5 RNH对细胞内MDA含量的影响
Fig.5 Effect of RNH concentration on intracellular MDA
如图5所示,与空白组相比,经过200 μmol/L AAPH处理3 h后的HepG2细胞中MDA含量显著增加(P<0.05)。与AAPH对照组相比,用不同质量浓度RNH预处理2 h后均对细胞内MDA含量有所抑制:其中低质量浓度(1.00 mg/mL)RNH处理后的HepG2细胞中MDA含量为1.08 nmol/mg,其对细胞内MDA的抑制率为45.24%;而高质量浓度(4.00 mg/mL)RNH处理后的细胞内MDA含量为0.24 nmol/mg,其抑制率为88.10%,且与正常细胞相比无显著性差异(P>0.05)。以上结果表明,RNH对AAPH诱导的HepG2细胞内氧化损伤具有一定的保护作用,且具有抗氧化活性。
2.3.4 RNH对AAPH诱导的HepG2细胞中GSH浓度的影响
GSH是细胞内非常重要的一种非酶系统抗氧化剂,是体内清除ROS的一种重要物质,对于维持机体的氧化还原平衡意义重大。GSH浓度的减小表明机体发生了强烈的氧化应激反应,因此抗氧化剂保护细胞氧化损伤的一种有效途径就是减少细胞内GSH的消耗[23,30]。

图 6 RNH对AAPH诱导的氧化损伤HepG2细胞内GSH浓度的影响
Fig.6 Effect of RNH concentration on intracellular GSH
如图6所示,与空白组相比,加入AAPH之后GSH浓度显著降低(P<0.05),说明AAPH对细胞造成了氧化损伤,细胞为了抵御氧化损伤,导致GSH被消耗。但是,在加入RNH对细胞进行预培养之后,再加入AAPH进行氧化损伤,其GSH浓度均显著高于AAPH对照组(P<0.05)。可见,RNH可以提高HepG2细胞中的GSH浓度,减少AAPH诱导的氧化损伤,具有一定的抗氧化能力。
2.3.5 RNH对细胞内GSH-Px、SOD、CAT活力的影响
作为酶促系统中重要的抗氧化剂,细胞内GSH-Px、SOD、CAT 3 种酶主要通过间接清除自由基的方式减少对GSH的消耗,提高其自身活力从而抑制过氧化反应[19]。其中SOD可以清除人体内的自由基,催化O2-·形成H2O2和O2,而CAT和GSH-Px可将H2O2转化为H2O,三者都是哺乳动物体内重要的抗氧化酶,其中SOD被认为是防止氧化损伤的关键酶,具有独特的生物活性。因此,可以将抗氧化酶活力的变化作为细胞抗氧化应激的生物性标志[12,31]。
表 1 RNH对AAPH诱导的氧化损伤HepG2细胞内CAT、GSH-Px和SOD活力变化的影响
Table1 Effect of RNH on GSH-Px, SOD and CAT activities in HepG2 cells with AAPH-induced damage

注:*.与空白组相比差异显著(P<0.05);#.与AAPH对照组相比差异显著(P<0.05)。
RNH组活力/(U/mg)1.00 mg/mL 2.00 mg/mL 4.00 mg/mL GSH-Px 232.80±15.24#93.12±5.76* 123.05±5.76*#182.91±15.24*#325.92±20.77*#SOD 12.19±0.10#6.42±0.28* 10.13±0.44*#15.34±0.33*#24.41±0.37*#CAT 1.53±0.12#0.79±0.07* 1.01±0.07*#2.72±0.23*#5.22±0.14*#抗氧化酶 空白组活力/(U/mg)AAPH对照组活力/(U/mg)
如表1所示,与空白组相比,使用AAPH处理3 h可显著抑制GSH-Px、SOD和CAT活力(P<0.05),其抑制率分别为60.00%、47.33%和48.37%,表明AAPH处理增加了HepG2细胞内的氧化应激。RNH组与AAPH对照组相比,GSH-Px、SOD和CAT活力都有所提升,低质量浓度组分别增加32.14%、57.79%和27.85%,中质量浓度组分别增加96.42%、138.94%和244.30%,高质量浓度组分别增加250.00%、280.22%和560.76%。以上结果表明,多肽对AAPH诱导的氧化损伤HepG2细胞氧化应激具有保护作用。Du Yichen[32]和Wang Liying[33]等的研究发现,肽具有抗氧化能力,其可以通过改善细胞内重要抗氧化酶(GSH-Px、SOD和CAT)的活力来保护细胞免受氧化应激的相关损伤。在本研究中,RNH也通过增加GSH-Px、SOD和CAT 3 种抗氧化酶活力,有效地激发了HepG2细胞的抗氧化酶系防御系统,减少氧化应激损伤。
多肽的抗氧化性主要与其氨基酸组成、排列顺序、分子质量大小及其空间结构等相关。由于His结构中含有的咪唑基团具有良好的供电子和供氢能力,因此具有良好的自由基清除能力。据报道,咪唑基团能抑制脂质过氧化,如Chen Huaming等[34]从大豆β-伴球蛋白水解产物中鉴定出6 个肽,其中4 个含有His,这些肽均能抑制脂质过氧化。另外,Escudero等[35]从火腿中鉴定出一系列多肽,发现含有His的肽段SSAHT和IHSGSVG也都具有一定的抗氧化能力,并指出这是序列中His的贡献。另外,也有研究表明His能促进血红素的SOD活力[36-37],从而发挥其抗氧化作用。因此,本研究从白酒中分离鉴定出的多肽RNH的抗氧化性也可能是His的贡献。
本研究利用HPLC-Q-TOF-MS在芝麻香型白酒中鉴定出一种三肽RNH,通过AAPH诱导的HepG2细胞氧化损伤模型,发现该三肽具有一定的细胞内抗氧化活性,不仅可以提高机体内还原性物质GSH的浓度,清除细胞内ROS,而且能够提高细胞内抗氧化酶(GSH-Px、SOD、CAT)的活力,同时可以防止MDA含量的增加,降低细胞中AAPH诱导的脂质过氧化水平,从而提高细胞的抗氧化能力。
目前已报道的白酒中具有生物活性的多肽还很少,本实验结果不仅可以为功能性白酒的研究提供一定的参考,而且可以为食源性生物活性肽在白酒工业中的应用提供一定的依据。今后将继续对白酒中的各种健康因子进行研究,尤其是不同香型白酒的功效将是主要研究目标。
[1] RAJENDRAN P, NANDAKUMAR N, RENGARAJAN T, et al.Antioxidants and human diseases[J]. Clinica Chimica Acta, 2014,436(25): 332-347. DOI:10.1016/j.cca.2014.06.004.
[2] SEIFRIED H E, ANDERSON D E, FISHER E I, et al. A review of the interaction among dietary antioxidants and reactive oxygen species[J].The Journal of Nutritional Biochemistry, 2007, 18(9): 567-579.DOI:10.1016/j.jnutbio.2006.10.007.
[3] 林宝玉. 浅谈自由基对人体的危害及清除方法[J]. 中国西部科技,2007(18): 37; 48. DOI:10.3969/j.issn.1671-6396.2007.12.016.
[4] 刘德明, 常利, 朱壮荣. 活性氧化学: 自由基与生命[J]. 化学教育,1999(12): 1-3.
[5] ZHANG H J, ZHANG S S, WANG J, et al. Wheat bran feruloyl oligosaccharides protect against AAPH-induced oxidative injury via p38MAPK/PI3K-Nrf2/Keap1-MafK pathway[J]. Journal of Functional Foods, 2017, 29: 53-59. DOI:10.1016/j.jff.2016.12.009.
[6] ZHAO M M, YANG Q Y, LIN L Z, et al. Intracellular antioxidant activities of selected cereal phenolic extracts and mechanisms underlying the protective effects of adlay phenolic extracts on H2O2-induced oxidative stress in human erythrocytes[J]. Journal of Functional Foods, 2017, 31: 160-171. DOI:10.1016/j.jff.2017.01.046.
[7] 夏春燕, 郭晓晖, 李富华, 等. 细胞抗氧化活性方法在食物抗氧化活性评价中的研究进展[J]. 食品科学, 2012, 33(15): 297-302.
[8] BARATZADEH M H, ASOODEH A, CHAMANI J. Antioxidant peptides obtained from goose egg white proteins by enzymatic hydrolysis[J]. International Journal of Food Science and Technology,2013, 48(8): 1603-1609. DOI:10.1111/ijfs.12130.
[9] REN J Y, ZHAO M M, SHI J, et al. Purification and identification of antioxidant peptides from grass carp muscle hydrolysates by consecutive chromatography and electrospray ionizationmass spectrometry[J]. Food Chemistry, 2008, 108(2): 727-736.DOI:10.1016/j.foodchem.2007.11.010.
[10] YOU L J, ZHAO M M, REGENSTEIN J M, et al. Purification and identification of antioxidative peptides from loach (Misgurnus anguillicaudatus) protein hydrolysate by consecutive chromatography and electrospray ionization-mass spectrometry[J]. Food Research International, 2010, 43(4): 1167-1173. DOI:10.1016/j.foodres.2010.02.009.
[11] 杜秀敏, 殷文璇, 赵彦修, 等. 植物中活性氧的产生及清除机制[J]. 生物工程学报, 2001, 17(2): 121-125. DOI:10.3321/j.issn:1000-3061.2001.02.003.
[12] 吕品, 张岩, 李建华, 等. 植物细胞活性氧的产生和清除机制[J]. 生物学教学, 2010, 35(2): 4-5. DOI:10.3969/j.issn.1004-7549.2010.02.002.
[13] 王正元, 张国丛, 田青, 等. DA201-C 型大孔树脂吸附黄酒多肽的研究[J]. 河南工业大学学报(自然科学版), 2014, 35(5): 35-39.
[14] ALCAIDE-HIDALGO J M, PUEYO E, POLO M C, et al. Bioactive peptides released from Saccharomyces cerevisiae under accelerated autolysis in a wine model system[J]. Journal of Food Science, 2007,72(7): 276-279. DOI:10.1111/j.1750-3841.2007.00450.x.
[15] ZHANG Rong, WU Qun, XU Yan. Lichenysin, a cyclooctapeptide occurring in Chinese liquor Jiannanchun reduced the headspace concentration of phenolic off-flavors via hydrogen-bond interactions[J].Journal of Agricultural and Food Chemistry, 2014, 62(33): 8302-8307.DOI:10.1021/jf502053g.
[16] 吴继红, 孙宝国, 赵谋明, 等. 白酒中血管紧张素转换酶抑制肽的发现与研究[J]. 中国食品学报, 2016, 16(9): 14-20. DOI:10.16429/j.1009-7848.2016.09.002.
[17] WU J H, HUO J Y, HUANG M Q, et al. Structural characterization of a tetrapeptide from sesame flavor-type Baijiu and its preventive effects against AAPH-induced oxidative stress in HepG2 cells[J]. Journal of Agricultural and Food Chemistry, 2017, 65(48): 10495-10504.DOI:10.1021/acs.jafc.7b04815.
[18] MERMELSTEIN N H. Determining antioxidant activity[J]. Food Technology, 2008, 62(11): 63-66.
[19] 陈亚蓝, 王雪青, 王怡雯, 等. 基于HepG2细胞模型研究普洱茶茶色素的抗氧化作用[J]. 食品科学, 2017, 38(1): 226-231. DOI:10.7506/spkx1002-6630-201701038.
[20] NGO D, QIAN Z J, RYU B, et al. In vitro antioxidant activity of a peptide isolated from Nile tilapia (Oreochromis niloticus) scale gelatin in free radical-mediated oxidative systems[J]. Journal of Functional Foods, 2010, 2(2): 107-117. DOI:10.1016/j.jff.2010.02.001.
[21] YU Z P, LIU B Q, ZHAO W Z, et al. Primary and secondary structure of novel ACE-inhibitory peptides from egg white protein[J]. Food Chemistry, 2012, 133(2): 315-322. DOI:10.1016/j.foodchem.2012.01.032.
[22] 孙自勇, 吴盛, 王石泉, 等. 液相色谱与串联质谱偶联在蛋白质序列分析中的应用[J]. 基础医学与临床, 2003(2): 126-131. DOI:10.3969/j.issn.1001-6325.2003.02.003.
[23] 郑淋. 抗氧化肽的构效关系及定向制备的研究[D]. 广州: 华南理工大学, 2015: 134.
[24] AVRAHAM K B, SCHICKLER M, SAPOZNIKOV D, et al. Down’s syndrome: abnormal neuromuscular junction in tongue of transgenic mice with elevated levels of human Cu/Zn-superoxide dismutase[J].Cell, 1988, 54(6): 823-829. DOI:10.1016/S0092-8674(88)91153-1.
[25] WIJERATNE S S, CUPPETT S L, SCHLEGEL V. Hydrogen peroxide induced oxidative stress damage and antioxidant enzyme response in Caco-2 human colon cells[J]. Journal of Agricultural and Food Chemistry, 2005, 53(22): 8768-8774. DOI:10.1021/jf0512003.
[26] ALÍA M, RAMOS S, MATEOS R, et al. Response of the antioxidant defense system to tert-butyl hydroperoxide and hydrogen peroxide in a human hepatoma cell line (HepG2)[J]. Journal of Biochemical and Molecular Toxicology, 2005, 19(2): 119-128. DOI:10.1002/jbt.20061.
[27] LEBEL C P, ISCHIROPOULOS H, BONDY S C. Evaluation of the probe 2’,7’-dichlorofluorescin as an indicator of reactive oxygen species formation and oxidative stress[J]. Chemical Research in Toxicology, 1992, 5(2): 227-231. DOI:10.1021/tx00026a012.
[28] PILZ J, MEINEKE I, GLEITER C H. Measurement of free and bound malondialdehyde in plasma by high-performance liquid chromatography as the 2,4-dinitrophenylhydrazine derivative[J].Journal of Chromatography B Biomedical Sciences & Applications,2000, 742(2): 315-325. DOI:10.1016/S0378-4347(00)00174-2.
[29] SUTTNAR J, CERMÁK J, DYR J E. Solid-phase extraction in malondialdehyde analysis[J]. Analytical Biochemistry, 1997, 249(1):20-23. DOI:10.1006/abio.1997.2157.
[30] 叶寅. L-茶氨酸通过增强肝脏细胞中抗氧化物质活性抑制酒精性肝损伤的研究[D]. 南京: 南京大学, 2011: 38-39.
[31] KIM G N, KWON Y I, JANG H D. Protective mechanism of quercetin and rutin on 2,2’-azobis(2-amidinopropane) dihydrochloride or Cu2+-induced oxidative stress in HepG2 cells[J]. Toxicology in Vitro,2011, 25(1): 138-144. DOI:10.1016/j.tiv.2010.10.005.
[32] DU Yichen, ESFANDI R, WILLMORE W G, et al. Antioxidant activity of oat proteins derived peptides in stressed hepatic HepG2 cells[J]. Antioxidants (Basel, Switzerland), 2016, 5(4): 1-9.DOI:10.3390/antiox5040039.
[33] WANG Liying, DING Long, YU Zhipeng, et al. Intracellular ROS scavenging and antioxidant enzyme regulating capacities of corn gluten meal-derived antioxidant peptides in HepG2 cells[J]. Food Research International, 2016, 90: 33-41. DOI:10.1016/j.foodres.2016.10.023.
[34] CHEN Huaming, MURAMOTO K, YAMAUCHI F. Structural analysis of antioxidative peptides from soybean β-conglycinin[J]. Journal of Agricultural and Food Chemistry, 1995, 43(3): 574-578. DOI:10.1021/jf00051a004.
[35] ESCUDERO E, MORA L, FRASER P D, et al. Identification of novel antioxidant peptides generated in Spanish dry-cured ham[J].Food Chemistry, 2013, 138(2/3): 1282-1288. DOI:10.1016/j.foodchem.2012.10.133.
[36] STAMPLER J, BELLEI M, SOUDI M, et al. Manipulating the proximal triad His-Asn-Arg in human myeloperoxidase[J]. Archives of Biochemistry and Biophysics, 2011, 516(1): 21-28. DOI:10.1016/j.abb.2011.09.007.
[37] 何颖洁. 酪氨酸和组氨酸对血红素过氧化物酶活性的影响[D].南昌: 江西师范大学, 2014: 31-35.
Identification of a Tripeptide Arg-Asn-His from Chinese Baijiu and Its Antioxidant Activity