表1 低温乳化香肠的基本配方
Table1 Formulation of low-temperature emulsified sausages
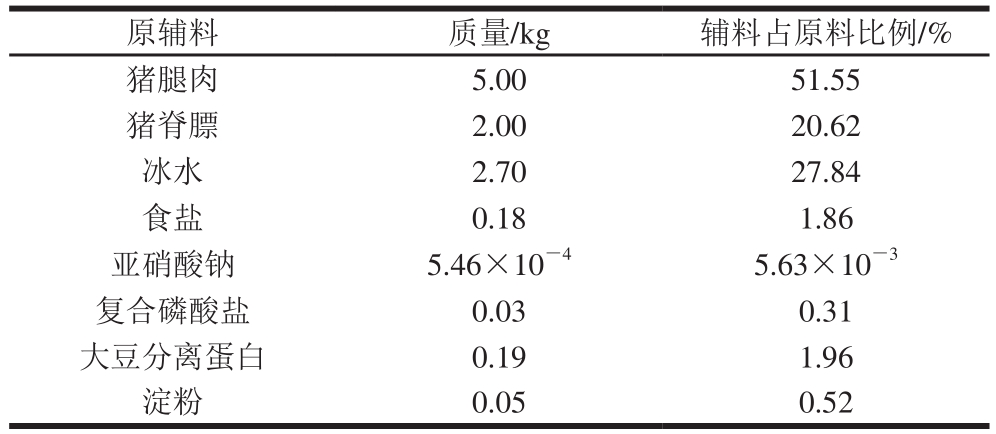
原辅料 质量/kg 辅料占原料比例/%猪腿肉 5.00 51.55猪脊膘 2.00 20.62冰水 2.70 27.84食盐 0.18 1.86亚硝酸钠 5.46×10-45.63×10-3复合磷酸盐 0.03 0.31大豆分离蛋白 0.19 1.96淀粉 0.05 0.52
食源性致病菌的交叉污染是指制作表面污染致病菌的食品时操作不当污染到其他食品。按照传统的烹饪习惯,正常的加工条件(加热一定时间)可保证食品商业无菌[1],但部分食品在加工、运输和销售过程中,易被食源性致病菌污染[2]。
近年来,食源性致病菌污染引起的食品安全事故频发,其中采用风险评估手段评估食品风险是世界公认的方法之一[3]。根据世界卫生组织(World Health Organization,WHO)2014年调查表明,2013—2014年期间,交叉污染是导致食源性疾病暴发的首要原因[4]。2013—2015年期间,国家卫生和计划生育委员会对我国食物中毒事件的监测结果表明,交叉污染是导致微生物性食物中毒人数最多的主要原因之一[5]。因此,为降低食源性疾病的暴发水平,整合交叉污染的风险评估工作迫在眉睫。
低温乳化香肠是以畜禽肉为主要原料,加入适当辅料经斩拌、灌装、蒸煮和巴氏杀菌等加工工艺,中心温度达到75~85 ℃并保持一定时间而制成的产品。其中,斩拌和灌装过程的交叉污染现象尤为严重[6]。同时,低温乳化香肠中污染主要来源于原料肉和食品介质表面的间接接触所造成的单增李斯特菌交叉污染[2]。
单增李斯特菌是人畜共患的食源性致病菌之一,可引起脑组织和血液感染。单增李斯特菌广泛存在于环境中,如养殖场周围的水源和土壤中,通过食物链导致畜禽感染,从而导致原料肉污染[7]。另外,在低温乳化香肠的加工、运输和贮藏过程中也可造成单增李斯特菌的污染[8]。根据WHO 2006年调查表明,单增李斯特菌污染低温乳化香肠的概率高达10%以上[9],较易引起相关的食源性疾病。因此,对低温乳化香肠进行单增李斯特菌的定量风险评估刻不容缓。
风险评估的核心内容是暴露评估,微生物定量暴露评估是对通过食物摄入或其他相关途径暴露于人体或环境中的食源性致病菌的定量评估[10]。基于定量暴露评估的结果,结合剂量效应模型(dose-response,DRM)可对人群发病率进行描述。目前已有部分香肠中食源性致病菌的风险评估研究,Gonzales-Barron等[11]对鲜肉香肠中鼠伤寒沙门氏菌进行定量风险评估研究,结果表明,低温贮藏过程中,10万 包香肠中约有83 包中沙门氏菌浓度高于103CFU/g,存在食用风险。相似的研究见于Syne[12]及Al-Nabulsi[13]等的研究中。因缺乏监测和单增李斯特菌的统计数据,目前香肠中单增李斯特菌的风险评估研究多为定性或半定量的风险评估。国家食品安全风险评估中心曾于2014—2015年开展了即食食品(包括香肠)中单增李斯特菌初步的定量风险评估(结果未公开)[14]。有研究表明,香肠加工过程中,绞肉和斩拌后,单增李斯特菌的检出率分别为24.2%及20.8%[15]。以上研究仅包括了部分加工过程,且未涉及加工过程的单增李斯特菌交叉污染,因此,整合交叉污染的香肠加工过程中单增李斯特菌的定量风险评估急待明确。
本实验模拟香肠斩拌和灌装过程中的常见场景,测定单增李斯特菌在肉样、斩拌机和灌肠机之间的转移率,进而基于斩拌和灌装过程的交叉污染结果构建香肠加工过程中单增李斯特菌的暴露评估模型,并从方法论的角度,应用指数模型、Beta-Poisson模型、Weibull-Gamma模型和Log-Logistic模型等常见剂量效应模型拟合和比较健康人群和易感人群食用污染香肠后的发病率大小,选择最优的剂量效应模型,为香肠加工过程单增李斯特菌完整的风险评估研究提供参考。
瘦肉选用去骨去皮的精腿肉,肥肉选用猪脊膘,辅料选用食盐、亚硝酸钠、复合磷酸盐、大豆分离蛋白和淀粉,具体配方[16]见表1。以上材料均购于上海卜蜂莲花超市。
表1 低温乳化香肠的基本配方
Table1 Formulation of low-temperature emulsified sausages

原辅料 质量/kg 辅料占原料比例/%猪腿肉 5.00 51.55猪脊膘 2.00 20.62冰水 2.70 27.84食盐 0.18 1.86亚硝酸钠 5.46×10-45.63×10-3复合磷酸盐 0.03 0.31大豆分离蛋白 0.19 1.96淀粉 0.05 0.52
胰酪胨大豆酵母浸膏肉汤(trypticase soy-yeast extract broth,TSB-YE)培养基、胰酪胨大豆酵母浸膏琼脂(trypticase soy-yeast extract agar,TSA-YE)培养基、单增李斯特菌选择性培养基(Palcam琼脂培养基)青岛海博生物技术有限公司。
HLQ-8型斩拌机 安徽华菱西厨装备股份有限公司;MLG-7型灌肠机 山东麦苗厨具有限公司;YP405N型电子天平 上海精密仪器仪表有限公司;YXQ-LS-75SII型立式压力蒸汽灭菌器 上海博迅实业有限公司;BCM-239D型无菌操作台 江苏苏州安泰空气技术有限公司;Scientz-09型无菌均质器 浙江宁波新芝生物科技股份有限公司。
1.3.1 菌株选用和菌悬液制备
单增李斯特菌(Listeria monocytogenes ATCC 13932血清型4b)保存于(4.0±0.5)℃的TSA-YE培养基上备用。用无菌接种环从TSA-YE培养基上挑取一环菌苔,接种于100 mL的TSB-YE培养基中,放置于37 ℃、180 r/min的摇床上培养(16±1)h至菌体浓度达到稳定期(109CFU/mL),制得初始菌悬液。用无菌生理盐水(质量分数0.85% NaCl溶液)稀释初始菌悬液,得到108CFU/mL的菌悬液。
1.3.2 介质接种与场景设计
模拟香肠加工过程,分别将250 g瘦肉和100 g肥肉切至约25 g/块肉样,肉样置于80 ℃热水中灭菌20 s。于无菌操作台内将肉样用无菌镊子夹入无菌均质袋中,并加入食盐,置于(4.0±0.5)℃冰箱中腌制24 h。
腌制后肉样置于洁净器皿表面,移液枪分别移取1 mL上述菌悬液(108CFU/mL)于每块肉样表面,无菌钳翻动肉样数次,静置15 min。将静置后的肉样置于斩拌机内,并加入辅料斩拌6 min。
斩拌后肉糜置于灌肠机内进行灌装,制得半成品,每组实验重复5 次。肉糜和半成品的带菌量根据GB 4789.2—2010《食品安全国家标准 食品微生物学检验 菌落总数测定》[17]进行定量测定,使用擦拭取样法测定斩拌机的斩刀和斩锅表面以及灌肠机的料桶和料斗表面的单增李斯特菌。
1.3.3 转移率测定
转移率(transfer rate,TR)是一个细菌从供体表面通过相互接触转移到受体表面的概率[18],计算公式如下。
式中:Nd为细菌供体表面带菌量(lg(CFU/g));Nr为细菌受体表面带菌量(lg(CFU/g))。
应用Microsoft Excel 2010进行数据统计,基于蒙特卡洛模拟和卡方分析,用@Risk5.5软件拟合转移率和肉样中单增李斯特菌菌量的最优分布。
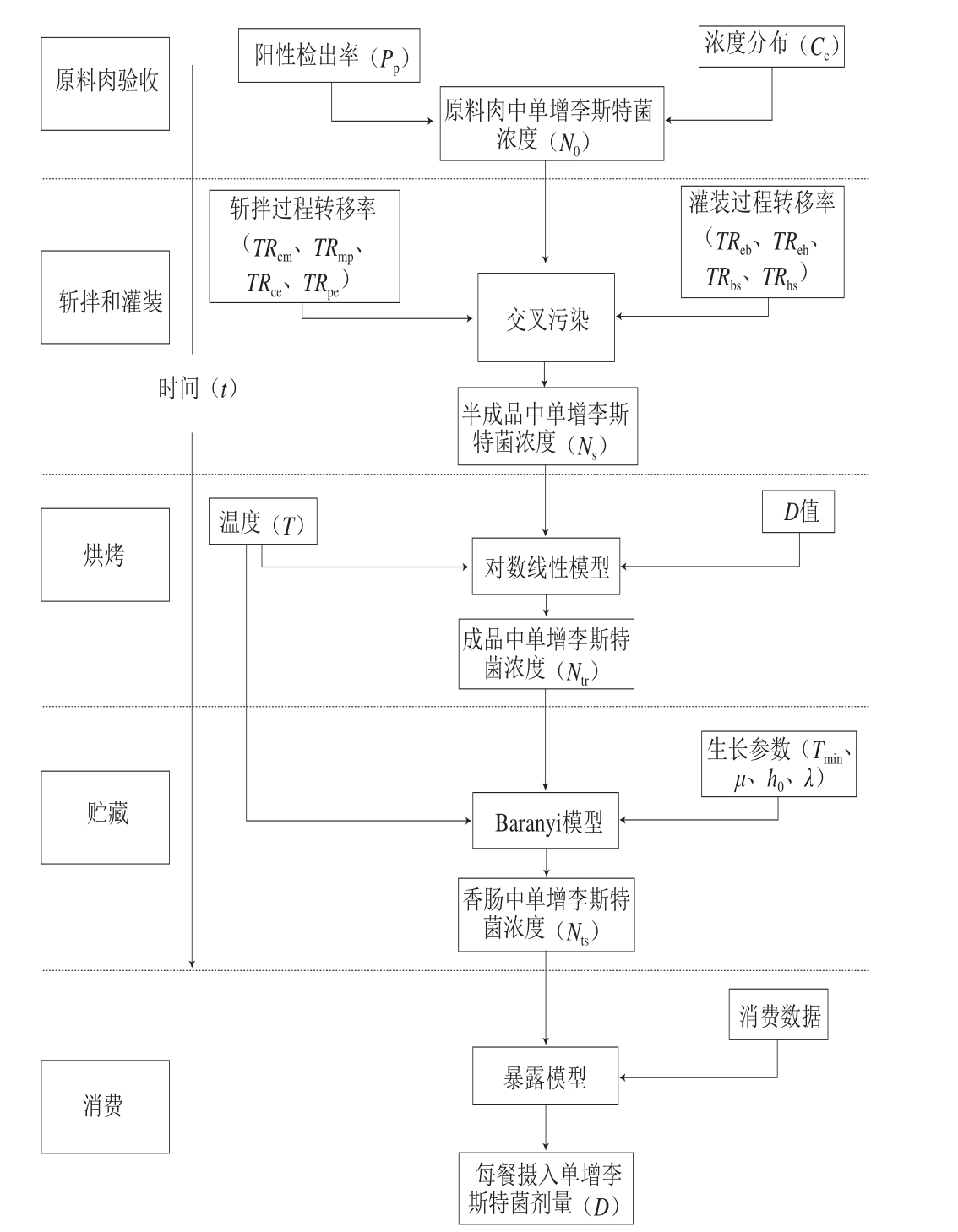
图1 低温乳化香肠加工过程的暴露评估模型
Fig.1 Exposure assessment model for low-temperature emulsified sausage processing
表2 低温乳化香肠加工过程的暴露评估模型参数设置
Table2 Parameter settings of exposure assessment model for chilledemulsified sausage processing

nnp污染概率(1a) PcDiscrete(1,0,0.47,0.53) Meloni等[19]浓度分布(1b) CcLognormal(3.2,1.4) D’OSTUNI等[20]生鲜肉中浓度 N0lg(CFU/g) N0=Pc×CcLopez等[21]斩拌过程斩刀表面浓度 Nclg(CFU/g) Uniform(1.98,2.96)斩锅表面浓度 Nplg(CFU/g) BetaGeneral(0.75,0.67,1.92,2.91)猪肉至斩刀 TRmcBetaGeneral(0.34,0.31,0.47,0.50)猪肉至斩锅 TRmpBetaGeneral(0.34,0.36,0.37,0.41)斩刀至乳化肉 TRceBetaGeneral(0.41,0.42,0.65,0.95)斩锅至乳化肉 TRpeBetaGeneral(0.44,0.46,0.64,0.89)乳化肉中浓度 Nelg(CFU/g) Ne=binomial(N0,1-TRmc-TRmp)+binomial(Nc,TRce)+binomial(Np,TRpe)灌装过程料桶表面浓度 Nblg(CFU/g) Normal(3.14,0.15)@Risk最佳分布拟合
续表2

?
单增李斯特菌从原料肉至香肠成品整个加工阶段的暴露评估模型如图1所示。暴露评估模型参数设置见表2,污染数据的阳性率一般符合Beta(α1,α2)分布,形状参数α1和α2对应的公式一般为:α1=S+1,α2=n-S+1,其中n是取样数,S是阳性检出数。应用@Risk5.5软件分别得到Pp和Pn,进而用离散型分布Discrete(1,0,Pp,Pn)描述Pc。Discrete(1,0,Pp,Pn)中,假定参数1是生鲜肉中污染单增李斯特菌的情况,对应Pp;参数0是生鲜肉中未污染单增李斯特菌的情况,对应Pn。
应用@Risk5.5软件分别对斩拌和灌装过程中实验数据进行处理,拟合出转移率和各介质表面单增李斯特菌浓度的最优分布。
烘烤过程中,参照文献[21-23],应用@Risk5.5软件得出烘烤温度和烘烤时间的分布。香肠中单增李斯特菌的一级失活模型采用线性模型,进而用Origin 9.0软件拟合出烘烤过程的二级失活模型。贮藏过程中,参照ComBase数据库和文献[25],用@Risk5.5软件得出贮藏温度和贮藏时间的分布。香肠中单增李斯特菌的一级生长模型采用Baranyi模型。考虑贮藏温度对香肠中单增李斯特菌生长的影响,采用Gamma分布进行描述。
消费过程中,发病风险区分2 类人群,分别为健康人群和易感人群,健康人群包括成年人,易感人群包括婴幼儿、老年人和孕妇。基于蒙特卡洛抽样方法,发病风险采用指数、Beta-Poisson、Weibull-Gamma和Log-Logistic 4 种剂量效应模型[34]对健康人群和易感人群的发病率进行描述,进而用@Risk5.5软件对发病率进行最佳分布拟合,并根据卡方检验结果选择最适分布。
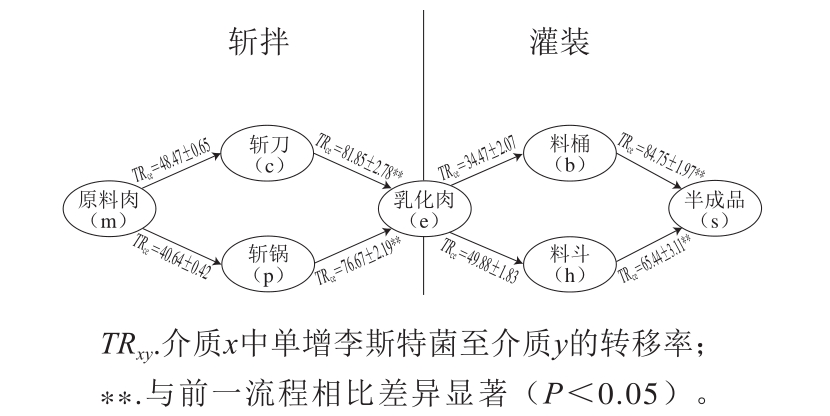
图2 斩拌和灌装过程中单增李斯特菌在不同介质表面间的转移率
Fig.2 Transfer rates of L. monocytogenes between different contact surfaces during chopping and stuffing
如图2所示,斩拌场景中,TRmc和TRce有显著性差异(P<0.05),同时,TRmp和TRpe有显著性差异(P<0.05)。灌装场景中,TReb和TRbs有显著性差异(P<0.05),同时,TReh和TRhs有显著性差异(P<0.05)。综上,斩拌和灌装两种场景下,单增李斯特菌由设备至肉样的转移量显著低于由肉样至设备的转移量(数据未列出),肉样至设备的转移率和设备至肉样的转移率均有显著性差异,单增李斯特菌由设备至肉样的转移率显著高于由肉样至设备的转移率。
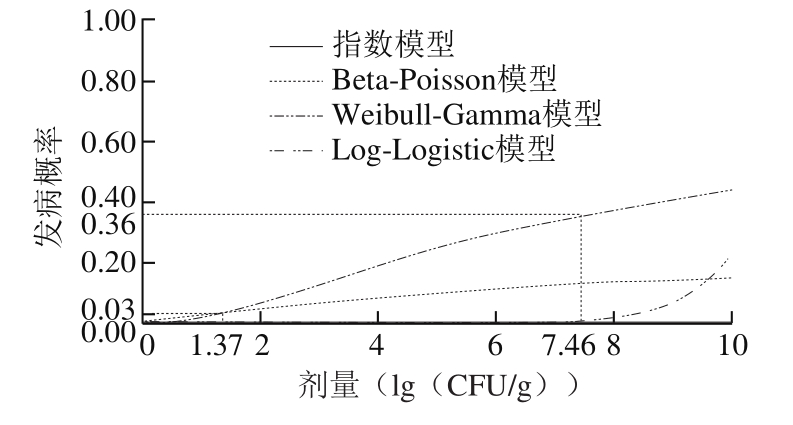
图3 健康人群食用污染香肠的发病率
Fig.3 Morbidity of healthy populations after consumption of contaminated sausages
根据香肠加工过程中暴露评估模型参数设置(表2),应用不同剂量效应模型拟合消费者食用污染香肠的发病率,采用@Risk5.5软件分别进行10 000 次蒙特卡洛模拟,结果如图3、4所示。图3展现了健康人群因食用污染单增李斯特菌的香肠而导致发病的概率。健康人群对病原微生物的入侵具有一定抵抗力,因此相对于易感人群,低剂量下(0~3(lg(CFU/g))健康人群的发病率较低。由图3可知,以Weibull-Gamma模型为例,当不考虑斩拌和灌装过程的交叉污染情况时,健康人群的摄入剂量为1.37(lg(CFU/g)),对应的发病率为3%;但考虑斩拌和灌装过程的交叉污染时,健康人群的摄入剂量为7.46(lg(CFU/g)),对应的发病率为36%,说明考虑交叉污染对健康人群食用污染香肠的风险描述有显著影响。以健康人群每餐摄入剂量为6(lg(CFU/g))时为例,Weibull-Gamma模型预测的发病率(30%)显著高于指数模型(0)、Beta-Poisson模型(10%)和Log-Logistic模型(0)的预测结果。基于风险评估研究一般从高估风险的角度,对比其他3 类模型,采用Weibull-Gamma模型预测健康人群食用污染香肠的发病率结果最大,风险最高,拟合效果最好,因此建议选择Weibull-Gamma模型进行健康人群发病率预测。
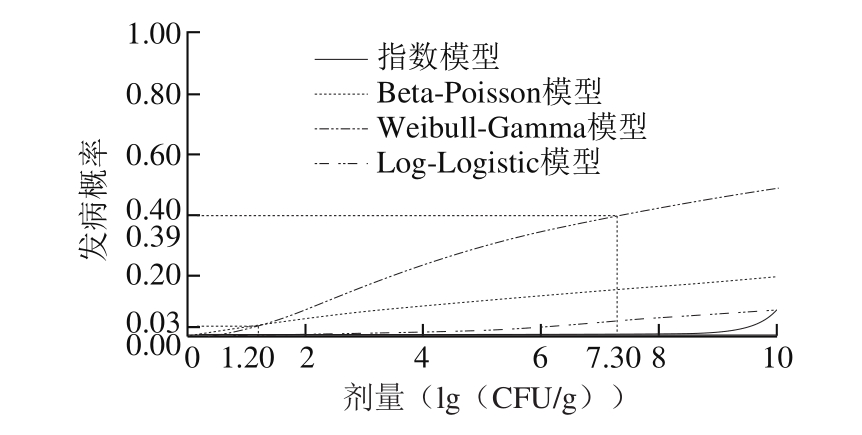
图4 易感人群食用污染香肠的发病率
Fig.4 Morbidity of susceptible populations after consumption of contaminated sausages
图4 反映了易感人群因食用污染单增李斯特菌的香肠而导致发病的概率。对比图3中健康人群发病率结果,4 类模型预测易感人群发病率结果均有显著提高。由图4可知,以Weibull-Gamma模型为例,当不考虑斩拌和灌装过程的交叉污染情况时,易感人群的摄入剂量为1.20(lg(CFU/g)),对应的发病率为3%;但考虑斩拌和灌装过程的交叉污染时,易感人群的摄入剂量为7.30(lg(CFU/g)),对应的发病率为39%,说明考虑交叉污染对易感人群食用污染香肠的风险描述有显著影响。以易感人群每餐摄入剂量为6(lg(CFU/g))时为例,对比其他3 类模型,Weibull-Gamma模型预测发病率的结果(35%)显著高于指数模型(0)、Beta-Poisson模型(14%)和Log-Logistic模型(4%)的预测结果,因此建议选择Weibull-Gamma模型进行易感人群发病率预测。
应用Weibull-Gamma模型预测健康人群和易感人群食用污染香肠后发病率的概率分布拟合如图5、6所示,经最佳分布拟合,Logistic(0.42,0.08)和Logistic(0.46,0.08)可分别对健康人群和易感人群的发病率进行较好描述。健康人群食用污染香肠后的发病率从8%(5%置信水平)至59%(95%置信水平),易感人群食用污染香肠后的发病率从10%(5%置信水平)至62%(95%置信水平)。

图5 健康人群食用污染香肠发病率的概率分布拟合
Fig.5 Probability distribution fitting of morbidity of healthy populations after consumption of contaminated sausages
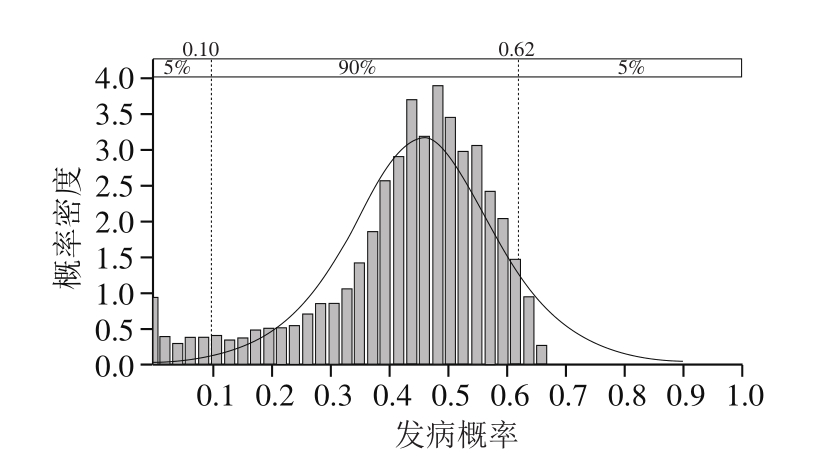
图6 易感人群食用污染香肠发病率的概率分布拟合
Fig.6 Probability distribution fitting of morbidity of susceptible populations after consumption of contaminated sausages
影响致病菌转移的因素可划分为两类:环境因素和内在因素。环境因素主要涉及材料表面的物理特征,包括湿度、压力、粗糙度和接触时间等;内在因素主要涉及菌种,包括胞外多糖的生产能力、菌膜形成能力和有无细胞外基质结构等[36-38]。
介质表面粗糙度和湿度是影响本实验转移率结果的主要原因。本研究表明,单增李斯特菌由设备至肉样的转移率显著高于由肉样至设备的转移率,光滑的设备表面更易促进单增李斯特菌的转移。Ravishankar等[39]研究切割生菜过程中沙门氏菌的转移情况,结果表明,对比沙门氏菌从生菜至无菌刀片的转移情况,沙门氏菌从刀片至无菌生菜的转移率更高。因此,介质表面粗糙度会影响致病菌的转移,相似的研究见于Lundén[40]和Midelet[41]等的研究中。另外,表面湿度亦会影响致病菌的转移[42],微生物易吸附于潮湿的介质表面,因此含有较高水分的肉样更适应于单增李斯特菌的吸附,从而限制单增李斯特菌向设备的转移能力。综上,介质表面的粗糙度和湿度会影响致病菌的转移能力。
风险评估由4 部分内容组成:危害识别、危害特征描述、暴露评估和风险特征描述[43]。本实验侧重描述低温乳化香肠加工过程的暴露评估和风险特征描述。本研究表明,对比未考虑交叉污染的人群发病率结果,整合交叉污染的人群发病率结果明显提高。日常加工操作中,设备清洗不当或操作人员卫生不合格均会造成致病菌的交叉污染。已有大量研究表明香肠加工过程中,斩拌、灌装和包装等过程均有致病菌交叉污染现象,且斩拌和灌装过程的交叉污染尤为严重[6]。有研究显示香肠加工过程中,沙门氏菌在不同介质间转移率显著,但这些研究主要侧重于香肠加工过程中某一环节沙门氏菌的交叉污染情况[44-46]。而单增李斯特菌广泛存在于香肠加工环境中,且可在香肠贮藏环境中生长。关于香肠加工过程中单增李斯特菌交叉污染的研究可为香肠加工过程中完整的风险评估研究提供借鉴。
剂量效应模型主要包括单参数模型、双参数模型和三参数模型。指数模型是单参数剂量效应模型,拟合过程较易但一般不能充分拟合剂量效应数据;Beta-Poisson模型是迄今已刊研究中模拟剂量效应关系最久的双参数剂量效应模型[47],已广泛应用于微生物定量风险评估研究中,但Marks等[48]质疑了Beta-Poisson模型的充分性;Log-Logistic模型是双参数剂量效应模型,对低剂量下的效应关系具有良好的拟合性[49];据有限文献调研表明,Weibull-Gamma模型是文献中记载最多的三参数剂量效应模型[50],当三参数中某参数为1时,Weibull-Gamma模型可以转化为Beta-Poisson模型或Log-Logistic模型,对比双参数剂量效应模型,三参数剂量效应模型的拟合效果更优,但拟合过程一般很难获得三参数剂量效应模型所需不少于4 个剂量水平的数据。
本研究中对比指数模型、Beta-Poisson模型和Log-Logistic模型的拟合结果,Weibull-Gamma模型预测消费者食用污染香肠的发病率结果最大,风险最高,拟合效果最好,基于风险评估研究一般从高估风险的角度,因此建议选用Weibull-Gamma模型作为低温乳化香肠中单增李斯特菌的最优剂量效应模型。Moon等[51]基于志愿者暴露于致病菌下感染和患病的数据,对比和评估了4 种双参数剂量效应模型和4 种三参数剂量效应模型的拟合效果,结果表明,Weibull-Gamma模型对观测数据的拟合效果最优。董庆利等[52]基于2001—2011年我国米饭中蜡样芽孢杆菌导致食物中毒的数据,构建了米饭中蜡样芽孢杆菌的剂量效应模型,数学检验结果表明,Weibull-Gamma模型的拟合效果明显优于其他模型。关于香肠中单增李斯特菌剂量效应模型的选用可为控制香肠加工过程中单增李斯特菌的交叉污染提供借鉴。
本实验研究了低温乳化香肠加工过程中斩拌和灌装过程单增李斯特菌的交叉污染情况。结果表明:单增李斯特菌由设备至肉样的转移率显著高于由肉样至设备的转移率。构建了低温乳化香肠加工过程中的暴露评估模型,比较了4 种剂量效应模型下健康人群和易感人群的发病率,建议选择Weibull-Gamma模型进行消费者食用污染香肠的发病率预测。同时研究了交叉污染对低温乳化香肠加工过程中风险评估的影响,结果表明:整合交叉污染的风险评估研究结果中消费者的发病率显著提高。
[1] 董庆利, 陆冉冉, 汪雯, 等. 案板材质对单增李斯特菌在生熟食品间交叉污染的影响[J]. 农业机械学报, 2016, 47(3): 207-213.DOI:10.6041/j.issn.1000-1298.2016.03.029.
[2] 姜红如, 李凤琴, 于红霞. 食品加工过程中交叉污染与微生物定量风险评估[J]. 卫生研究, 2013, 42(5): 875-879.
[3] 董庆利, 王海梅, PRADEEP K M, 等. 我国食品微生物定量风险评估的研究进展[J]. 食品科学, 2015, 36(11): 221-229. DOI:10.7506/spkx1002-6630-201511042.
[4] TIWARI U, CUMMINS E, VALERO A, et al. Farm to fork quantitative risk assessment of Listeria monocytogenes contamination in raw and pasteurized milk cheese in Ireland[J]. Risk Analysis, 2015,35(6): 1140-1153. DOI:10.1111/risa.12332.
[5] 国家卫生计生委办公厅关于2015年第全国食物中毒事件情况的通报[EB/OL]. (2016-04-01)[2017-06-22]. http://www.nhfpc.gov.cn/yjb/s7859/201604/8d34e4c442c54d33909319954c43311c.shtml.
[6] 江荣花, 汪雯, 蔡铮, 等. 肉制品加工过程中食源性致病菌交叉污染及风险评估的研究进展[J]. 食品科学, 2018, 39(7): 305-311.DOI:10.7506/spkx1002-6630-201807045.
[7] 陈道利, 陶勇, 霍开兰. 直接入口食品中单核细胞增生李斯特氏菌的污染调查及检验方法的比较[J]. 中国卫生检验杂志, 2003, 3(4):492-493.
[8] 鄂晓雪, 柳建华, 王融, 等. 真空预冷处理提高草葛与蟠桃的冷藏品质[J]. 上海理工大学学报, 2014, 36(1): 75-80.
[9] 林海, 李晓华, 朱衍馨, 等. 防治食品李斯特菌污染的方法及措施[J].东南国防医药, 2011, 3(6): 569-570.
[10] WHO. Proposed draft principles and guidelines for the conduct of microbiological risk management (MRM) (at step 3 of the procedure)[EB/OL]. (2003-1-27)[2017-06-22]. http://www.doc88.com/p-9843375553511.html.
[11] GONZALES-BARRON U, REDMOND G, BUTLER F, et al. A consumer-phase exposure assessment of Salmonella typhimurium from Irish fresh pork sausages: I. transport and refrigeration modules[J]. Food Control, 2010, 21(12): 1683-1692. DOI:10.1016/j.foodcont.2010.04.020.
[12] SYNE S M, RAMSUBHAG A, ADESIYUN A A, et al.Microbiological hazard analysis of ready-to-eat meats processed at a food plant in Trinidad, West Indies[J]. Infection Ecology and Epidemiology, 2013, 3(1): 54-55. DOI:10.3402/iee.v3i0.20450.
[13] AL-NABULSI A A, OSAILI T M, AWAD A A, et al. Occurrence and antibiotic susceptibility of Listeria monocytogenes isolated from raw and processed meat products in Amman, Jordan[J]. Journal of Food Science, 2015, 13(3): 346-352. DOI:10.1080/19476337.2014.982191.
[14] 国家食品安全风险评估中心. 熟肉制品中单增李斯特菌初步定量风险评估[R]. 北京: CFSA, 2015.
[15] DROSINOS E H, MATARAGAS, M, VESKOVIC-MORACANIN S,et al. Quantifying nonthermal inactivation of Listeria monocytogenes in European fermented sausages using bacteriocinogenic lactic acid bacteria or their bacteriocins: a case study for risk assessment[J].Journal of Food Protection, 2006, 69(11): 2648-2663.
[16] YETIM H, MULLER W D, EBER M, et al. Using fluid whey in comminuted meat products: effects on technological, chemical and sensory properties of frankfurter-type sausages[J]. Food Research International, 2001, 34(2): 97-101. DOI:10.1016/S0963-9969(00)00135-6.
[17] 卫生部. 食品安全国家标准 食品微生物学检验 菌落总数测定:GB 4789.2—2010[S]. 北京: 中国标准出版社, 2010.
[18] MONTVILLE R, CHEN Y H, SCHAFFNER D W, et al. Glove barriers to bacterial cross-contamination between hands to food[J].Journal of Food Protection, 2001, 64(6): 845-849.
[19] MELONI D. Presence of Listeria monocytogenes in Mediterraneanstyle dry fermented sausages[J]. Foods, 2015, 4(1): 34-50.DOI:10.3390/foods4010034.
[20] D’OSTUNI V, TRISTEZZA M, DE GIORGI M G, et al. Occurrence of Listeria monocytogenes and Salmonella spp. in meat processed products from industrial plants in Southern Italy[J]. Food Control,2016, 62: 104-109. DOI:10.1016/j.foodcont.2015.10.025.
[21] LOPEZ G U, KITAJIMA M, SHERCHAN S P, et al. Impact of disinfectant wipes on the risk of Campylobacter jejuni infection during raw chicken preparation in domestic kitchens[J]. Journal of Applied Microbiology, 2015, 119(1): 245-252. DOI:10.1111/jam.12834.
[22] MATARAGAS M, BELLIOC A, ROVETTOA F, et al. Riskbased control of food-borne pathogens Listeria monocytogenes and Salmonella enterica in the Italian fermented sausages Cacciatore and Felino[J]. Meat Science, 2015, 12(2): 39-45. DOI:10.1016/j.meatsci.2015.01.002.
[23] MØLLER C O A, NAUTA M J, SCHAFFNER D W, et al. Risk assessment of Salmonella in Danish meatballs produced in the catering sector[J]. International Journal of Food Microbiology, 2015, 196(1):109-125. DOI:10.1016/j.ijfoodmicro.2014.10.010.
[24] HAJMEER M N, TAJKARIMI M, GOMEZ E L, et al. Thermal death of bacterial pathogens in linguiça smoking[J]. Food Control, 2011,22(5): 668-672. DOI:10.1016/j.foodcont.2010.07.027.
[25] LUO Ke, HONG S S, OH D H, et al. Modeling the effect of storage temperatures on the growth of Listeria monocytogenes on ready-to-eat ham and sausage[J]. Journal of Food Protection, 2015, 78(9): 1675-1681. DOI:10.4315/0362-028X.JFP-15-053.
[26] GKOGKA E, REIJ M W, GORRIS L G, et al. Risk assessment strategies as a tool in the application of the Appropriate Level of Protection (ALOP) and Food Safety Objective (FSO) by risk managers[J]. International Journal of Food Microbiology, 2013,167(1): 8-28. DOI:10.1016/j.ijfoodmicro.2013.04.013.
[27] BUCHANAN R L, DAMERT W G, WHITING R C, et al. Use of epidemiologic and food survey data to estimate a purposefully conservative dose-response relationship for Listeria monocytogenes levels and incidence of listeriosis[J]. Journal of Food Protection, 1997,60(8): 918-922.
[28] World Health Organization. Risk assessment of Listeria monocytogenes in ready-to-eat foods. microbiolgical risk assessment series 4[EB/OL]. (2004-01-01)[2017-06-22]. http://www.who.int/foodsafety/publications/mra4-risk-listeria/en/.
[29] BARTRAND T A, WEIR M H, HAAS C N, et al. Dose-response models for inhalation of Bacillus anthracis spores: interspecies comparisons[J]. Risk Analysis, 2008, 28(4): 1115-1124. DOI:10.1111/j.1539-6924.2008.01067.x.
[30] POUILLOT R, HOELZER K, CHEN Y H, et al. Listeria monocytogenes dose response revisited: incorporating adjustments for variability in strain virulence and host susceptibility[J]. Risk Analysis,2015, 35(1): 90-108. DOI:10.1111/risa.12235.
[31] LINDQVIST R, WESTOO A. Quantitative risk assessment for Listeria monocytogenes in smoked or gravad salmon and rainbow trout in Sweden[J]. International Journal of Food Microbiology, 2000, 58(3):181-196. DOI:10.1016/S0168-1605(00)00272-5.
[32] FARBER J M, DALEY E, COATES F, et al. Feeding trials of Listeria monocytogenes with a nonhuman primate model[J]. Journal of Clinical Microbiology, 1991, 29(11): 2606-2608.
[33] WILLIAMS D, CASTLEMAN J, LEE C C, et al. Risk of fetal mortality after exposure to Listeria monocytogenes based on dose-response data from pregnant guinea pigs and primates[J].Risk Analysis, 2009, 29(11): 1495-1505. DOI:10.1111/j.1539-6924.2009.01308.x.
[34] SMITH M A, TAKEUCHI K, ANDERSON G, et al. Dose-response model for Listeria monocytogenes induced stillbirths in nonhuman primates[J]. Infection and Immunity, 2008, 76(2): 726-731.DOI:10.1128/IAI.01366-06.
[35] WILLIAMS M S, EBEL E D, VOSE D, et al. Methodology for determining the appropriateness of a linear dose-response function[J].Risk Analysis, 2011, 31(3): 345-350. DOI:10.1111/j.1539-6924.2010.01518.x.
[36] VORST K L, TODD E C, RYSER E T, et al. Transfer of Listeria monocytogenes during mechanical slicing of turkey breast, bologna,salami[J]. Journal of Food Protection, 2006, 69(1): 619-626.
[37] MOORE C M, SHELDON B W, JAYKUS L A, et al. Transfer of Salmonella and Campylobacter from stainless steel to romaine lettuce[J]. Journal of Food Protection, 2003, 66(1): 2231-2236.
[38] KNOBBEN B A S, VAN DER MEI H C, VAN HORN J R, et al.Transfer of bacteria between biomaterials surfaces in the operating room: an experimental study[J]. Journal of Biomedical Materials Research A, 2007, 80(2): 790-799. DOI:10.1002/jbm.a.30978.
[39] RAVISHANKAR S, ZHU L, JARONI D, et al. Assessing the cross contamination and transfer rates of Salmonella enterica from chicken to lettuce under different food-handling scenarios[J]. Food Microbiology, 2010, 27(1): 791-794. DOI:10.1016/j.fm.2010.04.011.
[40] LUNDÉN J M, AUTIO T J, KORKEALA H J, et al. Transfer of persistent Listeria monocytogenes contamination between foodprocessing plants associated with a dicing machine[J]. Journal of Food Protection, 2002, 65(2): 1129-1133.
[41] MIDELET G, CARPENTIER B. Transfer of microorganisms,including Listeria monocytogenes, from various materials to beef[J].Applied Environmental Microbiology, 2002, 68(1): 4015-4024.DOI:10.1128/AEM.68.8.4015-4024.2002.
[42] WANG H, RYSER E T. Quantitative transfer of Salmonella typhimurium LT2 during mechanical slicing of tomatoes as impacted by multiple processing variables[J]. International Journal of Food Microbiology, 2016, 234(3): 76-82. DOI:10.1016/j.ijfoodmicro.2016.06.035.
[43] WHO. Principles and guidelines for the conduct of microbiological risk assessment[EB/OL]. (1999-01-01)[2017-06-22]. http://img.21food.cn/img/biaozhun/20100108/180/11285305.pdf.
[44] NAUTA M J. Microbiological risk assessment models for partitioning and mixing during food handling[J]. International Journal of Food Microbiology, 2005, 100(3): 311-322. DOI:10.1016/j.ijfoodmicro.2004.10.027.
[45] MØLLER C O A, NAUTA M J, CHRISTENSEN B B, et al. Modelling transfer of Salmonella typhimurium DT104 during simulation of grinding of pork[J]. Journal of Applied Microbiology, 2012, 112(1):90-98. DOI:10.1111/j.1365-2672.2011.05177.x.
[46] MØLLER C O A, SANT’ANA A S, HANSEN S K H, et al. Evaluation of a cross contamination model describing transfer of Salmonella spp. and Listeria monocytogenes during grinding of pork and beef[J].International Journal of Food Microbiology, 2016, 1(1): 42-52.DOI:10.1016/j.ijfoodmicro.2016.03.016.
[47] BREUNINGER K J, WEIR M H. Development of an interspecies nested dose-response model for Mycobacterium avium subspecies paratuberculosis[J]. Risk Analysis, 2015, 35(8): 1479-1487.DOI:10.1111/risa.12380.
[48] MARKS H M, COLEMAN M E, LIN C J, et al. Topics in microbial risk assessment: dynamic flow tree process[J]. Risk Analysis, 1998,18(1): 309-328. DOI:10.1111/j.1539-6924.1998.tb01298.x.
[49] WILLIAMS D, CASTLEMAN J, LEE C C, et al. Risk of fetal mortality after exposure to Listeria monocytogenes based on dose-response data from pregnant guinea pigs and primates[J].Risk Analysis, 2009, 29(11): 1495-1505. DOI:10.1111/j.1539-6924.2009.01308.x.
[50] FARBER J M, ROSS W H, HARWIG J, et al. Health risk assessment of Listeria monocytogenes in Canada[J]. International Journal of Food Microbiology, 1996, 30(2): 145-154. DOI:10.1016/0168-1605(96)01107-5.
[51] MOON H, KIM H J, CHEN J J, et al. Model averaging using the Kullback information criterion in estimating effective doses for microbial infection and illness[J]. Risk Analysis, 2005, 25(5): 1147-1159. DOI:10.1111/j.1539- 6924.2005.00676.x.
[52] 董庆利, 王海梅, 刘箐, 等. 米饭中蜡样芽孢杆菌剂量效应模型的构建[J]. 食品安全质量检测学报, 2014, 5(4): 1021-1027.
Quantitative Risk Assessment of Cross-Contamination ofListeria monocytogenesduring Low-Temperature Emulsified Sausage Processing