肠道微生物是被忽视的“微生物器官”[1],越来越多的研究发现,肠道微生态失调与人类的健康有着或多或少的关系,除了与人体的消化有关之外,还与肠道疾病有着联系[2-5]。
肠道菌群存在着一种平衡,一旦这种平衡被疾病打破之后,可以用微生态制剂治疗恢复肠道菌群的平衡,或者使用药物辅助治疗。益生菌不仅可提高机体免疫力[6],且能产生确切具有健康功效的次级代谢产物,从而改善宿主微生态的平衡、发挥有益作用,还可以维持肠道内环境稳态、拮抗肠道致病菌、重建失调的肠道菌群、遏制毒性因子对肠道的损害、保证肠道营养代谢等[7-10],中药与肠道菌群相互作用的研究已经起步,并越来越得到众多中医药学者的关注。中药可直接调整肠道菌群结构进而影响健康,同时肠道菌群也会通过影响口服中药在体内的吸收代谢转化等而改变中药疗效的发挥[11-13]。有研究发现,多酚以及其被肠道菌群代谢的产物,能选择性调节肠道中易感微生物的生长,选择性促进有益菌群(如乳酸菌)生长,抑制有害菌的增殖,即引发肠道微生态的改变,这种改变对宿主产生重要影响[14]。
肠道中微生物的变化与粪便菌群的构成密切相关,因此对粪便菌群多样性的研究可以帮助人们深入了解肠道菌群的变化[15]。本研究的目的在于灌胃蓖麻油来建立小鼠腹泻的模型[16],使肠道菌群失调,通过联合使用益生菌和荔枝多酚,达到既能增强免疫力,又能促进营养吸收的双重效果,进而为益生菌和中药有效成分的联合应用提供理论依据。
SPF级昆明种小鼠,雌雄各半,购自北京华阜康生物科技股份有限公司,许可证号:SCXK(京)2014-0004。
嗜酸乳杆菌(Lactobacillus acidophilus)GIMCC GIM1.730、丁酸梭菌(Clostridium butyricum)GIMCC GIM1.676 广东省微生物研究所微生物菌种保藏中心;MRS培养基、梭菌增菌培养基 广东环凯微生物科技有限公司;荔枝多酚(荔枝皮提取,纯度为95%) 华中农业大学食品学院实验室;蓖麻油 湖北科田药业有限公司;洛哌丁胺 西安杨森制药有限公司;聚合酶链式反应(polymerase chain reaction,PCR)试剂 宝生物工程(大连)有限公司。
LRH-150F型系列生化培养箱 上海一恒科学仪器有限公司;5804R型低温高速离心机 德国Eppendorf公司;变性梯度凝胶电泳(denaturing gradient gel electrophoresis,DGGE)套装、凝胶成像仪、智能梯度PCR仪 美国Bio-Rad公司;CKX31倒置显微镜 日本Olympus公司;RM2255切片机 德国Leica公司。
1.3.1 动物饲养条件
小鼠养于屏障环境中,雌雄分开,正压通风,空调调节温度为(26±1)℃,光照周期12 h明12 h暗,小鼠自由饮食与饮水,适应性饲养一周。
1.3.2 菌种培养
嗜酸乳杆菌活化后,接种量为5%于MRS培养基中,培养时间为12 h,丁酸梭菌活化后接种量为5%于梭菌增菌培养基中,培养时间为24 h,温度均为37 ℃。在上述培养条件下均达到稳定期,分别采用MRS培养基、梭菌增殖培养基3 次重复进行活菌计数,嗜酸乳杆菌浓度近似可达1010~1011CFU/mL,丁酸梭菌浓度近似可达105~106CFU/mL。按时培养后直接灌胃小鼠。
1.3.3 动物实验分组与处理
本实验选用96 只体质量为18~22 g的SPF级昆明小鼠,雌雄各半,随机分为8 个处理组:正常组、模型组、洛哌丁胺组、嗜酸乳杆菌组、丁酸梭菌组、荔枝多酚组、复合菌、复合菌-荔枝多酚组,实验周期为14 d。每天各组定时按10 mL/kg体质量灌胃药物或无菌去离子水,其中正常组、模型组给予无菌去离子水,洛哌丁胺组按3 mg/kg灌胃;荔枝多酚组按 300 mg/kg灌胃;嗜酸乳杆菌组灌胃浓度1010~1011CFU/mL的嗜酸乳杆菌培养液;丁酸梭菌组灌胃浓度105~106CFU/mL丁酸梭菌培养液;复合菌组按上述丁酸梭菌和嗜酸乳杆菌菌液以体积比1∶1混合灌胃;复合菌-荔枝多酚组:将上述丁酸梭菌和嗜酸乳杆菌溶液按体积比1∶1混合灌胃,每天下午3:00复合菌-荔枝多酚组再按10 mL/kg的体质量灌胃300 mg/kg的荔枝多酚,其他组灌胃等剂量的无菌去离子水。第10 天每只按0.5 mL灌胃蓖麻油,之后每天仍按时喂药。第14天采集小肠组织,无菌采集粪便后,按照实验动物标准处死小鼠。
1.3.4 样品的采集与处理
于实验第14天后,将实验小鼠颈椎脱臼处死,剖腹,无菌操作,收集每组4 只小鼠的新鲜直肠粪便样本,置于-80 ℃下保存备用。再分别采取十二指肠(幽门后2~3 cm处)、空肠中段(幽门后约25 cm处)和回肠(离回盲口3 cm处)。每段肠管取2~3 cm,迅速用新配制的生理盐水洗去肠内容物后,放在体积分数10%福尔马林溶液中固定。按常规方法脱水、透明、石蜡包埋,连续横断切片,切片厚6 μm。每隔10 张切片取1 张,常规苏木精-伊红(hematoxylin-eosin,HE)染色。倒置显微镜20 倍物镜下仔细观察和比较小肠黏膜形态和结构的变化。选取5 张切片,每张切片取5 根最长且走向平直伸展良好的绒毛,应用明美数码成像处理软件,测量其绒毛长度(从绒毛基底部到绒毛顶端的距离)、最深的隐窝深度(隐窝基底部到绒毛基底部的距离)。计算绒毛长度与隐窝深度的比值(V/C)。
1.3.5 DNA的提取与PCR
采用QIAamp DNA Stool Mini Kit粪便提取试剂盒,提取粪便总DNA对细菌的16S rDNA的V3区片段进行PCR[17],PCR引物为带有GC夹子的上下游引物(357-F:5’-GCCGCCCGCCGCGCGCGGCGGGCGGGGCGGG GGCACGGGGGGCCTACGGGAGGCAGCAG-3’;518-R:5’-ATTACCGCGGCTGCTGG-3’)。PCR体系为:DNA模板2 μL、5×buffer 8 μL、dNTPs 1 μL、上游引物(10 mmol/L)1 μL、下游引物(10 mmol/L)1 μL,Phusion超保真DNA聚合酶0.8 U,加无菌水至40 μL(以上均在冰上操作)。PCR程序:94 ℃预变性2 min,94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸30 s,25 个循环,最后72 ℃延伸5 min反应结束,取3 μL于质量分数1%琼脂糖凝胶电泳检测,结果显示扩增条带唯一,长度在250 bp左右。
对细菌16S rDNA的V3可变区的扩增产物进行DGGE分析,采用质量分数8%聚丙烯酰胺凝胶,其中尿素质量分数梯度为48%~65%。电泳采用1×TAE缓冲液,200 V电压下预电泳10 min,随后在70 V的固定电压下电泳15.5 h,电泳结束后,置于磁钢容器中,加入400 mL BioLinker DNA Red染色液染色40 min,置于凝胶成像系统中观察拍照。
将DGGE图谱中清晰的优势条带标记后,在暗室中,紫外激发条件下,用无菌手术刀割胶回收,置于已标记的200 μL PCR管中,送上海生工生物公司进行测序。将测序结果在GenBank数据库中进行BLAST比对分析,找到亲缘关系最近的已知菌属。
用Quantity One 4.6.2软件进行菌群相似性和多样性分析,包括丰富度指数(richness,S)(即DGGE图谱每条泳道的条带数)和均匀度指数(evenness,E),微生物区系多样性指数即Shannon指数(H’),按照如下公式进行计算[18]。
式中:H’为Shannon指数,H’值越大,说明群落多样性越高;S为DGGE图谱中条带数量,S值越大,说明物种多样性越高;Pi为第i条带灰度占该样品总灰度的比率。
微生物区系相似性指数采用NTSYS 2.10软件进行聚类分析。多组间比较采用单因素方差分析(One-way ANOVA),两两比较采用Duncan法,使用SPSS 17.0统计软件分析。结果以平均值±标准差表示,P<0.05为差异有显著性意义。
2.1.1 复合菌-荔枝多酚对小鼠十二指肠结构的影响
表1 复合菌-荔枝多酚对小鼠十二指肠结构的影响
Table1 Effect of composite probiotics-litchi polyphenol on duodenum morphology of mice

注:同列肩标小写字母不同表示差异显著(P<0.05)。下同。
组别 绒毛长度/μm 隐窝深度/μm V/C正常组 550.28±40.12e77.30±11.36a7.31±0.39c模型组 382.50±38.08a105.67±19.67bc3.75±0.67a洛哌丁胺组 354.65±18.68ab93.07±17.56bc3.88±0.51a嗜酸乳杆菌组 461.97±32.72cd77.74±7.99a6.03±0.36b丁酸梭菌组 504.20±30.83de105.47±10.56bc5.19±0.81a荔枝多酚组 446.56±34.91cd120.93±8.77c3.71±0.32a复合菌组 523.06±25.75e90.96±15.34bc5.93±0.37b复合菌-荔枝多酚组 434.63±29.11bc92.22±13.21bc4.59±0.76a
由表1可知,除了洛哌丁胺组其他组小鼠十二指肠的绒毛长度均大于模型组,差异显著(P<0.05),其中复合菌组与正常组无显著差异(P>0.05);嗜酸乳杆菌组隐窝深度显著低于模型组(P<0.05),与正常组无显著差异,其他组与模型组差异不显著(P>0.05);V/C值表现为嗜酸乳杆菌组和复合菌组均显著大于模型组(P<0.05),其他组间差异不显著(P>0.05)。可以看出腹泻小鼠灌胃益生菌或荔枝多酚后,能明显提高小鼠十二指肠的绒毛长度和V/C值,其中嗜酸乳杆菌和复合菌效果最佳。
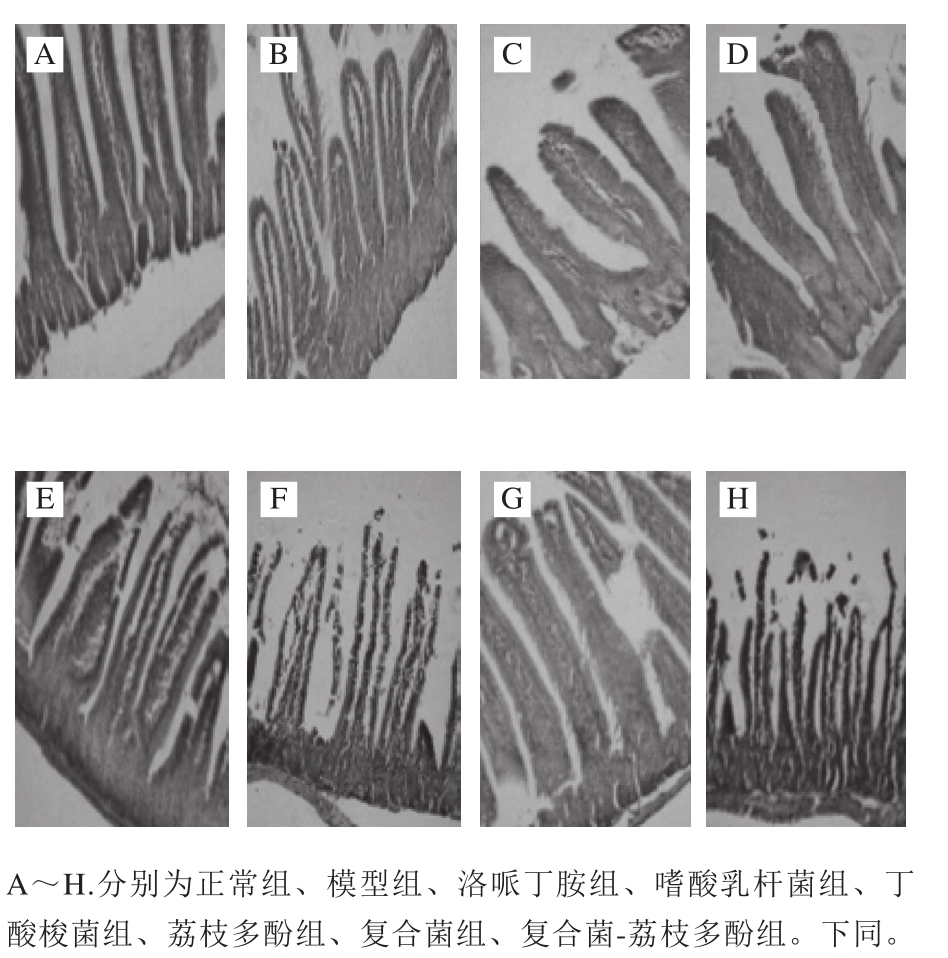
图1 十二指肠组织病理学变化(×200)
Fig.1 Histopathological change of duodenum (× 200)
由图1可知,正常组十二指肠肠壁层次清晰、绒毛结构完整、排列紧密,嗜酸乳杆菌组和复合菌组绒毛修长、丰满,荔枝多酚组和复合菌-荔枝多酚组绒毛纤细,可以明显看出嗜酸乳杆菌组和复合菌组对蓖麻油腹泻小鼠十二指肠的影响最大。
2.1.2 复合菌-荔枝多酚对小鼠空肠结构的影响
表2 复合菌-荔枝多酚对小鼠空肠结构的影响
Table2 Effect of composite probiotics-litchi polyphenol on jejunum morphology of mice
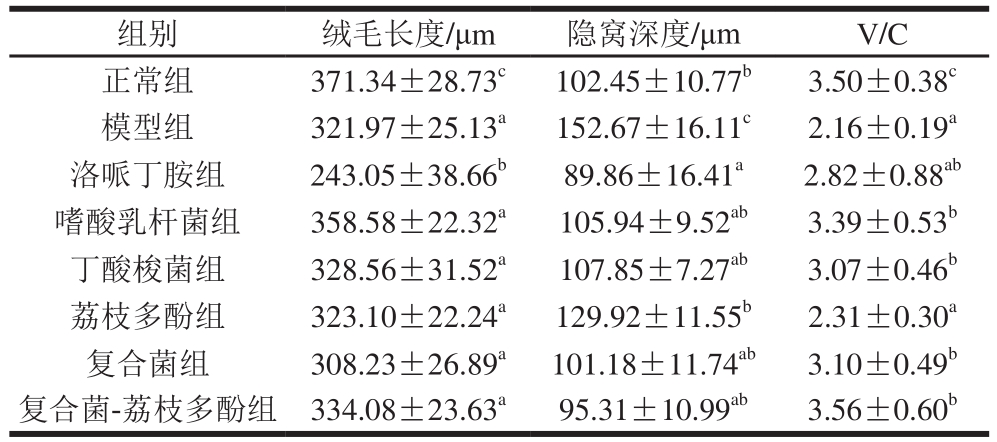
组别 绒毛长度/μm 隐窝深度/μm V/C正常组 371.34±28.73c102.45±10.77b3.50±0.38c模型组 321.97±25.13a152.67±16.11c2.16±0.19a洛哌丁胺组 243.05±38.66b89.86±16.41a2.82±0.88ab嗜酸乳杆菌组 358.58±22.32a105.94±9.52ab3.39±0.53b丁酸梭菌组 328.56±31.52a107.85±7.27ab3.07±0.46b荔枝多酚组 323.10±22.24a129.92±11.55b2.31±0.30a复合菌组 308.23±26.89a101.18±11.74ab3.10±0.49b复合菌-荔枝多酚组 334.08±23.63a95.31±10.99ab3.56±0.60b
由表2可知,洛哌丁胺组小鼠空肠绒毛长度小于模型组,差异显著(P<0.05),其他组间差异不显著(P>0.05),且均显著低于正常组(P<0.05)。6 个处理组小鼠空肠的隐窝深度均显著低于模型组(P<0.05),而且组间差异不显著(P>0.05)。V/C值表现为嗜酸乳杆菌组、丁酸梭菌组、复合菌组和复合菌多酚组均显著大于模型组(P<0.05),丁酸梭菌组与正常组无显著差异(P>0.05)。可以看出腹泻小鼠灌胃复合菌-荔枝多酚后,能明显提高小鼠十二指肠的绒毛长度和V/C值。

图2 空肠组织病理学变化(×200)
Fig.2 Histopathological change of jejunum (× 200)
由图2可知,模型组和洛哌丁胺组绒毛宽且短小,嗜酸乳杆菌组、复合菌组和复合菌-荔枝多酚组绒毛修长、整齐,表明嗜酸乳杆菌组、丁酸梭菌组、复合菌组和复合菌-荔枝多酚组有助于腹泻小鼠空肠肠黏膜损伤修复。2.1.3 复合菌-荔枝多酚对小鼠回肠结构的影响
表3 复合菌-荔枝多酚对小鼠回肠结构的影响
Table3 Effect of composite probiotics-litchi polyphenol on ileum morphology of mice
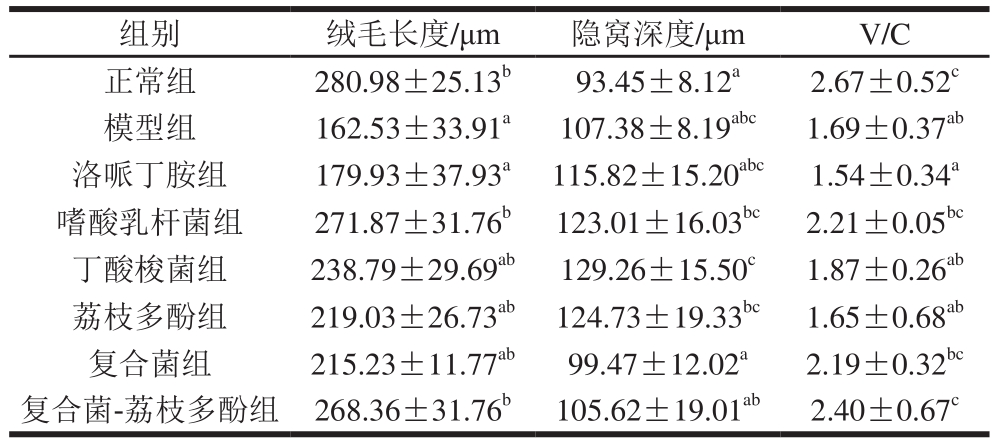
组别 绒毛长度/μm 隐窝深度/μm V/C正常组 280.98±25.13b93.45±8.12a2.67±0.52c模型组 162.53±33.91a107.38±8.19abc1.69±0.37ab洛哌丁胺组 179.93±37.93a115.82±15.20abc1.54±0.34a嗜酸乳杆菌组 271.87±31.76b123.01±16.03bc2.21±0.05bc丁酸梭菌组 238.79±29.69ab129.26±15.50c1.87±0.26ab荔枝多酚组 219.03±26.73ab124.73±19.33bc1.65±0.68ab复合菌组 215.23±11.77ab99.47±12.02a2.19±0.32bc复合菌-荔枝多酚组 268.36±31.76b105.62±19.01ab2.40±0.67c
从表3可以看出,嗜酸乳杆菌组和复合菌-荔枝多酚组小鼠回肠绒毛长度大于模型组,差异显著(P<0.05),与正常组无显著差异(P>0.05)。所有组小鼠隐窝深度与模型组均差异不显著(P>0.05)。V/C值表现为嗜酸乳杆菌组、复合菌组和复合菌-荔枝多酚组均显著大于模型组(P<0.05),与正常组无显著差异(P>0.05),表明腹泻小鼠灌胃益生菌或荔枝多酚后,能明显提高小鼠十二指肠的绒毛长度和V/C值,其中嗜酸乳杆菌和复合菌效果最佳。
由图3可知,模型组和洛哌丁胺组绒毛比较短小,嗜酸乳杆菌组、复合菌组和复合菌-荔枝多酚组绒毛修长、整齐,可以看出嗜酸乳杆菌组、复合菌组、复合菌多酚组对蓖麻油腹泻小鼠回肠肠黏膜损伤有修复作用。
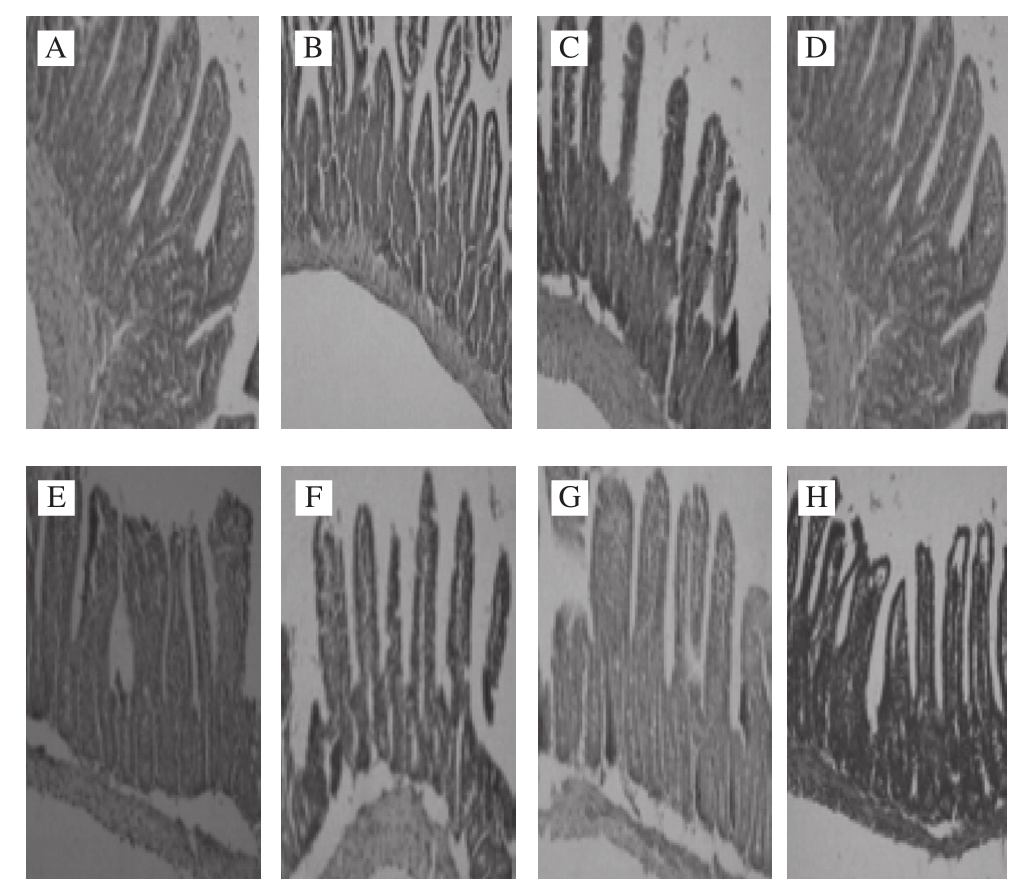
图3 小鼠回肠组织病理学变化(×200)
Fig.3 Histopathological change of ileum (× 200)
通过PCR-DGGE对小鼠粪便肠道菌群进行检测,对DGGE图谱上所显示的优势条带进行回收,送生工生物工程(上海)股份有限公司克隆并且进行测序,最后对测序的结果进行BLAST比对、NTSYS 2.10相似性聚类分析及图谱多样性指数分析。

图4 小鼠粪便细菌微生物区系16S rDNA V3区DGGE图谱
Fig.4 DGGE profiles obtained with universal primers for V3 of 16S rDNA of fecal microbiota
如图4所示,各组有个别条带发生了轻微的变化,如条带2、6、8是灌胃复合菌-荔枝多酚后新出现的,条带3是灌胃复合菌后新出现的,条带10是灌胃丁酸梭菌、嗜酸乳杆菌后新出现的,条带9是嗜酸乳杆菌组和丁酸梭菌组的优势菌种,而条带1、4、7、11、12、13是所有组的优势菌种。
为进一步了解各组对小鼠结肠中微生物群落的影响,对DGGE图谱中相关条带进行了测序分析。由表4可知,其中,条带2鉴定为胆型螺旋杆菌(Helicobacter bilis),条带6、8鉴定为梭状芽孢杆菌([Clostridium]polysaccharolyticum)、条带3鉴定为[真细菌]哈利菌([Eubacterium] hallii),条带10鉴定为乳酸菌(Lactobacillus taiwanensis),条带9鉴定为拟杆菌(Bacteroides chinchillae),条带1、4、7、11、12、13分别鉴定为拟杆菌(Bacteroides chinchillae)、艾克曼菌(Akkermansia muciniphila)、洛氏普雷沃菌(Prevotella loescheii)、长双歧杆菌(Stomatobaculum longum)、Alistipes senegalensis、费格森埃希菌(Escherichia fergusonii)。
表4 DGGE图谱中特异条带的测序比对结果
Table4 Sequence alignment of specific bands in DGGE profile

条带编号 比对结果 GenBank序列提交号 相似性/%1、9 Bacteroides chinchillae NR-113064.1 100 2 Helicobacter bilis NR-029182.3 100 3[Eubacterium] hallii NR-118673.1 99 4 Akkermansia muciniphila NR-074436.1 99 5 [Clostridium] xylanovorans NR-028740.1 91 6、8 [Clostridium] polysaccharolyticum NR-119085.1 99 7 Prevotella loescheii NR-113109.1 94 10 Lactobacillus taiwanensis NR-044507.1 100 11 Stomatobaculum longum NR-117792.1 98 12 Alistipes senegalensis NR-118219.1 98 13 Escherichia fergusonii NR-074902.1 100
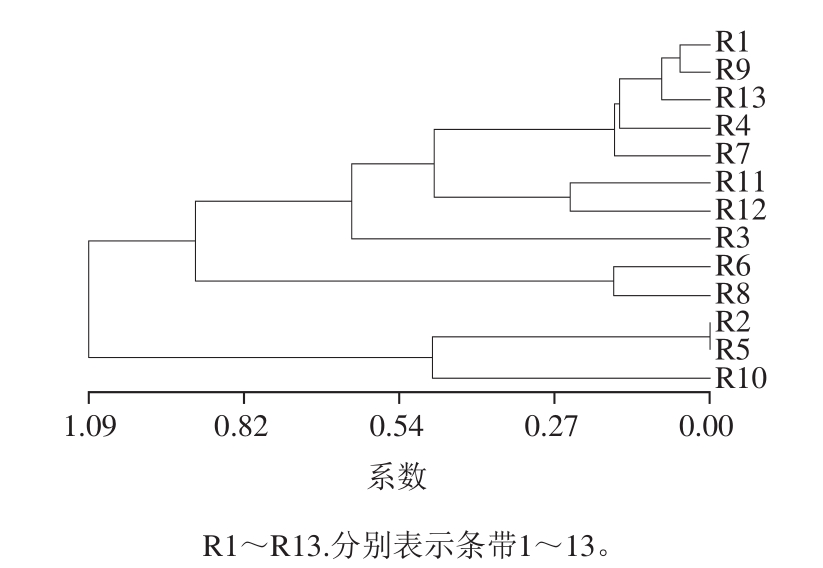
图5 小鼠粪便微生物系统发育树
Fig.5 Phylogenetic tree of mouse fecal microorganisms
采用NTSYS 2.10软件对DGGE图进行数字化和聚类分析,聚类分析的结果如图5所示。发现正常组和其他各组形成了一定程度的分界,树状图明显分成了两大簇,其中正常组全部聚在了一簇,组内比较集中,个体差异不大;相似性系数大于75%,而其他组聚成另外一簇,相似性系数都大于73%,表明蓖麻油腹泻后的小鼠的肠道菌群结构组成有了明显的变化。给药各组内比较分散,个体差异比较大。其中复合菌-荔枝多酚组比较分散,没有形成一簇,说明个体差异比较大。
由表5可以看出,嗜酸乳杆菌组、复合菌组和复合菌-荔枝多酚组能增加蓖麻油腹泻后小鼠肠道菌群的丰富度,均显著大于模型组和正常组(P<0.05),说明嗜酸乳杆菌、复合菌和复合菌-荔枝多酚能增加菌群的数量;复合菌组和复合菌-荔枝多酚组的菌群均匀度显著大于模型组和正常组(P<0.05),从中可以看出灌胃复合菌、复合菌-荔枝多酚的小鼠肠道菌群的微生态稳定性有所增强,复合菌组的Shannon指数显著大于模型组和正常组(P<0.05),其他组之间差异并不显著,说明小鼠肠道中的菌群多样性增大,群落的复杂程度增高。丁酸梭菌组和荔枝多酚组的丰富度指数、均匀度指数、Shannon指数与模型组和正常组均差异不显著(P>0.05),说明小鼠肠道中的菌群丰富度、多样性、复杂程度增高是嗜酸乳杆菌在起主导作用。
表5 小鼠肠道菌群DGGE图谱多样性指数分析
Table5 Diversity indices based on DGGE profile of intestinal microflora in mice

组别 丰富度指数 均匀度指数 Shannon指数正常组 16.80±2.28a0.88±0.03a2.58±0.09a模型组 17.00±2.19a0.88±0.02a2.59±0.09a洛哌丁胺组 19.50±1.73ab0.93±0.03ab2.75±0.04ab嗜酸乳杆菌组 23.67±3.21b0.90±0.05ab2.85±0.02ab丁酸梭菌组 21.50±2.43ab0.88±0.02ab2.68±0.05ab荔枝多酚组 19.25±2.99ab0.88±0.02a2.57±0.03a复合菌组 22.33±1.15b0.94±0.02b2.89±0.06b复合菌-荔枝多酚组 20.33±0.57b0.94±0.02b2.86±0.03ab
小肠绒毛的发育状况决定了营养物质的吸收和利用的情况,因为肠道内小肠吸收营养物质的主要部位,绒毛高度越高,成熟的细胞就越多,吸收能力就会越强,反之,吸收能力就越差[19-21],V/C值可以综合反映小肠营养吸收的状况,绒毛长度增加,隐窝深度降低,V/C值就会增大,营养吸收的能力就会增加[23]。实验结果显示,嗜酸乳杆菌和复合菌能提高十二指肠、空肠的V/C值,丁酸梭菌能增加空肠的V/C值,复合菌-荔枝多酚能增加空肠和回肠的V/C值。已有研究发现益生菌(嗜酸乳杆菌和鼠李糖乳杆菌)可以在小鼠的肠道内壁黏附、定植,产生有益物质改善肠道菌群,还能够通过增长肠绒毛的高度、降低小肠隐窝的深度,促进机体对营养物质的吸收[24-25]。本研究结果与前人相似,说明复合菌与荔枝多酚联用可在一定程度上增进肠道的消化吸收能力。
人体内肠道菌群如果失衡,肠道内环境就会发生变化,从而引起宿主代谢和免疫紊乱[22],使人体处于亚健康状态,甚至引发糖尿病和高血压等慢性疾病[26]。已有报道表明乳酸菌可以提高肠道内免疫力,促进肠道菌群恢复平衡状态的作用[27]。对比整个DGGE图谱可见,嗜酸乳杆菌、复合菌和复合菌-荔枝多酚能增加蓖麻油腹泻后小鼠菌群的数量,增强肠道菌群的微生态稳定性,而且复合菌还能增高群落的复杂程度。复合菌与荔枝多酚联用未增加群落的复杂程度,可能是荔枝多酚具有抑菌、提高机体免疫力、预防疾病的作用[28],从而抑制了有害菌的生长,导致菌群多样性、群落的复杂程度降低。这与唐艳等研究相一致,中草药所含的有效成分可以抑制有害菌:大肠杆菌、沙门氏菌的增殖等,最终会降低有害菌的数量[29]。本研究测序结果显示,各给药组条带与正常组和模型组相比,增加了优势条带,复合菌组和复合菌-荔枝多酚组还出现了新的条带,说明复合菌和复合菌-荔枝多酚不仅能有效地提高小鼠肠道的丰富度,增加小鼠肠道微生物的多样性,还能够促进肠道内部某些菌群的生成,优化小鼠肠道微生物菌群结构,所有给药组中复合菌体现出了更好的效果。
[1] KE G, STILLING R M, KENNEDY P J, et al. Minireview:gut microbiota: the neglected endocrine organ[J]. Molecular Endocrinology, 2014, 28(8): 1221-1238. DOI:10.1210/me.2014-1108.
[2] GEVER D, KUGATHASAN S, DENSON L A, et al. The treat-mentnaive microbiome in new-onset Crohn’s disease[J]. Cell Host &Microbe, 2014, 15(3): 382-392. DOI:10.1016/j.chom.2014.02.005.
[3] AHN J, SINHA R, PEI Zhiheng, et al. Human gut microbe-ome and risk for colorectal cancer[J]. National Cancer Institute, 2013, 105(24):1907-1911. DOI:10.1093/jnci/djt300.
[4] SAULNIER D M, RIEHLE K, MISTRETTA T A, et al. Gastrointestinal microbiome signatures of pediatric patients with irritable bowel syndrome[J]. Gastroenterology, 2011, 141(5): 1782-1791.DOI:10.1053/j.gastro.2011.06.072.
[5] MAZMANIAN S K, ROUND J L, KASPER D L. A microbial symbiosis factor prevents intestinal inflammatory disease[J]. Nature,2008, 453: 620-625. DOI:10.1038/nature07008.
[6] 孙芝兰. 卷曲乳杆菌益生特性及黏附机理研究[D]. 济南: 山东大学,2012: 4.
[7] DAVID L A, MAURICE C F, CARMODY R N, et al. Diet rapidly and reproducibly alters the human gut microbiome[J]. Nature, 2014,505: 559-563. DOI:10.1038/nature12820.
[8] GIBSON G R, PROBERT H M, LOO J V, et al. Dietary modulation of the human colonic microbiota: updating the concept of prebiotics[J].Nutrition Research Reviews, 2004, 17(2): 259-275. DOI:10.1079/NRR200479.
[9] NICHOLSON J K, HOLMES E, KINROSS J, et al. Host-gut microbiota metabolic interactions[J]. Science, 2012, 336: 1262-1267.DOI:10.1126/science.1223813.
[10] DASTAR B, KHOSRAVI A, BOLDAJIE F, et al. Effect of calcium with and without probiotic, lactose, or both on organ and body weights, immune response and caecal microbiota in moulted laying hens[J]. Animal Physiology and Animal Nutrition, 2016, 100(2): 243-250. DOI:10.1111/jpn.12358.
[11] 姜东京, 张丽, 曹雨诞, 等. 肠道菌群在中药研究中的应用[J]. 中国中药, 2016, 41(17): 3218-3225.
[12] 黄恩福, 黄柳梅, 阮记明, 等. 肠道菌群与中草药有效成分代谢的相互影响的研究进展[J]. 中国兽医学报, 2016(9): 1619-1623.
[13] AKAO T, KAWABATA K, YANAGISAWA E, et al. Balicalin, the predominant flavone glucuronide of scutellariae radix, is absorbed from the rat gastrointestinal tract as the aglycone and restored to its original form[J]. Journal of Pharmacy & Pharmacology, 2010, 52(12):1563-1568.
[14] 肖俊松, 单静敏, 曹雁平, 等. 多酚通过肠道菌群调节能量代谢研究进展[J]. 食品科学, 2012, 33(3): 300-303. DOI:10.7506/spkx1002-6630-201703062.
[15] 王丽凤. 益生菌L. plantarum P-8对肉鸡肠道菌群、肠道免疫和生长性能影响的研究[D]. 呼和浩特: 内蒙古农业大学, 2014: 2-10.
[16] BELLON F H, MAIHA B B, ANUKA J A. The effect of methanol rhizome extract of Nymphaea lotus Linn (Nymphaeaceae) in animal models of diarrhea[J]. Ethnopharmacology, 2016, 190: 13-21.DOI:10.1016/j.jep.2016.05.036.
[17] WALTER J, TANNOCK G W, TILSALA-TIMISJARVI A, et al.Detection and identification of gastrointestinal Lactobacillus species by using denaturing gradient gel electrophoresis and species-specific PCR primers[J]. Applied & Environmental Microbiology, 2000, 66(1):297-303. DOI:10.1128/AEM.66.1.297-303.2000.
[18] MCCRACKEN V J, SIMPSON J M, MACKIE R I, et al. Molecular ecological analysis of dietary and antibiotic induced alterations of the mouse intestinal microbiota[J]. Nutrition, 2001, 131(6): 1862-1870.
[19] CASPARY W F. Physiology and pathophysiology of intestinal absorption[J]. American Journal of Clinical Nutrition, 1992, 55(1):299-303.
[20] 王春荣, 刘学飞, 程永刚. 肠功能恢复汤对感染性多器官功能障碍综合征大鼠肠黏膜损伤的保护作用[J]. 郑州大学学报, 2008, 43(6):13-15. DOI:10.13705/j.issn.1671-6825.2008.06.015.
[21] 王子旭, 佘锐萍, 陈越, 等. 日粮锌硒水平对肉鸡小肠黏膜结构的影响[J]. 中国兽医科技, 2003, 33(7): 18-21. DOI:10.16656/j.issn.1673-4696.2003.07.005.
[22] 韩正康. 家畜营养生理学[M]. 北京: 中国农业出版社, 1991: 16-17.
[23] JOHNSON K C, MITCHELL D J, AVITZUR Y, et al. Probiotics reduce bacterial colonization and gastric inflammation in H. pyloriinfected mice[J]. Digestive Diseases and Sciences, 2004, 49(7): 1095-1102. DOI:10.1023/B:DDAS.0000037794.02040.c2.
[24] 丁素娟, 王薇薇, 李爱科, 等. 益生菌肠道黏附性研究进展[J]. 饲料工业, 2016, 37(23): 55-61.
[25] GILL S R, POP M, DEBOY R T, et al. Metagenomie analysis of the human distal gut microbiome[J]. Science, 2006, 312: 1355-1359.DOI:10.1126/science.1124234.
[26] 杨吉雨. 植物源添加剂对益生菌生长的影响和益生菌微生态制剂的开发[D]. 长春: 吉林大学, 2015: 11.
[27] 张扬, 袁杰利. 肠道益生菌对机体免疫功能的影响[J]. 中国微生态学杂志, 2003, 15(4): 246-248. DOI:10.13381/j.cnki.cjm.2003.04.036.
[28] IBRAHIM S M, MOHAMED G A. Litchi chinensis: medicinal uses,phytochemistry and pharmacology[J]. Ethnopharmacolog, 2015, 174:412-513. DOI:10.1016/j.jep.2015.08.054.
[29] 唐艳, 张宾, 霍健聪, 等. 12 种中草药抑菌作用研究[J]. 浙江海洋学院学报, 2012, 31(2): 147-152.
Effect of Co-administration of Mixed Probiotic Culture and Litchi Polyphenol on Intestinal Morphology and Intestinal Flora of Mice with Diarrhea