牦牛血低聚肽抗缺氧活性及其作用机制
肖 岚1,2,王 威2,吴玉娇2,杜 昕1,李 诚1,*
(1.四川农业大学食品学院,四川 雅安 625014;2.四川旅游学院食品学院,四川 成都 610100)
摘 要:研究牦牛血低聚肽的抗缺氧活性及其可能的作用机制。将75 只小鼠随机分为缺氧对照组、阳性对照组(红景天组)和牦牛血低聚肽高、中、低剂量组,连续灌胃给药30 d,末次灌胃60 min后,置于常压密闭容量瓶中直到呼吸停止,即刻取出心肌组织和脑组织并测定相关指标。结果表明:牦牛血低聚肽具有良好的抗缺氧活性,能够保护常压密闭缺氧小鼠的大脑及心脏。与对照组相比,高剂量牦牛血低聚肽干预能够极显著降低常压缺氧小鼠脑和心肌组织中丙二醛含量、H2O2含量和乳酸脱氢酶活力(P<0.01),显著提高常压缺氧小鼠脑和心肌组织中超氧化物歧化酶活力(P<0.01)、谷胱甘肽过氧化物酶活力(心肌组织中P<0.01,脑组织中P<0.05)、过氧化氢酶活力(P<0.01),极显著提高常压缺氧小鼠脑和心肌组织中三磷酸腺苷含量(P<0.01)。以上结果表明:牦牛血低聚肽能够缓解缺氧对机体导致的氧化应激损伤,作用机制可能与清除自由基、抑制脂质过氧化、维持机体抗氧化酶系活性及维持线粒体内氧化磷酸化的正常进行有关。
关键词:牦牛血低聚肽;抗缺氧活性;自由基;脂质过氧化;抗氧化酶
缺氧会诱导机体氧敏感性途径活化,催化线粒体通过Fenton反应和Haber-Weiss反应生成自由基[1],影响到机体正常的氧化分解供能作用。促进机体在缺氧条件下的调适能力是提高人体低氧耐受性的重要措施,其中比较有效的途径之一是摄食抗缺氧药物或功能食品[2-3]。牦牛是分布在海拔3 000 m以上的特殊家畜,经过世代的自然选择,牦牛显示出对低氧环境极好的适应性,这可能与牦牛血液的特殊性有一定关系[4-6]。姚星辰等[7]报道牦牛活性蛋白具有显著的延长抗缺氧时间的作用。缺氧诱发活性氧(reactive oxygen species,ROS)的大量蓄积是造成缺氧损伤的重要因素之一[8],而抗氧化剂能够通过清除ROS缓解缺氧造成的神经损伤,改善认知功能[9-11]。Fan Pengcheng等[11]首次证实咪唑啉类自由基清除剂具有抗高原缺氧作用;其机制为清除减压缺氧导致的体内过量ROS等自由基,即缺氧相关疾病的发生和线粒体内自由基释放增加密切相关[12]。Swenson等[13]研究发现抗氧化剂对高原病的预防有积极作用。Bailey等[14]研究发现,在登高前3 周开始补充L-抗坏血酸、VE、α-硫辛酸可有效改善机体的血氧饱和度,减轻高原反应症状。Subudhi等[15]的研究也显示,提前补充抗氧化剂能够改善机体在急性缺氧条件下(4 300 m海拔)的通气阈值。在大鼠急性缺氧实验中发现懈皮素可通过提升抗氧化能力和抑制氧化应激核转录因子-κB(nuclear factor-κB,NF-κB)的表达,有效地预防高原脑水肿的发生[1]。而Paul等[17]发现具有良好抗氧化活性的化合物水飞蓟素也能有效防治急性缺氧暴露时高原病的发生。Schreiber等[18]发现VE和VC的自由基清除作用可以延长急性缺氧小鼠的存活时间。Al-Hashem[19]发现补充VE和VC可以对抗高原缺氧相关的大鼠肺损伤。
本课题组前期测定了牦牛血低聚肽的体外抗氧化能力[20-22],包括还原力、2,2’-联氮-双-3-乙基苯并噻唑啉-6-磺酸自由基清除力、·OH清除能力、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除能力、总抗氧化力以及脂质过氧化抑制能力6 个指标,其中·OH清除能力、DPPH自由基清除能力、总抗氧化力以及脂质过氧化抑制能力均极显著优于商品化大豆低聚肽(P<0.01)。为了进一步证实牦牛血低聚肽的抗氧化能力,本实验拟通过高、中、低剂量牦牛血低聚肽对常压密闭缺氧动物模型的干预,研究其抗缺氧活性以及可能的作用机制,通过测定30 d灌胃小鼠血清中的丙二醛(malondialdehyde,MDA)含量、超氧化物歧化酶(superoxide dismutase,SOD)活力、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)活力、总抗氧化能力(total antioxidant capacity,T-AOC)等以综合评价牦牛血低聚肽的体内抗氧化能力。以期为牦牛血低聚肽作为抗缺氧功能食品的开发提供理论参考。
1 材料与方法
1.1 动物、材料与试剂
SPF级KM小鼠,雄性,体质量18~22 g,购自成都达硕实验动物中心,动物合格证号:SCXK(川)2015-030。
牦牛血低聚肽(氨基酸含量85.25 g/100 g,平均分子质量小于1 kDa)由实验室自制;红景天胶囊(国食健字G 20100243,规格为400 mg/粒,每100 g含红景天苷0.5 g)北京同仁堂健康药业股份有限公司;MDA测试盒、SOD测试盒、H2O2测试盒、GSH-Px测试盒、乳酸脱氢酶(lactate dehydrogenase,LDH)测试盒、过氧化氢酶(catalase,CAT)测试盒、三磷酸腺苷(adenosine 5’-triphosphate,ATP)含量测试盒、T-AOC测试盒、蛋白定量测试盒、A045-2考马斯亮蓝 南京建成生物工程研究所。
1.2 仪器与设备
DZKW-4型电子恒温水浴锅 北京中兴伟业仪器有限公司;722可见分光光度计、UV752N紫外-可见分光光度计 上海佑科仪器仪表有限公司;SYQ-DSX-280B手提式不锈钢压力蒸汽灭菌器 上海申安医疗器械厂;移液枪 大龙兴创实验仪器(北京)有限公司。
1.3 方法
1.3.1 动物喂养
将小鼠随机分为5 组,即对照组(等体积的生理盐水)、红景天阳性药物组以及牦牛血低聚肽低、中、高剂量组(365、700、1 500 mg/kg)。灌胃30 d,1 次/d,自由摄食和饮水。牦牛血低聚肽体内抗氧化实验喂养75 只小鼠;牦牛血低聚肽抗缺氧活性的实验部分喂养75 只小鼠。
红景天用量参照人用量(每日2 次,每次3 粒)进行折算,以蒸馏水溶解红景天颗粒,配成36.4 mg/mL的灌胃液,按10 mL/kg mb灌胃[23]。
1.3.2 抗缺氧实验
按1.3.1节喂养小鼠,灌胃30 d后小鼠眼眶内眦静脉丛采血测定MDA含量、SOD活力、GSH-Px活力、T-AOC。
根据《保健食品检验与评价技术规范(2003版)》[24]的规定对灌胃30 d小鼠进行常压缺氧处理,建立常压缺氧小鼠模型,当实验小鼠停止呼吸时处死并记录存活时间,取小鼠大脑和心肌组织,-80 ℃保存,并根据不同实验目的对组织进行相应处理及相关指标的测定。通过对缺氧相关指标的检测,研究牦牛血低聚肽对常压缺氧小鼠脑/心肌组织脂质过氧化相关指标(MDA、H2O2)的影响,对抗氧化酶系统中SOD、GSH-Px、CAT活力的影响,对无氧酵解系统中LDH活力、ATP含量的影响。所有操作均严格按照测试盒操作书说明进行。
1.4 数据处理
实验数据经3 次平行实验后得到,实验数据以平均值±标准差表示,统计分析使用Excel 2013、SPSS 16.0、Origin 8.1软件,组间比较采用单因素方差分析,P<0.05表示有显著性差异。
2 结果与分析
2.1 牦牛血低聚肽对小鼠体内抗氧化能力的影响
表1 牦牛血低聚肽对小鼠MDA含量、T-AOC、GSH-Px活力和SOD活力的影响
Table1 Effect of yak blood oligopeptides on MDA content, T-AOC,GSH-Px activity and SOD activity in mice

注:#.与对照组相比差异显著(P<0.05);##.与对照组相比差异极显著(P<0.01)。下同。
GSH-Px活力/(U/mg)对照组 10.30±1.85 229.13±19.90 9.42±1.10 567.53±75.67阳性对照组 9.36±1.30 260.34±16.49#11.51±1.60##651.33±63.43##牦牛血低聚肽高剂量组 9.39±1.10 259.10±16.78#11.11±1.17#667.11±48.53##牦牛血低聚肽中剂量组 9.50±1.84 244.18±39.21 10.83±1.06#633.80±68.33牦牛血低聚肽低剂量组 10.01±1.54 235.44±38.05 10.36±2.29 597.14±59.64组别 MDA含量/(nmol/mL)SOD活力/(U/mg)T-AOC/(U/mg)
不同剂量的牦牛血低聚肽灌胃小鼠30 d后,各组血清中的MDA含量、T-AOC、GSH-Px活力和SOD活力见表1。与对照组相比,阳性对照组、高剂量组小鼠血清中SOD活力显著升高(P<0.05);其余各组小鼠血清中SOD活力与对照组相比无显著差异。与对照组相比,阳性对照组小鼠血清中T-AOC极显著升高(P<0.01);高剂量组、中剂量组小鼠血清中T-AOC显著升高(P<0.05);低剂量组小鼠血清中T-AOC无明显差异。与对照组相比,阳性对照组、高剂量组小鼠血清中GSH-Px活力极显著升高(P<0.01);低剂量组小鼠血清中GSH-Px活力无显著差异。与对照组相比,各组小鼠血清中MDA含量无明显差异。由此可见,牦牛血低聚肽高、中、低剂量组均能影响小鼠血清中的MDA含量、T-AOC、GSH-Px活力和SOD活力,并呈现剂量依赖性;其中,牦牛血低聚肽高剂量组的抗氧化能力最好,与阳性对照组的抗氧化能力相当。此结果说明适当剂量的牦牛血低聚肽能显著升高小鼠体内抗氧化酶活力、抑制脂质过氧化、加速清除体内自由基,提示牦牛血低聚肽可作为抗缺氧保健食品做进一步研究。
2.2 牦牛血低聚肽对常压密闭缺氧小鼠存活时间的影响
牦牛血低聚肽在常压密闭缺氧研究过程中显示了较高的抗缺氧活性(表2)。与对照组相比,阳性对照组虽然能够延长常压密闭缺氧小鼠的存活时间,但是无显著性差异;牦牛血低聚肽高、中、低剂量组均能延长缺氧小鼠的存活时间,其中高剂量组的抗缺氧活性优于阳性对照组,延长率差异极显著(P<0.01)。该结果提示,具有抗氧化活性的低聚肽可通过减少机体内过多自由基生成,阻断ROS自由基瀑布效应,从而保护机体免受缺氧损伤[24]。
表2 牦牛血低聚肽对小鼠常压缺氧存活时间的影响
Table2 Effect of yak blood oligopeptides on survival time of mice under atmospheric hypoxia

注:**.与阳性对照组相比差异极显著(P<0.01)。
组别 存活时间/min 延长率/%对照组 33.74±3.42阳性对照组 36.61±3.17 7.92±1.37牦牛血低聚肽高剂量组 42.17±1.20#23.50±8.13**牦牛血低聚肽中剂量组 37.40±3.52 10.03±0.60牦牛血低聚肽低剂量组 35.19±4.48 3.81±2.57
2.3 牦牛血低聚肽对常压缺氧小鼠脑/心肌脂质过氧化保护作用
2.3.1 MDA含量
表3 牦牛血低聚肽对常压缺氧小鼠脑组织及心肌组织MDA含量的影响(n=15)
Table3 Effect of yak blood oligopeptides on MDA content in myocardial and brain tissues of mice under atmospheric hypoxia (n= 15)
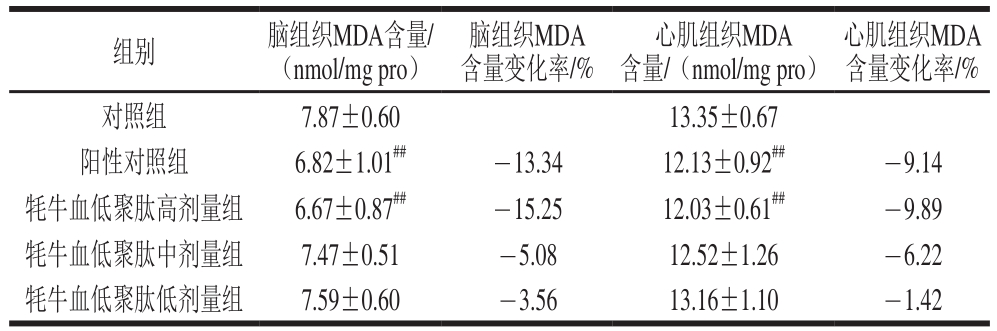
心肌组织MDA含量变化率/%对照组 7.87±0.60 13.35±0.67阳性对照组 6.82±1.01##-13.34 12.13±0.92##-9.14牦牛血低聚肽高剂量组 6.67±0.87##-15.25 12.03±0.61##-9.89牦牛血低聚肽中剂量组 7.47±0.51 -5.08 12.52±1.26 -6.22牦牛血低聚肽低剂量组 7.59±0.60 -3.56 13.16±1.10 -1.42组别 脑组织MDA含量/(nmol/mg pro)脑组织MDA含量变化率/%心肌组织MDA含量/(nmol/mg pro)
MDA是生物体脂质氧化的天然产物之一,生物体内MDA含量越高代表机体组织脂质过氧化越严重[25]。由表3可知,牦牛血低聚肽高、中、低剂量组均能减少小鼠脑和心肌组织中MDA含量;与对照组相比,阳性对照组、牦牛血低聚肽高剂量组小鼠脑组织中MDA含量极显著降低(P<0.01),降低率分别为13.34%和15.25%;其余各组小鼠脑组织中MDA含量无显著差异。与对照组相比,阳性对照组、高剂量组小鼠心肌组织中MDA含量极显著降低(P<0.01),降低率分别为9.14%和9.89%;其余各组小鼠心肌组织MDA含量无显著差异。这与2.1节的实验结果矛盾,可能是因为缺氧诱导小鼠机体氧敏感性途径活化,且机体抗氧化途径的关键酶上调,从而协同降低小鼠脑及心肌组织中MDA水平。由此可见,适当剂量的牦牛血低聚肽可以显著降低缺氧小鼠脑及心肌组织中MDA水平,提示其可降低机体脂质过氧化程度,保护机体免受氧化应激损伤。
2.3.2 H2O2含量
H2O2是活性氧代谢的副产物之一,H2O2含量的升高提示机体ROS生成量增加,机体氧化应激加剧,脂质过氧化损伤加重[25]。由表4可知,牦牛血低聚肽高、中、低剂量组均能减少小鼠脑和心肌组织中H2O2含量,与对照组比较,阳性对照组、高剂量组小鼠脑和心肌组织中H2O2含量均极显著降低(P<0.01);其余各组小鼠脑和心肌组织中H2O2含量均无显著差异。此结果提示牦牛血低聚肽可减少ROS生成或加速ROS分解,从而保护机体免受缺氧造成的氧化损伤。
表4 牦牛血低聚肽对常压缺氧小鼠脑组织及心肌组织H2O2含量的影响(n=15)
Table4 Effect of yak blood oligopeptides on H2O2content in myocardial and brain tissues of mice under atmospheric hypoxia (n= 15)
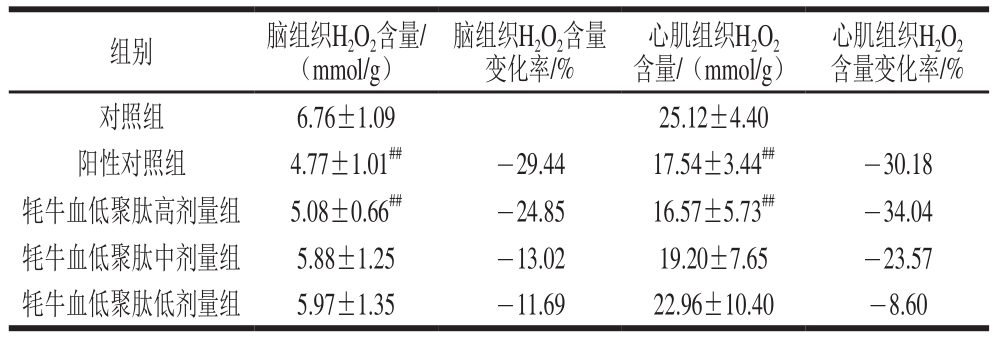
脑组织H2O2含量变化率/%组别 脑组织H2O2含量/(mmol/g)心肌组织H2O2含量/(mmol/g)心肌组织H2O2含量变化率/%对照组 6.76±1.09 25.12±4.40阳性对照组 4.77±1.01##-29.44 17.54±3.44##-30.18牦牛血低聚肽高剂量组 5.08±0.66##-24.85 16.57±5.73##-34.04牦牛血低聚肽中剂量组 5.88±1.25 -13.02 19.20±7.65 -23.57牦牛血低聚肽低剂量组 5.97±1.35 -11.69 22.96±10.40 -8.60
2.4 对抗氧化防御体系的保护作用
2.4.1 SOD活力
表5 牦牛血低聚肽对常压缺氧小鼠脑组织及心肌组织SOD活力的影响(n=15)
Table5 Effect of yak blood oligopeptides on SOD activity in myocardial and brain tissues of mice under atmospheric hypoxia (n= 15)
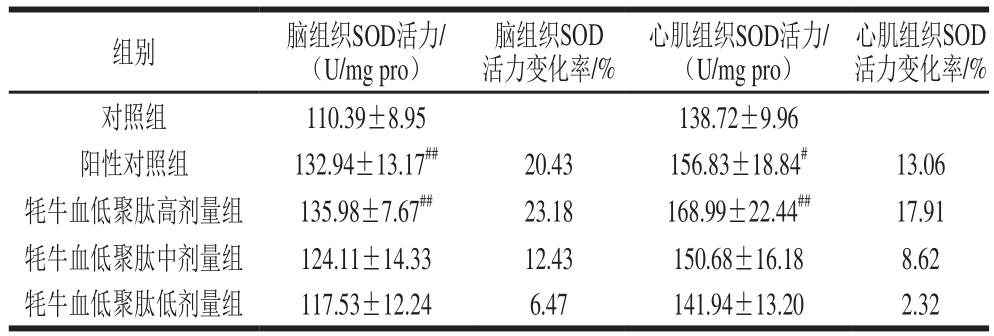
脑组织SOD活力变化率/%组别 脑组织SOD活力/(U/mg pro)心肌组织SOD活力/(U/mg pro)心肌组织SOD活力变化率/%对照组 110.39±8.95 138.72±9.96阳性对照组 132.94±13.17##20.43 156.83±18.84#13.06牦牛血低聚肽高剂量组 135.98±7.67##23.18 168.99±22.44##17.91牦牛血低聚肽中剂量组 124.11±14.33 12.43 150.68±16.18 8.62牦牛血低聚肽低剂量组 117.53±12.24 6.47 141.94±13.20 2.32
SOD能催化超氧化物阴离子发生歧化作用,是生物体内一种重要的抗氧化酶。表5结果显示,牦牛血低聚肽高、中、低剂量组均能升高小鼠脑和心肌组织中SOD活力;阳性对照组小鼠心肌组织中SOD活力升高率为13.06%,与对照组相比差异显著(P<0.05);高剂量组小鼠心肌组织中SOD活力极显著升高(P<0.01),升高率为17.91%;其余各组小鼠心肌组织中SOD活力无显著差异。与对照组相比,阳性对照组、高剂量组小鼠脑组织中SOD活力极显著升高(P<0.01),升高率分别为20.43%和23.18%;其余各组小鼠脑组织中SOD活力无明显差异。此结果提示,牦牛血低聚肽和阳性对照红景天均可以维持缺氧状态下机体SOD活力,加速自由基清除,缓解机体氧化应激,保护机体免受缺氧造成的氧化损伤。
2.4.2 GSH-Px活力
GSH-Px可以清除细胞内过氧化物,保护机体免受自由基损伤。表6结果显示,牦牛血低聚肽高、中、低剂量组均能升高小鼠脑和心肌组织中GSH-Px活力;与对照组比较,阳性对照组、高剂量组小鼠脑组织中GSH-Px活力升高率分别为29.65%和26.55%,差异显著(P<0.05);其余各组小鼠脑组织中GSH-Px活力无显著差异。与对照组相比,阳性对照组、中剂量组小鼠心肌组织中GSH-Px活力升高率分别为143.17%和134.78%,差异极显著(P<0.01);其余各组小鼠心肌组织中GSH-Px活力无显著差异。此结果提示,牦牛血低聚肽可以维持缺氧状态下小鼠心肌及脑组织的GSH-Px活力,减少自由基累积,减轻脂质过氧化损伤,保护机体免受缺氧造成的损伤。
表6 牦牛血低聚肽对常压缺氧小鼠脑组织及心肌组织GSH-Px活力的影响(n=15)
Table6 Effect of yak blood oligopeptides on GSH-Px activity in myocardial and brain tissues of mice under atmospheric hypoxia (n= 15)
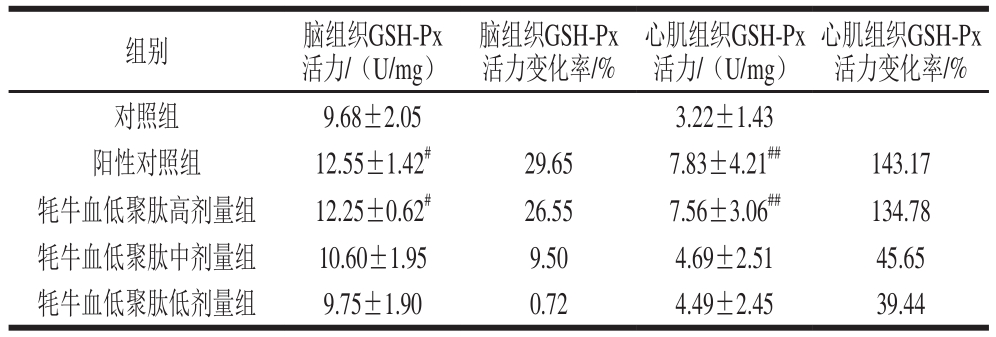
心肌组织GSH-Px活力变化率/%对照组 9.68±2.05 3.22±1.43阳性对照组 12.55±1.42#29.65 7.83±4.21##143.17牦牛血低聚肽高剂量组 12.25±0.62#26.55 7.56±3.06##134.78牦牛血低聚肽中剂量组 10.60±1.95 9.50 4.69±2.51 45.65牦牛血低聚肽低剂量组 9.75±1.90 0.72 4.49±2.45 39.44组别 脑组织GSH-Px活力/(U/mg)脑组织GSH-Px活力变化率/%心肌组织GSH-Px活力/(U/mg)
2.4.3 CAT活力
表7 牦牛血低聚肽对常压缺氧小鼠脑组织及心肌组织CAT活力的影响(n=15)
Table7 Effect of yak blood oligopeptides on CAT activity in myocardial and brain tissues of mice under atmospheric hypoxia (n= 15)
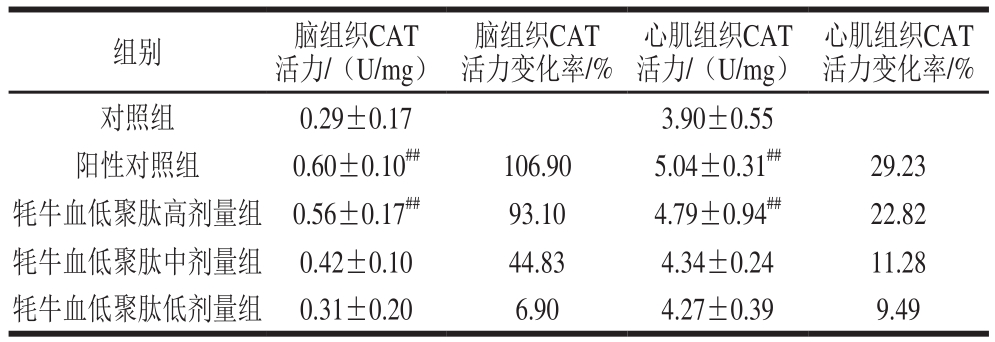
心肌组织CAT活力变化率/%对照组 0.29±0.17 3.90±0.55阳性对照组 0.60±0.10##106.90 5.04±0.31##29.23牦牛血低聚肽高剂量组 0.56±0.17##93.10 4.79±0.94##22.82牦牛血低聚肽中剂量组 0.42±0.10 44.83 4.34±0.24 11.28牦牛血低聚肽低剂量组 0.31±0.20 6.90 4.27±0.39 9.49组别 脑组织CAT活力/(U/mg)脑组织CAT活力变化率/%心肌组织CAT活力/(U/mg)
CAT是过氧化物酶体的标志酶,可催化分解体内H2O2,从而使细胞免受H2O2的损伤[25]。表7结果显示,牦牛血低聚肽高、中、低剂量组均能升高小鼠脑和心肌组织中CAT活力;与对照组相比,阳性对照组、高剂量组小鼠心肌和脑组织中CAT活力极显著升高(P<0.01);其余各组小鼠心肌和脑组织中CAT活力无显著差异。此结果提示,牦牛血低聚肽和红景天可发挥同样作用,即使缺氧状态下机体CAT活力也接近正常水平,但呈显著的剂量依赖性。
2.5 对能量代谢的影响
在持续的缺氧条件下,因氧气供给不足会导致ATP含量下降,机体各组织必须提高无氧代谢水平以获得足够能量。因此,无氧代谢能力是影响机体低氧应激状态下正常生理活动的关键因素之一[26]。
2.5.1 对无氧酵解的保护作用
表8 牦牛血低聚肽对常压缺氧小鼠脑组织及心肌组织LDH活力的影响(n=15)
Table8 Effect of yak blood oligopeptides on LDH activity in myocardial and brain tissues of mice under atmospheric hypoxia (n= 15)

心肌组织LDH活力变化率/%对照组 4 833.00±807.44 15 855.11±2 045.45阳性对照组 4 195.74±631.18#-13.19 12 684.55±2 174.62##-20.00牦牛血低聚肽高剂量组 4 152.49±612.62#-14.08 13 317.83±2 078.03#-16.00牦牛血低聚肽中剂量组 4 605.94±354.67 -4.70 14 377.98±2 808.14 -9.32牦牛血低聚肽低剂量组 4 474.62±552.82 -7.42 14 954.45±2 596.92 -5.68组别 脑组织LDH活力/(U/g)脑组织LDH活力变化率/%心肌组织LDH活力/(U/g)
LDH是一个与无氧代谢相关的酶,其活性升高是无氧酵解水平增强的重要标志之一[27],牦牛血低聚肽和红景天能够逆转这种变化,降低无氧酵解水平。如表8结果显示,牦牛血低聚肽高、中、低剂量组均能降低小鼠脑和心肌组织中LDH活力;相比于对照组,阳性对照组小鼠心肌组织中LDH活力极显著降低(P<0.01);高剂量组小鼠心肌组织中LDH活力显著降低(P<0.05);其余各组小鼠心肌组织中LDH活力无显著差异。相比于对照组,阳性对照组、高剂量组小鼠脑组织中LDH活力显著降低(P<0.05);其余各组小鼠脑组织中LDH活力无显著差异。此结论提示牦牛血低聚肽和红景天可发挥相同的作用,即在缺氧条件下降低脑和心肌组织中无氧酵解水平,从而保护机体免受缺氧损伤的影响。LDH活力的降低对小鼠脑及心肌组织中ATP的含量提升有一定的改善作用,与2.5.2节所得结果对应。
2.5.2 对能量代谢酶系活性的保护作用
表9 牦牛血低聚肽对常压缺氧小鼠大脑组织及心肌组织ATP含量的影响(n=15)
Table9 Effect of yak blood oligopeptides on ATP content in myocardial and brain tissues of mice under atmospheric hypoxia (n= 15)
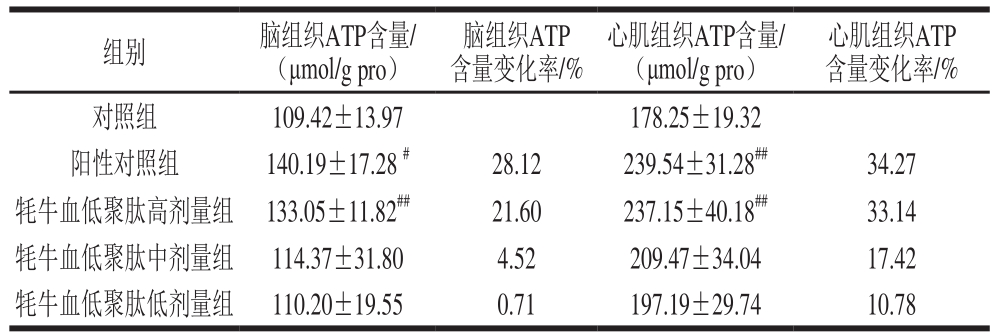
心肌组织ATP含量变化率/%对照组 109.42±13.97 178.25±19.32阳性对照组 140.19±17.28#28.12 239.54±31.28##34.27牦牛血低聚肽高剂量组 133.05±11.82##21.60 237.15±40.18##33.14牦牛血低聚肽中剂量组 114.37±31.80 4.52 209.47±34.04 17.42牦牛血低聚肽低剂量组 110.20±19.55 0.71 197.19±29.74 10.78组别 脑组织ATP含量/(μmol/g pro)脑组织ATP含量变化率/%心肌组织ATP含量/(μmol/g pro)
表9结果显示,牦牛血低聚肽高、中、低剂量组均能提高小鼠脑和心肌组织中ATP含量;与对照组相比,阳性对照组、高剂量组小鼠脑及心肌组织中ATP含量极显著升高(P<0.01);其余各组小鼠脑及心肌组织中ATP含量无显著差异。此结果提示,在缺氧条件下,牦牛血低聚肽能够和红景天胶囊发挥同样作用,即在一定程度上提高ATP含量,改善机体能量代谢并维持机体内环境的稳态。
3 讨 论
3.1 关于牦牛血低聚肽使用剂量问题
本实验使用国食健字G 20100243红景天胶囊,小鼠用量参照人用量(每日2 次,每次3 粒)进行折算,小鼠每日红景天用量为364 mg/kg。依据红景天用量,本实验设定牦牛血低聚肽低剂量组用量为365 mg/kg,中剂量组是低剂量组的2 倍用量,高剂量组是低剂量组的4 倍用量。另外,由于牦牛血低聚肽有苦味,后续开发牦牛血低聚肽功能食品需考虑包埋、微胶囊技术等解决低聚肽苦味问题。
3.2 牦牛血低聚肽体内抗氧化能力
前期实验表明牦牛血低聚肽具有良好的体外抗氧化能力[20],本实验表明牦牛血低聚肽具有良好的体内抗氧化能力,能够显著提高小鼠血清中SOD活力、GSH-Px活力和T-AOC(P<0.05);降低小鼠血清中MDA含量(P>0.05)。此结果说明牦牛血低聚肽能显著升高小鼠体内抗氧化酶活力、抑制脂质过氧化、加速清除体内自由基,此结果提示牦牛血低聚肽可作为抗缺氧保健食品做进一步研究。
3.3 牦牛血低聚肽抗缺氧活性及可能作用机制
常压耐缺氧实验是中国《保健食品检验与评价技术规范》[27]中评判保健食品抗缺氧功效的方法之一。小鼠在密闭瓶中的存活时间越长,说明小鼠的耐缺氧能力越强。牦牛血低聚肽高、中、低剂量组均能够延长小鼠的存活时间,并呈现剂量依赖性;与阳性对照组(红景天组)比较,牦牛血低聚肽高剂量组存活时间延长率差异极显著(P<0.01),初步证实牦牛血低聚肽具有良好的抗缺氧功效。值得说明的是,可能是小鼠缺氧诱导时间较短,未能观察到牦牛血低聚肽中剂量组对缺氧小鼠大脑及心肌组织的各项生化指标的显著改善[28]。
与对照组相比,经高剂量牦牛血低聚肽干预后能够极显著降低常压缺氧小鼠脑和心肌组织中MDA(P<0.01)、H2O2(P<0.01)的含量,减少自由基的蓄积和脂质过氧化。正常情况下,机体内存在完善的氧化-还原体系,但在缺氧条件下大量生成自由基能够抑制抗氧化酶活性,导致氧化还原状态失衡,加重组织损伤[29]。本实验结果与文献[30]报道结果一致,高剂量牦牛血低聚肽能够提高常压缺氧小鼠脑和心肌组织中SOD(P<0.01)、GSH-Px(心肌组织中P<0.01,脑组织中P<0.05)、CAT(P<0.01)活力,维持机体内自由基代谢稳态。LDH是参与糖无氧酵解和糖异生的重要酶[30],牦牛血低聚肽能够降低无氧酵解水平,常压缺氧小鼠脑和心肌组织中LDH活力与对照组相比极显著降低(P<0.01)。高剂量牦牛血低聚肽能极显著提升常压缺氧小鼠脑和心肌组织中的ATP含量(P<0.01),进而可能对小鼠的低氧耐受有积极影响,相关机制有待进一步研究。
以上结果说明,牦牛血低聚肽作为抗氧化剂可通过清除体内过多的自由基、抑制氧化应激导致的脂质过氧化、维持机体抗氧化酶系活性、维持线粒体内氧化磷酸化的正常进行,提高机体低氧耐受性。关于其具体的作用机制、信号通路将在后续实验中做进一步研究。
4 结 论
牦牛血低聚肽具有良好的体内抗氧化活性,能够显著提高小鼠血清中SOD活力、GSH-Px活力和T-AOC(P<0.05);降低小鼠血清中MDA含量(P>0.05),由此可见,牦牛血低聚肽具有良好的体内体外抗氧化活性。
作为具有良好抗氧化能力的牦牛血低聚肽也具有良好的抗缺氧活性,高、中、低剂量组均能够延长小鼠的存活时间,并呈现剂量依赖性;与阳性对照组(红景天组)比较,牦牛血低聚肽高剂量组存活时间延长率差异极显著(P<0.01)。与对照组相比,经高剂量牦牛血低聚肽干预后能够极显著降低缺氧小鼠脑和心肌组织中MDA含量(P<0.01)、H2O2含量(P<0.01)、LDH活力(P<0.01),显著提高缺氧小鼠脑和心肌组织中SOD活力(P<0.01)、GSH-Px活力(心肌组织中极显著升高(P<0.01),脑组织中显著升高(P<0.05)、CAT活力(P<0.01),极显著提高缺氧小鼠脑和心肌组织中ATP含量(P<0.01)。
以上结果表明:牦牛血低聚肽具有良好的抗缺氧活性,能够保护常压密闭缺氧小鼠的大脑及心脏。牦牛血低聚肽能够缓解缺氧对机体导致的氧化应激损伤,作用机制可能与清除自由基,抑制脂质过氧化,维持机体抗氧化酶系活性及维持线粒体内氧化磷酸化的正常进行有关。
参考文献:
[1] BAILEY D M, BARTSCH P, KNAUTH M, et al. Emerging concepts in acute mountain sickness and high-altitude cerebral edema: from the molecular to the morphological[J]. Cell Molecule Life Science, 2009,66: 3583-3594. DOI:10.1007/s00018-009-0145-9.
[2] KE T, WANG J, SWENSON E R, et al. Effect of acetazolamide and gingko biloba on the human pulmonary vascular response to an acute altitude ascent[J]. High Altitude Medicine & Biology, 2013, 14(2):162-1672013. DOI:10.1089/ham.2012.1099.
[3] RITCHIE N D, BAGGOTT A V, TODD W T A. Acetazolamide for the prevention of acute mountain sicknessu: a systematic review and meta-analysis[J]. Journal of Travel Medicine, 2012, 19(5): 298-307.DOI:10.1111/j.1708-8305.2012.00629.x.
[4] 魏雅萍, 张才骏, 杨荣珍, 等. 大通家牦牛及含野血牦牛血清亲血色蛋白多态性的比较研究[J]. 草食家畜, 1996(1): 22-23.DOI:10.16863/j.cnki.1003-6377.1996.01.007.
[5] 张才骏, 马凤莲, 李黎, 等. 互助白牦牛血液蛋白质多态性的研究[J].青海畜牧兽医杂志, 1996, 26(3): 9-11.
[6] 魏稚萍. 大通家牦牛及含野血牦牛血清运铁蛋白多态性的比较研究[J]. 甘肃畜牧兽医, 1997(5): 18-20. DOI:10.15979/j.cnki.cn62-1064/s.1997.05.007.
[7] 姚星辰, 许博林, 铁军, 等. 牦牛活性蛋白对小鼠抗缺氧抗疲劳能力及血糖的影响[J]. 时珍国医国药, 2014, 25(11): 2637-2639.
[8] BAKONYI T, RADAK Z. High altitude and free radicals[J]. Journal of Sports Science and Medicine, 2004, 3: 64-69.
[9] MUTHURAJU S, MAITI P, SOLANKI P, et al. Acetylcholinesterase inhibitors enhance cognitive functions in rats following hypobaric hypoxia[J]. Behavioral Brain Research, 2009, 203: 1-14. DOI:10.1016/j.bbr.2009.03.026.
[10] SHUKITT-HALE B, STILLMAN M J, WELCH D I, et al. Hypobaric hypoxia impairs spatial memory in an elevation-dependent fashion[J].Behavioral Neural Biology, 1994, 62: 244-252. DOI:10.1016/S0163-1047(05)80023-8.
[11] FAN Pengcheng, MA Huiping, JING Linlin, et al. The antioxidative effect of a novel free radical scavenger 4’-hydroxyl-2-substituted phenylnitronyl nitroxide in acute high-altitude hypoxia mice[J].Biological & Pharmaceutical Bulletin, 2013, 36(6): 917-924.DOI:10.1248/bpb.b12-00854.
[12] MASTER S, GOTTSTEIN J, BLEI A T. Cerebral blood flow and the development of ammonia-induced brain edema in rats after portacaval anastomosis[J]. Hepatology, 1999, 30: 876-880. DOI:10.1002/hep.510300428.
[13] SWENSON E R, BARTSCH P. High altitude: human adaptation to hypoxia[M]. New York: Springer, 2014: 57-170; 393-397; 405; 435.
[14] BAILEY D M, DAVIES B. Acute mountain sickness: prophylactic benefits of antioxidant vitamin supplementation at high altitude[J].High Altitude Medicine and Biology, 2001, 2(1): 21-29.DOI:10.1089/152702901750067882.
[15] SUBUDHI A W, JACOBS K A, HAGOBIAN T A, et al. Changes in ventilatory threshold at high altitude: effect of antioxidants[J].Medicine and Science in Sports and Exercise, 2006, 38(8): 1425-1431.DOI:10.1249/01.mss.0000228939.32281.39.
[16] PATIR H, SARADA S K S, SINGH S, et al. Quercetin as a prophylactic measure against high altitude cerebral edema[J]. Free Radical Biology and Medicine, 2012, 53(4): 659-668.
[17] PAUL S, ARYA A, GANGWAR A, et al. Size restricted silymarin suspension evokes integrated adaptive response against acute hypoxia exposure in rat lung[J]. Free Radical Biology and Medicine, 2016, 96:139-151. DOI:10.1016/j.freeradbiomed.2016.04.020.
[18] SCHREIBER M, TROJAN S. Protective effect of flavonoids and tocopherol in high altitude hypoxia in the rat: comparison with ascorbic acid[J]. Ceskoslovenská Fysiologie/Ústrední Ústav Biologicky, 1998,47: 51-52.
[19] AL-HASHEM F H. Potential roles for vitamins E and C in combination in modulating exhaustive swimming and high altitudeassociated lung injury in rats[J]. Saudi Medicine Journal, 2012, 33:367-374.
[20] 杜昕. 菌酶联合制备牦牛血抗氧化肽及其分离纯化的研究[D].雅安: 四川农业大学, 2016: 19-52.
[21] 杜昕, 李诚, 肖岚, 等. 酶解牦牛血发酵液制备抗氧化肽工艺优化[J]. 核农学报, 2017, 31(2): 325-333. DOI:10.11869/j.issn.100-8551.2017.02.0325.
[22] 杜昕, 肖岚, 李诚, 等. 枯草芽孢杆菌发酵牦牛血制备抗氧化肽工艺优化[J]. 食品与机械, 2016, 32(3): 165-168; 205. DOI:10.13652/j.issn.1003-5788.2016.03.036.
[23] 张雨舟. 红景天药理作用研究进展及应用前景分析[J]. 安徽农业科学, 2015, 43(25): 77-79; 82. DOI:10.3969/j.issn.0517-6611.2015.25.030.
[24] 卫生部. 保键食品检验与评价技术规范[M]. 北京: 卫生部, 2003: 94.
[25] 樊鹏程. 新型自由基清除剂抗高原实验时间较早缺氧作用及保护机制研究[D]. 兰州: 第四军医大学, 2013: 17-65.
[26] MARRIF H, JUURLINK B H. Astrocytes to hypoxia by increasing glycolytic capacity[J]. Jounal of Neuroscience Research, 1999, 57(2):255-260. DOI:10.1002/(SICI)1097-4547(19990715)57:2<255::AIDJNR11>3.0.CO;2-6.
[27] MARTI H H, JUNG H H, PFEILSCHIFTER J, et al. Hypoxia and cobalt stimulate lactate dehydrogenase (LDH) activity in vascular smooth muscle cells[J]. Pflügers Archiv, 1994, 429(2): 216-222.DOI:10.1007/BF00374315.
[28] 楚秉泉. 西藏芜菁的抗缺氧功能成分分离及其作用机制研究[D].杭州: 浙江大学, 2017: 21-78.
[29] MAITI P, SINGH S B, SHARMA A K, et al. Hypobaric hypoxia induces oxidative stress in rat brain[J]. Neurochemistry International,2006, 49: 709-716. DOI:10.1016/j.neuint.2006.06.002.
[30] 景临林, 武柠子, 杨颖, 等. 黄芩素-7-甲醚对高原缺氧小鼠脑组织保护作用研究[J]. 天然产物研究与开发, 2018, 30(6): 1054-1060.
Antihypoxia Activity of Yak Blood Oligopeptides and Underlying Mechanism
XIAO Lan1,2, WANG Wei2, WU Yujiao2, DU Xin1, LI Cheng1,*
(1. College of Food Science, Sichuan Agricultural University, Ya’an 625014, China;2. College of Food Science and Technology, Sichuan Tourism College, Chengdu 610100, China)
Abstract:This work was performed to explore the antihypoxia activity of yak blood oligopeptides and to elucidate the underlying mechanism. A total of 75 mice were randomly divided into hypoxia model, positive control (Rhodiola rosea L.roots) and high-, middle-, and low-dose yak blood oligopeptide groups. All mice were administered by gavage for 30 continuous days. At 60 min after the last administration, they were kept in airtight volumetric flasks until they stopped breathing and then myocardial and brain tissues were harvested immediately for the measurement of biochemical parameters.The results showed that yak blood oligopeptides had good antianoxic activity, and could protect brain and heart tissues of mice from atmospheric hypoxia. Compared with the model group, yak blood oligopeptides at high dose could significantly reduce malondialdehyde (MDA) content (P < 0.01), H2O2level (P < 0.01) and lactate dehydrogenase (LDH) activity(P < 0.01) in brain and myocardial tissues of atmospheric anoxia mice, improve superoxide dismutase (SOD) activity(P < 0.01), glutathione peroxidase (GSH-Px) activity (P < 0.01 for myocardial tissue, P < 0.05 for brain tissue) and catalase activity (P < 0.01), and increase the content of adenosine 5’-triphosphate (P < 0.01). The above results showed that yak blood oligopeptides could alleviate oxidative stress injury caused by hypoxia in the body, and the mechanism may be related scavenging free radicals, inhibiting lipid peroxidation, and maintaining antioxidant enzyme activities and normal oxidative phosphorylation in mitochondria.
Keywords:yak blood oligopeptide; antihypoxia activity; free radicals; lipid peroxidation; antioxidant enzyme
XIAO Lan, WANG Wei, WU Yujiao, et al. Antihypoxia activity of yak blood oligopeptides and underlying mechanism[J]. Food Science,2018, 39(23): 149-154. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201823023. http://www.spkx.net.cn
肖岚, 王威, 吴玉娇, 等. 牦牛血低聚肽抗缺氧活性及其作用机制[J]. 食品科学, 2018, 39(23): 149-154. DOI:10.7506/spkx1002-6630-201823023. http://www.spkx.net.cn
引文格式:
文章编号:1002-6630(2018)23-0149-06
文献标志码:A
中图分类号:TS201.1
DOI:10.7506/spkx1002-6630-201823023
*通信作者简介:李诚(1964—),男,教授,硕士,研究方向为畜产品加工与质量安全控制。E-mail:lichenglcp@163.com
第一作者简介:肖岚(1981—),女,副教授,博士研究生,研究方向为畜产品加工与安全控制。E-mail:30430664@qq.com
基金项目:四川省科技厅应用基础项目(2018JY0317);四川省教育厅自然科学重点项目(17ZA0289)
收稿日期:2018-03-22








