表1 单一护色剂质量浓度优化设计
Table1 Optimization design for individual use of browning inhibitors at different concentrations
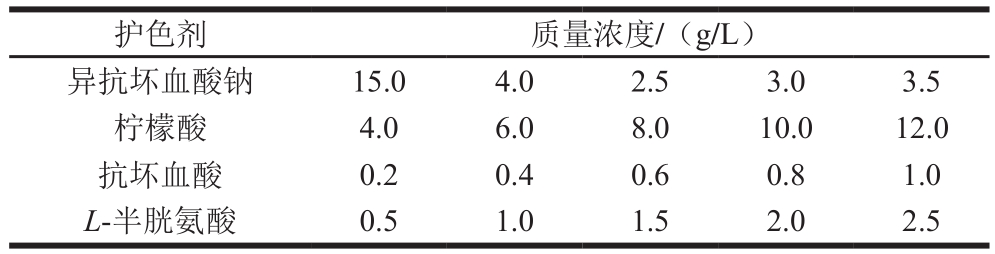
护色剂 质量浓度/(g/L)异抗坏血酸钠 15.0 4.0 2.5 3.0 3.5柠檬酸 4.0 6.0 8.0 10.0 12.0抗坏血酸 0.2 0.4 0.6 0.8 1.0 L-半胱氨酸 0.5 1.0 1.5 2.0 2.5
双孢蘑菇(Agaricus bisporus)又称白蘑菇,是一种食用广泛、营养价值丰富的食用菌,色质白嫩,肉质肥厚[1],其富含甘露醇、菌糖、有机碱、矿物质和蛋白质,是典型的高蛋白、低脂肪、低能量的菌类保健食品。近年来双孢蘑菇市场需求量与日俱增,随之而来的双孢蘑菇采后保鲜及加工问题被广泛关注和研究[2]。双孢蘑菇含水量高,组织结构柔嫩,菌盖表面没有保护结构,易损伤褐变,常温下采后2 d内菇体内的水分就会大量蒸发散失,使得双孢蘑菇干扁皱缩,商品价值和食用价值大大降低[3]。
随着冷链物流的发展,冷冻技术被应用于双孢蘑菇的采后加工过程[4],一定程度上解决了双孢蘑菇的褐变问题。冷冻贮藏是有效延长农产品货架期的加工方式之一,能够最大限度地保持其感官品质和营养价值。李清明等[5]对冷冻双孢蘑菇进行护色研究,结果表明氯化钠和异抗坏血酸钠溶液作为护色液,对双孢蘑菇褐变有显著抑制作用,但其未对双孢蘑菇冷冻方面深入研究,仅停留在护色层面。Jaworska[6]、Islam[7]等从冷冻角度对双孢蘑菇的质构进行研究,结果表明通过抗坏血酸和柠檬酸预处理的双孢蘑菇经冷冻处理比未经冷冻处理的质地更好。Júnior等[8]研究发现,-20 ℃低温保存不能有效保持双孢蘑菇的菌丝活力,但-75 ℃的低温冷冻保存可以有效保持双孢蘑菇的菌丝活力。以上研究都表明,冷冻能够有效保留食用菌营养价值,并保持其良好的质构特性。然而,常规冷冻后的双孢蘑菇,解冻后汁液流失过高,双孢蘑菇容易出现断裂、皱缩、褐变及菇形坍塌等品质劣变现象,此类问题仍未得到有效的解决[9]。因此,开发一种适用于双孢蘑菇的护色预处理技术以及冻融工艺成为提升冷冻双孢蘑菇品质的关键。
本研究以双孢蘑菇为材料,优化复合护色剂的配比,并比较不同冻融方法(-80、-40、-20 ℃冷冻,4 ℃或25 ℃解冻)对经过复合护色剂预处理的双孢蘑菇品质的影响,为提升冷冻双孢蘑菇的品质提供技术支撑。
双孢蘑菇由江苏天丰生物科技有限公司提供。
异抗坏血酸钠、抗坏血酸、柠檬酸、L-半胱氨酸国药集团化学试剂有限公司;过氧化物酶(peroxidase,POD)试剂盒 南京建成生物工程研究所。
AL1043电子天平 瑞士梅特勒-托利多仪器有限公司;Spectra Max 190酶标仪 美国美谷分子仪器(上海)有限公司;TA-XT2i质构仪 英国Stable Micro Systems公司;HH-6数显恒温水浴锅 江苏国华电器有限公司;TM3000扫描电子显微镜 日本日立公司;DW-40W10医用低温保存箱 青岛海尔特种电器有限公司;ULT-1386-5-V42超低温冰箱 赛默飞世尔科技(中国)有限公司;NMI20-Analyst 核磁共振分析仪苏州(上海)纽迈电子科技有限公司;DT-8891E电热偶深圳华盛昌机械实业有限公司。
1.3.1 护色处理
挑选新鲜无机械损伤的双孢蘑菇,经去根和清洗后,切成(10.0±0.5)mm厚的双孢蘑菇片,按料液比1∶4(m/V)加入护色剂,25 ℃浸泡处理30 min,双孢蘑菇经护色剂浸泡后,置于网格盘自然沥干后,立即测定褐变度。按照表1的设计进行双孢蘑菇冷冻前的单一护色剂优化;在单一护色剂质量浓度优化研究结果的基础上,进一步利用4因素3水平的正交试验(表2)优化异抗坏血酸钠、柠檬酸、抗坏血酸、L-半胱氨酸4 种护色剂的最佳配比。
表1 单一护色剂质量浓度优化设计
Table1 Optimization design for individual use of browning inhibitors at different concentrations

护色剂 质量浓度/(g/L)异抗坏血酸钠 15.0 4.0 2.5 3.0 3.5柠檬酸 4.0 6.0 8.0 10.0 12.0抗坏血酸 0.2 0.4 0.6 0.8 1.0 L-半胱氨酸 0.5 1.0 1.5 2.0 2.5
表2 异抗坏血酸钠、柠檬酸、抗坏血酸、L-半胱氨酸复合护色剂的质量浓度设计
Table2 Three concentrations levels of sodium isoascorbate, citric acid,ascorbic acid and L-cysteine for their combined use g/L

水平 A异抗坏血酸钠质量浓度 B柠檬酸质量浓度 C抗坏血酸质量浓度 D L-半胱氨酸质量浓度1 2.0 6.0 0.4 1.0 2 2.5 8.0 0.6 1.5 3 3.0 10.0 0.8 2.0
1.3.2 褐变抑制率测定
称取5.0 g经护色剂处理的双孢蘑菇切片,冰浴条件下用0.2 mol/L磷酸盐缓冲液(pH 7.0)匀浆并定容至25 mL,5 000 r/min离心10 min提取色素,取上清液,用酶标仪在450 nm波长处测吸光度。褐变度抑制率由式(1)计算。
式中:A0、Am分别表示新鲜双孢蘑菇和经护色剂处理后双孢蘑菇的吸光度。
1.3.3 冷冻过程中双孢蘑菇温度变化曲线绘制
将电热偶的温度传感探头插入双孢蘑菇切片中心,将双孢蘑菇切片分别放入-20、-40、-80 ℃冰箱内,每30 s记录1 次双孢蘑菇中心温度,绘制冷冻过程中的温度变化曲线。
1.3.4 POD活力测定
POD活力的测定参考文献[10]。称取5.0 g双孢蘑菇,与生理盐水按照料液比1∶9(m/V)在冰浴条件下制备成1 g/10 mL的组织匀浆液,3 500 r/min离心10 min,取上清液进行POD活力测定。37 ℃条件下每毫克组织蛋白每分钟催化产生1 μg底物的酶量定义为一个POD活力单位,单位为U/mg。
1.3.5 冷冻双孢蘑菇的解冻温度优化
将在不同温度下冷冻25 min的双孢蘑菇分别置于4 ℃和25 ℃解冻60 min。通过测定汁液流失率研究不同解冻温度对双孢蘑菇品质的影响。冷冻双孢蘑菇在解冻前称质量,解冻后用滤纸拭去双孢蘑菇表面的汁液,然后称质量,计算样品解冻后减少的质量占样品原质量的百分率,即为汁液流失率。
1.3.6 双孢蘑菇扫描电子显微镜观察
先将双孢蘑菇切成1 mm×1 mm×1 mm正方体,然后在体积分数4%戊二醛固定液中固定1 h,用0.1 mol/L磷酸盐缓冲液(pH 7.8)漂洗3 次,每次15 min。再依次用体积分数为50%、70%、80%、90%、100%的叔丁醇脱水,每次15 min;然后将样品冻干后,将样品固定在样品托上,采用离子溅射仪在观察样品的横断面上喷金,扫描电子显微镜(500 倍)观察[11]。
1.3.7 双孢蘑菇水分分布的测定
利用NMI20-Analyst核磁共振分析仪测定双孢蘑菇横向弛豫时间(T2)曲线。仪器参数:测量温度32 ℃,采用Carr-Purcell-Meiboom-Gill脉冲序列,线圈直径15 mm,回波数4 000,累计扫描4 次。采用核磁共振方法测定双孢蘑菇中的水分分布状态[12],利用核磁成像仪检测双孢蘑菇中间层面水信号的变化。使用横向弛豫时间T2加权成像序列,检测参数为:重复时间1 400 ms;回波时间85 ms;采集次数4 次。双孢蘑菇水分分布测定区域(从双孢蘑菇片中间切取5 mm)如图1所示。
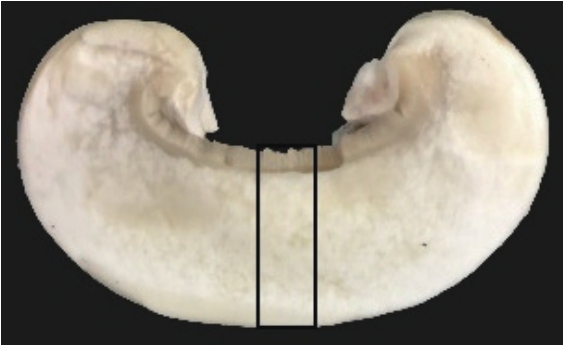
图1 样品测定区域示意图
Fig.1 Schematic diagram of the sample measurement area
1.3.8 双孢蘑菇质构特性的测定
解冻后的双孢蘑菇采用TA-XT2i质构仪进行质构特性的测定[13],测定参数为:P6探头,探头预备速率2.00 mm/s,测定速率1.00 mm/s,测后速率5.00 mm/s,探头插入双孢蘑菇中心部位,深度5 mm。
采用Origin 8.5.1软件进行数据处理和作图,JMP 10软件进行数据统计分析,利用Duncan法进行多重分析,P<0.05表示差异显著。
添加护色剂是果蔬加工过程中常用的护色方法,其中异抗坏血酸钠、柠檬酸、抗坏血酸、L-半胱氨酸是几种常见的护色剂。异抗坏血酸钠是一种公认安全的食品添加剂,可将体系中的醌类及其衍生物还原成酚类,防止醌类物质形成黑色素[14],从而起到护色作用;柠檬酸是金属离子螯合剂,可以螯合Cu2+、Mg2+、Fe2+多价金属离子,这些金属离子通常为酶的作用辅基,缺乏它们会使酶的催化活性下降;抗坏血酸是一种抗氧化剂,可以清除氧自由基[15];L-半胱氨酸抑制双孢蘑菇褐变的作用机理在于它既可作用于产物多巴醌生成稳定的无色物质,又可通过与酶蛋白不可逆结合而作用于酶蛋白[16]。由图2可知,随着护色剂使用质量浓度的升高,双孢蘑菇抑制率总体趋势都是先增后降,异抗坏血酸钠、柠檬酸、抗坏血酸、L-半胱氨酸的质量浓度分别为2.5、8.0、0.6、1.5 g/L时,对双孢蘑菇的褐变抑制率达到最高。发生这种现象的原因可能为:在一定质量浓度范围内异抗坏血酸钠、抗坏血酸、柠檬酸、L-半胱氨酸对过氧化物酶活性起着很好的抑制作用,超过一定质量浓度后,双孢蘑菇自身发生非酶促褐变,褐变程度加深,抑制效果下降[17]。
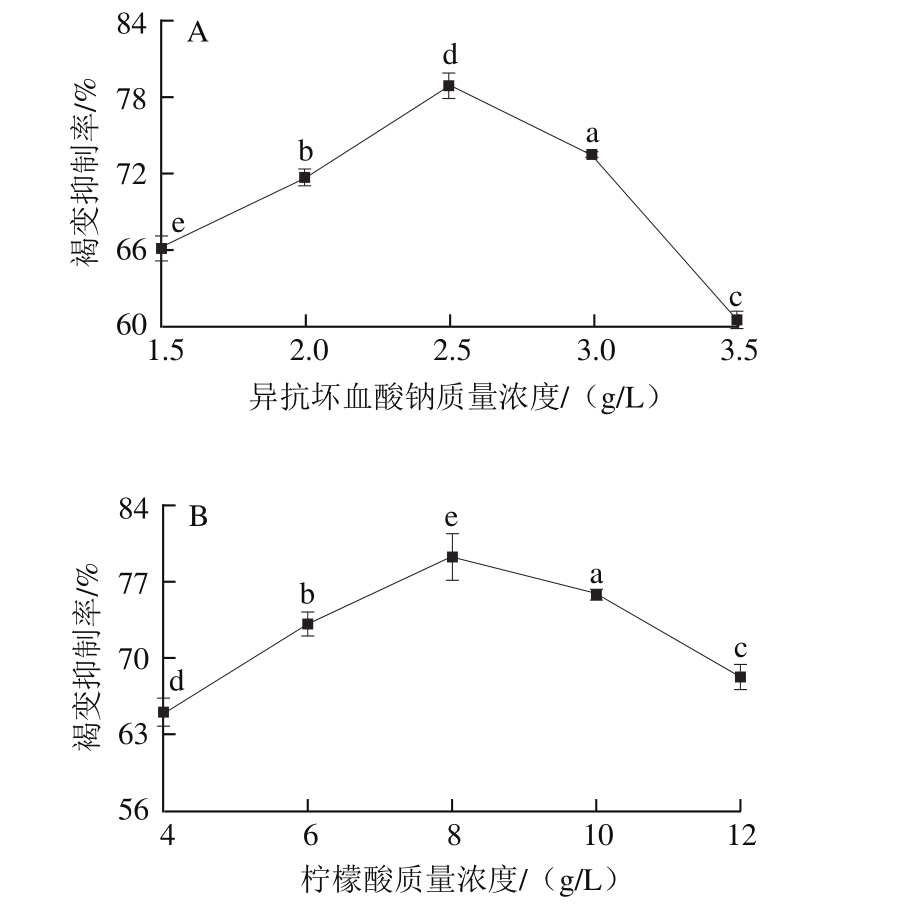
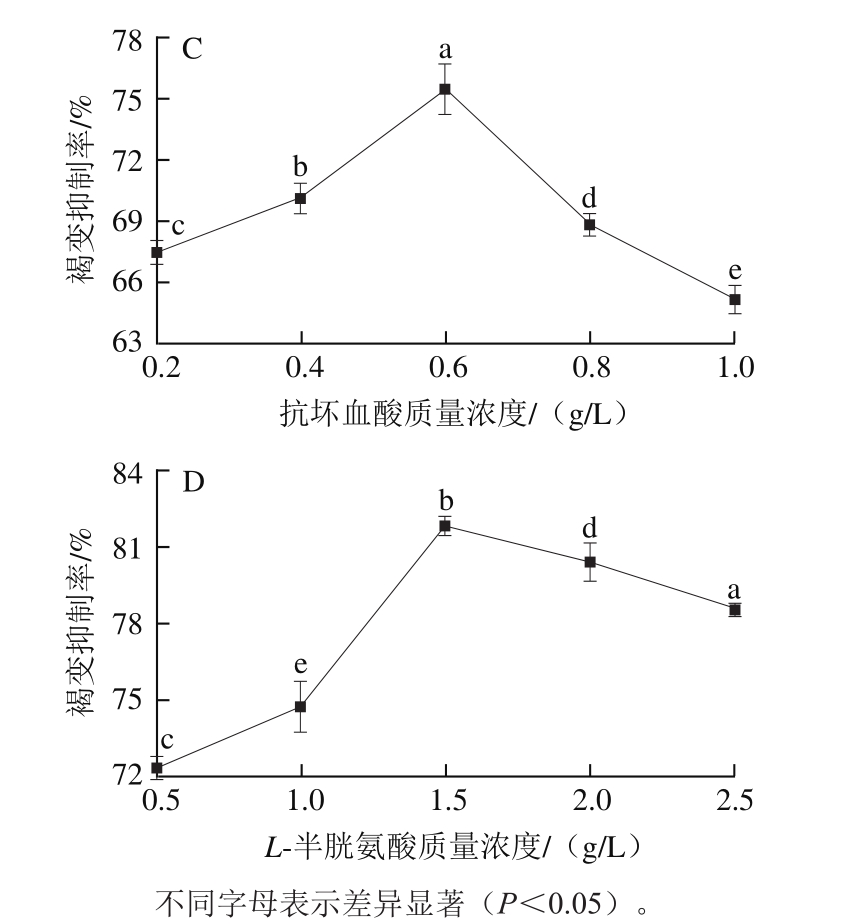
图2 不同质量浓度异抗坏血酸钠(A)、柠檬酸(B)、抗坏血酸(C)、L-半胱氨酸(D)对双孢蘑菇褐变抑制率的影响
Fig.2 Effects of isoascorbic acid sodium (A), citric acid (B),ascorbic acid (C), L-cysteine (D) on the browning of Agaricus bisporus
表3 双孢蘑菇复合护色剂正交试验设计方案与结果
Table3 Orthogonal array design with experimental results for optimization of combined use of four browning inhibitors

注:同列肩标字母不同表示差异显著(P<0.05)。
试验编号 因素水平 褐变抑制率/%A B C D 1 1 1 1 1 78.91±1.56e2 1 2 2 2 83.91±0.94a3 1 3 3 3 69.51±1.02e4 2 1 2 3 63.54±2.32f5 2 2 3 1 62.51±1.46f6 2 3 1 2 82.88±0.38b7 3 1 3 2 81.63±1.72c8 3 2 1 3 82.02±0.42c9 3 3 2 1 80.06±1.31d平均值1 77.443 74.693 81.270 73.827平均值2 69.643 76.147 75.837 82.807平均值3 81.237 77.483 71.217 71.690极差 11.594 2.790 10.053 11.117最佳组合 A3B3C1D285.32±0.25
极差和均值越大,对样品褐变抑制率影响越大,由表3极差和均值大小可知,4 种护色剂对双孢蘑菇切片褐变抑制率大小顺序为:异抗坏血酸钠(A)>L-半胱氨酸(D)>抗坏血酸(C)>柠檬酸(B),所测定复合护色剂最佳组合为A3B3C1D2,即3.0 g/L异抗坏血酸钠、10.0 g/L柠檬酸、0.4 g/L抗坏血酸、1.5 g/L L-半胱氨酸,经验证该组合复合护色剂处理的双孢蘑菇褐变抑制率为85.32%,比使用单一护色剂和其他复合护色剂护色效果显著提高,抑制效果佳。与何继文等[18]对复合护色剂研究结果一致,利用复合护色剂各成分之间的协同作用,能有效提高对褐变抑制效果。
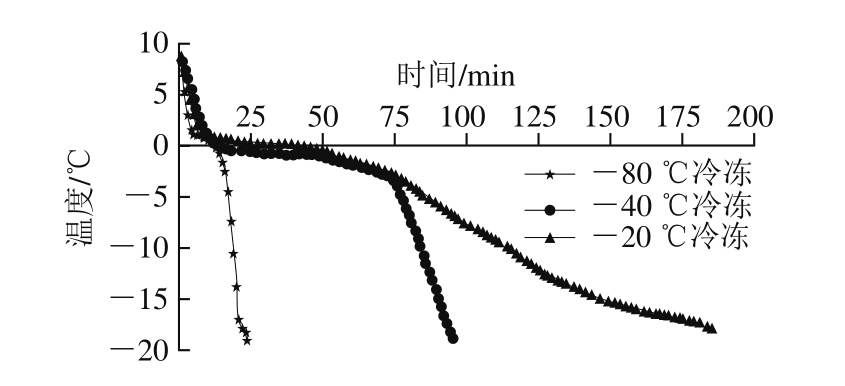
图3 不同冷冻温度下双孢蘑菇的中心温度变化曲线
Fig.3 Temperature curves of Agaricus bisporus at different frozen temperatures
冷冻的温度和时间是影响细胞组织结构的两个重要变量[19],冷冻温度越低,形成的冰晶体越小,对双孢蘑菇的微观结构破坏越小[20]。不同冷冻温度下双孢蘑菇的中心温度变化如图3所示,-80 ℃下冷冻25 min左右双孢蘑菇的中心温度达到-18 ℃,而-40 ℃与-20 ℃冷冻条件下,双孢蘑菇的中心温度降至-18 ℃所用时间分别为93.5 min和185 min。-80 ℃冷冻双孢蘑菇相比于-40 ℃与-20 ℃所用的降温时间短,冻结速率快,双孢蘑菇冰晶小,对细胞结构破坏小。
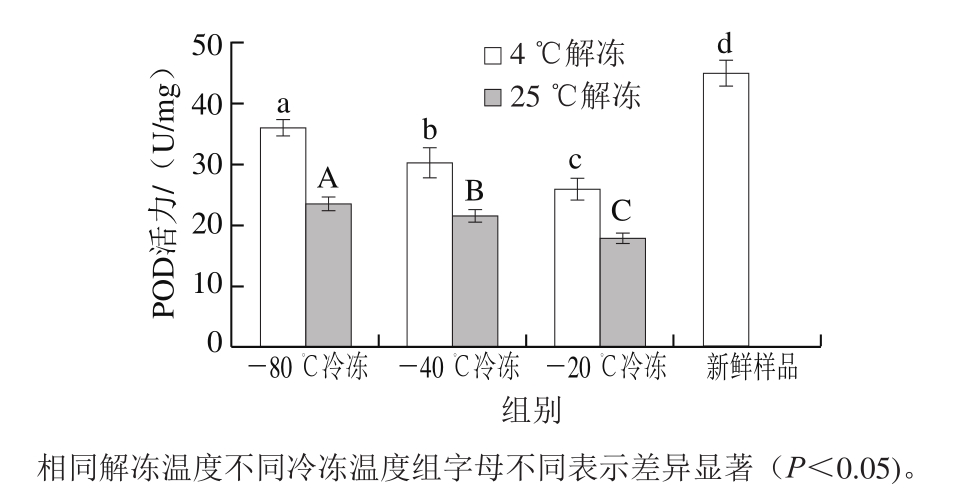
图4 不同冻融温度对双孢蘑菇POD活力的影响
Fig.4 Effects of different freeze-thaw temperatures on POD activity of Agaricus bisporus
POD是双孢蘑菇体内广泛分布的一类氧化还原酶,可催化由过氧化氢参与的各种物质的氧化反应,其活力能有效反映双孢蘑菇抗氧化能力[21]。如图4所示,4 ℃解冻的冷冻双孢蘑菇POD活力显著高于25 ℃解冻的双孢蘑菇。随着冷冻温度升高,酶活力降低,其中-80 ℃冷冻、4 ℃解冻双孢蘑菇的POD活力最高,为35.9 U/mg,最接近新鲜样品的POD活力(45 U/mg),而-20 ℃冷冻、25 ℃解冻的双孢蘑菇的POD活力最低,为17.7 U/mg。-80 ℃冷冻、4 ℃解冻的双孢蘑菇POD活力最高,表明-80 ℃冷冻4 ℃解冻双孢蘑菇抗氧化能力较好,品质保持良好。
含水率较高的双孢蘑菇在冻结时,其体系内的水分转变为冰晶体,细胞结构中的蛋白质等组分会发生一定的变性,结构类物质会有所流失,导致整个体系的持水性显著下降[22];当解冻时冰晶融化成的水分并不能完全被双孢蘑菇细胞重新吸收,就会产生汁液流失。如图5所示,25 ℃解冻的双孢蘑菇汁液流失率显著高于4 ℃解冻的双孢蘑菇(P<0.05)。-80 ℃冷冻、4 ℃解冻的双孢蘑菇汁液流失率最低,为1.98%,而-20 ℃冷冻、25 ℃解冻的双孢蘑菇汁液流失率最高,为17.15%。造成这种现象的原因为-20 ℃冷冻、25 ℃解冻组冻结速率小,冰晶大,细胞结构破坏大,解冻速率大,冰晶融化速率快,汁液流失率高[23]。
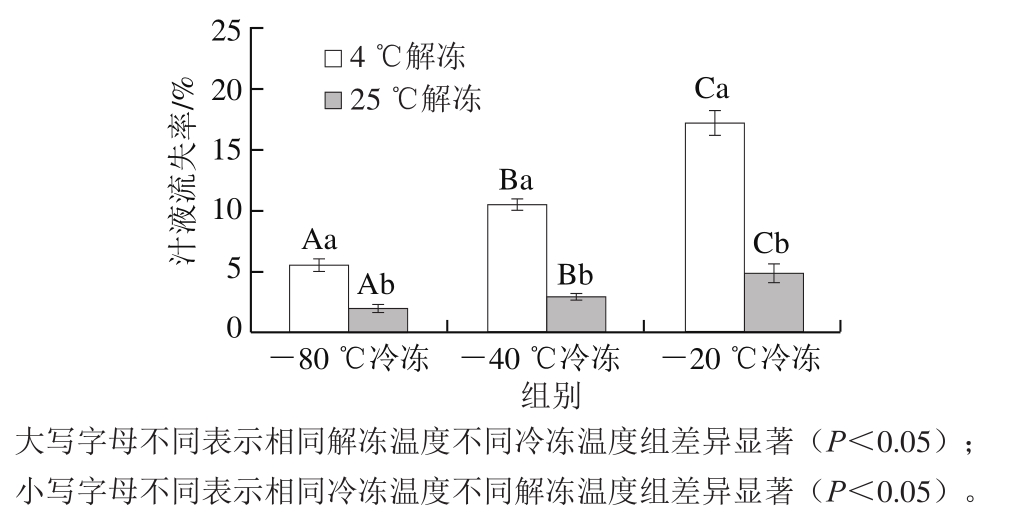
图5 冻融温度对双孢蘑菇汁液流失率的影响
Fig.5 Effect of different freeze-thaw temperatures on drip loss of Agaricus bisporus
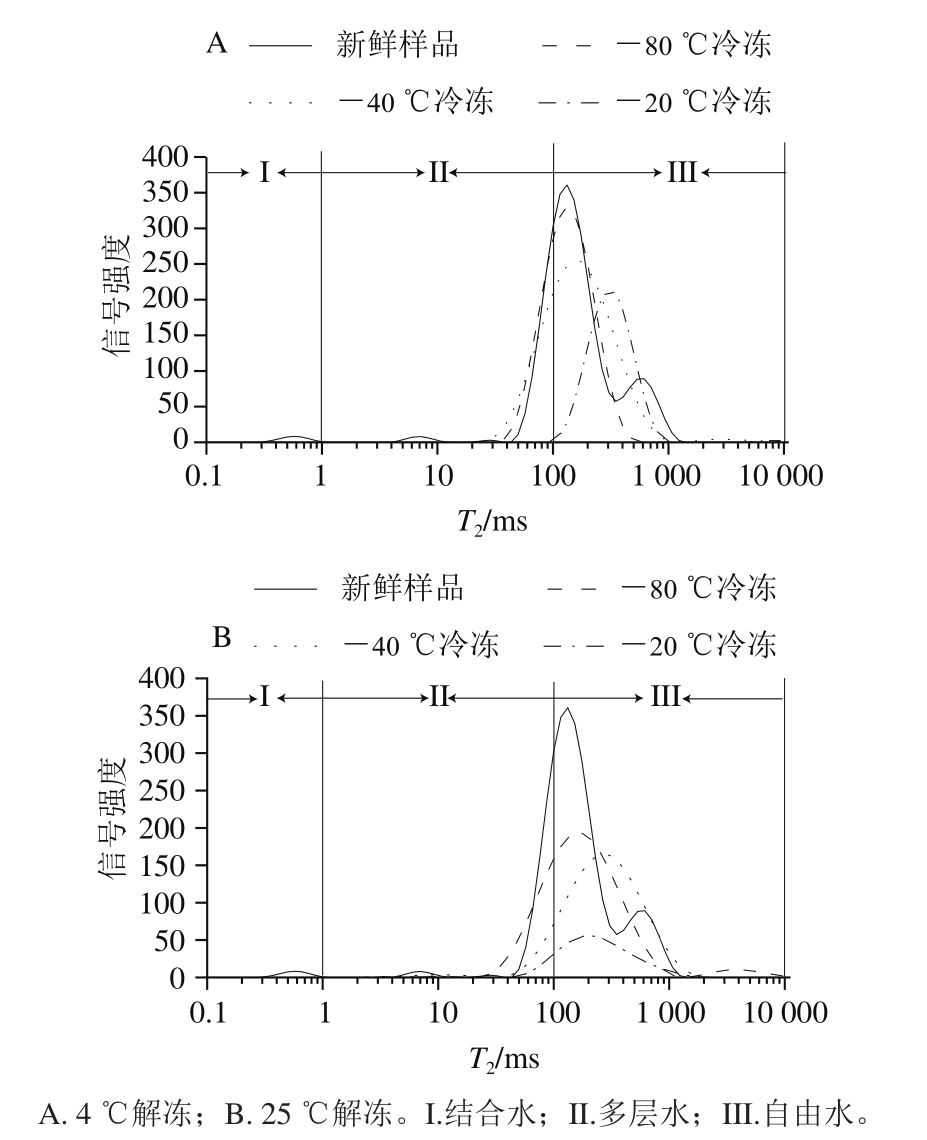
图6 不同冻融温度条件下双孢蘑菇的T2变化
Fig.6 Changes in transverse relaxation time (T2) of Agaricus bisporus at different freeze-thaw temperatures
双孢蘑菇中含有大量的水分,水分的分布、状态及其在双孢蘑菇中的迁移情况对双孢蘑菇的外观形状、新鲜度、腐败程度等有显著影响[24]。0~1 ms(I)为结合水,此部分水分子与生物大分子间紧密结合,动力学活性较小;1~100 ms(II)为多层水,此部分水分流动性受到限制;100~1 000 ms(III)为自由水,此部分水分流动性强。如图6A、B所示,随着冷冻温度的升高,解冻样品水分信号峰向右迁移,水分的流动性增强,这是由于较高温度冷冻样品时,形成冰晶越大,对细胞破坏越大[25]。25 ℃解冻样品和4 ℃解冻样品在区域I与区域II信号强度无明显差别,25 ℃解冻样品区域III信号强度明显低于4 ℃解冻样品,表明25 ℃解冻样品自由水流失多,汁液流失率高;这种现象是由于解冻温度越高,解冻速度过快,细胞间隙的冰晶体快速融化后没有充足时间复水,汁液流失增多[23]。其中-80 ℃冷冻、4 ℃解冻的双孢蘑菇横向弛豫时间信号峰最接近新鲜双孢蘑菇的信号峰,说明细胞间自由水含量最高,水分易流失,由于冷冻温度低,形成的冰晶体小,对双孢蘑菇结构破坏程度最小,组织持水能力最强,在解冻温度低的条件下,汁液流失率低,内部水分含量高。-20 ℃冷冻、25 ℃解冻的双孢蘑菇自由水含量低,冷冻形成的冰晶体大,对双孢蘑菇结构破坏程度最大,解冻后汁液流失最多,内部自由水含量低。

图7 冻融温度对双孢蘑菇水分分布的影响
Fig.7 Effect of different freeze-thaw temperatures on moisture distribution of Agaricus bisporus
根据横向弛豫时间T2加权成像原则,含水率高的部分信号区域显亮,含水率低的部分信号区域显暗[26]。如图7所示,4 ℃解冻的双孢蘑菇显著亮于25 ℃解冻的双孢蘑菇,说明4 ℃解冻的双孢蘑菇水分明显高于25 ℃解冻的双孢蘑菇,其中-80 ℃冷冻、4 ℃解冻的双孢蘑菇显亮区域最大,表明含水量最高,-20 ℃冷冻、25 ℃解冻的双孢蘑菇显亮区域最小,表明该部分含水量低。有研究表明[19],冷冻双孢蘑菇的温度越低,形成的冰晶越小,对双孢蘑菇的组织结构破坏越小,双孢蘑菇组织持水能力越高,解冻后汁液流失显著降低。解冻的温度越高,相同解冻时间汁液流失越多,发生这种现象的原因是解冻温度越高,冰晶体融化速度越快,双孢蘑菇汁液流失显著增高,双孢蘑菇内部水分含量显著降低。

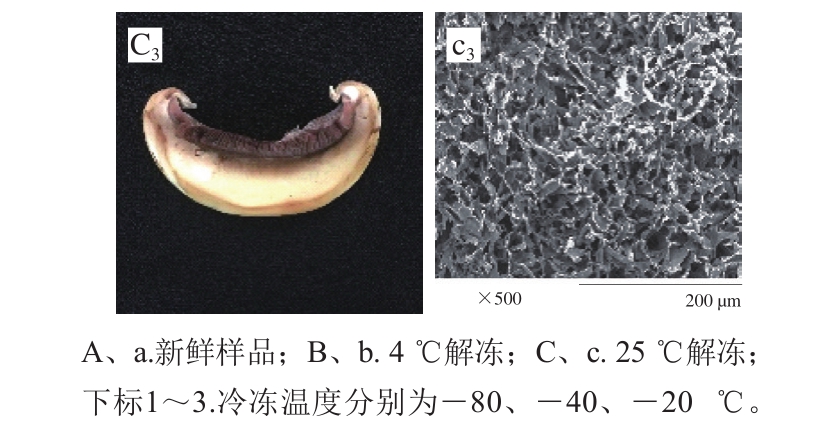
图8 冻融温度对双孢蘑菇外观和微观结构的影响
Fig.8 Effect of different freeze-thaw temperatures on the microstructure of Agaricus bisporus
新鲜双孢蘑菇组织结合紧密并保持完整的结构,呈较为规则的孔状结构[27]。双孢蘑菇在冷冻过程细胞间形成冰晶体,体积膨胀,解冻过程冰晶体融解,孔状结构变得疏松,双孢蘑菇持水能力下降,汁液流失增多[28]。解冻过程汁液流失可导致双孢蘑菇体失水坍塌,引起组织结构变形和皱缩。由图8可知,4 ℃解冻的双孢蘑菇色泽比25 ℃解冻的双孢蘑菇白嫩,孔状结构紧密,其中-80 ℃冷冻、4 ℃解冻条件的双孢蘑菇色泽最白,孔状结构最紧密,-20 ℃冷冻、25 ℃解冻的双孢蘑菇色泽最暗,表面出现大面积褐色,孔状结构最疏松。发生这种现象的原因是双孢蘑菇冷冻温度越低,形成冰晶体越小,对组织结构破坏越小,孔状结构维持较好,双孢蘑菇表面褐色面积越小。因此,-80 ℃冷冻、4 ℃解冻的双孢蘑菇保持了良好的孔状结构,而-20 ℃冷冻、25 ℃解冻的双孢蘑菇结构疏松,孔状结构被明显破坏。
表4 冻融温度对双孢蘑菇质构的影响
Table4 Effect of different freeze-thaw temperatures on texture characteristics of Agaricus bisporus
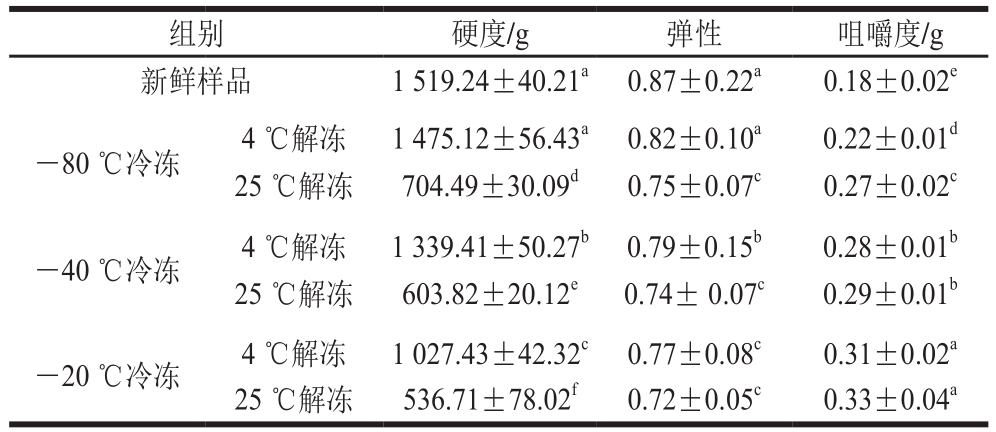
注:同列肩标字母不同表示差异显著(P<0.05)。
组别 硬度/g 弹性 咀嚼度/g新鲜样品 1 519.24±40.21a0.87±0.22a0.18±0.02e-80 ℃冷冻 4 ℃解冻 1 475.12±56.43a0.82±0.10a0.22±0.01d25 ℃解冻 704.49±30.09d0.75±0.07c0.27±0.02c-40 ℃冷冻 4 ℃解冻 1 339.41±50.27b0.79±0.15b0.28±0.01b25 ℃解冻 603.82±20.12e0.74± 0.07c0.29±0.01b-20 ℃冷冻 4 ℃解冻 1 027.43±42.32c0.77±0.08c0.31±0.02a25 ℃解冻 536.71±78.02f0.72±0.05c0.33±0.04a
质构特性是衡量冷冻过程农产品品质变化的重要指标,冻融过程中微观结构特性的改变直接关系到果蔬质构特性(硬度、弹性、咀嚼度)的变化[29]。由表4可知,4 ℃解冻的双孢蘑菇硬度高于25 ℃解冻的双孢蘑菇;相同解冻温度下,随着冷冻温度的升高,硬度降低,其中-80 ℃冷冻、4 ℃解冻的硬度最高,-20 ℃冷冻、25 ℃解冻的硬度最低。与25 ℃解冻的双孢蘑菇相比,4 ℃解冻的双孢蘑菇的弹性更高,而咀嚼度更低;解冻温度相同时,咀嚼度随着冷冻温度上升而上升,-80 ℃冷冻、4 ℃解冻的双孢蘑菇咀嚼度最低,-20 ℃冷冻、25 ℃解冻的咀嚼度最高;而弹性变化趋势是随着冷冻温度上升而下降,-80 ℃冷冻、4 ℃解冻的双孢蘑菇弹性最高,-20 ℃冷冻、25 ℃解冻的弹性最小。发生现象的原因是冷冻温度低,形成冰晶体小,对细胞的破坏较小,解冻温度低可以使双孢蘑菇细胞快速复水,膨压有所回升,从而能够较好地保持样品的质构特性[30]。综上所述,-80 ℃冷冻、4 ℃解冻的双孢蘑菇质构特性最佳。
经3.0 g/L异抗坏血酸钠、1.5 g/L L-半胱氨酸、0.4 g/L抗坏血酸、10.0 g/L柠檬酸复合护色剂浸泡30 min后,通过-80 ℃冷冻25 min、4 ℃解冻60 min的冻融条件处理双孢蘑菇时,双孢蘑菇片汁液流失率最低,POD活力最高,质构特性最好,色泽更接近新鲜样品,水分含量最高。结合上述在-80 ℃冷冻、4 ℃解冻条件下,双孢蘑菇品质较佳,更符合工业化生产需求。
[1] LEIVA F J, SAENZ-DÍEZ J C, MARTÍNEZ E, et al. Environmental impact of Agaricus bisporus cultivation process[J]. European Journal of Agronomy, 2015, 71: 141-148. DOI:10.1016/j.eja.2015.09.013.
[2] 张荣飞, 王相友, 刘战丽. 纳米TiO2/SiO2复合膜结构的表征及其对双孢蘑菇涂膜保鲜的影响[J]. 现代食品科技, 2014, 30(9): 134-141.
[3] 赵吉顺, 赵天瑞, 樊建, 等. 冻结条件对双孢蘑菇PPO和POD活性的影响[J]. 中国食用菌, 2010, 29(3): 43-45.
[4] ARCE-CERVANTES O, SAUCEDO-GARCÍA M, LEAL LARA H, et al.Alternative supplements for Agaricus bisporus production and the response on lignocellulolytic enzymes[J]. Scientia Horticulturae, 2015,192: 375-380. DOI:10.1016/j.scienta.2015.06.030.
[5] 李清明, 谭兴和, 王锋, 等. 速冻双孢蘑菇护色工艺研究[J]. 食品工业科技, 2007(3): 160-162.
[6] JAWORSKA G, BERNAŚ E. Effects of pre-treatment, freezing and frozen storage on the texture of Boletus edulis (Bull: Fr.)mushrooms[J]. International Journal of Refrigeration, 2010, 33(4):877-885. DOI:10.1016/j.ijrefrig.2009.12.031.
[7] ISLAM N, ZHANG M, ADHIKARI B, et al. The effect of ultrasoundassisted immersion freezing on selected physicochemical properties of mushrooms[J]. International Journal of Refrigeration, 2014, 42: 121-133. DOI:10.1016/j.ijrefrig.2014.02.012.
[8] JÚNIOR L L Z, LOPES A D, CORDEIRO F A, et al. Cryopreservation at -75 ℃ of Agaricus subrufescens on wheat grains with sucrose[J].Brazilian Journal of Microbiology, 2018, 49(2): 370-377.DOI:10.1016/j.bjm.2017.08.003.
[9] 谭熙耀, 吴继红, 廖小军, 等. 高压二氧化碳技术速冻双孢蘑菇工艺优化[J]. 农业工程学报, 2011, 27(3): 375-380.
[10] XING Rui, ZHENG Aping, WANG Fang, et al. Functionality study of Na6PMo11FeO40as a mushroom tyrosinase inhibitor[J]. Food Chemistry, 2015, 175: 292-299. DOI:10.1016/j.foodchem.2014.11.157.
[11] 陈立夫, 裴斐, 张里明, 等. 超声辅助渗透处理对冷冻干燥双孢蘑菇冻干效率和品质的影响[J]. 食品科学, 2017, 38(23): 8-13.DOI:10.7506/spkx1002-6630-201723002.
[12] YANG Wenjian, YU Jie, PEI Fei, et al. Effect of hot air drying on volatile compounds of Flammulina velutipes detected by HS-SPMEGC-MS and electronic nose[J]. Food Chemistry, 2016, 196: 860-866.DOI:10.1016/j.foodchem.2015.09.097.
[13] GOWEN A A, O’DONNELL C P, TAGHIZADEH M, et al.Hyperspectral imaging for the investigation of quality deterioration in sliced mushrooms (Agaricus bisporus) during storage[J]. Sensing and Instrumentation for Food Quality and Safety, 2008, 2(3): 133-143.DOI:10.1007/s11694-008-9042-4.
[14] 李鑫熠, 杨炳南, 赵凤敏, 等. 复合护色剂的配制及对鲜切马铃薯片保鲜效果[J]. 农业工程学报, 2011, 27(增刊2): 232-236.
[15] 范林林, 赵文静, 赵丹, 等. 柠檬酸处理对鲜切苹果的保鲜效果[J].食品科学, 2014, 35(18): 230-235. DOI:10.7506/spkx1002-6630-201418044.
[16] 李铉军, 崔胜云. 抗坏血酸清除DPPH自由基的作用机理[J]. 食品科学, 2011, 32(1): 86-90.
[17] 孔维宝, 陆健, 赵海锋, 等. L-半胱氨酸抑制多酚氧化酶的机制研究[J]. 食品科学, 2007, 28(11): 66-70. DOI:10.3321/j.issn:1002-6630.2007.11.010.
[18] 何继文, 程力, 洪雁, 等. 甘薯全粉加工中无硫复合护色工艺优化[J].农业工程学报, 2013, 29(9): 275-284.
[19] 苏光明, RAMASWAMY H, 朱松明, 等. 鲜虾卸压超冷速冻过程中的热变化和冰晶形态[J]. 农业工程学报, 2013(22): 267-276.DOI:10.3969/j.issn.1002-6819.2013.22.032.
[20] 叶文斌, 贠汉伯, 樊亮, 等. 复合涂膜对杨梅贮藏过程中POD、PPO、PAL酶活性的影响[J]. 包装与食品机械, 2012, 30(2): 10-16.DOI:10.3969/j.issn.1005-1295.2012.02.003.
[21] 吕蔷, 朱继英, 王相友. 双孢蘑菇POD酶学特性及其与褐变的关系[J].园艺学报, 2016, 43(3): 595-602.
[22] WANG S Y, WANG P C, FAUST M, et al. Non-destructive detection of watercore in apple with nuclear magnetic resonance imaging[J].Scientia Horticulturae, 1988, 35(3/4): 227-234. DOI:10.1016/0304-4238(88)90116-1.
[23] 王海鸥, 陈守江, 扶庆权, 等. 热烫冻融组合对苹果片真空冻结特性的影响[J]. 食品与发酵工业, 2018, 44(6): 180-186. DOI:10.13995/j.cnki.11-1802/ts.015906.
[24] 胡潇予, 蓝蔚青, 张楠楠, 等. 低场核磁共振技术在食品领域中的研究进展[J]. 食品工业科技, 2017, 38(6): 386-390.
[25] 邵小龙, 李云飞. 用低场核磁研究烫漂对甜玉米水分布和状态影响[J]. 农业工程学报, 2009, 25(10): 302-306. DOI:10.3969/j.issn.1002-6819.2009.10.054.
[26] 宋艳波, 刘振宇, 郭玉明. 基于电镜观察及介质理论分析高压脉冲电场处理果蔬机理[J]. 核农学报, 2012, 26(1): 91-94.
[27] CHANDRAN R, WILLIAMS L, HUNG A, et al. SEM characterization of anatomical variation in chitin organization in insect and arthropod cuticles[J]. Micron, 2016, 82: 74-85. DOI:10.1016/j.micron.2015.12.010.
[28] BULUT M, BAYER Ö, KIRTIL E, et al. Effect of freezing rate and storage on the texture and quality parameters of strawberry and green bean frozen in home type freezer[J]. International Journal of Refrigeration, 2018, 88: 360-369. DOI:10.1016/j.ijrefrig.2018.02.030.
[29] 李丽. 速冻草莓品质评价体系的建立研究[D]. 沈阳: 沈阳农业大学,2016: 62-65.
[30] XU Yangzi, TAO Yukun, SHIVKUMAR S. Effect of freeze-thaw treatment on the structure and texture of soft and firm tofu[J].Journal of Food Engineering, 2016, 190: 116-122. DOI:10.1016/j.jfoodeng.2016.06.022.
Effects of Pretreatment with Browning Inhibitor Mixtures and Different Freezing and Thawing Conditions on Quality of FrozenAgaricus bisporus