茄子(Solanum melongena L.)果实富含多酚、膳食纤维和维生素等营养物质,具有降血脂、预防II型糖尿病、保肝、抗氧化等多种保健功效,深受消费者的青睐[1]。茄子果实采后在常温贮藏过程中极易发生失水萎缩、花萼变色,并易受微生物侵染出现腐烂,从而失去商品价值[2]。冷藏是果蔬采后最有效的保鲜方法,但茄子为冷敏性果实,当贮藏温度低于7~10 ℃时,就会出现果皮脱色凹陷、果肉和种子褐变等冷害症状,直接影响其商品价值和贮藏品质[3]。因此,对茄子冷害发生机理及其控制措施的研究,一直是茄子采后贮藏技术研究中的重要内容[4-5]。
冷激处理是将果蔬置于低温条件下进行短时间处理,从而提高自身抗逆性的一种物理处理方法,其对果蔬保鲜作用的研究始于20世纪70年代末。Inaba等[6]的研究发现采用0 ℃冰水混合物短时处理番茄果实,可保持果实的品质,延长其贮藏期,并将这种低温逆境效应称为“冷激效应”。随后的研究表明,冷激处理能有效抑制香蕉、黄桃和甜樱桃果实常温贮藏期间呼吸作用等生理代谢,延缓果实硬度下降等后熟衰老进程,更好地保持果实原有的风味及营养品质[7-9]。冷激处理还可显著提高黄瓜[10]、辣椒[11]、香蕉[12]和甘薯[13]等果蔬的抗冷性,从而减轻低温贮藏时冷害的发生。这些结果表明,冷激处理在果蔬保鲜中具较好的应用前景。但冷激处理对茄子果实低温贮藏期间冷害发生的影响及其相关生理机制鲜见研究报道。为此本实验研究了不同条件冷激处理对茄子果实冷害、活性氧代谢及脯氨酸和可溶性糖等渗透调节物质含量的影响,以明确冷激处理减轻茄子果实冷害的作用和适宜条件,并从活性氧代谢的角度阐明其作用机理,为冷激处理在茄子冷链物流保鲜中的应用提供依据。
供试茄子采购于南京市众彩物流市场,品种为‘大龙’。采购后立即运回实验室,选择形状、大小一致,成熟度、色泽基本相同,且无病虫害和机械损伤的茄子果实,保留茄子萼片和1 cm长的果梗。
氢氧化钠、抗坏血酸、过氧化氢、硫代巴比妥酸南京杰汶达试剂器材有限公司;乙二胺四乙酸二钠、甲硫氨酸、氮蓝四唑、对氨基苯磺酸、α-萘胺、核黄素 国药集团化学试剂有限公司;三氯乙酸、盐酸羟胺 上海凌峰化学试剂有限公司;没食子酸、Folin-Ciocalteu试剂、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH) 美国Sigma公司。
UV-1600分光光度计 上海美谱达仪器有限公司;FA1104电子天平 上海精密科学仪器有限公司;GL-20G-H冷冻离心机 上海安亭科学仪器厂;HP-2132色差仪 深圳汉谱光彩科技有限公司;DDS-11A电导仪上海第二分析仪器厂。
1.3.1 材料处理
将挑选好的茄子果实随机分为对照(不作任何处理,CK)组和冷激处理组,其中4 个冷激处理组分别用0 ℃冰水混合物浸泡10、20、30、40 min。冷激处理方法:选用0.64 m×0.42 m×0.22 m的白色泡沫盒为冰水浸泡容器,往容器中倒入提前预冷到4 ℃的清水,之后加入制冷机所制造的小碎冰,使得冰水混合物体系的温度稳定在0 ℃,再将果实完全浸泡在冰水混合物中,料液比为1∶10(m/V)。每个处理组120 个茄子,重复3次。处理后的茄子果实经晾干后与对照组果实分别用0.01 mm厚聚乙烯薄膜袋分装,每袋8 个茄子,袋口用普通橡皮筋绕两道,于(4±1)℃、相对湿度为85%~90%的恒温箱中贮藏15 d。冷藏期间每3 d于各组随机取3 袋,置于(20±1)℃货架2 d后测定冷害指数和果肉色差值,确定20 min冷激处理能最显著地减轻茄子果实的冷害;因此在后续实验中研究了0 ℃冰水混合物冷激处理20 min对茄子果实冷藏期间活性氧代谢和渗透调节物质含量的影响,以探讨冷激处理减轻茄子果实冷害的机理。
1.3.2 指标测定
1.3.2.1 冷害指数和果肉色差测定
参照郭雨萱等[5]的方法测定冷害指数。每次从恒温箱中取18 个果实,于(20±1)℃货架贮藏2 d。先按冷害程度分为5级。1级:无冷害;2级:轻度冷害,果面有少许直径小于0.5 cm的凹陷褐色斑点;3级:中度冷害,果面褐色斑块增大,出现直径大于1 cm的烫伤状斑;4级:严重冷害,褐变斑块连成片,果面褐变面积未达1/3,果肉、种子轻微褐变;5级:极严重冷害,果肉、种子严重褐变,已无商品价值。冷害指数按照式(1)进行计算。
参照Concellón等[14]的方法测定果肉色差L*值。货架贮藏2 d后,用色差仪对果肉色差进行测量,在茄子中间部分取厚度为0.5 cm的圆形截面,切取后迅速用色差仪进行测量L*值。果实褐变程度的评价标准:L*值≥80为优质的果肉颜色,无褐变;L*值在78~79之间,种子出现褐变;L*值接近77,果肉和种子出现初期褐变;L*值≤75.5,果肉和种子出现严重褐变。
1.3.2.2 相对电导率和MDA含量测定
相对电导率测定参照Wang Qing等[15]的方法,略作修改。用圆筒打孔器从5 个茄子中取直径10 mm、厚度3 mm的果肉切片,将切片置于2 g于试管中,用0.6 mol/L甘露醇定容至25 mL,立即用电导仪测定电导度(L0),在室温下静置2 h后再次测定电导度(L1),最后放入100 ℃沸水浴中沸腾15 min,冷却后再一次测定电导度(L2)。相对电导率按式(2)进行计算。
丙二醛(malondialdehyde,MDA)含量采用硫代巴比妥酸法[16]测定。分别测定上清液在450、532、600 nm波长处的吸光度,单位为nmol/g,结果以鲜质量计。
1.3.2.3 脯氨酸含量和可溶性糖质量分数测定
脯氨酸含量采用酸性茚三酮法测定[17],单位为µg/g,结果以鲜质量计;可溶性糖质量分数采用蒽酮试剂法测定[18]。
1.3.2.4 总酚含量和DPPH自由基清除率测定
总酚含量采用Folin-Ciocalteu法测定[19]。称取2 g冷冻的样品,用5 mL体积分数80%的冷丙酮溶液(含体积分数0.2%甲酸)提取,研磨成匀浆后(冰浴),于4 ℃、12 000×g离心20 min,取上清液备用。反应体系:上清液、蒸馏水、Folin-Ciocalteu试剂及7.5 g/L的碳酸钠溶液。充分混匀后,溶液置于30 ℃条件下水浴1 h,并于765 nm波长处测定吸光度。结果以每克鲜质量样品所含的没食子酸质量来表示,单位为mg/g。
DPPH自由基清除率参照de Ancos等[20]的方法测定。总酚提取液可用来测定DPPH自由基清除率,向DPPH自由基溶液中加入提取液,测定反应液在525 nm波长处的吸光度。
1.3.2.5 SOD、CAT、APX活力的测定
超氧化物歧化酶(superoxide dismutase,SOD)活力的测定参照Jin Peng等[21]的方法,提取液用50 mmol/L的磷酸盐缓冲液(phosphate buffer saline,PBS)(pH 7.8,含1 mmol/ L EDTA和4 g/L聚乙烯吡咯烷酮(polyvinyl pyrrolidone,PVP))。一个SOD活力单位为每分钟每克鲜质量样品的反应体系对氮蓝四唑(nitro-blue tetrazolium,NBT)光化还原50%,单位为U/g。
过氧化氢酶(catalase,CAT)活力测定参照Cheng Hongyan等[22]的方法。提取液用50 mmol/ L的PBS(pH 7.0,含4 g/L PVP)。反应体系:pH 7.0 50 mmol/L PBS、体积分数0.75% H2O2和酶液,以每毫克鲜质量样品每分钟在240 nm波长处吸光度降低0.01为1个CAT活力单位,单位为U/mg。
抗坏血酸过氧化物酶(ascorbate peroxidase,APX)活力测定参照Xu Hongxia等[23]的方法。提取液用50 mmol/L PBS(pH 7.0,含0.1 mmol/L EDTA、1 mmol/L抗坏血酸、2 g/L PVP)。反应体系:50 mmol/L PBS(pH 7.0)、9 mmol/L抗坏血酸溶液、上清液、体积分数3%H2O2溶液,以每毫克鲜质量样品每分钟在290 nm波长处吸光度降低0.01为1个APX活力单位(U),单位为U/mg。
1.3.2.6 生成速率和H2O2含量的测定
生成速率和H2O2含量的测定
超氧阴离子自由基( )生成速率测定参照Bian Shaomin等[24]的方法,
)生成速率测定参照Bian Shaomin等[24]的方法,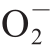 ·生成速率根据亚硝酸钠的标准曲线计算,以每分钟每克鲜质量样品产生
·生成速率根据亚硝酸钠的标准曲线计算,以每分钟每克鲜质量样品产生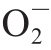 ·的物质的量表示,单位为nmol/(g·min)。
·的物质的量表示,单位为nmol/(g·min)。
H2O2含量测定参照Sun Dequan等[25]的方法,单位为μmol/g,结果以鲜质量计。
以上各项指标均取3 个平行样,重复测定3 次。采用Excel 2010软件进行数据处理,Origin 8.6软件作图,SAS软件进行单因素方差分析,用Duncan多重比较法进行差异显著性分析,P<0.05表示差异显著。
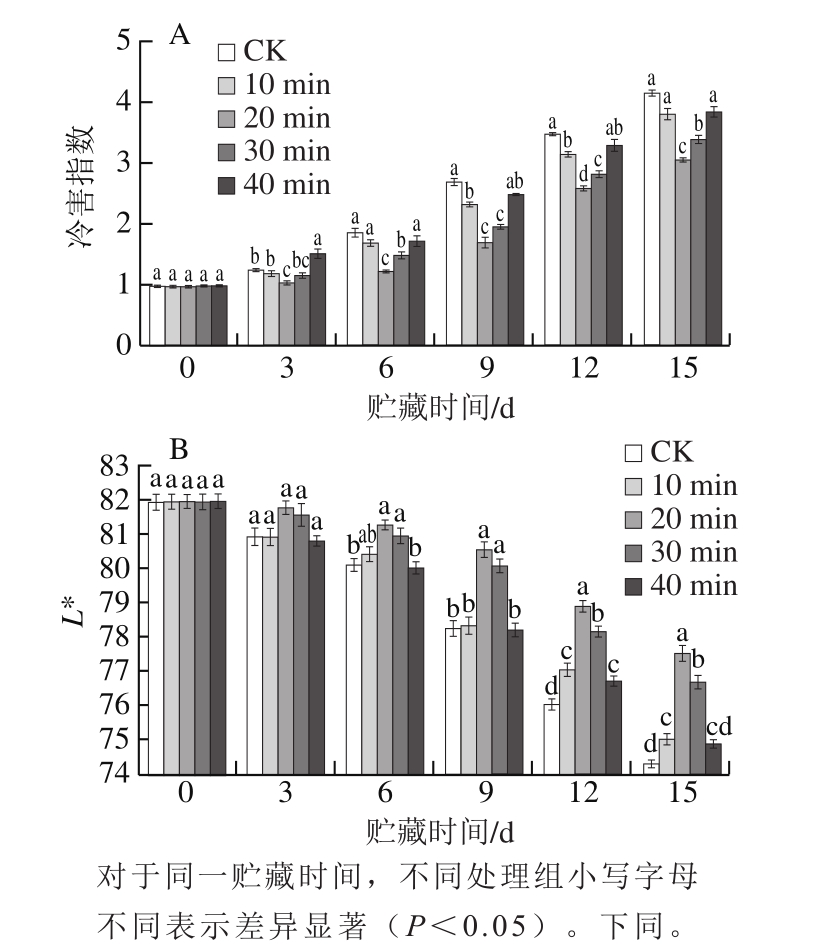
图1 冷激处理对茄果实冷藏期间冷害指数(A)和果肉L*值(B)的影响
Fig.1 Effect of cold shock treatment on chilling injury index (A) and pulp lightness (B) in eggplants during cold storage
如图1A所示,茄子冷藏期间,随着贮藏时间的延长,果实冷害指数不断增加。冷激处理10、20、30 min 均能减轻茄子冷害,且这些处理组的果实冷害指数增长较为缓慢,其中冷激处理20 min对减轻茄子冷害的效果较好,贮藏15 d后的冷害指数仅为2.96,显著低于CK组和其他处理组(P<0.05)。40 min冷激处理对茄子果实冷害无显著影响。
果肉色差L*值是反映茄子果肉褐变程度的直观指标,L*值越小,表明果肉褐变程度越大,冷害越严重。如图1B所示,CK组和冷激处理10、40 min组茄子果肉色差L*值在贮藏前6 d下降缓慢,在6~9 d急剧下降,
果肉出现轻微褐变,种子变黑,贮藏15 d时果肉褐变严重。冷激处理20、30 min的茄子果肉色差L*值12~15 d迅速下降,种子变黑,在贮藏15 d时,果肉只出现轻微褐变,且在贮藏6~15 d,果肉色差L*值都显著高于对照组(P<0.05)。其中在整个贮藏期间,冷激处理20 min组果肉色差L*值最高,果肉褐变程度最低。因此在后续实验中均只研究了0 ℃冰水混合物冷激处理20 min对茄子果实冷藏期间活性氧代谢和渗透调节物质含量的影响。
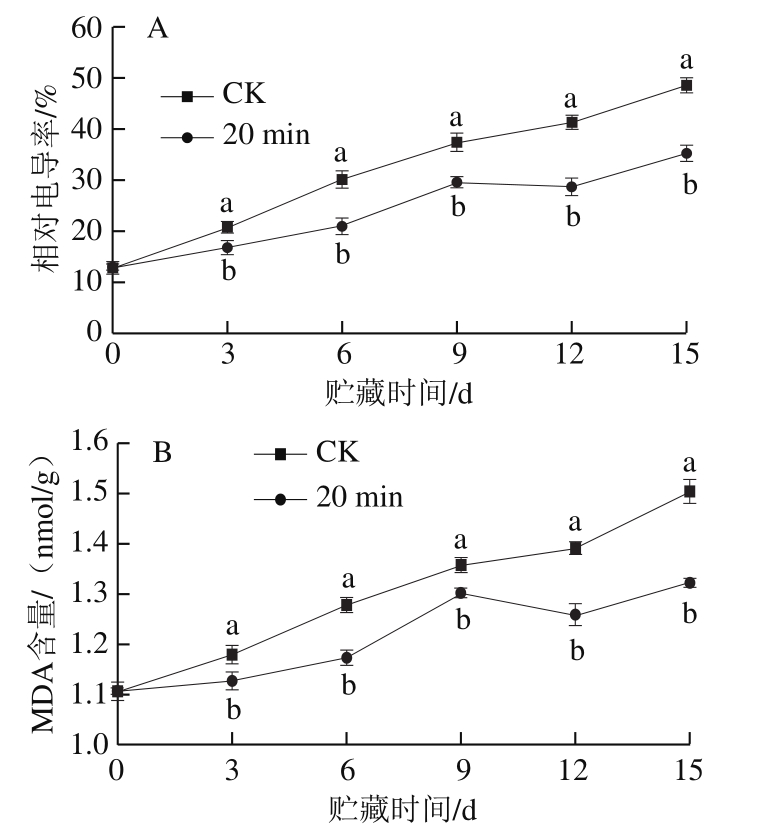
图2 20 min冷激处理对茄子冷藏期间相对电导率(A)和MDA含量(B)的影响
Fig.2 Effect of 20 min cold shock treatment on relative electric conductivity (A) and MDA content (B) in eggplants during cold storage
细胞膜透性的大小能反映细胞膜的完整性,是衡量果实冷害的重要指标之一。如图2A所示,在整个冷藏期,冷激处理组和CK组茄子果肉相对电导率均在不断上升,冷激处理组果肉相对电导率上升的速率更慢、幅度更小,始终显著低于对照组(P<0.05)。MDA作为膜脂过氧化代谢产物,它的含量能反映细胞膜被破坏的程度,也是衡量果实冷害程度的指标之一。如图2B所示,随着冷害的加剧,茄子采后贮藏期间MDA含量逐渐增加,冷激处理可抑制MDA含量上升的速率,在贮藏末期,冷激处理组MDA含量比CK组低12.08%。表明冷激处理能较好抑制茄子细胞膜通透性和MDA含量的增加,可有效地维持果实细胞膜结构的完整性,从而减轻果实的冷害症状。
可溶性糖和脯氨酸都是植物细胞重要的渗透调节物质。如图3A所示,茄子脯氨酸含量整体呈上升趋势,但冷激处理组茄子脯氨酸含量在整个贮藏过程中都显著高于CK组(P<0.05)。CK组茄子可溶性糖质量分数整体呈上升趋势,冷激处理组茄子可溶性糖质量分数在贮藏前3 d急剧上升,并在第12天达到了整个冷藏期的最大值,此时是CK组的1.90 倍,冷激处理组茄子可溶性糖质量分数在整个贮藏过程中都显著高于CK组(P<0.05)(图3B)。

图3 20 min冷激处理对茄子冷藏期间脯氨酸含量(A)和可溶性糖质量分数(B)的影响
Fig.3 Effect of 20 min cold shock treatment on total proline content (A)and soluble sugar content (B) in eggplants during cold storage

图4 20 min冷激处理对茄子冷藏期间总酚含量(A)和DPPH自由基清除率(B)的影响
Fig.4 Effect of 20 min cold shock treatment on total phenol content (A)and DPPH radical scavenging capacity (B) in eggplants during cold storage
如图4A所示,CK组茄子总酚含量在贮藏3 d后呈明显上升趋势。冷激处理处理组茄子总酚含量在0~9 d快速上升,9~12 d轻微下降。在整个贮藏过程中,冷激处理组茄子总酚含量始终高于CK组。如图4B所示,CK组DPPH自由基清除率变化趋势与总酚含量相似,整体不断上升;冷激处理组DPPH自由基清除率在贮藏3~9 d急剧上升,并在第9天达到最大值,是贮藏第0天的1.48 倍。在整个冷藏期内,冷激处理组茄子DPPH自由基清除率始终高于对照组。

图5 20 min冷激处理茄子冷藏期间SOD(A)、CAT(B)和APX(C)活力的影响
Fig.5 Effect of 20 min cold shock treatment on SOD (A), CAT (B) and APX (C) activities in eggplants during cold storage
如图5A所示,在整个贮藏期间,CK组茄子SOD活力总体呈下降趋势,冷激处理促进贮藏前期茄子果实SOD活力的上升,抑制贮藏中后期SOD活力的下降,贮藏6 d后,冷激处理组SOD活力始终显著高于对照组(P<0.05)。随着贮藏时间延长,冷激处理组和CK组果实CAT活力呈先上升后下降的趋势,且均在贮藏6 d时达到最大值,但冷激处理组茄子CAT活力在贮藏6~9 d内一直保持较高的活力,之后才下降;在贮藏中后期,冷激处理组茄子CAT活力始终显著高于对照组(P<0.05)(图5B)。CK组茄子APX活力在贮藏前中期缓慢上升,在第9天达到最大值(12.71 U/mg),随后迅速下降;冷激处理组茄子APX活力在贮藏前期迅速上升,第6天达到最大值(15.50 U/mg ),之后缓慢下降;在整个冷藏期,冷激处理组APX活力始终保持在较高水平,且在贮藏12 d 后,与CK组差异显著(P<0.05)(图5C)。上述结果表明,冷激处理可以保持细胞较高的SOD、CAT和APX等活性氧清除酶活力,从而减少活性氧的积累。
 生成速率和H2O2含量的影响
生成速率和H2O2含量的影响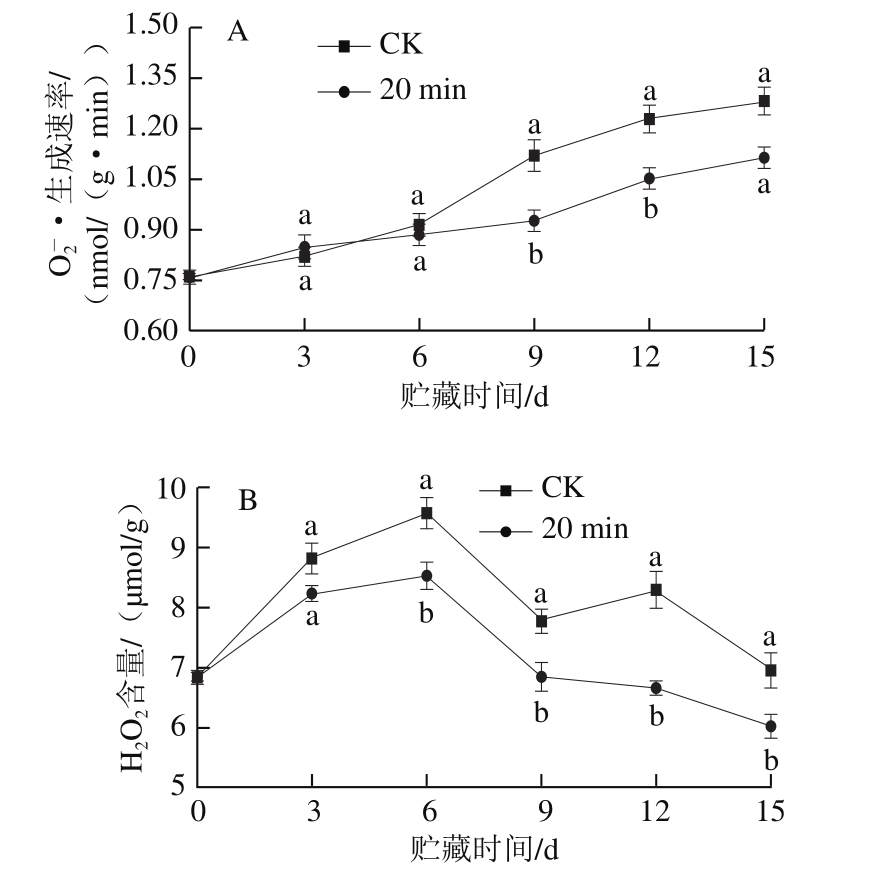
图6 20 min冷激处理茄子冷藏期间 ·生成速率(A)和
·生成速率(A)和
H2O2含量(B)的影响
Fig.6 Effect of 20 min cold shock treatment on · generation rate (A)and H2O2content (B) in eggplants during cold storage
· generation rate (A)and H2O2content (B) in eggplants during cold storage
如图6A所示,冷藏前12 d,CK组茄子果实 ·生成速率先缓慢增加后急剧上升,在贮藏结束时,果实
·生成速率先缓慢增加后急剧上升,在贮藏结束时,果实 ·生成速率比贮藏0 d时高68.42%。冷激处理组茄子
·生成速率比贮藏0 d时高68.42%。冷激处理组茄子 ·生成速率随着贮藏时间延长缓慢增加,在贮藏的第15天,
·生成速率随着贮藏时间延长缓慢增加,在贮藏的第15天, ·生成速率比CK组低13.00%。在贮藏第9~15天,冷激处理组茄子
·生成速率比CK组低13.00%。在贮藏第9~15天,冷激处理组茄子 ·生成速率显著低于对照组(P<0.05)。总体来看,冷激处理抑制了茄子果实在贮藏中后期
·生成速率显著低于对照组(P<0.05)。总体来看,冷激处理抑制了茄子果实在贮藏中后期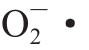 生成速率的上升,减少了
生成速率的上升,减少了 的积累。
的积累。
如图6B所示,在冷藏期间,茄子H2O2含量总体呈现先上升后下降的趋势。冷激处理组和CK组果实H2O2含量均在贮藏第6天达到最大值,分别为8.53 µmol/g和9.58 µmol/g,随后冷激处理组果实H2O2含量迅速下降,CK组果实H2O2含量在9~12 d出现短暂上升。与CK组果实相比,经冷激处理的茄子在采后冷藏期间内能保持相对较低的H2O2含量,且在贮藏6 d后与CK组差异显著(P<0.05)。
不适当低温造成的冷害是限制果蔬冷链流通的主要因素。前人研究表明冷激处理能提高黄瓜[10]、辣椒[11]、香蕉[12]和甘薯[13]等果蔬的抗冷性,显著减少其低温贮藏期间冷害的发生,延长果蔬贮藏期。本实验结果表明,采用0 ℃的冰水混合物冷激处理20 min能显著抑制茄子冷害和果肉褐变的发生,保持较低的冷害指数和较高的果肉色差L*值。由于冷激处理简单易行,同时还可起到预冷的作用,因而在茄子冷链物流保鲜中具较好的应用前景。0 ℃的冰水混合物40 min冷激处理对减轻茄子冷害没有明显作用,这可能是因为冷激处理时间过长导致茄子果实发生低温伤害。
可溶性糖和脯氨酸都是植物细胞重要的渗透调节物质,适宜浓度的可溶性糖和脯氨酸可提高细胞内溶质浓度,降低冰点,防止细胞脱水,减轻原生质因结冰而导致的细胞伤害[26-27]。此外,脯氨酸还可清除活性氧,稳定活性氧清除酶类的结构,抑制脂质过氧化,从而保护细胞膜的完整性,在提高植物低温耐受性中起到积极的作用[26,28]。已有研究表明,采后处理可提高冷敏性果蔬游离脯氨酸和可溶性糖含量,进而增加果蔬的抗冷性[26,29]。如茉莉酸甲酯处理可提高枇杷果实冷藏期间脯氨酸及γ-氨基丁酸的含量,进而降低冷害指数[26]。NO和外源褪黑素处理可分别提高香蕉和桃果实中果糖、葡萄糖和蔗糖含量,增强果实抗冷性,减轻冷害症状[30-31]。在本研究中,茄子果实脯氨酸含量在冷藏期间呈上升趋势,这可能是机体对低温胁迫的应激反应,冷激处理可促进茄子可溶性糖和脯氨酸的积累,表明冷激处理可以通过增加渗透调节物质含量进而提高茄子果实的低温耐受性。
O2-·和H2O2为2 种主要的活性氧物质,SOD可催化O2-·歧化生成毒性较低的H2O2和无毒的O2,H2O2再被CAT、APX分解为无毒的H2O和O2,最终抑制O2-·与H2O2结合生成破坏力更强的羟自由基[32]。低温胁迫会导致活性氧清除酶类(SOD、CAT、APX)活力下降,诱导植物产生大量活性氧,高浓度的活性氧会加剧膜脂的过氧化作用,破坏生物膜的结构和功能,增加液泡中多酚类物质与质体中多酚氧化酶接触的机会,从而引发组织褐变等冷害症状[33-34]]。前人研究表明,冷激处理可提高番茄与黄瓜果实CAT、APX、POD的活力,降低了果实的冷害发生率[35-36]。Liu Dongjie等[37]报道亚精胺和冰温处理可以提高青椒果实SOD活力,提高果实抗冷性。Cao Shifeng等[38]发现茉莉酸甲酯处理可提高冷藏期间枇杷果实活性氧清除酶的活力,减少活性氧的积累,抑制膜脂的过氧化作用,维持较低的细胞膜透性,进而减轻果实褐变等冷害症状。本研究发现,随着冷害程度的加重,CK组SOD活力呈不断下降趋势,CAT和APX活力在贮藏前期上升,贮藏后期下降,且O2-·产生量和冷藏前期H2O2含量的不断增加,诱发了膜脂的过氧化作用,破坏生物膜的结构和功能,使细胞膜透性及MDA含量处在较高水平,导致果实褐变,最终加剧了茄子冷害的症状。而冷激处理抑制了茄子低温贮藏过程中SOD活力的下降,促进茄子冷藏前期CAT及APX活力的上升,并延缓了贮藏中后期CAT、APX活力的下降,抑制了活性氧的积累,降低了膜脂过氧化产物MDA含量和相对电导率,减缓了果肉色差L*值的下降。以上结果表明,冷激处理可维持茄子果实活性氧代谢的平衡,抑制低温诱导的活性氧对膜脂的过氧化作用,从而维持膜结构的完整性,抑制果实褐变程度,进而延缓茄子果实冷害的发生。
0 ℃冰水20 min冷激处理可显著降低茄子果实在4 ℃贮藏时的冷害指数和果肉褐变,减轻冷害发生。冷激处理可保持茄子果实在冷藏过程中较高的SOD、APX和CAT等抗氧化酶活力和总酚含量,提高果实的抗氧化活力,维持果实活性氧代谢平衡,抑制膜脂过氧化作用,保护膜结构的完整性,进而延缓茄子果实冷害的发生。冷激处理可提高冷藏过程中茄子果实渗透调节物质可溶性糖质量分数和脯氨酸含量,从而提高果实抗冷性,延缓冷害发生。
[1] 史君彦, 高丽朴, 左进华, 等. PVC膜和CO2高渗透保鲜膜包装对茄子保鲜效果的影响[J]. 包装工程, 2017, 38(3): 7-11. DOI:10.19554/j.cnki.1001-3563.2017.03.002.
[2] 高慧, 张宏军, 康丽娜, 等. 24-表油菜素内酯对茄子果实贮藏品质及抗氧化活性的影响[J]. 西北植物学报, 2014, 34(8): 1614-1619.DOI:10.7606/j.issn.1000-4025.2014.08.1614.
[3] 侯建设, 李中华, 江杰, 等. 茄子的保鲜贮藏研究[J]. 食品科技, 2002,27(4): 67; 68-70. DOI:10.3969/j.issn.1005-9989.2002.04.028.
[4] 范林林, 高丽朴, 左进华, 等. 外源硝普钠处理对茄子贮藏过程中品质的影响[J]. 食品科学, 2015, 36(22): 222-226. DOI:10.7506/spkx1002-6630.2015.22.042.
[5] 郭雨萱, 郝利平, 卢银洁, 等. 不同贮藏温度对茄子冷害发生及质构特性的影响[J]. 核农学报, 2016, 30(9): 1763-1769. DOI:10.11869/j.issn.100-8551.2016.09.1763.
[6] INABA M, CRANDALL P G. Cold-shock treatment of mature green tomatoes to delay color development and increase shelf-life during room temperature storage[J]. Proceedings of the Florida State Horticultural, 1986, 99: 143-145.
[7] ZHANG H Y, YANG S Y, JOYCE D C, et al. Physiology and quality response of harvested banana fruit to cold shock[J]. Postharvest Biology and Technology, 2010, 55(3): 154-159. DOI:10.1016/j.postharvbio.2009.11.006.
[8] 陈留勇, 孔秋莲, 宋义忠, 等. 冷激处理对黄桃保鲜效果的影响[J]. 食品工业科技, 2003, 24(11): 67-69. DOI:10.13386/j.issn1002-0306.2003.11.0.
[9] ALIQUE R, ZAMORANOJ P, MARTÍNEZ M A, et al. Effect of heat and cold treatments on respiratory metabolism and shelflife of sweet cherry, type picota cv “Ambrunés”[J]. Postharvest Biology and Technology, 2005, 35(2): 153-165. DOI:10.1016/j.postharvbio.2004.07.003.
[10] 裴倩如, 朱本忠, 田慧琴, 等. 冷激处理对黄瓜低温贮藏中冷害的影响[J]. 北方园艺, 2014(1): 127-130.
[11] 谷会, 弓德强, 朱世江, 等. 冷激处理对辣椒冷害及抗氧化防御体系的影响[J]. 中国农业科学, 2011, 44(12): 2523-2530. DOI:10.3864/j.issn.0578-1752.2011.12.014.
[12] 邱佳容, 张良清, 陈纯, 等. 冷激处理对香蕉果实脂氧合酶和膜脂脂肪酸的影响及其与抗冷性的关系[J]. 现代食品科技, 2015, 31(11):211-218; 233. DOI:10.13982/j.mfst.1673-9078.2015.11.033.
[13] 林婕, 王则金, 林震山, 等. 冷激处理对甘薯冷害及活性氧代谢的影响[J]. 粮食与饲料工业, 2016(9): 12-16. DOI:10.7633/j.issn.1003-6202.2016.09.004.
[14] CONCELLÓN A, AÑÓN M C, CHAVES A R. Effect of low temperature storage on physical and physiological characteristics of eggplant fruit (Solanum melongena L.)[J]. LWT-Food Science and Technology, 2007, 40(3): 389-396. DOI:10.1016/j.lwt.2006.02.004.
[15] WANG Qing, DING Tian, GAO Lipu, et al. Effect of brassinolide on chilling injury of green bell pepper in storage[J]. Scientia Horticulturae, 2012, 144: 195-200. DOI:10.1016/j.scienta.2012.07.018.
[16] JIN P, ZHU H, WANG J, et al. Effect of methyl jasmonate on energy metabolism in peach fruit during chilling stress[J]. Journal of the Science of Food and Agriculture, 2013, 93(8): 1827-1832.DOI:10.1002/jsfa.5973.
[17] BATES L S, WALDREN R P, TEARE I D. Rapid determination of free proline for water stress studies[J]. Plant and Soil, 1973, 39(1): 205-207. DOI:10.1007/bf00018060.
[18] 曹建康, 姜微波, 赵玉梅. 果蔬采后生理生化实验指导[M]. 北京: 中国轻工业出版社, 2011: 57-59.
[19] HAN C, LI J, JIN P, et al. The effect of temperature on phenolic content in wounded carrots[J]. Food Chemistry, 2017, 215: 116-123.DOI:10.1016/j.foodchem.2016.07.172.
[20] DE ANCOS B, SGROPPO S, PLAZA L, et al. Possible nutritional and health related value promotion in orange juice preserved by highpressure treatment[J]. Journal of Agricultural and Food Chemistry,2002, 82(8): 790-796. DOI:10.1002/jsfa.1093.
[21] JIN Peng, ZHENG Yonghua, TANG Shuangshuang, et al. A combination of hot air and methyl jasmonate vapor treatment alleviates chilling injury of peach fruit[J]. Postharvest Biology and Technology,2009, 52(1): 24-29. DOI:10.1016/j.postharvbio.2008.09.011.
[22] CHENG Hongyan, SONG Songquan. Possible involvement of reactive oxygen species scavenging enzymes in desiccation sensitivity of Antiaris toxicaria seeds and axes[J]. Journal of Integrative Plant Biology, 2008, 50(12): 1549-1556. DOI:10.1016/j.sajb.2007.04.014.
[23] XU Hongxia, YANG Yong, XIE Li, et al. Involvement of multiple types of dehydrins in the freezing response in loquat (Eriobotrya japonica)[J].PLoS ONE, 2014, 9(1): 1-11. DOI:10.1371/journal.pone.0087575.
[24] BIAN Shaomin, JIANG Yiwei. Reactive oxygen species, antioxidant enzyme activities and gene expression patterns in leaves and roots of Kentucky bluegrass in response to drought stress and recovery[J].Scientia Horticulturae, 2009, 120(2): 264-270. DOI:10.1016/j.scienta.2008.10.014.
[25] SUN Dequan, LU Xinhua, HU Yulin, et al. Methyl jasmonate induced defense responses increase resistance to Fusarium oxysporum f. sp.cubense race 4 in banana[J]. Scientia Horticulturae, 2013, 164: 484-491. DOI:10.1016/j.scienta.2013.10.011.
[26] CAO S F, CAI Y T, YANG Z F, et al. MeJA induces chilling tolerance in loquat fruit by regulating proline and γ-aminobutyric acid contents[J]. Food Chemistry, 2012, 133(4): 1466-1470. DOI:10.1016/j.foodchem.2012.02.035.
[27] MA Q S, SUO J T, HUBER D J, et al. Effect of hot water treatments on chilling injury and expression of a new C-repeat binding factor(CBF) in ‘Hongyang’ kiwifruit during low temperature storage[J].Postharvest Biology and Technology, 2014, 97: 102-110. DOI:10.1016/j.postharvbio.2014.05.018.
[28] AGHDAM M S, ASGHARI M, FARMANI B, et al. Impact of postharvest brassinosteroids treatment on PAL activity in tomato fruit in response to chilling stress[J]. Scientia Horticulturae, 2012, 144: 116-120. DOI:10.1016/j.scienta.2012.07.008.
[29] LI P Y, ZHENG X L, LIU Y, et al. Pre-storage application of oxalic acid alleviates chilling injury in mango fruit by modulating proline metabolism and energy status under chilling stress[J]. Food Chemistry,2014, 142: 72-78. DOI:10.1016/j.foodchem.2013.06.132.
[30] 王延圣. 一氧化氮处理诱导采后香蕉果实耐冷性机理的研究[D]. 杭州: 浙江大学, 2015: 64-65.
[31] 徐利伟, 岑啸, 李林香, 等. 外源褪黑素对低温胁迫下桃果实蔗糖代谢的影响[J]. 核农学报, 2017, 31(10): 1963-1971. DOI:10.11869/j.issn.100-8551.2017.10.1963.
[32] MESQUITA V L V, QUEIROZ C. Biochemistry of Foods[M]. 3rd ed,San Diego: Academic Press, 2013: 387-418. DOI:10.1016/b978-0-08-091809-9.00010-8.
[33] JIN P, CAO S F, ZHENG Y H. Managing chilling injury in fruits[J].Acta Horticulturae, 2013, 1012: 1087-1096. DOI:10.17660/actahortic.2013.1012.147.
[34] JING G X, HUANG H, YANG B, et al. Effect of pyrogallol on the physiology and biochemistry of litchi fruit during storage[J].Chemistry Central Journal, 2013, 7(1): 1-11. DOI:10.1186/1752-153x-7-19.
[35] 欧阳丽喆, 申琳, 陈海荣, 等. H2O2参与冷激处理对番茄果实抗冷性及抗氧化酶活性的影响[J]. 食品科学, 2007, 28(7): 31-35.DOI:10.3321/j.issn:1002-6630.2007.07.001.
[36] 裴倩如, 朱本忠, 田慧琴, 等. 冷激处理对黄瓜低温贮藏中冷害的影响[J]. 北方园艺, 2014(1): 127-130.
[37] LIU Dongjie, SUI Guoliang, HE Yongzhuo, et al. Effect of icetemperature and spermidine on chilling sensitivity of pepper[J].Food and Nutrition Sciences, 2013, 4(2): 156-162. DOI:10.4236/fns.2013.42.022.
[38] CAO Shifeng, ZHENG Yonghua, WANG Kaituo, et al. Methyl jasmonate reduces chilling injury and enhances antioxidant enzyme activity in postharvest loquat fruit[J]. Food Chemistry, 2009, 115(4):1458-1463.
Effect of Cold Shock Treatment on Reducing Chilling Injury in Eggplant and Its Relationship with Reactive Oxygen Species Metabolism