随着经济的发展,人们对鱼类新鲜度品质的要求越来越高[1]。全世界每年有大约30%的水产品因腐败变质而失去食用价值,所以控制水产品的品质、研究保证其质量和安全的方法显得尤为重要。目前应用最广泛的水产保鲜方法是低温保鲜技术。微冻是低温保鲜技术的一种,又称部分冻结或过冷却冷藏,是20世纪60年代中期开始发展起来的在渔船上贮藏海产品的一种低温保鲜技术。微冻保鲜的基本原理是将水产品温度降低至初始冻结点以下,通常至低于初始冻结点1~2 ℃[2]。此时水产品中5%~30%的水分冻结成冰,未冻结部分溶液的细胞液汁浓度、渗透压增加,可有效抑制微生物生长,同时低温亦可抑制水产品中酶的活力,减少酶对体内有机物质的分解,使产品在较长的时间内保持原有品质及鲜度。微冻保鲜技术已广泛应用于罗非鱼、鲈鱼、石斑鱼、鲢鱼等以及各种鱼糜加工产品中,并取得较好的保鲜效果。阙婷婷等[3]对乌鳢各项指标的研究表明:微冻贮藏明显优于其他3 种低温冷冻预处理(-80 ℃速冻至-60 ℃中心温度、液氮速冻、-80 ℃速冻至-18 ℃中心温度)结合-20 ℃冻藏,能有效延长鱼肉贮藏期的同时,还能使肌肉内组织结构的完整性得到保护,使得鱼肉品质得到很好的保持。陈思等[4]以白鲢鱼为实验对象,测定了菌落总数、挥发性盐基氮(total volatile basic nitrogen,TVB-N)含量等理化指标,结合感官评价发现,4 ℃冷藏条件下鲢鱼片的货架期为6 d,-2 ℃微冻条件下货架期为18 d;与冷藏相比,微冻能明显延长白鲢鱼片的货架期。此外,近年来也有报道微冻保鲜技术与其他保鲜技术如气调包装、涂膜保鲜与真空包装等联合使用,可显著提高水产品品质或延长其货架期[5]。Zhu Yingchun等[6]发现,微冻结合高浓度CO2可很好保持住鲶鱼的新鲜度。
乳酸脱氢酶和ATP酶在淡水鱼中具有较高活力。乳酸脱氢酶是能量代谢中参与糖酵解的一种主要酶,其活力的改变将直接影响到机体的能量代谢[7]。ATP酶主要以Na+-ATP酶、K+-ATP酶、Ca2+-ATP酶、Mg2+-ATP酶4 种形式存在,其活力与肌动蛋白的变性程度呈线性正相关,可作为判断鱼肉品质的指标之一[8]。Nambudiri等[9]研究指出,印度鲮、鲻鱼、珍珠鱼、虱目鱼和罗非鱼在冷冻贮藏过程中乳酸脱氢酶和ATP酶活力与TVB-N含量、硫代巴比妥酸(thiobarbituric acid,TBA)值、过氧化值(peroxide value,POV)呈线性负相关。
目前研究较多的是鱼在微冻过程中的理化和微生物品质变化,且主要集中在微冻与其他冻结方式对鱼肉感官特性、质构指标等特性的影响,但是对鲈鱼的微冻特性鲜有研究,特别是能量代谢酶对鱼肉质构特性的影响鲜有研究报道,本实验以鲈鱼为研究对象,通过分析3 种能量代谢酶(乳酸脱氢酶、Ca2+-ATP酶、Mg2+-ATP酶)活力的变化,探讨其与蛋白质氧化降解之间的关系,进一步阐明对鲈鱼微冻贮藏过程中质构特性的影响,为鲈鱼低温贮藏的品质控制提供参考。
鲈鱼,规格(800±50)g,活体,购于武商量贩农科城店。
盐酸、氢氧化钠、Tris-base、牛血清白蛋白、CuSO4·5H2O、双缩脲、茶多酚 国药集团化学试剂有限公司;Ca2+-ATP酶试剂盒、Mg2+-ATP酶试剂盒、乳酸脱氢酶试剂盒 南京建成生物工程研究所。
BS-210型电子天平 德国Sartorius Instruments有限公司;UV-3802紫外-可见分光光度计 上海尤尼科仪器有限公司;TA-XT Plus质构仪 英国Stable Micro Systems公司;DIN51007差示扫描量热仪(differential scanning calorimetry,DSC) 耐驰仪器(上海)有限公司;FG2便携式pH计 梅特勒-托利多仪器(上海)有限公司;101B-2型均质机 上海一恒科技有限公司;真空处理机 诸城市昊坤装备科技有限公司;GL-25MS高速冷冻离心机 上海卢湘仪离心机仪器有限公司;DYY-12电泳仪 北京市六一仪器厂;Eclipse CI正置光学显微镜(包含DS-U3成像系统) 日本尼康公司。
1.3.1 原料处理
将运回实验室的鲜活鲈鱼用碎冰冻死,统一自鱼体两侧鳃盖骨后至尾鳍前取体背部肌肉作为样品进行测定。取宰杀后清洗干净鱼背鳍附近的白肉,将其切成鱼块(3 cm×3 cm×3 cm),鱼块样本随机分成3 个处理组:1)空气包装处理组,将鱼片直接放入无菌蒸煮袋中封口;2)真空处理组,将鱼片放入无菌蒸煮袋中进行抽真空密封(真空度为-0.1 MPa);3)茶多酚+真空处理组,将切分好的鱼肉(约8 g/份)置于质量分数0.2%的茶多酚溶液中浸泡30 min,沥干后放入无菌袋中抽真空密封。将处理好后的样品放入-18 ℃冰箱冷却,至鱼体温度降到0 ℃后,置于-2 ℃条件下贮藏,每隔3 d对鲈鱼各项指标进行测定,每个分析平行处理3 次。
1.3.2 剪切力的测定
采用质构仪测定鲈鱼剪切力。采用剪切探头HDP/BS,压缩测试模式,具体参数:测前探头下降速率2 mm/s;测中速率2 mm/s;测后探头回程速率2 mm/s;下降距离30 mm;触发应力200 g。
1.3.3 微观结构的观察
参考鲁珺等[10]的方法并作适当修改。将鱼肉组织于体积分数4%多聚甲醛溶液中,于-2 ℃固定24 h。然后将其取出置于脱水盒内,采用梯度乙醇进行脱水:体积分数75%乙醇4 h→体积分数85%乙醇2 h→体积分数90%乙醇2 h→体积分数95%乙醇1 h→无水乙醇30 min(重复2 次该步骤)→乙醇-二甲苯(体积比1∶1)5~10 min→二甲苯5~10 min(重复2 次该步骤)→蜡1 h(重复3 次该步骤)。然后进行包埋处理,于-20 ℃冻台冷却,将冷却后的蜡块进行切片,片厚4 μm。切片漂浮于摊片机40 ℃温水上将组织展平,用载玻片将组织捞起,并放进60 ℃烘箱内烤片,待水烤干、蜡烤化后取出,常温保存备用。采用伊红染液染色后在正置光学显微镜下进行拍照。
1.3.4 鲈鱼相变温度和热焓值的测定
参照鲁长新[11]的方法采用DSC仪测定,略作修改。选择质量相近的铝坩埚压封后作参比,实验分别进行基线测试、标样测试(蓝宝石)和样品测试。设置温度程序为:初温40℃,以3 ℃/min降温至50 ℃,恒温10 min,再以3 ℃/min升温至100 ℃,恒温10 min。待样品恢复到室温后,准确称量19.0~25.0 mg鱼肉样品,压封于DSC铝制坩埚中。冷却方式为机械制冷,样品吹扫气和保护气(氮气,纯度>99%)的流速分别为20 mL/min和60 mL/min。为确保实验数据的准确性,每次实验都采用相同的温度程序扫描空白坩埚、标样坩埚和样品坩埚,每个样品按上述方法重复5 次。
1.3.5 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳
十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)参考Laemmli[12]的方法,稍作修改。吸取前处理后的上清液10 μL进行点样,浓缩胶质量分数为4%,分离胶质量分数为12%。样品在浓缩胶中电压为60 V,进入分离胶后电压改为120 V。
1.3.6 总巯基含量的测定
参考Ellman[13]的方法。取1 mL蛋白溶液稀释至0.4 mg/mL,加入9 mL 0.2 mol/L Tris-HCl缓冲液(含8 mol/L尿素、10 mmol/L乙二酸四乙胺、质量分数2% SDS,pH 7.0),混匀后在室温下放置30 min,取4 mL,加入0.4 mL质量分数0.1% 5,5’-二硫代双(2-硝基苯甲酸)(5,5’-dithiobis-(2-nitrobenzoic acid),DTNB)(溶解在Tris-HCl溶液中,pH 8.0),在40 ℃反应25 min后,测定412 nm波长处的吸光度(A),以0.2 mol/L磷酸盐缓冲液为空白对照。计算公式如下:
式中:X为总巯基含量/(mol/105g);ρ0为蛋白质量浓度(0.4 mg/mL);D为稀释倍数;ɛ为摩尔消光系数(13 600 L/(mol·cm))。
1.3.7 乳酸脱氢酶、Ca2+-ATP酶、Mg2+-ATP酶活力的测定
肌原纤维蛋白的标准方程建立:准确称取3 g绞碎鱼肉于50 mL离心管中,加入30 mL提取液A(准确称取2.422 8 g Tris、7.455 g KCl,加入800 mL蒸馏水,搅拌溶解,用盐酸溶液调pH值至7.5,然后倒入1 000 mL容量瓶中并用蒸馏水定容至刻度线),匀浆液经4 ℃、10 000×g离心20 min,去上清液后在得到的沉淀中加入30 mL提取液B(准确称取2.422 8 g Tris、44.73 g KCl,加入800 mL蒸馏水,搅拌溶解,用盐酸溶液调pH值至7.0,然后倒入1 000 mL容量瓶中并用蒸馏水定容至刻度线),匀浆后离心取上清液,即为肌原纤维蛋白溶液。取6 支试管,分别加入0、0.2、0.4、0.6、0.8、1.0 mL牛血清白蛋白溶液(10 mg/mL),加蒸馏水至1 mL,即得质量浓度分别为0、2、4、6、8、10 mg/mL牛血清白蛋白溶液,加入4 mL双缩脲试剂,漩涡混匀,25 ℃下放置30 min,取出,用酶标仪测定560 nm波长处的吸光度,以蒸馏水作参比。以牛血清白蛋白质量浓度为横坐标,以吸光度为纵坐标,绘制出的标准曲线,其方程为y=0.005x+0.006 7,R2=0.998 1。
乳酸脱氢酶、Ca2+-ATP酶、Mg2+-ATP酶活力采用试剂盒测定,具体步骤参照测试盒说明书。
采用SPSS软件进行数据分析,Origin 8.0软件绘图,多重比较采用Duncan检验,P<0.05表示差异显著。
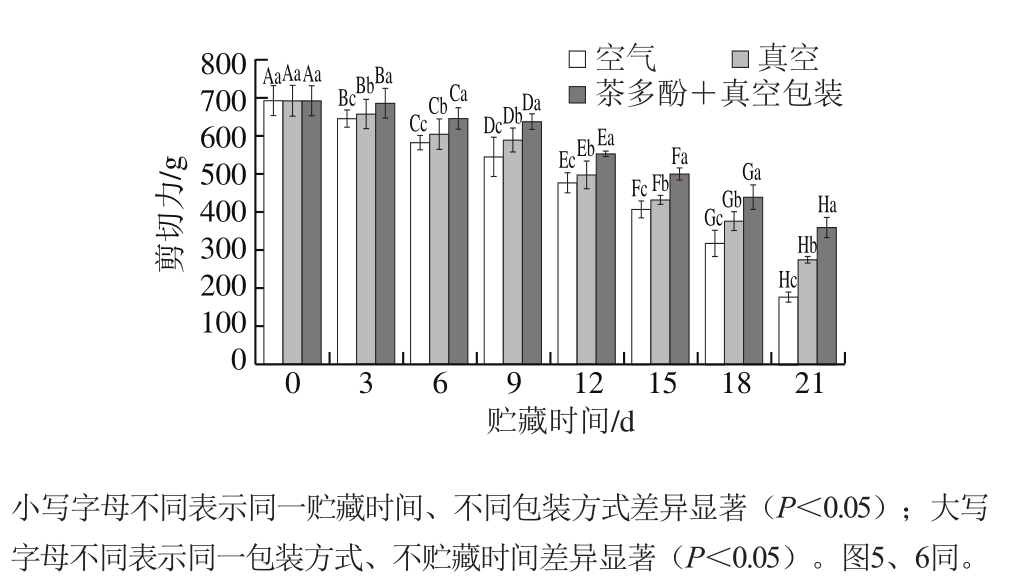
图1 不同处理对鲈鱼微冻贮藏过程中剪切力的影响
Fig.1 Effects of different treatments on shear force of perch during superchilled storage
如图1所示,在微冻贮藏期间不同处理组鲈鱼的剪切力均显著下降(P<0.05);在贮藏第21天时,空气包装处理组剪切力显著低于真空处理组和茶多酚+真空处理组(P<0.05)。鱼肉的剪切力下降,可能是由于微生物和酶的作用致使鱼肌肉蛋白发生降解,导致肌纤维遭到破坏,汁液流失增加,使组织结构变得较疏松。茶多酚+真空处理对鲈鱼剪切力的变化影响最小,可能是茶多酚的抗氧化性抑制了鱼肉蛋白质的降解,对肌原纤维蛋白有一定的保护作用。Li Tingting等[14]也发现茶多酚处理过的鲫鱼硬度要高于未经茶多酚处理组,Duun等[16]发现,在微冻贮藏过程中真空包装的鳕鱼比空气包装组的持水力更好。阙婷婷等[15]对乌鳢进行研究发现,相对于低温冻藏,微冻贮藏鱼肉失水率低,具有较好的持水力,质构特性较好。此次实验结果也表明,在微冻贮藏过程中茶多酚+真空包装处理组鲈鱼剪切力变化最小。
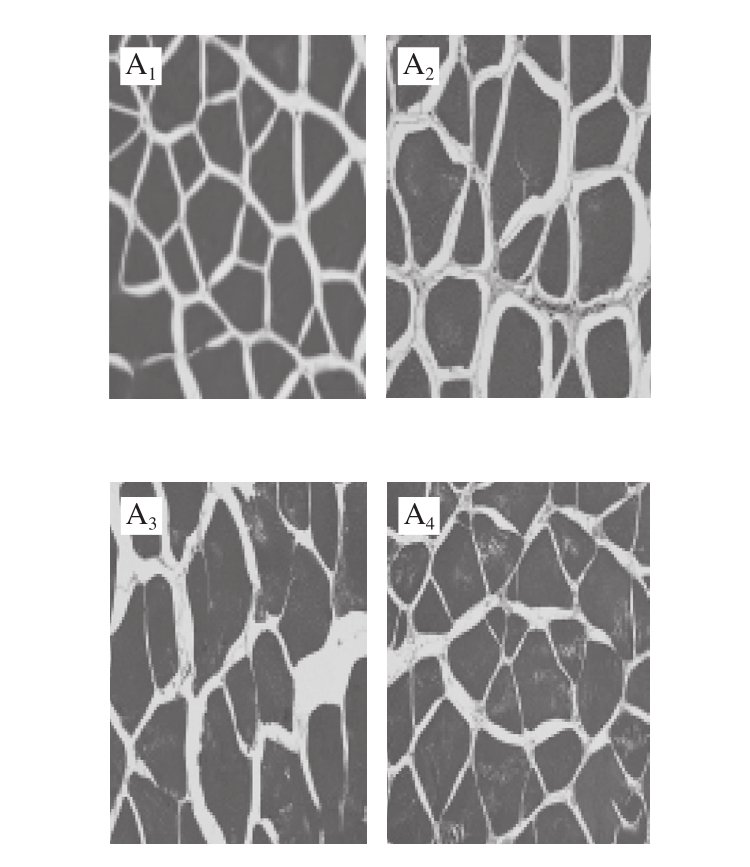
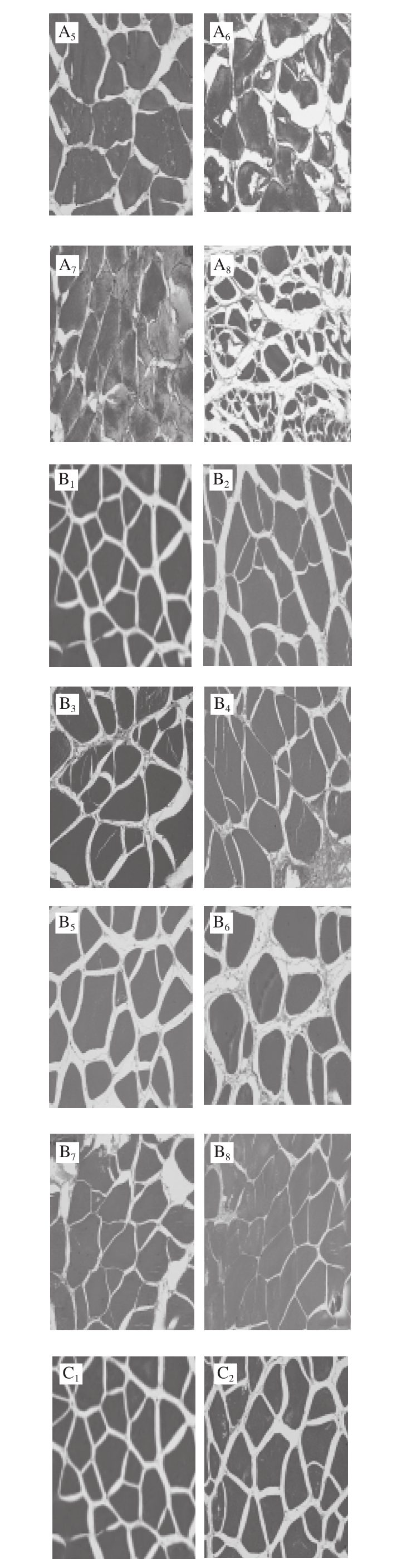

图2 不同处理对鲈鱼微冻贮藏过程中组织结构变化的影响
Fig.2 Effects of different treatments on microstructure of perch during superchilled storage
鱼肉组织结构的变化是判断肉类品质的重要因素,同时也能够反映出肌肉蛋白质分解与腐败程度。其中肌原纤维越细,排列越致密,肉质就越新鲜[17-18]。如图2所示,新鲜的鱼肉组织结构较为完整,且分布清晰均匀,肌内膜间隙较小但仍然丰满;这可能是鱼体死亡后鱼肉结缔组织发生轻微裂解所致。随着贮藏时间的延长,所有处理组鱼肉样品的肌纤维不断发生断裂,产生了许多小片状结构;与此同时肌纤维之间的间隙也逐渐增大,结构组织变得较为疏松。在-2 ℃贮藏条件下空气包装处理组在第15天时肌节间隙突然增大,肌纤维不断发生裂解,结构组织变得较为模糊。真空包装处理组中的鱼肉在第18天时的结构组织状态仍然好于空气包装处理组。而在贮藏末期(第21天)时茶多酚+真空处理组中的鱼肉肌纤维仍然较为清晰,组织结构仍然较为紧密,其组织结构状态显著优于其他两组;表明真空结合茶多酚处理对鲈鱼在贮藏期间肌原纤维结构的降解和组织质地的裂化具有较好的抑制作用,这与汪金林[19]研究茶多酚对冷藏养殖大黄鱼品质影响的结果一致。此外,Feng Lifang等[20]研究发现,茶多酚涂层结合臭氧水预洗黑鲷,对组织结构完整性的维持明显优于其他处理方式。
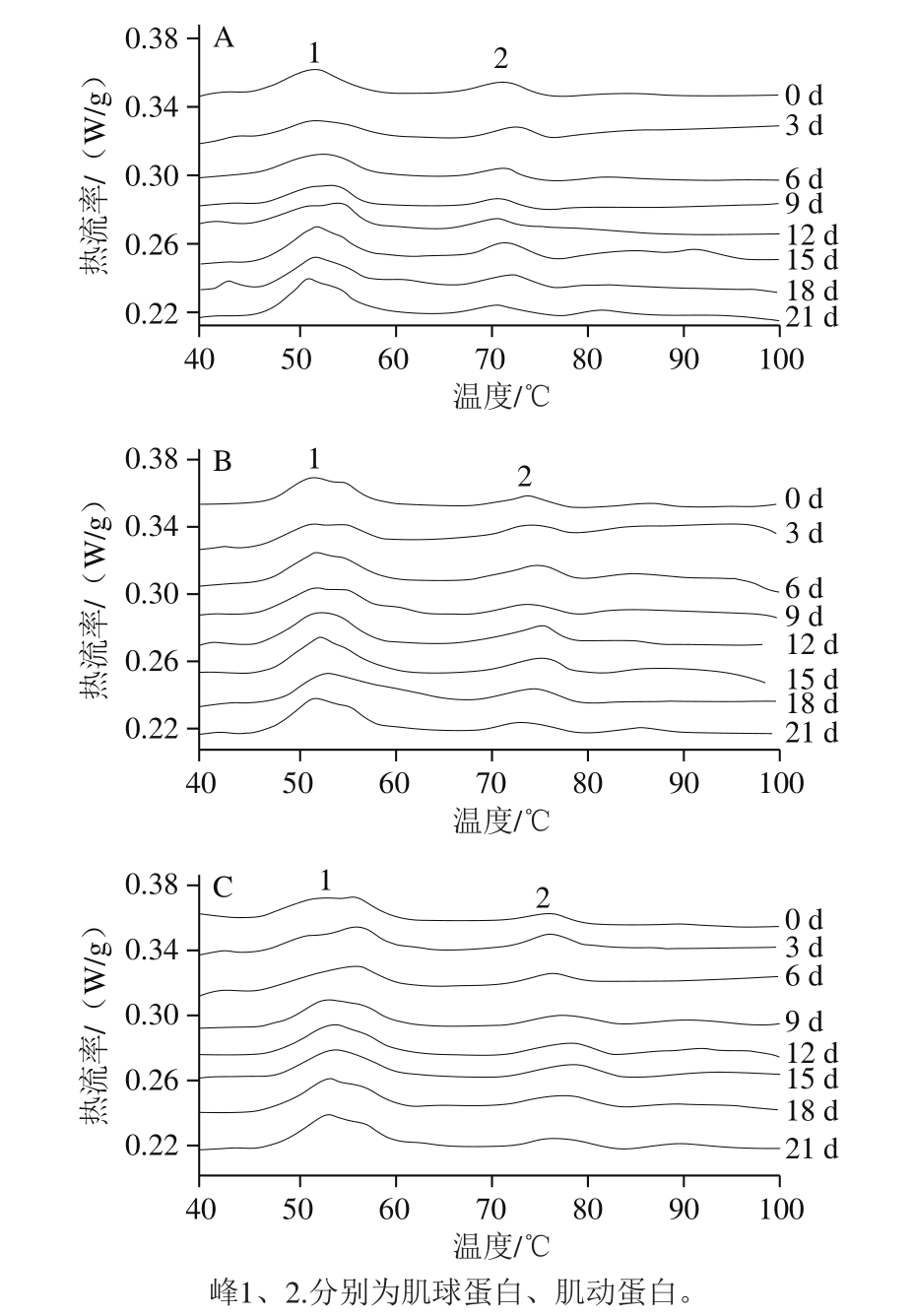
图3 不同处理对鲈鱼微冻贮藏过程中热流率变化的影响
Fig.3 Effects of different treatments on DSC curves of perch during superchilled storage
任丽娜[21]的研究表明,新鲜白鲢鱼肉肌球蛋白和肌动蛋白的变性温度分别为49 ℃和74 ℃。Tironi等[22]通过DSC分析发现大马哈鱼肌原纤维蛋白有3 个焓变点,分别为43.4、52.6 ℃和68.7 ℃,其中前2 个焓变点与肌球蛋白的变性相关,最后1 个与肌动蛋白的变性有关;因此图3中峰1和峰2分别对应于肌球蛋白和肌动蛋白。通过热分析软件Proteus Thermal Analysis 6.1.0计算图3相变温度和热焓值[23],发现在微冻贮藏过程中肌球蛋白所对应吸热峰的相变温度向低值方向移动,相变温度的减小是因为蛋白质热稳定性的损失,可见肌球蛋白在微冻贮藏过程中发生了变性;在空气对照组中肌球蛋白的相变温度和热焓值分别从第0天的51.9 ℃和1.299 J/g下降到了贮藏末期的50.8 ℃和1.007 J/g,分别下降了2.12%和22.48%。而真空和茶多酚+真空处理组肌球蛋白的相变温度和热焓值在贮藏末期第21天时分别为51.0、51.2 ℃和1.261、1.208 J/g,分别下降了1.73%、1.35%和2.93%、7.00%。与0 d相比,在21 d时茶多酚+真空处理组的肌球蛋白相变温度变化最小,说明此处理下肌球蛋白的变性程度最小;而在整个贮藏过程中肌动蛋白所对应的吸热峰2无显著变化,说明在微冻藏过程中,肌球蛋白比肌动蛋白更容易变性。Tironi等[22]也指出大马哈鱼在-11 ℃冻藏时,随着贮藏时间的延长,大马哈鱼肌球蛋白变性温度和变性热焓的变化十分显著,而肌动蛋白没有发生明显变化。
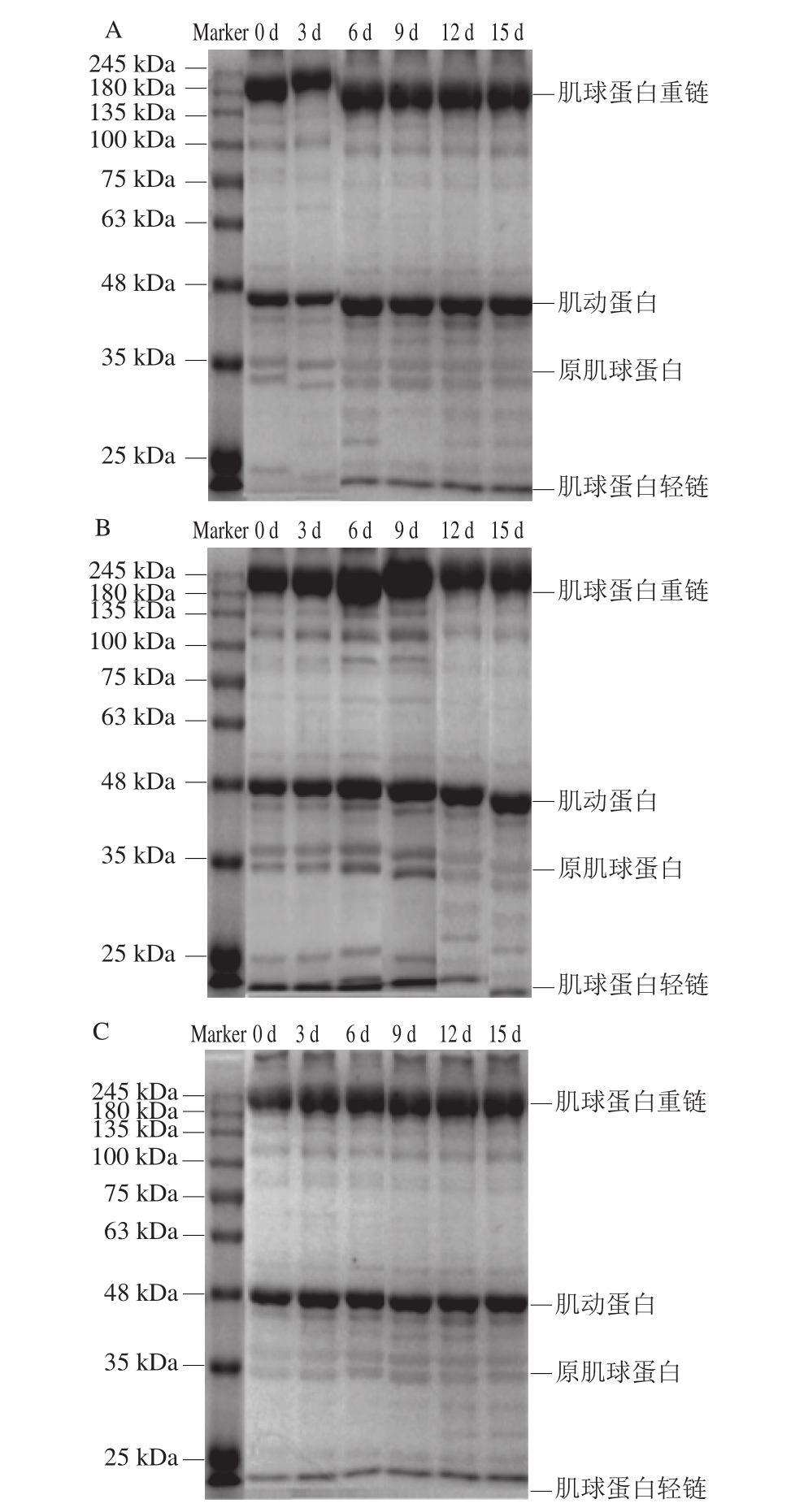
图4 不同处理对鲈鱼微冻过程中SDS-PAGE图谱变化的影响
Fig.4 Effects of different treatments on SDS-PAGE patterns of perch during superchilled storage
如图4所示,鲈鱼的肌原纤维蛋白包含肌球蛋白重链、肌动蛋白、原肌球蛋白和肌球蛋白轻链,是一个较为复杂的蛋白体系。其中肌球蛋白重链和肌动蛋白是最主要的蛋白质条带[24]。肌球蛋白重链、肌动蛋白和肌球蛋白轻链的分子质量分别为200、43 kDa和25 kDa,原肌球蛋白在SDS-PAGE中可分出2 条带,分子质量分别为34 kDa和36 kDa。
蛋白质分子降解的外在表现包括高分子质量条带的模糊、弱化、消失、扩展以及低分子质量条带的出现或浓度加强[25]。由图4可知,随着贮藏时间的延长,空气包装和真空包装处理组原肌球蛋白电泳条带变浅;在靠近肌动蛋白、原肌球蛋白处有新的小分子条带出现,说明在微冻贮藏过程中肌原纤维蛋白发生了变性。由图4还可发现,不同处理条件下的鲈鱼肌原纤维蛋白条带有差异,真空结合茶多酚包装处理组的图谱条带在贮藏过程中变化不明显,只在贮藏末期可看到肌原蛋白和肌球蛋白轻链间出现小分子质量条带,说明茶多酚对蛋白质有保护作用,可延缓肌原纤维蛋白的降解。Liu Dasong等[26]对草鱼蛋白质SDS-PAGE图谱进行分析也发现,草鱼片在3 ℃和0 ℃贮藏过程中,其电泳条带未出现明显变浅,这并不意味着蛋白质未分解,而是小分子质量蛋白质碎片太小而不能被检测到。
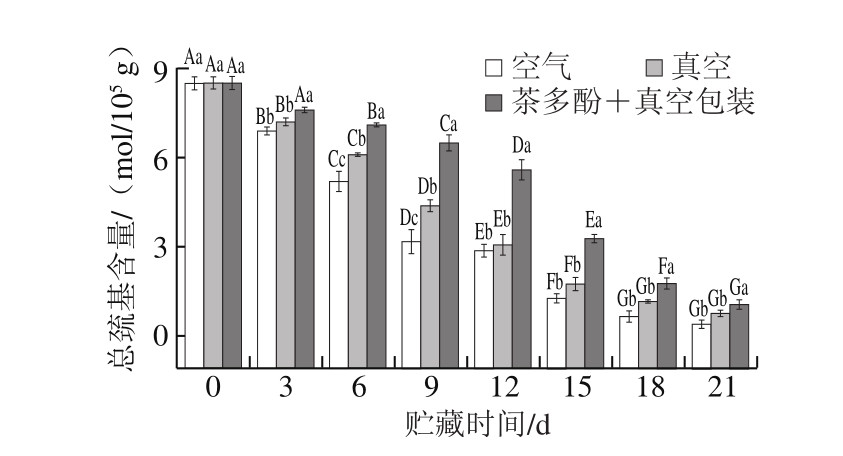
图5 不同处理对鲈鱼微冻过程中总巯基含量变化的影响
Fig.5 Effects of different treatments on total sulfhydryl content of perch during superchilled storage
由图5可以看出,随着贮藏时间延长,不同处理组样品的总巯基含量均呈现显著下降趋势,这可能与肌原纤维蛋白空间结构的变化有关。在低温藏过程中蛋白质分子内部结构的巯基氧化成二硫键[27],导致肌原纤维蛋白的空间结构遭到破坏,肌原纤维蛋白的总巯基含量相应减少[28]。总巯基在第0天含量为8.5 mol/105g,空气包装、真空处理和茶多酚+真空处理组在第21天时总巯基含量分别下降到0.45、0.81 mol/105g和1.10 mol/105g;茶多酚+真空处理组肌原纤维蛋白的总巯基含量下降速率显著低于空气包装和真空包装处理组(P<0.05),表明茶多酚可以很好地抑制总巯基含量的下降和肌原纤维蛋白的氧化,朱迎春等[25]研究也发现鲶鱼片经保鲜液处理后,在微冻贮藏中总巯基和羰基含量的下降受到了抑制。
乳酸脱氢酶和ATP酶的活力变化可作为检测鱼肉变质,特别是早期变质程度的指标。乳酸脱氢酶是体内能量代谢过程中的一个重要的酶。不同处理方式对鲈鱼乳酸脱氢酶活力的影响如图6A所示,新鲜鲈鱼随贮藏时间的延长,乳酸脱氢酶活力明显下降。第0天乳酸脱氢酶活力为3 569 U/g,贮藏第21天,包装处理组、真空处理组、茶多酚+真空处理组的酶活力分别降低至803.6、928.6、1 182 U/g,其中真空结合茶多酚处理组乳酸脱氢酶活力显著高于其他2 种处理方式(P<0.05)。
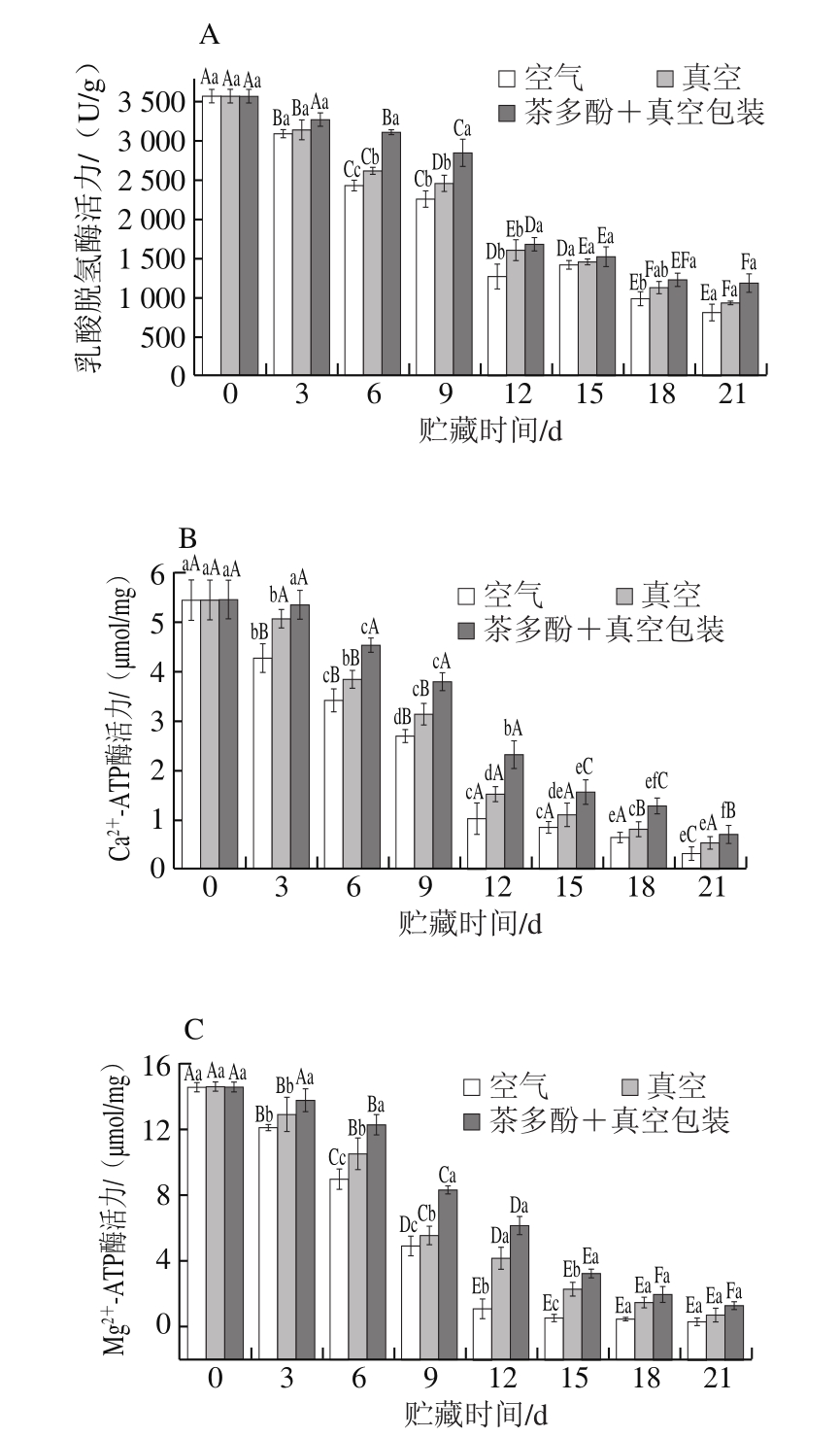
图6 不同处理对鲈鱼微冻过程中乳酸脱氢酶(A)、Ca2+-ATP酶(B)、Mg2+-ATP酶(C)活力变化的影响
Fig.6 Changes in lactate dehydrogenase (A),Ca2+-ATPase (B) and Mg2+-ATPase (C) activities of perch during superchilled storage
Ca2+-ATP酶活力可表征肌球蛋白头部性质[29],其活力越高,说明鱼肉蛋白质性质越稳定,变性程度越小,品质也越好。如图6B所示,随着贮藏时间的延长,Ca2+-ATP酶活力也出现明显下降,包装处理组Ca2+-ATP酶活力由初始5.44 µmol/mg下降至0.24 µmol/mg(21 d);真空处理组到第21天时下降至0.53 µmol/mg;茶多酚+真空处理组下降至0.70 µmol/mg,3 种不同包装处理下的鲈鱼Ca2+-ATP酶活力均有显著差异(P<0.05)。鱼类肌原纤维蛋白中的肌球蛋白分子包含的巯基位于肌球蛋白的球状头部,对Ca2+-ATP酶活力的维持起了重要作用,其氧化或聚集可能导致肌球蛋白头部构象发生改变,进而引起Ca2+-ATP酶活力的下降。
由图6C可知,Mg2+-ATP酶活力第0天为14.56 µmol/mg,空气包装处理组、真空处理组和茶多酚+真空处理组在第21天Mg2+-ATP酶活力分别为0.31、0.74 µmol/mg和1.29 µmol/mg。不同的处理方式对Mg2+-ATP酶活力变化均有一定影响,真空处理和茶多酚+真空处理组Ca2+、Mg2+-ATP酶活力变化速率显著低于空气包装处理(P<0.05)。低温下鱼肉肌浆网状结构的钙吸收能力下降,导致肌浆内Ca2+浓度增加,Ca2+具有激活Mg2+-ATP酶的作用,所以在前6 d Mg2+-ATP酶活力下降较为缓慢;而随着贮藏时间的延长,鱼肉肌浆网状结构被破坏,Ca2+浓度逐渐下降,对Mg2+-ATP酶的激活作用减弱,导致9 d后酶活力下降加快。
表1 能量代谢相关酶活力与品质变化的皮尔逊相关系数
Table1 Pearson's correlation coefficients between enzyme activities associated with energy metabolism and quality changes

注:*.相关显著(P<0.05);**.相关极显著(P<0.01)。
?
如表1所示,微冻贮藏下鲈鱼的3 种能量代谢酶活力均与总巯基含量呈现极显著相关性(P<0.01,r=0.99),表明ATP酶和乳酸脱氢酶活力与肌原纤维蛋白的降解相关,可以反映蛋白质的变性程度;可能是由于巯基的变化能影响酶活力中心上必需基团及底物与辅酶的解离程度,从而影响酶与底物之间的催化和结合特性[30]。剪切力与总巯基含量和ATP酶活力均呈现显著正相关,表明鲈鱼肌原纤维蛋白的变性会直接影响鱼肉的质构特性。
随着贮藏时间的延长,空气处理组鲈鱼剪切力、乳酸脱氢酶活力、ATP酶活力和总巯基含量下降,肌纤维松散,肌原纤维蛋白氧化加剧;乳酸脱氢酶和ATP酶活力会显著影响鲈鱼在微冻贮藏过程中蛋白质的氧化,蛋白质氧化进而使得鲈鱼质构特性劣化;与空气包装和真空包装组相比,茶多酚+真空处理可以更好地减缓鲈鱼在微冻贮藏过程中质构的劣化和蛋白质的变性,并抑制能量代谢酶活力的下降。
[1] 孙炜琳, 刘佩. 近10 年来我国水产品供求变化及趋势分析[J]. 农产品市场周刊, 2015(12): 54-57.
[2] 胡玥, 吴春华, 姜晴晴, 等. 微冻技术在水产品保鲜中的研究进展[J]. 食品工业科技, 2015, 36(9): 384-390. DOI:10.13386/j.issn1002-0306.2015.09.075.
[3] 阙婷婷, 郑家闻, 陈士国, 等. 微冻保鲜与冻藏保鲜对乌鳢品质的影响[J]. 中国食品学报, 2015, 15(6): 136-147. DOI:10.16429/j.1009-7848.2015.06.019.
[4] 陈思, 李婷婷, 李欢, 等. 白鲢鱼片在冷藏和微冻条件下的鲜度和品质变化[J]. 食品科学, 2015, 36(24): 297-301. DOI:10.7506/spkx1002-6630-201524055.
[5] ZHANG Bin, DENG Shanggui, LIN Huimin. Changes in the physicochemical and volatile flavor characteristics of Scomberomorus niphonius during chilled and frozen storage[J]. Food Science and Technology Research, 2012, 18(5): 747-754. DOI:10.4028/www.scientific.net/AMR.573-574.1057.
[6] ZHU Yingchun, MA Lizhen, Hua Yang, et al. Super-chilling (-0.7 ℃)with high-CO2packaging inhibits biochemical changes of microbial origin in catfish (Clarias gariepinus) muscle during storage[J]. Food Chemistry, 2016, 206: 182-190.
[7] 王勇, 李莉. 不同海拔地区牦牛组织线粒体LDH活性测定[J].安徽农业科学, 2008, 36(33): 14536-14537. DOI:10.13989/j.cnki.0517-6611.2008.33.130.
[8] 孙蕾蕾, 黄卉, 李来好, 等. 冰藏罗非鱼片能量代谢酶与品质的相关性分析[J]. 食品工业科技, 2015, 36(11): 70-74. DOI:10.13386/j.issn1002-0306.2015.11.006.
[9] NAMBUDIRI D D, GOPAKUMAR K. ATPase and lactate dehydrogenase activities in frozen stored fish muscle as indices of cold storage deterioration[J]. Journal of Food Science, 1992, 57(1): 72-76.
[10] 鲁珺, 余海霞, 杨水兵, 等. 液氮速冻对银鲳鱼品质及微观结构的影响[J]. 现代食品科技, 2015, 31(4): 210-216; 94. DOI:10.13982/j.mfst.1673-9078.2015.4.034.
[11] 鲁长新. 淡水鱼肌肉的热特性研究[D]. 武汉: 华中农业大学, 2007:15-26.
[12] LAEMMLI U K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J]. Nature, 1970, 227: 680-685.
[13] ELLMAN G L. Tissue sulfhydryl groups[J]. Archives of Biochemistry and Biophysics, 1959, 82(1): 70-77.
[14] LI Tingting, LI Jianrong , HU Wenzhong, et al. Shelf-life extension of crucian carp (Carassius auratus) using natural preservatives during chilled storage[J]. Food Chemistry, 2012, 135(1): 140-145.DOI:10.1016/j.foodchem.2012.04.115.
[15] 阙婷婷, 郑家闻, 陈士国, 等. 微冻保鲜与冻藏保鲜对乌鳢品质的影响[J]. 中国食品学报, 2015, 15(6): 136-147. DOI:10.16429/j.1009-7848.2015.06.019.
[16] DUUN A S, RUSTAD T. Quality changes during superchilled storage of cod (Gadus morhua) fillets[J]. Food Chemistry, 2007, 105(3): 1067-1075. DOI:10.1016/j.foodchem.2007.05.020.
[17] SOTELO I, PÉREZ-MUNUERA I, QUILES A, et al. Microstructural changes in rabbit meat wrapped with pteridium aquilinum fern during postmortem storage[J]. Meat Science, 2004, 66(4): 823-829.DOI:10.1016/j.meatsci.2003.08.014.
[18] 胡玥, 杨水兵, 余海霞, 等. 微冻保鲜方法对带鱼品质及组织结构的影响[J]. 食品科学, 2016, 37(18): 290-297. DOI:10.7506/spkx1002-6630-201618046.
[19] 汪金林. 茶多酚对冷藏养殖大黄鱼品质影响的研究[D]. 杭州: 浙江工商大学, 2013: 34-61.
[20] FENG Lifang, JIANG Tianjia, WANG Yanbo, et al. Effects of tea polyphenol coating combined with ozone water washing on thestorage quality of black sea bream (Sparus macrocephalus)[J].Journal of Food Science, 2012, 135(4): 2915-2921. DOI:10.1016/j.foodchem.2012.07.078.
[21] 任丽娜. 白鲢鱼肉肌原纤维蛋白冷冻变性的研究[D]. 无锡: 江南大学, 2014: 8-32.
[22] TIRONI V A, TOMAS M C, ANÓN M C. Structural and functional changes in myofibrillar proteins of sea salmon (Pseudopercis semifasciata) by interaction with malonaldehde (RI)[J]. Journal of Food Science, 2002, 67(3): 929-935.
[23] 邵颖, 王小红, 吴文锦, 等. 5 种淡水鱼肌肉热特性比较研究[J].食品科学, 2016, 37(19): 106-111. DOI:10.7506/spkx1002-6630-201619018.
[24] MIGNINO L A, PAREDI M E. Physico-chemical and functional properties of myofibrillar proteins from different species of molluscs[J]. LWT-Food Science and Technology, 2006, 39(1): 35-42.
[25] 朱迎春, 马俪珍, 党晓燕, 等. 不同天然保鲜液对气调包装冰温贮藏鲶鱼片品质的影响[J]. 农业工程学报, 2017, 33(1): 292-300.
[26] LIU Dasong, LI Liang, XIA Wenshui, et al. Biochemical and physical changes of grass carp (Ctenopharyngodon idella) fillets stored at -3 and 0 ℃[J]. Food Chemistry, 2013, 140(1/2): 105-114. DOI:10.1016/j.foodchem.2013.02.034.
[27] 施海峰, 高键, 应杰, 等. 水溶性壳聚糖对鱼糜制品保鲜效果的影响[J].南方水产科学, 2011, 7(4): 49-54.
[28] 郑微微. 海藻糖对防止淡水鱼糜蛋白冷冻变性的研究[D]. 长春: 吉林农业大学, 2011: 23-24.
[29] 董开成, 杨水兵, 余海霞, 等. 不同预冻条件对小黄鱼品质的影响[J]. 现代食品科技, 2015, 31(2): 225-231. DOI:10.13982/j.mfst.1673-9078.2015.2.037.
[30] 孙蕾蕾, 黄卉, 李来好, 等. 影响宰后鱼肉能量代谢和质构的酶及其活性测定方法研究进展[J]. 食品科学, 2014, 35(11): 348-355.DOI:10.7506/spkx1002-6630-201411067.
Effects of Energy Metabolism-Related Enzyme Activities and Protein Oxidation on Texture Properties of Perch(Micropterus salmoides) during Superchilled Storage