在食品加工贮藏过程中,水包油型(oil-in-water,O/W)乳状液由于其体系的不稳定性易发生氧化现象。在制备乳状液时,由于均质使油滴的体表面积增大,并在乳化过程中增加了水相的溶氧量,油与水的界面区域为不饱和脂肪酸和亲氧化合物(如金属离子)提供了接触的可能性[1],所以导致其在贮存过程易发生脂质氧化。脂质氧化产物会导致食物风味、颜色、质地的不良变化及营养价值的下降[2],而且形成的一些氧化产物很容易造成人体细胞或组织的损伤。因此,抑制乳状液食品在贮藏期间氧化至关重要。现今,食品工业中一般均使用国家批准的化学合成抗氧化剂,如丁基羟基茴香醚(butyl hydroxy anisd,BHA)、丁化羟基甲苯(butylated hydroxytoluene,BHT)等。但是,随着经济发展和生活水平的提高,人们对化学合成抗氧剂的疑虑日益增加。因此,具有高效、绿色、无毒副作用的天然抗氧剂在乳状液食品中的应用,更加符合消费者的潜在需求[3]。
在过去的10 a间,大量的研究发现,许多动物或者植物蛋白来源的水解物可以作为自由基清除剂、金属离子螯合剂或者与抑制脂质氧化的物质结合而起到抗氧化的作用[4-5]。在前期研究发现经过碱性蛋白酶水解5 h(重度水解)以后得到的猪血浆蛋白水解物(porcine plasma protein hydrolysate,PPPH)具有很强的自由基清除能力和金属离子螯合能力[6-7],而且在模拟脂质体系和肉糜中都表现出良好的抑制脂质氧化的能力[8-9]。但是,由于过长的水解时间产生的大量短肽或者小肽,对水解物的乳化性造成了很大的负面影响[7]。Jung等[10]研究发现,具有较高水解度的水解物大部分都会聚集在连续相中,而非吸附在油水界面上,是造成其较差乳化性的根本原因。另外,Lam等[11]研究发现,具有较大分子质量多肽的水解物中同时含有较多的疏水基团和亲水基团,因此在乳化体系的形成过程中,疏水基团能够与油滴相互结合,而亲水基团则通过空间位阻效应稳定整个体系中油滴的大小,从而达到提高乳状液稳定性的目的。然而,研究还发现,低水解度或者经过碱性蛋白酶适度水解得到的PPPH抗氧化活性一般,主要表现在其自由基清除活性和还原能力较弱[12]。因此,需要对较低水解度的PPPH进行必要的改性修饰,使其在具有较高乳化性的同时,还具有较强的抗氧化活性。
多酚类物质(如单宁酸、茶多酚、绿原酸等)具有较强的抗氧化活性,其与蛋白质之间发生的交互作用在食品加工中能够赋予产品特殊的性质和状态[13]。然而,在实际加工条件下,多酚类物质很容易被氧化,从而形成醌类物质。完全氧化的单宁酸能够作为一种良好的交联剂,用于改善蛋白质的功能性质。其氧化形成的邻苯醌通过侧链反应形成二聚物,此外,还能够与赖氨酸、蛋氨酸、半胱氨酸、色氨酸残基中亲核性基团反应,通过这些活性基团诱导多肽分子交联[14],从而提高水解物乳化能力。Strauss等[15]研究发现,氧化多酚类物质能够与蛋白质发生交联反应,形成稳固的分子结构,从而提高蛋白的功能性质。另外,Kim等[16]研究发现,多酚类物质(阿魏酸和焦性没石子酸)的氧化能够显著提高其抗氧化能力。与此同时,Intarasirisawat等[17]研究发现,利用氧化多酚修饰后的箭鱼籽蛋白水解物制备乳状液,能够显著抑制乳状液在贮藏期间脂质氧化的发生,而且显著提高乳状液在贮藏期间的物理稳定性。
基于此,本实验主要研究添加氧化单宁酸(oxidised tannic acid,OTA)能否提高以适度水解得到的PPPH作为乳化剂所制备的O/W型乳状液的氧化稳定性,分析探讨整个乳状液在贮藏期间的初级及次级脂质氧化产物的变化趋势,并利用荧光光谱分析色氨酸荧光强度和蛋白氧化产物的变化趋势。为PPPH和OTA在复杂的乳状液类食品体系中的应用提供一定的参考依据。
猪血浆蛋白粉(蛋白质量分数70%) 黑龙江北大荒肉类有限公司;碱性蛋白酶 丹麦Novozymes公司;菜籽油 恒大兴安有限公司;单宁酸、磷酸氢二钠、磷酸二氢钠、盐酸、硫代巴比妥酸(thiobarbituric acid reactive substances,TBARS)值、异辛烷、异丙醇、正丁醇等均为国产分析纯,实验用水均为超纯水。
JD500-2电子天平 沈阳龙腾电子称量仪器有限公司;AL-104型精密电子天平 上海梅特勒-托利多仪器设备有限公司;DK-8B热恒温水浴锅 上海惊宏实验设备有限公司;JB-2恒温磁力搅拌器 上海雷磁新径仪器有限公司;GL-21M冷冻离心机 湖南湘仪实验室仪器开发有限公司;T18匀浆机 德国IKA公司;UT-1800紫外-可见光分光光度计 北京普析通用仪器有限公司;JY92-IIN超声细胞粉碎机 宁波新芝生物科技股份有限公司;F-380型荧光分光光度计 天津港东科技发展股份有限公司。
1.3.1 PPPH的制备
参照Liu等[7]的方法将经过预热处理(95 ℃、5min)的猪血浆蛋白水溶液(质量分数4%、pH 8.0)加入碱性蛋白酶(酶与底物质量比为2∶100)置于55 ℃水浴水解1 h。水解过程以1 mol/L NaOH溶液调节pH值保持恒定(pH 8)。水解结束后95 ℃水浴5 min进行灭酶,用1 mol/L HCl溶液将水解液pH值调至7.0。水解物于9 000×g离心10 min除去悬浮物。
1.3.2 OTA的制备
参照Aewsiri等[18]方法制备OTA。单宁酸(2 g/100 mL)溶于蒸馏水,用1 mol/L NaOH溶液将pH值调至9。随后40 ℃条件下溶液通入高纯度氧气(99.5%)1 h,以确保单宁酸氧化为OTA。
1.3.3 PPPH乳状液的制备
菜籽油与PPPH溶液(质量分数4%、10 mmol/L磷酸盐缓冲溶液、pH 7.0)以体积比1∶9混合,用高速均质机在13 500 r/min均质2 min。然后将粗乳状液置于20 kHz,70%能量的条件下超声3min。然后,分别加入基于PPPH质量分数的OTA(0.1%、0.5%、1.0%、1.5%),再用高速均质机在13 500 r/min均质30 s。与此同时,在制备粗乳状液时,加入NaN3(0.2 g/L)作为抑菌剂。
1.3.4 脂质过氧化值测定
参照Uluata等[19]方法,采用硫氰化铁法测定乳状液于37 ℃贮藏条件下的脂质过氧化值(peroxidation value,POV)。取0.3 mL乳状液与1.5 mL异辛烷-异丙醇(3∶1,V/V)混合,旋涡振荡10 s(3 次)。1 000×g离心2 min后取0.2 mL有机相与2.8 mL甲醇-正丁醇(2∶1,V/V)混合,并加入15 μL、3.97 mol/L的硫氰酸铵和氯化亚铁溶液。室温反应20 min,于510 nm波长处测吸光度。以过氧化氢异丙苯做标准曲线,确定样品中的POV。
1.3.5 共轭二烯烃含量测定
参照Viljanen等[20]方法测定乳状液的共轭二烯烃(conjugated diene,CD)。取100 μL乳状液与1.5 mL异辛烷-异丙醇(3∶1,V/V)混合,旋涡振荡10 s(3 次)。548×g离心5 min获得有机相,取0.2 mL用异辛烷稀释到5 mL,混匀后234 nm波长处测量吸光度。CD值由下式计算:
式中: ε 为摩尔消光系数(25 200 L/(mol·cm));b为光程长度;A为吸光度。1.3.6 TBARS值测定
参照Intarasirisawat等[17]方法测定TBARS值。取1 mL乳状液与1 mL水及4 mL TBARS溶液混合(0.375 g TBARS、15 g三氯乙酸、1.76 mL 12 mol/L盐酸、82.9 mL水及3 mL 2% BHA溶液混合),沸水浴加热15 min,冷却至室温,取上清液于532 nm波长处测吸光度。以1,1,3,3-四乙氧基丙烷做标准曲线,确定样品中的TBARS值。
1.3.7 荧光光谱分析
参照Estévez等[21]的方法检测色氨酸荧光损失及蛋白质氧化产物(FP)荧光强度的变化情况。乳状液(检测色氨酸时取100 μL,FP取250 μL)用5mL磷酸盐缓冲溶液稀释(pH 7.0,0.01 mol/L)后置于石英荧光比色皿中。荧光参数:激发波长为283 nm时,记录300~400 nm间色氨酸发射光谱;激发波长为350 nm时,记录400~500 nm间FP发射光谱。其中,激发和发射狭缝宽度设置为10 nm,以 240 nm/min的速率收集数据。
每个实验重复3 次,结果表示为 ±s。数据统计分析采用Statistix 8.1(分析软件St Paul,MN)软件包中Linear Models程序进行,差异显著性(P<0.05)分析使用Tukey HSD程序。采用sigmaplot12.5软件作图。
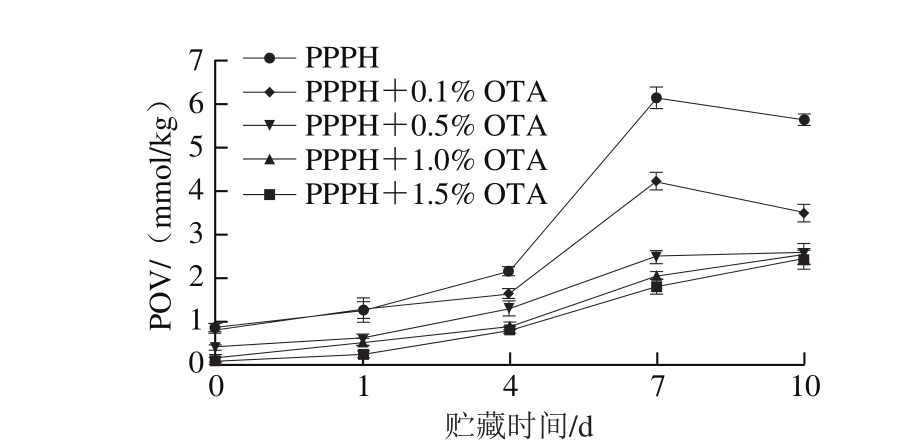
图1 不同质量分数OTA的添加对PPPH制备的O/W型乳状液在贮藏期间POV的影响
Fig. 1 Effect of OTA incorporation on POV of oil-in-water emulsion during storage
如图1所示,在37℃避光贮藏期间,所有样品POV大体上都呈现显著增加的变化趋势(P<0.05),其中,不添加OTA的PPPH乳状液的POV相比于其他实验组增加幅度较大,且在第7天POV达到最大,为6.13 mmol/kg。而添加基于PPPH质量分数0.5%、1%、1.5%的OTA乳状液POV在第7天仅为2.47、2.04、1.77 mmol/kg,并且乳状液的POV随着OTA添加量的增加而下降。一方面,脂质氢过氧化物的亲水亲油性决定了其主要位于油水界面处[22],而乳化后添加OTA促进了界面处PPPH的吸附,使得更多的PPPH可以通过提供氢离子结合油脂氧化过程中的脂肪酸自由基,并将其转化为稳定化合物而终止自由基链式反应,所以提高了氧化稳定性。而且界面处较多的肽可以减少油相和水相中金属离子的接触,从而有效地抑制金属氧化的发生[23]。此外,OTA的添加提高了油滴表面肽膜的厚度,从而形成致密的物理屏障而抑制氧的接触和渗透。另一方面,OTA可以诱导水相中PPPH分子内或分子间肽交联,使负电荷残基被屏蔽,导致负电荷的增多,这就意味着其可以与水相中带正电荷的Fe2+反应而减少促氧剂与脂质反应从而抑制氢过氧化物的形成。只添加PPPH及0.1% OTA的两组乳状液在贮藏后期POV出现下降趋势,这表明其乳化体系初级氧化完全后分解产生了次级氧化产物,氧化酸败的初始产物会分解产生醛、酮等小分子有害化合物,且氢过氧化物的生成速度小于其分解速度,而其他3 组POV依然呈现上升趋势,且POV一直较未添加OTA组低,该结果显示虽然PPPH作为天然抗氧化肽可以提高乳状液的氧化稳定性,但通过适量添加OTA可以在此基础上更加显著地减少氢过氧化物的形成。
不同质量分数OTA的添加对PPPH制备的O/W型乳状液在贮藏期间CD值的影响如图2所示。在10 d贮藏期间,所有样品CD呈现显著的上升趋势,且添加OTA的PPPH乳状液CD值较只添加PPPH的显著降低(P<0.05)。随着OTA质量分数的增加,脂质氧化产生的CD含量显著减少(P<0.05),其中,添加1.5% OTA的PPPH乳状液CD值在第10天仅为26.92 μmol/L。这可能是因为添加OTA提高了油水界面的PPPH覆盖率,不仅使更多的抗氧化氨基酸残基暴露于界面处,而且其疏水性末端减少了自由基与油脂不饱和脂肪酸的接触[24],抑制了不饱和脂肪酸氧化产生CD。鉴于油脂氧化主要发生于油水界面处,PPPH作为天然活性肽具有一定的抗氧化性,再次证明了OTA修饰的PPPH富集在氧化反应频繁发生的油水界面处。此外,OTA修饰的PPPH相互交联,在油滴表面形成较强的薄膜不仅可以阻碍氧的渗透和扩散,而且降低了乳状液液滴的絮凝,增加了液滴表面积处的抑氧物质的附着,从而减少脂质与金属离子反应。如图1和图2所示,相比于只添加PPPH的乳状液,乳化后添加OTA可以显著降低氧化初级阶段的氢过氧化物和CD含量(P<0.05),提高PPPH乳状液的氧化稳定性。
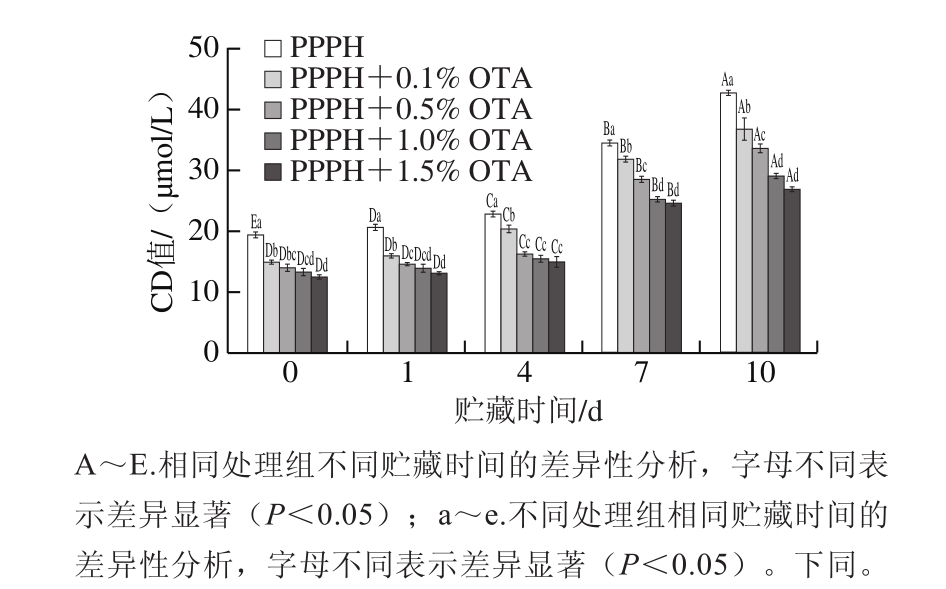
图2 不同质量分数OTA的添加对PPPH制备的O/W型乳状液在贮藏期间CD值的影响
Fig. 2 Effect of OTA incorporation on CD value of oil-in-water emulsion during storage
脂质氧化通过自由基链式反应机制进行,其氧化过程中间产物较多,其中以醛类化合物——丙二醛研究最为突出[25]。不同质量分数OTA的添加对PPPH制备的O/W型乳状液在贮藏期间TBARS值的影响如图3所示。乳状液的TBARS值随贮藏期的延长而增加,这与初级氧化POV及CD值变化趋势相一致。其中,只添加PPPH和0.1% OTA的乳状液在1~7 d贮藏期内表现较明显的TBARS值增加趋势,这说明虽然PPPH具有抗氧化活性,但其抗氧化效率较低,与之前的研究结果相一致[8]。而添加质量分数0.5%、1%、1.5% OTA的PPPH乳状液的TBARS值增加幅度很小,第10天时,与只含PPPH乳状液的TBARS值相比(9.81 mg/L,以丙二醛计),基于PPPH添加0.5%、1%、1.5% OTA的乳状液的TBARS值仅为1.47、1.41、1.1 mg/L,该结果表明乳化后添加OTA可显著降低乳状液TBARS值(P<0.05),明显抑制次级氧化,提高了乳化体系的氧化稳定性。有研究显示,氧化酚类化合物与蛋白相互作用相比于水相中游离酚可以更好地延缓脂质氧化[26]。图3揭示了OTA修饰的PPPH很好地抑制了丙二醛的形成,但是除丙二醛以外,初级氧化产物氢过氧化物还会分解成其他羰基化合物,在后续实验会进一步研究探讨OTA修饰的PPPH的抗氧化效果。此外,液滴大小、表面积、所带电荷及界面膜的厚度对乳状液氧化稳定性都有影响[27]。添加OTA的乳状液液滴表面覆盖水解物较多,减少了体系中游离脂肪酸与过渡金属离子的接触,也就避免了过度金属促进脂质氢过氧化物分解成高活性自由基(烷氧基、过氧自由基)及副产物(醛、酮、醇)[28]。Aewsiri等[18]研究发现OTA修饰的墨鱼鱼皮提取物相比于只添加提取物乳状液的TBARS值显著降低,尽管提高了乳状液中提取物的添加量,但对丙二醛的形成抑制作用依然较低。Intarasirisawat等[17]研究表明,添加OTA的鱼卵蛋白水解物(skipjack roe protein hydrolysate,SRPH)乳状液O/W界面蛋白多,界面膜较厚,形成的OTA-SRPH复合物可以抑制体系脂质氧化,显著地提高了乳状液的氧化稳定性,这与本实验的研究结果相吻合。

图3 不同质量分数OTA的添加对PPPH制备的O/W型乳状液在贮藏期间TBARS值的影响
Fig. 3 Effect of OTA incorporation on TBARS value of oil-in-water emulsion during storage
在贮藏期间,氨基酸的降解会引起色氨酸荧光损失,通过色氨酸荧光强度的变化可以间接反映乳状液蛋白氧化情况。不同质量分数OTA的添加对PPPH制备的O/W型乳状液在贮藏期间色氨酸荧光强度变化的影响如图4所示。所有乳状液样品在贮藏期间色氨酸荧光强度呈现显著下降的变化趋势(P<0.05)。最初色氨酸荧光强度取决于乳状液中PPPH的含量,新鲜乳状液中随着OTA质量分数的提高,色氨酸荧光强度显著降低(P<0.05),这是由于大部分色氨酸位于亲脂的蛋白表面[29],还有一部分位于蛋白结构内部,添加OTA后提高了油滴表面PPPH覆盖率,减少了暴露于水相中的色氨酸。而在贮藏期间,乳化体系中的金属离子(如Cu2+)可诱发色氨酸分解为自由基,直接与氧分子产生色氨酸过氧自由基,而通过蛋白覆盖于油滴表面的色氨酸会最先受脂质氧化的影响,导致这些自由基与脂质反应生成过氧化物。简单地来说,随着脂质氧化的进行,色氨酸随之降解损失,色氨酸荧光强度减弱。此外,色氨酸荧光强度的降低也有可能是氧化酚类芳香环与酪氨酸或色氨酸反应导致其荧光强度的降低[30]。
在贮藏期间,添加0.1% OTA的PPPH乳状液色氨酸荧光强度最高,且在贮藏期内该样品色氨酸荧光强度下降幅度最大,其发射光谱变化如图5所示。在283 nm激发波长处,色氨酸在340~360 nm发射波长处有最大峰值。色氨酸波峰随贮藏期延长而下降,且在贮藏后期下降较为明显,这是由于后期脂质初级氧化产物的增加,导致色氨酸残基与其反应产生蛋白氧化产物。Estévez等[17]发现色氨酸荧光损失与CD值呈负相关,脂质初级氧化产物越多,色氨酸氧化降解程度越大,荧光强度随之下降,这与本实验研究结果相一致。此外,酪氨酸残基易受到氧化修饰,这就导致其在310 nm波长处荧光强度下降。

图4 不同质量分数OTA的添加对PPPH制备的O/W型乳状液在贮藏期间色氨酸荧光强度的影响
Fig. 4 Effect of OTA incorporation on tryptophan fluorescence intensity of oil-in-water emulsions during storage

图5 添加0.1%OTA的PPPH制备的O/W型乳状液在贮藏期间色氨酸荧光发射光谱的变化
Fig. 5 Tryptophan fluorescence emission spectra of oil- in-water emulsion with 0.1% OTA added during storage
在贮藏期间,随着乳化体系脂质氧化产物的形成及氨基酸氧化降解导致了蛋白次级氧化产物的形成。不同质量分数OTA的添加对PPPH制备的O/W型乳状液在贮藏期间FP荧光强度的影响如图6所示。所有乳状液样品在贮藏期间FP荧光强度呈现显著上升的变化趋势(P<0.05)。随着OTA质量分数的增加,荧光蛋白氧化产物形成量随之减少。在氧化初期,色氨酸、酪氨酸氧化降解并与脂质初级和次级氧化产物反应形成FP,所以FP荧光强度的增加与色氨酸荧光损失的结果相吻合。同一贮藏时间内,随着OTA质量分数的增加,FP荧光强度显著下降(P<0.05),含0.1% OTA的PPPH乳状液的荧光强度是1.5% OTA实验组的1.5 倍。这是由于较高质量分数的OTA提高界面PPPH含量抑制脂质初级和次级氧化产生,间接减少了脂质氧化产物与PPPH反应生成FP。此外,肽链上的自由氨基与脂质次级氧化产物如醛类也可以导致荧光蛋白氧化产物的形成[31]。
其中,添加0.1% OTA的PPPH乳状液FP荧光强度最高,这说明其形成的次级荧光蛋白氧化产物最多,该乳状液贮藏期间FP荧光强度变化如图7所示。在350 nm激发波长处,FP在410 nm左右发射波长处有最大吸收峰值,且FP波峰随贮藏期延长而上升。在色氨酸氧化降解的同时,肽链上的其他芳香族氨基酸、含硫氨基酸的自由基与脂质氧化产物结合导致FP的增加[32]。
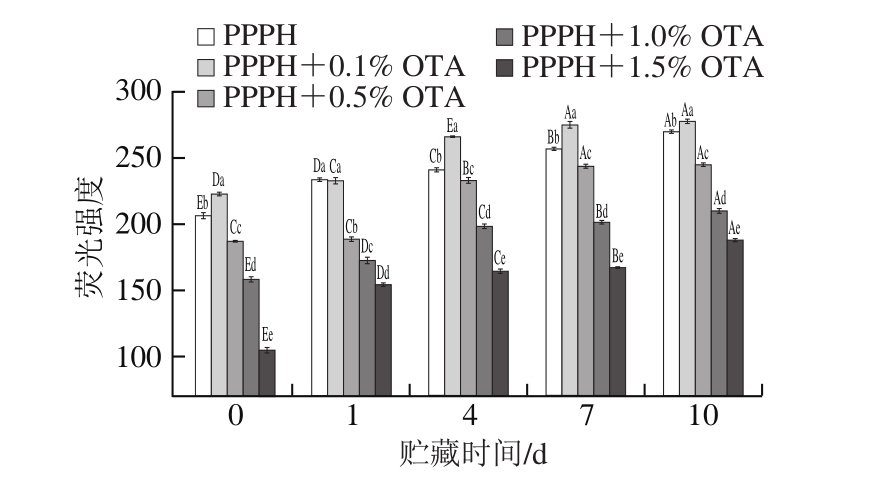
图6 不同质量分数OTA的添加对PPPH制备的O/W型乳状液在贮藏期间FP荧光强度的影响
Fig. 6 Effect of OTA incorporation on FP fluorescence intensity of oil-in-water emulsion during storage

图7 添加0.1%OTA的PPPH制备的O/W型乳状液在贮藏期间FP荧光发射光谱的变化
Fig. 7 FP fluorescence emission spectra of PPPH prepared oil-in-water emulsion with 0.1% OTA added during storage
本研究主要针对添加不同质量分数的OTA对以适度水解得到的PPPH作为稳定剂所制备的O/W型乳状液贮藏期间氧化稳定性的影响进行深入研究。通过测定乳状液在贮藏期间(0~10 d)的POV、CD、TBARS值以及色氨酸荧光强度和FP的变化趋势发现,随着OTA添加量的增加,明显降低了乳状液中POV、CD以及TBARS值。同时,色氨酸荧光强度和FP结果显示,添加OTA以后,能够明显提高整个乳状液在贮藏期间的氧化稳定性,而且存在添加质量分数依赖关系。因此,本实验为OTA在以蛋白水解物为乳化剂的乳状液中合理应用提供一定的参考依据。
[1] BERTON C C, ROPERS M H, GENOT C. Lipid oxidation in oil-in-water emulsions: involvement of the interfacial layer[J].Comprehensive Reviews in Food Science & Food Safety, 2014, 13(5):945-977. DOI:10.1111/1541-4337.12097.
[2] LEE C W, CHOI H M, SU Y K, et al. Influence of Perilla frutescens var. acutawater extract on the shelf life and physicochemical qualities of cooked beef patties[J]. Korean Journal for Food Science of Animal Resources, 2015, 35(3): 389-397.
[3] 凌关庭. 天然抗氧化剂及其消除氧自由基的进展[J]. 食品工业,2000(3): 19-22.
[4] GU M, CHEN H P, ZHAO M M, et al. Identification of antioxidant peptides released from defatted walnut (Juglans sigillata Dode) meal proteins with pancreatin[J]. LWT-Food Science and Technology, 2015,60(1): 213-220. DOI:10.1016/j.meatsci.2008.06.004.
[5] MORALES-MEDINA R, TAMM F, GUADIX A M, et al. Functional and antioxidant properties of hydrolysates of sardine (S. pilchardus)and horse mackerel (T. mediterraneus) for the microencapsulation of fish oil by spray-drying[J]. Food Chemistry, 2016, 194(1): 1208-1216.DOI:10.1016/j.foodchem.2015.08.122.
[6] LIU Q, KONG B H, JIANG L Z, et al. Free radical scavenging activity of porcine plasma protein hydrolysates determined by electron spin resonance spectrometer[J]. Food Science, 2009, 42(5): 956-962.DOI:10.1016/j.lwt.2008.12.007.
[7] LIU Q, KONG B, XIONG Y L, et al. Antioxidant activity and functional properties of porcine plasma protein hydrolysate as influenced by the degree of hydrolysis[J]. Food Chemistry, 2010,118(2): 403-410. DOI:10.1016/j.foodchem.2009.05.013.
[8] 刘骞, 孔保华. 猪血浆蛋白水解物抗氧化作用模式的研究[J]. 食品科学, 2009, 30(7): 15-19. DOI:10.3321/j.issn:1002-6630.2009.07.002.[9] 刘骞, 孔保华, 张宏伟, 等. 猪血浆蛋白水解物在生猪肉糜中抗氧化效果的研究[J]. 农产品加工: 学刊, 2009(10): 79-84. DOI:10.3969/j.issn.1671-9646(X).2009.10.021.
[10] JUNG S, MURPHY P A, JHONSON L A. Physicochemical and functional properties of soy protein substrates modified by low levels of protease hydrolysis[J]. Journal of Food Science, 2010, 70(2):C180-C187. DOI:10.1111/j.1365-2621.2005.tb07080.x.
[11] LAM R S H, NICKERSON M T. Food proteins: a review on their emulsifying properties using a structure-function approach[J].Food Chemistry, 2013, 141(2): 975-984. DOI:10.1016/j.foodchem.2013.04.038.
[12] 李月, 孔保华, 王超, 等. 蛋白酶种类及水解时间对猪血浆蛋白水解物抗氧化性和乳化性的影响[J]. 肉类研究, 2016, 30(12): 7-11.DOI:10.15922/j.cnki.rlyj.2016.12.002.
[13] BALANGE A, BENJAKUL S. Enhancement of gel strength of bigeye snapper (Priacanthus tayenus) surimi using oxidised phenolic compounds[J]. Food Chemistry, 2009, 113(1): 61-70. DOI:10.1016/j.foodchem.2008.07.039.
[14] HURRELL R F, FINOT P A. Nutritional consequences of the reactions between proteins and oxidized polyphenolic acids[J]. Advances in Experimental Medicine & Biology, 1984, 177(6): 423-435.DOI:10.1007/978-1-4684-4790-3_20.
[15] STRAUSS G, GIBSON S M. Plant phenolics as cross-linkers of gelatin gels and gelatin-based coacervates for use as food ingredients[J]. Food Hydrocolloids, 2004, 18(1): 81-89. DOI:10.1016/S0268-005X(03)00045-6.
[16] KIM T J, SILVA J L, JUNG Y S. Enhanced functional properties of tannic acid after thermal hydrolysis[J]. Food Chemistry, 2011, 126(1):116-120. DOI:10.1016/j.foodchem.2010.10.086.
[17] INTARASIRISAWAT R, BENJAKUL S, VISESSANGUAN W.Stability of emulsion containing skipjack roe protein hydrolysate modified by oxidised tannic acid[J]. Food Hydrocolloids, 2014, 41(20):146-155. DOI:10.1016/j.foodhyd.2014.03.034.
[18] AEWSIRI T, BENJAKUL S, VISESSANGUAN W, et al.Antioxidative activity and emulsifying properties of cuttlefish skin gelatin modified by oxidised phenolic compounds[J]. Food Chemistry,2009, 117(1): 160-168. DOI:10.1016/j.foodchem.2009.03.092.
[19] ULUATA S, MCCLEMENTS D J, DECKER E A. How the multiple antioxidant properties of ascorbic acid affect lipid oxidation in oil-inwater emulsions[J]. Journal of Agricultural & Food Chemistry, 2015,63(6): 1819-1824. DOI:10.1021/jf5053942.
[20] VILJANEN K, KYLLI P, KIVIKARI R, et al. Inhibition of protein and lipid oxidation in liposomes by berry phenolics[J]. Journal of Agricultural& Food Chemistry, 2004, 52(24): 7419-7424. DOI:10.1021/jf049198n.
[21] MARIO E, PETRI K, EERO P, et al. Fluorescence spectroscopy as a novel approach for the assessment of myofibrillar protein oxidation in oil-in-water emulsions[J]. Meat Science, 2008, 80(4): 1290-1296.DOI:10.1016/j.meatsci.2008.06.004.
[22] YUJI H, WEISS J, VILLENEUVE P, et al. Ability of surface-active antioxidants to inhibit lipid oxidation in oil-in-water emulsion[J]. Journal of Agricultural & Food Chemistry, 2007, 55(26): 11052-11056.
[23] KARGAR M, SPYROPOULOS F, NORTON I T. The effect of interfacial microstructure on the lipid oxidation stability of oil-in-water emulsions[J]. Journal of Colloid & Interface Science, 2011, 357(2): 527-533. DOI:10.1016/j.jcis.2011.02.019.
[24] BERTON C C, GENOT C, GAILARD C, et al. Design of interfacial films to control lipid oxidation in oil-in-water emulsions[J]. Food Hydrocolloids, 2013, 33(1): 99-105. DOI:10.1016/j.foodhyd.2013.02.021.
[25] FERNANDEZ J, PEREZ-ÁLVAREZ J A, FERNANDEZ-LOPEZ J A.Thiobarbituric acid test for monitoring lipid oxidation in meat[J]. Food Chemistry, 1997, 59(3): 345-353. DOI:10.1016/S0308-8146(96)00114-8.
[26] AEWSIRI T, BENJAKUL S, VISESSANGUAN W, et al. Emulsifying property and antioxidative activity of cuttle fish skin gelatin modified with oxidized linoleic acid and oxidized tannic acid[J]. Food and Bioprocess Technology, 2013, 6(4): 870-881.
[27] GUDIPATI V, SANDRA S, MCCLEMENTS D J, et al. Oxidative stability and in vitro digestibility of fish oil-in-water emulsions containing multilayered membranes[J]. Journal of Agricultural & Food Chemistry,2010, 58(13): 8093-8099. DOI:10.1021/jf101348c.
[28] KAUL S, SHARNA S S, MEHTA I K. Free radical scavenging potential of L-proline: evidence from in vitro assay[J]. Amino Acids, 2008, 34(2):315-320. DOI:10.1007/s00726-006-0407-x.
[29] BURSTEIN E A, VEDENKINA N S, IVKOVA M N. Fluorescence and the location of tryptophan residues in protein molecules[J].Photochemistry & Photobiology, 1973, 18(4): 263-279. DOI:10.1111/j.1751-1097.1973.tb06422.x.
[30] RAWEL H M, ROHN S, KRUSE H P, et al. Structural changes induced in bovine serum albumin by covalent attachment of chlorogenic acid[J]. Food Chemistry, 2002, 78(4): 443-455. DOI:10.1016/S0308-8146(02)00155-3.
[31] KAGAN V E. Lipid peroxidation in biomembranes[M]. CRC Press,1988.
[32] GARDNER H W. Lipid hydroperoxide reactivity with proteins and amino acids: a review[J]. Journal of Agricultural and Food Chemistry,1979, 27(2): 220-229. DOI:10.1021/jf60222a034.
Effect of Oxidized Tannic Acid on the Oxidative Stability of Oil-in-Water Emulsions Prepared Using Porcine Plasma Protein Hydrolysates as Emulsifier