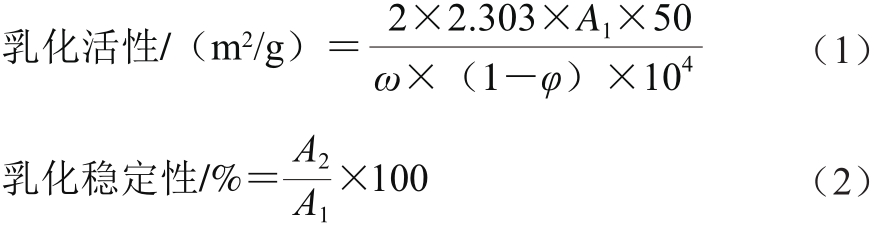
乳化作用是指两种不相混溶的液体如油和水中的一种以极小的粒子均匀地分散到另一种液体中形成乳状液的作用[1]。其中,把油滴分散到水中称为水包油型乳状液,水滴分散到油中则称为油包水型乳状液[1]。乳液经过机械搅打并且放置一段时间后,乳化体系中油水两相间试图减少接触面积,而出现乳析、聚集、奥氏熟化、聚结和相转变等现象,导致体系中油脂颗粒或者油滴粒径的变化[2]。根据乳状液中液滴粒径的大小不同,可将乳状液分为宏观乳状液(>1 μm)、纳米乳状液(50~500 nm)和微乳液(<50 nm)。在食品类乳状液中,液滴粒径在0.1~100 μm范围内[2]。理想化认为乳化肉糜中脂肪球直径大小为0.1~50 μm[3]。
脂肪酸按饱和程度可分为饱和脂肪酸和不饱和脂肪酸(unsaturated fatty acid,USFA)两大类,其中USFA分为单不饱和脂肪酸(monounsaturatedfatty acid,MUFA)和多不饱和脂肪酸(polyunsaturated fatty acid,PUFA)[4]。MUFA主要为油酸(C18:l),PUFA包括亚麻酸(C18:3)、亚油酸(C18:2)、DHA(C22:6)等[4-5]。油酸较易被人体吸收,能够减少高血脂的发生,也可抑制低密度脂蛋白的升高[6]。亚油酸是必需的脂肪酸,不仅能够降低胆固醇,而且可以预防动脉粥样硬化[7]。亚麻酸是含有3 个双键的多元不饱和脂肪酸[5],营养学界公认,如果婴幼儿、青少年成长期间长期缺乏亚麻酸,会严重影响智力的正常发育[8]。
本实验用油酸、亚油酸和亚麻酸这3 种脂肪酸处理肌肉盐溶性蛋白质溶液,研究USFA对肌肉盐溶性蛋白质乳化液乳化特性的影响,探究乳化液中脂肪酸和蛋白质的相互作用或者蛋白质与蛋白质相互作用对乳化液的影响情况,旨在改变脂肪酸组成、降低脂肪或者部分替代动物脂肪改善肉制品的保水保油和口感等。
新鲜猪背最长肌 锦州市大润发超市。油酸、亚油酸、亚麻酸、氯化钠、三聚磷酸盐、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、磷酸氢二钠、磷酸二氢钠、5,5’-二硫代二硝基苯甲酸盐、乙二胺四乙酸二钠等均为分析纯。
高速组织捣碎机 上海精科实业有限公司;磁力搅拌器 江苏国华仪器厂;UV2250紫外-可见分光光度计 日本岛津公司;T25 digital Ultra-turrak均质机德国IKA公司;BT-9300ST激光粒度分布仪 丹东市百特仪器有限公司;AL104电子天平 梅特勒-托利多仪器(上海)有限公司;Discovery DHR-1流变仪 美国TA公司;UMC-5C真空斩拌机 德国Stephan机械有限公司;BCD-215KALM立式冷藏柜 青岛海尔股份有限公司;电热鼓风干燥箱 上海跃进医疗器械厂;Nano ZS-90 Zeta电位仪 英国马尔文公司;D-37520温控离心机 德国Sigma公司。
1.3.1 肌肉盐溶性蛋白的提取及含量测定
肌肉盐溶性蛋白的提取根据Zorba[9]和亢春雨[10]等的方法进行。具体步骤如下:剔除瘦肉上可见的结缔组织和脂肪,切成肉丁,每100 g为一份,分装于聚乙烯真空包装袋中,置于-18 ℃贮藏备用。将100 mL 0.4 mol/L的NaCl溶液与25 g碎肉放入组织捣碎机,冰浴条件下18 000 r/min混合1 min,然后以8 000 r/min均质处理1 min。最后,用两层纱布过滤去掉结缔组织,提取的可溶性蛋白质量浓度的测定采用双缩脲法[11]。
1.3.2 乳化液的制备
稀释肌肉盐溶性蛋白质量浓度至40 mg/mL和10 mg/mL,分别取一定体积添加体积分数0%、1%、3%和5%油酸(亚油酸或亚麻酸),配制成脂肪酸和肌肉盐溶性蛋白混合液,并分装于直径为2.5 cm的塑料离心管中,在冰浴条件下用匀浆机9 500 r/min匀浆1 min,得到不同饱和程度脂肪酸与肌肉盐溶性蛋白乳化液。4 ℃保存备用,并在30 min之内全部用完。其中,蛋白质量浓度为10 mg/mL时配制的乳化液用于乳化特性、化学作用力、微粒粒度分布及Zeta电位的测定,而蛋白质量浓度为40 mg/mL时配制的乳化液用于流变学的测定。
1.3.3 乳化活性和乳化稳定性的测定
采用浊度法测定乳化活性及乳化稳定性[12-13]。蛋白质量浓度为10 mg/mL的乳化液经过冰浴匀浆后立即从距离心管底0.5 cm的地方取匀浆液100 μL(剩下的匀浆备用),加入到5 mL 0.1% SDS溶液中,振荡混匀后用紫外分光光度计在500 nm波长处测定吸光度A1,匀浆后10 min再次在相同位置取匀浆液100 μL,加入到5 mL 0.1% SDS溶液中,振荡混匀后测定吸光度A2,用0.1% SDS溶液作空白对照。每个处理组平行测定5 次,实验重复3 次。乳化活性和乳化稳定性分别由式(1)、(2)计算:
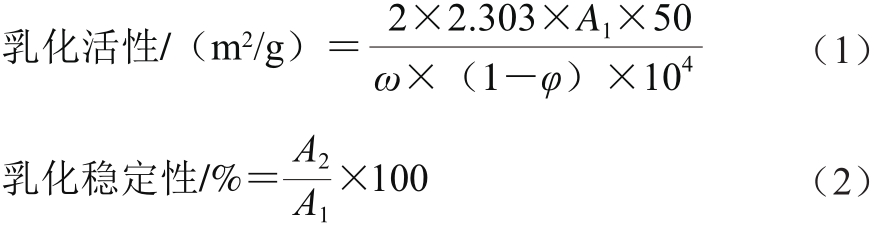
式中:ω为乳化前蛋白质量浓度/(g/mL);φ为乳化剂中油的质量分数/%;A1为0 min时的吸光度;A2为10 min时的吸光度。
1.3.4 乳化液表面活性巯基含量的测定
参考Ellman[14]和Beveridge[15]等方法,并适当修改,采用吸光度法进行表面活性巯基的测定,具体方法如下:15 mg样品溶解于5 mL不含尿素的上述Tris-Gly缓冲液中。而后加入50 μL Ellman试剂(5,5’-二硫代二硝基苯甲酸盐溶于Tris-Gly缓冲液,4 mg/mL),25 ℃保温反应60 min,离心(5 000×g,15 min),上清液在412 nm波长处测定吸光度,以含Ellman试剂的Tris-Gly缓冲液为空白对照。每个处理组平行测定5 次,实验重复3 次,计算如式(3)所示:
式中:A为除去试剂空白后样品的吸光度;D为稀释倍数;C为样品质量浓度/(mg/mL)。
1.3.5 乳化液微粒粒径的测定
采用BT-9300ST型激光粒度分析仪测定乳化肉糜微粒的大小,可得到微粒粒度分布图谱。具体参数设置如下:物质折射率实部为1.52,物质折射率虚部为0.10,介质折射率为1.33,分散剂为水,分析软件为配套软件[16]。其中,D10、D50和D90分别表示微粒的累计体积占颗粒体积群总体积的10%、50%和90%时的粒径大小,即小于该粒径的微粒体积占颗粒群总体积的10%、50%和90%[17],每个处理组平行测定3 次,实验重复3 次,测定D10、D50和D90并进行结果分析。
1.3.6 静态流变的测定
在40 mg/mL肌肉盐溶性蛋白溶液下,按油酸、亚油酸和亚麻酸添加量均分别为0%、1%、3%、5%配制得到脂肪酸与肌肉盐溶性混合液,并在冰浴条件下用匀浆机9 500 r/min匀浆1 min,利用流变仪测定其黏度-剪切速率曲线。参照张文会[18]的方法,并进行适当调整。测试条件为恒温15 ℃,测量板直径40 mm,测定模式Flow Sweep,剪切速率选定10 个(2、4、8、16、32、64、128、256、512、1 024 s-1),每个处理组平行测定3 次,实验重复3 次。
1.3.7 乳化液Zeta电位的测定
根据Crudden等[19]的测定方法,并适当修改,用Nano ZS-90 Zeta电位仪测定乳化液和蛋白溶液中蛋白的Zeta电位值,温度设置为25 ℃,每个处理组平行测6 次,实验重复3 次。
数据采用SPSS 19.0软件进行统计分析,采用ANOVA进行方差分析,数据进行正态分布检验,符合正态分布的多重比较采用Duncan’s法,不符合正态分布的用Kruskal-Wallis检验,P<0.05,差异显著,作图采用软件Origin 8.6和Sigma Plot 12.5。
乳化活性是蛋白质与蛋白质之间或者蛋白质与脂肪之间的相互作用[20],其增加有助于乳化物的形成[9]。从图1可以看出,随着脂肪酸添加量的增加,乳化液的乳化活性均呈整体上升趋势,并且增加幅度较大。在相同添加量脂肪酸的乳化液中,均表现为亚麻酸组>亚油酸组>油酸组。这证明脂肪酸的饱和程度对肌肉盐溶性蛋白起到了一种较好的乳化作用;这也可能是因为亚麻酸和亚油酸的添加使得乳化液中蛋白质与脂肪酸之间的相互作用或者是蛋白质分子之间的静电斥力增加,使得脂肪酸吸附的蛋白质量增加或者使得离散双电层加厚,溶液洁面膜增厚,从而形成更加致密稳定的蛋白质膜,因而增加了乳化液的乳化活性[21-22]。
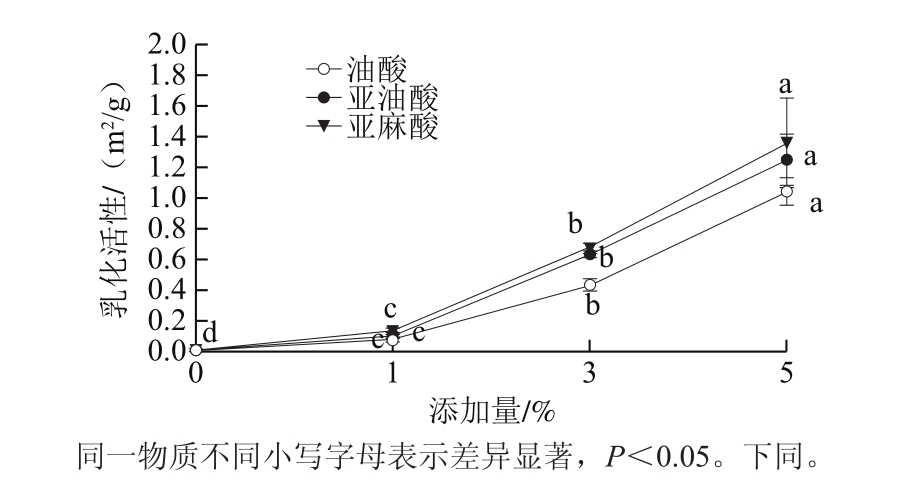
图1 脂肪酸对乳化液乳化活性的影响
Fig. 1 Effect of fatty acids on emulsifying activity
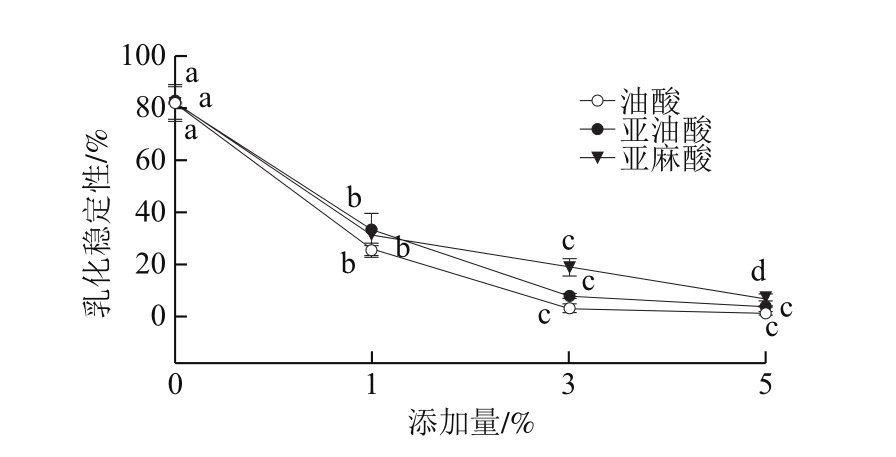
图2 脂肪酸对乳化液乳化稳定性的影响
Fig. 2 Effect of fatty acids on emulsion stability
从图2可以看出,随着添加量的增加,乳化液乳化稳定性均逐渐降低,当脂肪酸的添加量达到3%和5%时,各组乳化液的稳定性较低,且与添加量为0%和1%的处理组均具有显著性差异(P<0.05),此时的乳状液有明显的分层现象发生,这可能因为乳状液的分散相液滴在体系中处于永不停止的布朗运动,产生了不同程度的失稳现象[23]。此外,添加油酸和亚油酸的乳化液乳化稳定性,均表现添加量为3%和5%之间差异不显著。但是,当脂肪酸添加量为3%和5%时,同种添加量下乳化液乳化稳定性均是表现为亚麻酸组>亚油酸组>油酸组。这说明脂肪酸添加量在一定条件下,脂肪酸的饱和程度对乳状液贮藏稳定性有很大影响。此外,3%脂肪酸的添加量比5%脂肪酸添加量的乳状液稳定性高,5%脂肪酸添加量的乳状液分层高度最大,这说明5%添加量的条件下,脂肪酸-全肉盐溶性蛋白乳化液容易发生聚集和桥联现象,导致乳状液的不稳定现象发生[24]。同时,这也可能是因为5%的脂肪酸添加量下由于没有足够的蛋白质包裹脂肪酸的液滴,部分脂肪酸液滴重新聚集成团,重新形成油层分布在溶液的上部[24]或者是形成较多的蛋白质膜因重力的作用下沉导致分层严重。
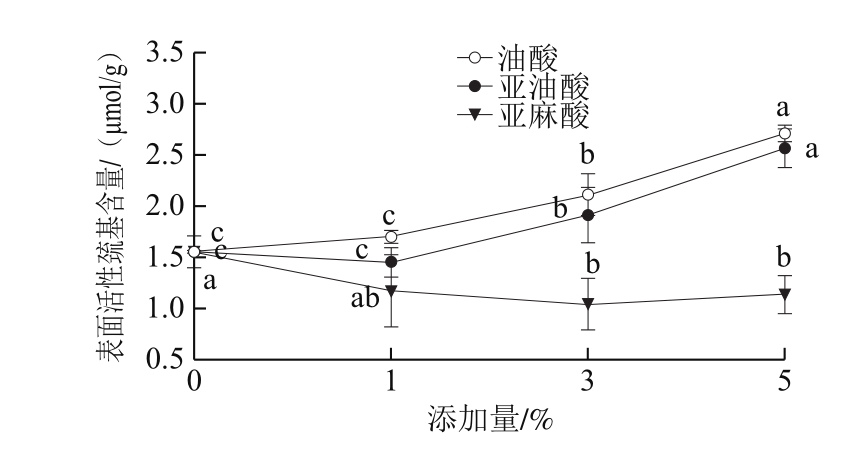
图3 脂肪酸对乳化液表面活性巯基的影响
Fig. 3 Effect of fatty acids on surface active sulfhydryl content of emulsion
蛋白质分子中,巯基是最具活性的功能基团[22,25]。巯基存在于肌球蛋白分子内部,当肌球蛋白结构发生变化,暴露出自由巯基,这些自由巯基就会发生氧化反应,然后形成二硫键[22,25]。由图3可以看出,油酸和亚油酸组均随着脂肪酸添加量的增加,乳化液的表面活性巯基也明显增加(P<0.05),而亚麻酸组随着添加量的增加,乳化液的表面活性巯基变化并不明显,这说明油酸和亚油酸的添加量(1%~5%)可能会使得肌球蛋白结构发生较大变化,暴露出较多的自由巯基,进而发生氧化反应形成二硫键,使得全肉盐溶性蛋白的表面巯基含量也随之增加[22,25]。此外,在整个添加量变化的过程中,表面活性巯基的含量始终表现为油酸组>亚油酸组>亚麻酸组,这说明添加亚麻酸会降低全肉盐溶性蛋白的表面巯基含量,而添加油酸会更好地使肌球蛋白结构发生变化,从而暴露出较多的自由巯基。
实际食品乳化液中微粒尺寸分布在一定范围内,属于多分散乳状液,多分散相乳状液可以用单峰、双峰或者多峰表示,这主要取决于微粒尺寸分布的峰值数量[16-17,26]。由图4可知,横坐标是乳化液微粒的直径大小,纵坐标是某一粒径的微粒占颗粒群总体积的百分比。整体上油酸、亚油酸和亚麻酸组的乳化液粒度分布曲线均呈现“单峰”型。其中,各处理组均在微粒粒径大小为10 μm左右出现明显的峰值,而且在微粒粒径大小为40 μm左右时,分布曲线微微上升,但未形成明显的峰。各处理组与空白组对比可以看出,各处理组的微粒粒度分布曲线均比空白组的分布曲线左移,并且添加量越大分布曲线发生左移的现象越明显,从油酸、亚油酸和亚麻酸的添加量方面可以得出,添加量越少意味着乳化液中生成了更多的肌动球蛋白聚集体[27]。
此外,油酸空白组的峰值明显高于其他处理组,并且在出现峰值之前,在微粒粒径大小为1~10 μm之间时,体积分数始终表现为5%油酸>3%油酸>1%油酸>空白,但在出现峰值之后,表现结果恰恰相反,这也说明了添加量越大分布曲线发生了规律性的左移现象;亚油酸各处理组的峰值变化并不明显,且峰值出现前后各处理组的变化与油酸添加量的变化相似;5%添加量的亚麻酸组出现的峰值达到4.21%,明显高于其他亚麻酸组,同时也高于油酸和亚油酸各处理组的峰值,这说明在一定的微粒粒径大小范围内,5%亚麻酸组可以较好地与全肉盐溶性蛋白相互作用,使得5%亚麻酸较好地被盐溶性蛋白包裹或者被蛋白质基质物理镶嵌[28],从而得到的乳化液颗粒比较均一,集中程度较好。
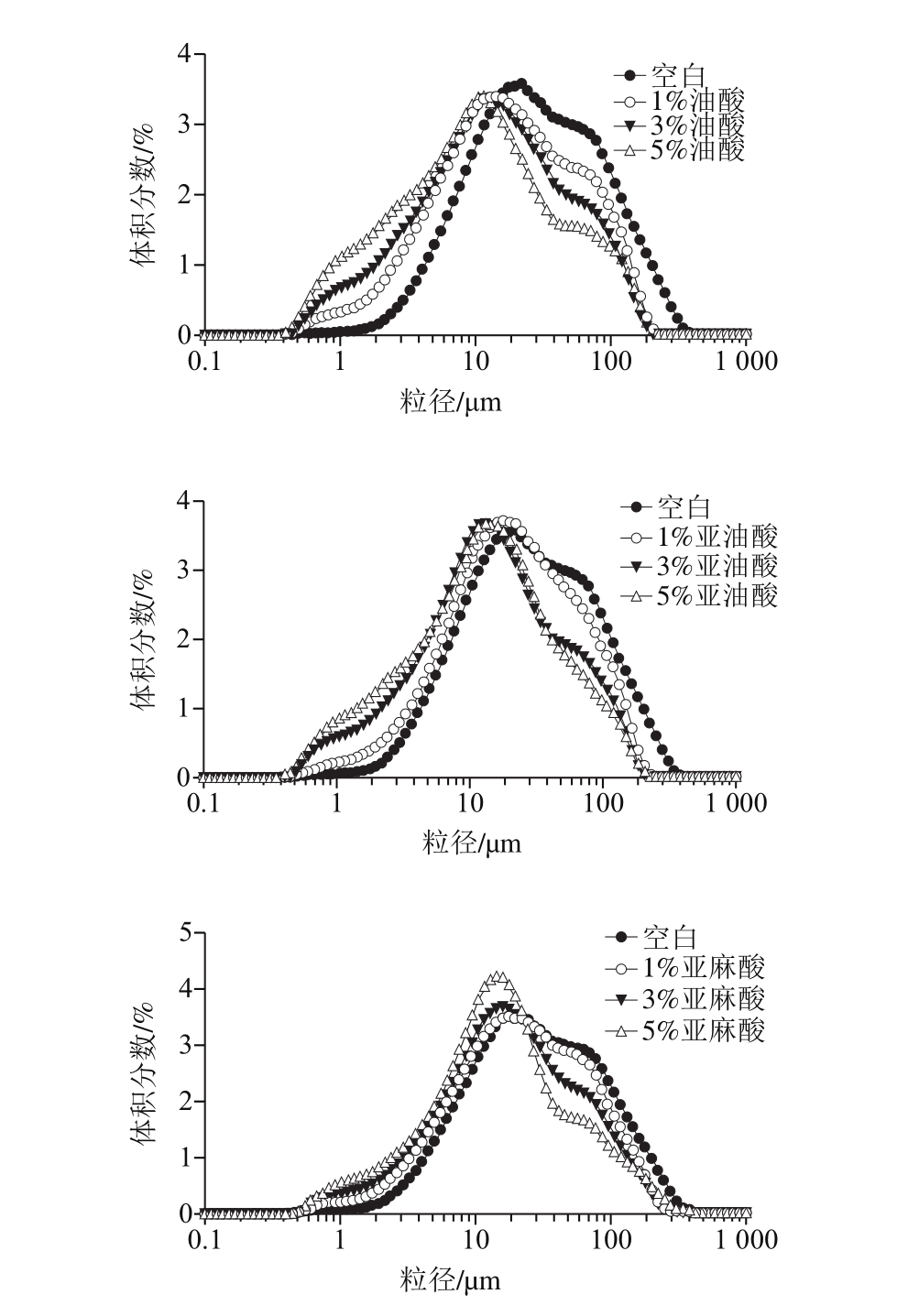
图4 乳化液微粒粒度体积分数分布
Fig. 4 Particle size distribution of emulsion
由图5可以看出,所有处理组在微粒粒径小于10 μm时,累计分布曲线变化较缓慢,随后分布曲线急速上升,最后趋于100%。而且,油酸、亚油酸和亚麻酸各处理组的微粒粒径累计分布,均表现的是空白组<1%<3%<5%。
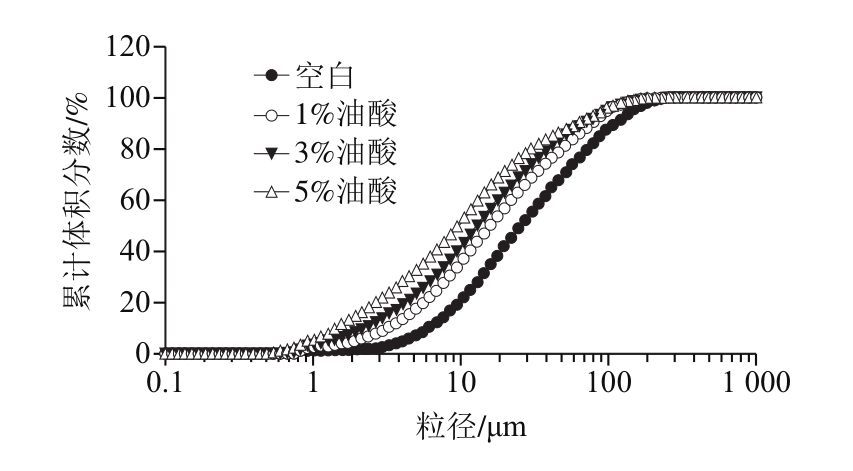
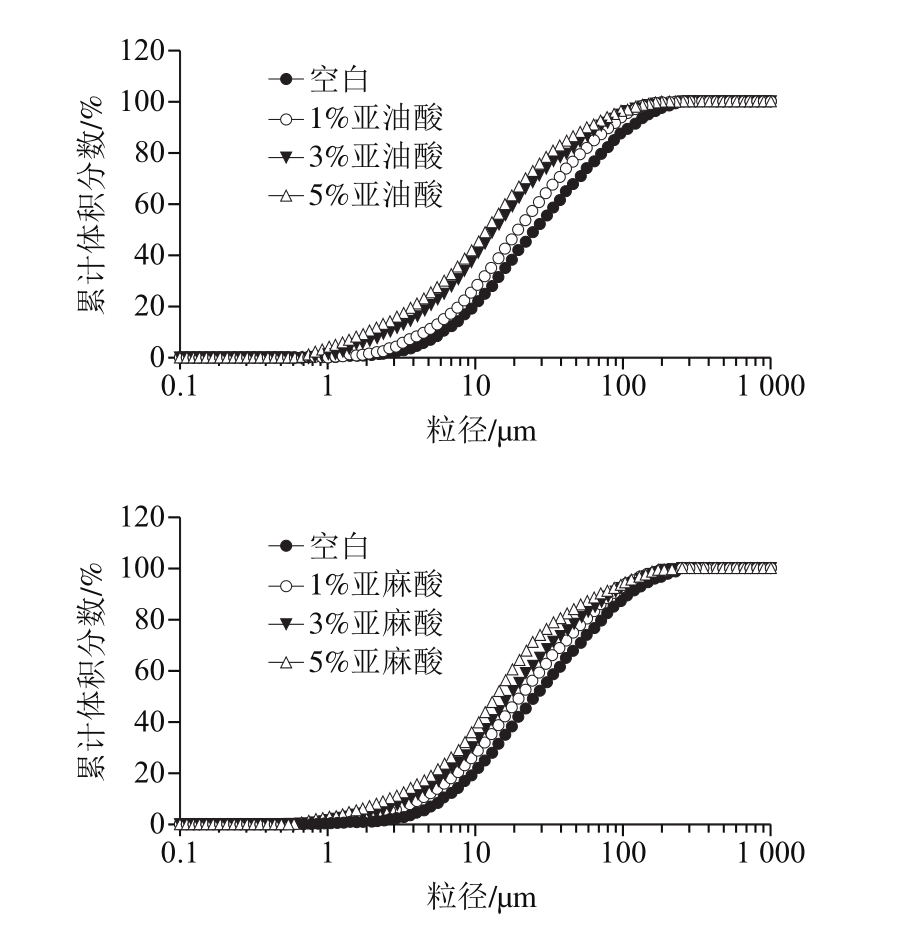
图5 乳化液微粒累计体积分数分布
Fig. 5 Cumulative particle size distribution of emulsion
粒度是描述一组颗粒降解程度的一个数学函数,它被定义为在一定范围内,通过测量得到的该颗粒的相对数量[29]。由表1可以看出,随着各脂肪酸添加量的增加,乳浊液中D10、D50和D90对应的粒径大小均显著性降低(P<0.05),这说明在一定的添加量范围内,全肉盐溶性蛋白能够较好地乳化油酸、亚油酸和亚麻酸,使得肌肉盐溶性蛋白在脂肪酸颗粒或液滴周围形成界面蛋白膜,减少脂肪酸颗粒或液滴的聚集[9],进而使得乳化液中的颗粒粒径大小降低。此外,在各种脂肪酸添加量一定的情况下,各处理组中微粒大小均表现为D10<D50<D90。当脂肪酸添加量达到3%时,乳化液中D10、D50和D90对应的微粒大小,则表现为油酸组<亚油酸组<亚麻酸组,这也说明随着添加量的增加,乳化液中没有足够的蛋白质来包裹脂肪酸的液滴,部分脂肪酸液滴重新聚集成团易发生聚集和桥联现象[24]。
表1 脂肪酸对乳化液粒径大小的影响(n=9)
Table 1 Effect of fatty acids on particle size distribution of emulsion (n= 9)
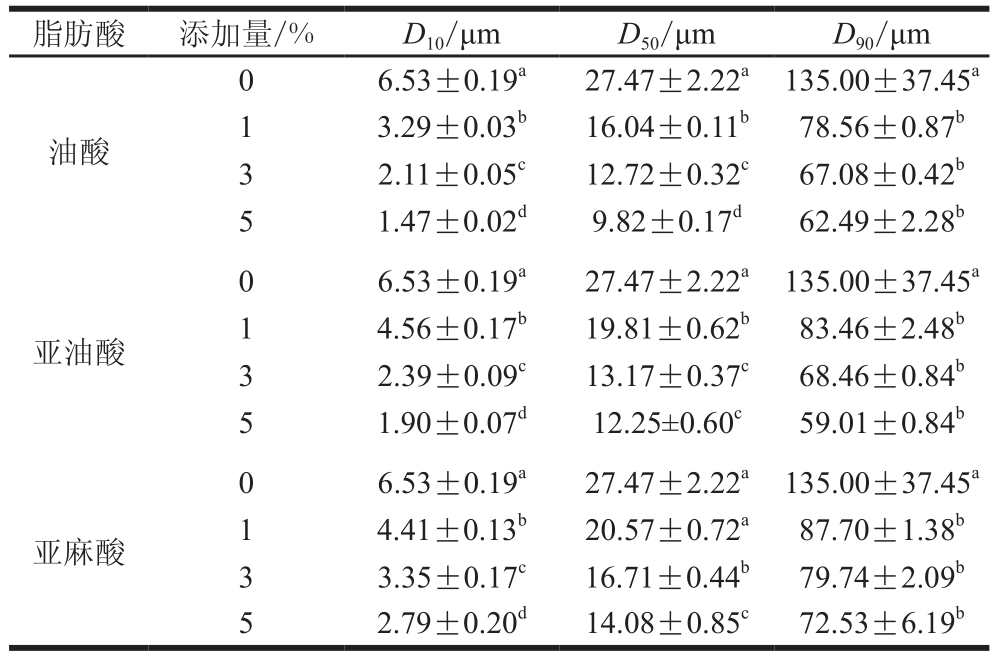
注:同一脂肪酸同列不同小写字母表示差异显著,P<0.05。
脂肪酸 添加量/% D10/μm D50/μm D90/μm油酸0 6.53±0.19a27.47±2.22a135.00±37.45a1 3.29±0.03b16.04±0.11b78.56±0.87b3 2.11±0.05c12.72±0.32c67.08±0.42b5 1.47±0.02d9.82±0.17d62.49±2.28b亚油酸0 6.53±0.19a27.47±2.22a135.00±37.45a1 4.56±0.17b19.81±0.62b83.46±2.48b3 2.39±0.09c13.17±0.37c68.46±0.84b5 1.90±0.07d12.25±0.60c59.01±0.84b0 6.53±0.19a27.47±2.22a135.00±37.45a1 4.41±0.13b20.57±0.72a87.70±1.38b3 3.35±0.17c16.71±0.44b79.74±2.09b5 2.79±0.20d14.08±0.85c72.53±6.19b亚麻酸

图6 不同剪切速率下脂肪酸对乳化液剪切应力的影响
Fig. 6 Effect of different amounts of fatty acids added on shear stress of emulsions at different shear rates
流动行为和黏性特征是食物中蛋白质的重要功能性质,对乳化液和悬浮粒子提供物理稳定性,并且还能够改善食品的口感和整体的品质[30]。由图6可知,乳化液的剪切应力随着剪切速率的增加均呈现先缓慢增加后急速上升的趋势,这一结果与Erçelebi等[31]研究乳清分离蛋白中添加果胶和瓜尔豆胶的研究结果相似。
当剪切速率在2~256 s-1范围内时,各组剪切应力随剪切速率缓慢上升,此阶段可能是脂肪酸和蛋白质竞争吸附的过程,表面的剪切应力开始被表面活性物质所控制[32]。当剪切速率超过256 s-1,各组的剪切应力急剧上升,此时由于摩擦产生了大量热量,探头表面瞬间产生的高温使周围的脂肪酸进一步熔化成更小的液态脂肪滴,这些形状大小不同的脂肪滴周围表面生成大量蛋白膜,分布在蛋白基质中,由于这些蛋白膜的束缚或者限制了乳化液的流动,使得乳化液不易发生流动[33-34],因此需要较大的剪切应力。
剪切稀化在乳液的流变特性研究领域中是最常遇到的现象,它表现为剪切速率越大,黏度则越小的趋势[35]。由图7可知,随着剪切速率的增大,所有处理组的乳化液黏度均逐渐减小,最后趋于平缓。其中,在较低的剪切速率下,随着剪切速率的增大乳化液黏度急剧下降;在较高的剪切速率下,随着剪切速率的增大乳化液黏度下降幅度很小,主要原因可能是在剪切应力作用下乳化液中液滴的取向作用远高于布朗运动所引起的随机效应,黏度随之下降,当剪切作用力达到一定程度时,液滴定向排布,黏度趋于定值[16,36]。
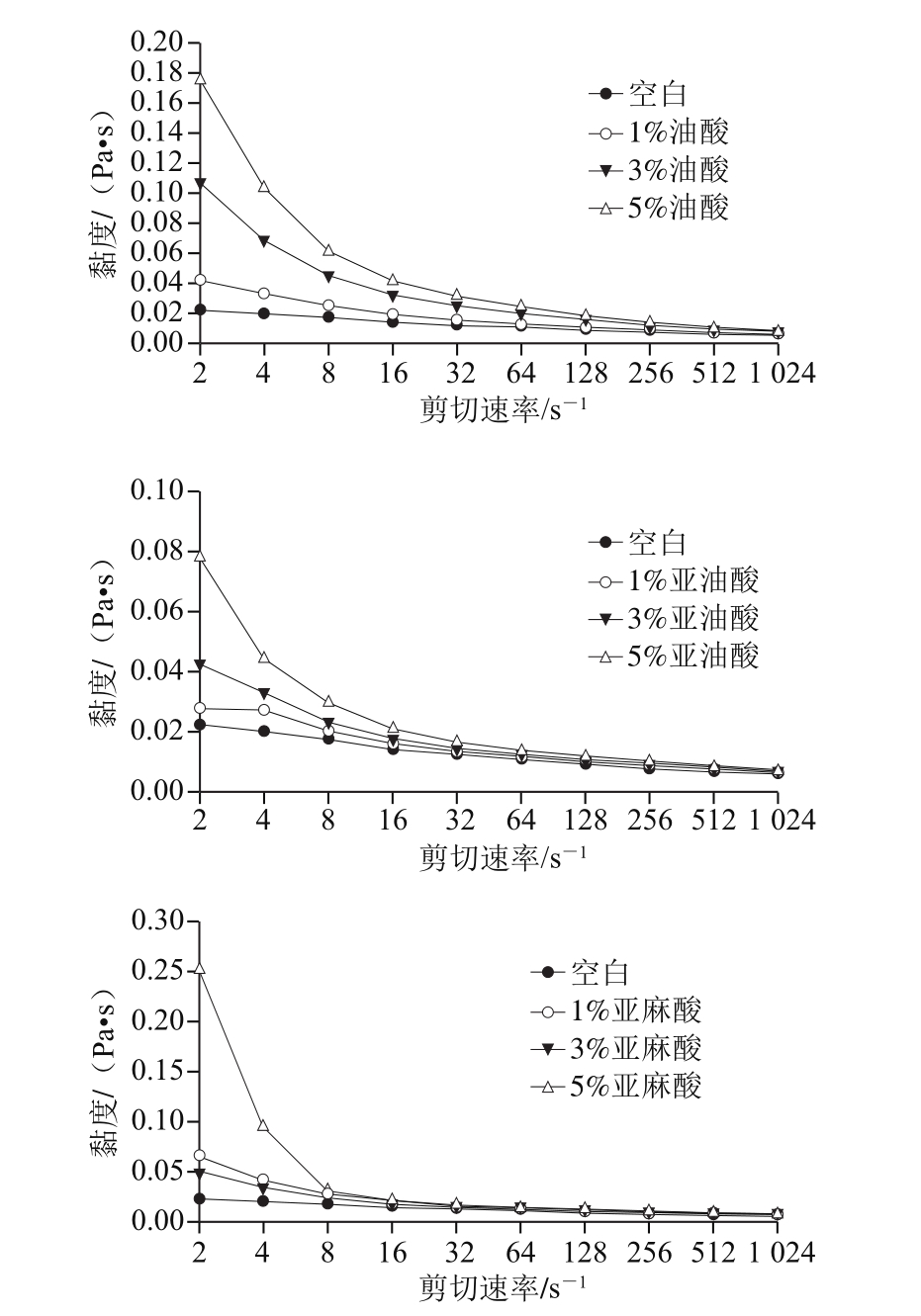
图7 不同剪切速率下脂肪酸对乳化液黏度的影响
Fig. 7 Effect of different amounts of fatty acid added on viscosity of emulsions at different shear rates
由图7可以看出,乳化液的黏度均明显表现为5%油酸组>3%油酸组>1%油酸组>空白组;由亚油酸组可以看出,剪切速率2~128 s-1的变化过程中,乳化液的黏度均明显表现为5%亚油酸组>3%亚油酸组>1%亚油酸组>空白组,之后随着剪切速率的增加,亚油酸的添加量对乳化液的影响不大;由亚麻酸组可以看出,剪切速率在2~16 s-1的变化过程中,乳化液的黏度均明显表现为5%亚麻酸组>1%亚麻酸组>3%亚麻酸组>空白组,之后随着剪切速率的增加,亚麻酸添加量对乳化液的影响不大。这说明在低剪切速率下,油酸、亚油酸和亚麻酸的添加量对乳化液黏度有一定影响,这可能是因为剪切速率过大,脂肪颗粒更小或脂肪细胞被破坏,脂肪颗粒总表面积增大,使得蛋白质不足以包围所有脂肪颗粒,摩擦产生的热量使得脂肪析出[33],乳化液的黏度较低并且变化不明显。
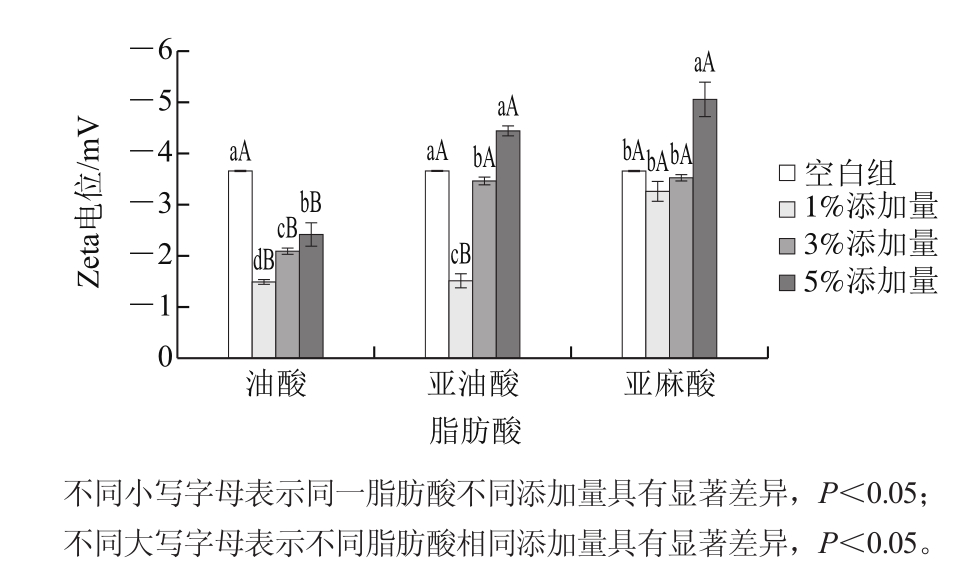
图8 脂肪酸对乳化液Zeta电位的影响
Fig. 8 Effect of fatty acids on Zeta potential of emulsion
Zeta电位是带电颗粒表面剪切层的电位,是胶体分散系稳定性的重要指标,广泛用于描述胶体颗粒之间的静电相互作用[37-38]。通常情况下,Zeta电位绝对值小于30 mV时,荷电粒子不稳定,容易聚集[37,39]。由图8可以看出,乳化液的Zeta电位均是负值,并且Zeta电位的绝对值都小于30 mV,这说明此状态下的乳化液不稳定,乳化液容易聚集[39],同时也说明了测定乳化稳定性时出现容易分层现象的原因。由图8可以看出,在添加了脂肪酸的乳化液中,Zeta电位的绝对值均为5%添加量>3%添加量>1%添加量,说明在这个范围内,油酸、亚油酸和亚麻酸的添加量越多,乳化液中颗粒之间的相互作用或吸引力就会越强[37]。同时,油酸组Zeta电位绝对值均小于空白组,而且油酸组添加量之间和亚油酸添加量之间Zeta电位绝对值均差异显著(P<0.05)。此外,由图8可以看出,同一添加量下,不同脂肪酸之间的Zeta电位也具有差异。其中,Zeta电位的绝对值均表现为亚麻酸组>亚油酸组>油酸组,Zeta电位值的这种差异可能是由脂肪酸极性头部大小、脂肪酸所带电荷、脂肪酸链在油水界面蛋白膜中堆积[40]导致。
通过提取猪肉肌肉盐溶性蛋白,添加不同饱和程度且不同添加量C18脂肪酸(油酸、亚油酸和亚麻酸),经过均质得到不同状态的乳化液。研究发现,脂肪酸的饱和程度和添加量对乳化液的乳化活性、乳化稳定性、化学键、微粒粒径以及静态流变等有着不同程度的影响。脂肪酸添加量越大,乳化液的乳化活性越强,而相同添加量下,脂肪酸的饱和程度对全肉盐溶性蛋白起到较好的乳化作用,但添加量越大,乳化液的分层现象越严重,这可能是因为添加量越大乳化液越容易发生聚集和桥联现象,同时也导致乳化微粒粒径增大,乳化液剪切应力增大。
[1] 王宇. 不同温度处理及添加物对猪肉肌原纤维蛋白功能性的影响[D].哈尔滨: 东北农业大学, 2010.
[2] 胡存书. 花生乳状液界面吸附蛋白的提取及其特性研究[D]. 郑州:河南工业大学, 2015.
[3] 汪张贵, 闫利萍, 彭增起, 等. 脂肪剪切乳化和蛋白基质对肉糜乳化稳定性的重要作用[J]. 食品工业科技, 2011, 32(8): 466-469.DOI:10.13386/j.issn1002-0306.2011.08.127.
[4] 任阳. 饱和与不饱和脂肪酸对猪肌纤维组成的影响及其AMPK途径研究[D]. 杭州: 浙江大学, 2014.
[5] FOLFH J, LEES M, SLOANE-STANLEY G H. A simple method for the isolation and purification of total lipids from animal tissues[J].Journal Biology Chemistry, 1957, 226(1): 497-509.
[6] 崔秀琴. 高纯油酸的制备和应用[J]. 南开大学学报(自然科学版),1999, 32(2): 124-126.
[7] 张亚刚, 樊莉, 文彬, 等. 紫外可见分光光度法在共轭亚油酸定量分析中的应用[J]. 新疆石油学院学报, 2002(2): 59-64.
[8] 盛灵慧, 黄峥, 王晶. 气相色谱质谱法测定植物油中脂肪酸[J]. 化学分析计量, 2010(2): 35-38.
[9] ZORBA Ö. The effects of the amount of emulsified oil on the emulsion stability and viscosity of myofibrillar proteins[J]. Food Hydrocolloids,2006, 20(5): 698-702. DOI:10.1016/j.foodhyd.2005.06.010.
[10] 亢春雨, 赵春青. 鸡胸肉盐溶蛋白热诱导凝胶保水性和超微结构的研究[J]. 食品科学, 2007, 28(1): 50-53. DOI:10.3321/j.issn:1002-6630.2007.01.007.
[11] 张龙翔, 张庭芳, 李令媛, 等. 生物化学实验方法和技术[M]. 2版.北京: 高等教育出版社, 1997: 136-137.
[12] 李艳青. 蛋白质氧化对鲤鱼蛋白结构和功能性的影响及其控制技术[D]. 哈尔滨: 东北农业大学, 2013.
[13] 王璋, 许时婴. 大孔吸附树脂提取苦味乳清蛋白水解物及其功能性质和生物活性的研究[J]. 食品科学, 2006, 27(8): 103-107.DOI:10.3321/j.issn:1002-6630.2006.08.020.
[14] ELLMAN G L. Tissue sulfhydryl groups[J]. Archives of Biochemistry and Biophysics, 1959, 82(1): 70-77.
[15] BEVERIDGE T, TOMA S J, NAKAI S. Determination of SH- and SS- groups in some food proteins using Ellman’s reagent[J]. Journal of Food Science, 1974, 39(1): 49-51. DOI:10.1111/j.1365-2621.1974.tb00984.x.
[16] 周纷, 谷大海, 徐家慧, 等. 淀粉对鸡胸肉盐溶性蛋白乳化特性的影响[J]. 食品科学, 2016, 37(15): 7-12. DOI:10.7506/spkx1002-6630-201615002.
[17] 高菲菲, 汪张贵, 彭增起, 等. 剪切时间对肉糜中微粒分散特性的影响[J]. 食品科学, 2012, 33(5): 74-77.
[18] 张文会. 马铃薯分离蛋白溶液流变学特性及热稳定性研究[D]. 长春:吉林农业大学, 2011: 14-21.
[19] CRUDDEN A, AFOUFA-BASTIEN D, FOX P F, et al. Effect of hydrolysis of casein by plasmin on the heat stability of milk[J].International Dairy Journal, 2005, 15(10): 1017-1025. DOI:10.1016/j.idairyj.2004.11.001.
[20] DAS K P, KINSELLA J E. Stability of food emulsions: physicochemical role of protein and nonprotein emulsifiers[J]. Advances in Food and Nutrition Research, 1990(34): 81-20. DOI:10.1016/S1043-4526(08)60007-8.
[21] 邵俊花. 猪肉蛋白质构象变化与保油保水性关系研究[D]. 南京: 南京农业大学, 2012.
[22] OMANA D A, XU Y, MOAYEDI V, et al. Alkali-aided protein extraction from chicken dark meat: chemical and functional properties of recovered proteins[J]. Process Biochemistry, 2010, 45(3): 375-381.DOI:10.1016/j.procbio.2009.10.010.
[23] 孙丽丽. 纳米乳状液的微观结构与相稳定性研究[D]. 北京: 北京化工大学, 2014.
[24] 孙健. 亚麻籽胶对肉制品保水性、乳化性、淀粉糊化和老化特性影响及其应用[D]. 南京: 南京农业大学, 2011.
[25] OMANA D A, PLASTOW G, BETTI M. The use of β-glucan as a partial salt replacer in high pressure processed chicken breast meat[J]. Food Chemistry, 2011, 129(3): 768-776. DOI:10.1016/j.foodchem.2011.05.018.
[26] LINDER M, FANNI J, PARMENTIER M. Functional properties of veal bone hydrolysates[J]. Journal of Food Science, 1996, 61(4): 712-716. DOI:10.1111/j.1365-2621.1996.tb12187.x.
[27] 潘君慧. 冻藏方式、猪肉蛋白氧化及猪肉品质关系的研究[D].无锡: 江南大学, 2011.
[28] BARBUT S. Importance of fat emulsification and protein matrix characteristics in meat batter stability[J]. Journal of Muscle Foods,1995, 6(2): 161-167. DOI:10.1111/j.1745-4573.1995.tb00564.x.
[29] LIU K. Particle size distribution of distillers dried grains with solubles(DDGS) and relationships to compositional and color properties[J].Bioresource Technology, 2008, 99(17): 8421-8428. DOI:10.1016/j.biortech.2008.02.060.
[30] XIANG B Y, SIMPSON M V, NGADI M O, et al. Flow behaviour and viscosity of reconstituted skimmed milk treated with pulsed electric field[J]. Biosystems Engineering, 2011, 109(3): 228-234.DOI:10.1016/j.biosystemseng.2011.04.004.
[31] ERÇELEBI E A, IBANOGLU E. Rheological properties of whey protein isolate stabilized emulsions with pectin and guar gum[J].European Food Research and Technology, 2009, 229(2): 281-286.DOI:10.1016/j.foodhyd.2014.09.025.
[32] KLEIN M, ASERIN A, ISHAI P B, et al. Interactions between whey protein isolate and gum Arabic[J]. Colloids and Surfaces B: Biointerfaces, 2010, 79(2): 377-383. DOI:10.1016/j.colsurfb.2010.04.021.
[33] 汪张贵, 闫利萍, 彭增起. 剪切时间对脂肪微粒大小和肉糜品质的影响[J]. 食品科技, 2011, 36(9): 127-130. DOI:10.13684/j.cnki.spkj.2011.09.054.
[34] INNOCENTE N, BIASUTTI M, VENIRR E, et al. Effect of highpressure homogenization on droplet size distribution and rheological properties of ice cream mixes[J]. Journal of Dairy Science, 2009,92(5): 1864-1875. DOI:10.3168/jds.2008-1797.
[35] BOUTER E, MEKHLOUFI G, ROSILIO V, et al. Proteins,polysaccharides, and their complexes used as stabilizers for emulsions:alternatives to synthetic surfactants in the pharmaceutical field?[J].International Journal of Pharmaceutics, 2012, 436(1): 359-378.DOI:10.1016/j.ijpharm.2012.06.052.
[36] QUEMADA D. Rheology of concentrated disperse systems II. A model for non-newtonian shear viscosity in steady flows[J]. Rheologica Acta,1978, 17(6): 632-642.
[37] 周伟, 刘玮琳, 刘伟, 等. 不同因素对中链脂肪酸脂质体Zeta电位的影响[J]. 食品科学, 2012, 33(19): 128-132.
[38] 叶进富, 林东强, 姚善泾. 蛋白质Zeta电位与离子交换层析容量因子的相关性研究[J]. 高校化学工程学报, 2007, 21(3): 381-385.
[39] 董晓东, 邓英杰, 陈超, 等. 灯盏花素阳离子脂质体的制备[J]. 中国新药杂志, 2010, 19(12): 1075-1079.
[40] 连建平. 带电磷脂膜泡的内、外表面电荷密度和表面电位[J]. 生物物理学报, 1988(4): 344-349.
Effect of Unsaturated Fatty Acids on Rheological and Physical Properties of Pork Protein-Stabilized Emulsions