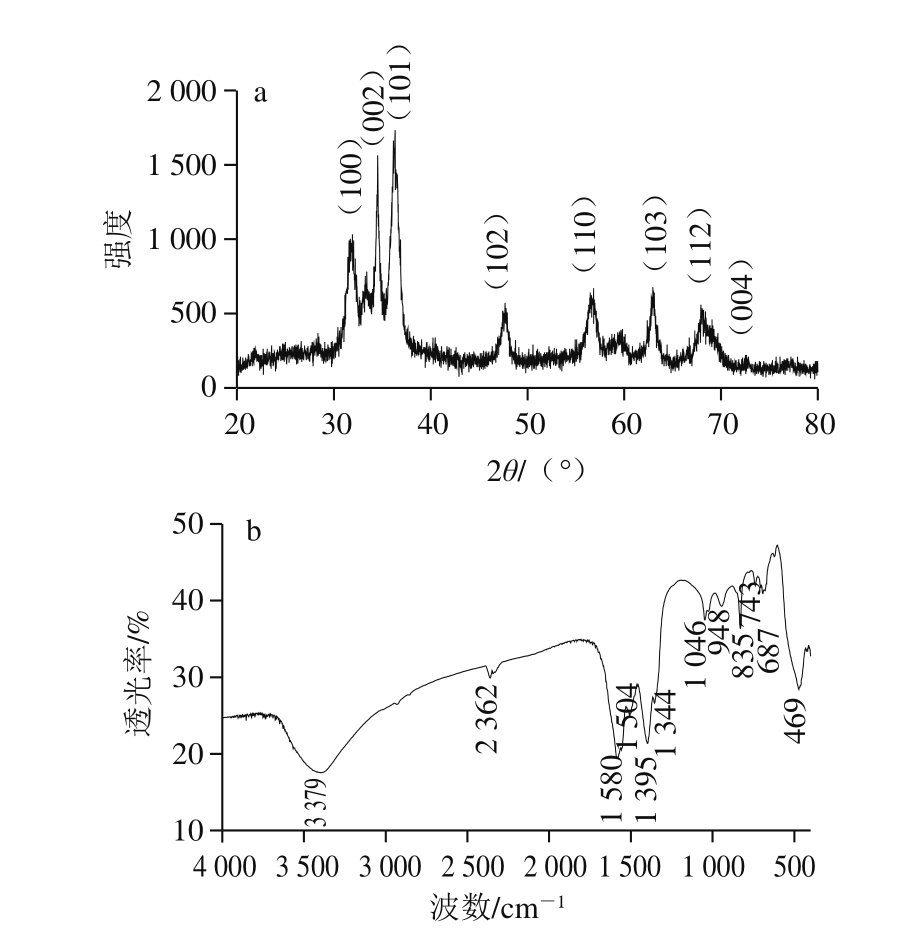
图1 ZnO薄膜的XRD(a)、FTIR(b)图
Fig. 1 XRD patterns (a) and FTIR spectra (b) of ZnO films
越来越多的研究显示,人类生活中的细菌感染大部分是由生物被膜引起的,单纯由游离菌导致的食物中毒并不多见[1-2]。因此在食品生产和贮藏过程中形成的生物被膜可能是引起食源性疾病的根本原因[3-5]。腐败希瓦氏菌(Shewanella putrefaciens)为革兰氏阴性菌,是一种典型水产品优势腐败菌,它大量存在于水、土壤及高水分高蛋白食品中,可还原氧化三甲胺,并产生H2S。腐败希瓦氏菌易黏附于材料表面,从而形成生物被膜[6-7]。由于生物被膜的黏附性远高于游离菌,若食品加工环境受到生物被膜污染,将很难处理干净且易留下污染源,进而腐蚀食品生产设备和包装材料,使生产成本提高,威胁食品安全[3,8]。抑制生物被膜的方法很多,但在生产过程中加药对食品安全的威胁显而易见[9-11]。因此,研制有效抑制生物被膜形成及生长的材料将为解决食品生产中的微生物污染提供技术支持[12]。
微纳米级ZnO作为广泛使用的一种无机抗菌剂,具有良好的稳定性和安全性[13-15]。制备ZnO的方法主要有直接沉淀法[16-17]、水热合成法[18-19]、溶胶-凝胶(sol-gel)法[20-21]、化学蒸汽沉积法[22]等。Asakuma等[21]采用提拉法将溶胶均匀涂于基片上,高温退火处理后得到纳米ZnO薄膜。sol-gel法制备的纳米薄膜具有形貌均匀、可控、反应条件温和、重复性好等特点。有研究表明,借助ZnO的抗菌性能,ZnO纳米粒子具有显著的抑制生物被膜性能[23-24],故有望应用ZnO薄膜作为抑制生物被膜的形成和生长的材料。
降低水产品加工及贮藏过程中容器及设备表面生物被膜残留能够减少其对产品的影响及设备的破坏,本实验采用sol-gel法于多孔钛片表面制备纳米ZnO薄膜,借助X射线衍射光谱(X-ray diffraction,XRD)、傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)、扫描电子显微镜(scanning electron microscope,SEM)、透射电子显微镜(transmission electron microscope,TEM)、选区电子衍射(selected area electron diffraction,SAED)等表征手段研究涂膜次数对ZnO薄膜微观结构的影响。以水产品腐败希瓦氏菌为作用对象,考察ZnO薄膜微观结构对其生物被膜抑制性能的影响。研究结果可为制备对水产品优势腐败菌生物被膜具有抑制作用的薄膜材料提供技术和理论支持。
菌种:腐败希瓦氏菌(S. putrefaciens,ATCC8071,美国微生物菌种保藏中心,实验室保藏);培养基:LB肉汤、LB营养琼脂;试剂:结晶紫、无水乙醇、氯化钠、磷酸氢二钠、磷酸二氢钾、氯化钾、戊二醛等均为分析纯;高纯钛箔(99.99%,0.02 mm) 清河县佳润金属材料有限公司。
Ultima IV型X射线粉末衍射仪 日本理学Rigaku公司;2000FT-IR型红外分光光度计 美国Varian公司;S-4800型场发射SEM 日本日立公司;Jem-2100F型场发射TEM 日本电子株式会社;OCA15EC型接触角测量仪北京东方德菲仪器有限公司;Victor X3酶标仪 上海珀金埃尔默仪器有限公司;WU800角磨机 宝时得机械(中国)有限公司;SK8210HP超声波清洗器、上海科导超声仪器有限公司;DF-II集热式磁力加热搅拌器 江苏省荣华仪器制造有限公司;MS605D直流稳压电源 东莞市迈豪电子科技有限公司;LDZX-50FBS立式压力蒸汽灭菌器 上海申安医疗器械厂;LRH型系列生化培养箱 上海一恒科技有限公司;SW-CJ-2FD洁净工作台 苏净集团苏州安泰空气技术有限公司;PL602-L电子天平 梅特勒-托利多仪器有限公司。
1.3.1 多孔钛片及ZnO薄膜的制备
1.3.1.1 阳极氧化法制备多孔钛片
角磨机打磨钛片至表面光滑,分别于丙酮、乙醇中超声清洗10 min(40 Hz、200 W),烘干。在抛光液(V(HF)∶V(HNO3)=1∶3)中化学抛光60 s后于去离子水中超声清洗10 min,烘干。以钛片为阳极,石墨为阴极,电极间距4.0 cm,电压14.0 V,0.4% HF电解液中阳极氧化60 min。去离子水、乙醇清洗,干燥,得孔径约为50 nm的多孔钛片,待用。
1.3.1.2 sol-gel法制备ZnO薄膜
室温剧烈搅拌下,将50 mL 0.15 mol/L的NaOH-乙醇溶液迅速加入至50 mL 0.075 mol/L的乙酸锌-乙醇溶液中,得混合溶液。多孔钛片浸于沸腾的无水乙醇中1 h取出,于-0.08 MPa抽真空30 min后将其浸于上述混合溶液中,浸渍20 min后加热至80 ℃,40 min后得蓝色溶胶,取出多孔钛片,水洗。100 ℃干燥2 h,得sol-gel涂膜1 次样品。同条件下多孔钛片sol-gel涂膜4 次后干燥,得另一样品。收集同时制备的粉体,待用。
1.3.2 材料表征分析
采用X射线粉末衍射仪对同期制备粉体进行晶型分析,CuKα辐射,40 kV,50 mA,步宽0.02°,扫描速率4 °/min。利用KBr压片法,采用2000FT-IR型红外分光光度计测定ZnO薄膜剥离粉体的FTIR光谱,测试范围4 000~400 cm-1,分辨率0.5 cm-1。采用S-4800型场发射SEM观察样品微观形貌。采用Jem-2100F型场发射TEM测定剥离的多孔钛片和ZnO薄膜的微观形貌,并对其进行SAED分析。运用切线法,采用OCA15EC型接触角测量仪测定样品的水接触角。
1.3.3 材料表面腐败希瓦氏菌生物被膜附着性能测定
取活化后OD595nm约为0.5的腐败希瓦氏菌的菌悬液,以1∶200稀释,取1 mL稀释后菌液于无菌离心试管中,放入基片(0.5 cm×0.5 cm),28 ℃培养一定时间后取出。
1.3.3.1 材料表面生物被膜黏附性能测定
取上述基片于无菌离心试管中,用1 mL 0.9%生理盐水清洗两次以去除浮游菌,1 mL 1.0%结晶紫溶液中染色5 min后再用1 mL生理盐水洗2 次去除浮色,加入体积分数33%冰乙酸溶液0.2 mL脱色10 min,移取脱色后溶液于96 孔板中,用Victor X3酶标仪测定OD595nm。
1.3.3.2 材料表面被膜菌生长曲线测定
取出菌悬液中培养一定时间后的基片,用无菌磷酸盐缓冲液(pH 7.4,KH2PO40.27 g,Na2HPO41.42 g,NaCl 8 g,KCl 0.2 g,加去离子水定容到1 L)冲洗3 次去除浮游菌,再将基片放入10 mL磷酸盐缓冲液中,于53 kHz、25 ℃条件下超声处理10 min,梯度稀释所得菌悬液,采用平板计数法测定生物被膜上腐败希瓦氏菌的菌落总数,绘制被膜菌生长曲线。
1.3.3.3 材料表面被膜微观形貌观察
菌悬液中培养一定时间后的基片用无菌水冲洗3 次,放入4 ℃预冷的2.5%戊二醛溶液中浸渍4 h,而后分别在30%、50%、70%、90%体积分数的乙醇溶液中浸泡30 min,在无水乙醇中浸泡1 h,取出后于超净台内自然风干。样品喷金后,观察其表面生物被膜的微观形貌。
2.1.1 XRD、FTIR分析

图1 ZnO薄膜的XRD(a)、FTIR(b)图
Fig. 1 XRD patterns (a) and FTIR spectra (b) of ZnO films
ZnO的微结构影响ZnO薄膜的抗菌性。Shams等[25]发现纳米粒子的形状影响生物被膜的形成。Dutta等[26]发现ZnO的结晶状态影响其抗菌性。与ZnO薄膜同时制备粉体的XRD表征结果表明,样品为六角纤锌矿结构ZnO晶体(JCPDS card No.36-1451),2θ角在31.77°、34.43°、36.26°、47.55°、56.61°、62.88°、67.97°、72.59°处的衍射峰分别对应ZnO晶体的(100)、(002)、(101)、(102)、(110)、(103)、(112)、(004)晶面。由图1a可见,衍射峰峰形不够尖锐,半峰宽较宽,33.40°
和59.82°处有较弱的杂质峰,说明样品结晶度较低,晶体粒径较小且有少量中间产物存在。采用谢乐公式计算晶体平均粒径为8.0 nm。
由剥离ZnO薄膜的FTIR图(图1b)可见,3 500~3 300 cm-1处的宽吸收峰和1 580 cm-1处的强吸收峰分别对应于—OH的伸缩振动和弯曲振动,表明样品中含有结合水和毛细孔水。2 362 cm-1处的吸收峰是由于样品吸附了空气中CO2引起的。948 cm-1和835 cm-1处的吸收峰是Zn—OH—Zn和Zn—OH的伸缩振动吸收峰,469 cm-1处的吸收峰是Zn—O弯曲振动吸收峰。1 046 cm-1以及743、687 cm-1处的吸收峰为氢氧化锌羟基(σ-OH)、(α-OH)的振动吸收峰[27],1344~1395 cm-1处归属于ZnO表面羟基或桥联羟基的伸缩和弯曲振动吸收峰,表明样品中ZnO吸附了部分极性的—OH,且有少量含—OH的中间产物存在,与XRD分析结果一致。
2.1.2 材料表面微观形貌分析
由图2可见,钛片表面有光滑的不规则笋状突起,介于50~150 nm。钛片经阳极氧化法处理后,表面形成孔径约50 nm、深度约100 nm的TiO2多孔,排列均匀。经sol-gel 1 次涂膜的多孔钛片表面有少量ZnO颗粒沉积于孔道顶端,相互聚集且分布不均匀,同时可见孔道内壁无ZnO颗粒沉积,ZnO薄膜约50 nm厚。经4 次涂膜后,ZnO附着量明显增大,少量ZnO颗粒进入孔道内壁,大量ZnO颗粒延孔壁顶端沉积,TiO2孔基本被覆盖,且ZnO颗粒呈多层堆积结构,“孔隙”增大。分析认为,醋酸锌的乙醇溶液和NaOH混合后发生了水解,加热至80 ℃后促进其水解反应的发生,使Zn—O—Znn缩聚形成凝胶,干燥处理后,凝胶中的ZnO结晶析出,得六方纤锌矿型ZnO[28]。在溶胶涂膜过程中,由于在真空条件下将多孔钛片浸渍于溶胶中,则会有部分溶胶进入孔中,脱水后沉积于孔的内壁。而由于真空度有限,孔中尚有很多空气,阻滞溶胶的进入,故表现为大多数ZnO颗粒沉积于多孔钛片表面。
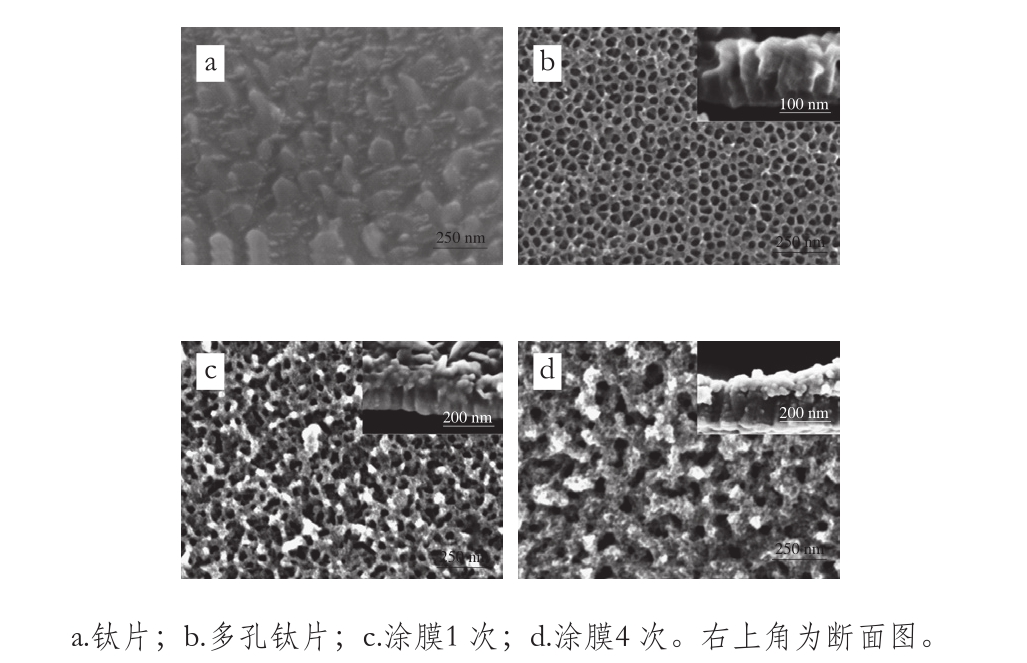
图2 钛片及不同涂膜次数的ZnO薄膜SEM图
Fig. 2 SEM images of titanium sheet and ZnO films with different cycles of coating
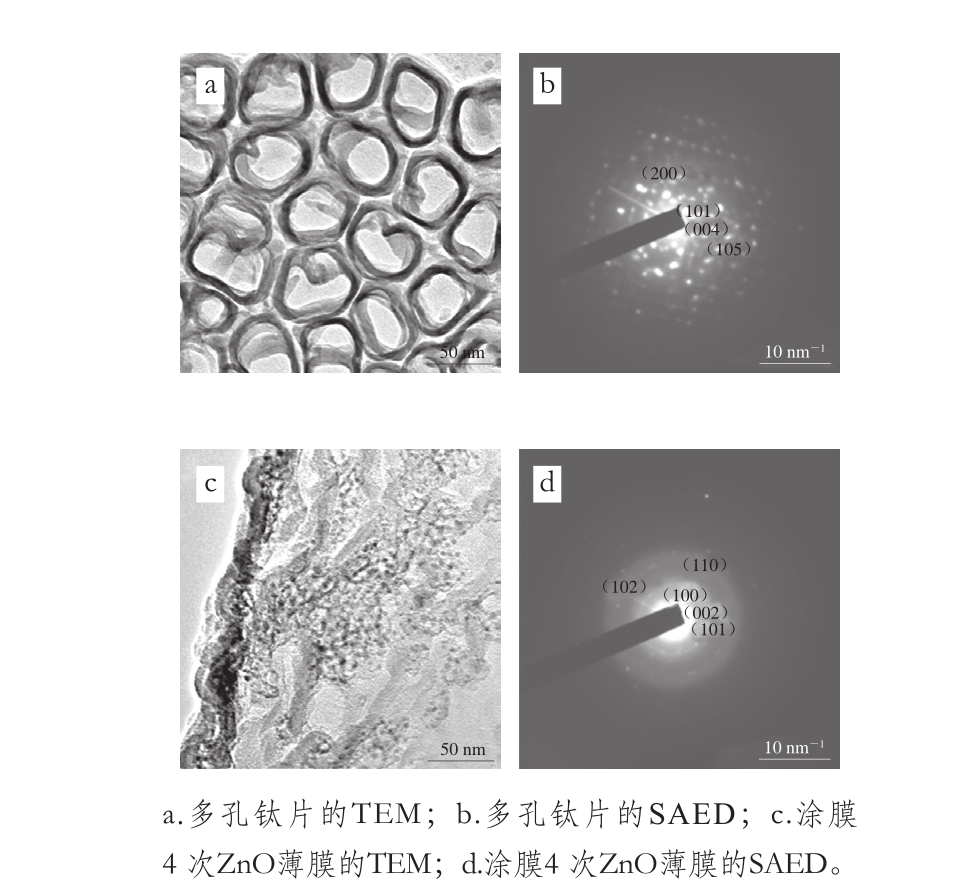
图3 多孔钛片及涂膜4 次ZnO薄膜的TEM和SAED图
Fig. 3 TEM images and SAED patterns of titanium sheet and ZnO films with 4 cycles of coating
由图3a、b可见,多孔钛片的孔径约为50 nm,孔壁厚约5 nm,排列规则,其SAED结果中可见锐钛矿型TiO2(JCPDS card No.89-4921)的(101)、(004)、(200)、(105)、(211)晶面,说明多孔钛片表面为TiO2。这是由于阳极氧化过程中钛片表面聚集的O2-与Ti4+形成氧化膜,在电场作用下膜层表面发生场致氧化和场致溶解,进而形成孔核,随氧化时间延长最终形成多孔结构[29]。多孔钛片经sol-gel涂覆4 次后的薄膜中ZnO颗粒粒径约5~10 nm,部分进入TiO2孔中,部分于孔壁边缘(图3c),与SEM结果一致。其SAED结果中可见ZnO晶体(JCPDS card No.36-1451)的(100)、(002)、(101)、(102)、(110)晶面(图3d),说明样品为六方纤锌矿型ZnO,与XRD分析结果相符。
2.1.3 材料表面亲疏水性表征
表1 钛片及ZnO薄膜的水接触角
Table 1 Water contact angle of titanium sheet and zinc oxide films
材料标号 钛片 多孔钛片 涂膜1 次ZnO薄膜 涂膜4 次ZnO薄膜接触角/(°) 61.9±0.3 111.8±0.3 47.8±0.3 32.4±0.3
由表1可见,钛片表面呈亲水性,而多孔钛片表面呈疏水性,ZnO薄膜呈强亲水性,且涂膜4 次ZnO薄膜的亲水性更强。分析认为,由于钛片表面并不平整,存在较多不规则突起,在一定程度上增大了其表面液体与气体的接触面所占比例,故其接触角较小,呈亲水性。而多孔钛片在与水接触时,水滴无法与基底直接接触,而与纳米孔及纳米孔中的空气接触,液滴与气体接触面积占比较大,故表现出较好的疏水性。由于纳米ZnO粒径小,且颗粒表面有毛细孔水和表面吸附水,且存在含有—OH的中间产物,使其亲水性增强。随着沉积次数增加,薄膜表面沉积的ZnO增多,故其亲水性更强,表现为其水接触角减小。
2.2.1 材料表面腐败希瓦氏菌生物被膜黏附率及被膜菌生长曲线
由图4可见,生物被膜开始培养至2 h,材料表面生物被膜黏附率及被膜菌增长较快,表明生物被膜从最初的可逆附着转化为不可逆附着,经历了生化作用阶段和菌体附着阶段。在2~24 h范围内,被膜黏附率及被膜菌菌落总数增长较快,表明生物被膜进入生长期。在24~36 h范围内,被膜黏附率增加缓慢,但被膜菌几乎不变,表明生物被膜进入成熟期,被膜菌代谢处于平衡状态,活菌数量不再增加,而基片表面附着的多糖和蛋白质及死亡菌体增多。36 h后,被膜黏附率和菌落总数开始下降,生物被膜进入衰退期。
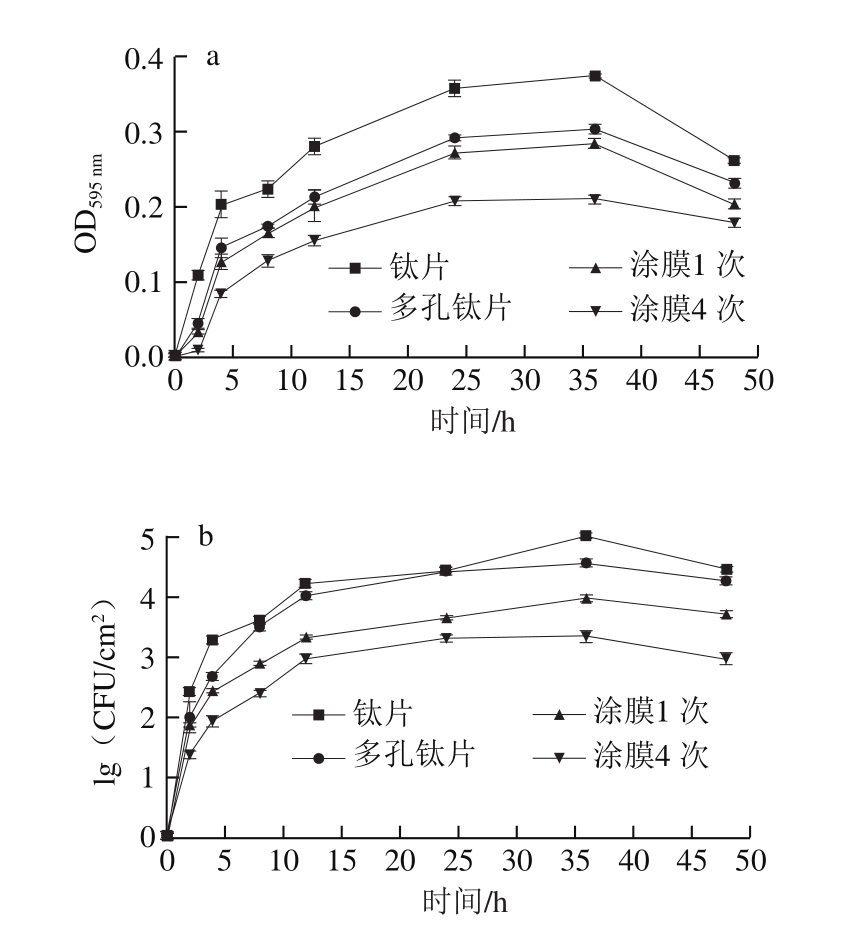
图4 材料表面腐败希瓦氏菌生物被膜的黏附率(a)及被膜菌生长曲线(b)
Fig. 4 Adhesion rate (a) and total number (b) of live cells of S. putrefaciens biofilms on surfaces
在生物被膜生长的各个阶段,钛片表面的生物被膜黏附率和被膜菌数量均高于同期其他样品,其次为多孔钛片,而ZnO薄膜表面的生物被膜生长缓慢,且涂膜4 次样品的抗生物被膜性能最优。钛片表面无抗菌性物质,且具有亲水性,故有利于生物被膜的附着和被膜菌的生长。而多孔钛片表面形成了TiO2,且具有疏水性能,不利于生物被膜的早期黏附和被膜菌的生长。故其表面的生物被膜黏附率明显低于同期的钛片,而其表面的被膜菌数量仅略低于同期的钛片,这是由于被膜黏附物质少,不能为被膜菌提供充足养分所致。多孔钛片涂覆ZnO薄膜后的样品表面虽然具有很强的亲水性,有利于生物被膜的初期黏附,但由于ZnO具有较强的抗菌性能,其表面生物被膜黏附率和被膜菌数量均较钛片和多孔钛片有较大幅度降低,且涂膜4次样品的抗生物被膜性能更优。ZnO纳米粒子抗菌基于离子溶出机理,Zn2+溶出后进入生物被膜内,接触菌体后与蛋白酶结合使之失去活性,进而使细菌死亡[15,30]。当被膜菌被杀死后,不再分泌被膜多糖等被膜黏附物,使生物被膜黏附率下降。同时,被膜黏附物质减少也不利于被膜菌的生长,使ZnO薄膜表面的被膜菌数量低于同期钛片表面1~2 个数量级。由于涂膜4 次的ZnO薄膜厚度达50~100 nm,其ZnO颗粒的沉积量远高于涂膜1 次的ZnO薄膜,故在生物被膜附着后,其Zn2+溶出较多,对被膜菌的杀菌能力更强,影响了被膜菌分泌生物被膜的黏附成分,表现为生物被膜的黏附率较低,同时可见,涂膜4 次的ZnO薄膜表面的被膜菌数量比涂膜1 次的ZnO薄膜低1 个数量级。
2.2.2 材料表面腐败希瓦氏菌生物被膜微观形貌表征

图5 不同时间段钛片及涂膜次数不同的ZnO薄膜表面生物被膜的SEM图
Fig. 5 SEM images of biofilms on titanium sheet and zinc oxide films with different cycles of coating at different incubation times
由图5可见,在生物被膜培养至第2小时,材料表面形成少量黏附多糖及蛋白质膜,但未见菌落,表明生物被膜已黏附于材料表面,而被膜菌数量较少。培养至第12小时,各材料表面均可见黏附态生物被膜,且有形态完整的被膜菌(见图中圈形标注),说明此时生物被膜进入生长阶段。第36小时,材料表面的胞外多糖膜逐渐增厚,甚至有的将菌体包裹其中,说明生物膜进入成熟阶段。第48小时,可见部分受损细胞及散落的黏附态物质,黏附多糖形成的连续膜部分脱落,说明此时已进入生物被膜的衰退期。比较同期的生物被膜微观形貌,钛片与多孔钛片表面的生物被膜黏附物较多,ZnO表面的被膜黏附物和菌体数量较少,与材料表面生物被膜黏附率及被膜菌生长曲线的实验结果一致。
钛片阳极氧化处理后得到多孔钛片,多孔钛片表面经sol-gel法涂膜后得到六方纤锌矿型ZnO薄膜,涂膜1 次的ZnO薄膜较薄,约50 nm,涂膜4 次后薄膜增厚至50~100 nm。薄膜中ZnO颗粒约5~10 nm,沉积于孔道顶端,相互聚集且分布不均匀。钛片呈亲水性,水产品腐败希瓦氏菌生物被膜在其表面生长速率和附着量均较大;多孔钛片呈疏水性,生物被膜在其表面的黏附率下降,但被膜菌生长未受到显著抑制。ZnO薄膜呈较强亲水性能,但由于ZnO具有杀菌性能,其对被膜黏附及被膜菌生长均有强抑制性能,且涂膜4 次所得ZnO薄膜对水产品腐败希瓦氏菌生物被膜的抑制性能最优。
[1] COSTERTON J W, STEWART P S, GREENBERG E P. Bacterial bioflms: a common cause of persistent infections[J]. Science, 1999, 284:1318-1322. DOI:10.1126/science.284.5418.1318.
[2] KUMAR C G, ANAND S K. Significance of microbial biofilms in food industry: a review[J]. International Journal of Food Microbiology, 1998,42(1/2): 9-27. DOI:10.1016/S0168-1605(98)00060-9.
[3] HOUDT R V, MICHIELS C W. Biofilm formation and the food industry, a focus on the bacterial outer surface[J]. Journal of Applied Microbiology, 2010, 109: 1117-1131. DOI:10.1111/j.1365-2672.2010.04756.x.
[4] 马艳, 李婷婷, 崔方超, 等. 不同培养条件及群体感应信号分子对蜂房哈夫尼亚菌生物被膜的影响[J]. 食品科学, 2017, 38(6): 42-47.DOI:10.7506/spkx1002-6630-201706007.
[5] ABEE T, KOVACS A T, KUIPERS O P, et al. Biofilm formation and dispersal in Gram-positive bacteria[J]. Current Opinion in Biotechnology,2011, 22(2): 172-179. DOI:10.1016/j.copbio.2010.10.016.
[6] BAGGE D, HJELM M, JOHANSEN C, et al. Shewanella putrefaciens adhesion and biofilm formation on food processing surfaces[J]. Applied and Environment Microbiology, 2001, 67(5): 2319-2325. DOI:10.1128/AEM.67.5.2319-2325.2001.
[7] 邓旗, 孙力军, 王雅玲, 等. 环境条件对腐败希瓦氏菌生物被膜形成能力的影响[J]. 中国食品学报, 2013, 13(10): 43-50. DOI:10.16429/j.1009-7848.2013.10.021.
[8] SREY S, JAHID I K, HA S D. Biofilm formation in food industries:a food safety concern[J]. Food Control, 2013, 31(2): 572-585.DOI:10.1016/j.foodcont.2012.12.001.
[9] SIMOES M, SIMOES L C, VIEIRA M J, et al. A review of current and emergent biofilm control strategies[J]. LWT-Food Science and Technology, 2010, 43(4): 573-583. DOI:10.1016/j.lwt.2009.12.008.
[10] BAN G H, KANG D H. Effect of sanitizer combined with steam heating on the inactivation of foodborne pathogens in a biofilm on stainless steel[J]. Food Microbiology, 2016, 55: 47-54. DOI:10.1016/j.fm.2015.11.003.
[11] MOREIRA J M R, FULGENCIO R, ALVES P, et al. Evaluation of SICAN performance for biofouling mitigation in the food industry[J].Food Control, 2016, 62: 201-207. DOI:10.1016/j.foodcont.2015.10.023.
[12] CARPENTIER B, CERF O. Persistence of Listeria monocytogenes in food industry equipment and premises[J]. International Journal of Food Microbiology, 2011, 145(1): 1-8. DOI:10.1016/j.ijfoodmicro.2011.01.005.
[13] VARAPRASAD K, RAGHAVENDRA G M, JAYARAMUDU T,et al. Nano zinc oxide-sodium alginate antibacterial cellulose fibres[J].Carbohydrate Polymers, 2016, 135(1): 349-355. DOI:10.1016/j.carbpol.2015.08.078.
[14] SIRELKHATIM A, MAHMUD S, SEENI A, et al. Review on zinc oxide nanoparticles: antibacterial activity and toxicity mechanism[J]. Nano-Micro Letters, 2015, 7(3): 219-242. DOI:10.1007/s40820-015-0040-x.
[15] PASQUET J, CHEVALIER Y, PELLETIER J, et al. The contribution of zinc ions to the antimicrobial activity of zinc oxide[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2014, 457: 263-274. DOI:10.1016/j.colsurfa.2014.05.057.
[16] WAHAB R, ANSARI S G, KIM Y S, et al. Low temperature solution synthesis and characterization of ZnO nano-flowers[J].Materials Research Bulletin, 2007, 42(9): 1640-1648. DOI:10.1016/j.materresbull.2006.11.035.
[17] CHEN C C, LIU P, LU C H. Synthesis and characterization of nano-sized ZnO powders by direct precipitation method[J].Chemical Engineering Journal, 2008, 144(3): 509-513. DOI:10.1016/j.cej.2008.07.047.
[18] N’KONOU K, HARIS M, LARE Y, et al. Effect of barium doping on structural and optical properties of zinc oxide nanoparticles synthesized by microwave hydrothermal method[J]. Physica Status Solidi B:Basic Solid State Physics, 2016, 253(2): 260-266. DOI:10.1002/pssb.201552177.
[19] SUN Y, RILEY D J, ASHFOLD M N R. Mechanism of ZnO nanotube growth by hydrothermal methods on ZnO film-coated Si substrates[J]. Journal of Physical Chemistry, 2006, 110(31): 15186-15192.DOI:10.1021/jp062299z.
[20] AYDIN H, AYDIN C, AL-GHAMDI A A, et al. Refractive index dispersion properties of Cr-doped ZnO thin films by sol-gel spin coating method[J]. Optik-International Journal for Light and Electron Optics,2016, 127(4): 1879-1883. DOI:10.1016/j.ijleo.2015.10.230.
[21] ASAKUMA N, HIRASHIMA H, IMAI H. Crystallization and reduction of sol-gel-derived zinc oxide films by irradiation with ultraviolet lamp[J].Journal of Sol-Gel Science and Technology, 2003, 26(1/2/3): 181-184.DOI:10.1023/A:1020782511960.
[22] HAGA K, SUZUKI T, KASHIWABA Y, et al. High-quality ZnO films prepared on Si wafers by low-pressure MO-CVD[J]. Thin Solid Films,2003, 433: 131-134. DOI:10.1016/S0040-6090(03)00327-4.
[23] APPLEROT G, LELLOUCHE J, PERKAS N, et al. ZnO nanoparticlecoated surfaces inhibit bacterial biofilm formation and increase antibiotic susceptibility[J]. RSC Advances, 2012, 2: 2314-2321. DOI:10.1039/C2RA00602B.
[24] ESHED M, LELLOUCHE J, MATALON S, et al. Sonochemical coatings of ZnO and CuO nanoparticles inhibit streptococcus mutans biofilm formation on teeth mode l[J]. Langmuir, 2012, 28: 12288-12295.DOI:10.1021/la301432a.
[25] KHAN S T, AHAMED M, Al-KHEDHAIRY A, et al. Biocidal effect of copper and zinc oxide nanoparticles on human oral microbiome and biofilm formation[J]. Materials Letters, 2013, 97: 67-70. DOI:10.1016/j.matlet.2013.01.085.
[26] DUTTA R K, NENAVATHU B P, GANGISHETTY M K, et al.Studies on antibacterial activity of ZnO nanoparticles by ROS induced lipid peroxidation[J]. Colloids and Surfaces B, Biointerfaces, 2012, 94:143-150. DOI:10.1016/j.colsurfb.2012.01.046.
[27] 武志富, 李素娟. 氢氧化锌和氧化锌的红外光谱特征[J]. 光谱实验室,2012, 29(4): 2172-2175. DOI:10.3969/j.issn.1004-8138.2012.04.052.
[28] 余罡. 纳米氧化锌的制备与抗菌性能研究[D]. 武汉: 华中科技大学,2007: 16-18.
[29] 计亚军. 二氧化钛纳米薄膜的制备与光电性能研究[D]. 南京: 南京大学, 2011: 18-20.
[30] SHARMA D, RAJPUT J, KAITH B S, et al. Synthesis of ZnO nanoparticles and study of their antibacterial and antifungal properties[J]. Thin Solid Films, 2010, 519(3): 1224-1229. DOI:10.1016/j.tsf.2010.08.073.
Preparation of Zinc Oxide Films by Sol-Gel Method and Their Anti-Biofilm Properties against Shewanella putrefaciens
孙彤(1966—),女,教授,博士,研究方向为水产品贮藏加工及质量安全控制。E-mail:jzsuntong@sina.com