鱼露也称“鱼酱油”,是一种以低值鱼类或水产品加工副产物为原料,经过天然发酵制得的风味独特的调味品。鱼露色泽呈琥珀色,味道鲜美,富含牛磺酸、人体必需氨基酸、有机酸、微量元素等营养成分,备受人们的青睐。传统鱼露作为一种天然发酵产品,发酵周期长达10—18 个月,其发酵过程是以蛋白质、脂质和糖类等营养物质为基质,在微生物和酶的作用下发生以营养物质分解为主体的一系列复杂代谢活动,逐渐产生醛、酮、醇、酯等化合物[1-2],从而形成鱼露独特的风味。
微生物是传统鱼露风味形成不可或缺的因素,明确传统鱼露发酵过程中复杂微生物群落结构对于揭示鱼露风味形成机制具有重要作用,是实现传统鱼露产业技术提升的重要环节。目前,国内外学者主要利用纯培养方式对鱼露中的微生物进行探索,在具有特定活性微生物筛选方面已取得了大量成果,如从鱼露发酵液中分离高产蛋白酶活性的Virgibacillus sp. SK33[3]、Bacillus subtilis CN2[4]、Virgibacillus halodenitrificans SK1-3-7[5]等,分离具有高效生物胺降解活性的Halomonas shantousis SWA25[6]、Staphylococcus carnosus FS19[7]等。然而,自然界中微生物群落及其栖息的环境远比人们预期的复杂和多样,通过纯培养技术在实验室所获取的微生物仅占环境微生物总量的1%左右,这使得传统纯培养方法在鱼露微生物研究上存在局限性,无法全面揭示鱼露中微生物的真实状况。随着分子生物学技术的发展,基于高通量测序技术的非培养方法为全面真实地了解环境中微生物群落结构提供了可能,此方法直接从环境中提取微生物群体基因组DNA,通过对微生物rRNA基因的若干可变区进行序列测定,可全面真实地反映环境样品中微生物的种类和丰度。近年来,高通量测序技术已在豆酱[8]、虾酱[9]、糯米酒[10]、干酪[11]等多种发酵食品微生物群落结构研究上进行了应用。然而,目前关于我国传统鱼露发酵过程中微生物群落结构的研究鲜见报道。
鉴于此,本研究采用Illumina MiSeq平台对不同发酵时间下鱼露细菌的16S rRNA基因进行高通量测序,分析鱼露发酵过程细菌群落结构及多样性变化规律,采用气相色谱-质谱联用(gas chromatography-mass spectrometry,GC-MS)技术研究鱼露发酵过程中的挥发性风味成分,并利用Pearson相关性分析方法研究细菌群落结构对传统鱼露挥发性风味形成的影响规律,这对于揭示鱼露风味的形成机制以及优化传统鱼露的发酵工艺具有重要意义。
鱼露采自于广东省鱼露生产厂家,根据传统生产工艺,按照30%的用盐量将鳀鱼和食盐进行混合,在的发酵池中进行发酵,取发酵时间为0、1、3、6、12 个月的鱼露发酵液,用定性滤纸过滤,收集滤液保存于-80 ℃冰箱待测。
细菌基因组DNA提取试剂盒 美国Omega科技公司;AMPure XP beads核酸纯化试剂盒 美国Beckman公司;2,4,6-三甲基吡啶(2,4,6-trimethylpyridine,TMP)标准品 日本TCI公司;其他试剂均为分析纯。
Illumina MiSeq测序仪 美国Illumina公司;GCMSQP2010 plus GC-MS联用仪 日本岛津公司;65 μm DVB-PDMS萃取头 美国Supelco公司。
1.3.1 鱼露发酵过程细菌群落结构分析
参照文献[12]方法。采用美国Omega科技有限公司的细菌基因组DNA提取试剂盒(DP302)提取鱼露发酵液中细菌的基因组DNA。设计细菌的16S rRNA基因序列V4片段扩增的通用引物:515F(5’-GTGCCAGCMGCCGCGGTAA-3’)和806R(5’-GGACTACNNGGGTATCTAAT-3’)。聚合酶链式反应条件:98 ℃预变性3 min;98 ℃变性45 s,55 ℃退火45 s,72 ℃延伸45 s,30 个循环;72 ℃延伸7 min。使用AMPure XP beads核酸纯化试剂盒纯化扩增产物,利用Illumina MiSeq PE250进行双末端测序。
1.3.2 静态顶空固相微萃取挥发性物质
参照文献[13]方法。将5.0 g过滤后的鱼露样品置于20 mL顶空进样瓶中,加入2 μL内标物TMP溶液(1 000 mg/L),封闭瓶口后插入已老化好的萃取头,置于温度为60 ℃的磁力搅拌台上,吸附40 min,再插入GC-MS进样口进行解吸,进样口温度250 ℃,解吸5 min,重复测定3 次。为防止样品间交叉污染,连续进样的萃取头需要在270 ℃的条件下老化10 min。
1.3.3 挥发性风味成分的GC-MS检测条件
色谱柱为CD-5MS(30 m×0.25 mm,0.25 μm),载气为氦气,载气流速1.0 mL/min,采用恒线速率,分流比1∶20,进样量1 μL。升温程序:起始温度35 ℃,保持1 min,以5 ℃/min的速率升温到60 ℃保持1 min,再以6 ℃/min上升到140 ℃保持1 min,最后以8 ℃/min升温到230 ℃,保持5 min。离子源温度200 ℃,电子能量70 eV,质量扫描范围m/z 35~350,无溶剂切除时间。
1.4.1 Illumina MiSeq PE250测序结果分析
原始的测序数据经过滤处理获得Clean Data,然后利用FLASH(v1.2.11)软件将双末端测序得到的成对reads进行组装,得到高变区的Tags。利用USEARCH(v7.0.1090)软件将组装好的Tags在97%相似度条件下进行聚类,得到用于物种分类的操作分类单元(operational taxonomic unit,OTU)序列。利用RDP classifer(v2.2)软件将OTU序列与数据库进行比对,获得物种注释。根据每个物种在每个样品的相对丰度进行物种热图分析。利用mothur(v1.31.2)软件计算样品的α多样性值,包括observed species指数、Chao指数、ACE指数、Shannon指数及Simpson指数。利用QIIME(v1.80)软件计算不同样品间的β多样性值,包括Bray-Curtis、weighted UniFrac、unweighted UniFrac等。
1.4.2 挥发性风味化合物定量分析
利用Xcalibur软件对挥发性风味化合物进行鉴定。利用计算机检索各化合物,与WILEY和NIST 05a. L谱库数据库相匹配,仅报道正反匹配度均大于800的结果。
各挥发性风味化合物的绝对含量按照待测挥发物与内标物TMP的峰面积之比求得其绝对含量,计算公式如下:
式中:P为正己醛与内标物TMP的峰面积之比;N为内标物TMP的质量/μg;M为称取的鱼露样品质量/g。
1.4.3 相关性分析
利用SPSS 19.0分析软件中的z-score标准化法对原始数据进行线性变换,将结果映射在一定的区间范围,导出标准化后的变量,然后利用Pearson相关性分析对标准化后变量之间的相关性进行分析。
利用16S rRNA测序技术研究不同发酵时间下传统鱼露细菌群落结构和多样性变化,测序数据统计如表1所示。所有样品一共得到156 304 条Tags,平均每个样品有31 260 条,Tags的平均长度为(252±1)bp。Tags经过优化后,在97%相似度下将其聚类为用于物种分类的OTU。5 个样品共产生387 种OTU,其中6 个月的OTU种类最多,达到312 种。
表1 鱼露发酵过程细菌16S rRNA测序数据统计
Table 1 16S rRNA sequencing data statistics of bacteria in fish sauce during fermentation

发酵时间/月 0 1 3 6 12总Tags数量 31 192 31 144 31 703 31 220 31 220 Tags平均长度 253 252 252 253 252 OTU种类 139 170 159 312 286
2.2.1 α多样性分析
α多样性是对单个样品中物种多样性进行分析,observed species指数、Chao指数和ACE指数反映样品中群落的丰富度,不考虑群落中每个物种的丰度情况,而Shannon指数和Simpson指数则同时考虑群落中物种丰富度和物种均匀度的影响[14]。不同发酵阶段鱼露细菌α多样性分析如表2所示。结果显示,随着发酵时间的延长,鱼露中细菌多样性越显丰富;发酵时间为6、12 个月时,鱼露中细菌多样性最为丰富;发酵时间为6 个月时鱼露细菌群落中物种的数量最多,而发酵12 个月时细菌群落中物种更为均匀。
表2 不同发酵时间鱼露细菌α多样性分析
Table 2 α Diversity analysis for bacterial communities in fish sauce at different fermentation stages

指数 发酵时间/月0 1 3 6 12 observed species指数 139 170 159 312 286 Chao指数 172.48 204.73 205.16 321.96 303.58 ACE指数 175.62 212.1 214.62 327.59 305.5 Shannon指数 0.6 1.43 0.51 2.16 2.39 Simpson指数 0.8 0.54 0.84 0.39 0.25
2.2.2 Venn图分析
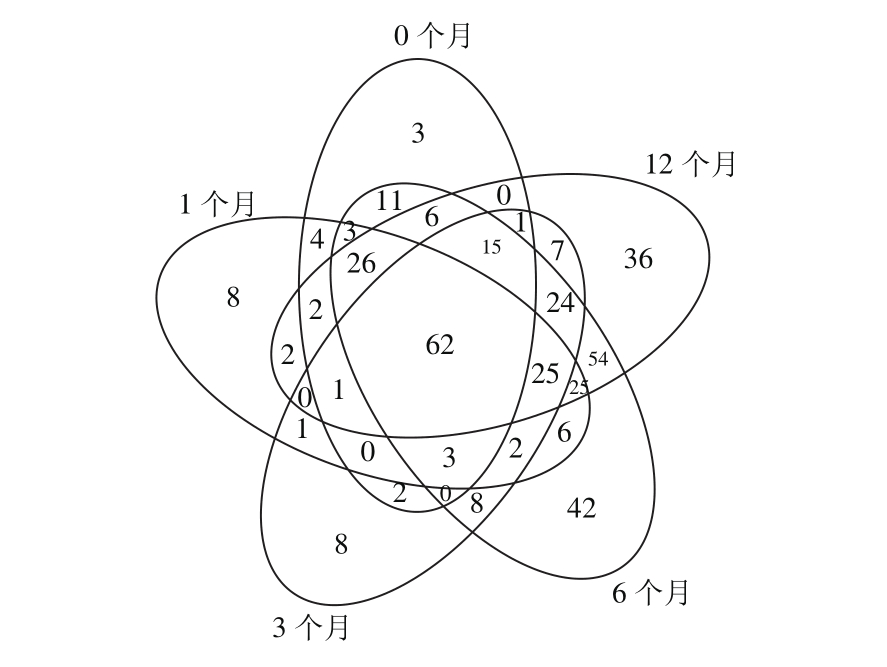
图1 不同发酵时间鱼露细菌群落Venn图分析
Fig. 1 Venn diagram analysis of bacterial communities in fish sauce at different fermentation stages
利用Venn图可以展示多个样品共有和各自特有OTU数目,直观展示样品间OTU的重叠情况。如图1所示,5 个发酵时间点共有的细菌种类为62 种;发酵后期即6、12 个月份共有的细菌种类最多,达到237 种;发酵时间为6 个月时,独有的细菌种类最多,达到42 种。
2.2.3 β多样性分析
采用Bray-Curtis、unweighted UniFrac、weighted UniFrac等β多样性指标比较不同发酵时间鱼露细菌多样性差异,如图2所示。Bray-Curtis的计算只考虑样品中物种的存在情况,而不考虑序列间的进化距离。结果显示,发酵前期0、1、3 个月之间菌群差异较小,而与发酵后期6、12 个月的菌群差异较大(图2A)。UniFrac是通过利用系统进化的信息来比较不同样品间物种群落差异,其中unweighted UniFrac不考虑物种丰度,weighted UniFrac考虑物种丰度。结果显示,在不考虑物种丰度的情况下,0 个月和1 个月之间菌群差异较小,6 个月和12 个月之间菌群差异较小,3 个月与6、12 个月之间的群落结构更为相似(图2B)。在考虑物种丰度的情况下,结果与Bray-Curtis分析结果相似,发酵前期0、1、3 个月之间菌群差异较小,发酵后期6、12 个月之间菌群差异较小,但是发酵前期与发酵后期菌群差异较大(图2C)。

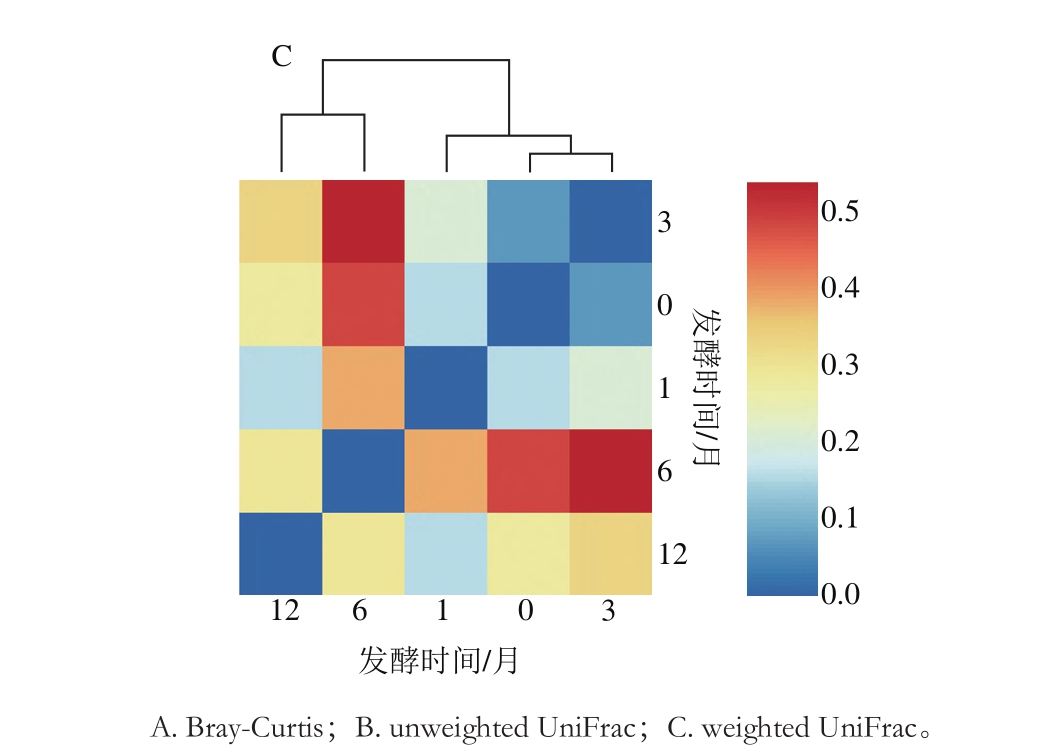
图2 不同发酵时间鱼露细菌β多样性热图分析
Fig. 2 β Diversity heat map analysis of bacterial communities in fish sauce at different fermentation stages
2.3.1 基于门水平传统鱼露发酵过程细菌群落结构变化
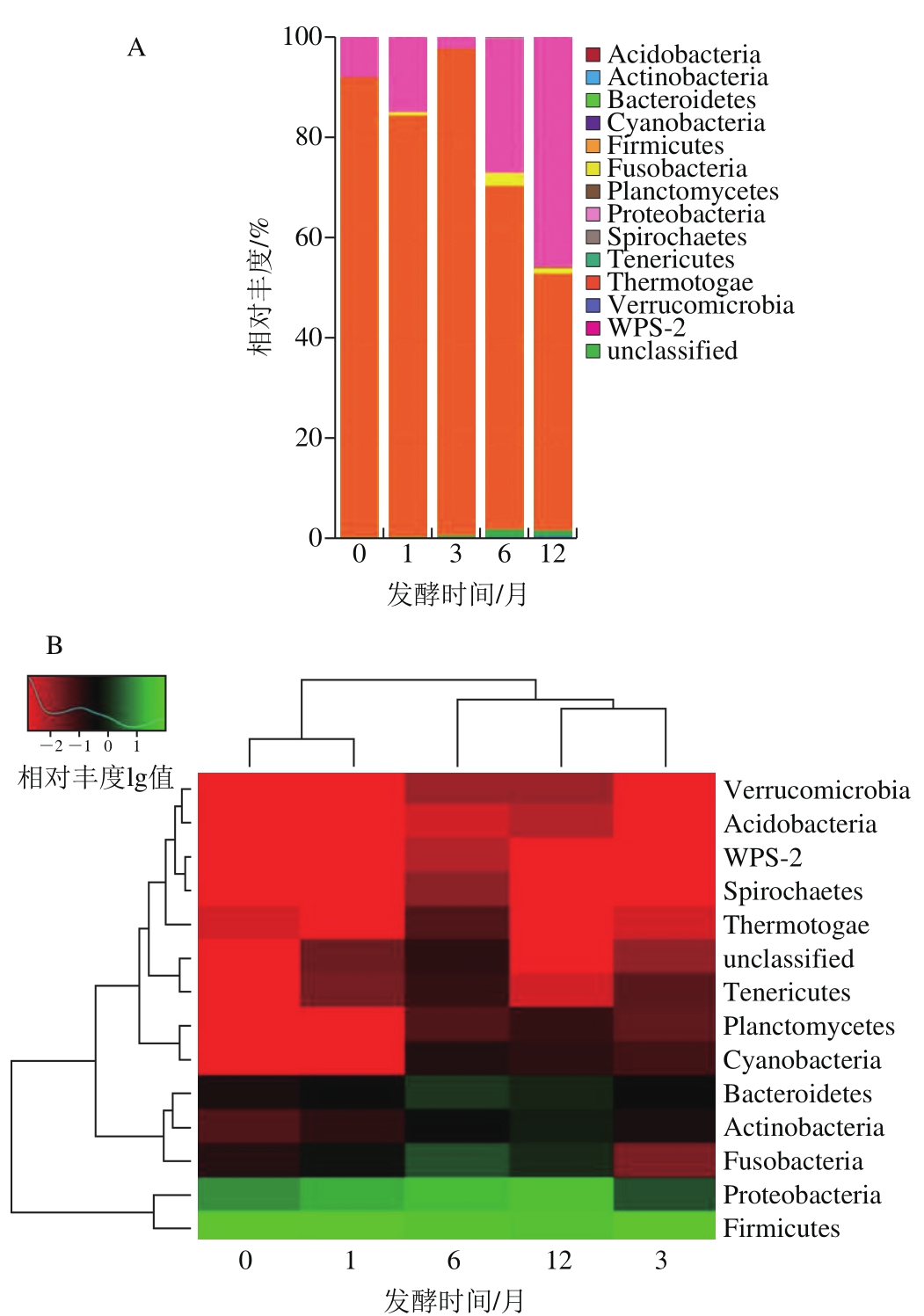
图3 在门水平下鱼露不同发酵时期菌群相对丰度柱形图(A)和热图(B)分析
Fig. 3 Stacked-column (A) and heat map (B) analysis of relative abundances of bacterial communities in fish sauce at different fermentation stages at the phylum level
如图3所示,厚壁菌门(Firmicutes)和变形菌门(Proteobacteria)是鱼露整个发酵过程中最主要的菌群,此结果与虾酱[15]和豆瓣酱[8]中报道的结果相似。在起始发酵阶段,主要以Firmicutes为主,并在3 个月时Firmicutes的相对丰度达到最高(96.8%)。随着发酵时间的延长,Firmicutes的丰度逐渐降低,而Proteobacteria的丰度逐渐升高,在12 个月时达到46.0%。这个结果与虾酱中菌群变化结果有所不同:发酵初期主要为Proteobacteria,发酵后期Firmicutes代替Proteobacteria成为主要菌群[15]。
2.3.2 基于属水平传统鱼露发酵过程微生物群落结构变化

图4 在属水平下鱼露不同发酵时期菌群相对丰度柱形图(A)和热图(B)分析
Fig. 4 Stacked-column (A) and heat map (B) analysis of relative abundances of bacterial communities in fish sauce at different fermentation stages at the genus level
如图4所示,不同发酵时期在属的水平下鱼露的菌群显著不同,其中盐厌氧菌属(Haloanaerobium)是鱼露整个发酵过程中最主要的菌群。这个结果与虾酱[15]、罐装腌渍鲱鱼(Surströmming)[16]和韩国鱼酱油(Myeolchi-Aekjeot)[17]中菌群变化结果一致。在发酵起始阶段,Haloanaerobium的相对丰度逐渐升高,并在3 个月时达到最高(92.1%),随着发酵时间的继续延长,Haloanaerobium的相对丰度逐渐降低。与发酵初期相比,发酵中后期时盐单胞菌属(Halomonas)、发光杆菌属(Photobacterium)、四联球菌属(Tetragenococcus)等菌群的相对丰度增加最为显著。发酵末期,Halomonas成为优势菌群,其相对丰度为25.8%。Tetragenococcus是豆瓣酱、泰国鱼酱油[8,18-19]等盐渍发酵食品中主要的菌群。本研究中,Tetragenococcus虽然是鱼露发酵过程中主要的菌群之一,但是与报道的盐渍发酵食品相比,Tetragenococcus的丰度相对较低。
传统鱼露不同发酵时期挥发性风味化合物含量变化结果如图5所示。发酵1、3、6、12 个月的鱼露样品共检测出54 种挥发性化合物,包括醛类(13 种)、酮类(5 种)、醇类(7 种)、酯类(5 种)、烃类(8 种)、酸类(7 种)和含氮化合物(9 种)。随着发酵时间的延长,醛类、醇类、酸类、酯类和烃类化合物的总含量呈现逐渐上升的趋势,酮类化合物的总含量呈现逐渐下降的趋势,含氮化合物的总含量则变化不大。在整个鱼露发酵过程,醛类、醇类、酸类化合物的总含量明显高于其他风味化合物。
醛类化合物是脂质氧化的降解产物,一般具有令人愉快的气味,如青草味、麦芽香味、水果香味和奶酪味[20-21]。在本研究中,醛类化合物是鱼露发酵过程中种类最多和含量最高的挥发性风味化合物。3-甲硫基丙醛、2-甲基丙醛和3-甲基丁醛是含量最高的醛类化合物,其含量变化与醛类化合物总含量变化相似,在12 个月时含量达到最高。庚醛是鱼腥味的主体成分,12 个月时鱼露中庚醛的含量比1 个月降低了67.5%。其他9 种醛类化合物的含量较低,其中(E,Z)-2,6-壬二烯醛的含量最低,在整个发酵过程中均低于1 μg/kg。酮类化合物一般会产生醚味、奶酪味、焦香味[13,22]。鱼露发酵过程共发现5种酮类化合物,相比于其他种类的风味化合物,酮类化合物的含量较低。



图5 传统鱼露不同发酵时间挥发性化合物含量变化
Fig. 5 Changes in contents of volatile flavor components in fish sauce at different fermentation stages
如图5所示,醇类化合物主要来源于碳水化合物、氨基酸和脂肪的代谢[23-24]。鱼露发酵过程中,乙醇、2-甲基-1-丁醇和1-辛烯-3-醇的含量相对较高,在4 个发酵阶段均被检出。鱼露发酵过程中酯类化合物主要来源于醇类和酸类物质的酯化反应,其中以乙酯类物质为主,这可能与鱼露发酵过程产生高浓度的乙醇有关,其中乙酸乙酯的含量最高,在4 个发酵阶段均被检出。这个结果与酱油中酯类挥发性化合物的报道一致[25-26]。
烃类化合物是鱼露发酵过程中含量最低的一类挥发性化合物,共检测到8 种烃类化合物,但是这几种化合物的含量都较小,而且烷烃类化合物通常认为不具有气味活性[27],因此烃类化合物对鱼露整体风味的贡献较小。鱼露发酵过程共检测到7 种酸类化合物,其中只有乙酸在4 个发酵阶段均被检出,其含量变化与乙酸乙酯含量变化一致。
含氮化合物来源于碳水化合物和氨基酸发生美拉德反应或者氨基酸的热分解。三甲胺、2-异戊基-6-甲基吡嗪和2-乙基呋喃在4个发酵阶段均被检出。三甲胺是鱼露中鱼腥味的主体成分,与庚醛的变化相似,发酵12 个月后鱼露中三甲胺含量比发酵1 个月降低了63.4%,结果表明发酵时间的延长有利于降低鱼露的腥味。
气味活性值(odor activity value,OAV)是香气化合物浓度与其阈值的比值,已广泛应用于特征性香气活性化合物的筛选,OAV≥1,则可认为此挥发性物质为主体呈香风味化合物,且OAV越大对整体香气贡献程度越高[28]。本研究利用OAV从鱼露发酵过程检测到的54 种挥发性风味化合物中筛选主体呈香化合物,结果如表3所示。在鱼露整个发酵过程中共有9 种化合物为主体呈香风味化合物(OAV≥1),其中3-甲硫基丙醛(土豆香味)的平均OAV最大,达到135.98,其次是3-甲基丁醛(麦芽香味)、1-辛烯-3-醇(蘑菇香味)、2-甲基丙醛(麦芽香味)和乙酸乙酯(水果香味),另外还有2-乙基呋喃(青草味)、三甲胺(鱼腥味)、2-甲基-1-丁醇(麦芽香味)和己醛(青草味、脂味),这些风味化合物对鱼露的整体香气轮廓有显著的贡献。本研究结果与Fukami等[29]对鱼露的特征挥发性风味化合物鉴定结果相似。这些呈香风味化合物也被证实为是酱油[30]和豆瓣酱[31]等发酵食品的关键香气化合物。结果表明,这9 种风味化合物可能是传统鱼露的关键主体呈香风味化合物。
表3 传统鱼露发酵过程中的主体呈香化合物(OAV≥1)
Table 3 Principal aroma compounds (OAV ≥ 1) in fish sauce at different fermentation stages

符号 化合物 气味描述 OAV 1 个月 3 个月 6 个月 12 个月 平均值a 2-甲基-1-丁醇 麦芽香味 1.88 1.38 3.66 4.27 2.80 b 1-辛烯-3-醇 蘑菇香味 12.65 21.79 55.31 69.41 39.79 c 3-甲硫基丙醛 土豆香味 115.90 121.45 146.83 159.74 135.98 d 2-甲基丙醛 麦芽香味 10.25 7.15 13.70 21.08 13.04 e 3-甲基丁醛 麦芽香味 39.91 87.61 83.39 129.71 85.16 f 己醛 青草味、脂味 1.37 3.46 1.72 3.83 2.60 g 乙酸乙酯 水果香味 2.15 10.18 6.03 19.06 9.36 h 三甲胺 鱼腥味 5.03 3.38 3.97 1.84 3.56 i 2-乙基呋喃 青草味 2.61 1.33 6.33 8.49 4.69
本研究筛选Halanaerobium、Halomonas、Photobacterium和Tetragenococcus 4 种优势菌群与3-甲硫基丙醛、3-甲基丁醛、1-辛烯-3-醇、2-甲基丙醛、乙酸乙酯、2-乙基呋喃、三甲胺、2-甲基-1-丁醇、己醛9 种主体风味化合物,利用Pearson相关性分析研究细菌群落结构对传统鱼露挥发性风味形成的影响规律,如表4所示。Halanaerobium与三甲胺呈显著正相关,与乙酸乙酯呈显著负相关,结果预示Halanaerobium可能会抑制传统鱼露发酵过程中水果香味的产生,促进传统鱼露发酵过程中鱼腥味的生成。Halomonas与2-甲基丙醛呈显著正相关,结果预示Halomonas可能会促进传统鱼露发酵过程中麦芽香味的生成。Photobacterium和Tetragenococcus与9 种主体风味化合物均无显著相关。有趣的是Halomonas与除三甲胺以外的8 种主体呈香化合物均呈正相关,而这8 种化合物的含量均在发酵12 个月时达到最大,结果预示Halomonas可能在鱼露发酵后期挥发性风味形成上发挥着重要作用。
表4 优势菌群与主体挥发性风味化合物之间的Pearson相关性分析
Table 4 Pearson’s correlation analysis between dominant bacterial communities and principal aroma compounds

注:A~D分别为Haloanaerobium、Halomonas、Tetragenococcus、Photobacterium。*.每行与每列两数据之间显著相关(P<0.05)。
相关性 A B C D a b c d e f g h i A 1 B -0.843 1 C -0.361 0.157 1 D 0.665 -0.451-0.607 1 a -0.522 0.483 -0.385 0.251 1 b -0.625 0.648 -0.069 0.161 0.913* 1 c -0.651 0.636 -0.112 0.132 0.947* 0.994* 1 d -0.7070.919* -0.249-0.019 0.862 0.889* 0.898* 1 e -0.870 0.645 0.334 -0.311 0.728 0.839 0.855 0.706 1 f -0.405 0.352 -0.326 0.388 0.973* 0.919* 0.939* 0.768 0.711 1 g -0.953*0.698 0.331 -0.510 0.655 0.725 0.759 0.689 0.965* 0.586 1 h 0.939* -0.713-0.390 0.462 -0.652-0.769-0.789-0.695-0.985*-0.605-0.991* 1 i -0.519 0.337 -0.391 0.142 0.951* 0.778 0.842 0.730 0.708 0.910* 0.681 -0.644 1
采用16S rRNA高通量测序技术研究鱼露发酵过程细菌群落结构及多样性变化,鱼露发酵过程细菌多样性较为丰富,共检测到387 种细菌。随着发酵时间的延长,鱼露细菌种类先上升后下降,在6 个月达到最大(312 种),从6 个月增加到12 个月菌群多样性有所下降但菌群差异性变小。Firmicutes和Proteobacteria是鱼露整个发酵过程中最主要的门。Haloanaerobium是鱼露发酵过程中最主要的属,随着发酵时间的延长其相对丰度先上升后下降,在3 个月时达到最高(92.1%)。与发酵初期(0 个月)相比,发酵中后期Photobacterium、Tetragenococcus和Halomonas等菌群的相对丰度增加最为显著。发酵末期(12 个月),Halomonas成为优势的菌群,其相对丰度为25.8%。采用GC-MS技术研究鱼露发酵过程中的挥发性风味成分,共检测出醛、醇、酮、酯、烃、酸、含氮化合物7大类共54 种挥发性化合物,并根据OAV≥1筛选到9 种主体呈香风味化合物,其中3-甲硫基丙醛(土豆香味)的平均OAV最大(135.98),其次是3-甲基丁醛(麦芽香味)、1-辛烯-3-醇(蘑菇香味)、2-甲基丙醛(麦芽香味)、乙酸乙酯(水果香味)、2-乙基呋喃(青草味)、三甲胺(鱼腥味)、2-甲基-1-丁醇(麦芽香味)和己醛(青草味、脂味),这些风味化合物对鱼露的整体香气轮廓有显著贡献。利用Pearson相关性分析考察4 种主要优势菌群与9 种主体风味化合物之间的相关性,结果发现Halanaerobium与三甲胺呈显著正相关,与乙酸乙酯呈显著负相关,Halanaerobium可能会抑制传统鱼露发酵过程中水果香味的产生,促进传统鱼露发酵过程中鱼腥味的生成;Halomonas与2-甲基丙醛呈显著正相关,Halomonas可能会促进传统鱼露发酵过程中麦芽香味的生成。
[1] 江航, 王锡昌. 顶空固相微萃取与GC-MS联用的鱼露挥发性风味成分分析[J]. 安徽农业科学, 2008, 36(23): 9838-9841. DOI:10.13989/j.cnki.0517-6611.2008.23.022.
[2] 肖宏艳, 曾庆孝. 潮汕鱼露发酵过程中挥发性风味成分分析[J].中国调味品, 2010, 35(2): 92-96.
[3] SINSUWAN S, RODTONG S, YONGSAWATDIGUL J. Production and characterization of NaCl-activated proteinases from Virgibacillus sp. SK33 isolated from fish sauce fermentation[J]. Process Biochemistry, 2008, 43(2):185-192. DOI:10.1016/j.procbio.2007.11.015.
[4] UCHIDA H, KONDO D, YAMASHITA S, et al. Purification and properties of a protease produced by Bacillus subtilis CN2 isolated from a Vietnamese fish sauce[J]. World Journal of Microbiology & Biotechnology, 2004, 20(6): 579-582. DOI:10.1023/B:WIBI.0000043168.15067.44.
[5] MONTRIWONG A, RODTONG S, YONGSAWATDIGUL J. Detergent-stable salt-activated proteinases from Virgibacillus halodenitrificans SK1-3-7 isolated from fish sauce fermentation[J].Applied Biochemistry and Biotechnology, 2015, 176(2): 505-517.DOI:10.1007/s12010-015-1591-5.
[6] JIANG W, LI C, XU B, et al. Halomonas shantousis sp nov., a novel biogenic amines degrading bacterium isolated from Chinese fermented fish sauce[J]. Antonie Van Leeuwenhoek International Journal of General and Molecular Microbiology, 2014, 106(6): 1073-1080. DOI:10.1007/s10482-014-0275-4.
[7] ZAMAN M Z, BAKAR F A, SELAMAT J, et al. Degradation of histamine by the halotolerant Staphylococcus carnosus FS19 isolate obtained from fish sauce[J]. Food Control, 2014, 40: 58-63.DOI:10.1016/j.foodcont.2013.11.031.
[8] KIM M J, KWAK H S, JUNG H Y, et al. Microbial communities related to sensory attributes in Korean fermented soy bean paste (doenjang)[J]. Food Research International, 2016, 89: 724-732. DOI:10.1016/j.foodres.2016.09.032.
[9] DUAN S, HU X, LI M, et al. Composition and metabolic activities of the bacterial community in shrimp sauce at the flavor-forming stage of fermentation as revealed by metatranscriptome and 16S rRNA gene sequencings[J]. Journal of Agricultural and Food Chemistry, 2016, 64(12):2591-2603. DOI:10.1021/acs.jafc.5b05826.
[10] LV X G, JIA R B, LI Y, et al. Characterization of the dominant bacterial communities of traditional fermentation starters for Hong Qu glutinous rice wine by means of MALDI-TOF mass spectrometry fingerprinting,16S rRNA gene sequencing and species-specific PCRs[J]. Food Control,2016, 67: 292-302. DOI:10.1016/j.foodcont.2016.03.005.
[11] 焦晶凯, 莫蓓红. Illumina MiSeq平台高覆盖率测定干酪中的细菌微生物多样性[J]. 中国酿造, 2014, 33(5): 34-38. DOI:10.11882/j.issn.0254-5071.2014.05.009.
[12] 吴燕燕, 钱茜茜, 李来好, 等. 基于Illumina MiSeq技术分析腌干鱼加工过程中微生物群落多样性[J]. 食品科学, 2017, 38(12): 1-8.DOI:10.7506/spkx1002-6630-201712001.
[13] 吴燕燕, 王悦齐, 李来好, 等. 基于电子鼻与HS-SPME-GC-MS技术分析不同处理方式腌干带鱼挥发性风味成分[J]. 水产学报, 2016,40(12): 1931-1940. DOI:10.11964/jfc.20160410346.
[14] SCHLOSS P D, WESTCOTT S L, RYABIN T, et al. Introducing mothur: open-source, platform- independent, community-supported software for describing and comparing microbial communities[J].Applied and Environmental Microbiology, 2009, 75(23): 7537-7541.DOI:10.1128/AEM.01541-09.
[15] LEE S H, JUNG J Y, JEON C O. Microbial successions and metabolite changes during fermentation of salted shrimp (saeu-jeot) with different salt concentrations[J]. PLoS ONE, 2014, 9(2): e90115. DOI:10.1371/journal.pone.0090115.
[16] KOBAYASHI T, KIMURA B, FUJII T. Strictly anaerobic halophiles isolated from canned Swedish fermented herrings (Surstromming)[J].International Journal of Food Microbiology, 2000, 54(1/2): 81-89.DOI:10.1016/S0168-1605(99)00172-5.
[17] LEE H W, CHOI Y J, HWANG I M. Relationship between chemical characteristics and bacterial community of a Korean salted-fermented anchovy sauce, Myeolchi-Aekjeot[J]. LWT-Food Science and Technology,2016, 73: 251-258. DOI:10.1016/j.lwt.2016.06.007.
[18] NAM Y D, LEE S Y, LIM S I. Microbial community analysis of Korean soybean pastes by next-generation sequencing[J]. International Journal of Food Microbiology, 2012, 155(1/2): 36-42. DOI:10.1016/j.ijfoodmicro.2012.01.013.
[19] UDOMSIL N, CHEN S, RODTONG S, et al. Quantification of viable bacterial starter cultures of Virgibacillus sp. and Tetragenococcus halophilus in fish sauce fermentation by real-time quantitative PCR[J].Food Microbiology, 2016, 57: 54-62. DOI:10.1016/j.fm.2016.01.004.
[20] WANG Y, JIANG Y T, CAO J X, et al. Study on lipolysis-oxidation and volatile flavour compounds of dry-cured goose with different curing salt content during production[J]. Food Chemistry, 2016, 190: 33-40.DOI:10.1016/j.foodchem.2015.05.048.
[21] WAH T T, WALAISRI S, ASSAVANIG A, et al. Co-culturing of Pichia guilliermondii enhanced volatile flavor compound formation by Zygosaccharomyces rouxii in the model system of Thai soy sauce fermentation[J]. International Journal of Food Microbiology, 2013,160(3): 282-289. DOI:10.1016/j.ijfoodmicro.2012.10.022.
[22] PEREZ-PALACIOS T, PETISCA C, MELO A, et al. Quantification of furanic compounds in coated deep-fried products simulating normal preparation and consumption: optimisation of HS-SPME analytical conditions by response surface methodology[J]. Food Chemistry, 2012,135(3): 1337-1343. DOI:10.1016/j.foodchem.2012.05.100.
[23] SIDIRA M, KANDYLIS P, KANELLAKI M, et al. Effect of immobilized Lactobacillus casei on the evolution of flavor compounds in probiotic dry-fermented sausages during ripening[J]. Meat Science,2015, 100: 41-51. DOI:10.1016/j.meatsci.2014.09.011.
[24] IVANOVA-PETROPULOS V, MITREV S, STAFILOV T, et al.Characterisation of traditional Macedonian edible oils by their fatty acid composition and their volatile compounds[J]. Food Research International, 2015, 77(3): 506-514. DOI:10.1016/j.foodres.2015.08.014.[25] 冯云子. 高盐稀态酱油关键香气物质的变化规律及形成机理的研究[D]. 广州: 华南理工大学, 2015: 131-132.
[26] SUN S Y, JIANG W G, ZHAO Y P. Profile of volatile compounds in 12 Chinese soy sauces produced by a high-salt-diluted state fermentation[J].Journal of the Institute of Brewing, 2010, 116(3): 316-328. DOI:10.1002/j.2050-0416.2010.tb00437.x.
[27] 高先楚, 王锡昌, 顾赛麒, 等. 中华绒螯蟹性腺加热熟制前后挥发性成分和脂肪酸组成分析[J]. 现代食品科技, 2014, 30(9): 265-274.DOI:10.13982/j.mfst.1673-9078.2014.09.044.
[28] 顾赛麒, 王锡昌, 陶宁萍, 等. 顶空固相微萃取-气质联用及电子鼻技术检测中华绒螯蟹不同可食部位中的香气成分[J]. 食品科学, 2013,34(18): 239-244. DOI:10.7506/spkx1002-6630-201318049.
[29] FUKAMI K, ISHIYAMA S, YAGURAMAKI H, et al. Identification of distinctive volatile compounds in fish sauce[J]. Journal of Agricultural and Food Chemistry, 2002, 50(19): 5412-5416. DOI:10.1021/jf020405y.
[30] STEINHAUS P, SCHIEBERLE P. Characterization of the key aroma compounds in soy sauce using approaches of molecular sensory science[J]. Journal of Agricultural and Food Chemistry, 2007, 55(15):6262-6269. DOI:10.1021/jf0709092.
[31] LEE S, AHN B. Comparison of volatile components in fermented soybean pastes using simultaneous distillation and extraction (SDE)with sensory characterisation[J]. Food Chemistry, 2009, 114(2): 600-609.DOI:10.1016/j.foodchem.2008.09.091.
Bacterial Community Succession during Fermentation of Chinese Fish Sauce and Its Effect on Formation of Volatile Flavor Components