类胡萝卜素是一类含有40 个碳的类异戊烯四萜化合物及其衍生物的总称,外观呈黄色、橙红色或红色,分为胡萝卜素和叶黄素两大类。自然界中,类胡萝卜素主要由一些高等植物和微生物合成;人体因自身不能合成类胡萝卜素,主要从日常膳食中摄取。类胡萝卜素不仅是人类膳食营养中重要的组成部分,具有VA的活性,而且还具有抗氧化、预防夜盲症、抗癌等药理作用,在医药和保健食品领域具有广泛用途[1-2]。
目前,生产类胡萝卜素的方法主要有植物提取法、化学合成法和微生物发酵法。其中微生物发酵法具有生产原料不受限制、易于工业化生产、生产周期短、生产效率高、天然安全、色泽丰富等优势,逐渐成为类胡萝卜素生产的主要方法[3]。合成类胡萝卜素的主要微生物种类有光合细菌、杜氏藻、雨生红球藻、三孢布拉霉、卷枝毛霉、红酵母等[4-6]。Buzzini等[7]研究了Rhodotorula、Rhodosporidium、Sporobolomyces和Sporidiobolus 4 个属的13 个菌株积累色素的情况,将培养5 d的菌体收集,测得总色素含量(以干菌体计)为16.40~184.00 μg/g,经色谱鉴定主要组分为红酵母红素、红酵母烯、γ-胡萝卜素和β-胡萝卜素。樊竹青等[8]对分离自云南抚仙湖水的379 株酵母菌进行产类胡萝卜素的筛选研究结果显示,83.91%的供试菌具有产类胡萝卜素的能力,大部分菌株产量在10~300 μg/g之间,最高达590.83 μg/g;产类胡萝卜素酵母集中分布于红冬孢酵母属(Rhodosporidium)和红酵母属(Rhodotorula),担子菌酵母产类胡萝卜素的能力高于子囊菌酵母。Chagas等[9]设计了微藻光生物反应器与酵母发酵集成培养装置,研究利用啤酒发酵时产生的CO2培养杜氏盐藻用于类胡萝卜素的生产,结果显示类胡萝卜素的产量(以干菌体计)可达4.74 g/g,产率可达0.86 mg/(L·d)。以Rhodotorula glutinis YB-252为菌种采用固态发酵方法生产类胡萝卜素时,在优化条件下可获得340 mg/L的番茄红素[10]。
但是,目前用于工业化生产类胡萝卜素的微生物菌种还十分有限,从自然界中筛选高产类胡萝卜素的优良菌种仍具有较高的研究和开发价值。本实验结合传统和现代微生物分类学方法,对1 株从土壤中分离获得的具有类胡萝卜素生产潜力的菌株进行鉴定,测定其生长特性和类胡萝卜素的稳定性,并优化其发酵培养基组成,旨在为采用发酵法生产类胡萝卜素提供菌种资源和工艺参考。
1.1.1 菌株
产色素菌株K-1由本实验室从土壤中分离纯化并保藏。
1.1.2 试剂
牛肉膏、蛋白胨、酵母粉、琼脂等试剂购自青岛海博生物技术有限公司,其他化学试剂均为分析纯;12.5%豆芽汁、牛板油等为自制。
1.1.3 培养基
麦芽汁琼脂培养基、明胶培养基、牛奶胨化培养基、产脂培养基等生理生化鉴定培养基的配制方法参考文献[11-12];YEPD培养基:酵母膏10 g/L,蛋白胨20 g/L,葡萄糖20 g/L,115 ℃灭菌15 min,固体培养基加2%琼脂粉,pH 6.0;基础培养基:葡萄糖30 g/L、蛋白胨5 g/L、KH2PO41 g/L、无水MgSO40.5 g/L、CaCl20.1 g/L、NaCl 0.1 g/L、pH 5.5;培养基121 ℃灭菌20 min。
CP114电子分析天平 美国奥豪斯公司;GI54T立式高压蒸汽灭菌锅 美国致微公司;SW-CJ-2FD洁净工作台 苏州安泰空气技术有限公司;UV-2800紫外-可见分光光度计 上海优尼柯公司;ZWYR-211D大容量恒温振荡摇床 上海智城分析仪器制造有限公司;DHG型电热恒温干燥箱 上海琅玕实验设备有限公司;研究级倒置荧光显微镜 德国Leika公司。
1.3.1 菌株的鉴定
1.3.1.1 菌株K-1的形态学及生理生化鉴定
参照文献[13]进行实验。
1.3.1.2 菌株K-1的分子生物学鉴定方法
参照文献[14]方法对菌株的DNA基因组进行提取,使用真菌核糖体ITS基因片段的通用引物ITS1(5’-TCCGTAGGTGAACCTGCGG-3’)和ITS4(5’-TCCTCCGCTTATTGATATGC-3’)进行聚合酶链式反应(polymerase chain reaction,PCR)扩增。PCR总体系为20 µL:2×Taq PCR StarMix 10 µL,上下游引物各取1 µL,DNA模板2 µL,ddH2O补至20 µL。PCR程序:94 ℃预变性5 min;94 ℃变性45 s,58 ℃退火45 s,72 ℃延伸2 min,共35 个循环;最后72 ℃延伸10 min。将扩增后的PCR产物进行琼脂糖凝胶电泳检测,切胶回收后进行测序。测序后将结果输入NCBI的GenBank数据库中,利用BLAST程序进行同源序列比较分析,采用MEGA 5.0软件中的Neighbor-Joining方法构建所测菌株的系统发育树,自展值为1 000 次。
1.3.2 类胡萝卜素的提取、定性及胞外稳定性测定
类胡萝卜素提取:菌体破壁处理采用改良过的酸热法[15-16],用丙酮作提取剂[17]。准确称量0.1 g冻干的菌体干粉,加入6 mL 3 mol/L HCl溶液,置于涡旋混合器上充分混匀10 min,沸水浴处理6 min,置于冰浴中速冷6 min,4 000 r/min离心15 min,弃去上清液后用蒸馏水洗涤菌体2 次,4 000 r/min离心15 min后去除上清液。向已破壁处理的菌体中加入6 mL丙酮,置于涡旋器上充分混合3 min,重复提取至菌体变白且无明显颜色变化,合并提取液,用丙酮定容后测定。
类胡萝卜素的定性:在取少量上述实验得到的丙酮浸提液置于平面皿中,放置数分钟适当滴加1滴浓硫酸,以丙酮作为空白对照,若变蓝色或蓝绿色,则可证明丙酮浸提液中含有类胡萝卜素。采用分光光度法将色素丙酮浸提液在380~800 nm波长下进行全波长扫描,确定最大吸收波长,并对该菌色素特征吸收峰进行光谱分析[18-19]。
类胡萝卜素提取液的稳定性测定:将类胡萝卜素的丙酮提取液置于系列温度梯度环境中30 min后,测定吸光度A486nm变化,考察温度对其稳定性的影响;将提取液置于0、2 600、6 400 lx光照强度下24 h后,测定其吸光度A486nm,考察光强度对其稳定性的影响;向类胡萝卜素丙酮提取液中分别加入0.1 mL 3% H2O2溶液、0.01%二丁基羟基甲苯(butylated hydroxytoluene,BHT)溶液,以丙酮浸提液为空白对照,置于室温下避光放置24 h后测定A486nm变化,考察氧化剂和抗氧化剂对其稳定性的影响。结果以吸光度下降率表示,按式(1)计算:
式中:Ai为起始A486nm;Ae为放置24 h后的A486nm。
1.3.3 培养基优化
1.3.3.1 种子液的制备及发酵条件
将菌种从斜面活化培养基中接入装有50 mL液体YEPD种子培养基的250 mL三角瓶中,28 ℃、150 r/min培养24 h后,再将其以10%的接种量接入装有50 mL液体YEPD培养基的三角瓶中,28 ℃、150 r/min培养12 h,将该培养液作为种子液用于接种发酵。
液态发酵条件均为装液量50 mL/250 mL三角瓶、接种量10%,摇床转速150 r/min,温度 (30±2)℃,培养基初始pH 5.5,培养5 d后,分离提取,测定菌体质量浓度和类胡萝卜素产量。
1.3.3.2 单因素试验
在基础培养基的基础上,分别考察葡萄糖、蔗糖、麦芽糖、甘油等碳源种类(添加量均为30 g/L)及葡萄糖质量浓度(20、30、40、50、60 g/L),酵母粉、蛋白胨、(NH4)2SO4等氮源种类(添加量均为5 g/L)及(NH4)2SO4质量浓度(5、10、15、20、25、30、40、50 g/L),K2HPO4·3H2O质量浓度(0、0.25、0.50、0.75、1.0、1.25 g/L),无水CaCl2质量浓度(0、1、2、3、4、5 g/L),柠檬酸三钠质量浓度(0、2.5、5.0、7.5、10、12.5 g/L)对菌株K-1生长及类胡萝卜素合成的影响,根据类胡萝卜素产量筛选影响显著的因素和水平,以便进一步采用正交试验优化培养基组成。
1.3.3.3 正交试验
在单因素试验的基础上,根据不同营养物质质量浓度对菌株K-1菌体和类胡萝卜素产量的综合影响,筛选影响较为显著的葡萄糖、(NH4)2SO4、无水CaCl2、柠檬酸三钠4 个影响因素,采用4因素3水平正交试验(表1)设计方案进一步优化培养基组成。
表1 L9(34)正交试验设计
Table 1 Code and level of independent variables used for L9(34) orthogonal array design g/L

水平D 柠檬酸三钠质量浓度1 20 20 2 5.0 2 30 25 3 7.5 3 40 30 4 10.0因素A 葡萄糖质量浓度B (NH4)2SO4质量浓度C无水CaCl2质量浓度
1.3.4 指标的测定
1.3.4.1 菌体质量浓度的测定
吸取4 mL发酵液加入已烘干称质量的5 mL离心管中,5 000 r/min离心10 min,弃去上清液后菌体沉淀物用蒸馏水洗涤,同样条件下离心后弃去上清液,含菌体的离心管在105 ℃烘干至恒质量,置于干燥器中冷却至室温后称质量,按式(2)计算菌体质量浓度:
式中:M1为带菌体管干质量/g;M为空管干质量/g;V为发酵液体积/mL。
1.3.4.2 类胡萝卜素产量的测定
向破壁菌体中加入6 mL丙酮后充分混合,重复提取至菌体变白,合并提取液,用丙酮定容后待测。提取液适当稀释后用比色法测定类胡萝卜素产量,测定波长为486 nm,根据文献[6,16-19]方法计算类胡萝卜素产量,计算见公式(3):
式中:A为类胡萝卜素最大吸收波长下的吸光度;D为样品稀释倍数;V为提取所用溶剂体积/mL;m为菌体干质量/g;0.16为类胡萝卜素消光系数/(L/mg)。
数据统计采用Excel 2010软件,显著性分析采用SPSS 19.0软件,正交试验设计采用正交设计助手II 3.1软件。数据以 ±s表示(n=3),P<0.05,差异显著。
2.1.1 形态学鉴定
在培养基中点植接种,15 d后能够形成直径约为(1.9±0.1)cm的菌落(图1A),菌落颜色由白色逐渐变为橙红色,表面光亮,有时呈现网状或缩成波状,质地软而呈黏状。培养基颜色未有明显变化,无渗出物形成,气味为特殊臭味。通过玉米粉琼脂培养基进行盖片培养,未观察到假菌丝。
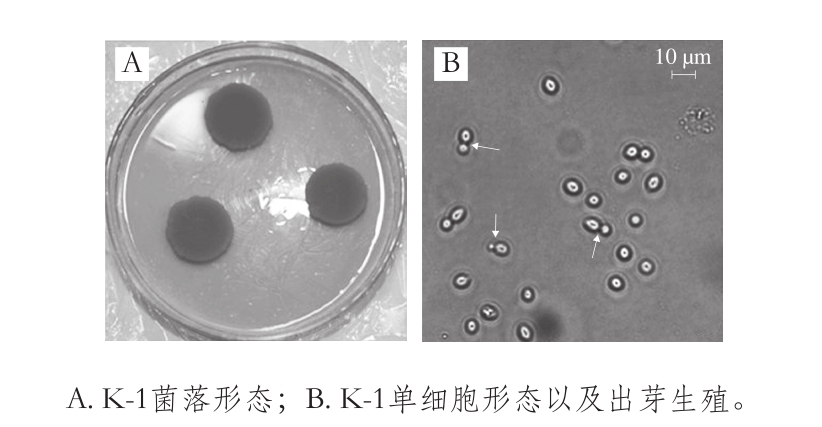
图1 菌株K-1的形态特征
Fig. 1 Morphological characteristics of strain K-1
在麦芽汁培养基中30 ℃培养3~5 d,细胞为短卵形,单个或者成对,细胞大小为3~6 μm,能形成完整环和沉淀,培养1 个月以上,菌体呈现深粉红色,可形成醭,菌体呈黏液状,为出芽生殖(图1B),不能形成子囊孢子和掷孢子。
2.1.2 生理生化鉴定
表2 菌株K-1的碳源同化测试结果
Table 2 Carbon source assimilation pattern of strain K-1

注:+.反应能同化;-.反应不能同化。
测试项目 结果 测试项目 结果 测试项目 结果葡萄糖 + D-半乳糖 + 甘油 +果糖 + 来苏糖 + 乙醇 -鼠李糖 + 麦芽糖 + 甘露醇 +D-核糖 + 蔗糖 + 肌醇 -海藻糖 + 甘露糖 + D-山梨醇 -木糖 + 乳糖 - 山梨酸 -D-阿拉伯糖 + 可溶性淀粉 - 苹果酸 +对氨基苯甲酸 - 柠檬酸 + 氨基乙酸 +
由表2可知,碳源同化实验结果显示,该菌株能利用葡萄糖、果糖等12 种糖,不能利用乳糖和可溶性淀粉,能利用甘油、甘露醇、柠檬酸、苹果酸、氨基乙酸,不能利用对氨基苯甲酸、乙醇、肌醇、山梨醇和山梨酸;氮源同化实验结果显示,该菌不能利用尿素,能利用硫酸铵、蛋白胨和酵母膏,能利用VB1和VB6;生理生化检测结果显示,该菌不能在无维生素的环境中生长,不能利用硝酸钾,5 g/L的亚硝酸钠对菌体有强的致死作用,可使牛奶发生胨化,不产芳香物质,不能使明胶液化,可在50%高渗培养基上生长。
2.1.3 分子生物学鉴定
由图2可知,目的基因PCR产物约为620 bp。将菌株K-1 ITS序列通过BLAST程序与GenBank数据库中现已报道的ITS基因序列进行相似性比对分析,构建的系统进化树如图3所示。结果显示,菌株K1与胶红酵母(Rhodotorula mucilaginosa)的相似性为99%,并结合菌株形态学、生理生化特性初步鉴定为胶红酵母。

图2 菌株K-1 PCR产物电泳图谱
Fig. 2 Electrophoresis pattern of PCR products of genomic DNA from strain K-1

图3 基于菌株K-1的ITS序列构建的系统发育树
Fig. 3 Phylogenetic tree of strain K-1 based on ITS sequences
2.2.1 色素定性
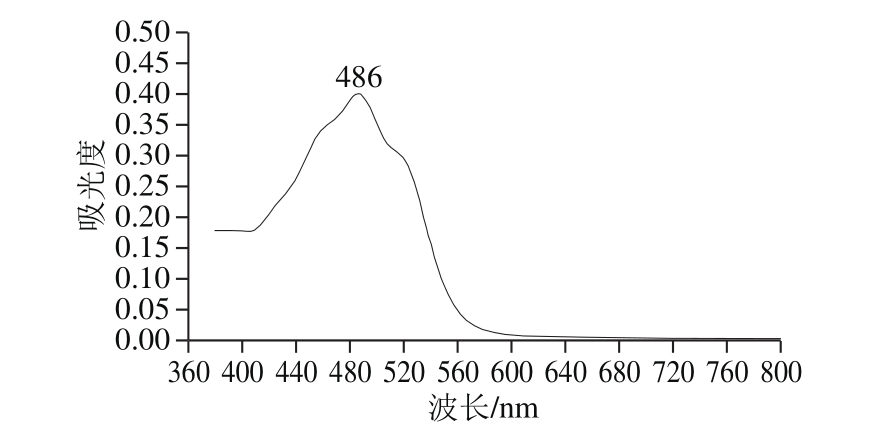
图4 胶红酵母K-1丙酮提取物的可见光波长扫描
Fig. 4 Visible absorption spectrum of the acetone extract from R. mucilaginosa K-1
将菌体丙酮提取液在380~800 nm波长下进行扫描。由图4可知,菌株K-1的丙酮提取液在486 nm波长处存在最大吸收峰,将此结果与Perrier等[20]在486 nm波长下不同类胡萝卜素特征吸收峰进行比对,初步确定该菌体K-1色素含有多种类胡萝卜素混合物。将此结果与Fraser等[21]的研究中胶红酵母CBS316主要的3 种类胡萝卜素的吸收光谱相比较,在484 nm波长处有最大吸收峰的色素为红酵母烯。其中对类胡萝卜素测定方法的描述中,确定其比色法检测时的波长为486 nm,该结果与菌株K-1的丙酮浸提液存在最大吸收峰的结果一致。
2.2.2 色素胞外稳定性结果

图5 胶红酵母K-1的色素稳定性测试结果
Fig. 5 Stability of the pigments from R. mucilaginosa K-1
将K-1菌体类胡萝卜素丙酮浸提液稀释至486 nm波长处的吸光度为0.426,分别放置在不同的温度、光照、氧化剂和还原剂的条件下测定计算A486nm下降率,考察其胞外稳定性,结果如图5所示。在20~100 ℃温度范围内将色素提取物处理30 min后,其A486nm随处理温度的升高而不断增大,在60、100 ℃下处理30 min后A486nm的下降率分别为13.62%和22.85%,说明低温处理有利于保护其稳定性,而高温具有破坏作用,由此也反映出该色素提取物具有较好的热稳定性。色素提取物在室温下放置24 h,光照强度为6 400 lx处理组的A486nm下降率最快,为56.42%,而2 600 lx光照强度处理组的下降率为34.19%,而0 lx对照组的下降率为12.75%,这一结果说明光照强度对K-1菌株产类胡萝卜素的胞外稳定性有显著影响,因此在保存时要尽量采取避光措施。
类胡萝卜素是一种抗氧化剂,其在生物体内能起到良好的抗氧化作用[22]。H2O2和BHT分别是常用的氧化剂和抗氧化剂,所以用这2 种物质对受试类胡萝卜素的胞外稳定性进行评价。与对照组相比,加入氧化剂H2O2的受试组吸光度下降率高于对照组,而添加BHT组吸光度较对照组低,这说明H2O2处理对K-1菌体所产类胡萝卜素的胞外稳定性影响较小,BHT能够保护和维持菌体类胡萝卜素的胞外稳定性。本实验有关胶红酵母色素耐热性、光照稳定性,以及氧化剂稳定性的研究结果总体趋势与韩永斌等[23]有关光合细菌类胡萝卜素稳定性研究的结果相似。
2.3.1 碳源种类的影响
碳源对微生物中含碳物质的合成至关重要,尤其在探讨影响类胡萝卜素合成的因素过程中,对碳源的研究最多[24]。酵母菌代谢行为也会因碳源的种类不同而改变。将基础培养基中的碳源设置为葡萄糖、蔗糖、甘油、麦芽糖4 种碳源进行碳源筛选实验。从表3得出,以葡萄糖为碳源时,菌体质量浓度(以干质量计,下同)、类胡萝卜素产量均较其他受试碳源高。蔗糖在菌体质量浓度和类胡萝卜素产量上略低于葡萄糖。麦芽糖和甘油的影响相当,菌体质量浓度和类胡萝卜素产量相对较低。因此,在后续实验中选用葡萄糖作为碳源。
表3 碳源对胶红酵母K-1类胡萝卜素产量的影响
Table 3 Effect of carbon sources on carotenoid yield of R. mucilaginosaK-1

注:同列不同小写字母表示存在显著性差异(P<0.05),下同。
碳源 菌体质量浓度/(g/L) 类胡萝卜素产量/(µg/g)葡萄糖 5.78±0.13a125.86±3.85a蔗糖 5.41±0.20a120.79±5.97a麦芽糖 4.26±0.16b86.42±6.31b甘油 4.63±0.09b84.69±2.55b
2.3.2 葡萄糖质量浓度的影响
表4 葡萄糖质量浓度对胶红酵母K-1类胡萝卜素产量的影响
Table 4 Effect of glucose concentrations on carotenoid yield of R. mucilaginosaK-1

葡萄糖质量浓度/(g/L)类胡萝卜素产量/(µg/g)20 8.92±0.13b154.22±5.18a30 10.07±0.17a155.36±4.91a40 10.17±0.18a152.08±4.02a50 10.06±0.11a151.11±4.89a60 10.37±0.13a146.81±6.17a菌体质量浓度/(g/L)
由表4可以得出,葡萄糖质量浓度30 g/L时类胡萝卜素产量最高,达到(155.36±4.91)µg/g;葡萄糖质量浓度60 g/L下菌体质量浓度最高;葡萄糖质量浓度在高于30 g/L时,随着质量浓度的增加类胡萝卜素产量呈现下降的趋势。这可能与菌体生长量的上升有关。由计算葡萄糖不同质量浓度培养基中的碳氮比发现,碳氮比在11~33范围内,类胡萝卜素产量之间无显著性差异,但随着碳氮比的提高,类胡萝卜素产量呈下降趋势。Aksu等[25]研究发现,在以葡萄糖、糖蜜蔗糖、乳清乳糖为碳源,以胶红酵母为菌种发酵产类胡萝卜素时,总体上随着糖浓度的增加,酵母的生长和类胡萝卜素产量也随之提高,当蔗糖质量浓度为20 g/L时,发酵液中类胡萝卜素的最高产量可达89.0 mg/L。因此,从促进菌体生长和积累合成类胡萝卜素,以及节约成本的角度考虑,应控制好培养基中葡萄糖的质量浓度。
2.3.3 氮源种类的影响
已有研究表明,氮源种类和浓度对红酵母产类胡萝卜素同样具有重要的影响[26-27]。从表5可以看出,在3 种氮源中,以酵母粉为氮源时,菌体质量浓度最高,类胡萝卜素产量较大;(NH4)2SO4组菌体生长量最小,但其类胡萝卜素产量最高,达到(147.16±2.27)µg/g。从类胡萝卜素的产量和生产成本综合考虑,(NH4)2SO4可作为该菌株发酵培养基的适宜氮源。
表5 氮源对胶红酵母K-1类胡萝卜素产量的影响
Table 5 Effect of nitrogen sources on carotenoid yield of R. mucilaginosaK-1

氮源 菌体质量浓度/(g/L) 类胡萝卜素产量/(µg/g)酵母粉 7.02±0.16a119.58±5.03b蛋白胨 6.09±0.20b120.86±3.27b(NH4)2SO44.93±0.06c147.16±2.27a
2.3.4 (NH4)2SO4质量浓度的影响
表6 (NH4)2SO4对胶红酵母K-1类胡萝卜素产量的影响
Table 6 Effect of (NH4)2SO4concentration on carotenoids yield of R. mucilaginosaK-1

(NH4)2SO4质量浓度/(g/L)菌体质量浓度/(g/L)类胡萝卜素产量/(µg/g)5 7.30±0.10f157.04±5.78b10 8.13±0.06e161.31±3.15ab15 9.22±0.11d160.32±1.58ab20 9.83±0.04bc160.75±3.41ab25 9.58±0.10c167.62±2.84a30 9.85±0.05bc166.09±2.00a40 10.00±0.08ab163.92±3.13a50 10.22±0.12a152.61±2.90b
从表6可以看出,随着(NH4)2SO4质量浓度的增加,菌体质量浓度也呈现增长趋势。40~50 g/L时菌体质量浓度最大;质量浓度25 g/L时菌体类胡萝卜素产量最大,达到(167.62±2.84)µg/g。
2.4.1 K2HPO4·3H2O质量浓度的影响
K2HPO4·3H2O为菌体的生长提供钾源和磷源,钾元素和磷元素是菌体生长必需的元素,K2HPO4·3H2O也能为稳定培养基的pH值起到微缓冲作用。唐棠等[28]在优化红酵母Y-5产类胡萝卜素培养基无机盐组分的研究时,从8 种无机盐中筛选出对提高类胡萝卜素产量具有显著效应的无机盐组分为KH2PO4、MgSO4和NaCl。由表7可以得出,在0.25~1.25 g/L的范围内,K2HPO4·3H2O对提高胶红酵母菌体质量浓度有着显著作用,当K2HPO4·3H2O质量浓度为0.25 g/L时,类胡萝卜素产量达到最大值(161.89±3.86)µg/g,且随着质量浓度的增加而降低。徐军等[27]在研究无机盐和碳氮源对青霉PT95类胡萝卜素产率的影响时也发现,供试的4 种无机盐中,K2HPO4的单因子效应最好,K2HPO4+KCl+MgSO4表现出最好的正协同效应。综上分析说明,磷源对于菌体产类胡萝卜素具有重要的影响。
表7 K2HPO4·3H2O对胶红酵母K-1类胡萝卜素产量的影响
Table 7 Effect of K2HPO4·3H2O concentration on carotenoids yield of R.mucilaginosaK-1

K2HPO4·3H2O质量浓度/(g/L)菌体质量浓度/(g/L)类胡萝卜素产量/(µg/g)0.00 6.98±0.04c156.60±3.50ab0.25 10.60±0.08a161.89±3.86a0.50 10.68±0.07a156.73±1.45ab0.75 10.62±0.10a155.76±0.23ab1.00 10.57±0.07a151.12±5.06bc1.25 9.80±0.13b142.12±2.60c
2.4.2 无水CaCl2质量浓度的影响
表8 无水CaCl2对胶红酵母K-1类胡萝卜素产量的影响
Table 8 Effect of CaCl2concentration on carotenoids yield of R. mucilaginosaK-1

无水CaCl2质量浓度/(g/L)菌体质量浓度/(g/L)类胡萝卜素产量/(µg/g)0 10.03±0.06b131.96±0.40c1 10.33±0.13ab134.86±1.47bc2 11.22±0.14a132.44±0.21c3 10.67±0.06ab139.95±0.46a4 10.63±0.10ab137.15±1.85ab5 10.26±0.12ab134.88±0.32bc
CaCl2主要为菌体提供Ca2+。Ca2+是维持菌体渗透压的重要离子,还是某些酶的辅因子,并能维持一些微生物蛋白酶的稳定性。由表8可知,当培养基中无水CaCl2质量浓度为3 g/L时,类胡萝卜素产量达到最大值(139.95±0.46)µg/g,在质量浓度2 g/L时,其菌体质量浓度达11.22 g/L。唐刚等[29]在研究间型脉孢菌产类胡萝卜素时发现,当培养基中添加了1.5 mg/L没食子酸和0.05 g/L植酸钙后,所培养菌丝中类胡萝卜素含量分别可达46.44 μg/g和54.03 μg/g,比对照分别提高了100%和133%。吕和鑫等[30]的研究也表明钙离子补料能提高杜氏盐藻细胞中类胡萝卜素产量。上述研究结果表明培养基中添加一定浓度的钙盐有利于菌体合成和积累类胡萝卜素。
2.4.3 柠檬酸三钠质量浓度的影响
柠檬酸既可作为部分微生物的碳源,也可以作为很好的细胞生长及代谢产物调节因子。廖春丽等[31]用三孢布拉霉(Blakeslea trispora)液体发酵产β-胡萝卜素时发现,柠檬酸浓度对产物β-胡萝卜素的产量影响显著。由表9可以看出,柠檬酸三钠质量浓度为2.5 g/L时,菌体质量浓度达到最大值,柠檬酸三钠质量浓度为7.5 g/L时,菌体类胡萝卜素产量最高可达(167.40±4.12)µg/g,但与5 g/L和10 g/L相比没有显著差异。本研究结果也显示柠檬酸盐对胶红酵母产类胡萝卜素具有促进作用。
表9 柠檬酸三钠对胶红酵母K-1类胡萝卜素产量的影响
Table 9 Effect of trisodium citrate concentration on carotenoids yield of R. mucilaginosaK-1

柠檬酸三钠质量浓度/(g/L)类胡萝卜素产量/(µg/g)0.0 7.15±0.09b141.87±4.80c2.5 8.87±0.12a149.95±7.02bc5.0 6.10±0.13cd167.34±19.69a7.5 6.02±0.12d167.40±4.12a10.0 6.37±0.06c166.49±13.05a12.5 5.98±0.08d154.56±9.24b菌体质量浓度/(g/L)
表10 L9(34)正交试验结果
Table 10 Experimental design and results of L9(34) orthogonal array

试验号 A葡萄糖质量浓度B (NH4)2SO4质量浓度C无水CaCl2质量浓度D柠檬酸三钠质量浓度类胡萝卜素产量/(µg/g)1 1 1 1 1 175.50±4.41 2 1 2 2 2 162.41±5.45 3 1 3 3 3 166.32±4.43 4 2 1 2 3 147.54±4.10 5 2 2 3 1 154.25±0.89 6 2 3 1 2 155.81±4.55 7 3 1 3 2 145.71±1.67 8 3 2 1 3 144.12±2.15 9 3 3 2 1 146.42±9.06 K1504.23 468.75 475.43 476.17 K2457.60 460.78 456.37 463.93 K3436.25 468.55 466.28 457.98极差 67.98 7.97 19.06 18.19最优组合 A1B1C1D1
从提高类胡萝卜素的发酵产量考虑,一方面应保证较高的菌体浓度,另一方面应尽量提高菌体中目标产物的量。根据单因素试验结果分析可知,碳源和氮源对菌体质量浓度的影响较为显著,而无水CaCl2和柠檬酸三钠对菌体细胞中类胡萝卜素产量的积累影响较为显著。因此,选择葡萄糖、(NH4)2SO4、无水CaCl2和柠檬酸三钠4 个对菌体质量浓度和色素产量影响较为显著的营养物质,设计4因素3水平正交试验,进一步优化发酵培养基组成。其他发酵条件同单因素试验条件,正交试验设计及结果如表10所示。
表11 正交试验结果方差分析
Table 11 Analysis of variance of the results from orthogonal array design
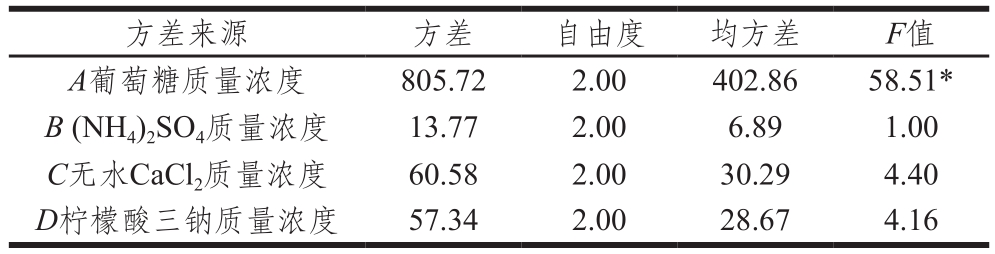
注:*.差异显著,P<0.05。
方差来源 方差 自由度 均方差 F值A葡萄糖质量浓度 805.72 2.00 402.86 58.51*B (NH4)2SO4质量浓度 13.77 2.00 6.89 1.00 C无水CaCl2质量浓度 60.58 2.00 30.29 4.40 D柠檬酸三钠质量浓度 57.34 2.00 28.67 4.16
由表10可知,影响类胡萝卜素产量的因素主次顺序为:葡萄糖质量浓度>无水CaCl2质量浓度>柠檬酸三钠质量浓度>(NH4)2SO4质量浓度;最优水平最佳组合为A1B1C1D1,即葡萄糖20 g/L,(NH4)2SO420g/L,无水CaCl22 g/L,柠檬酸三钠 5 g/L。在此基础上,对正交试验结果进行方差分析,见表11。结果表明:葡萄糖对类胡萝卜素产量的影响显著(P<0.05);而(NH4)2SO4、无水CaCl2和柠檬酸三钠对类胡萝卜素产量影响不显著(P>0.05)。对最优水平进行验证实验,类胡萝卜素产量为(180.14±2.45)µg/g。发酵培养基经优化后,类胡萝卜素产量比未优化前提高了43.13%。
在玉米粉琼脂、麦芽汁等培养基上对菌株K-1进行形态学鉴定;生理生化检测结果显示,该菌株能利用葡萄糖、果糖等12 种糖以及甘油、甘露醇、柠檬酸、苹果酸、氨基乙酸等物质可作为碳源,还能以(NH4)2SO4、蛋白胨和酵母膏等作为氮源,但不能利用KNO3,不产芳香物质,不能在无维生素的环境中生长,5 g/L的NaNO2对菌体有致死作用;将菌株K-1测序所得的ITS序列在NCBI数据库中进行比对,最终鉴定该菌株为R. mucilaginosa,即胶红酵母。
对菌体的丙酮提取液进行波长扫描,在486 nm波长处存在最大吸收峰,与已报道的红酵母烯的最大吸收峰相近,表明提取物中的主要成分可能为红酵母烯。
将胶红酵母K-1丙酮浸提液在不同温度、光照、氧化剂和还原剂条件下处理,考察其胞外稳定性,结果显示低温、避光处理有利于维持其稳定性,高温、强光照对其稳定性有破坏作用,H2O2处理对其胞外稳定性影响较小,BHT能够保护和维持其胞外稳定性。
选取碳源、氮源、无机盐种类及其质量浓度作为试验因素,类胡萝卜素产量作为衡量指标,结合单因素和正交试验优化了菌株K-1产类胡萝卜素的培养基组成,最终确定其优化的培养基组成为20 g/L葡萄糖、20 g/L(NH4)2SO4、2 g/L无水CaCl2、5 g/L柠檬酸三钠(培养温度30 ℃、接种量10%、摇床转速150 r/min、装瓶量50 mL/250 mL、初始pH 5.5、培养5 d),该优化条件下类胡萝卜素产量(干质量计)可达(180.14±2.45)µg/g,比未优化前的提高了43.13%。
研究表明,胶红酵母K-1生长性能良好、色素稳定性高,具有发酵高产类胡萝卜素的潜能。参考文献:
[1] SAINI R K, NILE S H, PARK S W. Carotenoids from fruits and vegetables: chemistry, analysis, occurrence, bioavailability and biological activities[J]. Food Research International, 2015, 76(Pt 3):735-750. DOI:10.1016/j.foodres.2015.07.047.
[2] RODRIGUEZ-AMAYA D B. Quantitative analysis in vitro assessment of bioavailability and antioxidant activity of food carotenoids: a review[J]. Journal of Food Composition & Analysis, 2010, 23(7): 726-740. DOI:10.1016/j.jfca.2010.03.008.
[3] 赵婷, 林孔亮, 惠伯棣. 微生物源类胡萝卜素研究进展[J]. 食品科学,2010, 31(23): 461-467.
[4] YOO A Y, ALNAEELI M, PARK J K. Production control and characterization of antibacterial carotenoids from the yeast Rhodotorula mucilaginosa AY-01[J]. Process Biochemistry, 2016,51(4): 463-473. DOI:10.1016/j.procbio.2016.01.008.
[5] 王强, 余晓斌. 三孢布拉霉发酵产番茄红素的研究进展[J].微生物学通报, 2015, 42(2): 420-426. DOI:10.13344/j.microbiol.china.140488.
[6] 魏娜, 徐琼, 张宁, 等. 掷孢酵母类胡萝卜素的提取与鉴定[J]. 食品科学, 2014, 35(19): 133-137. DOI:10.7506/spkx1002-6630-201419028.
[7] BUZZINI P, INNOCENTI M, TURCHETTI B, et al. Carotenoid profiles of yeasts belonging to the genera Rhodotorula,Rhodosporidium, Sporobolomyces, and Sporidiobolus[J]. Canadian Journal of Microbiology, 2007, 53(8): 1024-1031. DOI:10.1139/W07-068.
[8] 樊竹青, 李治滢, 董明华, 等. 云南抚仙湖产类胡萝卜素酵母菌的资源调查[J]. 微生物学通报, 2017, 44(2): 296-304. DOI:10.13344/j.microbiol.china.160078.
[9] CHAGAS A L, RIOS A O, JARENKOW A, et al. Production of carotenoids and lipids by Dunaliella tertiolecta using CO2from beer fermentation[J]. Process Biochemistry, 2015, 50(6): 981-988.DOI:10.1016/j.procbio.2015.03.012.
[10] HERNÁNDEZ-ALMANZA A, MONTAÑEZ-SÁENZ J,MARTÍNEZ-ÁVILA C, et al. Carotenoid production by Rhodotorula glutinis YB-252 in solid-state fermentation[J]. Food Bioscience, 2014,7: 31-36. DOI:10.1016/j.fbio.2014.04.001.
[11] 程丽娟, 薛泉宏. 微生物学实验技术[M]. 2版. 北京: 科学出版社, 2012.
[12] 沈萍, 陈向东. 微生物学实验[M]. 4版. 北京: 高等教育出版社, 2007.
[13] 魏景超. 真菌鉴定手册[M]. 上海: 上海科学技术出版社, 1979.
[14] 吴敏娜, 张惠文, 李新宇, 等. 提取北方土壤真菌DNA的一种方法[J].生态学杂志, 2007, 26(4): 611-616.
[15] 杨文, 吉春明. 一种简单的胞壁破碎方法[J]. 微生物学通报, 1995,22(1): 58-59.
[16] 唐棠. 红酵母Y-5菌株产类胡萝卜素发酵条件的研究[D]. 成都: 四川农业大学, 2011.
[17] 周鲜娇, 马家丽, 吴雪梅. 海洋红酵母色素不同提取方法的比较[J].食品工业科技, 2009, 30(3): 284-287.
[18] 李炎. 食品添加剂制备工艺[M]. 广州: 广东科技出版社, 2001.
[19] BRITTON G, LIAAEN-JENSEN S, PFANDER H. Functions of intact carotenoids[J]. Carotenoids, 2008(4): 189-212. DOI:10.1007/978-3-7643-7499-0_10.
[20] PERRIER V, DUBREUCQ E, GALZY P. Fatty acid and carotenoid composition of Rhodotorula strains[J]. Archives of Microbiology,1995, 164(3): 173-179. DOI:10.1007/s002030050251.
[21] FRASER P D, BRAMLEY P M. Methodologies for the analysis of fungal carotenoids[M]. Microbial Processes and Products Humana Press, 2005: 273-282.
[22] 任丹丹, 彭光华, 王海滨, 等. 菹草类胡萝卜素体外抗氧化活性的研究[J]. 食品科学, 2005, 26(3): 228-231. DOI:10.3321/j.issn:1002-6630.2005.03.059.
[23] 韩永斌, 刘桂玲, 陈德明, 等. 光合细菌类胡萝卜素的稳定性研究[J]. 食品科学, 2009, 30(3): 43-46. DOI:10.3321/j.issn:1002-6630.2009.03.008.
[24] 刘源, 李蕾蕾, 张涛, 等. 碳源对裂殖壶菌类胡萝卜素积累的影响[J]. 食品工业科技, 2016, 37(13): 148-151. DOI:10.13386/j.issn1002-0306.2016.13.021.
[25] AKSU Z, EREN A T. Carotenoids production by the yeast Rhodotorula mucilaginosa: use of agricultural wastes as a carbon source[J].Process Biochemistry, 2005, 40(9): 2985-2991. DOI:10.1016/j.procbio.2005.01.011.
[26] AKSU Z, EREN A T. Production of carotenoids by the isolated yeast of Rhodotorula glutinis[J]. Biochemical Engineering Journal, 2007,35(2): 107-113. DOI:10.1016/j.bej.2007.01.004.
[27] 徐军, 崔丽霞, 韩建荣. 无机盐和碳氮源对青霉PT95类胡萝卜素产率的影响[J]. 微生物学通报, 2003, 30(4): 77-81. DOI:10.3969/j.issn.0253-2654.2003.04.019.
[28] 唐棠, 黄乾明, 杨群峰. 红酵母Y-5产类胡萝卜素培养基无机盐组分的优化[J]. 食品科学, 2011, 32(3): 130-133.
[29] 唐刚, 陈育如, 刘友芬. 间型脉孢菌产类胡萝卜素研究[J]. 南京师范大学学报(工程技术版), 2009, 9(1): 73-77. DOI:10.3969/j.issn.1672-1292.2009.01.016.
[30] 吕和鑫, 贾士儒, 崔相敢, 等. 铁、钙离子补料对杜氏盐藻生长的影响[J]. 中国酿造, 2014, 33(11): 51-54. DOI:10.11882/j.issn.0254-5071.2014.11.011.
[31] 廖春丽, 余晓斌, 刘海丽. 响应面法优化β-胡萝卜素液体发酵培养基[J]. 食品与生物技术学报, 2007, 26(3): 95-99. DOI:10.3321/j.issn:1673-1689.2007.03.021.
Identification of a Carotenoid-Producing Strain and Optimization of Fermentation Medium