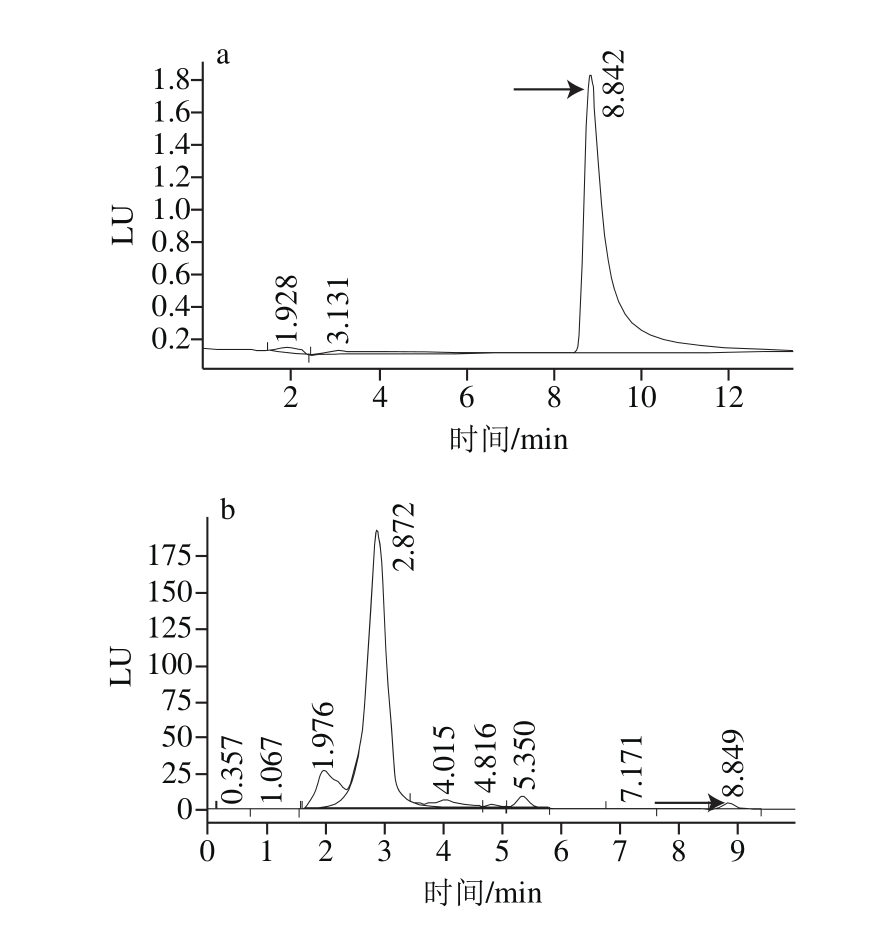
图1 CIT标准品(a)、菌株H1产物(b)高效液相色谱图
Fig. 1 HPLC chromatograms of CIT standard and sample from strain H1
桔青霉素(citrinin,CIT)是一种由青霉、曲霉、红曲霉属的某些菌株产生的对革兰氏阳性菌具有强烈抑菌效果的真菌次级代谢产物[1-2]。CIT是继黄曲霉毒素后又一个引起世界范围广泛关注的霉菌毒素,是食品和饲料的天然污染物,主要发生在储藏的谷物、玉米、小麦、大米、大麦和坚果中[3-4],且会与其他毒素共同存在。体内体外的大量研究已经证明CIT对人体和动物具有肾毒性[5]、胚胎毒性[6]、致畸性[7]、致癌性[8],还会破坏小鼠的生殖系统[9],导致动物机体消化系统紊乱,发生腹泻[10],是另一个除赭曲霉毒素A之外引起巴尔干地区肾病的潜在病原体[11]。此外,CIT可与其他真菌毒素如赭曲霉毒素、展青霉素等发生协同作用,增强对人畜的危害[12-13]。鉴于CIT污染广、毒性大的特点,人们对于CIT的关注度越来越高。
2000年日本率先规定了红曲色素中CIT的含量不能超过0.2 μg/g[14],欧盟要求CIT在红曲霉发酵大米中的限量标准为2 μg/g[15]。我国直到2008年才规定液态和固态红曲类产品中CIT限量标准分别为50 μg/L和1 μg/g,而对食品中CIT无限定指标。GB 5009. 222—2016《食品中桔青霉素的测定》中增加了大米、玉米、辣椒粉样品中CIT限量标准为25 μg/kg,大麦、燕麦、小麦中CIT不得超过10 μg/kg,红曲及其制品中CIT限量标准修改为80 μg/kg。然而对于水果及其制品中CIT的限量值仍未提及。
早在1931年,已有报道指出从桔青霉(Penicillium citrinum)的液体培养基中分离得到CIT[16]。后来发现曲霉属和红曲霉中也有大量的菌株能够积累CIT[17]。此外,CIT也是青霉属某些菌株的代谢产物,如黄绿青霉(Penicillium citreoviride)、点青霉(Penicillium notatum)等。青霉是导致水果腐烂的主要真菌,因此产生的次级代谢产物CIT对各种水果及其制品都有不同程度的污染[18-19]。Andersen等[20]从水果、果汁和谷物中分离得到260 株青霉,研究发现近85%的青霉能够产生CIT。Aziz等[21]检测了腐烂葡萄、苹果、梨等水果伤口处的CIT,发现CIT含量为280~920 μg/kg。Dietrich等[22]对超市中的几种果汁进行了CIT检测,结果表明果汁中也含有CIT,最高质量浓度达到20 μg/mL。尤其是柑橘果实,常常受到CIT的污染。CIT的污染基本上发生在柑橘采后贮藏期,受环境、收获年份及地理位置等的影响,CIT对柑橘的污染程度有所不同。对于水果中真菌毒素的研究,目前主要集中在葡萄及其制品中赭曲霉毒素,苹果及其制品中展青霉素等的研究,对于柑橘果实中的真菌毒素尤其是CIT的研究鲜有报道[23]。
鉴于CIT的毒性及在水果及其产品中的污染情况,本课题组在镇江江心洲果园的腐烂柑橘上筛选出1株产CIT的菌株H1,经鉴定为扩展青霉(Penicillium expansum),并进一步研究培养基、温度、pH值、溶氧量、培养时间等对菌株H1生长及产CIT能力的影响。该研究不仅为生产条件下规避柑橘CIT产毒条件、减少毒素产生的风险提供一定的依据,同时为控制CIT产毒方法的研究提供实验支撑,具有重要的现实意义。
本实验所用菌株H1采用平板划线法分离自江苏省镇江江心洲果园的腐烂柑橘果实。
CIT标准品 北京普华仕科技发展有限公司;甲醇、乙腈(均为色谱纯) 美国Sigma公司;甲苯、乙酸乙酯、甲酸、酵母浸膏、琼脂、蔗糖、葡萄糖、ZnSO4·7H2O、MnSO4·H2O、MgSO4·7H2O、FeSO4·7H2O、CaCl2、KH2PO4、K2HPO4、L-谷氨酸单钠国药集团化学试剂有限公司;核酸染色液、琼脂糖、TAE电泳缓冲液、聚合酶链式反应(polymerase chain reaction,PCR)Supermix(包含PCR缓冲液、dNTP、Taq酶等)、DNA提取试剂盒 生工生物工程(上海)股份有限公司;实验所用引物由生工生物工程(上海)股份有限公司合成。
1260高效液相色谱仪(配荧光检测器) 安捷伦科技有限公司;7300型基因扩增仪 美国ABI公司;ChemiDoc XRS型凝胶成像系统 美国Bio-Rad公司;DYY-12型电脑三恒多用电泳仪 北京六一公司;血球计数板 丹阳市健陵医疗器械公司;全自动高压灭菌锅上海三申医疗器械有限公司;LRH-250生化培养箱上海一恒科技有限公司;数码成像光学显微镜 江南光学仪器厂。
1.3.1 培养基和试剂的配制
马铃薯葡萄糖液体(potato dextrose broth,PDB)培养基:马铃薯200 g,加水煮沸20 min,过滤后往滤液中加入20 g葡萄糖,蒸馏水定容至1 L,121 ℃高压灭菌30 min。
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:在PDB培养基的基础上加入20 g琼脂,其余处理完全相同。
味精(MSG)培养基:ZnSO4·7H2O 0.01 g,MnSO4·H2O 0.03 g,MgSO4·7H2O 0.5 g,FeSO4·7H2O 0.01 g,CaCl20.1 g,KH2PO45 g,K2HPO45 g,L-谷氨酸单钠 5 g,葡萄糖20 g,加蒸馏水定容至1 000 mL,121 ℃高压灭菌20 min。
酵母浸膏蔗糖(YSM)培养基:酵母浸膏40 g,蔗糖160 g,加蒸馏水定容至1 000 mL,121 ℃高压灭菌20 min。
复合萃取剂:甲苯-乙酸乙酯-甲酸(7∶3∶1,V/V)。
CIT标准储备溶液:将1 mg CIT标准品溶于1 mL色谱级甲醇中,制成1 000 μg/mL的CIT标准储备溶液,保存在-20 ℃冰箱中。
1.3.2 分子生物学鉴定
首先使用DNA提取试剂盒提取菌株的DNA,然后用PCR仪扩增得到该菌的内转录间隔区(internal transcribed spacer,ITS)、BenA、CaM、PRB2序列,引物分别为ITS:ITS1(F):TCCGTAGGTGAACCTGCG和ITS4(R):TCCTCCGCTTATTGATATGC;BenA:Bt2a(F):GGTAACCAAATCGGTGCTGCTTTC和Bt2b(R):ACCCTCAGTGTAGTGACCCTTGGC;CaM:CMD5(F):CCGAGTACAAGGARGCCTTC和CMD6(R):CCGATRGAGGTCATRACGTGG;PRB2:5Feur(F):GAYGAYCGKGAYCAYTTCGG和7CReur(R):CCCATRGCYTGYTTRCCCAT。PCR扩增体系采用25 μL体系:超纯水6.5 µL、正反引物各2.5 µL、PCR Supermix 12.5 µL、待测菌DNA提取液1 µL。扩增程序:95 ℃预变性10 min,95 ℃变性1 min,54 ℃(根据引物选择合适的退火温度)退火1 min(或1 min 30 s),72 ℃延伸1 min,35 个循环,72 ℃延伸10 min,12 ℃保温。
PCR完成后,以1%的琼脂糖凝胶进行电泳分析,电泳程序:100 V,100 mA,30 min,PCR产物送生工生物工程(上海)有限公司进行测序。将菌株H1的ITS、BenA、PRB2、CaM序列与NCBI资料库中已有的序列作比对,测序结果使用Clustal W方法对齐,并用MEGA6.0进行聚类分析,以Neighbor-Joining分析方法构建系统发育进化树,从而确定菌株的亲缘关系及分类地位。
1.3.3 菌悬液的制备
将菌株H1接种于PDA培养基上活化,25 ℃培养7 d,用接种环挑取孢子至无菌生理盐水中,振荡混匀,用无菌枪头吸取菌悬液从盖玻片侧边滴于血球计数板上,吸掉盖玻片外多余液体,在10×40 倍显微镜下观察计算菌悬液的浓度,调整菌悬液孢子的浓度至1×106个/mL备用。研究环境条件对菌株生长和产毒的影响时吸取1 mL 1×106个/mL的孢子悬浮液至目标液体培养基中,每个实验做3 个平行3 组重复。
1.3.4 不同培养条件的确定及其菌丝干质量的测定
不同培养基:分别吸取1 mL 1×106个/mL的H1孢子悬浮液至装有50 mL目标培养基(PDB、YSM和MSG培养基)的250 mL三角瓶中,于25 ℃、130 r/min的恒温恒湿摇床中培养14 d,其他条件保持一致。结束培养后用纱布过滤,将菌丝球置于60 ℃烘箱中烘干至恒质量,称量菌丝干质量[24],每个实验做3 个平行3 组重复,用以检测培养基对H1生长的影响。
培养温度:分别选择4、15、20、25、30、35、40 ℃于130 r/min的恒温恒湿摇床中培养14 d,其他条件保持一致;pH值:通过添加HCl或NaOH将YSM培养基的pH值分别调节为3.0、5.0、7.0、9.0和11.0,25 ℃、130 r/min的恒温恒湿摇床中培养14 d,其他条件保持一致;溶氧量也会影响菌株的生长和产毒,将接种后的培养基分别放置于25 ℃培养箱静置和25 ℃、130 r/min摇床培养14 d,其他条件保持一致;培养时间选择1~5 周,每周测定1 次。
1.3.5 菌株CIT含量的测定
CIT提取参照Wang Shichao等[25]的方法,略作修改。
菌株H1使用上述不同的培养条件培养2 周后加入2 倍体积的提取液复合萃取剂,于60 ℃、130 r/min水浴摇床中振荡提取60 min,静置5 min,将上清液转入圆底烧瓶中40 ℃旋转蒸发至干,之后加入1 mL的色谱甲醇复溶,移液枪吸出至1.5 mL的EP管中,1 000 r/min离心10 min。上清液经0.22 μm有机滤膜过滤后,用注射器移入1.5 mL的进样瓶中,用配备荧光检测器的高效液相色谱仪检测。检测条件:荧光检测器检测波长:激发波长331 nm,发射波长500 nm;色谱柱:反相C18柱(250 mm×4.6 mm,5 μm);流动相:乙腈-水(用色谱纯磷酸调至pH 2.5)1∶1(V/V);流速:1.0 mL/min;柱温:28 ℃;进样量:20 μL。
实验进行3 次生物学重复,数据以 ±s表示。数据统计学分析采用SPSS 16.0软件的Student’s t检验或One-Way ANOVA的Tukey’s检验,P<0.05,差异显著。
经高效液相色谱测定可知,菌株H1代谢产物色谱图(图1b)中保留时间为8.849 min,和CIT标准品(图1a)的保留时间8.842 min接近,可能是由于菌株H1代谢产物中杂质较多,影响了保留时间。向H1产物样品中添加适宜浓度CIT标准品重新进行液相检测,该峰与CIT标准品峰完全重合,得出8.849 min处的物质为CIT。

图1 CIT标准品(a)、菌株H1产物(b)高效液相色谱图
Fig. 1 HPLC chromatograms of CIT standard and sample from strain H1
将菌株H1单点分别接种到PDA培养基和柑橘伤口处,25 ℃培养,其生长形态和菌落形态如图2所示,H1在PDA培养基上生长迅速,培养3 d和7 d菌落直径分别为20 mm和58 mm左右。菌丝起初为白色,约3 d后颜色逐渐转暗绿色,7 d左右转灰绿色,中心部位较突出,有放射状皱纹,无渗出液,质地绒状,外缘呈白色,近外缘处有淡黄色渗出物,背面呈肉桂色。H1接种在柑橘上腐烂直径较大,生长2 d后腐烂直径约为8.8 mm(伤口直径3 mm),说明该菌株会引起柑橘腐烂。在10×40 倍显微镜下可见分生梗无色,末端处有2 个左右的分枝,分枝上有许多呈放射状的小梗,分生孢子椭圆形,无色,呈链状。
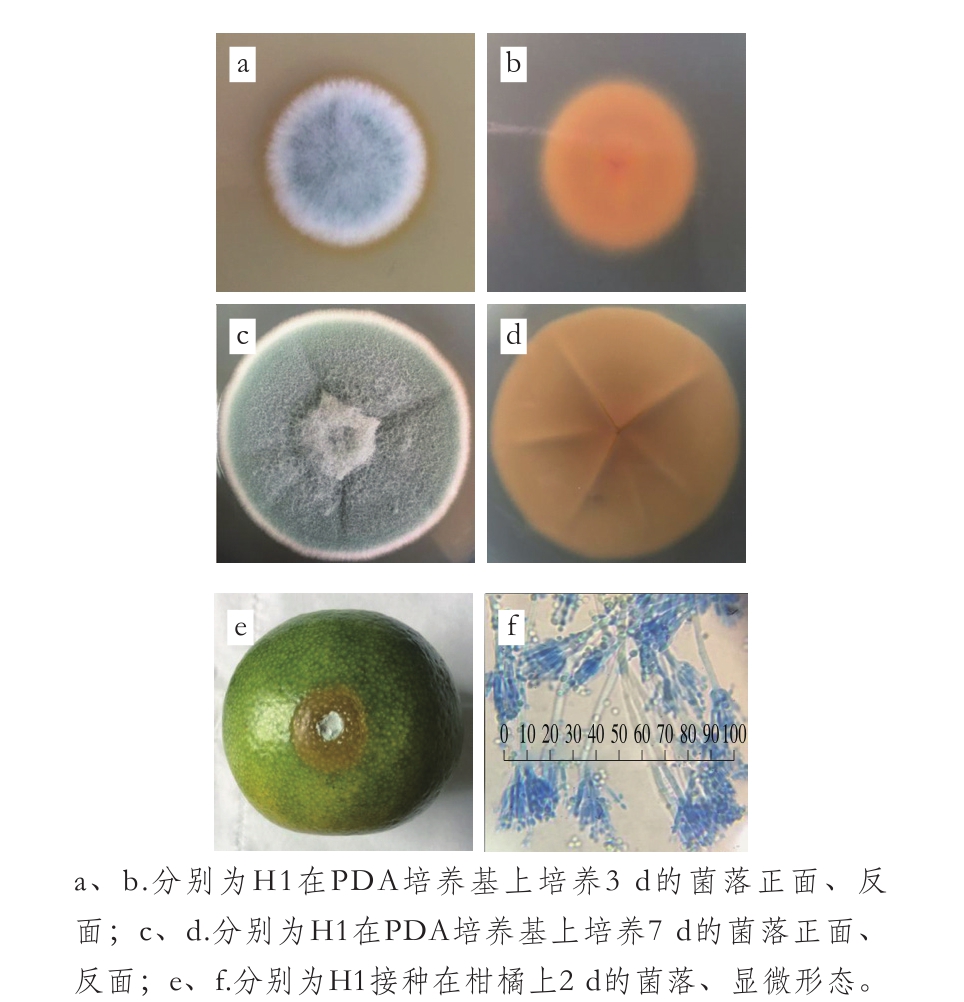
图2 菌株H1的菌落形态及显微形态
Fig. 2 Colony and microscopic morphology of strain H1
菌株H1的ITS、BenA、CaM、PRB2的PCR扩增产物经测序后的长度分别为540、451、519 bp和1 142 bp(图3),图4是以Neighbor-Joining分析方法基于ITS、BenA、CaM、PRB2序列构建的系统发育进化树,结合形态学结果,将菌株H1鉴定为扩展青霉(P. expansum)。

图3 菌株H1的PCR扩增产物的电泳结果Fig. 3 Electrophoresis of PCR amplification products of genomic DNA from strain H1 on 1% agarose gel
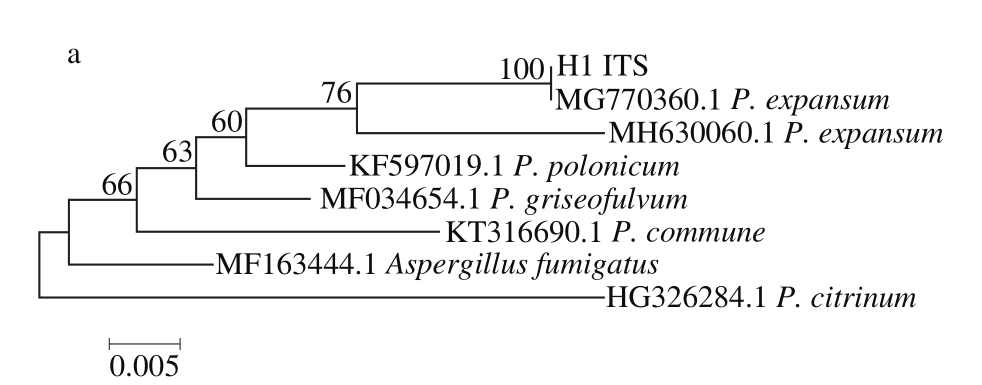

图4 菌株H1基于ITS(a)、BenA(b)、CaM(c)、PRB2(d)序列的系统发育树
Fig. 4 Phylogenetic tree obtained from Neighbor-Joining analysis of ITS (a),BenA (b), CaM (c), and RPB2 (d) sequences of strain H1

图5 培养基种类对菌株H1生长及产CIT的影响
Fig. 5 Effects of different media on mycelial growth and CIT production of strain H1
由图5可知,菌株H1在3 种培养基上均能生长和产毒,在YSM培养基上生长最旺盛,PDB培养基上生长状况与MSG培养基上接近。同时,从图5可以看出,菌株H1在YSM培养基上CIT产量也最高,达到1.2 μg/g以上,而PDB培养基上CIT产量最低,仅为0.3 μg/g。因此后续实验均选择YSM培养基用于菌株H1的产毒研究。已有研究发现,产CIT的红曲霉在有机氮含量丰富的培养基上生长和产毒能力都较高,尤其是在酵母浸膏中[26]。本研究培养菌株H1所用的YSM培养基中酵母浸膏的比例为4%,有机氮含量较为丰富,CIT产量最高,与上述研究结果一致。由于柑橘中氨基酸含量较为丰富,可以为P. expansum侵染柑橘提供较为丰富的氮源,更有利于P. expansum的生长和CIT的产生,所以在柑橘运输贮藏过程中应尽量减少其机械损伤,从源头阻止P. expansum侵染果实。
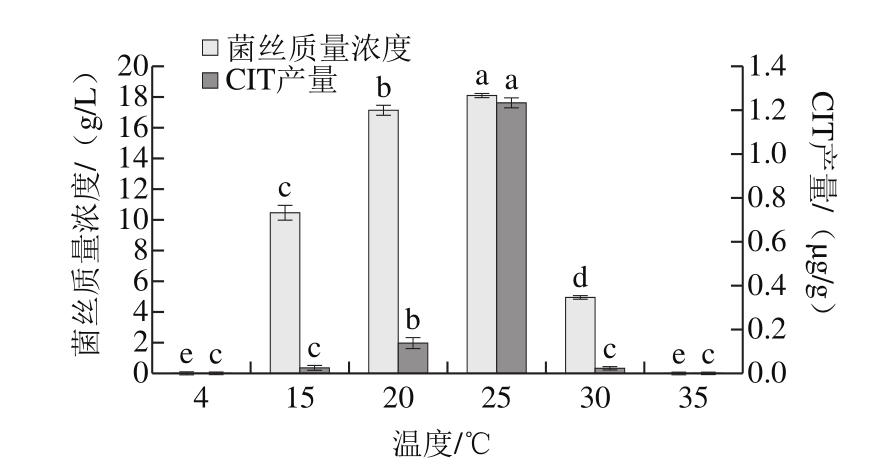
图6 温度对菌株H1生长及产CIT的影响
Fig. 6 Effects of culture temperature on mycelial growth and CIT production of strain H1
如图6所示,菌株H1在4 ℃和35 ℃时不生长,也检测不到CIT。15~25 ℃时,随着培养温度的升高,其菌丝质量浓度和产毒量均增加,至25 ℃时达到最大值。以上实验结果表明温度对菌株H1生长和产毒影响均较大,4 ℃的低温和35 ℃的高温均会抑制该菌株生长和产毒,因此在实验中可通过低温或偏高温度贮藏抑制H1的生长和产毒。
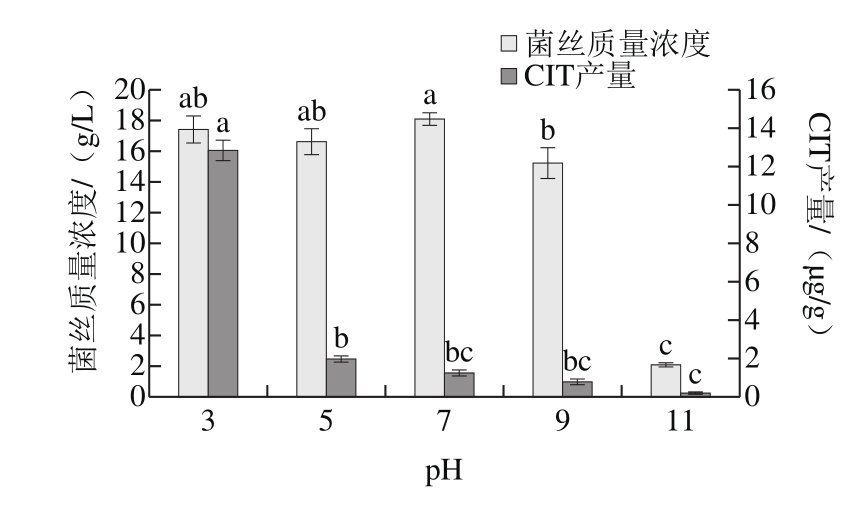
图7 pH值对菌株H1生长及产CIT的影响
Fig. 7 Effects of initial medium pH on mycelial growth and CIT production of strain H1
从图7可以看出,菌株H1在pH 3.0、5.0、7.0、9.0、11.0的培养基上均可生长,其中菌丝质量浓度最小的为碱性(pH 11)培养条件,为2 g/L左右,pH 3.0~9.0时菌丝质量浓度相当。说明其生长范围较为广泛,生存能力较强。同时,培养基的pH值对菌株产CIT的影响呈逐渐递减的变化趋势,在培养基pH 3.0时CIT产量最高,达到12.8 μg/g,之后产毒量依次降低,在培养基pH 11.0时,产物中几乎检测不到CIT,说明碱性环境能抑制毒素合成,与Sandra等[27]的研究结果一致,这为探究控制毒素方法提供了思路,有必要对其进行深入的研究。而Xiong Xu等[28]的研究发现,降低红曲发酵液的pH值至3.0以下时可以抑制CIT的产生。这可能是由于菌株H1系从柑橘腐烂伤口处筛选出来的,柑橘果肉偏酸性,宿主环境一定程度上影响了侵染菌株的特性。
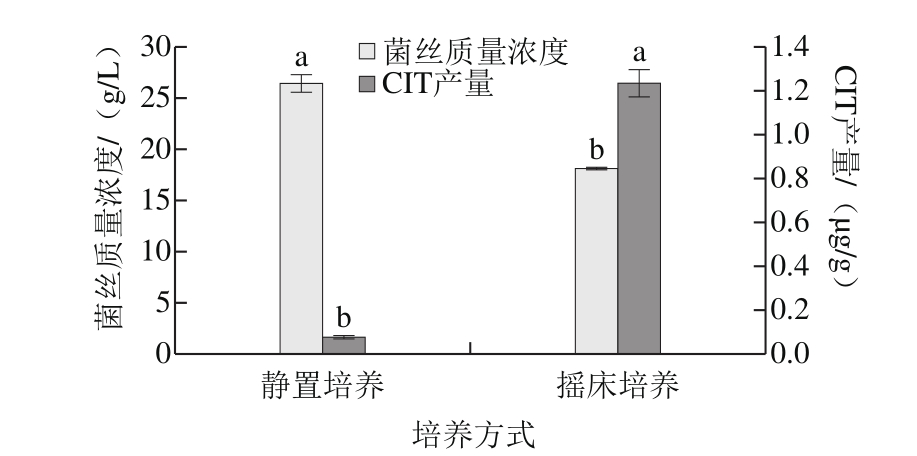
图8 溶氧量对菌株H1生长及产CIT的影响
Fig. 8 Effects of dissolved oxygen on mycelial growth and CIT production of strain H1
由图8可知,静置和摇床培养下菌株H1均可生长和产毒,H1在静置条件下菌丝生物量最高,与王静[29]的研究结果一致,可能是由于摇床培养下菌株会形成球状,占据的空间变大,生长受到抑制。但在溶氧量较高的摇床培养下CIT产量达到最大值,是静置条件下的12.13 倍,Hajjaj等[30]和Pereira[31]的研究也得到相同的结果,说明氧气对于桔霉素的合成具有促进作用。
由于柑橘及其制品的储运期往往比较长,在这期间菌丝生长和毒素产量是动态变化的,通过测定不同时期的培养基中菌丝生物量以及毒素积累量,了解菌株H1的生长状态和CIT在产毒菌中的代谢变化,有利于深入研究CIT在菌体中的合成与代谢。如图9所示,菌株H1培养1 周时已经开始产生CIT,第2~5周,随着时间的延长,CIT产量逐渐减少,第2周时CIT的积累量达到最高,CIT逐渐降低的原因可能是由于后期营养物质消耗殆尽,CIT被分解,参与其他代谢途径或保护菌体自身安全。不同菌株产生CIT的时间也有所不同,卢锦强等[32]发现红曲霉培养10 d后,其CIT积累量达到最高。
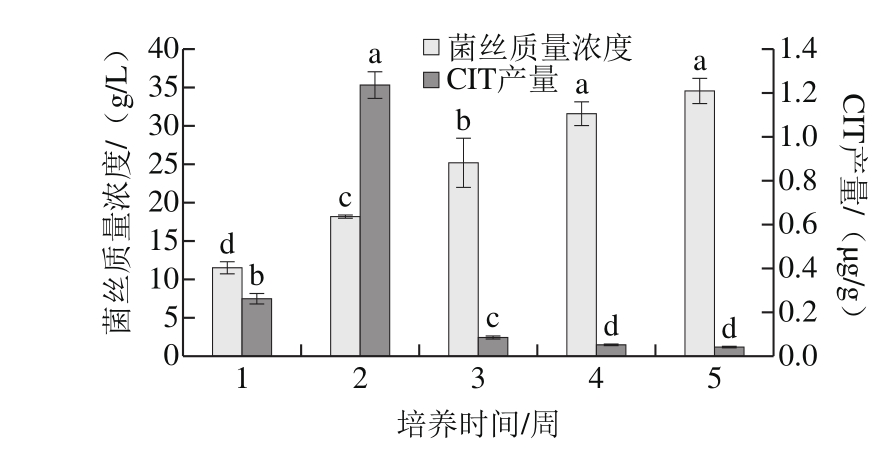
图9 培养时间对菌株H1生长及产CIT的影响
Fig. 9 Effects of culture time on mycelial growth and CIT production of strain H1
本实验从柑橘伤口处筛选的菌株H1经形态学和多基因序列分析鉴定为扩展青霉,利用高效液相色谱对其是否产CIT进行验证,并在体外研究培养基、温度、pH值、溶氧量和培养时间对H1生长和产CIT能力的影响可知,菌株H1在所选取的几种培养基上都可以生长和产毒,而YSM培养基最适合菌株生长和产毒;菌株H1的最适生长和产毒温度为25 ℃,在15~30 ℃之间均能生长和产毒,4 ℃的低温和35 ℃的高温均会抑制该菌株生长和产毒;菌株H1适宜生长的培养基pH值范围较宽,pH值对菌株生长的影响很小,H1的最适生长pH值为7.0,本研究中的菌株H1在培养基pH 3.0时产毒量达到峰值,在碱性环境中随着pH值升高,产毒量减小,但都处于较低水平;溶氧量对于菌株H1生长无显著影响,溶氧量较高的摇床培养下H1产毒能力较强,氧气对CIT的合成具有促进作用;菌株H1在培养的第1周开始产生毒素,第2周时达到最高,之后毒素产量降低。综上所述,菌株H1在pH 3的YSM培养基中25 ℃摇床培养生长较好,且生长2 周时毒素含量最高。通过实验表明,H1在低温下不生长,在非生长适宜温度环境或碱性环境、溶氧量低等条件下产毒受到抑制。因此在食品加工储存过程中应当应用这些特点以减少毒素产生,可以从根本上降低食品中CIT的污染。
[1] XU B J, JIA X Q, GU L J, et al. Review on the qualitative and quantitative analysis of the mycotoxin citrinin[J]. Food Control, 2006,17(4): 271-285. DOI:10.1016/j.foodcont.2004.10.012.
[2] BERTUZZI T, RASTELLI S, PIETRI A. Aspergillus and Penicillium toxins in chestnuts and derived products produced in Italy[J]. Food Control, 2015, 50: 876-880. DOI:10.1016/j.foodcont.2014.10.047.
[3] VLADIMIR O, FRANTISEK M, JIRI R. Producers and important dietary sources of ochratoxin A and citrinin[J]. Toxins, 2013, 5(9): 1574-1586. DOI:10.3390/toxins5091574.
[4] SAMSUDIN N I P, ABDULLAH N. A preliminary survey on the occurrence of mycotoxigenic fungi and mycotoxins contaminating red rice at consumer level in Selangor, Malaysia[J]. Mycotoxin Research,2013, 29(2): 89-96. DOI:10.1007/s12550-012-0154-7.
[5] WU T S, YANG J J, YU F Y, et al. Evaluation of nephrotoxic effects of mycotoxins, citrinin and patulin, on zebrafish (Danio rerio) embryos[J].Food & Chemical Toxicology, 2012, 50(12): 4398-4404. DOI:10.1016/j.fct.2012.07.040.
[6] KUMAR M, DWIVEDI P, SHARMA A K, et al. Apoptosis and lipid peroxidation in ochratoxin A- and citrinin-induced nephrotoxicity in rabbits[J]. Toxicology & Industrial Health, 2014, 30(1): 90-98.DOI:10.1177/0748233712452598.
[7] SINGH N D, SHARMA A K, PATIL R D, et al. Effect of feeding graded doses of citrinin on clinical and teratology in female Wistar rats[J]. Indian Journal of Experimental Biology, 2014, 52(2): 159-167.DOI:10.1007/BF01190639.
[8] ARAI M, HIBINO T. Tumorigenicity of citrinin in male F344 rats[J].Cancer Letters, 1983, 17(3): 281-287. DOI:10.1016/0304-3835(83)90165-9.
[9] HAN Q, YU L B, GUO Y Q, et al. Toxic effects of citrinin on the male reproductive system in mice[J]. Experimental & Toxicologic Pathology,2012, 64(5): 465-469. DOI:10.1016/j.etp.2010.10.015.
[10] ROSE M D. Scientific opinion on the risks for public and animal health related to the presence of citrinin in food and feed[J]. EFSA Journal,2012, 10(3): 2605-2687. DOI:10.2903/j.efsa.2012.2605.
[11] BOVDISOVA I, ZBYNOVSKA K, KALAFOVA A, et al. Toxicological properties of mycotoxin citrinin[J]. Journal of Microbiology Biotechnology & Food Sciences, 2016, 5: 10-13. DOI:10.15414/jmbfs.2016.5.special1.10-13.
[12] GAYATHRI L, DHIVYA R, DHANASEKARAN D, et al. Hepatotoxic effect of ochratoxin A and citrinin, alone and in combination, and protective effect of vitamin E: in vitro study in HepG2 cell[J]. Food &Chemical Toxicology, 2015, 83: 151-163. DOI:10.1016/j.fct.2015.06.009.[13] PAPP G, MÃTE G, MIKE N, et al. Regulation of the antioxidant system in cells of the fission yeast Schizosaccharomyces pombe after combined treatment with patulin and citrinin[J]. Toxicon, 2016, 111(23): 100-107.DOI:10.1016/j.toxicon.2015.12.021.
[14] AKIYAMA H. Regulation of food additives in Japan[J]. ACS Symposium,2014, 1162: 11-25. DOI:10.1021/bk-2014-1162.ch002.
[15] BOHM J, SAEGER S D, EDLERE L, et al. Scientific opinion on the risk for public and animal health related to the presence of sterigmatocystin in food and feed[J]. European Food Safety Authority Journal, 2012, 10(3):1-82. DOI:10.2903/j.efsa.2012.2605.
[16] HETHERINGTON A C, RAISTRICK H. On the production and chemical constitution of a new yellow colouring matter, citrinin,produced from glucose by Penicillium citrinum Thom[J]. Philosophical Transactions of the Royal Society of London, 1931, 220(2): 269-295.DOI:10.1098/rstb.1931.0025.
[17] BLANC P J, LORET M O, GOMA G. Production of citrinin by various species of Monascus[J]. Biotechnology Letters, 1995, 17(3):291-294. DOI:10.1007/BF01190639.
[18] RUAN C, DIAO X, LI N, et al. Determination of ochratoxin A and citrinin in fruits using ultrasound-assisted solvent extraction followed by dispersive liquid-liquid microextraction with HPLC with fluorescence detection[J]. Analytical Methods, 2016, 8(7): 1586-1594.DOI:10.1039/C5AY03219A.
[19] SÁNCHEZA P L, DE NIJSA M, SPANJERB M, et al. Generation of occurrence data on citrinin in food[J]. EFSA Supporting Publications,2017, 14(2): 1-47. DOI:10.2903/sp.efsa.2017.EN-1177.
[20] ANDERSEN B, SMEDSGAARD J, FRISVAD J C. Penicillium expansum: consistent production of patulin, chaetoglobosins, and other secondary metabolites in culture and their natural occurrence in fruit products[J]. Journal of Agricultural & Food Chemistry, 2004, 52(8):2421-2428. DOI:10.1021/jf035406k.
[21] AZIZ N H, MOUSSA L A A. Influence of gamma-radiation on mycotoxin producing moulds and mycotoxins in fruits[J]. Food Control, 2002,13(4/5): 281-288. DOI:10.1016/S0956-7135(02)00028-2.
[22] DIETRICH R, SCHMID A, MÄRTLBAUER E. Citrinin in fruit juices[J]. Mycotoxin Research, 2001, 17(2): 156-159. DOI:10.1007/BF03036426.
[23] 胡媛媛, 马良, 张宇昊. 柑橘果实中主要的真菌毒素及其检测技术[J]. 食品工业科技, 2013, 34(24): 385-391. DOI:10.13386/j.issn1002-0306.2013.24.090.
[24] HAJJAJ H, GOMA G, FRANCOIS J M. Effect of the cultivation mode on red pigments production from Monascus ruber[J]. International Journal of Food Science & Technology, 2015, 50(8): 1731-1736.DOI:10.1111/ijfs.12803.
[25] WANG S C, ZHAO S, MU H, et al. Effect of Lactococcus lactis subsp.on production of pigment and citrinin by Monascus[J]. Lecture Notes in Electrical Engineering, 2014, 251: 1591-1599. DOI:10.1007/978-3-642-37925-3_170.
[26] HAJJAJ H, FRANÇOIS J M, GOMA G, et al. Effect of amino acids on red pigments and citrinin production in Monascus ruber[J].Journal of Food Science, 2012, 77(3): 156-159. DOI:10.1111/j.1750-3841.2011.02579.x.
[27] SANDRA F, BILBAO O, BEATRIZ V K. Effect of pH on citrinin and red pigments production by Monascus purpureus CCT3802[J]. World Journal of Microbiology & Biotechnology, 2008, 24(2): 263-268.DOI:10.1007/s11274-007-9465-9.
[28] XIONG X, ZHANG X, WU Z, et al. Optimal selection of agricultural products to inhibit citrinin production during submerged culture of Monascus anka[J]. Biotechnology and Bioprocess Engineering, 2014,19(6): 1005-1013. DOI:10.1007/s12257-014-0419-4.
[29] 王静. 环境因子对红曲霉菌产桔霉素的影响[D]. 天津: 天津科技大学, 2011.
[30] HAJJAJ H, GOMA G, FRANÇOIS J M. Effect of the cultivation mode on red pigments production from Monascus ruber[J]. International Journal of Food Science & Technology, 2015, 50(8): 1731-1736.DOI:10.1111/ijfs.12803.
[31] PEREIRA D G T A. Effect of dissolved oxygen concentration on red pigment and citrinin production by Monascus purpureus ATCC 36928[J]. Brazilian Journal of Chemical Engineering, 2008, 25(2):247-253. DOI:10.1590/S0104-66322008000200004.
[32] 卢锦强, 童爱均, 赵超, 等. 8 株红曲菌生产特性研究[J]. 中国调味品, 2017, 42(2): 38-42. DOI:10.3969/j.issn.1000-9973.2017.02.009.
Identification of a Penicillium expansum Strain Producing Citrinin and Optimization of Culture Conditions for Citrinin Production