蔬菜及其制品中不同形态酚酸成分分析
高 媛1,王 蒙1,王 瑶1,吕晓玲2,冯晓元1,*
(1.北京农业质量标准与检测技术研究中心,农业部农产品质量安全风险评估实验室(北京),北京 100097;2.鄞州出入境检验检疫局,浙江 宁波 315192)
摘 要:采用超高效液相色谱-串联质谱法对10 种蔬菜及其制品,包括豇豆、西兰花、黄豆芽、茄子、番茄、黄瓜、菠菜、白菜、马铃薯和番茄酱中的游离型、游离酯型和结合型酚酸进行测定和分析。结果表明不同种类蔬菜酚酸含量差异较大,游离型酚酸以白菜中含量最高;游离酯型酚酸在豇豆中含量最高,其次是菠菜;结合型酚酸在菠菜中含量最高。主成分分析表明,对香豆酸是豇豆中的特征性物质,阿魏酸和异阿魏酸是菠菜区别于其他种类蔬菜的特征性组分,而芥子酸是白菜中的特征性物质。本研究可以为蔬菜中功能性成分的开发利用提供有益参考。
关键词:酚酸;蔬菜;特征性组分;超高效液相色谱-串联质谱法;主成分分析
蔬菜在我国居民膳食中的食物构成比高达33.7%[1]。大量流行病学研究显示,经常食用水果蔬菜可以有效降低多种疾病的发生率,果蔬中富含酚类物质是重要原因[2]。酚类物质具有抗氧化、抗炎、抗癌、提高免疫力等生物活性[3-4]。酚酸是酚类物质中的一类,约占植物源食品中酚类化合物的三分之一,多为苯甲酸和肉桂酸的羟化衍生物。研究表明酚酸还与采后运输、贮藏、诱导抗性及果实色泽和风味等品质指标密切相关[5-6]。水果、蔬菜、谷物、豆类等都是很好的酚酸来源[7-8]。酚酸的种类和含量因地理环境、气候条件、栽培措施、提取方法等的不同有所差异[9-10]。
酚酸存在形式复杂,有游离型、游离酯型和结合型(不可溶)3 种存在形式。其中,游离酯型和结合型酚酸多以酯键、醚键等与其他物质(包括纤维素、多肽、蛋白质、糖、有机酸等)相结合[11],需经水解释放出来才能被测定。不同植物中酚酸的种类和含量均有所不同。目前已有番茄[12]、马铃薯[9]、茄子[13]、胡萝卜[14]、白菜[15-16]、苦瓜[17]中酚酸含量的报道。其中,绿原酸是研究较为广泛的酚酸类物质之一,在番茄和马铃薯中含量丰富;此外,也有关于阿魏酸、咖啡酸、芥子酸、对香豆酸等的报道,但研究多集中于游离型酚酸。不同形态的酚酸在多种水果[18-19]、谷物麸皮[20]等中得到鉴定,但在蔬菜中关注较少,尤其对于游离酯型和结合型酚酸鲜见相关报道。游离酯型酚酸在体内外实验中均证明有较强的抗氧化活性[19,21],且研究表明酯型和结合型酚酸可以与细胞壁相结合,作用于消化道,经酶解释放出生物活性物质,可以预防结肠癌等慢性疾病[22]。因此,全面分析蔬菜中酚酸的分布、存在形式具有重要意义。
本研究利用超高效液相色谱-串联质谱法对10 种蔬菜及其制品,包括豇豆、西兰花、黄豆芽、茄子、番茄、黄瓜、菠菜、白菜、马铃薯和番茄酱中的游离型、游离酯型和结合型酚酸含量进行测定和分析,以期为蔬菜中酚酸类物质生物活性的研究提供数据支持与理论依据。
1 材料与方法
1.1 材料与试剂
10 种蔬菜,包括豇豆(Vigna unguiculata cylindrica)、西兰花(Brassica oleracea L. var. italic Planch.)、黄豆芽、茄子(Solanum melongena L.)、番茄(Lycopersicon esculentum Mill.)、黄瓜(Cucumis sativus L.)、菠菜(Spinacia oleracea L.)、白菜(Brassica pekinensis)、马铃薯(Solanum tuberosum)和番茄酱,均购自北京地区超市。样品采集日期为同一天(2017年9月15日),共选取了3 个代表性采样点,分别为果香四溢蔬菜市场、家乐福超市和沃尔玛超市,每个超市采集10 种蔬菜样品各1.5~2 kg,样品运输回实验室后,将3 份样品混合为一份样品。样品混合完成后,将非可食用部分除去,切成8~10 mm的小块,在液氮保护下研磨成粉末,-80 ℃保存备用。
酚酸标准品新绿原酸、绿原酸、没食子酸、4-羟基苯甲酸、咖啡酸、香草酸、丁香酸、对香豆酸、阿魏酸、芥子酸、异阿魏酸、鞣花酸、水杨酸和肉桂酸(纯度均大于97%) 美国Sigma-Aldrich公司;甲醇、甲酸、乙腈(均为色谱级) 美国Fisher公司;氢氧化钠、盐酸(均为分析纯) 北京化学试剂公司;水为超纯水。
1.2 仪器与设备
AcquityTM超高效液相色谱仪-TQS串联质谱仪、电喷雾离子源(electron spray ionization,ESI)接口 美国Waters公司;R-210旋转蒸发仪 瑞士Büchi公司;A11分析研磨机、KS260摇床 德国IKA公司;Milli-Q超纯水机 美国Mimpore公司;N-EVA-112P氮吹仪 美国Organomation公司;pHS-3C精密pH计 上海雷磁仪器厂;3-30k台式高速离心机 德国Sigma公司。
1.3 方法
1.3.1 色谱条件
Acquity HSS C18色谱柱(2.1 mm×150 mm,1.8 μm);柱温45 ℃;样品室温度10 ℃,进样体积5 μL;流动相A为0.1%甲酸溶液;流动相B为0.1%甲酸-乙腈溶液;梯度洗脱条件:初始流动相A为95%,保持0.5 min,4.5 min内降至70%,随后在4.5 min内降至10%,保持0.5 min后在0.5 min内升至95%,保持2.5 min;流速0.3 mL/min;总运行时间13 min。
1.3.2 质谱条件
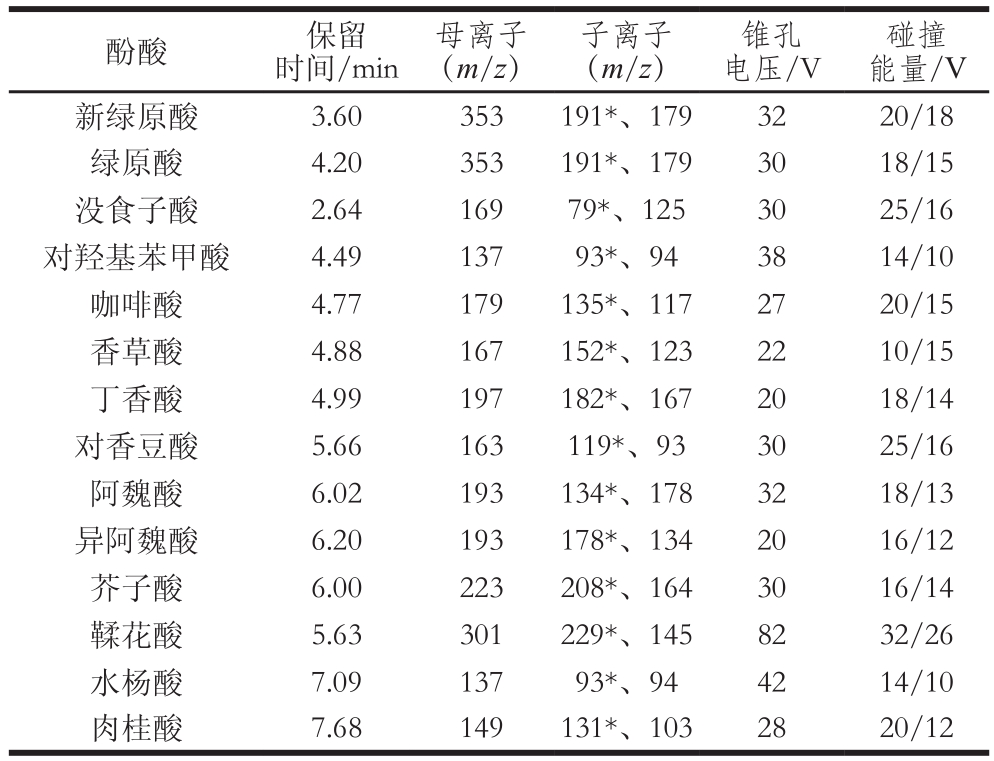
离子源模式采用正负离子模式(ESI+和ESI-);毛细管电压2.5 kV(ESI+)/-1.5 kV(ESI-);离子源温度150 ℃;脱溶剂气温度500 ℃;去溶剂气流量1 000 L/h;锥孔气流速150 L/h。采用多反应监测(multiple reaction monitoring,MRM)模式,14 种酚酸的MRM参数见表1。
表1 14 种酚酸的质谱参数
Table 1 MRM parameters for 14 phenolic acids
注:*.定量离子。
碰撞能量/V新绿原酸 3.60 353 191*、179 32 20/18绿原酸 4.20 353 191*、179 30 18/15没食子酸 2.64 169 79*、125 30 25/16对羟基苯甲酸 4.49 137 93*、94 38 14/10咖啡酸 4.77 179 135*、117 27 20/15香草酸 4.88 167 152*、123 22 10/15丁香酸 4.99 197 182*、167 20 18/14对香豆酸 5.66 163 119*、93 30 25/16阿魏酸 6.02 193 134*、178 32 18/13异阿魏酸 6.20 193 178*、134 20 16/12芥子酸 6.00 223 208*、164 30 16/14鞣花酸 5.63 301 229*、145 82 32/26水杨酸 7.09 137 93*、94 42 14/10肉桂酸 7.68 149 131*、103 28 20/12酚酸 保留时间/min母离子(m/z)子离子(m/z)锥孔电压/V
1.3.3 标准溶液的配制
分别称取14 种酚酸标准品各10 mg,配制成1 mg/mL的酚酸标准储备液,于-20 ℃保存。酚酸混合标准工作液采用梯度稀释法现用现配。
1.3.4 酚酸类物质的提取
1.3.4.1 游离型酚酸
参照本实验室前期优化的方法,作适当改动[23]。取10 g样品于50 mL离心管中,加入20 mL体积分数80%甲醇提取液(含1%盐酸),涡旋振荡10 s,室温条件下超声提取20 min,10 000 r/min离心5 min,将上清液转移至50 mL容量瓶。重复上述步骤1 次,合并上清液,定容至50 mL。混匀后过0.22 μm有机相滤膜,待上机。游离型酚酸含量以鲜质量计。
1.3.4.2 游离酯型酚酸
参考Li Li等[24]的方法并作适当修改。取10 g样品于50 mL离心管中,加入20 mL 80%甲醇提取液(含1%盐酸),涡旋,室温条件下超声提取20 min,10 000 r/min离心5 min,将上清液转移至100 mL鸡心瓶。重复上述步骤1 次,合并上清液,于旋转蒸发仪减压浓缩至15 mL以内。转移至100 mL离心管中,加入20 mL 4 mol/L NaOH溶液,充入N2,40 ℃气浴振荡避光水解2 h,之后用浓HCl溶液调节pH值至2,加入20 mL正己烷,室温振荡20 min,去除正己烷层。20 mL乙酸乙酯萃取2 次,合并萃取液,在旋转蒸发仪上35 ℃减压浓缩至尽干,用10 mL体积分数50%甲醇溶解,混匀过0.22 μm有机相滤膜,备用。该提取方法中,游离型和游离酯型酚酸均被乙酸乙酯萃取,因此游离酯型酚酸含量为检测结果减去1.3.4.1节中对应游离型酚酸的数据。游离酯型酚酸含量以鲜质量计。
1.3.4.3 结合型酚酸
取1.3.4.2节离心后剩余的残渣,加入20 mL 4 mol/L NaOH溶液,充入N2,40 ℃气浴振荡,避光水解2 h,浓HCl调节pH值至2。用20 mL乙酸乙酯萃取2 次,合并萃取液,于旋转蒸发仪上35 ℃减压浓缩至尽干,用10 mL体积分数50%甲醇溶液溶解,混匀过0.22 μm有机相滤膜,备用。结合型酚酸含量以鲜质量计。
1.3.5 定量分析
将1.3.3节中配制的混合标准品溶液,依次逐级稀释,配制成一系列质量浓度的混合标准工作液,按照测定条件进行分析。以峰面积与相应质量浓度进行线性回归,得到线性回归方程和相关系数。样品分析采用标准曲线法进行定量分析。
1.4 数据处理
不同蔬菜样品酚酸类物质主成分分析利用代谢组学数据分析网站(http://www.metaboanalyst.ca/)完成。
2 结果与分析
2.1 蔬菜及其制品中的游离型酚酸测定结果
表2 10 种蔬菜及其制品中游离型酚酸含量
Table 2 Free phenolic acid contents of ten vegetables and vegetable product mg/kg
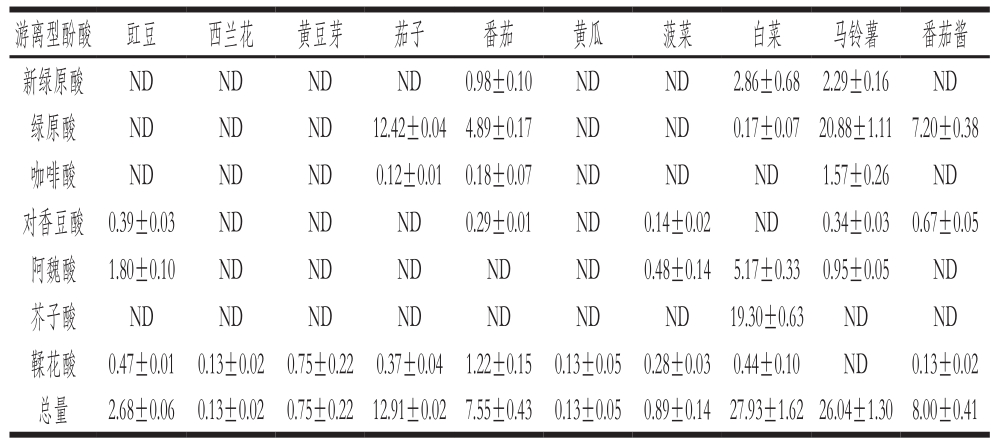
注:ND.低于检出限。下表同。
游离型酚酸 豇豆 西兰花 黄豆芽 茄子 番茄 黄瓜 菠菜 白菜 马铃薯 番茄酱新绿原酸 ND ND ND ND 0.98±0.10 ND ND 2.86±0.68 2.29±0.16 ND绿原酸 ND ND ND 12.42±0.044.89±0.17 ND ND 0.17±0.0720.88±1.117.20±0.38咖啡酸 ND ND ND 0.12±0.01 0.18±0.07 ND ND ND 1.57±0.26 ND对香豆酸 0.39±0.03 ND ND ND 0.29±0.01 ND 0.14±0.02 ND 0.34±0.03 0.67±0.05阿魏酸 1.80±0.10 ND ND ND ND ND 0.48±0.14 5.17±0.33 0.95±0.05 ND芥子酸 ND ND ND ND ND ND ND 19.30±0.63 ND ND鞣花酸 0.47±0.01 0.13±0.02 0.75±0.22 0.37±0.04 1.22±0.15 0.13±0.05 0.28±0.03 0.44±0.10 ND 0.13±0.02总量 2.68±0.06 0.13±0.02 0.75±0.2212.91±0.027.55±0.43 0.13±0.05 0.89±0.1427.93±1.6226.04±1.308.00±0.41
酚酸根据物质结构不同,可以分为羟基苯甲酸类和羟基肉桂酸类。如表2所示,共检出游离型酚酸7 种,均为羟基肉桂酸类,包括新绿原酸、绿原酸、咖啡酸、对香豆酸、阿魏酸、芥子酸和鞣花酸。除马铃薯外,鞣花酸在其他9 种蔬菜及其制品中均有检出,且对于游离型酚酸,西兰花、黄豆芽和黄瓜中,仅有鞣花酸检出。芥子酸仅在白菜中有检出,且含量较高(19.30 mg/kg),可占白菜中游离型酚酸总量的70%以上。新绿原酸仅在番茄、白菜和马铃薯中检测到。游离型酚酸总量在白菜中含量最高,其次为马铃薯。Seong等[16]测定了白菜不同部位的酚酸含量,结果表明芥子酸在酚酸总量中所占比例最大。马铃薯中游离型酚酸以绿原酸为主,含量与文献报道相符[9,25];其次为新绿原酸,其含量与Akyol等[9]报道相符,低于Furrer等[25]报道的含量,可能是由于检测方法不一致造成的[10]。茄子中也含有较高含量的绿原酸,研究表明酚酸含量可能会由于基因型、环境、地理因素、提取条件的不同而有所差异[10,12,26]。
2.2 蔬菜及其制品中的游离酯型酚酸测定结果
如表3所示,其中羟基苯甲酸类3 种,包括4-羟基苯甲酸、香草酸和丁香酸;羟基肉桂酸类6 种,包括咖啡酸、对香豆酸、阿魏酸、芥子酸、异阿魏酸和肉桂酸。结果表明,对于大部分蔬菜(除茄子、白菜、马铃薯外),游离酯型酚酸在3 种存在形式中含量最高,所占比例最大,这与文献[8,23]报道的结果一致。从种类上看,10 种蔬菜中均检测到4-羟基苯甲酸、对香豆酸和阿魏酸;且除黄豆芽和黄瓜外,其余8 种蔬菜也检测到异阿魏酸。从含量上看,豇豆中酚酸总量最高,其次是菠菜。豇豆、黄豆芽、茄子、黄瓜、菠菜中的游离酯型酚酸以对香豆酸为主,其中豇豆中的对香豆酸含量高于其他种类蔬菜,可占其游离酯型酚酸总量的80%左右。西兰花和马铃薯中则以阿魏酸所占比例最高。阿魏酸在植物中广泛存在,在植物细胞壁中主要与碳水化合物通过酯键相连,与木质素通过醚键相连,作为“桥梁”将木质素与碳水化合物连接在一起[25];研究表明阿魏酸在谷物、干豆及多种蔬菜中含量丰富[27]。10 种蔬菜中菠菜的阿魏酸含量最高(27.29 mg/kg),其次为西兰花(17.88 mg/kg),黄瓜中含量最低(0.31 mg/kg)。番茄和番茄酱中的游离酯型酚酸以咖啡酸含量最高,而白菜中芥子酸所占比例最大,且含量高于其他种类蔬菜。
表3 10 种蔬菜及其制品中游离酯型酚酸含量
Table 3 Conjugated phenolic acid contents of ten vegetables and vegetable products
mg/kg
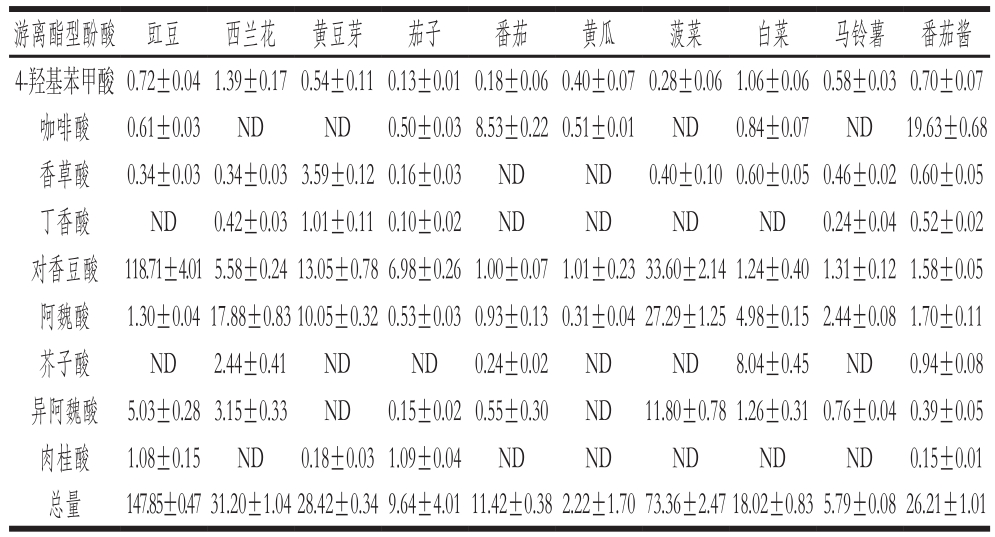
游离酯型酚酸 豇豆 西兰花 黄豆芽 茄子 番茄 黄瓜 菠菜 白菜 马铃薯 番茄酱4-羟基苯甲酸 0.72±0.041.39±0.170.54±0.110.13±0.010.18±0.060.40±0.070.28±0.061.06±0.060.58±0.030.70±0.07咖啡酸 0.61±0.03 ND ND 0.50±0.038.53±0.220.51±0.01 ND 0.84±0.07 ND 19.63±0.68香草酸 0.34±0.030.34±0.033.59±0.120.16±0.03 ND ND 0.40±0.100.60±0.050.46±0.020.60±0.05丁香酸 ND 0.42±0.031.01±0.110.10±0.02 ND ND ND ND 0.24±0.040.52±0.02对香豆酸 118.71±4.015.58±0.2413.05±0.786.98±0.261.00±0.071.01±0.2333.60±2.141.24±0.401.31±0.121.58±0.05阿魏酸 1.30±0.0417.88±0.8310.05±0.320.53±0.030.93±0.130.31±0.0427.29±1.254.98±0.152.44±0.081.70±0.11芥子酸 ND 2.44±0.41 ND ND 0.24±0.02 ND ND 8.04±0.45 ND 0.94±0.08异阿魏酸 5.03±0.283.15±0.33 ND 0.15±0.020.55±0.30 ND 11.80±0.781.26±0.310.76±0.040.39±0.05肉桂酸 1.08±0.15 ND 0.18±0.031.09±0.04 ND ND ND ND ND 0.15±0.01总量 147.85±0.4731.20±1.0428.42±0.349.64±4.0111.42±0.382.22±1.7073.36±2.4718.02±0.835.79±0.0826.21±1.01
游离酯型酚酸是一种可通过甲醇溶液直接提取的可溶性成分,但与可溶性糖、多肽等通过酯键或者醚键相连,需通过水解才能释放出来[28-29]。有研究表明,绝大多数的酚酸在碱性条件下更容易水解,而酸性条件则不利于酚酸的释放[8,19]。不同形态的酚酸在蜜橘[18]、谷物麸皮[20]等中得到分析,但在蔬菜中对于不同形态酚酸的测定鲜见报道。传统的分析方法通过直接提取分析,只能得到游离型酚酸,导致实验结果不全面[30-31]。蔬菜中的酚酸多以酯化形式存在[8],更加全面的测定方法能更好地解释其抗氧化特性及营养价值。
2.3 蔬菜及其制品中的结合型酚酸测定结果
结合型酚酸与细胞壁多糖、木质素通过酯键或醚键相连,不能直接被甲醇溶液提取,是不可溶性酚酸,在碱性条件下水解可释放出来。如表4所示,10 种蔬菜及制品中共检出结合型酚酸8 种,其中羟基苯甲酸类3 种,包括4-羟基苯甲酸、香草酸和丁香酸;羟基肉桂酸类5 种,包括咖啡酸、对香豆酸、阿魏酸、芥子酸和异阿魏酸。10 种蔬菜中均检测到阿魏酸,但含量差异较大,菠菜中结合型阿魏酸含量(10.17 mg/kg)远高于其他种类蔬菜,此外阿魏酸也是白菜和马铃薯中检出的唯一一种结合型酚酸。除白菜和马铃薯外其他8 种蔬菜中均有对香豆酸检出。咖啡酸仅在豇豆和茄子中有检出;香草酸和丁香酸仅在黄豆芽中检出,10 种蔬菜及制品中,芥子酸仅存在于西兰花中;异阿魏酸在菠菜中有较高的含量,在豇豆和西兰花中也有少量检出。结合型酚酸总量在菠菜中含量最高(20.32 mg/kg),马铃薯和白菜中含量较低。阿魏酸是菠菜中最主要的结合型酚酸,约占结合型酚酸总量的50%,其次为异阿魏酸(8.66 mg/kg)。目前鲜见以上10 种蔬菜中结合型酚酸含量的文献报道。游离酯型酚酸和结合型酚酸在植物抗氧化性作用中发挥重要作用[28,32],因此,全面分析酚酸的含量及存在形式,可为其生物活性包括对健康的影响等提供更加科学和系统的评估。
表4 10 种蔬菜及其制品中结合型酚酸含量
Table 4 Bound phenolic acid contents of ten vegetables and vegetable products mg/kg

结合型酚酸 豇豆 西兰花 黄豆芽 茄子 番茄 黄瓜 菠菜 白菜 马铃薯 番茄酱4-羟基苯甲酸 0.51±0.02 ND 0.35±0.03 ND ND ND ND ND ND ND咖啡酸 0.48±0.13 ND ND 1.53±0.10 ND ND ND ND ND ND香草酸 ND ND 1.88±0.20 ND ND ND ND ND ND ND丁香酸 ND ND 2.83±0.40 ND ND ND ND ND ND ND对香豆酸 0.91±0.070.12±0.010.62±0.055.06±0.071.59±0.201.34±2.301.49±0.18 ND ND 0.65±0.01阿魏酸 0.77±0.032.43±0.070.55±0.050.35±0.040.11±0.010.11±0.0310.17±0.620.21±0.110.13±0.000.44±0.02芥子酸 ND 1.32±0.04 ND ND ND ND ND ND ND ND异阿魏酸 0.45±0.000.40±0.02 ND ND ND ND 8.66±0.34 ND ND ND总量 3.11±0.084.27±0.146.23±0.656.94±0.201.70±0.211.46±2.3220.32±0.850.21±0.110.13±0.001.09±0.12
2.4 主成分分析
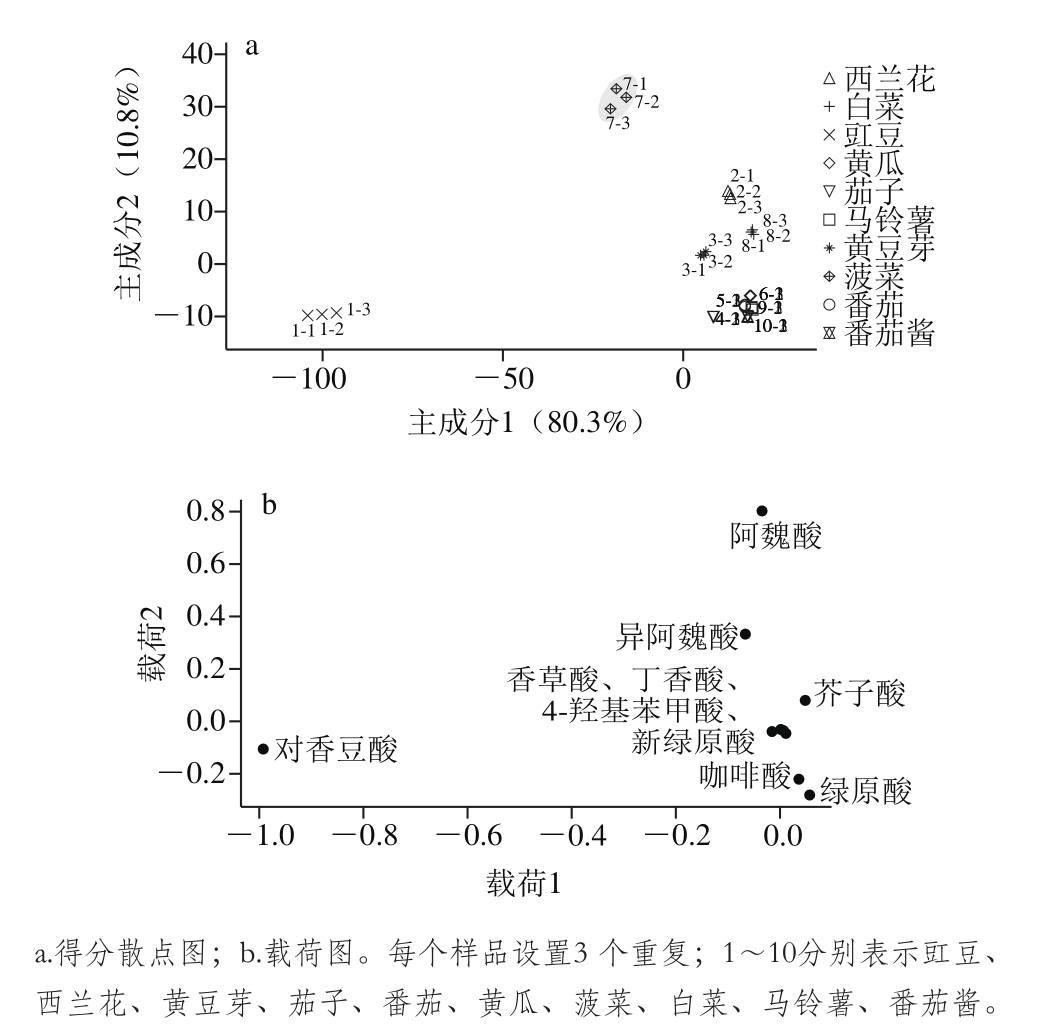
图1反映了不同种类蔬菜与酚酸类物质之间的对应关系。从图1a可以看出,大部分蔬菜样品可以较好地区分开。前2 个主成分解释了总方差的91.1%,其中第1主成分占总方差的80.3%,除豇豆和菠菜外,其他蔬菜样品分布在第1主成分的正半轴。第2主成分占总变量的10.8%,除菠菜、西兰花、白菜和黄豆芽外,其他样品分布在第2主成分的负半轴。从图1b可以看出,酚酸类物质处于横坐标负半轴的居多。其中,茄子、番茄、马铃薯和番茄酱在得分散点图中距离较近,表明酚酸差异相对较小,结合载荷图发现,与其他蔬菜相比,绿原酸和咖啡酸含量相对较高。豇豆位于第1主成分的负半轴,且与其他样品距离较远,结合载荷图,其对香豆酸含量远高于其他种类蔬菜,是区别于其他样品的特征性物质;而阿魏酸和异阿魏酸是菠菜的特征性组分;西兰花中也含有较高含量的阿魏酸;芥子酸是白菜中的特征性物质。
3 结 论
本实验采用UPLC-MS/MS对10 种蔬菜及制品中不同形态酚酸(包括游离型、游离酯型和结合型)进行测定,结果表明不同蔬菜样品间酚酸种类和含量差异很大。白菜中游离型酚酸总量最高;游离酯型酚酸以豇豆中含量最高,其次为菠菜;结合型酚酸在菠菜中含量最高。主成分分析结果表明,对香豆酸是豇豆区别于其他种类蔬菜的特征性物质,芥子酸在白菜中有较高的含量,而阿魏酸和异阿魏酸是菠菜的特征性组分。本研究可为果蔬不同形态酚酸组分的鉴定及功能性产品的开发利用提供一定的参考价值。
参考文献:
[1] 侯媛媛. 我国蔬菜供需平衡研究[D]. 杨凌: 西北农林科技大学, 2012.
[2] LIU X, LV K. Cruciferous vegetables intake is inversely associated with risk of breast cancer: a meta-analysis[J]. Breast, 2013, 22(3): 309-313.DOI:10.1016/j.breast.2012.07.013.
[3] GONZÁLEZ S, FERNÁNDEZ M, CUERVO A, et al. Dietary intake of polyphenols and major food sources in an institutionalised elderly population[J]. Journal of Human Nutrition and Dietetics, 2014, 27(2):176-183. DOI:10.1111/jhn.12058.
[4] YU X, JIAO W, CAO J, et al. Effects of chlorogenic acid on capacity of free radicals scavenging and proteomic changes in postharvest fruit of nectarine[J]. PLoS ONE, 2017, 12(8): e0182494. DOI:10.1371/journal.pone.0182494.
[5] ROMANAZZI G, SANZANI S M, BI Y, et al. Induced resistance to control postharvest decay of fruit and vegetables[J]. Postharvest Biology and Technology, 2016, 122: 82-94. DOI:10.1016/j.postharvbio.2016.08.003.
[6] DUIZER L M, LANGFRIED A. Sensory characterizarion during repeated ingestion of small molecular weight phenolic acids[J]. Journal of the Science of Food and Agriculture, 2016, 96(2): 513-521. DOI:10.1002/jsfa.7118.
[7] MATTILA P, HELLSTRÖM J, TÖRRÖNEN R. Phenolic acids in berries, fruits, and beverages[J]. Journal of Agricultural and Food Chemistry, 2006, 54(19): 7193-7199. DOI:10.1021/jf0615247.
[8] CHEN P X, TANG Y, MARCONE M F, et al. Characterization of free, conjugated and bound phenolics and lipophilic antioxidants in regular- and non-darkening cranberry beans (Phaseolus vulgaris L.)[J].Food Chemistry, 2015, 185: 298-308. DOI:10.1016/j.foodchem.2015.03.100.
[9] AKYOL H, RICIPUTI Y, CAPANOGLU E, et al. Phenolic compounds in the potato and its byproducts: an overview[J]. International Journal of Molecular Sciences, 2016, 17(6): 835. DOI:10.3390/ijms17060835.
[10] MICHIELS J A, KEVERS C, PINCEMAIL J, et al. Extraction conditions can greatly influence antioxidant capacity assays in plant food matrices[J]. Food Chemistry, 2012, 130(4): 986-993. DOI:10.1016/j.foodchem.2011.07.117.
[11] ROBBINS R J. Phenolic acids in foods: an overview of analytical methodology[J]. Journal of Agricultural and Food Chemistry, 2003,51(10): 2866-2887. DOI:10.1021/jf026182t.
[12] KAUSHIK P, ANDÚJAR I, VILANOVA S, et al. Breeding vegetables with increased content in bioactive phenolic acids[J]. Molecules, 2015,20(10): 18464-18481.
[13] KACHAN M N, MIKULIČ-PETKOVŠEK M, ŠTAMPAR F. Grafting influences phenolic profile and carpometric traits of fruits of greenhousegrown eggplant (Solanum melongena L.)[J]. Journal of Agricultural and Food Chemistry, 2014, 62(43): 10504-10514. DOI:10.3390/molecules201018464.
[14] SUN T, SIMON P W, TANUMIHARDJO S A. Antioxidant phytochemicals and antioxidant capacity of biofortified carrots (Daucus carota L.) of various colors[J]. Journal of Agricultural and Food Chemistry, 2009, 57(10): 4142-4147. DOI:10.1021/jf9001044.
[15] KIM Y J, KIM Y B, LI X, et al. Accumulation of phenylpropanoids by white, blue, and red light irradiation and their organ-specific distribution in Chinese cabbage (Brassica rapa ssp. pekinensis)[J].Journal of Agricultural and Food Chemistry, 2015, 63(30): 6772-6778.DOI:10.1021/acs.jafc.5b02086.
[16] SEONG G U, HWANG I W, CHUNG S K. Antioxidant capacities and polyphenolics of Chinese cabbage (Brassica rapa L. ssp. pekinensis)leaves[J]. Food Chemistry, 2016, 199: 612-618. DOI:10.1016/j.foodchem.2015.12.066.
[17] CHOI J S, KIM H Y, SEO W T, et al. Roasting enhances antioxidant effect of bitter melon (Momordica charantia L.) increasing in flavan-3-ol and phenolic acid contents[J]. Food Science and Biotechnology, 2012,21(1): 19-26. DOI:10.1007/s10068-012-0003-7.
[18] 徐贵华, 关荣发, 叶兴乾, 等. 不同成熟期蜜桔中酚酸的组成与分布[J]. 食品科学, 2008, 29(2): 137-141. DOI:10.3321/j.issn:1002-6630.2008.02.023.
[19] WANG M, JIANG N, WANG Y, et al. Characterization of phenolic compounds from early and late ripening sweet cherries and their antioxidant and antifungal activities[J]. Journal of Agricultural and Food Chemistry, 2017, 65(26): 5413-5420. DOI:10.1021/acs.jafc.7b01409.
[20] 郝杰, 张长虹, 曹学丽. 七种谷物麸皮中的酚酸类成分分析[J]. 食品科学, 2010, 31(10): 263-267.
[21] SATO Y, ITAGAKI S, KUROKAWA T, et al. In vitro and in vivo antioxidant properties of chlorogenic acid and caffeic acid[J].International Journal of Pharmaceutics, 2011, 403(1/2): 136-138.DOI:10.1016/j.ijpharm.2010.09.035.
[22] SAURA-CALIXTO F. Dietary fiber as a carrier of dietary antioxidants:an essential physiological function[J]. Journal of Agricultural and Food Chemistry, 2011, 59(1): 43-49. DOI:10.1021/jf1036596.
[23] GAO Y, MA S, WANG M, et al. Characterization of free, conjugated,and bound phenolic acids in seven commonly consumed vegetables[J].Molecules, 2017, 22(11): 1878. DOI:10.3390/molecules22111878.
[24] LI L, SHEWRY P R, WARD J L. Phenolic acids in wheat varieties in the HEALTHGRAIN diversity screen[J]. Journal of Agricultural and Food Chemistry, 2008, 56(21): 9732-9739. DOI:10.1021/jf801069s.
[25] FURRER A, CLADIS D P, KURILICH A, et al. Changes in phenolic content of commercial potato varieties through industrial processing and fresh preparation[J]. Food Chemistry, 2016, 218: 47-55. DOI:10.1016/j.foodchem.2016.08.126.
[26] LUTHRIA D L, MUKHOPADHYAY S. Influence of sample preparation on assay of phenolic acids from eggplant[J]. Journal of Agricultural and Food Chemistry, 2006, 54(1): 41-47. DOI:10.1021/jf0522457.
[27] LUTHRIA D L, PASTOR-CORRALES M A. Phenolic acids content of fifteen dry edible bean (Phaseolus vulgaris L.) varieties[J]. Journal of Food Composition and Analysis, 2006, 19(2): 205-211. DOI:10.1016/j.jfca.2005.09.003.
[28] MADHUJITH T, SHAHIDI F. Antioxidant potential of barley as affected by alkaline hydrolysis and release of insoluble-bound phenolics[J]. Food Chemistry, 2009, 117(4): 615-620. DOI:10.1016/j.foodchem.2009.04.055.
[29] XU G, YE X, CHEN J, et al. Effect of heat treatment on the phenolic compounds and antioxidant capacity of citrus peel extract[J]. Journal of Agricultural and Food Chemistry, 2007, 55(2): 330-335. DOI:10.1021/jf062517l.
[30] ESPINOSA-ALONSO L G, LYGIN A, WIDHOLM J M, et al.Polyphenols in wild and weedy Mexican common beans (Phaseolus vulgaris L.)[J]. Journal of Agricultural and Food Chemistry, 2006, 54(12):4436-4444. DOI:10.1021/jf060185e.
[31] XU B, CHANG S K C. Total phenolic, phenolic acid, anthocyanin,flavan-3-ol, and flavonol profiles and antioxidant properties of pinto and black beans (Phaseolus vulgaris L.) as affected by thermal processing[J].Journal of Agricultural and Food Chemistry, 2009, 57(11): 4754-4764.DOI:10.1021/jf900695s.
[32] ZHANG C, MONK J M, LU J T, et al. Cooked navy and black bean diets improve biomarkers of colon health and reduce inflammation during colitis[J]. British Journal of Nutrition, 2014, 111(9):1549-1563. DOI:10.1017/S0007114513004352.
Characterization of Free, Conjugated, and Bound Phenolic Acids in Ten Vegetables and Vegetable Products
GAO Yuan1, WANG Meng1, WANG Yao1, LÜ Xiaoling2, FENG Xiaoyuan1,*
(1. Risk Assessment Laboratory for Agro-Products (Beijing), Ministry of Agriculture,Beijing Research Center for Agricultural Standards and Testing, Beijing 100097, China;2. Yinzhou Entry-Exit Inspection and Quarantine Bureau, Ningbo 315192, China)
Abstract:Free, conjugated, and bound phenolic acids in ten vegetables and vegetable products, including cow pea, broccoli,soybean sprouts, eggplant, potato, cucumber, spinach, Chinese cabbage, potato, and ketchup were identified and quantified by ultra-performance liquid chromatography-tandem mass spectrometry (UPLC-MS/MS). The results indicated that phenolic acid contents varied greatly among the vegetables. Of all the vegetables, Chinese cabbage contained the highest levels of free phenolic acids, while the highest amount of conjugated phenolics was determined in cow pea, followed by spinach, which showed the highest levels in bound phenolic acids. Principle component analysis (PCA) revealed some key compounds that could differentiate among these vegetables. p-Coumaric acid was identified as a characteristic component of cow pea. Ferulic acid and isoferulic acid were characteristics components that could differentiate spinach from the other kinds. In addition, sinapic acid was found to be a characteristic substance in cabbage. The results from this study can contribute to the development and application of functional components of vegetables.
Keywords:phenolic acid; vegetables; characteristic components; UPLC-MS/MS; principal component analysis (PCA)
GAO Yuan, WANG Meng, WANG Yao, et al. Characterization of free, conjugated, and bound phenolic acids in ten vegetables and vegetable products[J]. Food Science, 2018, 39(24): 189-194. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201824029. http://www.spkx.net.cn
高媛, 王蒙, 王瑶, 等. 蔬菜及其制品中不同形态酚酸成分分析[J]. 食品科学, 2018, 39(24): 189-194. DOI:10.7506/spkx1002-6630-201824029. http://www.spkx.net.cn
引文格式:
文章编号:1002-6630(2018)24-0189-06
文献标志码:A
中图分类号:TS21
DOI:10.7506/spkx1002-6630-201824029
*通信作者简介:冯晓元(1965—),女,研究员,博士,研究方向为果品质量与安全。E-mail:fengxiaoyuan2014@126.com
第一作者简介:高媛(1987—),女,助理研究员,博士,研究方向为农产品质量与安全。E-mail:gaoyuan060117@163.com
北京市农林科学院所级科技创新团队建设项目(JNKST201620);北京市农林科学院创新能力专项(20170302)
基金项目:“十三五”国家重点研发计划重点专项(2016YFD0400902);
收稿日期:2017-12-29